Method Article
Drosophila Pupal Notum'un Diseksiyonu, Sabitlenmesi ve Görselleştirilmesi
Bu Makalede
Özet
Mevcut protokol, Drosophila pupa notumunun sabit dokusunun hazırlanmasını ve görselleştirilmesini detaylandırmaktadır. Sağlam veya yaralı doku için kullanılabilir ve dokunun orijinal mimarisi korunur. Diseksiyon, sabitleme ve boyama prosedürlerinin tümü bu makalede açıklanmıştır.
Özet
Drosophila melanogaster'in pupaları, metamorfoz sırasında birkaç gün boyunca hareketsizdir ve bu sırada ince şeffaf bir yetişkin bütünlüğüne sahip yeni bir vücut geliştirirler. Hareketsizlikleri ve şeffaflıkları onları in vivo canlı görüntüleme deneyleri için ideal kılar. Birçok çalışma, erişilebilirliği ve nispeten büyük boyutu nedeniyle pupa notumunun dorsal epitel tek katmanına odaklanmıştır. Epitel mekaniği ve gelişimi çalışmalarına ek olarak, notum yara iyileşmesini incelemek için ideal bir doku olmuştur. Bir yaralanmadan sonra, tüm epitel onarım süreci 6-12 saat boyunca canlı görüntüleme ile yakalanabilir. Notumun canlı görüntüleme için popülaritesine rağmen, çok az sayıda yayınlanmış çalışma sabit notum örneklerini kullanmıştır. Fiksasyon ve boyama, basit hücresel lekelerin ve antikorların geniş repertuarından yararlanan hemen hemen tüm diğer Drosophila dokuları için ortak yaklaşımlardır. Bununla birlikte, pupa notum kırılgandır ve vücuttan çıkarıldıktan sonra kıvrılmaya ve bozulmaya eğilimlidir, bu da canlı görüntülemeyi tamamlamayı zorlaştırır. Bu protokol, pupa notumunu hem sağlam hem de lazerle yaraladıktan sonra sabitlemek ve boyamak için basit bir yöntem sunar. Bu teknikle, pupa'nın ventral tarafı, pupayı hareketsiz hale getirmek için bir örtü kaymasına yapıştırılır ve notum dikkatlice çıkarılır, sabitlenir ve lekelenir. Notum epiteli, dokunun dorsal veya ventral tarafından görüntülemeyi kolaylaştırmak için bir slayt üzerine veya iki kapak kapağı arasına monte edilir.
Giriş
Drosophila melanogaster'in pupa notumu, son on yılda canlı görüntüleme çalışmaları için giderek daha fazla kullanılmaktadır, çünkü hayvan hem hareketsizdir hem de bu aşamada şeffaf bir kütiküle sahiptir 1,2,3,4,5,6,7. Bununla birlikte, pupa notumunun diseke edilmesi ve sabitlenmesi zordur, bu da canlı görüntüleme çalışmalarını antikor ve hücre boyama ile tamamlamayı zorlaştırır. Bu çalışmanın genel amacı, yeni veya daha önce canlı görüntülenmiş örneklerde antikor ve hücre boyama için pupa notumunu diseke etmek ve sabitlemek için tekrarlanabilir bir protokol oluşturmaktır.
Larvalar metamorfoza başladığında, epidermis larva kütikülünden uzaklaşır ve sert bir pupa vakası8 oluşturur. Larva vücut planı bozulur ve yeni yetişkin vücut planı geliştirilir. Bu süre zarfında, pupalar hareketsizdir ve bu da onları canlı görüntüleme için ideal kılar. Yaygın olarak görüntülenen bir doku, dorsal toraksta oluşan yetişkin bir tek katmanlı epitel olan pupa notumudur. Notum, pupa vakası9'u çıkarmak için basit bir diseksiyondan sonra görsel olarak erişilebilir. Bütün hayvan daha sonra monte edilebilir ve notum saatlerce veya günlerce canlı olarak görüntülenebilir, bu da onu gelişim, homeostaz ve10,11,12,13,14 yaralanmasını takiben epitel hücre davranışlarını incelemek için ideal bir doku haline getirir. Bununla birlikte, notumun diseke edilmesi ve sabitlenmesi zordur, çünkü kırılgandır ve hidrofobik olan ince şeffaf bir yetişkin kütikülü ile kaplıdır. Bu hidrofobik kütikül, vücudun geri kalanından çıkarıldığında sulu çözeltilerde kıvrılmaya eğilimli hale getirir. Bu nedenle, notum diseksiyonu ve fiksasyonu nadiren bildirilmiştir ve diseksiyon sıklıkla tanımlanmamıştır15,16,17,18. Literatürde ayrıntılı bir protokol olmadan, bir Drosophila araştırmacısının canlı görüntülemeyi pupaların boyanmasıyla tamamlaması son derece zordur.
Bu teknik, lazer yaralı olanlar da dahil olmak üzere daha önce canlı olarak görüntülenen örnekleri yeniden üretilebilir bir şekilde diseke etmeyi ve düzeltmeyi amaçlamaktadır. Canlı görüntüleme pupa vakasının çıkarılmasını gerektirdiğinden, bu diseksiyon tekniği, pupa vakası 4,19,20 içindeki pupaları sabitleyen veya bisekte eden önceki protokollerin aksine, anterior pupa vakasının çıkarılmasıyla başlar. Notum kırılgan bir dokudur ve yaralama kırılganlığını arttırabilir. Böylece, bu hassas dokuyu desteklemek için, notumun bütünlüğü (epitel ve bağlı şeffaf yetişkin kütikül), her zaman sulu bir ortama batırılırken, pupanın geri kalanından uzağa diseke edilir. Bu yöntem dokunun kıvrılma ve kullanılamaz hale gelme olasılığını azaltır. Bu teknik, yaralı notum dokusunu yaralanma sonrası 30 dakika kadar erken bir sürede (Şekil 1E-H) ve yaralanma sonrası 3 saatte (Şekil 1I-L) başarıyla lekelemiştir. Bu protokolün notum gelişimi veya yara onarımı süresince etkili olması beklenmektedir. Mevcut teknik, pupa notumunun canlı görüntüleme yeteneklerini mevcut immünohistokimya reaktiflerinin bolluğu ile birleştirmek isteyen araştırmacılar için yararlı olacaktır.
Protokol
Drosophila melanogaster (meyve sinekleri) standart bir mısır unu-pekmez ortamında 25 ° C'de tutuldu. Çalışmalar EGFP etiketli histon H2A pupa (w[*]; P{w+mC=His2Av-EGFP.C}2/SM6a). Sinekler halka açık bir stok merkezinden elde edildi (bakınız Malzeme Tablosu).
1. Pupa immobilizasyonu
- Bir mikroskop slaytına 2" çift taraflı bant şeridi uygulayın.
- 25 ° C'de yükseltilmiş şişelerde beyaz prepupaları tanımlayın ve şişe dışındaki yerlerini belirtmek için bir işaretleyici kullanın. Şişeleri 25 °C'ye geri döndürün.
NOT: Beyaz prepupa hareketsizlikleri, beyaz renkleri ve everted spiracles ile karakterize edilir. Bunlar puparyum oluşumundan (APF) 0-1 saat sonra veya P18 evresinden sonra oluşur. - 12-15 saat sonra, bir diseksiyon kapsamı kullanarak belirtilen pupaların 3-4'ünü (patlatmadan) dikkatlice çıkarın ve bandın yanındaki mikroskop slaytında toplayın.
NOT: Pupa artık P5 aşaması olacak ve pupaların ön ucu8'de görülebilen sonsuz bir kafa kesesi olacak. - Pupaları en az bir pupa genişliğinde ventral kenarları aşağıda olacak şekilde bant üzerine yerleştirin.
- Bir damla yapışkan yapıştırıcıyı bir parafin filme (bkz. Malzeme Tablosu) veya bir santrifüj tüp kapağına yerleştirin. 0,1-10 μL pipet ucunun ucunu (pipetsiz) yapışkan tutkal damlasına batırın. Pipet ucuna 24 mm x 60 mm (1,5 kalınlıkta) bir kapak kapağına, köşeden 1 cm x 1 cm uzakta iki kez dokunarak, pupanın uzunluğunun ~1/2'si kadar yapışkan bir yapıştırıcı çizgisi oluşturun.
- 0,2-2 μL (P2) pipeti 2 μL'ye ve 200 μL (P200) pipeti 200 μL'ye önceden ayarlayın ve yapışkan yapıştırıcıyı temas ettiğinde hızla katılaştıracak 1x PBS + 0,1 mM Ca2+ ile doldurulmaya hazır olmaları için uçlarla takın.
- Forsepsleri (bkz. Malzeme Tablosu) başın yan tarafına yakın bir yere yerleştirin ve kasayı önden arkaya doğru yavaşça çıkarın9. Kasanın mümkün olduğunca çoğunu çıkarın. Pupa'nın gelişmekte olan bacaklarını bir çift künt forseps ile kavrayın ve pupa'yı kasasından dikkatlice çekin.
NOT: Pupaların ventral kısmındaki küçük bir yırtılma bu prosedüre zarar vermeyecektir. - Pupa'yı kapak kapağının köşesine yerleştirin.
- Pupa'yı arka karın bölgesinde veya gelişmekte olan kanatta künt forsepslerle kavrayın, kaldırın ve pupaların ventral tarafını yapışkan tutkal çizgisine yerleştirin.
- P2 pipetini hızlı bir şekilde 2 μL 1x PBS + 0,1 mM Ca 2+ ile doldurun ve havada tutarak ucunda küçük bir kabarcık oluşturacak kadar dışarı atın (0,25-0,5 μL).
- Çözeltinin küçük kabarcığını toraksın tabanındaki pupaların bir tarafına dokunun, ardından diğer tarafta tekrarlayın.
NOT: Bu, pupa'yı yerinde tutmak için az miktarda yapışkan yapıştırıcıyı katılaştıracaktır. Genel olarak, tüm çözümler kullanılmayacaktır. - P200 pipetini 200 μL 1x PBS + 0,1 mM Ca2+ ile doldurun, ardından pipetin ucunu toraksın üzerine yerleştirin ve pupayı tamamen suya batırmak için içindekileri dışarı atın. Yapışkan yapıştırıcının geri kalanı hemen katılaşacaktır.
- PBS çözeltisinin ~ 100 μL'sini çıkarın, böylece pupa hemen bir sonraki adıma geçmeden önce zar zor suya batırılır.
NOT: Yaralanmamış numuneler için, adım 1.1'den başlayın. Yaralı kısmen disseke edilmiş örnekler için, adım 1.5'ten başlayın. Lazer ablasyon ile yaralanma daha önce14,21 olarak tanımlanmıştır. İmmobilizasyon, diseksiyon ve montaj adımlarının bir diseksiyon mikroskobu kullanılarak yapılması gerekir.
2. Notumun diseksiyonu
- Sapın bir tarafını baskın elin işaret parmağına ve orta parmağına yaslayan bir çift mikrodiseksiyon makası kavrayın, böylece baskın elin baş parmağı kesme kuvvetini uygular (Şekil 2A, B).
- Makasın boynunu baskın olmayan elin orta parmağına karşı stabilize ederken, kapak kaymasını baskın olmayan elin yüzük parmağıyla destekleyin.
- Küçük bir delik oluşturmak için sırt karnının ortasında, ~ 0.2-0.5 mm. Bazı hemolenfler genellikle dökülür ve ihlalin iyi bir göstergesidir.
- Küçük 0.5-0.75 mm'lik kesimler yapın, arka taraftan ön tarafa kadar bütünlük boyunca keser ve izole etmek için sırt dokusunu çevreleyin. Mümkün olduğunca düz bir doku oluşturmak için, çok ventralal kesimden kaçının; Toraksın sadece dorsal 'kubbesi' baş ve karın küçük bölümleri ile birlikte çıkarılmalıdır.
- Pupaların diğer tarafındaki ön kesimlere posterior tekrarlayın.
- Gerekirse kafadan temiz bir kesim yapılmasına izin vermek için diseksiyon aşamasını döndürün.
NOT: Bu aşamada, dorsal bütünleşme veya notum, pupanın geri kalanından ayrılacaktır. Ayrı görünüyorsa ancak kolayca hareket ettirilmiyorsa, notumun altındaki birkaç kesik yerinden çıkmasına yardımcı olabilir. - Kapak kapağının ortasına ~200 μL 1x PBS ekleyin ve pipet ucunu kapak camı boyunca yeni damlacıktan orijinaline yavaşça sürükleyerek orijinal diseksiyon damlacığına bağlayan bir kanal oluşturun.
- Bir çift künt forseps kullanarak, izole edilmiş notumu yavaşça kapak kaymasının merkezine itin veya sürükleyin ve döndürün, böylece iç taraf yukarı bakacaktır. Dokuyu asla damlacıktan çıkarmayın.
NOT: Daha sonraki görüntüleme sırasında numuneyi tıkayan yapışkan tutkal kalıntılarını önlemek için notumu orijinal diseksiyon bölgesinden uzaklaştırmak önemlidir. - Notumu künt forseps ile karın veya baş bölümlerine bastırarak aşağı doğru tutun. Bir çift keskin forseps ve / veya 200 μL'lik bir pipetten 1x PBS'lik nazik atılımlar kullanarak, tek katmanlı epiteli tamamen ortaya çıkarmak ve nihai lekelenmeyi daha eşit hale getirmek için kalan yağ gövdesini, kas bantlarını veya hemolenfleri (varsa) çıkarın. Disseke edilmiş notum Şekil 3A'daki gibi görünmelidir.
- Doku temizlendikten sonra, PBS çözeltisinin mümkün olduğunca çoğunu (döküntü ve pupaların ventral kısmı ile birlikte) çıkarmak için 200 μL'lik bir pipet kullanın, notumun aspire edilmesini önlemek için bir diseksiyon kapsamı ile izleyin.
- Sıvının çoğu çıkarıldıktan sonra, yapışkan tutkalın ve pupanın geri kalanını ve ayrıca kapak kayması üzerinde kalan diğer kalıntıları dikkatlice silmek için emici bir doku kullanın.
NOT: Kapak kapağında bir miktar yapışkan yapıştırıcı kalırsa, sırt dokusunun kendisinden daha ince olduğu sürece bir soruna neden olmaz. - 150-200 μL% 4 PFA (1x PBS cinsinden) ekleyin ve oda sıcaklığında 20 dakika sabitleyin. Diseksiyon hızına bağlı olarak, ilk pupanın fiksasyonu sırasında 1 veya daha fazla pupa diseke edilebilir.
- PFA'yı çıkarın ve notu 30 saniye boyunca bir kez yıkamak için 1x PBS ile değiştirin.
- Antikor boyama işlemine devam ediyorsanız, antijen hücre içi ise dokuyu geçirgenleştirmek için 1x PBS veya 1x PBST'de (Ek Dosya 1) 5 dakikalık yıkama (3 kez) yapın.
- Numuneyi nemlendirilmiş bir odada gece boyunca 1x PBS +% 0.02 NaN3'te saklayın veya dokuyu lekelemeyi planlıyorsanız, Bloke edici çözeltide gece boyunca inkübe edin (Ek Dosya 1).
3. Notumun boyanması
NOT: Antikorlar veya hücresel lekeler kullanarak boyama için aşağıdaki adımları izleyin. Notum çözeltiden çıkarılmamalıdır, çünkü bu muhtemelen dokunun kıvrılmasına neden olacaktır. Böylece, boyama protokollerini tamamen kapak kayması üzerinde gerçekleştirilecek şekilde uyarlayın ve nemlendirilmiş bir odada 5 dakikadan daha uzun herhangi bir adımda saklayın. Numunelerin diseksiyon mikroskobu altında izlenmesi, yıkamalar sırasında dokunun kazara aspirasyonunu önlemeye yardımcı olabilir.
- Hücre sınırlarını görselleştirmek için, 200 μL anti-FasIII primer Fare IgG2a antikorunda (bakınız Malzeme Tablosu) 1:8 konsantrasyonda Bloke Edici Tampon + % 0.02 NaN3'te seyreltilmiş 4 ° C'de bir gecede inkübe edin.
- Fazla primer antikoru (3 kez) oda sıcaklığında yıkama başına 1 saat boyunca 200 μL 1x PBS + %0,02 NaN3 ile yıkayın.
- Oda sıcaklığında 2 saat boyunca Bloke Edici Tamponda Cy3'te 200 μL 1:200 konsantrasyonda anti-fare IgGa2 + %0,02 NaN3 ile sekonder antikor inkübasyonu gerçekleştirin.
- Fazla sekonder antikoru (3 kez) oda sıcaklığında yıkama başına 1 saat boyunca 200 μL 1x PBS + % 0.02 NaN3 ile yıkayın.
- Çekirdekleri görselleştirmek için, lekenin kas bantlarından nüfuz etmesi için yeterli zamana izin vermek üzere numuneleri 1 μg / mL DAPI'de 45 dakika boyunca inkübe edin; DAPI içeren bir montaj ortamında sabitleme bu doku ile etkili değildir.
- Fazla DAPI'yi (3 kez) oda sıcaklığında yıkama başına 5 dakika boyunca 200 μL 1x PBS + %0,02 NaN 3 ile yıkayın, ardından 4 °C'de gece boyunca 200 μL 1x PBS + %0,02 NaN3'te bırakın veya hemen takın.
4. Notumun montajı ve görselleştirilmesi
- Boyama işleminden sonra, destekleri olan yeni bir 24 × 60 kapak kayması (topper) hazırlayın.
NOT: Notum kubbe şeklinde olduğundan, tamamen düzleştirilmesi buruşuk doku bozulmasına neden olur. İki kapak kapağı arasında bir boşluk oluşturmak, notumun normal şeklini korumasını sağlar. - 22 x 22 kapak kaymalarından (No. 0 kalınlık, ~100 μm kalınlığında) yapılmış, üst kısmın ortasına oje ile ~1 cm arayla yapıştırılmış ara parçalar kullanarak ~200 μm'lik bir boşluk oluşturun.
- Yapıştırmak için, ara parçaları üst kısma yerleştirin ve ara parçaların distal kenarlarını ince bir oje tabakası ile boyayın. Kurumaya bırakın.
NOT: Sadece ince ve akan bir oje kullanın; kalın oje, kapak kayması ve topper arasında gereksiz ek boşluk ekleyecektir. - Sulu çözeltinin mümkün olduğunca çoğunu numuneden çıkarın.
- Hemen numuneye iki damla (~100 μL) solmaya karşı montaj ortamı uygulayın (bkz.
- Gerekirse, notumu solmaya karşı montaj orta damlacığının ortasına yerleştirmek için temiz, keskin forseps kullanın.
- Notumlu kapak kaymasını, çalışma yüzeyine yapışmayacak şekilde numuneyi yükseltmek için ince bir köpük parçası (kapak kayma kutularının içindeki ambalaj malzemesinden kesilmiş) gibi ~ 10 x 40 mm'lik bir destek üzerine yerleştirin.
- Bir diseksiyon kapsamı altında, üst kısmı yavaşça numunenin üzerine indirin. Solmaya karşı koruma montaj ortamı üste ulaştığında, yavaşça serbest bırakın ve kılcal hareketin üstünü aşağı çekmesine izin verin.
NOT: İlk birkaç saniye içinde, notuma zarar vermeden kapak kaydırma konumunda küçük ayarlamalar yapılabilir. - Üst kısma başka bir köpük parçası yerleştirin ve numune kapağı, üst kısım ve ara parçalar arasındaki solmaya karşı montaj ortamını nazikçe koaksiyel hale getirmek için ağırlık olarak standart bir mikroskop sürgüsü kullanın.
- 5-10 dakika sonra, kapak kaymasının kenarlarına hafifçe dokunarak aşırı solma önleyici montaj ortamını uzaklaştırmak için emici bir doku kullanın.
- Birbirine yapıştırmak için kapak fişlerinin her köşesine nazikçe oje uygulayın. Kuruduktan sonra, sızdırmazlık sağlamak için kapak kaymalarının tüm kenarlarını boyayın. Önce tüm kenarları kaplamaktan kaçının, çünkü bu genellikle kapak kaymasını değiştirebilir ve sırt dokusuna zarar verebilir.
- Notumu floresan mikroskobu altında görselleştirin (bakınız Malzeme Tablosu) dorsal ve / veya ventral taraftan.
Sonuçlar
Sunulan teknik, yaralanmamış notum üzerinde iyi çalışır (Şekil 1A-D), dokunun gelişiminin ve homeostazının, örneğin poliploid mekanosensoriyel kıl hücrelerininoluşumunun 18 veya epitel hücrelerinin posterior akışının ön kısmının araştırılmasına izin verir10. Bu protokol aynı zamanda lazerle ablatlanmış bir notum için de geçerlidir (Şekil 1E-L), burada yaralanmaya hücresel yanıt, Histone2-EGFP gibi endojen floroforlarla canlı olarak analiz edilebilir (Şekil 1B, F, J). İmmünohistokimya ile boyama sonrası (adım 3), hücre sınırlarını etiketleyen Fasiklonin III gibi birçok özelliği ortaya çıkarabilir (Şekil 1C, G, K). Ek olarak, DAPI (Şekil 1A, E, I) gibi kantitatif lekeler, yara kaynaklı poliploidi22 dahil olmak üzere DNA içeriği değişikliklerini değerlendirmek için kullanılabilir.
Mevcut protokol, uzun süreli canlı görüntüleme deneylerini takiben kullanılabildiği için özellikle faydalıdır. Pupa hareketsiz olduğundan, saatlerce görüntülenebilirler (Şekil 4A, B). Önemli olarak, bu protokol diseksiyon sonrası yara epitelinin genel mimarisinde veya morfolojisinde önemli değişikliklere neden olmaz (Şekil 4B, C). Böylece, doku içindeki özellikler uzun süreli olarak görüntülenebilir ve daha sonra immünohistokimya veya hücresel lekelerle daha fazla araştırılabilir.
Dokuların derinliklerinde görüntüleme, opaklıkları nedeniyle karmaşıktır ve Drosophila, derin görüntülemeyi daha da zorlaştıran mumsu bir kütikül8 ile kaplanmıştır. Bununla birlikte, bu teknikle, epitel tek katmanının her iki taraftan görüntülenmesini sağlayan iki kapak kapağı arasına disseke edilmiş bir notum yerleştirilebilir: kütikülden apikal taraf (Şekil 5A-D) ve / veya epitelin vücut boşluğuna bakan bazal tarafı (Şekil 5E-H). Bu farklı görüşler, doku içindeki farklı yapıları görselleştirmek için idealdir. Örneğin, apikal görünüm, kütikülün hemen altında bulunan epitel hücre sınırlarını ve çekirdeklerini görselleştirmek için idealdir (Şekil 5A-D). Bazal görünümde, bu apikal sinyaller daha az görünür (Şekil 5E-H). Ancak yara boşluğunda bazal yapılar gözlenir (Şekil 5J,L sarı, beyaz oklar). Bu bazal yapılar, bazal görünümde apikal görünüme göre daha az tıkanıklık olduğu için çok daha parlaktır.
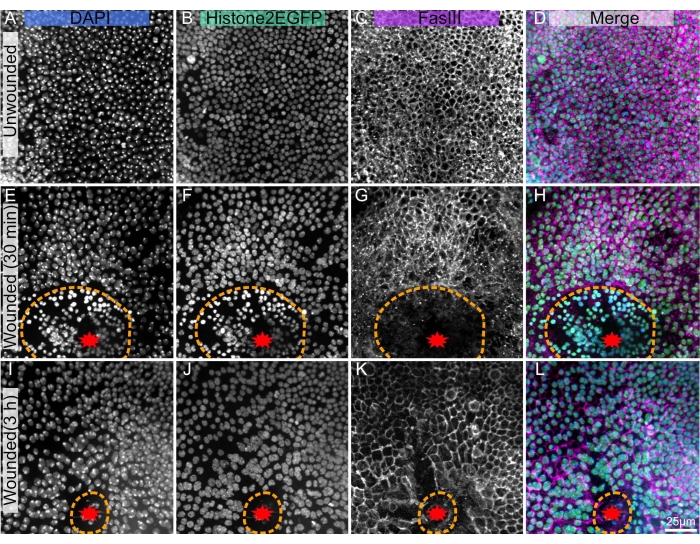
Resim 1: Disseke edilmiş, sabitlenmiş ve lekelenmiş Drosophila pupal nota. (A-D) Yaralanmamış notum. (E-H), Lazer ablasyondan 30 dakika sonra yaralı notum. (I-L) Lazer ablasyondan 3 saat sonra yaralı notum. (A,E,I) DAPI boyası çekirdekleri gösterir. (B,F,J) Canlı görüntülemede kullanılan transgenik Histone2-EGFP, sabitleme ve boyama işleminden sonra görülebilir. (C,G,K) Anti-FasIII antikoru, antikor lekelerinin sabit notum üzerinde iyi çalıştığını gösterir. (D,H,L) Birleştirilmiş görüntü. Görüntüler, dönen disk mikroskobu kullanılarak 40x objektif ile yakalanır, Z-yığınlarının maksimum yoğunluk projeksiyonları 0,3 μm Z-dilimleri ile gösterilir. A-D 263 Z-dilimini temsil eder. E-H 195 dilimi temsil eder. I-L, 53 Z-dilimini temsil eder. Turuncu kesikli çizgi, yara boşluğunu gösterir. L'deki ölçek çubuğu, A-L'ye uygulanabilir 25 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
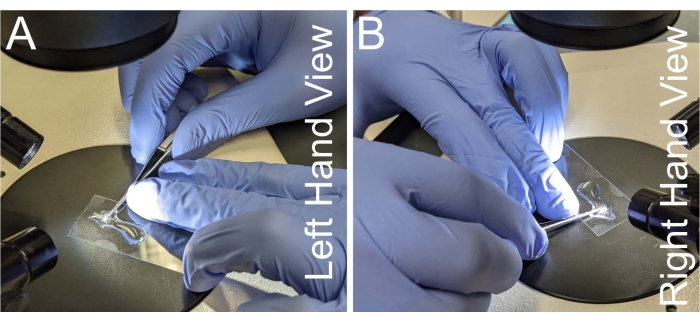
Şekil 2: Notum diseksiyonu için el yerleşimi. (A-B) Mikrodiseksiyon makaslarını tutmak için el yerleşiminin sol ve sağ görünümleri. El titremesini önlemek için, makasın boynu baskın olmayan elin orta parmağına yerleştirilir. Notum dokusunun bükülmesini önlemek için makasın mikroskop slaytına paralel olması gerekir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
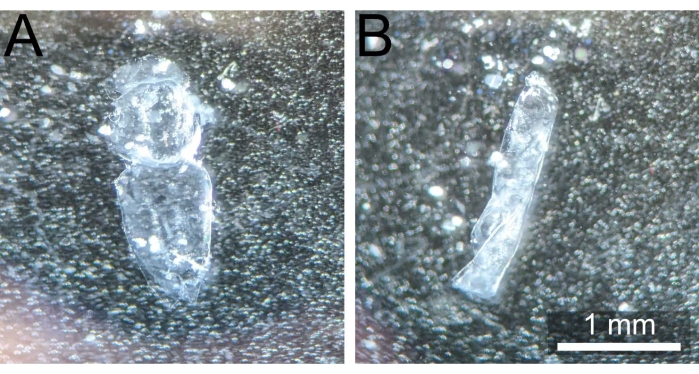
Şekil 3: Doğru disseke edilmiş notum vs kıvrılmış notum. (A) Pupa notum sonrası diseksiyon ve kıvrılmamış ve fiksasyona hazır temizlik. (B) Pupa notumu, 1x PBS'den çıkarıldıktan sonra kendi üzerine kıvrıldı, böylece kullanılamaz hale geldi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
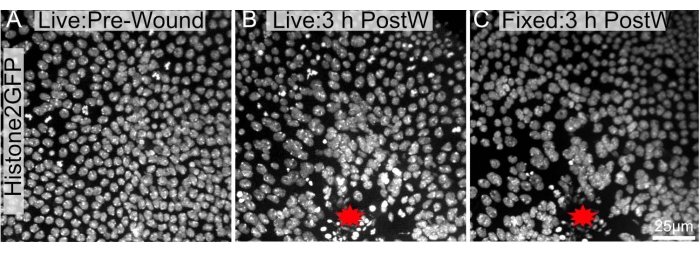
Şekil 4: Düzeltilmeden önceki ve sonraki görüntüler büyük ölçüde benzerdir. Çekirdeklerde Histone2-EGFP eksprese eden pupa notumu, (A) ablasyondan önce canlı ve (B) lazer-ablasyondan 3 saat sonra görüntülendi. (C) Notum, protokolde belirtildiği gibi alındı, disseke edildi ve sabitlendi ve sabitlendikten sonra yeniden görüntülendi. Yara yeri kırmızı bir yıldızla etiketlenmiştir. Görüntüler dönen disk mikroskobu kullanılarak 40x objektif olarak yakalandı, Z-dilimleri her 0.3 μm'de bir çekildi. Yaralama öncesi 34 Z-dilimi (A), yaralamadan 3 saat sonra 48 Z-dilimi (B) ve diseksiyon, fiksasyon ve boyama sonrası 103 Z-diliminin (C) maksimum yoğunluk projeksiyonları gösterilmiştir. C'deki ölçek çubuğu, A-C'ye uygulanabilir 25 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
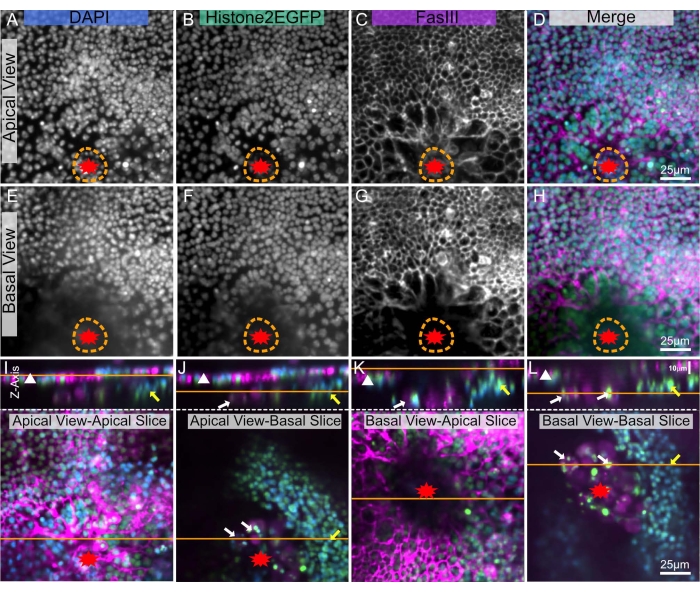
Resim 5: Yaralı bir notumun apikal ve bazal taraflarının görüntülenmesi. Tüm panellerde aynı yaralı pupa notumu gösterilmiştir. Yara kırmızı bir yıldızla işaretlenmiştir. Turuncu noktalı çizgi yara boşluğunu gösterir. (A-D) Notum, apikal taraftan, kütikülden geçirilerek görüntülenir. (E-H) Notum bazal iç taraftan görüntülenir. (I-L) Üst paneller, notumun X-Z görüntüsünü, apikal tarafı yukarı, epitel tabakası beyaz bir üçgenle belirlenmiş olarak gösterir. Turuncu çizgi, alt panellerde gösterilen X-Y diliminin apikal-bazal düzlemini gösterir. Alt panellerde, turuncu çizgi yukarıdaki X-Z görüntüsünün düzlemini gösterir. (I) Apikal olarak görüntülenen notum - apikal dilim. Üst X-Z görünümü, apikal epitel tabakasının (beyaz üçgen) hassas görüntülenmesini gösterir. Bu görünüm, canlı görüntüleme görünümüne eşdeğerdir. (J) Apikal olarak görüntülenen notum - bazal dilim, apikal doku tarafından kısmen tıkanmış. Bazal tarafta sarı ok (olası kas bandı) ve beyaz oklarla (olası kan hücreleri) gösterilen diğer dokular görülebilir. (K) Bazal olarak görüntülenen notum - apikal dilim, kısmen bazal doku ve yara kabuğu (karanlık merkezi alan) tarafından engellenmiştir. (L) Temel olarak görüntülenen notum - bazal dilim. Bu görünüm en iyi sarı ve beyaz oklarla gösterilen bazal dokuları gösterir. A,E: DAPI boyası, B,F: Histone-EGFP, C,G:FasIII boyaması. Görüntüler, dönen disk mikroskobu ile 20x objektif olarak yakalandı. Z-dilimleri her 0.9 μm'de bir alındı. A-D, 19 dilimin maksimum yoğunluk projeksiyonunu gösterir. E-H, 17 dilimin maksimum yoğunluk projeksiyonunu temsil eder. D,H,L'deki 25 μm ölçek çubukları sırasıyla A-D, E-H, I-L için geçerlidir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Çözeltilerin ve tamponların hazırlanması. Aşağıdaki çözeltiler için tarifler ayrıntılıdır: 1xPBS, 1x PBST, blokaj çözeltisi ve paraformaldehit fiksatif. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Kritik adımlar
Üç adımı optimize etmek, bu protokolün başarısını önemli ölçüde artıracaktır. İlk olarak, adım 1.5'te, kapak kapağına uygulanan yapışkan yapıştırıcı ile korunmalıdır. Çok fazla yapışkan yapıştırıcı eklenirse, pupalar kalın bir katılaşmış yapışkan yapıştırıcı tabakasına gömülebilir, bu da diseksiyonu imkansız hale getirir ve notumun kendisini kaplarsa, yapışkan yapıştırıcı numuneden gelen ışığı engeller. İkincisi, 2.3-2.6 adımları sırasında, yanal dokunun mümkün olduğunca çoğunu hariç tutarak, notumun yalnızca üst kubbesini çıkardığınızdan emin olun. Dahil edilirse, yanal doku montaj sırasında sıkıştırılır ve notumun ortasının içe doğru bükülmesine neden olur ve genellikle yüksek sayısal açıklık hedeflerinin çalışma mesafesinin dışına yerleştirilir. Üçüncüsü, temizleme adımı 2.9 sırasında, tek katmanlı epitele zarar vermemek için çok dikkatli olunmalıdır. Dokuda büyük kısımlar eksikse veya sinyal tespit edilemezse, bu adımın suçlanması muhtemeldir.
Sorun giderme
Sorun 1: Montajın ardından, pupa diseksiyon sırasında çift taraflı banttan uzaklaşır. Bu, özellikle yeni başlayanlar için yaygın bir sorundur. En iyi çözüm, pupa kasasının dışının tamamen kuru / yiyecek artıklarından arındırılmış olmasını sağlamaktır. Yiyecekleri bir çift künt forseps ile çıkarmak ve kasanın 10-15 dakika boyunca hava ile kurumasına izin vermek, banda yapışmaya yardımcı olacaktır. Alternatif olarak, diseksiyon sırasında pupaları banda karşı tutmak için baskın olmayan eli ve bir çift künt forseps kullanın. Sorun devam ederse, kasanın arka ucunun tabanına küçük, 5-10 μL damla oje uygulamak ve sertleşmesine izin vermek, genellikle en düzensiz pupalar için bile yeterli yapışma sağlar.
Sorun 2: Notum adım 2.3 sırasında çöküyor veya bütünlük içindeki ilk ihlal düzgün değil. Bütünlüğün ihlali zorsa, immobilizasyon adımlarından çok fazla yapışkan yapıştırıcı olabilir. Disseke edilmiş pupaların daha az yapışkan yapıştırıcıya yerleştirilmesi bu sorunu iyileştirecektir. Ayrıca, mikrodiseksiyon makaslarının keskin olduğundan emin olun. Künt makaslar bütünlüğü kesemez ve içe doğru çökmesine neden olma eğilimindedir. Hemolenf pupadan döküldükten sonra, kesme bıçaklarından birinin notumun deforme olmasına neden olmadan pupaya girebildiğinden emin olun. Notum çökerse ve bıçak pupaya girmezse, bir bıçak pupaya girene kadar kesmeye devam edin.
Sorun 3: Adım 2.4 sırasında makas bütünlüğü yakalar veya sürükler. Makas bütünlüğü yakalamaya veya sürüklemeye başlarsa, genellikle pupaların karşı tarafına geçmeye ve bütünlüğü 'gevşetmeye' devam etmeye yardımcı olur. Daha fazla künt mikrodiseksiyon makasları, bütünlük boyunca temiz kesimler elde etmeyi zorlaştıracaktır ve keskinleştirilmiş makas kullanılmalıdır.
Sorun 4: Boyama sırasında numune yanlışlıkla aspire edilir (adım 3.1-3.6). Disseke edilmiş notu görmek zordur çünkü şeffaftır. Kontrast sağlamak için kapak kapağının altına koyu mavi veya siyah bir tabaka yerleştirmek yararlı olabilir (eski bir pipet ucu tutucu rafı iyi çalışır.) Ek olarak, tüm çözelti değişiklikleri bir diseksiyon mikroskobu altında gerçekleştirilebilir.
Sorun 5: Hiçbir sinyal algılanmadı/yamalı sinyal algılandı. Lekeye özgü sorunları dışladıktan sonra, sinyal algılanmazsa veya yamalıysa, adım 2.9 (temizleme) muhtemelen suçludur. Eksik veya yamalı bir sinyal, temizlik sırasında epitel dokusunun hasar görmesinden ve çıkarılmasından kaynaklanabilir. Tersine, zayıf bir sinyal, çıkarılmazlarsa kas bantlarından / yağ vücut hücrelerinden tıkanmadan kaynaklanabilir, çünkü lekelerin ve antikorların çevreleyen dokuya göre notuma difüzyonunu sınırlayabilirler. Doku hasar görürse, temizlik sırasında daha nazik olmak en iyi çözümdür. Bunun yerine, leke görünür ancak yamalıysa, kas ve yağ gövdesinin mümkün olduğunca çoğunu çıkarmak için temizleme adımına ayrılan canlılığın / zamanın arttırılması önerilir. Ayrıca, leke süresini artırmak, bu sorunun daha iyi temizlik ile çözülmesine yardımcı olabilir.
Sayı 6: Notum dokusu görüntüleme sırasında çarpık/buruşuk bir görünüme sahiptir. Dokunun bükülmesi ve buruşması iki kaynaktan gelir. İlk olarak, montaj sırasında notumun sıkıştırılması, bükülmesine ve bükülmesine neden olur. En iyi çözüm, yanal dokuların mümkün olduğunca çoğunu çıkarmaktır, böylece kubbe mümkün olduğunca kısadır ve kapak kaydırma ara parçaları arasına sığabilir. İkincisi, eğer notum diseksiyon sırasında bükülürse, bu büküm montaj sırasında düzleşmez, bu nedenle diseksiyon sırasında notumun bükülmemesine dikkat edilmelidir. Notumun yanlışlıkla bükülmesi, bütünlüğü pupaların geri kalanından uzaklaştırırken en yaygın olanıdır. Diseksiyon makaslarını, pupa olarak örnek düzlemde tutmak yerine, pupaya göre bir açıyla yapmak caziptir. Bununla birlikte, açılı makas, kesildiğinde bütünlüğün düz kalmak yerine yukarı doğru bükülmesine neden olur.
Mevcut yöntemler, sınırlamalar ve gelecekteki uygulamalar
Wang ve ark.20, pupa epitelinin izolasyonu için karşılaştırılabilir bir diseksiyon protokolü bildirmiştir. Bu teknik, pupa'nın kasasında kalmasını ve bir neşterle hızla ikiye bölünmesini gerektirir. Bu protokol daha önce canlı olarak görüntülenen örneklerle uyumlu değildir, çünkü canlı görüntüleme pupa vakasının büyük bir bölümünün çıkarılmasını gerektirir. Pupa sertlikten yoksun olduğundan, vakanın dışındaki pupa biseksiyonu dokuyu karıştırdı ve bu protokolün oluşturulmasına ilham verdi. Burada detaylandırılan teknik, notumun izolasyonuna ve sabitlenmesine izin verir ve kriyoseksiyon, in situ hibridizasyon veya elektron mikroskobu gibi çok çeşitli diğer yöntemler için ilk adım olarak kullanılabilir.
Bu tekniğin bazı sınırlamaları vardır. İlk olarak, notumun diseksiyonu, sabitlenmesi ve boyanması, notumdaki canlı görüntüleme floresan etiketli proteinlerden daha fazla zaman alıcıdır, bu da pupa vakasını çıkarmak için sadece basit bir diseksiyon gerektirir 9,23. İkincisi, diğer Drosophila dokularının diseksiyonlarına kıyasla, bu diseksiyon ince, kırılgan doku ve hidrofobik kütikül nedeniyle daha zordur. Drosophila epitelindeki proteinleri basitçe görselleştirmek için, sabit embriyolarda, larva kanat disklerinde veya yumurtalıklarda immünohistokimya daha kolaydır. Bununla birlikte, bu teknik, canlı görüntülemenin gücünün sabitleme ve boyama ile eşleştirilmesini sağlar ve bir kez ustalaştığında onu güçlü bir araç haline getirir.
Diseksiyon/fiksasyon tekniğinin canlı görüntülemeye göre bazı avantajları vardır. Bazal (iç) yapılar bazal görünümle daha iyi çözülebilir (Şekil 5L,J). En önemlisi, canlı görüntüleme, genetik olarak sağlanması gereken floroforlarla sınırlıdır ve genellikle uzun genetik geçiş şemaları gerektirir. Buna karşılık, mevcut protokol lekelerin, immünohistokimyanın ve diseksiyon ve fiksasyon gerektiren diğer tekniklerin uygulanmasına izin vermektedir. Bu, dokuda incelenen sinyallerin sayısını önemli ölçüde artırırken, deneysel sonuçlara ulaşma süresini potansiyel olarak azaltır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Yazarlar, pupa yaralanması için kullanılan lazer ablasyon sistemini kurduğu için Dr. M. Shane Hutson'a ve protokolün geliştirilmesine katkıları ve geri bildirimleri için teşekkür eder. Bu çalışma APM ve M. Shane Hutson'a 1R01GM130130 tarafından desteklenmiştir. JW, 2T32HD007502-21 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ½” Scotch Permanent Double-Sided tape | Scotch 3M | 665 | |
| 0.1-10 µL uTIP pipette tip | Biotix | M-0011-9FC | |
| 22 x 22 mm No. 0 thickness coverslips | Thomas Scientific | 1207Z28 | |
| 24 x 60 mm coverslip | Corning | 2980-246 | |
| 3M VetBond | 3M | 1469SB | Called "adhesive glue" in protocol |
| Anti-FasIII primary Mouse IgG2a | Developmental Studies Hybridoma Bank | 7G10 | |
| Calcium Chloride | Fisher Chemical | c79-500 | |
| Cy3-conjugated AffiniPure Goat Anti-Mouse IgG2a | Jackson ImmunoResearch | 115-165-206 | |
| DAPI | Sigma Aldrich | D9542-1mg | |
| Dumont #5 Fine Tip Forceps | Fine Science Tools | No. 11254-20 | |
| Dumont #5 Fine Tip Forceps: Blunt | Fine Science Tools | No. 11254-20 | Heavily used and unsharpened forceps, or dulled with a whetstone |
| Fisherbrand Double frosted microscope slides | Fisher Scientific | 22-034-486 | |
| Fluorescent Light Source | Lumencor | Celesta 90-10512 | |
| Fly Stock: EGFP-tagged Histone H2A | Bloomington Drosophila Stock Center | 24163 | |
| Fly Vial Foam Plugs "Flugs" | Genesee Scientific | 49-101 | |
| Humidified Chamber: Foil-wrapped small container lined with filter paper saturated with water | Cole-Parmer | 759075D | A great humidified chamber can be made from the styrofoam box containing Cole-Parmer cuvettes, 759075D, filled with 50 ml water. |
| KimWipe | KimTech | 34155 | Called "Absorbent Tissue" in protocol |
| Nikon Ti2 Eclipse | Nikon | Eclipse Ti2-E | |
| NIS Elements Software | Nikon | AR | |
| Parafilm | Pechiney Plastic Packaging | PM-996 | |
| Paraformaldehyde (PFA) 16% | Ted Pella, Inc | 18505 | |
| Plastic Vials | Genesee Scientific | 32-114 | |
| Sodium Azide (NaN3) | Fisher Scientific | 19038-1000 | |
| Stereo Microdissection Scope | Carl Zeiss | STEMI 2000 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | New or freshly sharpened scissors |
| Vecta Shield | Vector Laboratories | H-1000 | Called " antifade mounting medium" in protocol |
| Vecta Shield with DAPI | Vector Laboratories | H-1200 | Not ideal for pupal notum. |
| X-Light V2 Spinning Disc | Crest Optics | V2 L-FOV |
Referanslar
- Valon, L., et al. Robustness of epithelial sealing is an emerging property of local ERK feedback driven by cell elimination. Developmental Cell. 56 (12), 1700-1711 (2021).
- Levayer, R., Dupont, C., Moreno, E. Tissue crowding induces caspase-dependent competition for space. Current Biology. 26 (5), 670-677 (2016).
- Couturier, L., et al. Regulation of cortical stability by RhoGEF3 in mitotic sensory organ precursor cells in Drosophila. Biology Open. 6 (12), 1851-1860 (2017).
- Couturier, L., Mazouni, K., Corson, F., Schweisguth, F. Regulation of Notch output dynamics via specific E(spl)-HLH factors during bristle patterning in Drosophila. Nature Communications. 10, 3486 (2019).
- Fujisawa, Y., Shinoda, N., Chihara, T., Miura, M. ROS regulate caspase-dependent cell delamination without apoptosis in the drosophila pupal notum. iScience. 23, 101413 (2020).
- Besson, C., et al. Planar cell polarity breaks the symmetry of par protein distribution prior to mitosis in drosophila sensory organ precursor cells. Current Biology. 25 (8), 1104-1110 (2015).
- Koto, A., Kuranaga, E., Miura, M. Apoptosis ensures spacing pattern formation of drosophila sensory organs. Current Biology. 21, 278-287 (2011).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Moreira, C., Regan, J., Zaidman-Rémy, A., Jacinto, A., Prag, S. Drosophila hemocyte migration: an in vivo assay for directional cell migration. Methods in Molecular Biology. 769, 249-260 (2011).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. Elife. 4, 08519 (2015).
- Cristo, I., Carvalho, L., Ponte, S., Jacinto, A. Novel role for Grainy head in the regulation of cytoskeletal and junctional dynamics during epithelial repair. Journal of Cell Science. 131 (17), 213595 (2018).
- Bellaïche, Y., Gho, M., Kaltschmidt, J. A., Brand, A. H., Schweisguth, F. Frizzled regulates localization of cell-fate determinants and mitotic spindle rotation during asymmetric cell division. Nature Cell Biology. 3 (1), 50-57 (2001).
- Shannon, E. K. Multiple mechanisms drive calcium signal dynamics around laser-induced epithelial wounds. Biophysical Journal. 113 (7), 1623-1635 (2017).
- O'Connor, J. T., et al. Proteolytic activation of Growth-blocking peptides triggers calcium responses through the GPCR Mthl10 during epithelial wound detection. Developmental Cell. 56 (15), 2160-2175 (2021).
- Hartenstein, V., Posakony, J. W. Development of adult sensilla on the wing and notum of Drosophila melanogaster. Development. 107 (2), 389-405 (1989).
- Yeh, E., Zhou, L., Rudzik, N., Boulianne, G. L. Neuralized functions cell autonomously to regulate Drosophila sense organ development. The EMBO Journal. 19 (17), 4827-4837 (2000).
- Loubéry, S., et al. Uninflatable and notch control the targeting of sara endosomes during asymmetric division. Current Biology. 24 (18), 2142-2148 (2014).
- Kawamori, A., Shimaji, K., Yamaguchi, M. Dynamics of endoreplication during Drosophila posterior scutellar macrochaete development. PLoS One. 7 (6), 38714 (2012).
- Couturier, L., Schweisguth, F., Bellen, H. J., Yamamoto, S. . Notch Signaling: Methods and Protocols. , 79-86 (2014).
- Wang, W., Yoder, J. H. Drosophila pupal abdomen immunohistochemistry. Journal of Visualized Experiments. (56), e3139 (2011).
- Kiehart, D. P., et al., Celis, J. E., et al. . Cell Biology (Third Edition). , 87-103 (2006).
- Bailey, E. C., Dehn, A. S., Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. A Drosophila model to study wound-induced polyploidization. Journal of Visualized Experiments. (160), e61252 (2020).
- O’Connor, J. T., S, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protocols. , (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır