Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una tubería para investigar las estructuras y vías de señalización de los receptores de esfingosina 1-fosfato
En este artículo
Resumen
S1P ejerce sus diversos efectos fisiológicos a través de la subfamilia de receptores S1P (S1PRs). Aquí, se describe una tubería para exponer las estructuras y la función de los S1PR.
Resumen
Los lisofosfolípidos (LPL) son lípidos bioactivos que incluyen esfingosina 1-fosfato (S1P), ácido lisofosfatídico, etc. S1P, un producto metabólico de los esfingolípidos en la membrana celular, es uno de los LPL mejor caracterizados que regula una variedad de respuestas fisiológicas celulares a través de vías de señalización mediadas por receptores de esfingosina 1-fosfato (S1PR). Esto implicó que el sistema de señalización S1P-S1PR es un objetivo terapéutico potencial notable para trastornos, incluida la esclerosis múltiple (EM), trastornos autoinmunes, cáncer, inflamación e incluso COVID-19. Los S1PR, un pequeño subconjunto de la familia de receptores acoplados a proteínas G (GPCR) de clase A, se componen de cinco subtipos: S1PR1, S1PR2, S1PR3, S1PR4 y S1PR5. Sin embargo, la falta de información estructural detallada impide el descubrimiento de fármacos dirigidos a los S1PR. Aquí, aplicamos el método de microscopía crioelectrónica para resolver la estructura del complejo S1P-S1PRs, y dilucidamos el mecanismo de activación, el reconocimiento selectivo de fármacos y el acoplamiento de proteínas G mediante el uso de ensayos funcionales basados en células. Otros receptores de lisofosfolípidos (LPLR) y GPCR también se pueden estudiar utilizando esta estrategia.
Introducción
La esfingosina-1-fosfato (S1P), un producto metabólico de los esfingolípidos en la membrana celular, es una molécula de señalización lisofosfatídica ubicua que involucra diversas actividades biológicas, incluyendo el tráfico de linfocitos, el desarrollo vascular, la integridad endotelial y la frecuencia cardíaca 1,2,3. S1P ejerce sus diversos efectos fisiológicos a través de cinco subtipos de receptores S1P (S1PRs 1-5); Los S1PR se encuentran en una variedad de tejidos y exhiben preferencias únicas por las proteínas G aguas abajo 4,5. S1PR1 se combina principalmente con la proteína Gi, que posteriormente inhibe la producción de cAMP; S1PR2 y S1PR3 están acoplados con Gi, Gq y G12/13, y S1PR4 y S1PR5 transducen la señal a través de Gi y G12/136.
La señalización S1P-S1PR es un objetivo terapéutico crítico para múltiples enfermedades, incluidos los trastornos autoinmunes7, la inflamación8, el cáncer9 e incluso COVID-1910. En 2010, el fingolimod (FTY720) fue autorizado como un fármaco de primera clase dirigido a S1PR para tratar la esclerosis múltiple (EM) de recaída11. Sin embargo, es capaz de unirse a todos los S1PR excepto a S1PR2, mientras que la unión no específica a S1PR3 produce edema de la corteza cerebral, constricción vascular y bronquial, y fuga epitelial pulmonar12. Como estrategia alternativa para aumentar la selectividad terapéutica, se han producido ligandos específicos de subtipo para el receptor. Siponimod (BAF312) fue aprobado en 2019 para el tratamiento de la EM en recaída13; se dirige eficazmente a S1PR1 y S1PR5, mientras que no tiene afinidad por S1PR3, exhibiendo menos efectos secundarios en la práctica clínica14. En 2020, la Administración de Alimentos y Medicamentos de los Estados Unidos autorizó ozanimod para la terapia de EM15. Se ha informado que ozanimod tiene una selectividad 25 veces mayor para S1PR1 que para S1PR516. En particular, en el contexto de la actual pandemia de COVID-19, se ha descubierto que los fármacos agonistas dirigidos a S1PR pueden utilizarse para tratar COVID-19 mediante el uso de técnicas de terapia inmunomoduladora17. En comparación con el fingolimod, el ozanimod ha demostrado superioridad en la reducción de los síntomas en pacientes con COVID-19 y ahora está siendo sometido a ensayos clínicos10. Comprender la base estructural y la función de los S1PR establece una base significativa para desarrollar un fármaco que se dirija selectivamente a los S1PR18.
Se utilizan muchas técnicas para investigar la información estructural de las biomacromoléculas, incluida la cristalografía de rayos X, la resonancia magnética nuclear (RMN) y la microscopía electrónica (EM). A marzo de 2022, hay más de 180.000 estructuras depositadas en el Protein Databank (PDB), y la mayoría de ellas se han resuelto mediante cristalografía de rayos X. Sin embargo, con la primera estructura de resolución casi atómica de TPRV1 (resolución 3.4 Å) reportada por Yifan Cheng y David Julius en 201319, la microscopía crioelectrónica (crio-EM) se ha convertido en una técnica convencional para estructuras de proteínas, y el número total de estructuras EM PDB fue de más de 10,000. Las áreas críticas de avance son el desarrollo de nuevas cámaras para imágenes conocidas como cámaras de detección directa de electrones y nuevos algoritmos de procesamiento de imágenes. Cryo-EM ha revolucionado la biología de la estructura y el descubrimiento de fármacos basados en la estructura en la última década20. Como la comprensión de cómo los complejos macromoleculares cumplen sus complicadas funciones en la célula viva es un tema central en las ciencias biológicas, la crio-EM tiene el potencial de revelar conformaciones de complejos moleculares dinámicos, particularmente para proteínas transmembrana21. Los receptores acoplados a proteínas G (GPCR) son la superfamilia más grande de proteínas transmembrana y los objetivos de más del 30% de los productos farmacéuticos comercializados actualmente22. El desarrollo de crio-EM ha contribuido a una explosión de estructuras de alta resolución de complejos de proteínas GPCR-G, permitiendo la determinación estructural de objetivos "intratables" que aún no son accesibles para el análisis cristalográfico de rayos X en el diseño de fármacos23. Por lo tanto, la aplicación crio-EM proporciona la oportunidad de determinar la estructura tridimensional de los GPCR en condiciones casi nativas cercanas a la resolución atómica24. Los avances en crio-EM permiten visualizar los fundamentos mecanicistas de la estimulación o inhibición de GPCR, y un beneficio adicional en el descubrimiento de los nuevos sitios de unión para la creación de fármacos dirigidos a GPCR25.
Confiando en los tremendos avances de la tecnología crio-EM, hemos identificado estructuras de complejos de señalización S1PR1-, S1PR3- y S1PR5-Gi agonizantes recientemente26,27. En humanos, los S1PR se encuentran en varios tejidos y exhiben preferencias únicas por las proteínas G aguas abajo 4,5. S1PR1 se combina principalmente con la proteína Gi, que posteriormente inhibe la producción de monofosfato de adenosina cíclico (cAMP) 3′,5'. S1PR3 y S1PR5 también son capaces de acoplarse con Gi 6,28. Dado que la activación del receptor acoplado a Gi disminuye la producción de cAMP29, se introdujo un ensayo de inhibición de Gi-amp para medir los efectos de inhibición de cAMP para capturar alteraciones funcionales26,27. Utilizando una versión mutante de Photinus pyralis luciferase en la que se ha insertado una fracción de proteína de unión a cAMP, este ensayo de cAMP ofrece un método simple y confiable para monitorear la actividad de GPCR a través de cambios en la concentración intracelular de cAMP30. Es un ensayo funcional sensible y no radiactivo y puede aplicarse para monitorear la señalización descendente en tiempo real de una amplia gama de GPCR con fines de descubrimiento de fármacos31.
Aquí, se proporciona un resumen de los métodos críticos para resolver los modos de activación y reconocimiento de fármacos de S1PR, que incluyen principalmente manipulaciones crio-EM y un ensayo de cAMP de inhibición Gi. Este artículo tiene como objetivo proporcionar una guía experimental completa para futuras exploraciones en las estructuras y funciones de los GPCR.
Protocolo
1. Purificación del complejo proteico S1PRs-G
- Para purificar el complejo proteico humano S1PRs-G, clonar los ADNc de S1PR1 que carecen de residuos C-terminales 338-382, el tipo salvaje S1PR3, S1PR5 truncado con 345-398 en C-terminal, y el tipo salvaje Gi1 en el vector pFastBac1 y los ADNc del tipo salvaje Gβ1 y Gγ2 en el vector pFastBacdual (Tabla de materiales).
NOTA: Todas las construcciones para S1PR también contienen la secuencia de señal de hemaglutinina (HA) seguida de una etiqueta de epítopo Flag en el extremo N y una etiqueta 10 veces HIS en el extremo C. Además, se insertó una secuencia de ADN sintético (Tabla de materiales) para traducir la lisozima T4 (T4L) en el extremo N de S1PR para facilitar la expresión y purificación del receptor. - Preparación del baculovirus que codifica S1PRs, Gi1 y Gβ1γ2
- Añadir los vectores recombinantes a 50 μL de Escherichia coli (E. coli) competente DH5α almacenada en un tubo de 1,5 ml a -80 °C, e incubar en hielo durante 30 min.
- Electrocutar las células a 42 °C durante 90 s, transferirlas inmediatamente al hielo y enfriarlas durante 2 min.
- Agitar el tubo a 37 °C durante 3-5 h después de suplementar con 300 μL de caldo de lisogenia (LB) medio. Colocar en placa 100 μL de células a la placa de agar LB e incubar a 37 °C manteniendo en oscurecimiento durante 48 h.
- Inocular la colonia blanca en 5 mL de medio LB que contenga 50 μg/mL de kanamicina, 10 μg/mL de tetraciclina y 7 μg/mL de gentamicina, y cultivar a 37 °C durante 16 h.
- Aislar la bacmid recombinante con el kit de minipreparación del plásmido (Tabla de materiales) siguiendo las instrucciones del fabricante, para producir el baculovirus P0.
NOTA: Antes de su uso, la bacmid purificada se analizó por PCR con cebadores pUC/M13 hacia adelante y hacia atrás. Para la PCR, número de ciclos = 30 ciclos, temperatura de fusión = 58 °C y tiempo de extensión = 1 min por 1 Kb. - Preparar el baculovirus P0 como se describe en un protocolo anterior32.
- Cultive las células sf9 (medio ESF921) en placas de seis pocillos y verifique que las células estén en la fase logarítmica (1.0-1.5 x 106 células/ml).
- Diluir 8 μL de reactivo de transfección de baculovirus en 100 μL del medio de Grace, e incubar durante 30 min a temperatura ambiente. Diluir 10 μg de la bacmid recombinante en 100 μL del medio de Grace, y mezclar suavemente. Combine el bacmid diluido con el reactivo de transfección de baculovirus diluido, mezcle suavemente e incube durante 30 minutos a temperatura ambiente.
- Añadir la mezcla (bacmida y reactivo) a las células (paso 1.2.6.1) y emplatarlas a 27 °C durante 3 h.
- Retire el medio de Grace y reemplácelo con 2 ml de medio de cultivo celular ESF921. Colocar en placa las placas de seis pocillos a 27 °C y recoger el medio de cultivo celular ESF921 después de 5 días después de la transfección.
- Centrifugar a 500 x g a 4 °C durante 10 min para eliminar las células y los residuos. Transfiera el sobrenadante a tubos de 2 ml. Esta es la población de baculovirus P0.
- Aislar el stock de virus P1
- Transfiera 30 ml de células sf9 a un frasco cónico, cultive a 27 °C con agitación a 270 rpm y verifique que las células alcancen una fase logarítmica (1.0-1.5 x 106 células/ml).
- Añadir 2 ml de caldo de virus P0 al frasco y agitar a 270 rpm durante 4 días a 27 °C.
- Transfiera las células a un tubo de 50 ml, centrifugar a 1.800 x g durante 10 minutos a 4 °C para eliminar las células y los residuos, y transfiera el sobrenadante a tubos de 50 ml. Esta es la población de baculovirus P1.
- Amplificar el stock baculoviral
- Repita el paso 1.2.7 utilizando 50 ml de células sf9 en la fase logarítmica (1,0-1,5 x 106 células/ml) y 1 ml de material P1.
- Almacene el stock de baculovirus P2 resultante a 4 °C, protegiéndolo de la luz.
NOTA: No amplifique el baculovirus indefinidamente, ya que los mutantes nocivos se produjeron con cada paso.
- Expresión del complejo proteico S1PRs-G
- Cultivar células de insectos sf9 para alcanzar una densidad de 2,5 x 106 células/ml, coinfectar con el baculovirus P2 que codifica S1PRs, Gi1 y Gβ1γ2 a una relación de volumen de 1:2:1, y cultivar de nuevo a 27 °C durante 48 h.
- Recoger las células centrifugando a 700 x g a 4 °C durante 15 min, congelarlas en nitrógeno líquido y almacenarlas a -80 °C para su uso.
- Purificación de proteínas
- Descongelar el pellet celular obtenido en la etapa 1.3 a temperatura ambiente, y luego resuspenderlo en tampón de lisis (20 mM HEPES pH 7.5, 50 mM NaCl, 5 mM MgCl 2, 5 mM CaCl2) suplementado con 100 μg/mL benzamidina, 100 μg/mL leupeptina, 100 μg/mL de aprotinina, 25 mU/mL de apirona y 10 μM agonista. Revuelva la suspensión celular a temperatura ambiente durante 2 h para inducir la formación del complejo proteico S1PRs-G.
NOTA: La apirasa es una ATP difosfohidrolasa. Cataliza la eliminación del fosfato gamma del ATP y el fosfato beta del ADP. - Transfiera la solución a los tubos, centrifugar a 70,000 x g durante 10 minutos y retire el sobrenadante con cuidado. Resuspender el pellet en tampón solubilizante (20 mM HEPES pH 7.5, 100 mM NaCl, 5 mM MgCl 2, 5 mM CaCl2, 0.5% (p/v) LMNG, 0.1% (p/v) CHS, 1% (p/v) colato de sodio, 10% (v/v) glicerol).
- Transfiera la suspensión a un vaso Rebote y homogeneice el pellet completamente. Añadir 10 μM agonistas, 4 mg de scFv16, 100 μg/ml de benzamidina, 100 μg/ml de leupeptina, 100 μg/ml de aprotinina y 25 mU/ml de apirasa a la suspensión, y agitar a 4 °C durante 2 h.
NOTA: Los pasos de homogeneización de los pellets son cruciales para la producción del complejo proteico GPCR-G. - Transfiera la solución a los tubos y centrifugar a 100.000 x g durante 30 min a 4 °C.
- Preequilibrar la resina bandera con el tampón de lavado (20 mM HEPES pH 7.5, 100 mM NaCl, 5 mM MgCl 2, 5 mM CaCl2, 10 μM agonista, 0.0375% (p/v) LMNG, 0.0125% (p/v) GDN, 0.01% (p/v) CHS).
- Transfiera el sobrenadante a los tubos e incube con la resina bandera a 4 °C durante 2 h.
- Cargue la mezcla anterior en la columna de vidrio y lave la columna con 50 ml de tampón de lavado suplementado con 100 μg / ml de benzamidina, 100 μg / ml de leupeptina y 100 μg / ml de aprotinina.
- Eluya la columna con 10 ml del tampón de elución que contiene 20 mM HEPES pH 7.5, 100 mM NaCl, 5 mM EDTA, 200 μg/mL péptido bandera, 10 μM agonista, 0.0375% (p/v) LMNG, 0.0125% (p/v) GDN, 0.01% (p/v) CHS, 100 μg/ml benzamidina, 100 μg/ml leupeptina y 100 μg/ml de aprotinina.
- Recoger el complejo proteico S1PRs-G y concentrar en 1 ml utilizando un concentrador de corte de 100 kDa a 1.300 x g a 4 °C. Filtrar a través de un filtro de 0,22 μM y centrifugar a 13.000 x g durante 10 min a 4 °C para eliminar los agregados.
- Cargue el complejo proteico S1PRs-G en una columna de filtración en gel de cromatografía de exclusión de tamaño (SEC) preequilibrada con el tampón SEC que contiene 20 mM HEPES pH 7.5, 100 mM NaCl, 10 μM agonista, 100 Μm TCEP, 0.00375% (p/v) LMNG, 0.00125% (p/v) GDN y 0.001% (p/v) CHS a un caudal de 0.5 mL/min a 4 °C.
- Recoger las fracciones pico y concentrar utilizando un concentrador de corte de 100 kDa a 1.300 x g a 4 °C para crio-EM.
- Descongelar el pellet celular obtenido en la etapa 1.3 a temperatura ambiente, y luego resuspenderlo en tampón de lisis (20 mM HEPES pH 7.5, 50 mM NaCl, 5 mM MgCl 2, 5 mM CaCl2) suplementado con 100 μg/mL benzamidina, 100 μg/mL leupeptina, 100 μg/mL de aprotinina, 25 mU/mL de apirona y 10 μM agonista. Revuelva la suspensión celular a temperatura ambiente durante 2 h para inducir la formación del complejo proteico S1PRs-G.
2. Microscopía electrónica para resolver la estructura de S1PRs
- Recogida de datos
- Para preparar las rejillas crioelectromagnéticas, sostenga las rejillas Au R1.2/1.3 de malla 300 durante 10 s y la descarga incandescente durante 60 s a 15 mA utilizando un sistema de limpieza de descarga incandescente.
- Realizar la vitrificación de la muestra como se ha descrito anteriormente33,34. En la consola de congelación por inmersión, ajuste la temperatura a 4 °C y la humedad relativa al 100% para el entorno de trabajo de la cámara. Utilice la fuerza de borrado para 0, el tiempo de espera de 0 s, el tiempo de borrado de 2 o 3 s y el tiempo de drenaje de 0 s. Por lo general, solo requiere 3 μL de la muestra en concentraciones de 5-10 mg / ml para la vitrificación única.
- Recorte y cargue rejillas en el ensamblaje automático de la rejilla, cargue el ensamblaje automático de la rejilla en Nanocab y cargue Nanocab en el microscopio mediante un cargador automático como se describió anteriormente35. Calidad de muestra de pantalla con el software EPU234. Por lo general, los datos recopilados en las áreas de espesor de hielo adecuado fueron mejores.
- Recopilar datos crio-EM como se describió en detalle anteriormente35. Para el receptor S1P, establezca el desplazamiento de desenfoque entre -1.0 μm y -1.8 μm con la dosis de electrones de exposición de 50-65 e-/Å2. Para los complejos S1PR1-Gi, recopile la pila de vídeo automáticamente utilizando el software EPU2 en modo de conteo con el detector K2 a un tiempo de exposición total de 2 s, una velocidad de grabación de cinco fotogramas brutos por segundo y una dosis total de 56 e-/Å2 para producir 35 fotogramas por pila.
NOTA: Por lo general, se necesitan más de 5,000 películas para reconstruir la estructura del receptor.
- Procesar los datos usando una combinación de RELION36 y cryoSPARC37 para obtener un mapa de densidad crio-EM ideal. Utilice RELION-3.1_gpu_ompi4 para procesar los datos inicialmente que impliquen operaciones similares a las descritas anteriormente34.
- En el terminal del sistema Linux, introduzca el directorio principal del directorio de almacenamiento de datos.
- Ingrese el comando relion en el terminal para abrir la interfaz gráfica de usuario (GUI) de RELION.
NOTA: Si esta es la primera vez que se abre una GUI de RELION en este directorio, aparecerá una ventana emergente; haga clic en Sí. - Haga clic en Importar en la barra de funciones en el lado derecho de la GUI de RELION para importar los datos sin procesar en RELION.
- En la opción Películas/micrófonos , seleccione Sí para ¿ Importar películas/micrografías sin procesar?, introduzca la ruta de datos en el campo Archivos de entrada sin procesar (se recomiendan caracteres comodín) y seleccione Sí para ¿Son estas películas de varios fotogramas?. Introduzca el tamaño de píxel de las películas en el campo Tamaño de píxel (Angstrom), el voltaje de funcionamiento del microscopio (en kV) en el campo Voltaje (kV) y la aberración esférica del microscopio en el campo Aberración esférica (mm). Estos son los parámetros que se registraron en el momento de la recolección de datos.
- En la opción En ejecución , modifique el nombre de la cola de acuerdo con el servidor donde se ejecuta el programa (otras funciones también necesitan modificar este parámetro). Deje los demás parámetros en los valores predeterminados establecidos por RELION. Finalmente, cuando todos los parámetros se detecten correctamente, haga clic en ¡EJECUTAR! para ejecutar el programa.
- Utilice la función de corrección de movimiento para la alineación de todos los fotogramas38.
- En la opción de E / S , haga clic en Examinar y elija la salida de la función de importación llamada movies.star como entrada del archivo STAR de películas de entrada. Introduzca la dosis por fotograma en el campo Dosis por fotograma (e/A2), que es igual a la dosis total dividida por el número de fotogramas. Seleccione No para Guardar suma de espectros de potencia?.
- En la opción Movimiento, introduzca 250 para el factor B, 5,5 para Número de parches X, Y y 2 para los fotogramas de grupo (asegúrese de la dosis del grupo >3). Si los datos no fueron referenciados a la ganancia durante el período de recolección, se necesita una imagen de referencia de ganancia que se puede obtener adquiriendo un área de cuadrícula en blanco. Seleccione No para usar la propia implementación de RELION? e ingrese el directorio que contiene el archivo ejecutable de MOTIONCOR2 39en el campo ejecutable MOTIONCOR2.
- En la opción En ejecución , elija el MPI y el número de subproceso adecuados según la potencia informática del servidor; aquí, se utilizaron MPI = 8 y subprocesos = 3.
- Utilice la función de estimación CTF para modular la imagen crio-EM de la muestra vitrificada40. En la opción de E / S, haga clic en Examinar y elija la salida de Motion cor llamada corrected micrographs.star como entrada del archivo STAR de películas de entrada. En la opción Gctf, seleccione Sí para UseGctf en su lugar?.
- Utilice la función de selección de subconjuntos para eliminar micrografías con un valor de rlnCtfMaxResolutin >4.
- En la opción de E / S , haga clic en Examinar ubicado a la derecha de O seleccione de micrographs.star y elija la salida de CtfFind llamada micrographs_ctf.star como entrada. En la opción Subconjunto , seleccione Sí para Seleccionar según los valores de metadatos? e introduzca 4 para el valor máximo de metadatos para eliminar datos incorrectos.
- Picking manual: elige algunas imágenes manualmente para la selección preliminar y la clasificación.
- En la opción de E/S , haga clic en Examinar y elija micrographs_selected.star del directorio Select anterior (Paso 2.2.6) como entrada.
- Haga clic en ¡EJECUTAR! (aparece una ventana). Haga clic en Archivo en la esquina superior izquierda de la nueva ventana y haga clic en Invertir selección para cancelar la selección de todas las imágenes. Marque el cuadro de selección situado más a la izquierda en la fila correspondiente de cada entrada y haga clic en elegir para verificar las imágenes y seleccionar ~ 500 buenas imágenes. Haga clic en Archivo > Guardar selección para guardar las imágenes seleccionadas y cerrar la ventana.
- Selección automática: los paquetes de software automatizados de selección de partículas son útiles y potentes41.
- En la opción de E/S , haga clic en Browse a la derecha de Input micrographs for autopick (Introducir micrografías) para autopick y elija micrographs_selected.star del directorio ManualPick anterior (Paso 2.2.7) como entrada. El algoritmo laplaciano de Gaussiano se usa al principio, así que seleccione Sí para O: use Laplaciano de Gaussiano.
- En la opción laplaciano, establezca Min.diameter para el filtro LoG (A) en 80 y Max.diameter para el filtro LoG (A) en 130. En la opción Selección automática, establezca Distancia mínima entre partículas (A) en 65 y seleccione Sí en Usar aceleración de GPU si se puede acceder a la GPU.
- Extraer partículas para los siguientes pasos.
- En la opción E/S , haga clic en Busque a la derecha del archivo STAR de micrografía y elija el archivo micrographs_selected.star del Paso 2.2.6. Haga clic en Examinar a la derecha de Introducir coordenadas y elija el cords_suffix_autopick.star del Paso 2.2.8.
- En la opción Extraer, seleccione Sí para Reescalar partículas y establezca el tamaño Reescalado (píxeles) en 128 para acelerar los pasos posteriores.
- Clasificación 2D para la clasificación preliminar de partículas
- En la opción de E / S , haga clic en Examinar a la derecha del archivo STAR de imágenes de entrada y elija particles.star del Paso 2.2.9. En la opción Optimización , establezca Número de clases en 100 y Diámetro de máscara (A) en 140.
- En la opción Computar , establezca Número de partículas agrupadas en 10, ingrese el directorio que se encuentra en una unidad local rápida (por ejemplo, una unidad SSD) en el campo Copiar partícula a directorio de borrador y seleccione Sí para usar aceleración de GPU? para una velocidad de procesamiento más rápida.
- Selección de subconjuntos para seleccionar buenos resultados 2D como plantillas para elegir partículas
- En la opción de E/S , haga clic en Examinar a la derecha de Seleccionar clases de model.star y elija la salida del Paso 2.2.10 llamado run_it025_model.star como entrada. Haga clic en RUN!. En la ventana emergente, marque Ordenar imágenes y Ordenar inversamente? y haga clic en ¡Mostrar!.
- Elija buenos resultados 2D representativos como referencia para Referencia de la función de selección automática .
NOTA: Los resultados seleccionados están encuadrados en rojo. Los resultados de clasificación 2D buenos y malos se muestran más adelante. - Haga clic con el botón derecho y seleccione Guardar clases seleccionadas.
- Utilice la plantilla para la segunda ronda de selección automática. En la opción E/S , haga clic en Examinar a la derecha de Micrografías de entrada para autopick y elija micrographs_selected.star en el Paso 2.2.6. Haga clic en Examinar a la derecha de las referencias 2D, elija class_averages.star en el Paso 2.2.11 y seleccione No para O: use Laplacian-of-Gaussian.
- Realice de nuevo la extracción de partículas utilizando coord_suffix_autopick.star del paso 2.2.12 y micrographs_selected.star del paso 2.2.6.
- Realice de nuevo la clasificación 2D utilizando particles.star del paso 2.2.13.
- Vuelva a realizar la selección de subconjuntos con run_it025_optimiser.star del paso 2.2.14.
NOTA: Todas las imágenes 2D con contornos claros y formas correctas deben ser elegidas. - Realice la extracción de partículas de la siguiente manera. En la opción E/S , haga clic en Busque a la derecha del archivo STAR de la micrografía, elija el micrographs_selected.star del Paso 2.2.6 y seleccione Sí para O volver a extraer partículas refinadas?. Haga clic en Busque a la derecha del archivo STAR de partículas refinadas y elija particles.star del Paso 2.2.15.
- Modelo inicial 3D y generación de un mapa de referencia: En la opción E/S , haga clic en Examinar a la derecha del archivo STAR de imágenes de entrada y elija particles.star del Paso 2.2.16. Establezca Número de clases en 1 y Diámetro de máscara (A) en 140 en la opción Optimización .
- Clasificación 3D y generación de un mapa 3D preliminar: En la opción E/S , haga clic en Examinar a la derecha del archivo STAR Input images y elija particles.star del Paso 2.2.16. Haga clic en Examinar a la derecha del mapa de referencia y elija el initial_model.mrc del paso 2.2.17. Establezca Número de clases en 4-6 y Diámetro de máscara (A) en 140 en la opción Optimización .
- Generación de máscaras: Seleccione buenos mapas 3D del paso 2.2.17 como entrada en la opción de E/S . Establezca el umbral de binarización inicial en 0,05 (ajuste en función de la salida), Extender el mapa binario de tantos píxeles a 3 y Agregar borde suave de este número de píxeles a 8 en la opción Máscara .
- Utilice cryoSPARC para el siguiente procesamiento.
- Cree un nuevo espacio de trabajo y haga clic en Job Builder para el primer trabajo.
- Para importar la pila de partículas, introduzca la ruta de la partícula (Paso 2.2.16) en el campo Ruta meta de la partícula y la ruta de la película (Paso 2.2.16) en el campo Ruta de datos de la partícula.
NOTA: Los parámetros Voltaje de aceleración (kV), Aberración esférica (mm) y Tamaño de píxel (Angstrom) son los mismos que antes. El valor de contraste de amplitud (fracción) es 0.1. - Importe volúmenes 3D introduciendo la ruta del mejor volumen 3D en el paso 2.2.18 de la ruta de datos del volumen y seleccionando Asignar para Tipo de volumen que se va a importar.
- Para importar máscara, introduzca la ruta de la máscara (paso 2.2.19) en la ruta de datos del volumen y seleccione Máscara para Tipo de volumen que se va a importar.
- Refinamiento no uniforme: Tome las salidas de los pasos 2.2.22, 2.2.23 y 2.2.24 como entrada.
NOTA: Esta función es muy útil para las proteínas de membrana.- Arrastre la salida del Paso 2.2.22 (imported_particles) como entrada de partículas de Refinamiento no uniforme (partícula), la salida del Paso 2.2.23 (imported_volume_1) como entrada del volumen (volumen) del Refinamiento no uniforme y salida del Paso 2.2.24 (imported_mask_1) como entrada de la máscara de Refinamiento no uniforme (máscara).
NOTA: A veces se pueden lograr mejores resultados sin máscara. - Haga clic en Cola para iniciar el procesamiento.
- Arrastre la salida del Paso 2.2.22 (imported_particles) como entrada de partículas de Refinamiento no uniforme (partícula), la salida del Paso 2.2.23 (imported_volume_1) como entrada del volumen (volumen) del Refinamiento no uniforme y salida del Paso 2.2.24 (imported_mask_1) como entrada de la máscara de Refinamiento no uniforme (máscara).
- Ejecute los pasos 2.2.18-2.2.25 para obtener mejores resultados. A través de la serie de procesamiento anterior, se puede obtener un mapa 3D S1PR-Gi de buena resolución.
3. Ensayo de inhibición de cAMP mediado por S1PRs-Gi
NOTA: El experimento de inhibición de cAMP mediado por S1PRs-Gi se dividió en varias partes, y los siguientes son procedimientos experimentales detallados. El principio experimental y el proceso experimental general se muestran en forma de diagrama de flujo en la Figura 1.
- Construcción de plásmidos
- Subclonar los ADNc de tipo salvaje S1PR1, S1PR3 y S1PR5 en el vector pcDNA3.1+ con una secuencia de señal HA seguida de una etiqueta Flag en el extremo N (Tabla de materiales).
NOTA: Las mutaciones para todos los receptores se generaron utilizando el kit de mutagénesis (Tabla de materiales).
- Subclonar los ADNc de tipo salvaje S1PR1, S1PR3 y S1PR5 en el vector pcDNA3.1+ con una secuencia de señal HA seguida de una etiqueta Flag en el extremo N (Tabla de materiales).
- Preparación del plásmido
- Agregue los vectores pcDNA3.1+ recombinantes o el plásmido sensor (Tabla de materiales) a 50 μL de Escherichia coli (E. coli) competente DH5α almacenada en un tubo de 1.5 ml a -80 °C por separado, e incube en hielo durante 30 min. Electrocutar las células a 42 °C durante 90 s, transferirlas inmediatamente al hielo y enfriarlas durante 2 min.
NOTA: El plásmido sensor proporcionado por el kit de ensayo de inhibición de Gi-amp (Tabla de materiales) expresa un gen de luciferasa modificado fusionado con un dominio de unión de cAMP y aumenta la actividad de luminiscencia cuando se une cAMP. - Agitar el tubo a 37 °C durante 1 h después de suplementar con 300 μL de caldo de lisogenia (LB) medio. Colocar en placa 100 μL de células a la placa de agar LB e incubar a 37 °C manteniéndola en la oscuridad durante 48 h. Inocular la colonia blanca en 5 mL de medio LB que contenga 100 μg/mL de ampicilina, y cultivar a 37 °C durante 16 h.
- Aísle el ADN utilizando el kit de minipreparación de plásmidos (Tabla de materiales) siguiendo las instrucciones del fabricante; el plásmido estaba en una concentración de más de 350 ng/μL con el valor de A260/A280 entre 1,7 y 1,9.
- Agregue los vectores pcDNA3.1+ recombinantes o el plásmido sensor (Tabla de materiales) a 50 μL de Escherichia coli (E. coli) competente DH5α almacenada en un tubo de 1.5 ml a -80 °C por separado, e incube en hielo durante 30 min. Electrocutar las células a 42 °C durante 90 s, transferirlas inmediatamente al hielo y enfriarlas durante 2 min.
- Cultivo celular
- Platear las células CHO-K1 en una placa de Petri de 10 cm, cultivarlas en una incubadora a 37 °C con 5% deCO2 y cosecharlas cuando la monocapa esté al 80%-90% de confluencia.
- Aspirar el medio de crecimiento de las células CHO-K1, añadir 4 ml de tripsina-EDTA al 0,05% precalentado a 37 °C sobre la placa de Petri suavemente, e incubar durante 15 s. Luego, agregue 4 ml de medio de crecimiento que consiste en medio F12 + 10% FBS.
- Desaloje las células de la superficie de la placa de Petri balanceando suavemente y golpeando el lado de la placa de Petri. Llene un tubo cónico con suspensión celular. Revuelva y pipetear lentamente para eliminar suavemente los grumos de células.
- Centrifugar células a 250 x g durante 5 min a temperatura ambiente, aspirar sobrenadante y resucitar con 3 ml de PBS. Repita este paso.
- Determinar el número de células con el hemacitómetro y centrifugar las células a 250 x g durante 5 min a temperatura ambiente.
- Aspirar tampón PBS y resuspender células CHO-K1 con 3 mL de medio de crecimiento que consiste en medio F12 y 10% FBS.
- Agregue 2 ml del medio de cultivo que consiste en medio F12 y 10% de FBS en cada pocillo de la placa de seis pocillos, y siembre 150 μL de suspensión celular en cada pocillo para mantener las células en la densidad de 1.5 x 105 células/ml. Incubar la placa de seis pocillos en una incubadora de cultivo de tejidos a 37 °C con 5% deCO2 durante aproximadamente 24 h.
- Transfección transitoria
- Diluir 2 μg de ADN (paso 3.2.3) en 200 μL de tampón de reactivo de transfección (tabla de materiales). Mezclar por vórtice durante 10 s y girar brevemente antes de usar.
NOTA: Aquí, los 2 μg de ADN contienen 0,5 μg de vector receptor (S1PR1, S1PR3 o S1PR5) y 1,5 μg del plásmido sensor. - Añadir 4 μL del reactivo de transfección (Tabla de materiales), vórtice durante 10 s y girar brevemente antes de usar. Incubar durante 15 min a temperatura ambiente.
- Deje caer lentamente 200 μL de mezcla de transfección en cada pocillo (que contiene células CHO-K1) para distribuir uniformemente. Agite suavemente la placa de seis pocillos para asegurar una mezcla completa.
- Reemplace el medio de transfección después de 4-6 h con el medio de crecimiento celular que consiste en medio F12 + 10% FBS, y devuelva la placa de seis pocillos a la incubadora.
- Cosechar células 24-48 h post-transfección.
- Digerir las células CHO-K1 en el pocillo con 500 μL de tripsina-EDTA al 0,05% (precalentado a 37 °C) durante 15 s y añadir 1 ml de medio de cultivo compuesto por medio F12 + 10% FBS. Desaloje las células de la superficie del pozo balanceándolas y golpeando suavemente el lado del pozo.
- Transfiera la suspensión de la celda a un tubo cónico y centrifugar a 250 x g durante 5 min a temperatura ambiente. Vierta el sobrenadante y coseche las células transfectadas.
NOTA: Antes de la determinación de la señal de fluorescencia, verifique los niveles de expresión de la superficie celular de los receptores mediante ELISA como se describió anteriormente26.
- Diluir 2 μg de ADN (paso 3.2.3) en 200 μL de tampón de reactivo de transfección (tabla de materiales). Mezclar por vórtice durante 10 s y girar brevemente antes de usar.
- Equilibrio con la sal D-luciferina-potasio (Tabla de materiales)
- Suspender inmediatamente las células cosechadas (24-48 h después de la transfección) con 3 ml de tampón de ensayo (es decir, la solución salina equilibrada de Hank (HBSS) que contiene 10 mM HEPES pH 7.4), con una dilución adicional de 3% v / v de la sal D-luciferina-potasio.
- Añadir 90 μL de suspensión celular por pocillo de una placa de 96 pocillos con una pipeta multicanal y mezclar suavemente.
- Incubar durante 40 min a temperatura ambiente.
- Determinación de la señal de fluorescencia
- Preparar de antemano 10 mM de soluciones madre de Siponimod disueltas en DMSO y realizar una dilución seriada utilizando tampón HBSS que contenga 25 μM de forskoline antes de la estimulación del ligando.
NOTA: Excepto para el grupo control sin ligando, los restantes tienen un rango de gradiente de concentración de 10-11-10-5 mol/L. - Estimular con 10 μL (por pocillo) de solución agonista a diferentes concentraciones durante 30 min.
- Cuente las señales de luminiscencia en un lector de microplacas utilizando los parámetros de software asociados (Tabla de materiales) de la siguiente manera. Seleccione Luminiscencia para el método de detección, Punto final para el tipo de lectura y Fibra de luminiscencia para el tipo de óptica. Ajuste la ganancia óptica a 255.
NOTA: Cada medición se repitió en al menos tres experimentos independientes, cada uno por triplicado. - Obtenga los valores de la señal de fluorescencia, importe los datos en un programa de hoja de cálculo y procese los datos utilizando la función dosis-respuesta de regresión no lineal (ajuste de curva).
- Preparar de antemano 10 mM de soluciones madre de Siponimod disueltas en DMSO y realizar una dilución seriada utilizando tampón HBSS que contenga 25 μM de forskoline antes de la estimulación del ligando.
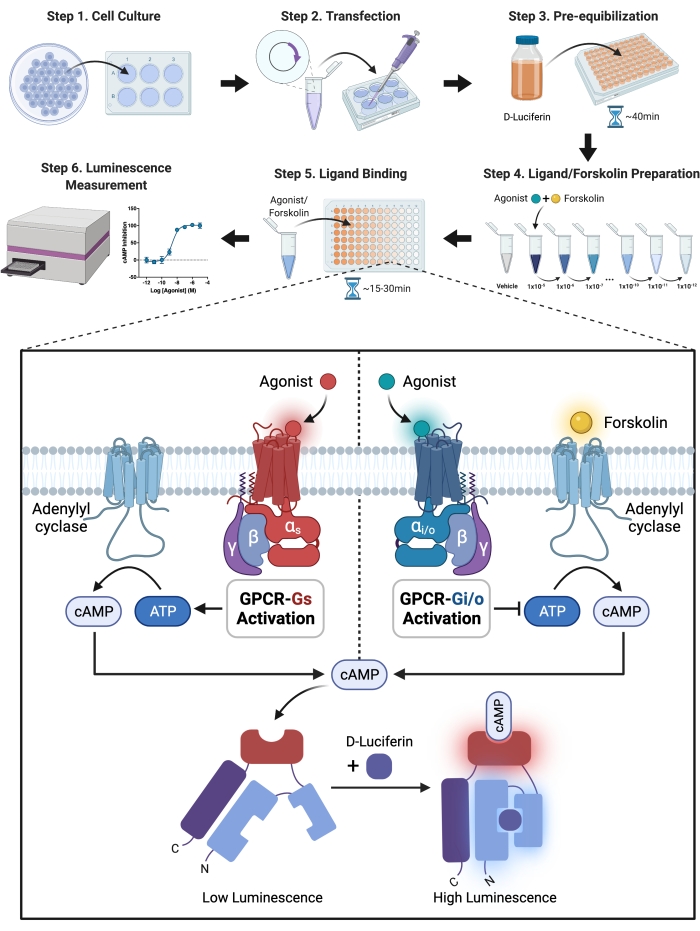
Figura 1: Ilustración esquemática del experimento. Una guía detallada paso a paso para la configuración y ejecución experimental. En resumen, el receptor y la luciferasa modificada se coexpresaron transitoriamente en células CHO-K1 transfectando el plásmido receptor y sensor en las células con reactivo de transfección. Las células se suspendieron en solución HBSS con sal de D-luciferina-potasio, el sustrato de luciferasa, y se sembraron en una placa de 96 pocillos después de 24 h. Para permitir la penetración en las células, la D-luciferina debe estar preequilibrada con las células. La enzima oxidativa luciferasa transforma la luciferina en oxiluciferina y emite luz. La luciferasa modificada, por otro lado, genera luz a través de una reacción química solo cuando se une a cAMP, y la intensidad de la luz tiene una asociación positiva con los niveles de cAMP en las células. Los niveles de cAMP se regularon con GPCR activado por agonista. Los receptores acoplados a Gi redujeron los niveles de cAMP, lo que requirió la adición de forskoline para activar la adenilil ciclasa en el experimento cAMP de inhibición de Gi. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Antes de congelar la muestra del complejo S1PRs-Gi, la muestra purificada debe separarse mediante cromatografía de exclusión de tamaño (SEC) y analizarse con cromatografía de filtración en gel. La figura 2 muestra el complejo S1PR3-Gi como ejemplo. La fracción pico del complejo homogéneo de proteínas GPCR-G generalmente se localizó en ~ 10.5 ml de la cromatografía de exclusión de tamaño (Figura 2A). El análisis de la página SDS del complejo S1PR3-G...
Discusión
Este protocolo describe una tubería primaria para determinar las estructuras de S1PR mediante crio-EM y medir la potencia de activación de S1PR mediante un ensayo de inhibición de cAMP mediado por Gi. Algunos pasos son cruciales para el éxito del experimento.
Para purificar el complejo S1PRs-Gi, se debe prestar más atención a la calidad del virus y a la salud de las células sf9 . La expresión del receptor se reduce drásticamente en las células sf9 pobres. La salud d...
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Los datos del complejo S1PRs-Gi se recolectaron en el Centro Cryo-EM de China Occidental en la Universidad de Sichuan y el Centro Cryo-EM en la Universidad de Ciencia y Tecnología del Sur (SUSTech) y se procesaron en el Centro de Computación de Alto Rendimiento Duyu en la Universidad de Sichuan. Este trabajo fue apoyado por la Fundación de Ciencias Naturales de China (32100965 a L.C., 32100988 a W.Y., 31972916 a Z.S.) y el Fondo de Investigación Postdoctoral a tiempo completo de la Universidad de Sichuan (2021SCU12003 a L.C.)
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% trypsin-EDTA | GIBCO | Cat# 25300054 | |
| 0.22 µM filter | Thermo Fisher Scientific | Cat# 42213-PS | |
| 100 kDa cut-off concentrator | Thermo Fisher Scientific | Cat# 88533 | |
| 6-well plate | Corning | Cat# 43016 | |
| 96-well plate | Corning | Cat# 3917 | |
| Aprotinin | Sigma-Aldrich | Cat# 9087-70-1 | |
| Apyrase | NEB | Cat# M0398S | |
| Baculovirus transfection reagent | Thermo Fisher Scientific | Cat# 10362100 | For the preparation of P0 baculovirus |
| Benzamidine | Sigma-Aldrich | Cat# B6506 | |
| CHO-K1 | ATCC | N/A | |
| CHS | Sigma-Aldrich | Cat# C6512 | |
| CryoSPARC | Punjani, A., et al.,2017 | https://cryosparc.com/ | |
| DH5α competent E.coli | Thermo Fisher Scientific | Cat# EC0112 | |
| D-Luciferin-Potassium Salt | Sigma- Aldrich | Cat# 50227 | |
| DMSO | Sigma- Aldrich | Cat# D2438 | |
| EDTA | Thermo Fisher Scientific | Cat# S311-500 | |
| ESF921 cell culture medium | Expression Systems | Cat# 96-001 | |
| Excel | microsoft | N/A | |
| F12 medium | Invitrogen | Cat# 11765 | |
| FBS | Cell Box | Cat# SAG-01U-02 | |
| Flag resin | Sigma- Aldrich | Cat# A4596 | |
| Forskolin | APExBIO | Cat# B1421 | |
| Gctf | Zhang, 2016 | https://www.mrc-lmb.cam.ac.uk/kzhang/Gctf/ | |
| GDN | Anatrace | Cat# GDN101 | |
| Gel filtration column | GE healthcare | Cat# 28990944 | |
| Gen5 3.11 | BIO-TEK | N/A | |
| Gentamicin | Solarbio | Cat# L1312 | |
| GloSensor cAMP assay kit | Promega | Cat# E1291 | Gi-inhibition cAMP assay kit |
| GloSensor plasmid | Promega | Cat# E2301 | Sensor plasmid |
| Grace’s medium | GIBCO | Cat# 11595030 | |
| GraphPad Prism 8 | Graphpad | N/A | |
| HBSS | Thermo Fisher Scientific | Cat# 88284 | |
| HEPES | Sigma- Aldrich | Cat# H4034 | |
| jetPRIME Reagent | Polyplus Transfection | Cat# 114-15 | transfection reagent |
| Janamycin | Solarbio | Cat# K1030 | |
| LB medium | Invitrogen | Cat# 12780052 | |
| Leupeptin | Sigma-Aldrich | Cat# L2884 | |
| LMNG | Anatrace | Cat# NG310 | |
| MotionCor2 | (Zheng et al., 2017) | https://emcore.ucsf.edu/ucsf-software | |
| NanoCab | Thermo Fisher Scientific | Cat# 1121822 | |
| PBS | Invitrogen | Cat# 14190-144 | |
| pcDNA3.1-HA-FLAG-S1PRs | GenScript | N/A | |
| pFastBac1-Gαi | GenScript | N/A | |
| pFastBac1-HA-FLAG-T4L-S1PRs-His10 | GenScript | N/A | |
| pFastBacdual-Gβ1γ2 | GenScript | N/A | |
| PureLink HiPure Plasmid Miniprep Kit | Invitrogen | Cat# K210003 | For the preparation of plasmids and P0 baculovirus |
| Q5 site-Directed Mutagenesis kit | NEB | Cat# E0554S | For the preparation of plasmids |
| Quantifoil | Quantifoil | Cat# 251448 | |
| RELION-3.1 | (Zivanov et al., 2018) | https://www2.mrc-lmb.cam.ac.uk/relion | |
| S1PRs cDNA | addgene | N/A | |
| scFv16 | Invitrogen | Cat# 703976 | |
| Sf9 | Expression Systems | N/A | |
| Siponimod | Selleck | Cat# S7179 | |
| sodium cholate | Sigma-Aldrich | Cat# C1254 | |
| Synergy H1 microplate reader | BIO-TEK | N/A | |
| Synthetic T4L DNA (sequence) | N/A | N/A | Aacatcttcgagatgctgcgcatcgacgaagg cctgcgtctcaagatttacaagaataccgaagg ttattacacgattggcatcggccacctcctgaca aagagcccatcactcaacgctgccaagtctga actggacaaagccattggtcgcaacaccaac ggtgtcattacaaaggacgaggcggagaaac tcttcaaccaagatgtagatgcggctgtccgtgg catcctgcgtaatgccaagttgaagcccgtgt atgactcccttgatgctgttcgccgtgcagcctt gatcaacatggttttccaaatgggtgagaccgg agtggctggttttacgaactccctgcgcatgctcc agcagaagcgctgggacgaggccgcagtga atttggctaaatctcgctggtacaatcagacacc taaccgtgccaagcgtgtcatcactaccttccg tactggaacttgggacgcttac |
| TCEP | Thermo Fisher Scientific | Cat# 77720 | |
| Tetracycline | Solarbio | Cat# T8180 | |
| Vitrobot Mark IV | Thermo Fisher Scientific | N/A |
Referencias
- Verstockt, B., et al. Sphingosine 1-phosphate modulation and immune cell trafficking in inflammatory bowel disease. Nature Reviews: Gastroenterology & Hepatology. , 1-16 (2022).
- Rosen, H., Stevens, R. C., Hanson, M., Roberts, E., Oldstone, M. B. Sphingosine-1-phosphate and its receptors: structure, signaling, and influence. Annual Review of Biochemistry. 82, 637-662 (2013).
- Cartier, A., Hla, T. Sphingosine 1-phosphate: Lipid signaling in pathology and therapy. Science. 366 (6463), 5551 (2019).
- Jozefczuk, E., Guzik, T. J., Siedlinski, M. Significance of sphingosine-1-phosphate in cardiovascular physiology and pathology. Pharmacological Research. 156, 104793 (2020).
- Kihara, Y., Maceyka, M., Spiegel, S., Chun, J. Lysophospholipid receptor nomenclature review: IUPHAR Review 8. British Journal of Pharmacology. 171 (15), 3575-3594 (2014).
- Bryan, A. M., Del Poeta, M. Sphingosine-1-phosphate receptors and innate immunity. Cellular Microbiology. 20 (5), 12836 (2018).
- Pelletier, D., Hafler, D. A. Fingolimod for multiple sclerosis. New England Journal of Medicine. 366 (4), 339-347 (2012).
- Obinata, H., Hla, T. Sphingosine 1-phosphate and inflammation. International Immunology. 31 (9), 617-625 (2019).
- Pyne, N. J., Pyne, S. Sphingosine 1-phosphate and cancer. Nature Reviews: Cancer. 10 (7), 489-503 (2010).
- Abu-Farha, M., et al. The role of lipid metabolism in COVID-19 virus infection and as a drug target. International Journal of Molecular Sciences. 21 (10), 3544 (2020).
- Chun, J., Kihara, Y., Jonnalagadda, D., Blaho, V. A. Fingolimod: lessons learned and new opportunities for treating Multiple Sclerosis and other disorders. Annual Review of Pharmacology and Toxicology. 59, 149-170 (2019).
- Murakami, A., et al. Sphingosine 1-phosphate (S1P) regulates vascular contraction via S1P3 receptor: investigation based on a new S1P3 receptor antagonist. Molecular Pharmacology. 77 (4), 704-713 (2010).
- Cao, L., et al. Siponimod for multiple sclerosis. Cochrane Database of Systematic Reviews. 11, (2021).
- Scott, L. J. Siponimod: a review in secondary progressive Multiple Sclerosis. CNS Drugs. 34 (11), 1191-1200 (2020).
- Lamb, Y. N. Ozanimod: first approval. Drugs. 80 (8), 841-848 (2020).
- Scott, F. L., et al. Ozanimod (RPC1063) is a potent sphingosine-1-phosphate receptor-1 (S1P1) and receptor-5 (S1P5) agonist with autoimmune disease-modifying activity. British Journal of Pharmacology. 173 (11), 1778-1792 (2016).
- McGowan, E. M., Haddadi, N., Nassif, N. T., Lin, Y. Targeting the SphK-S1P-SIPR pathway as a potential therapeutic approach for COVID-19. International Journal of Molecular Sciences. 21 (19), 7189 (2020).
- O'Sullivan, C., Dev, K. K. The structure and function of the S1P1 receptor. Trends in Pharmacological Sciences. 34 (7), 401-412 (2013).
- Liao, M., Cao, E., Julius, D., Cheng, Y. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. Nature. 504 (7478), 107-112 (2013).
- Bai, X. C., McMullan, G., Scheres, S. H. How cryo-EM is revolutionizing structural biology. Trends in Biochemical Sciences. 40 (1), 49-57 (2015).
- Murata, K., Wolf, M. Cryo-electron microscopy for structural analysis of dynamic biological macromolecules. Biochimica et Biophysica Acta General Subjects. 1862 (2), 324-334 (2018).
- Zhang, M., et al. Cryo-EM structure of an activated GPCR-G protein complex in lipid nanodiscs. Nature Structural & Molecular Biology. 28 (3), 258-267 (2021).
- Renaud, J. P., et al. Cryo-EM in drug discovery: achievements, limitations and prospects. Nature Reviews: Drug Discovery. 17 (7), 471-492 (2018).
- Ishchenko, A., Gati, C., Cherezov, V. Structural biology of G protein-coupled receptors: new opportunities from XFELs and cryoEM. Current Opinion in Structural Biology. 51, 44-52 (2018).
- Yang, D., et al. G protein-coupled receptors: structure- and function-based drug discovery. Signal Transduction and Targeted Therapy. 6 (1), 7 (2021).
- Yuan, Y., et al. Structures of signaling complexes of lipid receptors S1PR1 and S1PR5 reveal mechanisms of activation and drug recognition. Cell Research. 31 (12), 1263-1274 (2021).
- Zhao, C., et al. Structural insights into sphingosine-1-phosphate recognition and ligand selectivity of S1PR3-Gi signaling complexes. Cell Research. 32 (2), 218-221 (2022).
- Xu, Z., et al. Structural basis of sphingosine-1-phosphate receptor 1 activation and biased agonism. Nature Chemical Biology. 18, 281-288 (2022).
- Liu, Y. F., Ghahremani, M. H., Rasenick, M. M., Jakobs, K. H., Albert, P. R. Stimulation of cAMP synthesis by Gi-coupled receptors upon ablation of distinct Galphai protein expression. Gi subtype specificity of the 5-HT1A receptor. Journal of Biological Chemistry. 274 (23), 16444-16450 (1999).
- Buccioni, M., et al. Innovative functional cAMP assay for studying G protein-coupled receptors: application to the pharmacological characterization of GPR17. Purinergic Signalling. 7 (4), 463-468 (2011).
- Wang, F. I., Ding, G., Ng, G. S., Dixon, S. J., Chidiac, P. Luciferase-based GloSensor cAMP assay: Temperature optimization and application to cell-based kinetic studies. Methods. , (2021).
- Audet, M., et al. Small-scale approach for precrystallization screening in GPCR X-ray crystallography. Nature Protocols. 15 (1), 144-160 (2020).
- Sgro, G. G., Costa, T. R. D. Cryo-EM grid preparation of membrane protein samples for single particle analysis. Frontiers in Molecular Biosciences. 5, 74 (2018).
- White, J. B. R., et al. Single particle cryo-electron microscopy: from sample to structure. Journal of Visualized Experiments. (171), e62415 (2021).
- Thompson, R. F., Iadanza, M. G., Hesketh, E. L., Rawson, S., Ranson, N. A. Collection, pre-processing and on-the-fly analysis of data for high-resolution, single-particle cryo-electron microscopy. Nature Protocols. 14 (1), 100-118 (2019).
- Fernandez-Leiro, R., Scheres, S. H. W. A pipeline approach to single-particle processing in RELION. Acta Crystallographica Section D. 73 (6), 496-502 (2017).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. cryoSPARC: algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14 (3), 290-296 (2017).
- Brilot, A. F., et al. Beam-induced motion of vitrified specimen on holey carbon film. Journal of Structural Biology. 177 (3), 630-637 (2012).
- Zheng, S. Q., et al. MotionCor2: anisotropic correction of beam-induced motion for improved cryo-electron microscopy. Nature Methods. 14 (4), 331-332 (2017).
- Zhang, K. Gctf: Real-time CTF determination and correction. Journal of Structural Biology. 193 (1), 1-12 (2016).
- Scheres, S. H. Semi-automated selection of cryo-EM particles in RELION-1.3. Journal of Structural Biology. 189 (2), 114-122 (2015).
- Liu, S., et al. Differential activation mechanisms of lipid GPCRs by lysophosphatidic acid and sphingosine 1-phosphate. Nature Communications. 13 (1), 731 (2022).
- Duan, J., et al. Cryo-EM structure of an activated VIP1 receptor-G protein complex revealed by a NanoBiT tethering strategy. Nature Communications. 11 (1), 4121 (2020).
- DiIorio, M. C., Kulczyk, A. W. A robust single-particle cryo-electron microscopy (cryo-EM) processing workflow with cryoSPARC, RELION, and Scipion. Journal of Visualized Experiments. (179), e63387 (2022).
- Pradelles, P., Grassi, J., Chabardes, D., Guiso, N. Enzyme immunoassays of adenosine cyclic 3',5'-monophosphate and guanosine cyclic 3',5'-monophosphate using acetylcholinesterase. Analytical Chemistry. 61 (5), 447-453 (1989).
- Jiang, L. I., et al. Use of a cAMP BRET sensor to characterize a novel regulation of cAMP by the sphingosine 1-phosphate/G13 pathway. Journal of Biological Chemistry. 282 (14), 10576-10584 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados