Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Recopilación simultánea de datos de mediciones de fMRI y fNIRS utilizando una matriz de optodos de cabeza completa y canales de corta distancia
En este artículo
Resumen
Presentamos un método para recolectar simultáneamente señales de fMRI y fNIRS de los mismos sujetos con cobertura de fNIRS en toda la cabeza. El protocolo ha sido probado con tres adultos jóvenes y puede adaptarse para la recopilación de datos para estudios de desarrollo y poblaciones clínicas.
Resumen
La espectroscopia funcional de infrarrojo cercano (fNIRS) es una metodología de neuroimagen portátil, más robusta al movimiento y más rentable que la resonancia magnética funcional (fMRI), lo que la hace muy adecuada para realizar estudios naturalistas de la función cerebral y para su uso en poblaciones clínicas y de desarrollo. Tanto las metodologías fNIRS como fMRI detectan cambios en la oxigenación de la sangre cerebral durante la activación cerebral funcional, y estudios previos han demostrado una alta correspondencia espacial y temporal entre las dos señales. Sin embargo, no existe una comparación cuantitativa de las dos señales recogidas simultáneamente de los mismos sujetos con cobertura fNIRS de toda la cabeza. Esta comparación es necesaria para validar de forma exhaustiva las activaciones a nivel de área y la conectividad funcional con el estándar de oro de la resonancia magnética funcional, que a su vez tiene el potencial de facilitar las comparaciones de las dos señales a lo largo de la vida útil. Abordamos esta brecha mediante la descripción de un protocolo para la recopilación simultánea de datos de señales de fMRI y fNIRS que: i) proporciona cobertura de fNIRS en toda la cabeza; ii) incluye mediciones de corta distancia para la regresión de la señal fisiológica sistémica no cortical; y iii) implementa dos métodos diferentes para el co-registro optodo a cuero cabelludo de las mediciones de fNIRS. Se presentan los datos de fMRI y fNIRS de tres sujetos, y se discuten las recomendaciones para adaptar el protocolo a las poblaciones clínicas y de desarrollo. La configuración actual con adultos permite sesiones de escaneo durante un promedio de aproximadamente 40 minutos, que incluyen escaneos funcionales y estructurales. El protocolo describe los pasos necesarios para adaptar el equipo fNIRS para su uso en el entorno de resonancia magnética (RM), proporciona recomendaciones tanto para el registro de datos como para el co-registro de optodo a cuero cabelludo, y analiza las posibles modificaciones del protocolo para adaptarse a las características específicas del sistema fNIRS seguro para RM disponible. Las respuestas representativas específicas de un sujeto de una tarea de tablero de ajedrez intermitente ilustran la viabilidad del protocolo para medir señales fNIRS de toda la cabeza en el entorno de RM. Este protocolo será particularmente relevante para los investigadores interesados en validar las señales fNIRS contra la resonancia magnética funcional a lo largo de la vida.
Introducción
La función cognitiva se ha estudiado en el cerebro humano adulto a través de imágenes de resonancia magnética funcional (fMRI) durante casi tres décadas. Aunque la resonancia magnética funcional proporciona una alta resolución espacial e imágenes tanto funcionales como estructurales, a menudo no es práctica para estudios realizados en contextos naturalistas o para su uso con bebés y poblaciones clínicas. Estas limitaciones limitan sustancialmente nuestra comprensión de la función cerebral. Una alternativa a la resonancia magnética funcional es el uso de metodologías portátiles que son más rentables y resistentes al movimiento, como la espectroscopia funcional de infrarrojo cercano (fNIRS)1,2,3. fNIRS se ha utilizado con bebés y niños pequeños para evaluar la función cerebral en una variedad de dominios cognitivos, como el desarrollo del lenguaje, el procesamiento de información socialmente relevante y el procesamiento de objetos 4,5,6. fNIRS también es una modalidad de neuroimagen especialmente adecuada para la realización de pruebas en poblaciones clínicas debido a su potencial para la repetición de pruebas y monitorización a lo largo de las edades 7,8,9. A pesar de su amplia aplicabilidad, no hay estudios que comparen cuantitativamente las señales de fMRI y fNIRS recogidas simultáneamente de los mismos sujetos con cobertura de toda la cabeza. Esta comparación es necesaria para validar de forma exhaustiva las activaciones a nivel de área y la conectividad funcional entre regiones de interés (ROI) con respecto al estándar de oro de fMRI. Además, el establecimiento de esta correspondencia intermodal tiene el potencial de mejorar la interpretación de fNIRS cuando es la única señal recogida tanto en el desarrollo típico como en el atípico.
Tanto las señales de fMRI como fNIRS detectan cambios en la oxigenación de la sangre cerebral (CBO) durante la activación funcional del cerebro10,11. La resonancia magnética funcional se basa en los cambios en los campos electromagnéticos y proporciona una alta resolución espacial de los cambios en la CBO12. fNIRS, por el contrario, mide los niveles de absorción de la luz infrarroja cercana utilizando una serie de optodos emisores y detectores de luz2. Dado que fNIRS mide los cambios en la absorción en diferentes longitudes de onda, puede evaluar los cambios en la concentración tanto en la oxihemoglobina como en la desoxihemoglobina. Estudios previos que utilizaron registros simultáneos de señales de fMRI y fNIRS con un pequeño número de optodos han demostrado que las dos señales tienen una alta correspondencia espacial y temporal10. Existen fuertes correlaciones entre la fMRI dependiente del nivel de oxígeno en sangre (BOLD) y las medidas ópticas11,13, siendo la desoxihemoglobina la que muestra la mayor correlación con la respuesta BOLD, según lo reportado por trabajos previos que comparan la dinámica temporal de las funciones de respuesta hemodinámica (HRF) fNIRS y fMRI)14. Estos primeros estudios implementaron paradigmas de respuesta motora (es decir, golpeteo con los dedos) y utilizaron un número limitado de optodos que cubrían las áreas de la corteza motora primaria y premotora. En la última década, los estudios han ampliado el enfoque para incluir una batería más grande de tareas cognitivas y sesiones en estado de reposo, aunque todavía utilizan un número limitado de optodos que cubren ROI específicos. Estos estudios han demostrado que la variabilidad en las correlaciones entre fNIRS y fMRI depende de la distancia del optodo al cuero cabelludo y al cerebro15. Además, fNIRS puede proporcionar medidas de conectividad funcional en estado de reposo comparables a las de fMRI16,17.
El protocolo actual se basa en trabajos anteriores y aborda las limitaciones clave mediante i) proporcionar cobertura de fNIRS en toda la cabeza, ii) incluir mediciones de corta distancia para la regresión de señales fisiológicas no corticales, iii) implementar dos métodos diferentes para el registro conjunto de optodo a cuero cabelludo de las mediciones de fNIRS y iv) permitir la evaluación de la fiabilidad test-retest de la señal en dos sesiones independientes. Este protocolo para la recopilación simultánea de datos de señales de fMRI y fNIRS se desarrolló inicialmente para realizar pruebas a adultos jóvenes. Sin embargo, uno de los objetivos del estudio era crear una configuración experimental para recopilar señales simultáneas de fMRI/fNIRS que puedan adaptarse posteriormente para probar poblaciones en desarrollo. Por lo tanto, el protocolo actual también puede utilizarse como punto de partida para desarrollar un protocolo para realizar pruebas a los niños pequeños. Además de utilizar la cobertura de fNIRS en toda la cabeza, el protocolo también tiene como objetivo incorporar avances recientes en el campo del hardware fNIRS, como la inclusión de canales de corta distancia para medir la señal fisiológica sistémica (es decir, los cambios vasculares derivados de fuentes no corticales, como la presión arterial, las señales respiratorias y cardíacas)18,19 ; y el uso de un sensor de estructura 3D para el co-registro optodo-scalp20. Aunque el presente protocolo se centra en los resultados de una tarea de tablero de ajedrez de parpadeo visual, todo el experimento incluye dos sesiones con una mezcla de diseños tradicionales de tareas en bloque, sesiones en estado de reposo y paradigmas naturalistas de visualización de películas.
El protocolo describe los pasos necesarios para adaptar el equipo fNIRS para su uso en el entorno de resonancia magnética, incluido el diseño de la tapa, la alineación temporal a través de la sincronización de disparadores y las pruebas fantasma necesarias antes del inicio de la recopilación de datos. Como se ha señalado, la atención se centra aquí en los resultados de la tarea del tablero de ajedrez intermitente, pero el procedimiento general no es específico de la tarea y puede ser apropiado para cualquier número de paradigmas experimentales. El protocolo describe además los pasos necesarios durante la recopilación de datos, que incluyen la colocación de la tapa fNIRS y la calibración de la señal, la configuración de los equipos participantes y experimentales, así como la limpieza posterior al experimento y el almacenamiento de datos. El protocolo finaliza proporcionando una descripción general de las canalizaciones analíticas específicas para el preprocesamiento de datos fNIRS y fMRI.
Protocolo
La investigación fue aprobada por la Junta de Revisión Institucional (IRB, por sus siglas en inglés) de la Universidad de Yale. Se obtuvo el consentimiento informado de todos los sujetos. Los sujetos tuvieron que pasar la prueba de resonancia magnética para garantizar su participación segura. Se excluyeron si tenían antecedentes de trastornos médicos o neurológicos graves que probablemente afectarían el funcionamiento cognitivo (es decir, un trastorno neurocognitivo o depresivo, trauma, esquizofrenia o trastorno obsesivo-compulsivo).
NOTA: El protocolo actual utiliza un dispositivo CW-NIRS con 100 canales de larga distancia y 8 canales de corta distancia (32 fuentes de diodos láser, λ = 785/830 nm con una potencia media de 20 mW/longitud de onda, y 38 detectores de fotodiodos de avalancha) muestreados a 1,95 Hz. Las resonancias magnéticas y las resonancias magnéticas funcionales se recogieron en un escáner Siemens 3 Tesla Prisma utilizando una bobina de cabeza de 20 canales. Todos los datos se recogieron en el Centro de Imágenes Cerebrales de Yale (https://brainimaging.yale.edu/). Las modificaciones específicas del sistema para la recopilación simultánea de datos de fMRI y fNIRS se observan en todo el protocolo.
1. Modificaciones y desarrollo de equipos fNIRS para la recolección simultánea de datos
NOTA: Los pasos 3 a 6 son específicos del sistema NIRScoutXP y es posible que no se apliquen a otros sistemas fNIRS debido a la variación en el software de adquisición y los maniquíes disponibles para la evaluación del optodo.
- Preparación de los tapones fNIRS
- Identifique los capuchones de fNIRS necesarios para el estudio. Para un estudio en adultos, asegúrese de que los siguientes tamaños de tapón estén disponibles (en cm): 54, 56, 58 y 60.
- NOTA: Los tamaños de las tapas son específicos del sistema utilizado en este protocolo. Por lo tanto, puede haber variaciones en los tamaños específicos necesarios para los diferentes sistemas NIRS.
- Usando cápsulas de vitamina E y un material repelente al agua (por ejemplo, tela de nailon con recubrimiento de PU), prepare los fiduciales. Envuelva las cápsulas con el material de su elección y cose (o pegue) los fiduciales a las áreas elegidas (ver Figura 1A). Las cápsulas de vitamina E sirven como marcadores de referencia para identificar la posición de los canales fNIRS en relación con el tejido cerebral subyacente utilizando la imagen T1w.
- Determine el número de fiduciales en función de la matriz de optódios y el método de corregistro. Algunos estudios solo requerirán la detección de unos pocos puntos de referencia anatómicos, mientras que otros pueden beneficiarse de colocar fiduciales junto a cada optodo.
- Si la gorra fNIRS está demasiado suelta en la parte posterior de la cabeza, coloque dos correas a cada lado de la gorra con tela elástica (con ojales precortados) y botones para aumentar la capacidad de ajuste de la gorra. A pesar de lo apretada que esté la gorra, asegure las correas para garantizar una configuración consistente de la gorra.
- Si la parte delantera de la gorra está demasiado apretada en la frente, coloque topes de goma en aquellos optodes que estén en contacto directo con la piel. Si el proveedor de fNIRS no proporciona amortiguadores, créelos con pegatinas de tela de fieltro. Si usa topes de goma, utilícelos para todos los participantes, independientemente del ajuste de la tapa, para garantizar una configuración uniforme de la tapa. Asegúrese de que los ingredientes de los tampones de goma no tengan componentes metálicos que protejan contra los artefactos en las imágenes de RM.
- Configuración del equipo fNIRS en las salas de control y escáner de resonancia magnética
- Coloque el dispositivo fNIRS en la sala de control cerca de una de las guías de ondas que conducen a la sala del escáner. Utilice una superficie elevada (por ejemplo, un taburete) si es necesario para asegurarse de que el dispositivo fNIRS esté lo más cerca posible de las guías de onda para maximizar la longitud de la fibra.
- Usando una red de cable de malla, agrupe las fibras ópticas en grupos. Determine estos grupos en función de la matriz de optódicos elegida. Lo ideal es que las fibras ópticas se agrupen de manera que todos los optódos del grupo se coloquen en el mismo lado de la cabeza (izquierda o derecha).
- Conecte las fibras ópticas al dispositivo fNIRS y guíe los paquetes hacia la sala del escáner a través de las guías de ondas. Antes de pedir las fibras ópticas, mida la distancia entre el dispositivo fNIRS y el centro del orificio del escáner para asegurarse de que la longitud de las fibras ópticas sea suficiente.
- Lleve las fibras ópticas a la mesa del escáner. Use un puente seguro para resonancia magnética para sujetar las fibras ópticas para asegurarse de que el peso de las fibras no haga que las fibras se hundan y para evitar que separen la tapa de la cabeza del sujeto (véase la figura 1B).
- Configuración de la caja del replicador de puertos paralelos
- Instale la última versión del software NIRStar en el ordenador de adquisición de datos fNIRS.
- Conecte el replicador de puerto paralelo al cable que transmite el pulso similar a la lógica del transistor (TTL) del transistor desde el escáner como se indica en el manual de disparo del fabricante (versión R2.1; consulte la Figura 1C). El pulso TTL corresponde a un pulso de temporización de corte enviado directamente desde el escáner. Cuando el escáner envía un pulso, uno de los indicadores LED se enciende.
- Conecte la caja del replicador de puerto paralelo al dispositivo fNIRS a través de una entrada de puerto paralelo. Esto enviará un disparador al software NIRStar cada vez que se detecte un pulso TTL del escáner. La señal de disparo se reflejará en la pantalla de grabación de adquisición de datos como una línea punteada. Esta configuración garantiza la sincronización de la recopilación de datos de fNIRS y fMRI, ya que cada vez que se recopila un pulso de temporización de corte en el escáner, esto se reflejará en el flujo de datos fNIRS registrado por el software de adquisición NIRStar.
- Preparación del maniquí estático para la evaluación del optodo
- Coloque los optodos en el dispositivo fantasma estático proporcionado por el proveedor fNIRS. La disposición de los optódos en el maniquí dependerá del tipo de instrumento fNIRS y del número de fuentes y detectores disponibles. Verifique la disposición correcta del optódico en la guía de inicio del proveedor del fabricante.
- Asegúrese de que el maniquí esté completamente protegido de cualquier fuente de luz. Algunos proveedores proporcionan un estuche adecuado que ayuda a proteger los optodes de cualquier fuente de luz externa.
- Conecte todas las fuentes y paquetes de detectores disponibles en el maniquí fNIRS de acuerdo con la disposición de optódico especificada.
- Conecte el maniquí fNIRS al ordenador de adquisición e inicie el software de adquisición NIRStar.
- Realización de una prueba de instrumento de ruido oscuro fantasma
- En el elemento de menú Configurar hardware del software de adquisición NIRStar, abra la pestaña Configuración de canal . Asegúrese de que en Número de fuentes y Número de detectores, el número total de fuentes y detectores disponibles esté configurado correctamente. Confirme esta configuración haciendo clic en Aceptar.
- Inicie la ventana de prueba de ruido oscuro haciendo clic en el elemento de menú Diagnóstico en el menú principal de la ventana NIRStar.
- Ejecute la prueba presionando el botón Ejecutar prueba . Guarde los resultados de la prueba pulsando el botón Guardar resultados .
NOTA: Consulte la "Guía de introducción: solución de problemas de fantasma estático" del fabricante para obtener orientación sobre cómo interpretar los resultados.
- Realización de una prueba de calibración fantasma
- En el elemento de menú Configurar hardware del software de adquisición NIRStar, abra la pestaña Configuración de canal . Asegúrese de que en Número de fuentes y Número de detectores, el número total de fuentes y detectores disponibles esté configurado correctamente.
- En el elemento de menú Configurar hardware , abra la pestaña Enmascaramiento de canales . Enmascare todos los canales pulsando el botón Seleccionar todo .
- En el elemento de menú Configurar hardware , en la pestaña Especificación de hardware , elija Fantasma estático en Tipo de estudio. Confirme esta configuración haciendo clic en Aceptar.
- Inicie la calibración pulsando el botón Calibrar . Una vez completada la calibración, presione el botón Detalles para ver los resultados detallados de la calibración.
NOTA: Consulte la "Guía de introducción: solución de problemas de fantasma estático" del fabricante para obtener orientación sobre cómo interpretar los resultados.
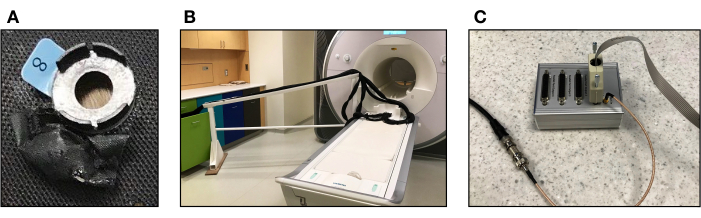
Figura 1. Equipo para la toma simultánea de datos de mediciones de fMRI y fNIRS. (A) Bolsa hecha de material negro repelente al agua para almacenar cápsulas de vitamina E cosidas en la tapa fNIRS adyacente a cada optodo. (B) Puente seguro para resonancia magnética para sostener las fibras ópticas por encima del piso para que puedan llegar a la cabeza del participante durante la recopilación de datos. (C) Replicador de puerto paralelo que transmite pulsos desde el escáner al dispositivo fNIRS. Haga clic aquí para ver una versión más grande de esta figura.
2. Diseño de tareas experimentales
- Decida la duración de la sesión de escaneo teniendo en cuenta la comodidad del participante dentro del escáner. Por ejemplo, el estudio que se destaca aquí incluye dos imágenes estructurales (T1w y T2w) con una duración total de aproximadamente 14 min, y cinco corridas funcionales con una duración adicional de aproximadamente 25 min.
NOTA: Será necesario realizar una prueba piloto del estudio con varios participantes para identificar la duración adecuada del estudio, ya que los factores específicos del estudio (p. ej., la edad del participante, el tamaño de la gorra) determinarán el nivel de comodidad. - Diseñar las tareas de neuroimagen de acuerdo con los objetivos de la investigación. Esto será específico para cada estudio. Aquí, se presenta el procedimiento (y los resultados representativos) de una tarea de tablero de ajedrez intermitente.
3. Colocación de la tapa fNIRS y calibración de la señal el día de la prueba
NOTA: Todos los pasos a continuación se llevan a cabo en las salas de control o consentimiento de MRI, a menos que se indique lo contrario.
- Medidas del cabezal colector y selección de la tapa fNIRS
- Una vez que el participante haya firmado los formularios de consentimiento pertinentes y haya recibido las instrucciones para las próximas tareas, indíquele que se siente en una silla ubicada en la sala de control.
- Usando una cinta métrica suave estándar, envuelva la cinta alrededor de la circunferencia más ancha posible de la cabeza del participante; desde la parte más prominente de la frente (a menudo 1 o 2 dedos por encima de la ceja) hasta la parte más ancha de la parte posterior de la cabeza y viceversa. Trata de encontrar la circunferencia más ancha.
- Elija el tamaño de tapa más cercano a la circunferencia medida.
- Colocación de las sondas detectoras de corta distancia en la tapa
NOTA: Este paso es específico para los sistemas NIRx y es posible que no se aplique a otros dispositivos fNIRS.- Coloque las sondas detectoras de corta distancia agarrando firmemente la base y deslizándola alrededor de la parte del ojal que atraviesa la malla de la tapa fNIRS (consulte la Figura 2A). Tenga cuidado de no tirar de las sondas detectoras de corta distancia del cable, ya que esto puede dañar el cable.
NOTA: Al decidir la distribución de las sondas, consulte el trabajo reciente que compara las distribuciones específicas de cabeza completa con las distribuciones específicas de ROI18. - Utilice los clips organizadores de fibra proporcionados por el fabricante para la gestión de cables si es necesario. Asegúrese de que los cables del detector de corta distancia estén orientados hacia la parte posterior de la tapa para mantener despejada el área alrededor de la cara.
- Coloque las sondas detectoras de corta distancia agarrando firmemente la base y deslizándola alrededor de la parte del ojal que atraviesa la malla de la tapa fNIRS (consulte la Figura 2A). Tenga cuidado de no tirar de las sondas detectoras de corta distancia del cable, ya que esto puede dañar el cable.
- Colocación de la gorra fNIRS y los optodes en la cabeza del participante
- Pida al participante que se ponga la gorra deslizándola hacia abajo desde la parte superior de la cabeza, como si se estuviera poniendo un gorro de invierno. Asegúrese de que la tapa esté recta y que las orejas estén en los orificios de las orejas.
- Pida al participante que apriete la correa de la barbilla tanto como le resulte cómodo. Apriete las correas traseras y asegúrese de que la tapa esté bien sujeta y que los enchufes del optódico estén apretados a la cabeza.
- Coloque pegatinas verdes para marcar las ubicaciones fiduciales clave de acuerdo con las 10-20 posiciones del sistema (inion, nasion, puntos preauriculares anteriores a la oreja y Cz)21.
NOTA: Las pegatinas verdes son necesarias si se utiliza el sensor de estructura 3D para determinar las coordenadas espaciales de la fuente y las ubicaciones del optódico del detector. Esto puede variar según el tipo de sensor de estructura 3D. El protocolo actual utiliza un sensor de estructura (Mark II) de Occipital20. - Con una cinta métrica, alinee simétricamente los puntos de la gorra con los puntos del cuero cabelludo asegurándose de que i) los puntos preauriculares sean equidistantes del punto Cz y ii) el punto de inión y el punto de nasion sean equidistantes del punto Cz. Asegúrese de que la posición de la tapa sea idéntica para todos los participantes.
- Obtención de un modelo de la cabeza del participante mediante un digitalizador de sensores de estructura 3D
- Indique al participante que se quede quieto para crear un modelo 3D de su cabeza.
- Abra la aplicación Estructura en una tableta o iPad.
NOTA: El protocolo describe los pasos necesarios para crear una malla de cabeza con el sensor de estructura (Mark II) de Occipital20. Estos pasos pueden variar de un sistema a otro. - Asegúrese de que los siguientes ajustes estén desactivados: Color de alta resolución, Exposición automática de infrarrojos y Rastreador mejorado.
- Centra al participante de modo que toda su cabeza esté dentro del cuadrado 3D de la pantalla, se renderice toda su cabeza y no haya demasiados hombros en el encuadre.
- Dé un paseo de 360° con cuidado alrededor del participante para crear el escaneo 3D. Espere a que la aplicación capture la imagen aproximadamente cada 90° antes de continuar (consulte la Figura 3A).
- Una vez que se haya capturado todo el escaneo, presione el botón a la derecha de la pantalla para crear la representación 3D.
- Verifique la representación para asegurarse de que sea clara y que haya suficientes detalles para determinar la ubicación de los optodos y las pegatinas fiduciales verdes. Almacene el escaneo 3D en un servidor protegido por HIPAA.
- Preparación del participante para entrar en la sala de escáneres
- Una vez que se haya generado el modelo 3D, retire las pegatinas verdes e indique al participante que se coloque tapones para los oídos en los oídos.
- Siga las instrucciones vigentes en el centro de imágenes por resonancia magnética para asegurarse de que el participante sea seguro para ingresar a la sala del escáner. Este paso suele consistir en confirmar con el participante que no hay metales en su cuerpo y pasar por un detector de metales como comprobación final. La mayoría de los centros de diagnóstico por imágenes suelen requerir un cuestionario de seguridad de resonancia magnética completado por el sujeto antes de su llegada.
- Colocación de las sondas de la fuente y del detector en la tapa fNIRS
- En la sala del escáner, indique al participante que se siente cómodamente en la mesa del escáner.
- Mientras estabiliza cada ojal optódico con una mano, use un aplicador apto para resonancia magnética con la otra mano para empujar el cabello del centro del ojal (véase la Figura 2B). Cuando el cabello se haya movido lo suficiente fuera del área (idealmente para que el cuero cabelludo sea visible), presione firmemente el optodo en el ojal.
- Asegúrese de que, una vez liberada la tensión en el ojal, el cabello no vuelva a ocluir el centro del optodo. Si se utiliza una matriz de cabeza completa, se recomienda orientar los optódos en la parte posterior de la cabeza con sus fibras dirigidas hacia el frente y los optódos en la parte delantera de la cabeza con sus fibras apuntando hacia atrás. Esta configuración de las fibras ópticas evitará que se enreden o engarcen cuando el participante se acueste y coloque la cabeza en la bobina de la cabeza de la resonancia magnética.
NOTA: Este proceso de inserción y alineación de fibras se realiza de manera más rápida y sencilla con dos experimentadores ubicados a cada lado del participante, tapando simultáneamente. - Organice las fibras ópticas ordenadamente en haces utilizando organizadores de cables (consulte la Figura 2B y la Figura 3B). Realice una calibración de prueba y una medición de la intensidad de la señal utilizando el software NIRStar. La colocación y calibración de los optódicos realizada por dos investigadores experimentados tardará aproximadamente 10 minutos.
- Ajuste los optodos individuales según sea necesario hasta que se logre una calidad de señal suficiente desplazando el cabello que interfiere de los optodos problemáticos. Retire los optodes de la gorra para desplazar el cabello con pinzas de plástico (véase la figura 2B).

Figura 2. Detectores de corta distancia y herramientas para la preparación de tapones fNIRS. (A) Sondas detectoras de corta distancia y amortiguadores de goma que se fijarán a la tapa fNIRS sobre las áreas frontales donde haya un mínimo de pelo. (B) De izquierda a derecha: organizadores de cables para organizar las fibras ópticas en paquetes, aplicadores seguros para resonancia magnética para empujar el cabello durante la colocación del optódico y pinzas de plástico para quitar los optodos de la tapa si es necesario durante la configuración de la tapa NIRS para desplazar el cabello. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Digitalizador del sensor de estructura 3D y colocación de la tapa fNIRS. (A) Experimentador que utiliza el digitalizador del sensor de estructura 3D para crear un modelo 3D de la cabeza del participante. Las pegatinas verdes se utilizan para identificar las ubicaciones de los fiducios. (B) Fibras ópticas insertadas en la tapa fNIRS en la cabeza de un participante y dispuestas en haces usando organizadores de cables antes de la calibración de la señal. Haga clic aquí para ver una versión más grande de esta figura.
4. Configuración del participante
NOTA: Los siguientes pasos se llevan a cabo en la sala de escáneres de resonancia magnética. El uso de un cinturón respiratorio y un oxímetro de pulso es opcional y solo es necesario si los investigadores están interesados en hacer una regresión de estas señales de los datos de fNIRS22. El protocolo utiliza un cinturón respiratorio, que forma parte de la unidad respiratoria para la adquisición de la amplitud respiratoria mediante un cinturón de sujeción. Del mismo modo, la unidad de pulso fisiológico consiste en un sensor óptico de pletismografía que permite la adquisición del ritmo cardíaco.
- Asegúrese de que la bobina del cabezal de 20 canales esté colocada en el escáner. Si se utiliza un arreglo fNIRS de cabeza completa, las bobinas de cabeza de 32 y 64 canales estarán demasiado apretadas para los participantes adultos.
- Coloque una almohada de espuma dentro de la parte inferior de la bobina de la cabeza de la RMN para apoyar la parte posterior de la cabeza del participante (véase la figura 4A).
- Pida al participante que se acueste lenta y cuidadosamente para que su movimiento no mueva la tapa ni tire de las fibras ópticas. Ajuste los haces de fibra óptica según sea necesario para permitir que la cabeza del participante descanse cómodamente dentro de la bobina de la cabeza (consulte la Figura 4B). Es posible que sea necesario elevar la mesa del escáner durante este paso, dependiendo de dónde se encuentren los cables de la guía de ondas.
- Coloque una almohada debajo de las piernas del participante para asegurarse de que se sienta cómodo. Coloque el cinturón respiratorio alrededor de la cintura del participante.
- Pida al participante que se coloque los auriculares con cancelación de ruido alrededor de los oídos, teniendo cuidado de no interferir con la colocación de la sonda fNIRS. Para evitar que los auriculares se deslicen, use almohadillas seguras para resonancia magnética a ambos lados de la cabeza entre los auriculares y el lado interior de la bobina de la cabeza. Se puede utilizar una funda de almohada para evitar que los auriculares entren en contacto con la bobina del cabezal.
- Coloque el oxímetro de pulso en el dedo índice del sujeto de su mano no dominante. Si usa una caja de botones para las tareas experimentales, pídale al participante que la sostenga con su mano dominante. Proporcione al participante instrucciones sobre cómo usar la caja de botones.
- Coloque la bola de compresión o la alarma de botón en la mano no dominante del sujeto e instruya al participante sobre cómo usarla. Pruebe la alarma pidiéndole al participante que la presione.
- Deslice al participante unos centímetros en el orificio del escáner para alinear la cabeza. Coloque la parte superior de la bobina principal. A continuación, inserte el micrófono y el espejo en los insertos de bobina correspondientes.
- Deslice el participante lentamente en el orificio del escáner mientras sostiene las fibras ópticas. Este proceso requerirá dos personas, que estarán ubicadas a cada lado de la mesa del escáner. Asegúrese de que las fibras ópticas se guíen cuidadosamente hacia el orificio del escáner para evitar tirar de los optodos o pellizcar las fibras entre la bobina del cabezal y el orificio del escáner.
- Después de confirmar con el participante que está listo para la sesión de escaneo, regrese a la sala de control y confirme a través del audio del intercomunicador que el participante puede escuchar al experimentador y el experimentador puede escuchar al participante.
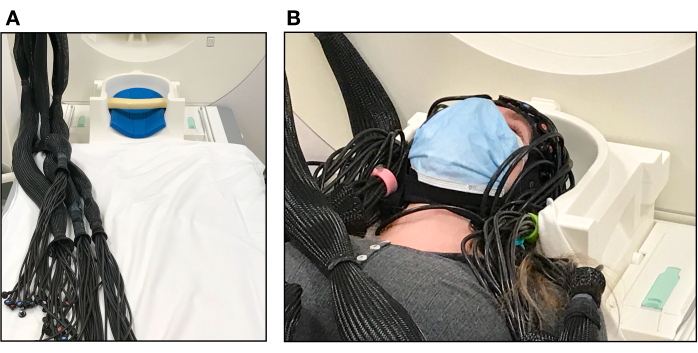
Figura 4. Configuración del participante en el escáner de resonancia magnética. (A) Almohadas dentro de la bobina de la cabeza de RM utilizadas para sostener la cabeza del participante y fibras ópticas dispuestas en haces antes de la configuración del participante. (B) Participante acostado en la cama del escáner con la tapa fNIRS lista para la prueba. La parte superior de la bobina de cabeza aún no se ha colocado sobre la cara del participante. Haga clic aquí para ver una versión más grande de esta figura.
5. Configuración del escáner y del equipo fNIRS antes de la grabación de la señal
- En el ordenador del escáner, seleccione las secuencias estructurales y funcionales relevantes para el estudio. Al calcular un modelo de luz de sensibilidad de los datos fNIRS, recopile imágenes T1w y T2w para obtener la mejor resolución de contraste tisular.
- Compruebe el localizador para confirmar que la cabeza está bien posicionada dentro del orificio del escáner. Verifique que se obtenga una cobertura cerebral completa desde la parte superior de la cabeza hasta el cerebelo.
- Confirme con el participante que la pantalla de la computadora es visible a través del espejo de la bobina principal.
- Ejecute el primer escaneo estructural. Paralelamente, ejecute otra prueba de calibración de los optodos fNIRS para comprobar si la configuración de los participantes afectó a la intensidad de la señal de alguno de los canales.
- Después de ejecutar la primera resonancia magnética estructural, recopile las secuencias del mapa de campo de eco de gradiente y calibre los auriculares con cancelación de ruido para asegurarse de que los auriculares puedan transmitir estímulos auditivos al participante, así como bloquear cualquier ruido ambiental.
NOTA: Es posible que algunos participantes necesiten que se ajusten sus auriculares. Si este es el caso, vuelva a entrar en la sala del escáner y ajuste el acolchado alrededor de los auriculares, teniendo cuidado de no interferir con la colocación de la sonda fNIRS. Ejecute otro localizador, secuencias de mapas de campo de eco de gradiente y prueba de calibración de los optodos fNIRS antes de continuar.
6. Grabación simultánea de la señal
- Consulte con el participante a través del intercomunicador para asegurarse de que se sienta cómodo y que lo esté haciendo bien. Proporcione las instrucciones para la tarea y recuerde a los participantes que mantengan la cabeza y el cuerpo quietos.
- Proporcione las siguientes instrucciones, específicas para la tarea de tablero de ajedrez intermitente (Figura 5).
- En esta tarea, indique al participante que mire siempre al centro de la pantalla que está frente a él (a través del espejo). A veces, la pantalla mostrará un tablero de ajedrez con fichas parpadeando a diferentes frecuencias. Otras veces, el participante verá un círculo blanco en el centro de la pantalla.
- Cuando aparezca el círculo blanco en la pantalla, pida al participante que presione la caja de botones con el dedo índice. Después de presionar el botón, el círculo se volverá rojo.
- Esta tarea utiliza un diseño de bloques alternos. Deje que los participantes completen una sola carrera de 6 minutos, que incluye 11 bloques de tablero de ajedrez intermitentes de 10 s cada uno y 11 bloques circulares de 20 s cada uno.
- Comience el registro de datos fNIRS en la computadora fNIRS y comience las tareas en la computadora de presentación de estímulos. El script para las tareas experimentales se mostrará como instrucciones de tarea.
- Inicie la primera ejecución funcional. Una vez que el escáner envía el primer pulso TTL, este se mostrará como una señal de disparo en la pantalla de grabación de datos del software NIRStar. Este primer pulso también iniciará la tarea experimental.
- Supervise el rendimiento y el movimiento de los participantes en todas las tareas. En algunos casos, especialmente cuando se utiliza una matriz de optódios de cabeza completa y tapones de tamaño pequeño, algunos participantes pueden experimentar cierta incomodidad al usar el gorro. Es importante vigilar siempre la comodidad del participante.
- Si es necesario, proporcione un descanso para el participante en medio de la sesión. Durante este descanso, si los participantes necesitan sentarse, tome un localizador y ejecute las secuencias de mapas de campo de eco de gradiente, la calibración de auriculares y la calibración de prueba fNIRS nuevamente antes de continuar. Por lo general, este paso no es necesario cuando se realiza la prueba de adultos jóvenes en el escáner si se siguen los pasos exactos del protocolo actual.
- Durante la recopilación de datos, tome notas sobre la sesión (p. ej., tamaño de la tapa, hora del día, optodos que no estaban bien calibrados o cualquier cosa inusual).
- Al final de todas las ejecuciones funcionales, deje de recopilar datos fNIRS. Ejecute un segundo análisis estructural si es necesario.
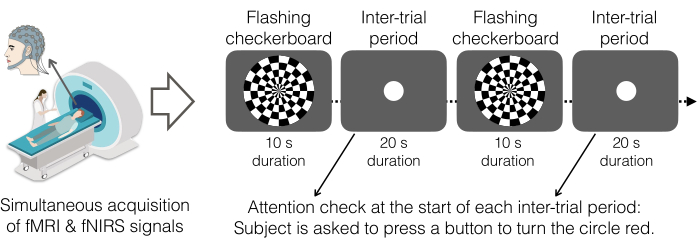
Figura 5. Paradigma del tablero de ajedrez intermitente como tarea experimental. Los participantes vieron un patrón de tablero de ajedrez en blanco y negro con cuadrados blancos que parpadeaban ocho veces por segundo que se alternaban con una pantalla gris que mostraba un círculo blanco. Como prueba de atención, se les indicó a los participantes que presionaran un botón con la mano derecha al ver aparecer un círculo blanco en el medio de la pantalla. Al presionar el botón, el círculo se vuelve rojo. La tarea se completó en una sola ejecución compuesta por 22 bloques en total: 11 bloques de tablero de ajedrez intermitentes y 11 períodos entre ensayos. Los períodos de tablero de ajedrez intermitente duraron 10 s y los períodos entre juicios duraron 20 s. Por lo tanto, el inicio del tablero de ajedrez intermitente se produjo cada 30 s (0,033 Hz). Las pantallas fueron generadas por PsychoPy v2021.2.4 y proyectadas en el espejo retrovisor en la parte superior de la bobina de la cabeza a través de un sistema de proyección DLP de 1080p. Los participantes completaron una ejecución de esta tarea (~6 min). Haga clic aquí para ver una versión más grande de esta figura.
7. Limpieza posterior al experimento y almacenamiento de datos
- Utilice la base motorizada del escáner para retirar lentamente al participante del orificio del escáner, teniendo cuidado de no pellizcar ninguna de las fibras ópticas. Retire la parte superior de la bobina de la cabeza y haga que el participante se siente lentamente.
- Retire la tapa fNIRS de la cabeza del participante y retire cada optodo de los ojales respectivos. El cabello a menudo se atasca en los ojales incluso después de que se hayan quitado los optos, así que indique a los participantes que se quiten la gorra lenta y cuidadosamente.
- Algunos ojales pueden desprenderse en el proceso de destapado. Asegúrese de localizar todas las piezas de la arandela y reemplazar las que falten antes de la sesión de escaneo del siguiente participante.
- Pida a los participantes que se deslicen de la cama del escáner, agradézcales por su tiempo y proporcione una compensación monetaria, si corresponde.
- Asegúrese de que los registros de tareas, los datos de fNIRS y fMRI se almacenen y se realice una copia de seguridad. Desinfecte la tapa con una solución de limpieza en aerosol, según lo recomendado por el proveedor de fNIRS, y limpie las puntas optodas con toallitas con alcohol aptas para plástico y caucho.
8. Preprocesamiento de datos de resonancia magnética funcional
NOTA: Los datos de fMRI se preprocesaron siguiendo los procesos mínimos de preprocesamiento del Proyecto ConectomaHumano 23 utilizando QuNex24, un paquete de software de código abierto que admite la organización de datos, el preprocesamiento, el control de calidad y los análisis en todas las modalidades de neuroimagen. La documentación detallada sobre la configuración y los parámetros específicos para cada uno de los pasos que se destacan a continuación se puede encontrar en el sitio web de QuNex en https://qunex.yale.edu/. A continuación se presentan los principales pasos y parámetros utilizados para procesar los datos.
- Preprocesar los datos estructurales
- Canalización PreFreeSurfer. Realice los siguientes pasos: Corrección de la distorsión del gradiente, alineación de series repetidas de imágenes T1w y T2w con una transformación de cuerpo rígido de 6 grados de libertad (DOF), alineación AC-PC de las imágenes T1w y T2w a la plantilla del espacio MNI, extracción cerebral inicial, corrección de la distorsión de lectura, registro intermodal de T1w y T2w en el espacio de volumen nativo, corrección del campo de sesgo y registro de volumen no lineal MNI.
- Canalización de Freesurfer. Realice los siguientes pasos: Reduzca la muestra T1w a 1 mm con interpolación spline y ejecute recon-all para generar superficies de materia blanca, lo que incluye el ajuste fino del registro de T2w a T1w utilizando el algoritmo BBRegister de Freesurfer (consulte23 para obtener más detalles).
- Canalización PostFreeSurfer. Realice los siguientes pasos: Convierta las salidas de reconocimiento a GIFTI y NIFTI en el espacio de volumen nativo, genere la máscara cerebral final y el volumen de cinta cortical, genere mapas de mielina y realice la transformación de volumen no lineal de nativo a MNI.
- Preprocesar los datos funcionales
- Canalización de volumen de fMRI. Realice los siguientes pasos: corrección de distorsión, corrección de movimiento basada en FLIRT, preprocesamiento de mapas de campo basado en TOPUP utilizando un mapa de campo de eco de espín, corrección de distorsión de imagen EPI y registro de EPI a T1w, remuestreo de spline en un solo paso al espacio atlas (MNI), normalización de intensidad mediante eliminación de campos de sesgo y enmascaramiento cerebral.
- fMRI Tubería de superficie. Realice los siguientes pasos para asignar la serie temporal de volumen a una representación combinada de superficie y volumen, ordenadas grises almacenada en formato CIFTI: construcción de cinta de resonancia magnética funcional, suavizado de superficies, procesamiento subcortical y generación de series temporales densas.
- Prepare los datos en negrita. Calcule estadísticas cuantitativas de control de calidad que reflejen el movimiento y sus propiedades artificiales para identificar fotogramas defectuosos. Consulte la documentación de QuNex para conocer las opciones disponibles para generar estadísticas cuantitativas de control de calidad. Estas estadísticas a menudo incluyen estadísticas de señal temporal a ruido y depuración de movimiento en negrita, como el umbral de desplazamiento de fotogramas y el umbral de error cuadrático medio (RMSE) normalizado de intensidad de imagen. Dependiendo de los criterios específicos del estudio, ignorar o interpolar los marcos problemáticos identificados.
- Extraer la señal de molestia. Extraiga las señales molestas de los ventrículos cerebrales, la sustancia blanca y la materia gris para realizar la regresión de las señales molestas en los pasos posteriores.
9. Preprocesamiento de datos fNIRS
NOTA: Los datos de fNIRS se analizaron siguiendo las mejores prácticas en el análisis de datos de fNIRS25 utilizando NeuroDOT26, un entorno de código abierto para el análisis de datos ópticos de los niveles de luz sin procesar en mapas de función cerebral a nivel de vóxel, que se registran conjuntamente con la anatomía de un participante específico o un atlas. Todos los pasos que se describen a continuación se pueden realizar con NeuroDOT. Puede encontrar documentación adicional sobre la configuración y los parámetros específicos para cada uno de los pasos que se destacan a continuación en los tutoriales y scripts de https://github.com/WUSTL-ORL/NeuroDOT_Beta. Por último, el registro de optodos a cuero cabelludo requiere la obtención de las coordenadas de optodo fNIRS en relación con el tejido cerebral subyacente, lo que puede hacerse utilizando un digitalizador 3D o cápsulas de vitamina E como fiduciales, si están disponibles. Ambos métodos se describen en esta sección y se proporcionan referencias a los paquetes de software relevantes.
- Generación de una malla de cabeza específica para cada sujeto y creación del modelo de luz
- Segmente la imagen T1w en los tipos de tejido relevantes para crear un modelo de cabeza segmentado: cuero cabelludo, cráneo, líquido cefalorraquídeo (LCR), materia gris y materia blanca. Utilice imágenes T1w y T2w, si están disponibles, ya que cada una de ellas aporta información complementaria sobre los tipos de tejido relevantes.
NOTA: Este paso se realiza en el protocolo actual con la función "Segment5R_fs" de NeuroDOT, que toma como entrada información de la segmentación volumétrica28 de Freesurfer. Otros paquetes de software comúnmente disponibles para la segmentación del tejido cerebral son SPM29 y AFNI30. - Genere una malla de cabeza a partir del modelo de cabeza segmentada utilizando el paquete de software Mimics a través de NeuroDOT. Si se utiliza un digitalizador 3D para colocar las ubicaciones de los optódios en el modelo de cabeza, siga las recomendaciones de Excursión para la localización de optódios31. Alternativamente, si las cápsulas de vitamina E se utilizan como fiduciales para la identificación de las coordenadas de los pares fuente-detector, identifique manualmente las posiciones de las fuentes y los detectores en la imagen T1w (consulte32 para ver un ejemplo).
- Coloque las ubicaciones de la fuente y del detector obtenidas a través del digitalizador 3D o de las cápsulas de vitamina E en los loci correspondientes de la malla utilizando NeuroDOT.
- Establezca los siguientes parámetros para calcular la matriz de sensibilidad para el modelo de cabeza específico del sujeto utilizando el paquete de software NIRFAST a través de NeuroDOT: resolución de vóxelación: 2; etiquetas de la región: LCR, blanco, gris, hueso, piel; coeficientes de absorción para regiones: LCR [0,004, 0,004], blanco [0,0167, 0,0208]; gris [0,018 0,0192], hueso [0,0116, 0,0139], piel [0,74, 0,64]; coeficientes de dispersión para regiones: CSF [0,3, 0,3], blanco [1,1908, 1,0107]; gris [0,8359, 0,6726], hueso [0,94, 0,84], piel [0,64, 0,74], índice de refracción para regiones: LCR [1,4, 1,4], blanco [1,4, 1,4]; gris [1.4, 1.4], hueso [1.4, 1.4], piel [1.4, 1.4].
NOTA: El protocolo utiliza el paquete de software NIRFAST (versión 9.1)33,34, que utiliza un modelo de luz directa de elementos finitos basado en la aproximación de difusión a la ecuación de transporte radiativo. Para calcular el modelo de luz, NIRFAST se basa en tres tipos de información: i) la forma del límite del tejido, ii) la distribución interna de las propiedades ópticas de referencia y iii) la ubicación de las fuentes y los detectores en la superficie (ver 35,36 para más detalles). Los métodos de Monte Carlo pueden emplearse como alternativa para calcular soluciones a la ecuación de difusión para diferentes tipos de tejidos 37,38. - Visualice un ejemplo de la sensibilidad de la medición como una evaluación cualitativa.
- Segmente la imagen T1w en los tipos de tejido relevantes para crear un modelo de cabeza segmentado: cuero cabelludo, cráneo, líquido cefalorraquídeo (LCR), materia gris y materia blanca. Utilice imágenes T1w y T2w, si están disponibles, ya que cada una de ellas aporta información complementaria sobre los tipos de tejido relevantes.
- Procesamiento de los datos brutos de las mediciones del detector de origen
- Muestre el nivel de luz promedio para cada fuente y detector en una representación 2D de la matriz de imágenes. Elimine los pares fuente-detector con una desviación estándar temporal superior al 7,5 %36. Si los datos se adquieren a una velocidad de fotogramas de al menos 3 Hz, utilice el umbral de potencia cardíaca para rechazar las mediciones del par fuente-detector, ya que un buen acoplamiento optodo-cuero cabelludo exhibirá características consistentes con la frecuencia de pulso (~1 Hz).
- Elimine la tendencia de los datos para eliminar la tendencia lineal en cada medición. Filtro de paso alto (corte de 0,02 Hz) los datos para eliminar la deriva de baja frecuencia. En lugar de filtrar, una alternativa es agregar un factor de deriva en el GLM como regresor.
- Filtro de paso bajo (1 Hz) los datos para eliminar las oscilaciones cardíacas.
- Estime la señal superficial global calculando el promedio de todas las mediciones del par fuente-detector de 8 mm. Utilice las mediciones de corta distancia como una estimación de las señales fisiológicas sistémicas no corticales, ya que muestrean principalmente el cuero cabelludo y el cráneo.
- Regresión de la señal global de todas las mediciones39.
- Filtre los datos de paso bajo (corte de 0,5 Hz) para enfocar aún más los datos restantes en torno a la frecuencia del estímulo y reduzca la muestra de los datos a 1 Hz 40,41,42 para reducir la carga computacional.
- Implementar la censura de movimiento utilizando la varianza global de las derivadas temporales (GVTD) en el curso temporal43. GVTD se calcula como la raíz cuadrada media de las derivadas temporales a través de un conjunto de medidas o vóxeles43. Implemente la censura de movimiento o la depuración excluyendo los puntos de tiempo que superen el umbral de ruido GVTD.
- Reconstruir el modelo de luz y los datos preprocesados en un volumen de neuroimagen funcional
- Reconstruya los cambios relativos en la absorción a 785 nm y 830 nm basándose en una inversión regularizada de la matriz de sensibilidad utilizando la regularización de Tikhonov y la regularización espacialmente variante44.
- Calcular los cambios relativos en la concentración de hemoglobina a través de una descomposición espectral de los datos de absorción dependientes de la longitud de onda44,45.
10. Análisis de datos evocados por tareas de fMRI/fNIRS
- Ejecute un análisis GLM de primer nivel de una sola sesión (modelado de HRF, regresión de señales fisiológicas, incluidas las mediciones de fNIRS de corta distancia) para evaluar cómo se relaciona la actividad cerebral con la hipótesis estadística para un sujeto determinado.
NOTA: Una alternativa al GLM es el promedio de bloques, que evita las suposiciones a priori sobre la forma de la HRF. Sin embargo, el promedio de bloques no permite modelar factores de confusión relevantes en la señal fNIRS junto con la respuesta hemodinámica al estímulo. - Ejecute un análisis de GLM grupal o de segundo nivel para combinar las estimaciones de primer nivel de activación en todos los sujetos.
- Extraiga las estimaciones de efectos relevantes de los archivos GLM individuales y combínelos en archivos de grupo.
- Calcule las estadísticas deseadas. Un paquete bien establecido para ejecutar métodos de remuestreo de permutación de modelos GLM uni y multivariados para inferencia estadística es FSL PALM46.
- Obtener estimaciones de la beta de GLM de todo el cerebro.
Resultados
En esta sección se presentan respuestas representativas específicas de cada sujeto para la tarea de tablero de ajedrez intermitente para señales de resonancia magnética funcional y fNIRS. En primer lugar, en las Figuras 6 y 7 se muestran datos brutos representativos de fNIRS y evaluaciones de calidad para ilustrar la viabilidad de la configuración experimental para medir las señales de fNIRS en el entorno de la RMN. En la
Discusión
Este protocolo para la recopilación simultánea de datos de señales de fMRI y fNIRS utiliza una matriz de optódicos fNIRS de cabeza completa y canales de corta distancia para medir y hacer una regresión de las señales fisiológicas sistémicas no corticales. Los pasos críticos en este protocolo incluyen la modificación y el desarrollo del equipo fNIRS para recolectar señales fNIRS en el entorno de RMN. Hasta donde sabemos, no existe un sistema comercial llave en mano que esté totalmente optimizado para capturar ...
Divulgaciones
Las tarifas de publicación de este artículo están patrocinadas por NIRx. Los autores no tienen nada más que revelar.
Agradecimientos
Esta investigación fue apoyada por las siguientes fuentes de financiamiento: una beca NARSAD Young Investigator Award de la Fundación de Investigación del Cerebro y el Comportamiento (Subvención # 29736) (SSA), una subvención Global Grand Challenges de la Fundación Bill y Melinda Gates (subvención #INV-005792) (RNA) y una subvención del Fondo Discovery del Departamento de Psicología de la Universidad de Yale (RNA). Los autores también desean agradecer a Richard Watts (Yale Brain Imaging Center) por su apoyo durante la recopilación de datos y a Adam Eggebrecht, Ari Segel y Emma Speh (Universidad de Washington en St. Louis) por su ayuda en el análisis de datos.
Materiales
| Name | Company | Catalog Number | Comments |
| 280 low-profile MRI-compatible grommets for NIRs caps | NIRx | GRM-LOP | |
| 4 128-position NIRS caps with 128x unpopulated slits in 10-5 layout | NIRx | CP-128-128S | Sizes: 52, 54, 56, 60 |
| 8 bundles of 4x detector fibers with low-profile tip; MRI-, MEG-, and TMS-compatible. | NIRx | DET-FBO- LOW | 10 m long |
| 8 bundles of 4x laser source fibers with MRI-compatible low-profile tip | NIRx | SRC-FBO- LAS-LOW | 10 m long |
| Bundle set of 8 short-channel detectors with specialized ring grommets that fit to low-profile grommets | NIRx | DET-SHRT-SET | Splits a single detector into 8 short channels that may be placed anywhere on a single NIRS cap |
| Magnetom 3T PRISMA | Siemens | N/A | 128 channel capacity, 64/32/20 channel head coils, 80 mT/m max gradient amplitude, 200 T/m/s slew rate, full neuro sequences |
| NIRScout XP Core System Unit | NIRx | NSXP- CHS | Up to 64x Laser-2 (or 32x laser-4) illuminators or 64 LED-2 illuminators; up to 32x detectors; capable of tandem (multi-system) and hyperscanning (multi-subject) measurements; compatible with EEG, tDCS, eye-tracking, and other modalities; modules available for fMRI, TMS, MEG compatibility |
| NIRStar software | NIRx | N/A | Version 15.3 |
| NIRx parallel port replicator | NIRx | ACC-LPT-REP | The parallel prot replicator comes with three components: parallel port replicator box, USB power cable and BNC adapter |
| Physiological pulse unit | Siemens | PPU098 | Optical plethysmography allowing the acquisiton of the cardiac rhythm. |
| Respiratory unit | Siemens | PERU098 | Unit intended for the acquisition of the respiratory amplitude (by means of a pneumatic system and a restraint belt). |
| Structure Sensor Mark II | Occipital | 101866 (SN) | 3D structure sensor for optode digitization. |
Referencias
- Pinti, P., et al. The present and future use of functional near-infrared spectroscopy (fNIRS) for cognitive neuroscience. Annals of the New York Academy of Sciences. 1464 (1), 5-29 (2020).
- Quaresima, V., Ferrari, M. Functional Near-Infrared Spectroscopy (fNIRS) for Assessing Cerebral Cortex Function During Human Behavior in Natural/Social Situations: A Concise Review. Organizational Research Methods. 22 (1), 46-68 (2016).
- Pinti, P., et al. A Review on the Use of Wearable Functional Near-Infrared Spectroscopy in Naturalistic Environments. The Japanese Psychological Research. 60 (4), 347-373 (2018).
- Wilcox, T., Biondi, M. fNIRS in the developmental sciences. Wiley Interdisciplinary Reviews: Cognitive Science. 6 (3), 263-283 (2015).
- Blasi, A., Lloyd-Fox, S., Katus, L., Elwell, C. E. fNIRS for Tracking Brain Development in the Context of Global Health Projects. Photonics. 6 (3), 89 (2019).
- Aslin, R. N. Questioning the questions that have been asked about the infant brain using near-infrared spectroscopy. Cognitive Neuropsychology. (1-2), 7-33 (2012).
- Chen, W. L., et al. Functional Near-Infrared Spectroscopy and Its Clinical Application in the Field of Neuroscience: Advances and Future Directions. Frontiers in Neuroscience. 14, 724 (2020).
- Lee, Y. J., Kim, M., Kim, J. S., Lee, Y. S., Shin, J. E. Clinical Applications of Functional Near-Infrared Spectroscopy in Children and Adolescents with Psychiatric Disorders. Journal of Child & Adolescent Psychiatry. 32 (3), 99-103 (2021).
- Bonilauri, A., Sangiuliano Intra, F., Baselli, G., Baglio, F. Assessment of fNIRS Signal Processing Pipelines: Towards Clinical Applications. Applied Sciences. 12 (1), 316 (2021).
- Kleinschmidt, A., et al. Simultaneous recording of cerebral blood oxygenation changes during human brain activation by magnetic resonance imaging and near-infrared spectroscopy. Journal of Cerebral Blood Flow and Metabolism. 16 (5), 817-826 (1996).
- Strangman, G., Culver, J. P., Thompson, J. H., Boas, D. A. A Quantitative Comparison of Simultaneous BOLD fMRI and NIRS Recordings during Functional Brain Activation. NeuroImage. 17 (2), 719-731 (2002).
- Glover, G. H. Overview of functional magnetic resonance imaging. Neurosurgery Clinics of North America. 22 (2), (2011).
- Toronov, V., et al. Investigation of human brain hemodynamics by simultaneous near-infrared spectroscopy and functional magnetic resonance imaging. Medical Physics. 28 (4), 521-527 (2001).
- Huppert, T. J., Hoge, R. D., Diamond, S. G., Franceschini, M. A., Boas, D. A. A temporal comparison of BOLD, ASL, and NIRS hemodynamic responses to motor stimuli in adult humans. NeuroImage. 29 (2), 368-382 (2006).
- Cui, X., Bray, S., Bryant, D. M., Glover, G. H., Reiss, A. L. A quantitative comparison of NIRS and fMRI across multiple cognitive tasks. NeuroImage. 54 (4), 2808-2821 (2011).
- Duan, L., Zhang, Y. J., Zhu, C. Z. Quantitative comparison of resting-state functional connectivity derived from fNIRS and fMRI: a simultaneous recording study. NeuroImage. 60 (4), 2008-2018 (2012).
- Sasai, S., et al. A NIRS-fMRI study of resting state network. NeuroImage. 63 (1), 179-193 (2012).
- Noah, J. A., et al. Comparison of short-channel separation and spatial domain filtering for removal of non-neural components in functional near-infrared spectroscopy signals. Neurophotonics. 8 (1), 015004 (2021).
- Wyser, D., et al. Short-channel regression in functional near-infrared spectroscopy is more effective when considering heterogeneous scalp hemodynamics. Neurophotonics. 7 (3), 035011 (2020).
- Homolle, S., Oostenveld, R. Using a structured-light 3D scanner to improve EEG source modeling with more accurate electrode positions. Journal of Neuroscience Methods. 326, 108378 (2019).
- Jasper, H. H. The ten-twenty electrode system of the International Federation. Electroencephalography and Clinical Neurophysiology. 10, 370-375 (1958).
- von Luhmann, A., Li, X., Muller, K. R., Boas, D. A., Yucel, M. A. Improved physiological noise regression in fNIRS: A multimodal extension of the General Linear Model using temporally embedded Canonical Correlation Analysis. NeuroImage. 208, 116472 (2020).
- Glasser, M. F., et al. The minimal preprocessing pipelines for the Human Connectome Project. NeuroImage. 80, 105-124 (2013).
- Ji, J. L., et al. QuNex-An integrative platform for reproducible neuroimaging analytics. Frontiers in Neuroinformation. 17, 1104508 (2023).
- Yucel, M. A., et al. Best practices for fNIRS publications. Neurophotonics. 8 (1), 012101 (2021).
- Eggebrecht, A., Muccigrosso, D., Culver, J. NeuroDOT: an extensible Matlab toolbox for streamlined optical brain mapping. Diffuse Optical Spectroscopy and Imaging VII. , (2019).
- Jenkinson, M., Beckmann, C. F., Behrens, T. W., Woolrich, M. W., Smith, S. M. FSL. NeuroImage. 62 (2), 782-790 (2012).
- Fischl, B. FreeSurfer. NeuroImage. 62 (2), 774-781 (2012).
- Penny, W. D., Friston, K. J., Ashburner, J. T., Kiebel, S. J., Nichols, T. E. . Statistical parametric mapping: the analysis of functional brain images. , (2011).
- Cox, R. W. AFNI: software for analysis and visualization of functional magnetic resonance neuroimages. Computers and Biomedical Research. 29 (3), 162-173 (1996).
- Oostenveld, R., Fries, P., Maris, E., Schoffelen, J. M. FieldTrip: Open source software for advanced analysis of MEG, EEG, and invasive electrophysiological data. Computational Intelligence and Neuroscience. 2011, 156869 (2011).
- Sato, H., et al. A NIRS-fMRI investigation of prefrontal cortex activity during a working memory task. NeuroImage. 83, 158-173 (2013).
- Jermyn, M., et al. Fast segmentation and high-quality three-dimensional volume mesh creation from medical images for diffuse optical tomography. Journal of Biomedical Optics. 18 (8), 86007 (2013).
- Dehghani, H., et al. Near infrared optical tomography using NIRFAST: Algorithm for numerical model and image reconstruction. Communications in Numerical Methods in Engineering. 25 (6), 711-732 (2008).
- Wheelock, M. D., Culver, J. P., Eggebrecht, A. T. High-density diffuse optical tomography for imaging human brain function. The Review of Scientific Instruments. 90 (5), 051101 (2019).
- Eggebrecht, A. T., et al. A quantitative spatial comparison of high-density diffuse optical tomography and fMRI cortical mapping. NeuroImage. 61 (4), 1120-1128 (2012).
- Boas, D. A., Culver, J. P., Stott, J. J., Dunn, A. K. Three dimensional Monte Carlo code for photon migration through complex heterogeneous media including the adult human head. Optics Express. 10 (3), 159-170 (2002).
- Wang, L., Jacques, S. L., Zheng, L. MCML-Monte Carlo modeling of light transport in multi-layered tissues. Computer Methods and Programs in Biomedicine. 47 (2), 131-146 (1995).
- Gregg, N. M., White, B. R., Zeff, B. W., Berger, A. J., Culver, J. P. Brain specificity of diffuse optical imaging: improvements from superficial signal regression and tomography. Frontiers in Neuroenergetics. 2, 14 (2010).
- Brigadoi, S., et al. Motion artifacts in functional near-infrared spectroscopy: a comparison of motion correction techniques applied to real cognitive data. NeuroImage. 85, 181-191 (2014).
- Pelphrey, K. A., Shultz, S., Hudac, C. M., Vander Wyk, B. C. Research review: Constraining heterogeneity: the social brain and its development in autism spectrum disorder. Journal of Child Psychology and Psychiatry, and Allied Disciplines. 52 (6), 631-644 (2011).
- Cui, X., Bray, S., Reiss, A. L. Functional near infrared spectroscopy (NIRS) signal improvement based on negative correlation between oxygenated and deoxygenated hemoglobin dynamics. NeuroImage. 49 (4), 3039-3046 (2010).
- Sherafati, A., et al. Global motion detection and censoring in high-density diffuse optical tomography. Human Brain Mapping. 41 (14), 4093-4112 (2020).
- Eggebrecht, A. T., et al. Mapping distributed brain function and networks with diffuse optical tomography. Nature Photonics. 8 (6), 448-454 (2014).
- Ferradal, S. L., et al. Functional Imaging of the Developing Brain at the Bedside Using Diffuse Optical Tomography. Cerebral Cortex. 26 (4), 1558-1568 (2016).
- Winkler, A. M., Ridgway, G. R., Webster, M. A., Smith, S. M., Nichols, T. E. Permutation inference for the general linear model. NeuroImage. 92, 381-397 (2014).
- Hassanpour, M. S., et al. Statistical analysis of high density diffuse optical tomography. NeuroImage. 85, 104-106 (2014).
- Zhang, F., et al. Correcting physiological noise in whole-head functional near-infrared spectroscopy. Journal of Neuroscience Methods. 360, 109262 (2021).
- Duan, L., et al. Wavelet-based method for removing global physiological noise in functional near-infrared spectroscopy. Biomedical Optics Express. 9 (8), 3805-3820 (2018).
- Klein, F., Kranczioch, C. Signal Processing in fNIRS: A Case for the Removal of Systemic Activity for Single Trial Data. Frontiers in Human Neuroscience. 13, 331 (2019).
- Zhou, X., Sobczak, G., McKay, C. M., Litovsky, R. Y. Comparing fNIRS signal qualities between approaches with and without short channels. PLoS One. 15 (12), 0244186 (2020).
- Santosa, H., Zhai, X., Fishburn, F., Sparto, P. J., Huppert, T. J. Quantitative comparison of correction techniques for removing systemic physiological signal in functional near-infrared spectroscopy studies. Neurophotonics. 7 (3), 035009 (2020).
- Emberson, L. L., Crosswhite, S. L., Goodwin, J. R., Berger, A. J., Aslin, R. N. Isolating the effects of surface vasculature in infant neuroimaging using short-distance optical channels: a combination of local and global effects. Neurophotonics. 3 (3), 031406 (2016).
- Frijia, E. M., et al. Functional imaging of the developing brain with wearable high-density diffuse optical tomography: A new benchmark for infant neuroimaging outside the scanner environment. NeuroImage. 225, 117490 (2021).
- Brigadoi, S., Cooper, R. J. How short is short? Optimum source-detector distance for short-separation channels in functional near-infrared spectroscopy. Neurophotonics. 2 (2), 025005 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados