このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
全頭部オプトードアレイと短距離チャンネルを用いたfMRIとfNIRSの同時測定データ収集
要約
本稿では、全頭fNIRSカバレッジで同一被験者からfMRI信号とfNIRS信号を同時に収集する方法を提示する。このプロトコルは、3人の若年成人でテストされており、発達研究や臨床集団のデータ収集に適応させることができます。
要約
機能的近赤外分光法(fNIRS)は、機能的磁気共鳴画像法(fMRI)よりも動きに強く、費用対効果の高いポータブルニューロイメージング手法であるため、脳機能の自然主義的な研究の実施や、発達および臨床集団での使用に非常に適しています。fNIRSとfMRIの両手法は、脳の機能的活性化における脳血中酸素化の変化を検出するものであり、先行研究により、2つの信号の間に高い空間的および時間的対応があることが示されている。ただし、同じ被験者から同時に収集された 2 つの信号を全頭 fNIRS カバレッジで定量的に比較することはできません。この比較は、fMRIのゴールドスタンダードに照らしてエリアレベルの活性化と機能的接続性を包括的に検証するために必要であり、寿命全体にわたって2つの信号の比較を容易にする可能性があります。我々は、fMRIとfNIRS信号の同時データ収集のためのプロトコルを記述することによって、このギャップに対処します:i)全頭部fNIRSカバレッジを提供します。ii)非皮質の全身性生理学的信号の退行のための短距離測定を含む。iii)fNIRS測定のオプトードと頭皮の同時登録のための2つの異なる方法を実装します。3人の被験者のfMRIおよびfNIRSデータが提示され、発生集団および臨床集団の検査にプロトコルを適応させるための推奨事項が議論されます。成人の現在のセットアップでは、機能スキャンと構造スキャンの両方を含む平均約40分のスキャンセッションが可能です。このプロトコルでは、磁気共鳴(MR)環境で使用するためにfNIRS機器を適応させるために必要な手順を概説し、データ記録とオプトードと頭皮の同時登録の両方に関する推奨事項を提供し、利用可能なMRセーフfNIRSシステムの仕様に適合するようにプロトコルを変更する可能性について説明します。点滅チェッカーボードタスクからの代表的な被験者固有の応答は、MR環境における全頭部fNIRS信号を測定するためのプロトコルの実現可能性を示しています。このプロトコルは、生涯にわたってfMRIに対するfNIRS信号の検証に関心のある研究者に特に関連します。
概要
認知機能は、機能的磁気共鳴画像法(fMRI)を介して成人の脳で30年近く研究されてきました。fMRIは高い空間分解能と機能的および構造的画像の両方を提供しますが、自然主義的な文脈で実施される研究や、乳児や臨床集団での使用には実用的ではないことがよくあります。これらの制約は、脳機能の理解を実質的に制限します。fMRIの代替法は、機能的近赤外分光法(fNIRS)1,2,3など、より費用対効果が高く、動きに対して堅牢なポータブル手法を使用することです。fNIRSは、言語発達、社会的に関連性のある情報の処理、物体処理など、さまざまな認知領域にわたる脳機能を評価するために乳幼児に使用されています4,5,6。fNIRSは、7、8、9歳にわたって繰り返し検査とモニタリングを行う可能性があるため、臨床集団の検査に特に適した神経画像モダリティでもあります。その幅広い適用性にもかかわらず、同じ被験者から同時に収集されたfMRI信号とfNIRS信号を頭全体を対象として定量的に比較した研究はありません。この比較は、fMRIゴールドスタンダードに照らして、領域レベルの活性化と関心領域(ROI)間の機能的接続性を包括的に検証するために必要です。さらに、このモダリティ間の対応関係を確立することは、fNIRSが典型的および非定型的発達の両方で収集された唯一のシグナルである場合に、fNIRSの解釈を強化する可能性を秘めています。
fMRIとfNIRSの信号はどちらも、脳の機能的活性化中の脳血中酸素化(CBO)の変化を検出します10,11。fMRIは電磁場の変化に依存し、CBOの変化の高い空間分解能を提供する12。対照的に、fNIRSは、一連の発光および光検出オプトードを使用して近赤外光の吸収レベルを測定します2。fNIRSは異なる波長での吸収の変化を測定するため、オキシヘモグロビンとデオキシヘモグロビンの両方の濃度変化を評価することができます。少数のオプトードでfMRI信号とfNIRS信号の同時記録を用いた先行研究により、2つの信号は高い空間的および時間的対応関係を有することが示されている10。血中酸素濃度依存性(BOLD)fMRIと光学的測定値11,13の間には強い相関関係があり、fNIRSとfMRIの血行動態応答関数(HRF)の時間的ダイナミクスを比較した先行研究で報告されているように、デオキシヘモグロビンはBOLD応答と最も高い相関を示しています14。これらの初期の研究では、運動反応パラダイム(すなわち、指のタッピング)を実装し、一次運動野と運動前皮質領域をカバーする限られた数のオプトードを使用していました。過去10年間で、研究は焦点を拡大し、認知タスクと安静状態のセッションのより大きなバッテリーを含むようになりましたが、特定のROIをカバーする限られた数のオプトードを依然として使用しています。これらの研究は、fNIRS/fMRI相関の変動性が頭皮および脳からの光学管の距離に依存することを示した15。さらに、fNIRSは、fMRI16,17に匹敵する安静時の機能的接続測定を提供することができます。
現在のプロトコルは、以前の研究に基づいて構築されており、i) 全頭部 fNIRS カバレッジの提供、ii) 非皮質生理学的信号の回帰のための短距離測定を含む、iii) fNIRS 測定のオプトードから頭皮への同時登録のための 2 つの異なる方法の実装、および iv) 2 つの独立したセッションにわたる信号のテストと再テストの信頼性の評価を可能にします。fMRI信号とfNIRS信号を同時にデータ収集するためのこのプロトコルは、当初、若年成人の検査用に開発されました。しかし、この研究の目標の1つは、fMRI/fNIRS信号を同時に収集し、その後、発生集団の検査に応用できる実験装置を作成することでした。したがって、現在のプロトコルは、幼児をテストするためのプロトコルを開発するための出発点としても使用できます。このプロトコルは、全身のfNIRSカバレッジの使用に加えて、全身の生理学的信号(すなわち、血圧、呼吸器、心臓信号などの非皮質ソースから生じる血管の変化)を測定するための短距離チャネルを含めるなど、fNIRSハードウェアの分野における最近の進歩を組み込むことも目的としています18,19。オプトードと頭皮の共登録のための3D構造センサーの使用20。現在のプロトコルの焦点は、視覚的に点滅するチェッカーボードタスクの結果にありますが、実験全体には、従来のブロックタスク設計、安静状態セッション、および自然主義的な映画鑑賞パラダイムを組み合わせた2つのセッションが含まれています。
このプロトコルでは、キャップの設計、トリガー同期による時間的アライメント、データ収集開始前に必要なファントムテストなど、fNIRS装置をMRI環境で使用するために適応させるために必要な手順を説明しています。前述したように、ここでは点滅するチェッカーボードタスクの結果に焦点を当てていますが、全体的な手順はタスク固有ではなく、任意の数の実験パラダイムに適している可能性があります。このプロトコルでは、fNIRSキャップの配置とシグナルのキャリブレーション、参加者と実験装置のセットアップ、実験後のクリーンアップとデータの保存など、データ収集中に必要な手順をさらに概説しています。プロトコルの最後には、fNIRSおよびfMRIデータの前処理に特化した分析パイプラインの概要を示します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
この研究は、イェール大学の治験審査委員会(IRB)によって承認されました。すべての被験者についてインフォームドコンセントが得られました。被験者は、安全な参加を確保するためにMRIスクリーニングに合格する必要がありました。認知機能に影響を与える可能性のある重篤な医学的または神経学的障害の病歴がある場合は除外されました(すなわち、神経認知障害またはうつ病障害、外傷、統合失調症、または強迫性障害)。
注:現在のプロトコルでは、1.95 Hzでサンプリングされた100の長距離チャネルと8つの短距離チャネル(32のレーザーダイオード光源、λ = 785/830 nm、平均出力20mW/波長、および38のアバランシェフォトダイオード検出器)を備えたCW-NIRSデバイスを使用しています。すべてのデータは、Yale Brain Imaging Center(https://brainimaging.yale.edu/)で収集されました。fMRIとfNIRSの同時データを収集するためのシステム固有の変更は、プロトコル全体を通して記載されています。
1. fNIRSの装置改造と一斉データ収集のための開発
注:ステップ 3 から 6 は NIRScoutXP システムに固有のものであり、取得ソフトウェアやオプトード評価に使用可能なファントムのバリエーションにより、他の fNIRS システムには適用されない場合があります。
- fNIRSキャップの調製
- 研究に必要な fNIRS キャップを特定します。成人の研究では、次のキャップサイズ(cm単位)が利用可能であることを確認してください:54、56、58、および60。
- メモ: キャップサイズは、このプロトコルで使用されるシステムに固有です。したがって、異なるNIRSシステムに必要な特定のサイズにばらつきがある場合があります。
- ビタミンEカプセルと撥水素材(PUコーティングを施したナイロン生地など)を使用して、基準を準備します。カプセルを選択した材料で包み、選択した領域に基準を縫い付け(または接着)します( 図1Aを参照)。ビタミンEカプセルは、T1w画像を用いて、下にある脳組織に対するfNIRSチャネルの位置を特定するための基準マーカーとして機能します。
- オプトード配列と共登録方法に応じて指標の数を決定します。いくつかの研究は、いくつかの解剖学的ランドマークの検出のみを必要としますが、他の研究は、各オプトードの隣に基準を配置することで利益を得るかもしれません。
- fNIRSキャップが後頭部で緩すぎる場合は、キャップの両側に伸縮性のある生地(カット済みのボタンホール付き)とボタンを使用して2本のストラップを取り付け、キャップの調整性を高めます。参加者間で、キャップのきつい具合に関係なく、ストラップを固定して、一貫したキャップのセットアップを確保します。
- キャップの前面が額にきつすぎる場合は、皮膚に直接接触しているオプトードにゴム製の緩衝材を置きます。fNIRSサプライヤーがバッファーを提供していない場合は、フェルト生地のステッカーを使用してバッファーを作成します。ゴム製バッファーを使用する場合は、キャップの適合度に関係なく、すべての参加者にゴムバッファーを使用して、一貫したキャップ設定を確保します。ゴム緩衝液中の成分に金属成分が含まれていないことを確認し、MR画像のアーチファクトを防ぎます。
- MRI制御室とスキャナー室でのfNIRS装置の設置
- fNIRS装置を、スキャナー室に通じる導波管の1つの近くの制御室に置きます。ファイバー長を最大にするために、必要に応じて高い面(ステップスツールなど)を使用して、fNIRSデバイスが導波路にできるだけ近づくようにします。
- メッシュケーブルネットを使用して、光ファイバーをグループに束ねます。選択したオプトード配列に基づいてこれらのグループを決定します。理想的には、光ファイバーは、グループ内のすべてのオプトードがヘッドの同じ側(左と右)に配置されるようにグループ化されます。
- 光ファイバーをfNIRSデバイスに接続し、導波管を介してバンドルをスキャナールームに導きます。光ファイバーを注文する前に、fNIRSデバイスとスキャナーボアの中心の間の距離を測定して、光ファイバーの長さが十分であることを確認してください。
- 光ファイバーをスキャナーテーブルに運びます。MRIセーフブリッジを使用して光ファイバーを保持し、ファイバーの重量によってファイバーがたるまないようにし、キャップが被験者の頭から引き離されないようにします( 図1Bを参照)。
- パラレルポートリプリケータボックスのセットアップ
- fNIRSデータ収集コンピュータにNIRStarソフトウェアの最新バージョンをインストールします。
- パラレルポートリプリケータを、メーカーのトリガマニュアル(バージョンR2.1、 図1Cを参照)に示されているように、スキャナからトランジスタ-トランジスタロジック(TTL)のようなパルスを送信するケーブルに接続します。TTLパルスは、スキャナから直接送信されるスライスタイミングパルスに対応します。スキャナーがパルスを送信しているとき、LEDインジケーターの1つが点灯します。
- パラレルポート入力を介して、パラレルポートリプリケータボックスをfNIRSデバイスに接続します。これにより、スキャナーからのTTLパルスが検出されるたびに、NIRStarソフトウェアにトリガーが送信されます。トリガ信号は、データ取得記録画面に点線で反映されます。このセットアップにより、スライスタイミングパルスがスキャナーで収集されるたびに、NIRStar取得ソフトウェアによって記録されたfNIRSデータストリームに反映されるため、fNIRSとfMRIデータ収集の同期が保証されます。
- オプトード評価のための静的ファントムの調製
- オプトードをfNIRSサプライヤーが提供する静的ファントムデバイスに配置します。ファントム上のオプトードの配置は、fNIRS装置の種類と、利用可能な光源と検出器の数によって異なります。メーカーのプロバイダーの入門ガイドで正しいオプトードの配置を確認してください。
- ファントムが光源から完全に遮蔽されていることを確認してください。一部のサプライヤーは、オプトードを外部光源から遮蔽するのに役立つフィッティングケースを提供しています。
- 利用可能なすべての光源と検出器バンドルを、指定されたオプトード配置に従ってfNIRSファントムに接続します。
- fNIRSファントムをアクイジションコンピュータに接続し、NIRStarアクイジションソフトウェアを起動します。
- ファントム・ダーク・ノイズ・インストゥルメント・テストの実行
- NIRStar データ取得ソフトウェアの Configure Hardware メニュー項目で、Channel Setup タブを開きます。[Number of Sources] と [Number of Detectors] で、使用可能なソースと検出器の合計数が正しく設定されていることを確認します。[OK]をクリックして、これらの設定を確認します。
- NIRStar ウィンドウのメイン メニューにある [Diagnostics ] メニュー項目をクリックして、ダーク ノイズ テスト ウィンドウを起動します。
- [ テストの実行 ] ボタンを押してテストを実行します。[ 結果の保存 ]ボタンを押して、テスト結果を保存します。
メモ:結果の解釈方法については、製造元の『Getting Started Guide: Troubleshooting Static Phantom』を参照してください。
- ファントムキャリブレーションテストの実行
- NIRStar データ取得ソフトウェアの Configure Hardware メニュー項目で、 Channel Setup タブを開きます。 [Number of Sources] と [Number of Detectors] で 、使用可能なソースと検出器の合計数が正しく設定されていることを確認します。
- [ Configure Hardware ] メニュー項目で、[ Channel Masking ] タブを開きます。[ すべて選択 ]ボタンを押して、すべてのチャンネルをマスクします。
- ハードウェア設定(Configure Hardware)メニュー項目のハードウェア仕様(Hardware Specification)タブで、スタディ タイプ(Study Type)のスタティック ファントム(Static Phantom)を選択します。[OK] をクリックして、これらの設定を確認します。
- キャリブレーションボタンを押してキャリブレーションを開始します。キャリブレーションが完了したら、詳細ボタンを押して view 詳細なキャリブレーション結果。
メモ:結果の解釈方法については、製造元の『Getting Started Guide: Troubleshooting Static Phantom』を参照してください。
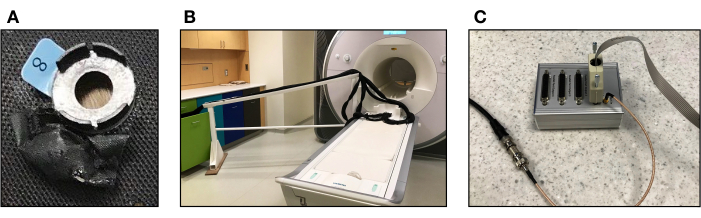
図 1.fMRIとfNIRSの同時測定データ収集装置です。 (A)各オプトードに隣接するfNIRSキャップに縫い付けられたビタミンEカプセルを保管するための黒い撥水素材で作られたパウチ。(B)データ収集中に光ファイバーが参加者の頭に届くように、光ファイバーを床の上に保持するためのMRIセーフブリッジ。(C)スキャナーからfNIRSデバイスにパルスを送信するパラレルポートレプリケータ。 この図の拡大版をご覧になるには、ここをクリックしてください。
2. 実験課題設計
- スキャナー内の参加者の快適さを考慮して、スキャンセッションの期間を決定します。例えば、ここで取り上げた研究には、合計約14分間の2つの構造画像(T1wとT2w)と、さらに約25分間の5つの機能的実行が含まれています。
注:研究固有の要因(参加者の年齢、キャップサイズなど)が快適さのレベルを決定するため、研究の適切な長さを特定するには、複数の参加者で研究を試験的に実施する必要があります。 - 研究目標に沿ってニューロイメージングタスクを設計します。これは研究固有になります。ここでは、点滅チェッカーボードタスクの手順(および代表的な結果)を示します。
3. テスト当日のfNIRSキャップの配置と信号校正
注:以下のすべての手順は、特に断りのない限り、MRIコントロールルームまたは同意室で行われます。
- ヘッド測定値の収集とfNIRSキャップの選択
- 参加者が関連する同意書に署名し、今後のタスクの指示を受け取ったら、コントロールルームにある椅子に座るように指示します。
- 標準的な柔らかい巻尺を使用して、参加者の頭のできるだけ広い円周にテープを巻き付けます。額の最も目立つ部分(多くの場合、眉毛の上の1〜2本の指)から、後頭部の最も広い部分まで。最も広い円周を見つけてみてください。
- 測定された円周に最も近いキャップサイズを選択します。
- 短距離検出器プローブのキャップへの取り付け
メモ: この手順は NIRx システムに固有のものであり、他の fNIRS デバイスには適用されない場合があります。- ベースをしっかりとつかみ、fNIRSキャップのメッシュを通過するグロメットの部分の周りにスライドさせて、短距離検出器プローブを配置します( 図2Aを参照)。短距離検出器プローブをケーブルから引き抜くと、ケーブルが損傷する可能性があるため、注意してください。
注:プローブの分布を決定するときは、ヘッド全体とROI固有の分布を比較した最近の研究を参照してください18。 - 必要に応じて、メーカーが提供するファイバーオーガナイザークリップをケーブル管理に使用します。顔の周りの領域をきれいに保つために、短距離検出器ケーブルがキャップの背面に向けられていることを確認してください。
- ベースをしっかりとつかみ、fNIRSキャップのメッシュを通過するグロメットの部分の周りにスライドさせて、短距離検出器プローブを配置します( 図2Aを参照)。短距離検出器プローブをケーブルから引き抜くと、ケーブルが損傷する可能性があるため、注意してください。
- fNIRSキャップとオプトードを参加者の頭に装着する
- 参加者に、帽子を頭のてっぺんからまっすぐ下にスライドさせて、冬の帽子をかぶるように頼みます。キャップがまっすぐで、耳が耳の穴にあることを確認してください。
- 参加者に、できるだけ顎紐を締めるように依頼します。バックストラップを締め、キャップがしっかりと取り付けられ、オプトードソケットが頭にしっかりと固定されていることを確認します。
- 緑色のステッカーを貼って、10〜20のシステム位置(inion、nasion、耳の前方の耳介前点、Cz)に従って主要な基準位置をマークします21。
注意: 緑色のステッカーは、3D構造センサーを使用してソースと検出器のオプトード位置の空間座標を決定する場合に必要です。これは、3D構造センサーの種類によって異なる場合があります。現在のプロトコルでは、後頭部20の構造センサー(Mark II)を使用しています。 - 巻尺を使用して、i)耳介前点がCz点から等距離にあり、ii)陰イオンと鼻嚢点がCz点から等距離にあることを確認することにより、キャップのポイントを頭皮ポイントと対称的に位置合わせします。キャップの位置がすべての参加者で同じであることを確認してください。
- 3D構造センサーデジタイザーを使用した参加者の頭部モデルの取得
- 参加者に、頭の3Dモデルを作成するためにじっと座っているように指示します。
- タブレットまたは iPad でアプリケーション 「構造 」を開きます。
注:このプロトコルでは、後頭部20の構造センサー(Mark II)を使用してヘッドメッシュを作成するために必要な手順を説明しています。これらの手順は、システムによって異なる場合があります。 - 次の設定がオフになっていることを確認します:高解像度カラー、IR自動露出、改善されたトラッカー。
- 参加者の頭全体が画面上の 3D 正方形内に収まり、頭全体がレンダリングされ、フレームに肩があまり入らないように、参加者を中央に配置します。
- 参加者の周りを360°慎重に歩き回って、3Dスキャンを作成します。アプリケーションが約90°ごとに画像をキャプチャするのを待ってから、続行します(図3Aを参照)。
- スキャン全体がキャプチャされたら、画面の右側にあるボタンを押して3Dレンダリングを作成します。
- レンダリングをチェックして、レンダリングが明確であり、オプトードと緑色の基準ステッカーの配置を確認するのに十分な詳細があることを確認します。3DスキャンをHIPAAで保護されたサーバーに保存します。
- 参加者がスキャナールームに入る準備をする
- 3Dモデルが生成されたら、緑色のステッカーをはがし、参加者に耳栓を耳に装着するように指示します。
- MRイメージングセンターの指示に従って、参加者がスキャナールームに安全に入ることができることを確認します。このステップでは、通常、参加者の体内に金属がないことを確認し、最終チェックとして金属探知機を通過します。到着前に被験者が記入したMRI安全性アンケートは、ほとんどの画像センターでしばしば要求されます。
- 光源プローブと検出器プローブをfNIRSキャップに配置する
- スキャナールームで、参加者にスキャナーテーブルに快適に座るように指示します。
- 片手で各オプトードグロメットを安定させながら、もう一方の手でMRIセーフアプリケーターを使用して、グロメットの中心から髪の毛を押しのけます( 図2Bを参照)。髪の毛がその領域から十分に移動したら(理想的には頭皮が見えるように)、オプトードをグロメットにしっかりと押し込みます。
- グロメットの張力が解放されると、髪の毛が戻ってオプトードの中心を閉塞しないようにしてください。ヘッドアレイ全体を使用する場合は、オプトードを頭の後ろの線維を前面に向け、オプトードを頭部の前部に向け、繊維を後ろに向けて配置することをお勧めします。この光ファイバーの構成により、参加者が横になってMRIヘッドコイルに頭を入れたときに、光ファイバーが絡まったり縮着したりするのを防ぎます。
注:このファイバー挿入およびアライメントプロセスは、参加者の両側に配置された2人の実験者を配置し、同時にキャッピングすることで、より迅速かつ簡単に実行できます。 - ケーブルオーガナイザーを使用して、光ファイバーを束ねてきれいに配置します( 図2B および 図3Bを参照)。NIRStarソフトウェアを使用して、テストキャリブレーションと信号強度の測定を実施します。2人の経験豊富な研究者による検眼の配置と校正には、約10分かかります。
- 問題のあるオプトードから干渉するヘアを置換して十分な信号品質が得られるまで、必要に応じて個々のオプトードを調整します。キャップからオプトードを取り外し、プラスチックピンセットを使用して髪の毛を変位させます( 図2Bを参照)。

図 2.fNIRSキャップ調製用の短距離検出器とツール。 (A)短距離検出器プローブとゴム緩衝液をfNIRSキャップに取り付け、髪の毛がほとんどない前頭部に取り付けます。(B)左から右へ:光ファイバーを束ねて配置するためのケーブルオーガナイザー、オプトードの配置中に髪の毛を押しのけるためのMRIセーフアプリケーター、およびNIRSキャップのセットアップ中に必要に応じてキャップからオプトードを取り外して髪の毛を移動させるためのプラスチックピンセット。 この図の拡大版をご覧になるには、ここをクリックしてください。

図 3.3D構造センサーデジタイザーとfNIRSキャップの配置。 (A)実験者は、3D構造センサーデジタイザーを使用して、参加者の頭部の3Dモデルを作成します。緑色のステッカーは、基準の場所を識別するために使用されます。(B)参加者の頭部のfNIRSキャップに光ファイバーを挿入し、信号キャリブレーションの前にケーブルオーガナイザーを使用して束に配置します。 この図の拡大版をご覧になるには、ここをクリックしてください。
4. 参加者の設定
注:次の手順は、MRIスキャナールームで行われます。呼吸ベルトとパルスオキシメータの使用はオプションであり、研究者がfNIRSデータからこれらの信号を回帰させることに関心がある場合にのみ必要です22。このプロトコルでは、拘束ベルトを使用して呼吸振幅を取得するための呼吸ユニットの一部である呼吸ベルトを使用します。同様に、生理学的パルスユニットは、心臓のリズムの取得を可能にする光学プレチスモグラフィセンサからなる。
- 20チャンネルのヘッドコイルがスキャナーに配置されていることを確認します。全頭型fNIRSアレイを使用する場合、32チャンネルと64チャンネルのヘッドコイルは成人の参加者にはきつすぎます。
- MRIヘッドコイルの底部にフォーム枕を置き、参加者の後頭部を支えます( 図4Aを参照)。
- 参加者に、キャップを動かしたり、光ファイバーを引っ張ったりしないように、ゆっくりと慎重に横になるように求めます。必要に応じて光ファイバーの束を調整し、参加者の頭がヘッドコイル内に快適に収まるようにします( 図4Bを参照)。このステップでは、ケーブルが導波管からどこにあるかによっては、スキャナーテーブルを上げる必要がある場合があります。
- 参加者が快適に過ごせるように、参加者の足の下に枕を置きます。呼吸ベルトを参加者の腰に巻き付けます。
- 参加者に、fNIRSプローブの配置を妨げないように注意しながら、ノイズキャンセリングヘッドホンを耳の周りに配置するように依頼します。ヘッドホンが滑らないように、ヘッドホンとヘッドコイルの内側の間のヘッドの両側にMRIセーフパッドを使用してください。枕カバーを使用して、ヘッドホンがヘッドコイルに接触するのを防ぐことができます。
- パルスオキシメータを被験者の利き手ではない方の手の人差し指に置きます。実験課題にボタンボックスを使用する場合は、利き手で持ってもらいます。参加者にボタンボックスの使用方法の説明を提供します。
- スクイーズボールまたはボタンアラームを被験者の利き手ではない手に置き、参加者にその使い方を指示します。参加者にアラームを押すように依頼して、アラームをテストします。
- 参加者をスキャナーの穴に数インチスライドさせて、ヘッドの位置を合わせます。ヘッドコイルの上部を配置します。次に、マイクとミラーを対応するコイルインサートに挿入します。
- 参加者を光ファイバーを持ちながら、スキャナーの穴にゆっくりとスライドさせます。このプロセスには、スキャナーテーブルの両側に配置される2人が必要です。光ファイバーがスキャナーの穴に注意深く導かれていることを確認して、オプトードを引っ張ったり、ヘッドコイルとスキャナーの穴の間にファイバーを挟んだりしないようにします。
- スキャンセッションの準備ができていることを参加者に確認した後、コントロールルームに戻り、インターホンの音声で、参加者に実験者の声が聞こえ、実験者に参加者の声が聞こえることを確認します。
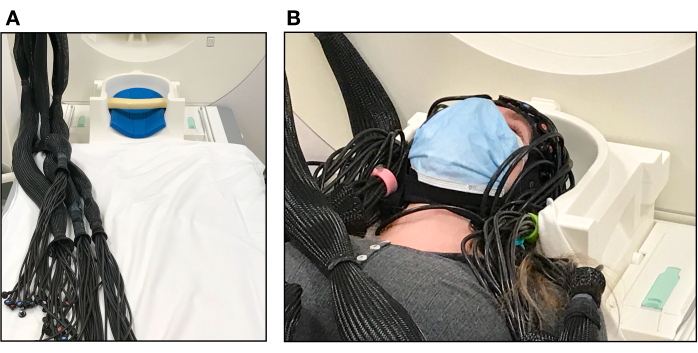
図4.MRIスキャナーで設定された参加者。 (A)MRヘッドコイル内の枕は、参加者の頭部を支えるために使用され、光ファイバーは、参加者がセットアップする前に束ねて配置されます。(B)fNIRSキャップを装着した状態でスキャナーベッドに横たわり、テストの準備をしている参加者。ヘッドコイルの上部は、まだ参加者の顔の上に置かれていません。 この図の拡大版をご覧になるには、ここをクリックしてください。
5. 信号記録前のスキャナーとfNIRS装置のセットアップ
- スキャナーコンピュータで、スタディに関連する構造的および機能的シーケンスを選択します。fNIRSデータの感度光モデルを計算するときは、T1wとT2wの両方の画像を収集して、最高の組織コントラスト分解能を取得します。
- ローカライザーをチェックして、スキャナーボア内のヘッドの位置が適切であることを確認します。頭のてっぺんから小脳まで脳を完全にカバーしていることを確認します。
- ヘッドコイルミラー越しにパソコンの画面が見えることを参加者に確認する。
- 最初の構造スキャンを実行します。並行して、fNIRSオプトードの別のキャリブレーションテストを実行して、参加者の設定がいずれかのチャンネルの信号強度に影響を与えたかどうかを確認します。
- 最初の構造MRIスキャンを実行した後、グラジエントエコーフィールドマップシーケンスを収集し、ノイズキャンセリングヘッドホンを調整して、ヘッドホンが参加者に聴覚刺激を伝え、周囲のノイズをブロックできるようにします。
注意: 一部の参加者は、ヘッドフォンを調整する必要がある場合があります。その場合は、スキャナールームに再度入り、fNIRSプローブの配置を妨げないように注意しながら、ヘッドホンの周りのパッドを調整してください。先に進む前に、別のローカライザー、グラジエントエコーフィールドマップシーケンス、およびfNIRSオプトードのキャリブレーションテストを実行します。
6.同時信号記録
- インターホンで参加者に確認し、参加者が快適で問題ないことを確認します。 タスクの指示を出し、参加者に頭と体を動かさないようにします。
- 点滅するチェッカーボードタスクに固有の次の手順を提供します(図5)。
- このタスクでは、参加者に、常に目の前にある表示画面の中央を(鏡を介して)見るように指示します。画面には、タイルがさまざまな周波数でちらつくチェッカーボードが表示されることがあります。また、参加者には画面の中央に白い円が表示されます。
- 画面に白い円が表示されたら、参加者に人差し指で ボタンボックス を押すように指示します。ボタンを押すと、円が赤に変わります。
- このタスクでは、交互ブロック計画を使用します。参加者に、それぞれ10秒の点滅するチェッカーボードブロック11個と、それぞれ20秒の円ブロック11個を含む、6分間の1回のランニングを完了させます。
- fNIRSコンピュータでfNIRSデータ記録を開始し、刺激提示コンピュータでタスクを開始します。実験タスクのスクリプトは、タスクの指示として表示されます。
- 最初の機能実行を開始します。スキャナーが最初のTTLパルスを送信すると、これはNIRStarソフトウェアのデータ記録画面にトリガー信号として表示されます。この最初のパルスは、実験タスクも開始します。
- すべてのタスクを通して参加者のパフォーマンスと動きを監視します。場合によっては、特に全頭オプトードアレイと小さなサイズのキャップを使用する場合、一部の参加者はキャップを着用するときに不快感を感じることがあります。参加者の快適さを常に監視することが重要です。
- 必要に応じて、セッションの途中で参加者に休憩を与えます。この休憩中に、参加者が座ってローカライザーを収集し、グラジエントエコーフィールドマップシーケンスを実行する必要がある場合は、先に進む前にヘッドフォンキャリブレーションとfNIRSテストキャリブレーションを再度実行します。このステップは、現在のプロトコルの正確な手順に従えば、スキャナーで若年成人をテストするときに通常必要ありません。
- データ収集中に、セッションに関するメモを取ります(例:キャップサイズ、時刻、適切にキャリブレーションされていないオプトード、または異常なもの)。
- すべての関数の実行が終了したら、fNIRS データの収集を停止します。必要に応じて、2 回目の構造スキャンを実行します。
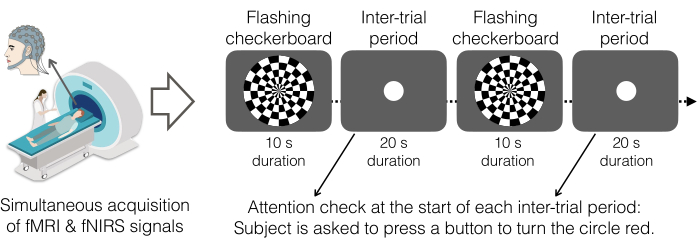
図5.実験的なタスクとしてのチェッカーボードパラダイムの点滅。 参加者は、白い四角が毎秒8回点滅し、白い円を示す灰色の画面と交互に点滅する白黒の市松模様を見ました。注意チェックとして、参加者は画面中央に白い円が表示されたら右手でボタンを押すように指示されました。ボタンを押すと、円が赤に変わります。このタスクは、11個の点滅するチェッカーボードブロックと11個の試行期間の計22個のブロックで構成される1回の実行で完了しました。チェッカーボードの点滅期間は10秒間続き、試行期間は20秒間続きました。したがって、点滅するチェッカーボードの開始は30秒(0.033Hz)ごとに発生しました。ディスプレイはPsychoPy v2021.2.4で生成し、1080pのDLPプロジェクションシステムを介してヘッドコイル上部のリアミラーに投影しました。参加者は、このタスクを 1 回実行しました (~6 分)。 この図の拡大版をご覧になるには、ここをクリックしてください。
7. 実験後のクリーンアップとデータの保存
- 電動スキャナーベッドを使用して、光ファイバーを挟まないように注意しながら、参加者をスキャナーの穴からゆっくりと取り外します。ヘッドコイルの上部を取り外し、参加者にゆっくりと座ってもらいます。
- 参加者の頭からfNIRSキャップを取り外し、それぞれのグロメットから各オプトードを取り外します。オプトードを抜いた後もグロメットに髪の毛が詰まることが多いので、ゆっくりと慎重にキャップを外すように参加者に指示します。
- 一部のグロメットは、キャッピングを外すプロセスで外れる可能性があります。次の参加者のスキャンセッションの前に、必ずすべてのグロメット部品を見つけ、不足している部品を交換してください。
- 参加者にスキャナーベッドから滑り降りてもらい、時間を割いてくれたことに感謝し、該当する場合は金銭的補償を提供します。
- タスクログ、fNIRS、fMRIデータが保存され、バックアップされていることを確認します。fNIRSベンダーが推奨するスプレー洗浄液でキャップを消毒し、プラスチックとゴムで安全なアルコールワイプでオプトードチップを拭きます。
8. fMRIデータの前処理
注:fMRIデータは、ニューロイメージングモダリティ全体のデータ整理、前処理、品質保証、および分析をサポートするオープンソースソフトウェアスイートであるQuNex24を使用して、Human Connectome Project23の最小限の前処理パイプラインに従って前処理されました。以下で強調表示されている各ステップの特定の設定とパラメーターに関する詳細なドキュメントは、QuNexのWebサイト(https://qunex.yale.edu/)にあります。データの処理に使用される主な手順とパラメーターを以下に示します。
- 構造データの前処理
- PreFreeSurfer パイプライン。 勾配歪み補正、6自由度(DOF)剛体変換によるT1wおよびT2w画像の繰り返し実行のアライメント、MNI空間テンプレートへのT1wおよびT2w画像のAC-PCアライメント、初期脳抽出、読み出し歪み補正、ネイティブボリューム空間でのT1wおよびT2wのクロスモーダルレジストレーション、バイアスフィールド補正、およびMNI非線形ボリュームレジストレーションを実行します。
- フリーサーファーのパイプライン。以下の手順を実行します:スプライン補間を使用してT1wを1mmにダウンサンプリングし、FreesurferのBBRegisterアルゴリズムを使用してT2wからT1wへのレジストレーションを微調整することを含む、白質表面を生成するためのrecon-allを実行します(詳細は23 を参照)。
- PostFreeSurfer パイプライン。次の手順を実行します:ネイティブボリューム空間ですべてのリコン出力をGIFTIおよびNIFTIに変換し、最終的なブレインマスクと皮質リボンボリュームを生成し、ミエリンマップを生成し、ネイティブからMNIへの非線形ボリューム変換を実行します。
- 機能データの前処理
- fMRI ボリューム パイプライン。ディストーション補正、FLIRTベースのモーション補正、スピンエコーフィールドマップを使用したTOPUPベースのフィールドマップ前処理、EPI画像歪み補正とEPIからT1wへのレジストレーション、アトラス空間(MNI)へのワンステップスプラインリサンプリング、バイアスフィールド除去による強度正規化、ブレインマスキングのステップを実行します。
- fMRI Surface パイプライン。体積時系列を、CIFTI形式で保存されたサーフェスとボリュームを組み合わせたグレー縦座標表現にマッピングするには、fMRIリボン構築、表面平滑化、皮質下処理、および高密度時系列の生成の手順を実行します。
- BOLDデータを用意します。動きとその人工物特性を反映した定量的なQC統計を計算して、不良フレームを特定します。定量的QC統計を生成するために利用可能なオプションについては、QuNexのドキュメントを参照してください。これらの統計には、多くの場合、フレーム変位のしきい値や画像強度の正規化された二乗平均平方根誤差 (RMSE) のしきい値など、BOLD の時間的 S/N 統計とモーション スクラビング統計が含まれます。スタディ固有の基準に応じて、特定された問題のあるフレームを無視または補間します。
- 迷惑信号を抽出します。 脳室、白質、灰白質から迷惑信号を抽出し、後続のステップで迷惑信号の回帰を実行します。
9. fNIRSデータの前処理
注:fNIRSデータは、特定の参加者またはアトラスの解剖学的構造に同時登録されている、生の光レベルから脳機能のボクセルレベルのマップに光学データを分析するためのオープンソース環境であるNeuroDOT26を使用して、fNIRSデータ分析25のベストプラクティスに従って分析されました。以下で説明するすべての手順は、NeuroDOTで実行できます。以下で強調表示されている各手順の特定の設定とパラメーターに関する追加のドキュメントは、https://github.com/WUSTL-ORL/NeuroDOT_Beta のチュートリアルとスクリプトにあります。最後に、オプトードから頭皮へのレジストレーションには、下にある脳組織に対するfNIRSオプトード座標を取得する必要がありますが、これは、3DデジタイザーまたはビタミンEカプセルを基準として使用して行うことができます。このセクションでは、両方の方法について説明し、関連するソフトウェアパッケージへの参照を提供します。
- 被写体固有の頭部メッシュの生成とライトモデルの作成
- T1w イメージを関連する組織タイプにセグメント化して、頭皮、頭蓋骨、脳脊髄液 (CSF)、灰白質、白質) のセグメント化された頭部モデルを作成します。T1w画像とT2w画像は、それぞれが関連する組織タイプに関する補完的な情報を提供するため、可能であれば両方を使用してください。
注:このステップは、Freesurferの体積セグメンテーション28から入力情報として受け取るNeuroDOTの機能「Segment5R_fs」を使用して、現在のプロトコルで実行されます。脳組織セグメンテーションのために一般的に入手可能な他のソフトウェアパッケージは、SPM29 およびAFNI30です。 - NeuroDOT経由でMimicsソフトウェアパッケージを使用して、セグメント化された頭部モデルから頭部メッシュを生成します。3D デジタイザを使用して頭部モデルにオプトード位置を配置する場合は、オプトード位置推定のフィールドトリップの推奨事項31 に従ってください。あるいは、ビタミンEカプセルを線源と検出器のペアの座標を同定するための基準として使用する場合は、T1w画像内の線源と検出器の位置を手動で特定します(例として32 を参照のこと)。
- 3DデジタイザーまたはビタミンEカプセルを介して得られたソースと検出器の位置を、NeuroDOTを使用してメッシュ上の関連する遺伝子座に配置します。
- NeuroDOTを介してNIRFASTソフトウェアパッケージを使用して被験者固有の頭部モデルの感度マトリックスを計算するには、次のパラメータを設定します。領域ラベル:CSF、白、灰色、骨、皮膚;領域の吸収係数:CSF [0.004、0.004]、白[0.0167、0.0208];灰色 [0.018 0.0192]、骨 [0.0116, 0.0139]、皮膚 [0.74, 0.64];領域の散乱係数:CSF [0.3, 0.3]、白色[1.1908, 1.0107];灰色 [0.8359, 0.6726]、骨 [0.94, 0.84]、皮膚 [0.64, 0.74]、領域の屈折率: CSF [1.4, 1.4]、白 [1.4, 1.4];グレー [1.4, 1.4]、ボーン [1.4, 1.4]、スキン [1.4, 1.4]。
注:このプロトコルは、NIRFASTソフトウェアパッケージ(バージョン9.1)33,34を使用しており、放射輸送方程式への拡散近似に基づく有限要素前方光モデルを使用します。光モデルを計算するために、NIRFASTは3種類の情報に依存しています:i)組織境界形状、ii)ベースライン光学特性の内部分布、iii)表面上の光源と検出器の位置(詳細については35,36を参照)。モンテカルロ法は、異なる組織タイプの拡散方程式の解を計算するための代替手段として採用することができる37,38。 - 測定の感度の例を定性評価として視覚化します。
- T1w イメージを関連する組織タイプにセグメント化して、頭皮、頭蓋骨、脳脊髄液 (CSF)、灰白質、白質) のセグメント化された頭部モデルを作成します。T1w画像とT2w画像は、それぞれが関連する組織タイプに関する補完的な情報を提供するため、可能であれば両方を使用してください。
- ソース検出器測定からの生データの処理
- 各光源と検出器の平均光レベルをイメージング アレイの 2D 表現で表示します。時間標準偏差が 7.5% を超えるソースと検出器のペアを除去します。36。データが少なくとも3Hzのフレームレートで集録される場合は、良好なオプトードとスカルプのカップリングが脈拍数(~1 Hz)周波数と一致する特性を示すため、心拍パワー閾値を使用してソースと検出器のペアの測定を拒否します。
- データのトレンドを除去して、各測定の線形トレンドを削除します。ハイパスフィルター(0.02Hzカットオフ)で低周波ドリフトを除去します。フィルタリングの代わりに、ドリフト係数をリグレッサーとして GLM に追加することもできます。
- ローパスフィルター(1 Hz)は、心臓の振動を除去するためのデータです。
- 8 mm の光源と検出器のペアのすべての測定値の平均を計算することで、グローバルな表層信号を推定します。主に頭皮と頭蓋骨をサンプリングするため、全身の非皮質生理学的信号の推定値として短距離測定を使用します。
- すべての測定値からグローバル信号を回帰します39.
- データをローパスフィルタリング(0.5Hzカットオフ)して、残りのデータを刺激の周波数にさらに集中させ、データを1Hz40、41、42 にダウンサンプリングして計算負荷を軽減します。
- 時間微分(GVTD)の時間経過の大域分散43を使用してモーション打ち切りを実装します。GVTDは、一連の測定値またはボクセル43にわたる時間微分の二乗平均平方根として計算される。GVTD ノイズしきい値を超える時点を除外して、モーションの打ち切りまたはスクラビングを実装します。
- 光モデルと前処理されたデータを機能的ニューロイメージングボリュームに再構築
- 785 nm と 830 nm での吸収の相対的な変化を、Tikhonov 正則化と空間的に変化する正則化44 を使用した感度行列の正則化反転に基づいて再構築します。
- ヘモグロビン濃度の相対的な変化を、波長依存吸収データのスペクトル分解によって計算する44,45。
10. fMRI/fNIRSタスク誘発データ解析
- シングルセッションの第 1 レベルの GLM 分析 (HRF モデリング、短距離 fNIRS 測定を含む生理学的信号の回帰) を実行して、脳活動が特定の被験者の統計的仮説とどのように関連しているかを評価します。
注: GLM の代替として、HRF の形状に関する先験的な仮定を回避するブロック平均化があります。しかし、ブロック平均化では、刺激に対する血行動態応答とともに、fNIRSシグナルに関連する交絡因子をモデル化することはできません。 - グループまたは第 2 レベルの GLM 分析を実行して、被験者間の活性化の第 1 レベルの推定値を組み合わせます。
- 個々のGLMファイルから関連する効果推定値を抽出し、それらをグループファイルに結合します。
- 必要な統計を計算します。統計的推論のために単変量および多変量の両方のGLMモデルの順列リサンプリング法を実行するための十分に確立されたパッケージは、FSL PALM46です。
- 全脳GLMベータ推定値を取得します。
Access restricted. Please log in or start a trial to view this content.
結果
このセクションでは、fMRI信号とfNIRS信号の両方について、チェッカーボードの点滅タスクに対する代表的な被験者固有の応答を示します。まず、MRI環境でfNIRS信号を測定するための実験セットアップの実現可能性を示すために、代表的な生のfNIRSデータと品質評価を図6と図7に示します。頭部オプトードアレイ全体と感度プロファイル?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
fMRIとfNIRS信号を同時にデータ収集するためのこのプロトコルは、全身の非皮質生理学的信号を測定および退回させるために、全頭部fNIRSオプトードアレイと短距離チャネルを使用します。このプロトコルの重要なステップには、MRI環境でfNIRS信号を収集するためのfNIRS装置の変更と開発が含まれます。私たちの知る限り、全頭fNIRSアレイを使用してfMRIとfNIRSの同時測定値を取得するために完全?...
Access restricted. Please log in or start a trial to view this content.
開示事項
この記事の掲載料はNIRxが後援しています。著者は他に開示するものは何もありません。
謝辞
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 280 low-profile MRI-compatible grommets for NIRs caps | NIRx | GRM-LOP | |
| 4 128-position NIRS caps with 128x unpopulated slits in 10-5 layout | NIRx | CP-128-128S | Sizes: 52, 54, 56, 60 |
| 8 bundles of 4x detector fibers with low-profile tip; MRI-, MEG-, and TMS-compatible. | NIRx | DET-FBO- LOW | 10 m long |
| 8 bundles of 4x laser source fibers with MRI-compatible low-profile tip | NIRx | SRC-FBO- LAS-LOW | 10 m long |
| Bundle set of 8 short-channel detectors with specialized ring grommets that fit to low-profile grommets | NIRx | DET-SHRT-SET | Splits a single detector into 8 short channels that may be placed anywhere on a single NIRS cap |
| Magnetom 3T PRISMA | Siemens | N/A | 128 channel capacity, 64/32/20 channel head coils, 80 mT/m max gradient amplitude, 200 T/m/s slew rate, full neuro sequences |
| NIRScout XP Core System Unit | NIRx | NSXP- CHS | Up to 64x Laser-2 (or 32x laser-4) illuminators or 64 LED-2 illuminators; up to 32x detectors; capable of tandem (multi-system) and hyperscanning (multi-subject) measurements; compatible with EEG, tDCS, eye-tracking, and other modalities; modules available for fMRI, TMS, MEG compatibility |
| NIRStar software | NIRx | N/A | Version 15.3 |
| NIRx parallel port replicator | NIRx | ACC-LPT-REP | The parallel prot replicator comes with three components: parallel port replicator box, USB power cable and BNC adapter |
| Physiological pulse unit | Siemens | PPU098 | Optical plethysmography allowing the acquisiton of the cardiac rhythm. |
| Respiratory unit | Siemens | PERU098 | Unit intended for the acquisition of the respiratory amplitude (by means of a pneumatic system and a restraint belt). |
| Structure Sensor Mark II | Occipital | 101866 (SN) | 3D structure sensor for optode digitization. |
参考文献
- Pinti, P., et al. The present and future use of functional near-infrared spectroscopy (fNIRS) for cognitive neuroscience. Annals of the New York Academy of Sciences. 1464 (1), 5-29 (2020).
- Quaresima, V., Ferrari, M. Functional Near-Infrared Spectroscopy (fNIRS) for Assessing Cerebral Cortex Function During Human Behavior in Natural/Social Situations: A Concise Review. Organizational Research Methods. 22 (1), 46-68 (2016).
- Pinti, P., et al. A Review on the Use of Wearable Functional Near-Infrared Spectroscopy in Naturalistic Environments. The Japanese Psychological Research. 60 (4), 347-373 (2018).
- Wilcox, T., Biondi, M. fNIRS in the developmental sciences. Wiley Interdisciplinary Reviews: Cognitive Science. 6 (3), 263-283 (2015).
- Blasi, A., Lloyd-Fox, S., Katus, L., Elwell, C. E. fNIRS for Tracking Brain Development in the Context of Global Health Projects. Photonics. 6 (3), 89(2019).
- Aslin, R. N. Questioning the questions that have been asked about the infant brain using near-infrared spectroscopy. Cognitive Neuropsychology. (1-2), 7-33 (2012).
- Chen, W. L., et al. Functional Near-Infrared Spectroscopy and Its Clinical Application in the Field of Neuroscience: Advances and Future Directions. Frontiers in Neuroscience. 14, 724(2020).
- Lee, Y. J., Kim, M., Kim, J. S., Lee, Y. S., Shin, J. E. Clinical Applications of Functional Near-Infrared Spectroscopy in Children and Adolescents with Psychiatric Disorders. Journal of Child & Adolescent Psychiatry. 32 (3), 99-103 (2021).
- Bonilauri, A., Sangiuliano Intra, F., Baselli, G., Baglio, F. Assessment of fNIRS Signal Processing Pipelines: Towards Clinical Applications. Applied Sciences. 12 (1), 316(2021).
- Kleinschmidt, A., et al. Simultaneous recording of cerebral blood oxygenation changes during human brain activation by magnetic resonance imaging and near-infrared spectroscopy. Journal of Cerebral Blood Flow and Metabolism. 16 (5), 817-826 (1996).
- Strangman, G., Culver, J. P., Thompson, J. H., Boas, D. A. A Quantitative Comparison of Simultaneous BOLD fMRI and NIRS Recordings during Functional Brain Activation. NeuroImage. 17 (2), 719-731 (2002).
- Glover, G. H. Overview of functional magnetic resonance imaging. Neurosurgery Clinics of North America. 22 (2), (2011).
- Toronov, V., et al. Investigation of human brain hemodynamics by simultaneous near-infrared spectroscopy and functional magnetic resonance imaging. Medical Physics. 28 (4), 521-527 (2001).
- Huppert, T. J., Hoge, R. D., Diamond, S. G., Franceschini, M. A., Boas, D. A. A temporal comparison of BOLD, ASL, and NIRS hemodynamic responses to motor stimuli in adult humans. NeuroImage. 29 (2), 368-382 (2006).
- Cui, X., Bray, S., Bryant, D. M., Glover, G. H., Reiss, A. L. A quantitative comparison of NIRS and fMRI across multiple cognitive tasks. NeuroImage. 54 (4), 2808-2821 (2011).
- Duan, L., Zhang, Y. J., Zhu, C. Z. Quantitative comparison of resting-state functional connectivity derived from fNIRS and fMRI: a simultaneous recording study. NeuroImage. 60 (4), 2008-2018 (2012).
- Sasai, S., et al. A NIRS-fMRI study of resting state network. NeuroImage. 63 (1), 179-193 (2012).
- Noah, J. A., et al. Comparison of short-channel separation and spatial domain filtering for removal of non-neural components in functional near-infrared spectroscopy signals. Neurophotonics. 8 (1), 015004(2021).
- Wyser, D., et al. Short-channel regression in functional near-infrared spectroscopy is more effective when considering heterogeneous scalp hemodynamics. Neurophotonics. 7 (3), 035011(2020).
- Homolle, S., Oostenveld, R. Using a structured-light 3D scanner to improve EEG source modeling with more accurate electrode positions. Journal of Neuroscience Methods. 326, 108378(2019).
- Jasper, H. H. The ten-twenty electrode system of the International Federation. Electroencephalography and Clinical Neurophysiology. 10, 370-375 (1958).
- von Luhmann, A., Li, X., Muller, K. R., Boas, D. A., Yucel, M. A. Improved physiological noise regression in fNIRS: A multimodal extension of the General Linear Model using temporally embedded Canonical Correlation Analysis. NeuroImage. 208, 116472(2020).
- Glasser, M. F., et al. The minimal preprocessing pipelines for the Human Connectome Project. NeuroImage. 80, 105-124 (2013).
- Ji, J. L., et al. QuNex-An integrative platform for reproducible neuroimaging analytics. Frontiers in Neuroinformation. 17, 1104508(2023).
- Yucel, M. A., et al. Best practices for fNIRS publications. Neurophotonics. 8 (1), 012101(2021).
- Eggebrecht, A., Muccigrosso, D., Culver, J. NeuroDOT: an extensible Matlab toolbox for streamlined optical brain mapping. Diffuse Optical Spectroscopy and Imaging VII. , (2019).
- Jenkinson, M., Beckmann, C. F., Behrens, T. W., Woolrich, M. W., Smith, S. M. FSL. NeuroImage. 62 (2), 782-790 (2012).
- Fischl, B. FreeSurfer. NeuroImage. 62 (2), 774-781 (2012).
- Penny, W. D., Friston, K. J., Ashburner, J. T., Kiebel, S. J., Nichols, T. E. Statistical parametric mapping: the analysis of functional brain images. , Academic Press, Elsevier. (2011).
- Cox, R. W. AFNI: software for analysis and visualization of functional magnetic resonance neuroimages. Computers and Biomedical Research. 29 (3), 162-173 (1996).
- Oostenveld, R., Fries, P., Maris, E., Schoffelen, J. M. FieldTrip: Open source software for advanced analysis of MEG, EEG, and invasive electrophysiological data. Computational Intelligence and Neuroscience. 2011, 156869(2011).
- Sato, H., et al. A NIRS-fMRI investigation of prefrontal cortex activity during a working memory task. NeuroImage. 83, 158-173 (2013).
- Jermyn, M., et al. Fast segmentation and high-quality three-dimensional volume mesh creation from medical images for diffuse optical tomography. Journal of Biomedical Optics. 18 (8), 86007(2013).
- Dehghani, H., et al. Near infrared optical tomography using NIRFAST: Algorithm for numerical model and image reconstruction. Communications in Numerical Methods in Engineering. 25 (6), 711-732 (2008).
- Wheelock, M. D., Culver, J. P., Eggebrecht, A. T. High-density diffuse optical tomography for imaging human brain function. The Review of Scientific Instruments. 90 (5), 051101(2019).
- Eggebrecht, A. T., et al. A quantitative spatial comparison of high-density diffuse optical tomography and fMRI cortical mapping. NeuroImage. 61 (4), 1120-1128 (2012).
- Boas, D. A., Culver, J. P., Stott, J. J., Dunn, A. K. Three dimensional Monte Carlo code for photon migration through complex heterogeneous media including the adult human head. Optics Express. 10 (3), 159-170 (2002).
- Wang, L., Jacques, S. L., Zheng, L. MCML-Monte Carlo modeling of light transport in multi-layered tissues. Computer Methods and Programs in Biomedicine. 47 (2), 131-146 (1995).
- Gregg, N. M., White, B. R., Zeff, B. W., Berger, A. J., Culver, J. P. Brain specificity of diffuse optical imaging: improvements from superficial signal regression and tomography. Frontiers in Neuroenergetics. 2, 14(2010).
- Brigadoi, S., et al. Motion artifacts in functional near-infrared spectroscopy: a comparison of motion correction techniques applied to real cognitive data. NeuroImage. 85, 181-191 (2014).
- Pelphrey, K. A., Shultz, S., Hudac, C. M., Vander Wyk, B. C. Research review: Constraining heterogeneity: the social brain and its development in autism spectrum disorder. Journal of Child Psychology and Psychiatry, and Allied Disciplines. 52 (6), 631-644 (2011).
- Cui, X., Bray, S., Reiss, A. L. Functional near infrared spectroscopy (NIRS) signal improvement based on negative correlation between oxygenated and deoxygenated hemoglobin dynamics. NeuroImage. 49 (4), 3039-3046 (2010).
- Sherafati, A., et al. Global motion detection and censoring in high-density diffuse optical tomography. Human Brain Mapping. 41 (14), 4093-4112 (2020).
- Eggebrecht, A. T., et al. Mapping distributed brain function and networks with diffuse optical tomography. Nature Photonics. 8 (6), 448-454 (2014).
- Ferradal, S. L., et al. Functional Imaging of the Developing Brain at the Bedside Using Diffuse Optical Tomography. Cerebral Cortex. 26 (4), 1558-1568 (2016).
- Winkler, A. M., Ridgway, G. R., Webster, M. A., Smith, S. M., Nichols, T. E. Permutation inference for the general linear model. NeuroImage. 92, 381-397 (2014).
- Hassanpour, M. S., et al. Statistical analysis of high density diffuse optical tomography. NeuroImage. 85, 104-106 (2014).
- Zhang, F., et al. Correcting physiological noise in whole-head functional near-infrared spectroscopy. Journal of Neuroscience Methods. 360, 109262(2021).
- Duan, L., et al. Wavelet-based method for removing global physiological noise in functional near-infrared spectroscopy. Biomedical Optics Express. 9 (8), 3805-3820 (2018).
- Klein, F., Kranczioch, C. Signal Processing in fNIRS: A Case for the Removal of Systemic Activity for Single Trial Data. Frontiers in Human Neuroscience. 13, 331(2019).
- Zhou, X., Sobczak, G., McKay, C. M., Litovsky, R. Y. Comparing fNIRS signal qualities between approaches with and without short channels. PLoS One. 15 (12), 0244186(2020).
- Santosa, H., Zhai, X., Fishburn, F., Sparto, P. J., Huppert, T. J. Quantitative comparison of correction techniques for removing systemic physiological signal in functional near-infrared spectroscopy studies. Neurophotonics. 7 (3), 035009(2020).
- Emberson, L. L., Crosswhite, S. L., Goodwin, J. R., Berger, A. J., Aslin, R. N. Isolating the effects of surface vasculature in infant neuroimaging using short-distance optical channels: a combination of local and global effects. Neurophotonics. 3 (3), 031406(2016).
- Frijia, E. M., et al. Functional imaging of the developing brain with wearable high-density diffuse optical tomography: A new benchmark for infant neuroimaging outside the scanner environment. NeuroImage. 225, 117490(2021).
- Brigadoi, S., Cooper, R. J. How short is short? Optimum source-detector distance for short-separation channels in functional near-infrared spectroscopy. Neurophotonics. 2 (2), 025005(2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved