Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Optimización del procesamiento de Tiebangchui con vino de cebada de las tierras altas basado en el diseño Box-Behnken combinado con el método de entropía
En este artículo
Resumen
El presente protocolo describe un método eficiente para la optimización de la tecnología de procesamiento de Tiebangchui procesado con vino de cebada de tierras altas basado en una superficie de respuesta de diseño Box-Behnken combinada con el método de entropía.
Resumen
El procesamiento de etnomedicinas tóxicas es de gran importancia para su aplicación clínica segura. Por lo tanto, se deben abordar las limitaciones del procesamiento tradicional, y el método de procesamiento de etnomedicinas debe estandarizarse utilizando métodos de investigación modernos. En este estudio, se optimizó la tecnología de procesamiento de una medicina tibetana de uso común Tiebangchui (TBC), la raíz seca de Aconitum pendulum Busch, procesada con vino de cebada de las tierras altas. El contenido de alcaloide diéster-diterpenoide (DDA) (aconitina, 3-deoxiaconitina, 3-acetilaconitina) y alcaloide monoéster-diterpenoide (MDA) (benzoilaconina) se utilizaron como indicadores de evaluación, y el coeficiente de peso de cada índice de evaluación se determinó por el método de entropía.
La prueba de un solo factor y el diseño de Box-Behnken se utilizaron para investigar la influencia de la relación entre el vino de cebada de las tierras altas y el TBC, el grosor de la rebanada de TBC y el tiempo de procesamiento. La puntuación integral se realizó de acuerdo con el peso objetivo de cada índice determinado por el método de entropía. Las condiciones óptimas de procesamiento de TBC con vino de cebada de tierras altas fueron las siguientes: la cantidad de vino de cebada de tierras altas es cinco veces mayor que la de TBC, un tiempo de remojo de 24 h y un espesor de TBC de 1,5 cm. Los resultados mostraron que la desviación estándar relativa entre la prueba de verificación y el valor previsto fue inferior al 2,55% y la tecnología de procesamiento optimizada de TBC procesado con vino de cebada de tierras altas es simple, factible y estable, por lo que puede proporcionar una referencia para la producción industrial.
Introducción
Tiebangchui (TBC), la raíz seca de Aconitum pendulum Busch, es una medicina tibetana bien conocida y fue registrada inicialmente en el clásico libro de medicina tibetana "Cuatro Tantra Médicos"1,2. De acuerdo con las "Normas de medicamentos del Ministerio de Salud de la República Popular China (Medicina Tibetana)", TBC es eficaz para expulsar el frío, aliviar el dolor, disipar el viento y calmar el shock, y se usa comúnmente para tratar la artritis reumatoide en clínicas 3,4,5.
TBC contiene principalmente alcaloides, incluyendo alcaloides diésteres-diterpenoides (DDA) altamente tóxicos, y los alcaloides monoéster-diterpenoides (MDA) moderadamente tóxicos6,7,8. Estos componentes químicos son ingredientes activos con efectos medicinales pero son tóxicos. Uno de los ingredientes activos y tóxicos más famosos, la aconitina, causa envenenamiento cuando supera 1 mg9. Por lo tanto, el uso inadecuado o excesivo de TBC puede resultar en envenenamiento e incluso muerte, y la atenuación de toxicidad y la reserva de eficacia de TBC es crucial para su aplicación clínica segura10,11.
El procesamiento es un método eficaz para desintoxicar TBC. Según los antiguos libros de medicina tibetana, el procesamiento con vino de cebada de las tierras altas es una forma eficiente de atenuar la toxicidad y preservar la eficacia de TBC. TBC se remoja en vino de cebada de las tierras altas, se almacena durante una noche, se seca y se agrega a los medicamentos12. Sin embargo, la tecnología de procesamiento específica y los posibles factores de influencia rara vez se informan, y el proceso de procesamiento tradicional a menudo se basa en la experiencia y carece de métodos estandarizados. Por lo tanto, se necesitan métodos científicos y tecnológicos modernos para optimizar y estandarizar el proceso de procesamiento.
El método de diseño de Box-Behnken se utiliza para investigar las interacciones entre diferentes factores y su influencia en la puntuación integral a través del ajuste polinómico cuadrático. Este diseño permite la observación intuitiva de las condiciones óptimas y ha sido ampliamente utilizado en el campo de la farmacia13. Por ejemplo, el método de diseño Box-Behnken, basado en el método de entropía, optimizó con éxito la tecnología de procesamiento de salteado con vinagre de Curcuma Longa Radix14. En este estudio, el diseño experimental de superficie de respuesta de Box-Behnken combinado con el método de entropía se utilizó para optimizar la tecnología de procesamiento de TBC procesado con vino de cebada de tierras altas. Se espera que la tecnología de procesamiento optimizada garantice el control de calidad y el uso clínico seguro.
Protocolo
En este estudio, la tecnología de procesamiento de TBC procesado con vino de cebada de tierras altas se optimizó con un diseño de Box-Behnken combinado con el método de entropía. El contenido de DDA y MDA se utilizó como indicadores de evaluación, y el coeficiente de peso de cada índice de evaluación se determinó por el método de entropía.
1. Preparación experimental
- Preparar vino de cebada de las tierras altas15.
- Tome 500.00 g de arroz de cebada negra de las tierras altas y agregue cinco veces la cantidad de agua. Cocine el arroz hasta que se absorba el agua restante (~2 h). Verterlo, esperar hasta que la temperatura descienda a 37 ° C, agregar 4 g de Jiuqu (ver Tabla de materiales), mezclar bien, sellar la lata, envolver el recipiente con algodón y dejar guisar durante 7 días.
- Añadir 300 ml de agua en el 7º día y sellar de nuevo. En el día 8, comience a quitar el vino y reemplácelo con 300 ml de agua después. Sellar y fermentar durante 1 día, tomar el vino y agregar 300 ml de agua nuevamente. Repita este procedimiento tres veces y combine los licores.
- Llevar a ebullición, luego reducir el fuego a fuego lento y continuar cocinando hasta que se absorba el agua restante.
- Para preparar productos procesados, pese con precisión el TBC en un recipiente, agregue vino de cebada de las tierras altas y remoje durante 1 día. Luego, seque en un horno de secado eléctrico a temperatura constante.
NOTA: La temperatura de secado debe ser inferior a 40 °C para evitar cambios en la composición del alcaloide. - Prepare la solución de muestra de prueba.
- Pesar con precisión el polvo del producto procesado TBC (2 g) en un matraz cónico, añadir una solución de amoníaco al 40% y realizar la extracción asistida por ultrasonido con disolventes mezclados de isopropanol-acetato de etilo (1:1) (50 ml) (potencia: 200 W; frecuencia: 40 kHz; temperatura: 40 °C) durante 30 min.
NOTA: Para preparar una solución de amoníaco al 40%, transferir 40 ml de amoníaco a un matraz aforado de 100 ml y luego diluir con agua pura. - Ajustar la solución extraída al peso original añadiendo una mezcla de isopropanol-acetato de etilo (1:1 v/v).
- Transferir con precisión la solución extraída (25 ml) a un matraz de fondo redondo para la recuperación del disolvente a presión reducida hasta que se seque.
- Finalmente, transferir la solución de ácido clorhídrico-metanol al 0,05% para disolver el residuo de la etapa 1.3.3 en un matraz aforado de 5 ml y diluir con una solución de clorhidrato de metanol al 0,05%. Filtrar la solución a través de un filtro de membrana microporosa de 0,22 μm antes de inyectarla en los sistemas de cromatografía líquida de alta resolución (HPLC).
NOTA: Prepare el clorhidrato de metanol al 0,05% de ácido añadiendo 0,05 ml de ácido clorhídrico a un matraz aforado de 100 ml y, a continuación, diluya con metanol.
- Pesar con precisión el polvo del producto procesado TBC (2 g) en un matraz cónico, añadir una solución de amoníaco al 40% y realizar la extracción asistida por ultrasonido con disolventes mezclados de isopropanol-acetato de etilo (1:1) (50 ml) (potencia: 200 W; frecuencia: 40 kHz; temperatura: 40 °C) durante 30 min.
- Preparar una solución patrón pesando 5,18 mg de benzoilaconina, 13,13 mg de aconitina, 10,05 mg de 3-deoxiaconitina y 10,09 mg de 3-acetilaconitina con precisión, y luego colocar los sólidos en un matraz aforado de 5 ml individualmente. Diluir con solución de clorhidrato de metanol al 0,05%.
2. Estado cromatográfico
- Configure las condiciones cromatográficas como se muestra en la Tabla 1 para HPLC. Los detalles de los instrumentos utilizados se proporcionan en la Tabla de materiales.
3. Prueba de adaptabilidad del sistema
- Rango de linealidad
NOTA: Primero, utilizamos HPLC para determinar las áreas pico de benzoilaconitina, aconitina, 3-deoxiaconitina y 3-acetilacoconitina en la muestra, y luego determinamos aleatoriamente el área pico de una concentración conocida de solución estándar. A continuación, comparamos la diferencia entre dos áreas pico (solución de muestra y solución estándar) para estimar la concentración de benzoilaconitina, aconitina, 3-deoxiaconitina y 3-acetilaconitina en diferentes muestras, y luego ajustamos la solución estándar en un rango lineal para incluir la concentración de la muestra en la curva. Las concentraciones de la curva estándar se muestran en la Tabla 2.- Preparar soluciones de referencia de benzoilacoconitina que contengan 1.036 mg/mL, 0.518 mg/mL, 0.2072 mg/mL, 0.1036 mg/mL y 0.0518 mg/mL.
- Preparar soluciones de referencia de aconitina que contengan 1,313 mg/ml, 0,5252 mg/ml, 0,2626 mg/ml, 0,1313 mg/ml y 0,05252 mg/ml.
- Preparar soluciones de referencia de 3-desoxiaconitina que contengan 1.005 mg/mL, 0.5025 mg/mL, 0.201 mg/mL, 0.1005 mg/mL y 0.402 mg/mL.
- Prepare soluciones de referencia de 3-acetilaconitina que contengan 0.2018 mg/mL, 0.1009 mg/mL, 0.04036 mg/mL, 0.02018 mg/mL y 0.01009 mg/mL.
- Investigue la linealidad de cada compuesto trazando el área pico frente a la concentración de inyección.
- Para realizar la prueba de precisión, inyecte 10 μL de cada solución de referencia en el sistema de HPLC seis veces al día y emplee las mismas condiciones de HPLC descritas en el paso 2.1 para ejecutar las muestras. Registre el área pico de cada componente.
- Realizar pruebas de estabilidad intradía inyectando 10 μL de la solución de muestra preparada a través del paso 1.3 y determinar las áreas pico después de 0 h, 2 h, 4 h, 8 h, 14 h, 12 h y 24 h16.
- Realice una prueba de reproducibilidad tomando seis muestras del mismo lote de TBC para preparar la solución de muestra de prueba, de acuerdo con el paso 1.3. Inyecte 10 μL de cada muestra en el sistema de HPLC y ejecute las muestras como se describe en el paso 2.1.
- Realice la prueba de recuperación para evaluar la precisión del método. Añadir el 100% de la solución patrón de cada componente índice (benzoilaconitina, aconitina, 3-deoxiaconitina y 3-acetilaconitina) en la solución de ensayo para calcular la tasa de recuperación, respectivamente. Por ejemplo, como el contenido de benzoilalaconitina es de 0,1524 mg/ml en la muestra TBC, pese con precisión 0,1524 mg de patrones de benzoillaconitina y agréguelos a la muestra de TBC, luego prepare la solución de muestra de prueba de acuerdo con el paso 1.3. Ejecute estos ejemplos con las mismas condiciones de HPLC descritas en el paso 2.1. Calcula la tasa de recuperación usando la Ecuación (1):
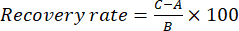 (1)
(1)
Aquí, A es la cantidad de componente (benzoilaconitina, aconitina, 3-deoxiaconitina o 3-acetilaconitina) que debe medirse en la solución de muestra, B es la cantidad de patrón añadido (benzoilaconitina, aconitina, 3-deoxiaconitina o 3-acetilaconitina), y C es el valor medido de la solución que contiene la solución patrón y la solución de muestra (ver Tabla 3). Consulte el paso 2.1 para conocer las condiciones cromatográficas para realizar los pasos anteriores. La tasa de recuperación refleja el grado de pérdida del componente objetivo (benzoilaconitina, aconitina, 3-deoxiaconitina o 3-acetilaconitina) durante el análisis de la muestra; Cuanto mayor sea la tasa de recuperación, menor será la pérdida del componente objetivo.
4. Prueba de factor único de TBC procesado con vino de cebada de tierras altas
NOTA: La relación entre el vino de cebada de tierras altas y TBC, el grosor de la rodaja de TBC y el tiempo de remojo afectarán la disolución de componentes más tóxicos (aconitina, 3-deoxiaconitina y 3-acetilaconitina) en TBC durante el TBC procesado con vino de cebada de tierras altas17. La prueba de un solo factor y el diseño de Box-Behnken se utilizaron para investigar la influencia de la proporción de vino de cebada de tierras altas a TBC, el grosor de la rebanada de TBC y el tiempo de remojo.
- Realice la prueba de adición de vino de cebada de las tierras altas (A) configurando cinco grupos de pruebas, cada una con 30 g de TBC, donde la cantidad de vino de cebada de las tierras altas es dos, tres, cuatro, cinco y seis veces la cantidad de TBC en la receta. El tiempo de remojo es de 12 h, y las rodajas tienen un grosor de1,0 cm 18.
NOTA: Cada grupo de la misma prueba de condición debe procesarse en tres grupos paralelos. - Realice la prueba del tiempo de remojo (B) configurando cinco grupos de pruebas, cada una con 30 g de TBC. Los tiempos de remojo son 12 h, 24 h, 36 h y 48 h. La cantidad de vino de cebada de las tierras altas es cinco veces mayor que la de TBC, y las rebanadas tienen un grosor de 1.0 cm19.
NOTA: Cada grupo del mismo experimento de condición debe procesarse en tres grupos paralelos. - Realice la prueba de espesor de corte (C) configurando cinco grupos de pruebas, cada una con 30 g de TBC. Las rodajas tienen 0.5, 1.0, 1.5, 2.0 y 2.5 cm de espesor, el tiempo de remojo es de 24 h y la cantidad de vino de cebada de las tierras altas es cinco veces mayor que la de TBC20.
NOTA: Cada grupo del mismo experimento de condición debe procesarse en tres grupos paralelos. - Pesar con precisión los productos procesados para cada grupo de prueba para preparar la solución de muestra de prueba de acuerdo con el paso 1.3. Determine el área pico de cada muestra mediante HPLC y utilice la curva estándar para estimar las cantidades de MDA y DDA. En la curva estándar, y es el área del pico y x es el contenido. El contenido de MDA es benzoilaconitina, y el contenido de DDA es la suma de aconitina, 3-deoxiaconitina y 3-acetilaconitina.
- Utilice el contenido total de los DDA y el contenido de los MDA como indicadores de evaluación, y determine el coeficiente de ponderación de cada índice de evaluación y la puntuación integral mediante el método de entropía (sección 5).
PRECAUCIÓN: TBC es tóxico y, por lo tanto, se deben tomar medidas de protección durante el procesamiento.
5. Método de entropía para calcular la puntuación integral
NOTA: Utilizamos los datos experimentales de la prueba de espesor de corte en la prueba de factor único como ejemplo para ilustrar el proceso de cálculo en detalle. Utilizamos el área pico de los componentes en cada muestra en la Tabla Suplementaria S1 y la curva estándar en la Tabla 2 para calcular el contenido de MDA y DDA (ver Tabla Suplementaria S2). En la ecuación lineal, y es el área del pico y x es el contenido. En este estudio, el MDA moderadamente tóxico (benzoilaconitina) se utilizó como indicador positivo, y el contenido total de DDA (aconitina, 3-desoxiaconitina y 3-acetilaconitina) con alta toxicidad se utilizó como indicador negativo. El contenido de MDA es benzoilaconitina, y el contenido de DDA es la suma de aconitina, 3-deoxiaconitina y 3-acetilaconitina. Cada muestra tiene dos indicadores de evaluación: i = 1,2,...,n y j = 1,2,... m21.
- Utilice la ecuación (2) para estandarizar el contenido de MDA22.
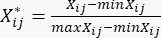 (2)
(2)
Así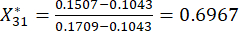
NOTA: Xij es el valor del indicador j-ésimo de la i-ésima muestra. Xij* es el valor estandarizado de Xij. Por ejemplo, i = 3 y j = 1, X31 representa el valor del primer indicador de la tercera muestra, y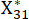 es el valor estandarizado del primer indicador de la tercera muestra.
es el valor estandarizado del primer indicador de la tercera muestra. 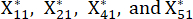 se muestran en la Tabla Suplementaria S3.
se muestran en la Tabla Suplementaria S3. - Utilice la ecuación (3) para estandarizar el contenido total de los PDD23.
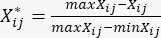 (3)
(3)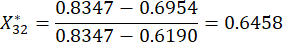
NOTA: Aquí, i = 3, j = 2, representa el segundo indicador de la tercera muestra.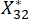 es el valor estandarizado del segundo indicador de la tercera muestra.
es el valor estandarizado del segundo indicador de la tercera muestra. 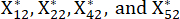 se muestran en el cuadro suplementario S3.
se muestran en el cuadro suplementario S3. - Utilice las ecuaciones (4) y (5) para definir el valor de entropía (Hj) de cada indicador23.
- Calcule la probabilidad del ensayo j-ésimo bajo el i-ésimo indicador de evaluación Pij usando la ecuación (4).
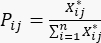 (4)
(4)
Para el número 3,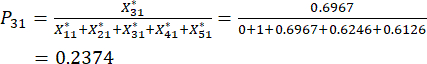
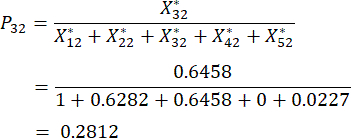
NOTA: Los valores de probabilidad para el primer indicador y el segundo indicador de la tercera muestra son 0,2374 y 0,2812, respectivamente.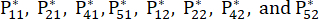 se muestran en el cuadro suplementario S3.
se muestran en el cuadro suplementario S3. - Calcular la entropía de información Hj.
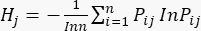 (5)
(5)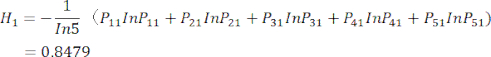
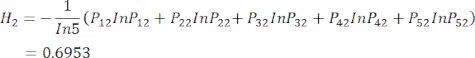
NOTA: H 1 es la entropía del primer indicador (MDA) y H2 es la entropía del segundo indicador (DDA) en la prueba de espesor de corte.
- Calcule la probabilidad del ensayo j-ésimo bajo el i-ésimo indicador de evaluación Pij usando la ecuación (4).
- Utilice la ecuación (6) para calcular las ponderaciones del indicador (Wj)23.
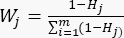 (6)
(6)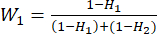 = 33,3%
= 33,3% = 66,7%
= 66,7%
NOTA: Wjes el coeficiente de peso de cada indicador. En la prueba de espesor de corte, el coeficiente de peso del indicador positivo (MDA) y el indicador negativo (DDA) son 33.3% y 66.7%, respectivamente. - Utilice la ecuación (7) para calcular la puntuación completa de los indicadores23.
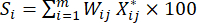 (7)
(7)
Para el número 3,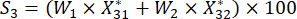
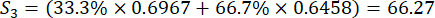
NOTA: Si es la puntuación completa de cada muestra. Necesitamos obtener la puntuación más alta como punto central en el diseño de Box-Behnken. S 1, S 2, S 3, S 4 y S5 figuran en el cuadro suplementario S3.
6. Diseño Box-Behnken
- A través de la prueba de factor único, use la condición con la puntuación integral más alta (consulte la Tabla 4, la Tabla 5, la Tabla 6 y la Figura 2) como punto central de la superficie de respuesta. Utilice la cantidad de vino de cebada de tierras altas (A), el tiempo de remojo (B) y el grosor de la rebanada de TBC (C) como factores influyentes y la puntuación integral como valor de respuesta24.
NOTA: Con base en los datos de un solo factor en la Tabla 4, Tabla 5 y Tabla 6, la puntuación integral más alta se calcula mediante las ecuaciones (2), (3), (4), (5), (6) y (7) en la sección 5, y se obtiene el mejor punto. La cantidad de vino de cebada de las tierras altas fue cinco veces mayor que la de TBC, el tiempo de remojo fue de 36 h y el grosor del corte fue de 1,0 cm.
7. Pasos de operación del software de diseño Box-Behnken
- Abra el software (consulte Tabla de materiales) y seleccione Nuevo diseño | Diseño de Box-Behnken (véase el paso 5.1; Expediente complementario 1).
- Introduzca el número de factores influyentes e introduzca la información de nivel (tres niveles tres factores; véase la Tabla 7). El diseño de Box-Behnken se compone de 17 experimentos en este estudio. Por último, haga clic en Continuar (consulte el paso 5.2; Expediente complementario 1).
- Establezca la puntuación completa (Y) por las ecuaciones (2), (3), (4), (5), (6) y (7) en la sección 5 como respuesta. Introduzca el número de valores de respuesta (la imagen muestra solo un valor de respuesta) y haga clic en Finalizar (consulte el paso 5.3; Expediente complementario 1).
- Procesar el TBC con vino de cebada de tierras altas de acuerdo con los resultados del diseño y completar el experimento basado en los 17 escenarios diseñados para la superficie de respuesta.
- Prepare las soluciones de ejemplo siguiendo el paso 1.3 y calcule el contenido total de los MDA y DDA por el sistema HPLC.
- Calcule la puntuación completa para cada grupo mediante las ecuaciones (2), (3), (4), (5), (6) y (7) en el paso 5, e ingrese los resultados de la puntuación (consulte el paso 5.4; Expediente complementario 1).
- Haga clic en analizar para analizar la información de la fecha y del modelo (consulte el paso 5.4.1; Expediente complementario 1).
- Realizar validación estadística de ecuaciones polinómicas y análisis de superficie de respuesta trazados en gráficos de modelos 3D obtenidos por el software.
- Haga clic en ANOVA en el menú superior y observe la tabla de resultados.
- Haga clic en Optimización para ver las condiciones óptimas de proceso previstas (consulte el paso 5.4.2; Expediente complementario 1).
8. Prueba de validación
- De acuerdo con los resultados previstos a partir del diseño de la superficie de respuesta de Box-Behnken, en el paso 7.3, identifique la condición óptima de procesamiento de TBC. Aquí, es como sigue: TBC se remoja durante 24 h en cinco veces la cantidad de vino de cebada de las tierras altas, y el grosor del TBC es de 1,5 cm. Tome el nivel óptimo de factores influyentes como condiciones de procesamiento y configure tres conjuntos paralelos de experimentos para verificar la estabilidad de la tecnología de procesamiento.
Resultados
En este estudio, la precisión, estabilidad, repetibilidad y recuperación de muestras de TBC indicaron que el método es factible. Los cuatro componentes del índice en TBC tenían una buena relación lineal dentro de un rango de concentración específico. Los cromatogramas típicos se muestran en la Figura 1. Los resultados de las pruebas de precisión (Tabla 8) mostraron que la desviación estándar relativa (DSR) de las áreas pico fue de 2,56%, 1,49% y 2,03% para benzo...
Discusión
Como medicina tibetana de uso común con efectos tóxicos, el efecto atenuante de toxicidad del procesamiento es extremadamente importante para la aplicación clínica de TBC25. En este estudio, se optimizó la tecnología de procesamiento de TBC procesado con vino de cebada de tierras altas. Al revisar los principales principios activos y relacionar los efectos farmacológicos del TBC, encontramos que los alcaloides TBC tienen efectos antiinflamatorios y analgésicos y pueden usarse para tratar l...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue apoyado financieramente por la Fundación Nacional de Ciencias Naturales de China (No. 82130113), la Fundación de Ciencias Postdoctorales de China (No. 2021MD703800), la Fundación de Ciencias para Jóvenes del Departamento de Ciencia y Tecnología de la Provincia de Sichuan (No. 2022NSFSC1449) y el Programa de Promoción de la Investigación "Xinglin Scholars" de la Universidad de Medicina Tradicional China de Chengdu (No. BSH2021009).
Materiales
| Name | Company | Catalog Number | Comments |
| Aconitine | Chengdu Push Biotechnology Co.,Ltd | PS000905 | |
| 3-Acetylaconitine | Chengdu Push Biotechnology Co.,Ltd | PS010552 | |
| 3-Deoxyaconitine | Chengdu Push Biotechnology Co.,Ltd | PS011258 | |
| Benzoylaconine | Chengdu Push Biotechnology Co.,Ltd | PS010300 | |
| Circulating water vacuum pump | Gongyi City Yuhua Instrument Co., Ltd | SHZ-DIII | |
| Design-Expert | State-East Corporation | 8.0.6 | |
| Electric constant temperature drying oven | Shanghai Yuejin Medical Equipment Co., Ltd | 101-3-BS | |
| Electronic analytical balance | Shanghai Liangping Instruments Co., Ltd. | FA1004 | |
| High performance liquid chromatography | Shimadzu Enterprise Management (China) Co., Ltd | shimadzu 2030 | |
| Highland barley rice | Kangding City, Ganzi Tibetan Autonomous Prefecture, Sichuan Province | 20221015 | |
| Millipore filter | Tianjin Jinteng Experimental Equipment Co., Ltd | φ13 0.22 Nylon66 | |
| Rotary evaporator | Shanghai Yarong Biochemical Instrument Factory | RE-2000A | |
| Starter of liquor-making | Angel Yeast CO., Ltd | BJ22-104 | |
| Ultra pure water systemic | Merck Millipore Ltd. | Milli-Q | |
| Ultrasonic cleansing machine | Ningbo Xinyi Ultrasonic Equipment Co., Ltd | SB-8200 DTS |
Referencias
- Zhang, J., et al. Study of quality standards for Aconitum pendulum Busch. Chinese Traditional Patent Medicine. 40 (9), 2100-2103 (2018).
- Liu, X. F., et al. Study on toxicity reduction and effect preservation of the compatibility of Tibetan medicine Aconitum pendulum Busch and Terminalia chebula Retz. Pharmacy and Clinics of Chinese Materia Medica. 13 (3), 69-72 (2022).
- Luo, D. S. . Chinese Tibetan herbs. 63, (2007).
- Li, C. Y., et al. Aconitum pendulum Busch and A. flavum Hand-Mazz: A narrative review on traditional uses, phytochemistry, bioactivities and processing methods. Journal of Ethnopharmacology. 292, 115216 (2022).
- Yu, L. Q., et al. Traditional Tibetan medicine: therapeutic potential in rheumatoid arthritis. Frontiers in Pharmacology. 13, 938915 (2022).
- Zhang, Y., Fu, X. Y. UPLC Simultaneous determination of six esteric alkaloids components in Aconitum pendulum Busch. Asia-pacific Traditional Medicine. 16 (5), 62-65 (2020).
- Wang, Y. J., et al. Determination of alkaloid content in different medicinal parts of the folk medicine. Aconitum pendulum Busch. Chinese Traditional Patent Medicine. 32 (8), 1390-1393 (2010).
- Shao, C. L., Fu, J. L., Fu, S. X., Ma, H. W., Sun, X. D. Toxicity research and processing methods of Aconitum pendulum Busch. Asia-pacific Traditional Medicine. 10 (2), 32-34 (2014).
- Chan, T. Y. K. Aconite poisoning. Clinical Toxicology. 47 (4), 279-285 (2009).
- Li, S. L., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Zhao, M. Y. Study on identification and processing attenuation of Tibetan drug Bangna. Southwest Jiaotong University. , (2018).
- Tibet Autonomous Region Food and Drug Administration. . Tibetan herbal medicine concoction specification. , 135 (2008).
- Abd-El-Aziz, N. M., Hifnawy, M. S., El-Ashmawy, A. A., Lotfy, R. A., Younis, I. Y. Application of Box-Behnken design for optimization of phenolics extraction from Leontodon hispidulus in relation to its antioxidant, anti-inflammatory and cytotoxic activities. Scientific Reports. 12 (1), 8829 (2022).
- Quan, L., et al. Optimization of processing technology of stir-frying with vinegar of Curcuma Longa Radix by orthogonal design and Box-Behnken design-response surface based on entropy method. Chinese Traditional and Herbal Drugs. 49 (8), 1823-1828 (2018).
- Jia, F. C., et al. Research on the brewing technology of Tibetan traditional barley liquor based on response surface method. Food and Fermentation Industries. 45 (22), 171-178 (2019).
- Zhao, X. H., et al. Determination of osthol in different traditional Chinese medicines by HPLC. Chinese Journal of Pharmaceutics. 19 (5), 154-158 (2021).
- Feng, Z. G., et al. Processing methods and the underlying detoxification mechanisms for toxic medicinal materials used by ethnic minorities in China: A review. Journal of Ethnopharmacology. 305, 116126 (2023).
- Wang, D. M., Lu, Z. J., Wang, Y. H., Zhang, C. S. Applying grading methods of synthesizing multiple guidelines to optimizing alcohol-steam processing technology from Ploygonatum odordatum. Journal of Zhejiang A & F University. 30 (1), 100-106 (2013).
- He, N. L., Bao, M. L., Ba, G. N. Study on the best processing technology of Terminalia Decoction soaking iron. Journal of Medicine & Pharmacy of Chinese Minorities. 20 (9), 36-38 (2014).
- Liu, C., et al. Optimization of processing technology for Saposhnikoviae Radix by Box-Behnken design-response surface methodology. Chinese Journal of Experimental Traditional Medical Formulae. 20 (5), 18-21 (2014).
- Ferreira, S. L. C., et al. Box-Behnken design: an alternative for the optimization of analytical methods. Analytica Chimica Acta. 597 (2), 179-186 (2007).
- Dong, R., Lu, Y., Wang, P. The process optimization of vinegar roasting of Bupleurum chinense by entropy weight method combined with Box-Behnken response surface method and its protective effect on mice liver injury. Science and Technology of Food Industry. 42 (23), 209-217 (2021).
- Li, W. J., et al. Analysis on the times of Polygonati Rhizoma steamed by multiple times based on entropy weight and gray relative analysis method. China Journal of Traditional Chinese Medicine and Pharmacy. 36 (11), 6764-6769 (2021).
- Huang, B. J., Liu, X. T., Mao, Y. M., Qi, B., Liu, L. Response surface methodology combined with analytic hierarchy process to optimize the processing technology of Custutae semen with wine. Lishizhen Medicine and Materia Medica Research. 33 (8), 1890-1894 (2022).
- Wang, J., Meng, X. H., Chai, T., Yang, J. L., Shi, Y. P. Diterpenoid alkaloids and one lignan from the roots of Aconitum pendulum Busch. Natural Products and Bioprospecting. 9 (6), 419-423 (2019).
- Xie, H. H., et al. Metabolomics study of aconitine and benzoylaconine induced reproductive toxicity in Be Wo cell. Chinese Journal of Analytical Chemistry. 43 (12), 1808-1813 (2015).
- Han, Y. F., et al. Optimization of extraction process for Yangyin Runmu granules by Box-Behnken design based on entropy weight method-analytic hierarchy process method. Chinese Journal of Modern Applied Pharmacy. 39 (7), 896-903 (2022).
- Chen, F. G., et al. Optimization of the baked drying technology of Clinamomi Ramulus based on CRITIC combined with Box-Behnken response surface method. Journal of Chinese Medicinal Materials. 2022 (8), 1838-1842 (2022).
- Pan, Y. L. Optimization of stir-baking process of Coix lacryma-Jobi Var.Mayuen Kernel by Box-Behnken response surface methodology. Shandong Chemical Industry. 51 (14), 73-75 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados