Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Optimisation du traitement du tiebangchui avec du vin d’orge des Highlands basé sur la conception Box-Behnken combinée à la méthode d’entropie
Dans cet article
Résumé
Le présent protocole décrit une méthode efficace d’optimisation de la technologie de traitement du Tiebangchui traité avec du vin d’orge des hautes terres basé sur une surface de réponse de conception Box-Behnken combinée à la méthode d’entropie.
Résumé
Le traitement des ethnomédicaments toxiques est d’une grande importance pour leur application clinique sûre. Ainsi, les limites de la transformation traditionnelle devraient être abordées, et la méthode de traitement des ethnomédicaments devrait être normalisée en utilisant des méthodes de recherche modernes. Dans cette étude, la technologie de traitement d’un médicament tibétain couramment utilisé, Tiebangchui (TBC), la racine séchée d’Aconitum pendulum Busch, traitée avec du vin d’orge des hautes terres, a été optimisée. La teneur en alcaloïde diester-diterpénoïde (DDA) (aconitine, 3-désoxyaconitine, 3-acétylaconitine) et en alcaloïde monoester-diterpénoïde (MDA) (benzoylaconine) a été utilisée comme indicateurs d’évaluation, et le coefficient pondéral de chaque indice d’évaluation a été déterminé par la méthode de l’entropie.
Le test à facteur unique et la conception Box-Behnken ont été utilisés pour étudier l’influence du rapport entre le vin d’orge des Highlands et le TBC, l’épaisseur de la tranche de TBC et le temps de traitement. La notation complète a été effectuée en fonction du poids objectif de chaque indice déterminé par la méthode de l’entropie. Les conditions optimales de transformation du TBC avec le vin d’orge des Highlands étaient les suivantes : la quantité de vin d’orge des Highlands est cinq fois supérieure à celle du TBC, un temps de trempage de 24 h et une épaisseur TBC de 1,5 cm. Les résultats ont montré que l’écart type relatif entre l’essai de vérification et la valeur prévue était inférieur à 2,55% et que la technologie de traitement optimisée de TBC traitée avec du vin d’orge des hautes terres est simple, réalisable et stable, et peut donc fournir une référence pour la production industrielle.
Introduction
Tiebangchui (TBC), la racine séchée d’Aconitum pendulum Busch, est un médicament tibétain bien connu et a été initialement enregistré dans le livre médical tibétain classique « Four Medical Tantra"1,2. Selon les « Normes pharmaceutiques du ministère de la Santé de la République populaire de Chine (médecine tibétaine) », TBC est efficace pour expulser le froid, soulager la douleur, dissiper le vent et calmer le choc, et est couramment utilisé pour traiter la polyarthrite rhumatoïde dans les cliniques 3,4,5.
Le TBC contient principalement des alcaloïdes, y compris des alcaloïdes diester-diterpénoïdes (ADD) hautement toxiques et des alcaloïdes monoester-diterpénoïdes (MDA) modérément toxiques6,7,8. Ces composants chimiques sont des ingrédients actifs aux effets médicinaux mais toxiques. L’un des ingrédients actifs et toxiques les plus célèbres, l’aconitine, provoque une intoxication lorsqu’elle dépasse 1 mg9. Par conséquent, une utilisation inappropriée ou excessive du TBC peut entraîner un empoisonnement et même la mort, et l’atténuation de la toxicité et la réserve d’efficacité du TBC sont cruciales pour son application clinique sûre10,11.
Le traitement est une méthode efficace pour détoxifier le TBC. Selon les anciens livres de médecine tibétaine, le traitement avec du vin d’orge des hautes terres est un moyen efficace d’atténuer la toxicité et de préserver l’efficacité du TBC. TBC est trempé dans du vin d’orge des Highlands, stocké pendant une nuit, séché et ajouté aux médicaments12. Cependant, la technologie de traitement spécifique et les facteurs d’influence potentiels sont rarement signalés, et le processus de traitement traditionnel repose souvent sur l’expérience et manque de méthodes normalisées. Par conséquent, des méthodes scientifiques et technologiques modernes pour optimiser et normaliser le processus de traitement sont nécessaires.
La méthode de conception de Box-Behnken est utilisée pour étudier les interactions entre différents facteurs et leur influence sur la notation complète par ajustement polynomial quadratique. Cette conception permet l’observation intuitive des conditions optimales et a été largement utilisée dans le domaine de la pharmacie13. Par exemple, la méthode de conception Box-Behnken, basée sur la méthode d’entropie, a optimisé avec succès la technologie de traitement du sauté au vinaigre de Curcuma Longa Radix14. Dans cette étude, la conception expérimentale de la surface de réponse de Box-Behnken combinée à la méthode d’entropie a été utilisée pour optimiser la technologie de traitement du TBC traité avec du vin d’orge des hautes terres. La technologie de traitement optimisée devrait assurer le contrôle de la qualité et une utilisation clinique sûre.
Protocole
Dans cette étude, la technologie de traitement du TBC traité avec du vin d’orge des hautes terres a été optimisée avec une conception Box-Behnken combinée à la méthode d’entropie. Les teneurs en DDA et MDA ont été utilisées comme indicateurs d’évaluation, et le coefficient de pondération de chaque indice d’évaluation a été déterminé par la méthode de l’entropie.
1. Préparation expérimentale
- Préparer du vin d’orge des Highlands15.
- Prenez 500,00 g de riz noir à l’orge des hautes terres et ajoutez cinq fois plus d’eau. Cuire le riz jusqu’à ce que l’eau restante soit absorbée (~2 h). Versez-le, attendez que la température tombe à 37 °C, ajoutez 4 g de Jiuqu (voir Tableau des matières), mélangez bien, scellez la boîte, enveloppez le récipient avec du coton et laissez mijoter pendant 7 jours.
- Ajouter 300 ml d’eau le 7e jour et refermer. Le 8e jour, commencez à retirer le vin et remplacez-le par 300 ml d’eau par la suite. Sceller et fermenter pendant 1 jour, prendre le vin et ajouter à nouveau 300 ml d’eau. Répétez cette procédure trois fois et combinez les liqueurs.
- Porter à ébullition, puis réduire le feu à ébullition et poursuivre la cuisson jusqu’à ce que l’eau restante soit absorbée.
- Pour préparer les produits transformés, pesez avec précision le TBC dans un récipient, ajoutez du vin d’orge des Highlands et laissez tremper pendant 1 jour. Ensuite, sécher dans une étuve de séchage électrique à température constante.
NOTE: La température de séchage doit être inférieure à 40 ° C pour éviter les changements dans la composition des alcaloïdes. - Préparer la solution d’échantillon d’essai.
- Peser avec précision la poudre de produit traité TBC (2 g) dans une fiole conique, ajouter une solution d’ammoniac à 40 % et effectuer une extraction assistée par ultrasons avec des solvants mixtes d’acétate d’isopropanol-éthyle (1:1) (50 mL) (puissance : 200 W; fréquence : 40 kHz; température : 40 °C) pendant 30 min.
REMARQUE : Pour préparer une solution d’ammoniac à 40 %, transférer 40 mL d’ammoniac dans une fiole jaugée de 100 mL, puis diluer avec de l’eau pure. - Ajuster la solution extraite au poids initial en ajoutant un mélange isopropanol-acétate d’éthyle (1:1 v/v).
- Transférer avec précision la solution extraite (25 mL) dans une fiole à fond rond pour la récupération du solvant sous pression réduite jusqu’à séchage.
- Enfin, transvaser la solution d’acide chlorhydrique-méthanol à 0,05 % pour dissoudre le résidu de l’étape 1.3.3 dans une fiole jaugée de 5 mL et diluer avec une solution de chlorhydrate de méthanol à 0,05 %. Filtrer la solution à travers un filtre à membrane microporeuse de 0,22 μm avant l’injection dans les systèmes de chromatographie liquide haute performance (CLHP).
REMARQUE : Préparer l’acide de chlorhydrate de méthanol à 0,05 % en ajoutant 0,05 mL d’acide chlorhydrique dans une fiole jaugée de 100 mL, puis diluer avec du méthanol.
- Peser avec précision la poudre de produit traité TBC (2 g) dans une fiole conique, ajouter une solution d’ammoniac à 40 % et effectuer une extraction assistée par ultrasons avec des solvants mixtes d’acétate d’isopropanol-éthyle (1:1) (50 mL) (puissance : 200 W; fréquence : 40 kHz; température : 40 °C) pendant 30 min.
- Préparer une solution étalon en pesant 5,18 mg de benzoylaconine, 13,13 mg d’aconitine, 10,05 mg de 3-désoxyaconitine, et 10,09 mg de 3-acétylaconitine avec précision, puis placer les solides dans une fiole jaugée de 5 mL individuellement. Diluer avec une solution de chlorhydrate de méthanol à 0,05%.
2. Condition chromatographique
- Configurez les conditions chromatographiques comme indiqué dans le tableau 1 pour la CLHP. Les détails des instruments utilisés sont fournis dans le tableau des matériaux.
3. Test d’adaptabilité du système
- Gamme de linéarité
REMARQUE: Tout d’abord, nous avons utilisé la CLHP pour déterminer les zones de pic de benzoylaconitine, d’aconitine, de 3-désoxyaconitine et de 3-acétylaconitine dans l’échantillon, puis nous avons déterminé au hasard la zone de pic d’une concentration connue de solution étalon. Ensuite, nous avons comparé la différence entre deux zones de pic (solution échantillon et solution étalon) pour estimer la concentration de benzoylaconitine, d’aconitine, de 3-désoxyconitine et de 3-acétylaconitine dans différents échantillons, puis nous avons ajusté la solution standard dans une plage linéaire pour inclure la concentration de l’échantillon dans la courbe. Les concentrations de la courbe standard sont indiquées au tableau 2.- Préparer des solutions de référence de benzoylaconitine contenant 1,036 mg/mL, 0,518 mg/mL, 0,2072 mg/mL, 0,1036 mg/mL et 0,0518 mg/mL.
- Préparer des solutions de référence d’aconitine contenant 1,313 mg/mL, 0,5252 mg/mL, 0,2626 mg/mL, 0,1313 mg/mL et 0,05252 mg/mL.
- Préparer des solutions de référence de 3-désoxyaconitine contenant 1,005 mg/mL, 0,5025 mg/mL, 0,201 mg/mL, 0,1005 mg/mL et 0,402 mg/mL.
- Préparer des solutions de référence de 3-acétylaconitine contenant 0,2018 mg/mL, 0,1009 mg/mL, 0,04036 mg/mL, 0,02018 mg/mL et 0,01009 mg/mL.
- Étudier la linéarité de chaque composé en traçant la surface du pic en fonction de la concentration d’injection.
- Pour effectuer l’essai de précision, injecter 10 μL de chaque solution de référence dans le système CLHP six fois par jour et utiliser les mêmes conditions CLHP décrites à l’étape 2.1 pour exécuter les échantillons. Enregistrez la surface de pic de chaque composant.
- Effectuer un test de stabilité intrajournalier en injectant 10 μL de la solution échantillon préparée à l’étape 1.3 et déterminer les zones de pic après 0 h, 2 h, 4 h, 8 h, 14 h, 12 h et 24 h16.
- Effectuer un test de reproductibilité en prélevant six échantillons du même lot de TBC pour préparer la solution d’échantillon d’essai, conformément à l’étape 1.3. Injecter 10 μL de chaque échantillon dans le système CLHP et exécuter les échantillons comme décrit à l’étape 2.1.
- Effectuer le test de récupération pour évaluer la précision de la méthode. Ajouter 100 % de la solution étalon de chaque composant index (benzoylaconitine, aconitine, 3-désoxyaconitine et 3-acétylaconitine) dans la solution d’essai pour calculer le taux de récupération, respectivement. Par exemple, comme la teneur en benzoylaconitine est de 0,1524 mg/mL dans l’échantillon TBC, peser avec précision 0,1524 mg d’étalons de benzoylaconitine et ajouter à l’échantillon TBC, puis préparer la solution de l’échantillon d’essai conformément à l’étape 1.3. Exécutez ces échantillons avec les mêmes conditions CLHP que celles décrites à l’étape 2.1. Calculez le taux de récupération à l’aide de l’équation (1) :
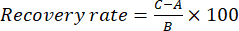 (1)
(1)
Ici, A est la quantité de composant (benzoylaconitine, aconitine, 3-désoxyconitine ou 3-acétylaconitine) à mesurer dans la solution échantillon, B est la quantité d’étalon ajouté (benzoylaconitine, aconitine, 3-désoxyaconitine, ou 3-acétylaconitine), et C est la valeur mesurée de la solution contenant la solution étalon et la solution échantillon (voir tableau 3). Reportez-vous à l’étape 2.1 pour connaître les conditions chromatographiques permettant d’effectuer les étapes ci-dessus. Le taux de récupération reflète le degré de perte du composant cible (benzoylaconitine, aconitine, 3-désoxyaconitine ou 3-acétylaconitine) lors de l’analyse de l’échantillon; Plus le taux de récupération est élevé, plus la perte de la composante cible est faible.
4. Test à facteur unique du TBC traité avec du vin d’orge des Highlands
NOTE: Le rapport entre le vin d’orge des Highlands et le TBC, l’épaisseur de la tranche de TBC et le temps de trempage affecteront la dissolution des composants plus toxiques (aconitine, 3-désoxyacontitine et 3-acétylaconitine) dans le TBC pendant le TBC traité avec du vin d’orge des Highlands17. Le test à facteur unique et la conception Box-Behnken ont été utilisés pour étudier l’influence du rapport entre le vin d’orge des hautes terres et le TBC, l’épaisseur de la tranche de TBC et le temps de trempage.
- Effectuez le test d’addition du vin d’orge des Highlands (A) en mettant en place cinq groupes de tests, chacun avec 30 g de TBC, où la quantité de vin d’orge des Highlands est deux, trois, quatre, cinq et six fois la quantité de TBC dans la recette. Le temps de trempage est de 12 h et les tranches ont une épaisseurde 1,0 cm 18.
REMARQUE : Chaque groupe d’un même test d’état doit être traité en trois groupes parallèles. - Effectuer l’essai de temps de trempage (B) en mettant en place cinq groupes d’essais, chacun avec 30 g de TBC. Les temps de trempage sont 12 h, 24 h, 36 h et 48 h. La quantité de vin d’orge des Highlands est cinq fois supérieure à celle de TBC, et les tranches ont une épaisseurde 1,0 cm 19.
Remarque : Chaque groupe de la même expérience de condition doit être traité en trois groupes parallèles. - Effectuer l’essai d’épaisseur de tranchage (C) en mettant en place cinq groupes d’essais, chacun avec 30 g de TBC. Les tranches ont une épaisseur de 0,5, 1,0, 1,5, 2,0 et 2,5 cm, le temps de trempage est de 24 h et la quantité de vin d’orge des hautes terres est cinq fois supérieure à celle de TBC20.
Remarque : Chaque groupe de la même expérience de condition doit être traité en trois groupes parallèles. - Peser avec précision les produits transformés pour chaque groupe d’essai afin de préparer la solution d’échantillon d’essai conformément à l’étape 1.3. Déterminer la surface de pic de chaque échantillon par CLHP et utiliser la courbe standard pour estimer les quantités de MDA et d’ADD. Dans la courbe standard, y est l’aire du pic et x est le contenu. La teneur en MDA est benzoyl aconitine, et la teneur en DDA est la somme de l’aconitine, de la 3-désoxyaconitine et de la 3-acétylaconitine.
- Utiliser le contenu total des ADD et le contenu des MDA comme indicateurs d’évaluation, et déterminer le coefficient de pondération de chaque indice d’évaluation et la notation complète par la méthode de l’entropie (section 5).
ATTENTION: Le TBC est toxique et des mesures de protection doivent donc être prises pendant le traitement.
5. Méthode d’entropie pour calculer la notation globale
NOTE: Nous utilisons les données expérimentales de l’essai d’épaisseur de tranchage dans le test à facteur unique comme exemple pour illustrer le processus de calcul en détail. Nous utilisons l’aire de pointe des composantes de chaque échantillon du tableau supplémentaire S1 et la courbe standard du tableau 2 pour calculer la teneur en MDA et DDA (voir le tableau supplémentaire S2). Dans l’équation linéaire, y est l’aire du pic et x est le contenu. Dans cette étude, la MDA modérément toxique (benzoylaconitine) a été utilisée comme indicateur positif, et la teneur totale en ADD (aconitine, 3-désoxyaconitine et 3-acétylaconitine) à toxicité élevée a été utilisée comme indicateur négatif. La teneur en MDA est benzoyl aconitine, et la teneur en DDA est la somme de l’aconitine, de la 3-désoxyaconitine et de la 3-acétylaconitine. Chaque échantillon comporte deux indicateurs d’évaluation : i = 1,2,...,n et j = 1,2,... m21.
- Utilisez l’équation (2) pour normaliser le contenu des MDA22.
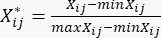 (2)
(2)
Ainsi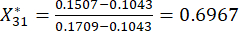
NOTE: Xij est la valeur du j-ème indicateur du i-ème échantillon. Xij* est la valeur normalisée de Xij. Par exemple, i = 3 et j = 1, X31 représente la valeur du premier indicateur du troisième échantillon et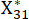 est la valeur normalisée du premier indicateur du troisième échantillon.
est la valeur normalisée du premier indicateur du troisième échantillon. 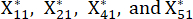 sont indiqués dans le tableau supplémentaire S3.
sont indiqués dans le tableau supplémentaire S3. - Utilisez l’équation (3) pour normaliser le contenu total des PDD23.
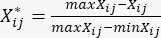 (3)
(3)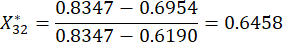
NOTE: Ici, i = 3, j = 2, représente le deuxième indicateur du troisième échantillon.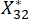 est la valeur normalisée du deuxième indicateur du troisième échantillon.
est la valeur normalisée du deuxième indicateur du troisième échantillon. 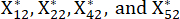 sont indiqués dans le tableau supplémentaire S3.
sont indiqués dans le tableau supplémentaire S3. - Utilisez les équations (4) et (5) pour définir la valeur d’entropie (Hj) de chaque indicateur23.
- Calculer la probabilité du j-ième essai selon le i-ème indicateur d’évaluation Pij à l’aide de l’équation (4).
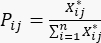 (4)
(4)
Pour le numéro 3,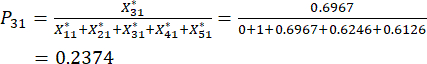
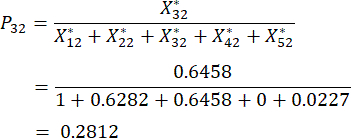
NOTE: Les valeurs de probabilité pour le premier indicateur et le deuxième indicateur du troisième échantillon sont respectivement de 0,2374 et 0,2812.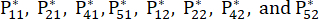 sont indiqués dans le tableau supplémentaire S3.
sont indiqués dans le tableau supplémentaire S3. - Calculer l’entropie d’information Hj.
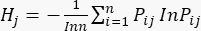 (5)
(5)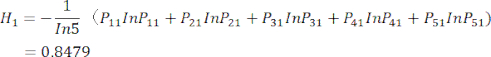
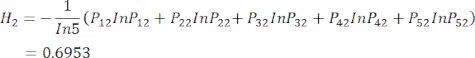
NOTE: H 1 est l’entropie du premier indicateur (MDA) et H2 est l’entropie du deuxième indicateur (DDA) dans l’essai d’épaisseur de tranchage.
- Calculer la probabilité du j-ième essai selon le i-ème indicateur d’évaluation Pij à l’aide de l’équation (4).
- Utilisez l’équation (6) pour calculer les pondérations de l’indicateur (Wj)23.
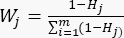 (6)
(6)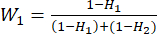 = 33,3 %
= 33,3 % = 66,7 %
= 66,7 %
NOTE: Wjest le coefficient de pondération de chaque indicateur. Dans l’essai d’épaisseur de tranchage, le coefficient de pondération de l’indicateur positif (MDA) et de l’indicateur négatif (DDA) est de 33,3 % et 66,7 %, respectivement. - Utilisez l’équation (7) pour calculer la notation complète des indicateurs23.
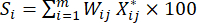 (7)
(7)
Pour le numéro 3,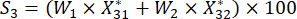
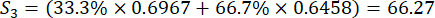
NOTE: Si est la notation complète de chaque échantillon. Nous devons obtenir le score le plus élevé en tant que point central de la conception de Box-Behnken. S 1, S 2, S 3, S 4 et S5 sont présentés dans le tableau supplémentaire S3.
6. Conception de Box-Behnken
- Grâce au test à facteur unique, utilisez la condition avec la notation globale la plus élevée (voir Tableau 4, Tableau 5, Tableau 6 et Figure 2) comme point central de la surface de réponse. Utilisez la quantité de vin d’orge des Highlands (A), le temps de trempage (B) et l’épaisseur de la tranche de TBC (C) comme facteurs d’influence et la notation complète comme valeur de réponse24.
REMARQUE : Sur la base des données à facteur unique des tableaux 4, 5 et 6, la cote globale la plus élevée est calculée au moyen des équations (2), (3), (4), (5), (6) et (7) de la section 5, et le meilleur point est obtenu. La quantité de vin d’orge des Highlands était cinq fois supérieure à celle de TBC, le temps de trempage était de 36 h et l’épaisseur de tranchage était de 1,0 cm.
7. Étapes de fonctionnement du logiciel de conception Box-Behnken
- Ouvrez le logiciel (voir Tableau des matériaux) et sélectionnez Nouveau design | Conception Box-Behnken (voir étape 5.1; Dossier supplémentaire 1).
- Entrez le nombre de facteurs d’influence et entrez l’information sur le niveau (trois niveaux-trois facteurs; voir le tableau 7). La conception de Box-Behnken est composée de 17 expériences dans cette étude. Enfin, cliquez sur Continuer (voir étape 5.2 ; Dossier supplémentaire 1).
- Définissez la notation globale (Y) par les équations (2), (3), (4), (5), (6) et (7) de la section 5 comme réponse. Entrez le nombre de valeurs de réponse (l’image n’affiche qu’une seule valeur de réponse) et cliquez sur Terminer (voir étape 5.3 ; Dossier supplémentaire 1).
- Traiter le TBC avec du vin d’orge des hautes terres selon les résultats de la conception et compléter l’expérience en fonction des 17 scénarios conçus pour la surface de réponse.
- Préparez les exemples de solutions en suivant l’étape 1.3 et calculez la teneur totale des MDA et des DDA par le système HPLC.
- Calculez la notation complète pour chaque groupe à l’aide des équations (2), (3), (4), (5), (6) et (7) à l’étape 5 et entrez les résultats du score (voir l’étape 5.4; Dossier supplémentaire 1).
- Cliquez sur Analyser pour analyser la date et les informations du modèle (voir étape 5.4.1; Dossier supplémentaire 1).
- Effectuer la validation statistique des équations polynomiales et l’analyse de surface de réponse tracées dans des diagrammes de modèles 3D obtenus par le logiciel.
- Cliquez sur ANOVA dans le menu supérieur et observez le tableau des résultats.
- Cliquez sur Optimisation pour afficher les conditions optimales de procédé prévues (voir l’étape 5.4.2 ; Dossier supplémentaire 1).
8. Test de validation
- Selon les résultats prédits à partir de la conception de la surface de réponse de Box-Behnken, à l’étape 7.3, identifier les conditions de traitement optimales du TBC. Ici, il est le suivant: TBC est trempé pendant 24 h dans cinq fois la quantité de vin d’orge des hautes terres, et l’épaisseur du TBC est de 1,5 cm. Prenez le niveau optimal de facteurs d’influence comme conditions de traitement et mettez en place trois séries parallèles d’expériences pour vérifier la stabilité de la technologie de traitement.
Résultats
Dans cette étude, la précision, la stabilité, la répétabilité et la récupération de l’échantillon de TBC ont indiqué que la méthode est réalisable. Les quatre composantes de l’indice dans TBC avaient une bonne relation linéaire à l’intérieur d’une plage de concentration spécifique. Les chromatogrammes typiques sont présentés à la figure 1. Les résultats des tests de précision (tableau 8) ont montré que l’écart-type relatif (DSR) des zones de ...
Discussion
En tant que médicament tibétain couramment utilisé avec des effets toxiques, l’effet atténuant de toxicité du traitement est extrêmement important pour l’application clinique de TBC25. Dans cette étude, la technologie de traitement de TBC traitée avec du vin d’orge des Highlands a été optimisée. En passant en revue les principaux ingrédients actifs et en reliant les effets pharmacologiques du TBC, nous avons constaté que les alcaloïdes TBC ont des effets anti-inflammatoires et ...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu financièrement par la Fondation nationale des sciences naturelles de Chine (n ° 82130113), la Fondation chinoise des sciences postdoctorales (n ° 2021MD703800), la Fondation scientifique pour les jeunes du Département des sciences et de la technologie de la province du Sichuan (n ° 2022NSFSC1449) et le programme de promotion de la recherche « Xinglin Scholars » de l’Université de médecine traditionnelle chinoise de Chengdu (No. BSH2021009).
matériels
| Name | Company | Catalog Number | Comments |
| Aconitine | Chengdu Push Biotechnology Co.,Ltd | PS000905 | |
| 3-Acetylaconitine | Chengdu Push Biotechnology Co.,Ltd | PS010552 | |
| 3-Deoxyaconitine | Chengdu Push Biotechnology Co.,Ltd | PS011258 | |
| Benzoylaconine | Chengdu Push Biotechnology Co.,Ltd | PS010300 | |
| Circulating water vacuum pump | Gongyi City Yuhua Instrument Co., Ltd | SHZ-DIII | |
| Design-Expert | State-East Corporation | 8.0.6 | |
| Electric constant temperature drying oven | Shanghai Yuejin Medical Equipment Co., Ltd | 101-3-BS | |
| Electronic analytical balance | Shanghai Liangping Instruments Co., Ltd. | FA1004 | |
| High performance liquid chromatography | Shimadzu Enterprise Management (China) Co., Ltd | shimadzu 2030 | |
| Highland barley rice | Kangding City, Ganzi Tibetan Autonomous Prefecture, Sichuan Province | 20221015 | |
| Millipore filter | Tianjin Jinteng Experimental Equipment Co., Ltd | φ13 0.22 Nylon66 | |
| Rotary evaporator | Shanghai Yarong Biochemical Instrument Factory | RE-2000A | |
| Starter of liquor-making | Angel Yeast CO., Ltd | BJ22-104 | |
| Ultra pure water systemic | Merck Millipore Ltd. | Milli-Q | |
| Ultrasonic cleansing machine | Ningbo Xinyi Ultrasonic Equipment Co., Ltd | SB-8200 DTS |
Références
- Zhang, J., et al. Study of quality standards for Aconitum pendulum Busch. Chinese Traditional Patent Medicine. 40 (9), 2100-2103 (2018).
- Liu, X. F., et al. Study on toxicity reduction and effect preservation of the compatibility of Tibetan medicine Aconitum pendulum Busch and Terminalia chebula Retz. Pharmacy and Clinics of Chinese Materia Medica. 13 (3), 69-72 (2022).
- Luo, D. S. . Chinese Tibetan herbs. 63, (2007).
- Li, C. Y., et al. Aconitum pendulum Busch and A. flavum Hand-Mazz: A narrative review on traditional uses, phytochemistry, bioactivities and processing methods. Journal of Ethnopharmacology. 292, 115216 (2022).
- Yu, L. Q., et al. Traditional Tibetan medicine: therapeutic potential in rheumatoid arthritis. Frontiers in Pharmacology. 13, 938915 (2022).
- Zhang, Y., Fu, X. Y. UPLC Simultaneous determination of six esteric alkaloids components in Aconitum pendulum Busch. Asia-pacific Traditional Medicine. 16 (5), 62-65 (2020).
- Wang, Y. J., et al. Determination of alkaloid content in different medicinal parts of the folk medicine. Aconitum pendulum Busch. Chinese Traditional Patent Medicine. 32 (8), 1390-1393 (2010).
- Shao, C. L., Fu, J. L., Fu, S. X., Ma, H. W., Sun, X. D. Toxicity research and processing methods of Aconitum pendulum Busch. Asia-pacific Traditional Medicine. 10 (2), 32-34 (2014).
- Chan, T. Y. K. Aconite poisoning. Clinical Toxicology. 47 (4), 279-285 (2009).
- Li, S. L., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115 (2022).
- Zhao, M. Y. Study on identification and processing attenuation of Tibetan drug Bangna. Southwest Jiaotong University. , (2018).
- Tibet Autonomous Region Food and Drug Administration. . Tibetan herbal medicine concoction specification. , 135 (2008).
- Abd-El-Aziz, N. M., Hifnawy, M. S., El-Ashmawy, A. A., Lotfy, R. A., Younis, I. Y. Application of Box-Behnken design for optimization of phenolics extraction from Leontodon hispidulus in relation to its antioxidant, anti-inflammatory and cytotoxic activities. Scientific Reports. 12 (1), 8829 (2022).
- Quan, L., et al. Optimization of processing technology of stir-frying with vinegar of Curcuma Longa Radix by orthogonal design and Box-Behnken design-response surface based on entropy method. Chinese Traditional and Herbal Drugs. 49 (8), 1823-1828 (2018).
- Jia, F. C., et al. Research on the brewing technology of Tibetan traditional barley liquor based on response surface method. Food and Fermentation Industries. 45 (22), 171-178 (2019).
- Zhao, X. H., et al. Determination of osthol in different traditional Chinese medicines by HPLC. Chinese Journal of Pharmaceutics. 19 (5), 154-158 (2021).
- Feng, Z. G., et al. Processing methods and the underlying detoxification mechanisms for toxic medicinal materials used by ethnic minorities in China: A review. Journal of Ethnopharmacology. 305, 116126 (2023).
- Wang, D. M., Lu, Z. J., Wang, Y. H., Zhang, C. S. Applying grading methods of synthesizing multiple guidelines to optimizing alcohol-steam processing technology from Ploygonatum odordatum. Journal of Zhejiang A & F University. 30 (1), 100-106 (2013).
- He, N. L., Bao, M. L., Ba, G. N. Study on the best processing technology of Terminalia Decoction soaking iron. Journal of Medicine & Pharmacy of Chinese Minorities. 20 (9), 36-38 (2014).
- Liu, C., et al. Optimization of processing technology for Saposhnikoviae Radix by Box-Behnken design-response surface methodology. Chinese Journal of Experimental Traditional Medical Formulae. 20 (5), 18-21 (2014).
- Ferreira, S. L. C., et al. Box-Behnken design: an alternative for the optimization of analytical methods. Analytica Chimica Acta. 597 (2), 179-186 (2007).
- Dong, R., Lu, Y., Wang, P. The process optimization of vinegar roasting of Bupleurum chinense by entropy weight method combined with Box-Behnken response surface method and its protective effect on mice liver injury. Science and Technology of Food Industry. 42 (23), 209-217 (2021).
- Li, W. J., et al. Analysis on the times of Polygonati Rhizoma steamed by multiple times based on entropy weight and gray relative analysis method. China Journal of Traditional Chinese Medicine and Pharmacy. 36 (11), 6764-6769 (2021).
- Huang, B. J., Liu, X. T., Mao, Y. M., Qi, B., Liu, L. Response surface methodology combined with analytic hierarchy process to optimize the processing technology of Custutae semen with wine. Lishizhen Medicine and Materia Medica Research. 33 (8), 1890-1894 (2022).
- Wang, J., Meng, X. H., Chai, T., Yang, J. L., Shi, Y. P. Diterpenoid alkaloids and one lignan from the roots of Aconitum pendulum Busch. Natural Products and Bioprospecting. 9 (6), 419-423 (2019).
- Xie, H. H., et al. Metabolomics study of aconitine and benzoylaconine induced reproductive toxicity in Be Wo cell. Chinese Journal of Analytical Chemistry. 43 (12), 1808-1813 (2015).
- Han, Y. F., et al. Optimization of extraction process for Yangyin Runmu granules by Box-Behnken design based on entropy weight method-analytic hierarchy process method. Chinese Journal of Modern Applied Pharmacy. 39 (7), 896-903 (2022).
- Chen, F. G., et al. Optimization of the baked drying technology of Clinamomi Ramulus based on CRITIC combined with Box-Behnken response surface method. Journal of Chinese Medicinal Materials. 2022 (8), 1838-1842 (2022).
- Pan, Y. L. Optimization of stir-baking process of Coix lacryma-Jobi Var.Mayuen Kernel by Box-Behnken response surface methodology. Shandong Chemical Industry. 51 (14), 73-75 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon