Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes en vivo de la recepción del tubo polínico de Arabidopsis y la doble fertilización utilizando el método semi-in vitro cum septum
En este artículo
Resumen
Aquí, describimos una mejora del método semi-in vitro (SIV) para observar la guía y recepción del tubo polínico en Arabidopsis thaliana, lo que aumenta la receptividad de los óvulos. El método SIV cum septum de alto rendimiento puede combinarse con líneas marcadoras de gametofitos y biosensores codificados genéticamente para monitorear el proceso dinámico de fertilización.
Resumen
En las plantas con flores, el crecimiento y la guía del tubo polínico (gametofito masculino) dentro del pistilo y la recepción del tubo polínico por el gametofito hembra son esenciales para la doble fertilización y el posterior desarrollo de la semilla. Las interacciones entre los gametofitos masculinos y femeninos durante la recepción del tubo polínico culminan en la ruptura del tubo polínico y la liberación de dos espermatozoides para efectuar una doble fertilización. Como el crecimiento del tubo polínico y la doble fertilización están profundamente ocultos dentro de los tejidos de la flor, este proceso es difícil de observar in vivo.
En varias investigaciones se ha desarrollado e implementado un método semi-in vitro (SIV) para la obtención de imágenes de células vivas de fertilización en la planta modelo Arabidopsis thaliana . Estos estudios han ayudado a dilucidar las características fundamentales de cómo se produce el proceso de fertilización en las plantas con flores y qué cambios celulares y moleculares se producen durante la interacción de los gametofitos masculinos y femeninos. Sin embargo, debido a que estos experimentos de imágenes de células vivas implican la escisión de óvulos individuales, están limitados a un bajo número de observaciones por sesión de imágenes, lo que hace que este enfoque sea tedioso y lleve mucho tiempo. Entre otras dificultades técnicas, a menudo se informa de un fallo de los tubos polínicos para fertilizar los óvulos in vitro , lo que confunde gravemente tales análisis.
Aquí, se proporciona un protocolo de video detallado para la obtención de imágenes de la recepción y fertilización del tubo polínico de manera automatizada y de alto rendimiento, lo que permite hasta 40 observaciones de la recepción y ruptura del tubo polínico por sesión de imágenes. Junto con el uso de biosensores codificados genéticamente y líneas marcadoras, este método permite la generación de grandes tamaños de muestra con una inversión de tiempo reducida. Los matices y puntos críticos de la técnica, incluida la estadificación floral, la disección, la preparación del medio y las imágenes, se detallan claramente en formato de video para facilitar futuras investigaciones sobre la dinámica de la guía, recepción y doble fertilización del tubo polínico.
Introducción
La generación de descendencia genéticamente única en organismos que se reproducen sexualmente depende de la fusión exitosa de gametos masculinos y femeninos. En las plantas con flores, la interacción de dos gametos masculinos (espermatozoides) con dos gametos femeninos (óvulo y célula central) durante la doble fertilización depende de la liberación de espermatozoides del tubo polínico (el gametofito masculino). Este proceso, llamado recepción del tubo polínico, está controlado en gran medida por las células sinérgicas que residen dentro del saco embrionario (el gametofito femenino)1,2. Como la recepción del tubo polínico tiene lugar en el interior de la flor, se ha establecido un método que permite obtener imágenes de células vivas del proceso, llamado recepción del tubo polínico semi-in vitro (SIV)3. Con este método, los óvulos de Arabidopsis extirpados se colocan en un medio de germinación de polen semilíquido y se dirigen a tubos de polen que crecen a través del estigma y el estilo de un pistilo cortado en la unión del tracto transmisor del estilo 3,4. Desde el desarrollo de esta técnica, las observaciones detalladas han llevado a varios descubrimientos en torno a la guía, recepción y fertilización del tubo polínico. Entre otros, estos descubrimientos incluyen la adquisición de la competencia dirigida al tubo polínico por crecimiento a través del estigma3, el inicio de oscilaciones intracelulares de calcio en las sinérgicas a la llegada del tubo polínico 5,6,7,8,9, y la dinámica de la liberación y fertilización de los espermatozoides tras la explosión del tubo polínico10 . Sin embargo, debido a que esta técnica se basa en la escisión de óvulos, las observaciones de fertilización son limitadas en número, y la recepción del tubo polínico es a menudo aberrante, lo que resulta en el fracaso de la ruptura del tubo polínico (Video 1 y Archivo Suplementario 1). Por lo tanto, existe la necesidad de un enfoque más eficiente que permita análisis de alto rendimiento de la recepción del tubo polínico y la fertilización.
Al desarrollar este protocolo, se probaron varios enfoques nuevos para analizar la recepción del tubo polínico, que abarcan desde los métodos más "in vitro" hasta los más "in vivo", y se estableció una técnica eficiente basada en la escisión de todo el tabique, que permite hasta 40 observaciones de fertilización por día. Aquí, se describen los matices y los puntos críticos de la técnica, incluida la puesta en escena de flores, la disección, la preparación del medio y la configuración de imágenes. Al seguir este protocolo, se debe facilitar la investigación centrada en la guía del tubo polínico, la recepción del tubo polínico y la doble fertilización. Se espera que los tamaños de muestra más altos que permite el método refuercen la solidez científica de las conclusiones extraídas de los experimentos de imágenes en vivo. Las aplicaciones potenciales de esta técnica incluyen, pero no se limitan a, realizar observaciones de los cambios moleculares y fisiológicos en las concentraciones citosólicas de calcio ([Ca2+]cyt), pH oH2O2 durante las interacciones de gametofitos mediante el uso de biosensores codificados genéticamente. Además, los cambios citológicos, como la degeneración de la sinergia receptiva, la migración de espermatozoides o la cariogamia, se pueden observar más fácilmente utilizando este método mejorado. Finalmente, el momento de las diferentes etapas de la fertilización se puede monitorear bajo microscopía de campo amplio, y luego se pueden realizar análisis más detallados utilizando microscopía de barrido láser confocal (CLSM) o microscopía de excitación de dos fotones (2PEM) para una mayor resolución y reconstrucción 3D.
Protocolo
NOTA: Consulte la Tabla de materiales para obtener una lista de los materiales y equipos utilizados en este protocolo.
1. Consideraciones para diseñar el experimento de imágenes
- Predetermine la duración de la imagen y la frecuencia de muestreo requerida para capturar el fenómeno deseado a observar. Por ejemplo, siguiendo el teorema de muestreo de Nyquist, la frecuencia de muestreo debe ser mayor que el doble de la frecuencia más alta de la muestra de entrada. Por lo tanto, para capturar con precisión las oscilaciones sinérgicas [Ca2+]cyt , realice imágenes aproximadamente cada 10 s, pero para medir la velocidad de los espermatozoides tras la descarga del tubo polínico, asegúrese de una resolución temporal de menos de 1 s10.
- Seleccione marcadores fluorescentes para las células de interés que sean suficientemente brillantes más allá de la autofluorescencia de fondo. Para el uso de biosensores, seleccione las líneas más brillantes que no perturben la función celular, ya que generalmente son más sensibles y requieren menos tiempo de exposición.
- Considere qué tipo de microscopía de fluorescencia y aumento son los más adecuados para capturar el fenómeno deseado. Utilice microscopía de campo amplio y objetivos de bajo aumento para capturar la luz desde una mayor profundidad de campo y mantener el enfoque a lo largo del tiempo, obtener imágenes de objetos más grandes, como óvulos completos, o usar sensores ratiométricos que sean sensibles a los artefactos de desplazamiento cromático. Use CLSM o 2PEM con objetivos de gran aumento para una mejor resolución de objetos celulares y subcelulares, pero tenga en cuenta la dificultad de mantener el enfoque a lo largo del tiempo.
- Calcule el número de muestras que se tomarán por experimento. Por ejemplo, use un objetivo 10x con un tiempo de muestreo mínimo de ~ 30 s para obtener imágenes de tres septos y obtener imágenes de hasta 40 eventos de fertilización por experimento debido al tiempo requerido para las funciones de enfoque automático y adquisición de etapas múltiples.
2. Preparación del medio de germinación del polen
- Preparar el medio de germinación de polen líquido (5mM CaCl2, 1mM MgSO4, 5mM KCl, 0,01% [p/v] H 3 BO3y 10% [p/v] sacarosa) utilizando 1 M alícuotas de cada micronutriente, que se almacenan a −20 °C. Ajuste el pH a 7,5 con 0,1 M KOH. Conservar el medio a 4 °C durante un máximo de 2 semanas.
NOTA: El pH puede disminuir con el tiempo. - Agregue 2.5 ml de medio líquido a un vaso de precipitados de 10 ml, y agregue lentamente 32 mg de agarosa de punto de fusión ultra bajo (~ 1.3%) con una barra de agitación de rotación rápida para evitar la formación de grumos.
- Derretir la agarosa en una placa calefactora a 65 °C y nutre el vaso de precipitados para recoger cualquier condensación de los lados.
- Pipetear 130 μL de medio en el pocillo de 14 mm de una placa con fondo de vidrio de 35 mm y girar la placa hasta que el medio cubra el pozo.
- Aspirar un total de 40 μL con una pipeta desde el centro del plato, dejando un volumen total de 90 μL.
NOTA: Se puede aspirar más medio fuera del pozo para lograr un volumen total más bajo; Esto puede ser necesario para objetivos de gran aumento con distancias de trabajo bajas. Sin embargo, cuanto más delgada sea la almohadilla de agar, más rápido se secará. - Enfríe el plato en un bloque de aluminio en una cámara de humedad para garantizar un enfriamiento uniforme. Conservar las placas a 4 °C durante la noche para utilizarlas a la mañana siguiente.
3. Estadificación floral de donantes de tabique, donantes de estigma y donantes de polen
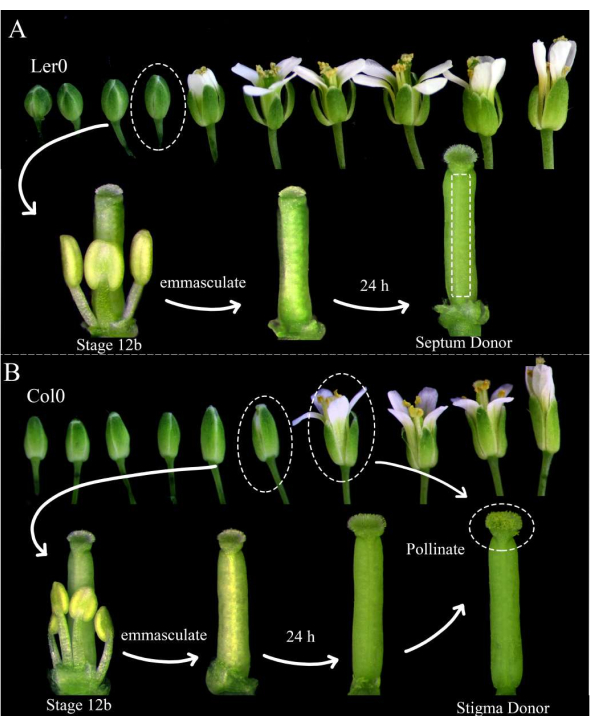
Figura 1: Estadificación floral de donantes de tabique, donantes de estigma y donantes de polen. (A) Etapas de las flores de Arabidopsis (Ler-0) dentro de una inflorescencia. Los brotes en la etapa 12B, que tienen pétalos que están a punto de abrirse y anteras indehiscentes amarillas, deben ser castrados eliminando todos los sépalos, pétalos y estambres. Los pistilos (que albergan al fabricante de gametofitos femeninos) se pueden usar como donantes de tabique 24 h después. (B) Etapas de las flores de Arabidopsis (Col-0) dentro de una inflorescencia. Los brotes en la etapa 12B, que tienen anteras indehiscentes amarillas y estigmas que apenas emergen de los pétalos, deben ser castrados eliminando todos los sépalos, pétalos y estambres. Los pistilos son entonces utilizables como donantes de estigma 24 h después, cuando deberían ser polinizados por flores (que albergan el marcador gametofito masculino) que están abiertas y arrojando polen. Los estigmas polinizados deben diseccionarse dentro de 1 h de polinización. Haga clic aquí para ver una versión más grande de esta figura.
- La mañana antes de la obtención de imágenes, elija plantas de Arabidopsis para usarlas como donantes de tabique y donantes de estigma; Asegúrese de que estén sanos y que recientemente hayan comenzado a producir siliques.
NOTA: Landsberg erecta (Ler-0) es una buena accesión para su uso como donante de tabique, ya que sus septos son robustos y hay pequeños entrenudos entre los óvulos. Columbia (Col-0) es una buena adhesión para usar como donante de estigma porque parecen ser propicios para el crecimiento del tubo polínico. - Castrar al menos tres flores donantes de tabique etapa 12B y 12 flores donantes de estigma etapa 12B eliminando sus estambres, sépalos y pétalos (Figura 1A, B). Retire también las flores más viejas en la misma inflorescencia, que potencialmente podrían polinizar la flor castrada.
- Por la mañana, 24 h más tarde, polinizar a los donantes de estigma con las flores donantes de polen (por ejemplo, que albergan marcadores de tubo polínico o espermatozoides) que eliminan fácilmente el polen. La polinización es completa cuando los estigmas están casi completamente cubiertos de polen (Figura 1B).
4. Disección del tabique
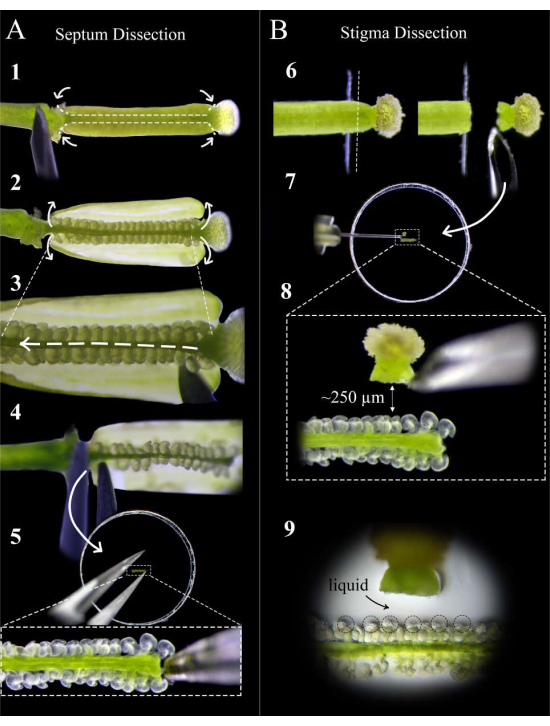
Figura 2: Una guía rápida para la disección del tabique y el estigma . (A) Pasos de la disección del tabique. Fije el pistilo en cinta de doble cara con una aguja de jeringa de insulina y haga cortes en la unión estilo-ovario y la unión ovario-pedículo, seguido de un corte poco profundo a lo largo del tabique de cualquiera de los carpianos (Paso 1). Despegue las paredes del carpelo de nuevo sobre la cinta (Paso 2). Corte la ciruela debajo del tabique superior (Paso 3). Corte el tabique al estilo y retire con fórceps en el pedicelo (Paso 4). Coloque el tabique en un medio de agar e insértelo suavemente con fórceps. (B) Pasos de la disección del estigma. Fije el pistilo (polinizado <1 h antes) en cinta adhesiva de doble cara y córtelo en la unión estilo-ovario con una cuchilla de afeitar (Paso 6). Coloque el estigma en medio de agar con una aguja de insulina junto al tabique y ajuste la distancia a aproximadamente 250 μm (Pasos 7-8). Asegúrese de que se forme una piscina semilíquida alrededor de los micropyles y la base de los estilos (Paso 9). Haga clic aquí para ver una versión más grande de esta figura.
- Treinta minutos después de la polinización, recoja pistilos donantes de tabique sanos y maduros en el pedículo y colóquelos en una cinta adhesiva fresca de doble cara montada en un portaobjetos de vidrio, con el estigma pegado justo al borde de la cinta.
NOTA: Limite el tiempo de disección durante el cual los pistilos están en la cinta adhesiva para asegurarse de que sea lo más corto posible. La disección debe realizarse a alta humedad, lo que se puede lograr colocando un humidificador al lado del portaobjetos. - Fije el pistilo firmemente en la cinta presionando suavemente sobre el pedículo y a lo largo del ovario con la parte posterior de una nueva aguja de jeringa de insulina antes de retirar el sépalo, el pétalo y los restos de estambre que quedan de la emasculación.
- Bajo un estereoscopio, use una aguja de jeringa de insulina para hacer dos cortes por carpelo en la unión estilo-ovario y la unión ovario-pedículo, seguidos de cortes poco profundos a lo largo del tabique de cada carpelo (Figura 2, paso 1).
NOTA: Cortar demasiado profundamente a lo largo del tabique cortará los óvulos en el funículo. - Despegue las paredes del ovario con cuidado sobre la cinta (Figura 2, paso 2) y deslice la aguja suavemente entre los dos septos para cortar la repluma a lo largo de toda la longitud del pistilo sin alterar los óvulos (Figura 2, paso 3).
NOTA: Corte la ciruela en la dirección desde el estilo hasta el pedículo para asegurarse de que los óvulos en el tabique superior se alteren lo menos posible. - Corte suavemente el tabique superior tanto en la unión con el estilo como con el pedículo, y retire el tabique con fórceps del lado del pedículo (Figura 2, paso 4).
NOTA: Mantenga este corte recto y suave para que el tabique permanezca plano y no se curve. - Coloque el tabique lo más plano posible en el medio de modo que los micropilos de los óvulos estén boca arriba y en el mismo plano focal. Presione el tabique suavemente en el medio hasta que los óvulos estén ligeramente incrustados en el medio (Figura 2, paso 5).
NOTA: Es fundamental que el tabique se coloque de tal manera que los micropilos de los óvulos sean accesibles a los tubos polínicos (cualquier óvulo inaccesible se puede reorganizar suavemente con una aguja). Se debe formar un pequeño charco de líquido alrededor del tabique después de la incrustación. - Repita los pasos 4.1-4.6 para un máximo de dos pistilos más, colocando los septos de extremo a extremo.
5. Disección del estigma
- Coloque los pistilos donantes de estigma polinizados en una cinta adhesiva fresca de doble cara montada en un portaobjetos de vidrio, de modo que la unión estilo ovario quede fuera del borde de la cinta (Figura 2, paso 6).
- Use una hoja de afeitar nueva para cortar el estilo hacia abajo y levantarlo para mantener el estigma adherido a la hoja (Figura 2, paso 6).
NOTA: Corte en el borde de la cinta para obtener el corte más limpio. - Retire el estigma de la cuchilla con una aguja de jeringa de insulina y colóquela plana aproximadamente a 250-300 μm de los óvulos (Figura 2, pasos 7-8).
NOTA: El estilo debe estar orientado horizontalmente de lado; De lo contrario, la mayoría de los tubos de polen crecerán debajo del tabique. Un pequeño charco de líquido en la entrada del estilo debe aparecer después de que haya estado acostado en el medio durante 1 minuto; Esta es una buena señal, ya que los tubos de polen tendrán una salida suave del estilo. - Repita los pasos 5.1-5.3 para un máximo de 12 estigmas, colocando dos a cada lado de cada tabique. Busque un pequeño charco de líquido que se forma alrededor del micropilo de los óvulos; esto ayuda a la accesibilidad y orientación de los tubos polínicos a los sacos embrionarios (Figura 2, paso 9).
NOTA: Limite la cantidad de tiempo que el plato está abierto para evitar que el medio y los óvulos se sequen.
6. Imágenes
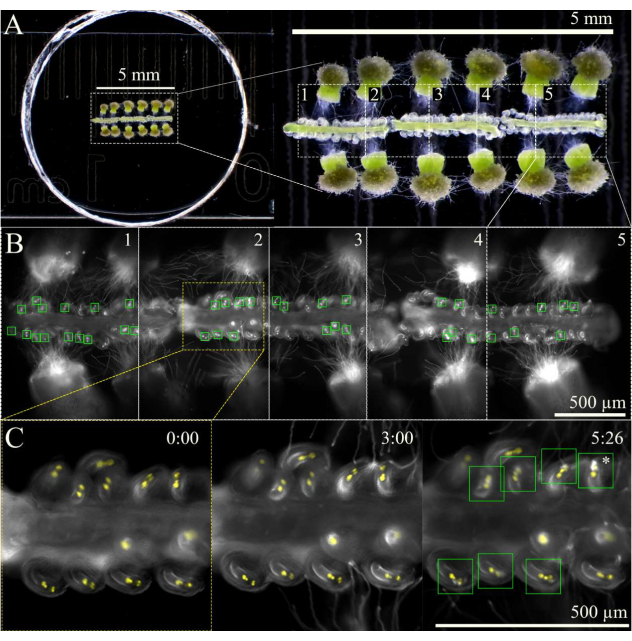
Figura 3: Esquema de imagen SIV cum septum. (A) Configuración completa de SIV cum septum con 12 estigmas polinizados y 3 septos, como se ve a través de un estereoscopio. (B) Imágenes combinadas de la configuración completa del SIV cum septum vista en A 5 h después de la incubación utilizando un objetivo de 10x, con las cinco áreas de visión general (~ 1 mm cada una) marcadas para la adquisición de múltiples etapas. Las cajas verdes muestran los óvulos que recibieron tubos de polen sometidos a una explosión explosiva en las sinergias. (C) Vista más cercana del área 2 de la visión general en diferentes momentos. Aproximadamente 3 h después de la incubación en la cámara de humedad del microscopio, los tubos polínicos deben llegar cerca de los micropilos, y a las 6 h de la imagen, la mayoría de los óvulos deben haber recibido adecuadamente los tubos de polen (cuadrados verdes); Estos óvulos luego sufren una explosión explosiva del tubo polínico (asterisco). Barras de escala = (A) 5 mm, (B,C) 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
- Una vez que la disección haya terminado y el plato esté listo para ser fotografiado, déjelo incubar en una cámara de humedad en el microscopio mantenida al 92% de humedad relativa y 21 ° C.
NOTA: Si no hay una cámara de humedad disponible para el microscopio, forrar los bordes exteriores de la tapa y el plato con un pequeño volumen de agua ayudará a mantener un alto nivel de humedad en el plato. - Enfoque las muestras bajo campo claro a una intensidad de luz baja y, a continuación, cambie a luz fluorescente, marcando las áreas de la muestra en la vista general del escenario que se va a fotografiar.
NOTA: Con un aumento de 10x, se pueden marcar aproximadamente cinco áreas para un total de tres septos (Figura 3). Limite la cantidad de tiempo utilizado para marcar las áreas de visión general para minimizar la fototoxicidad o el calentamiento de la muestra por la luz fluorescente. - Comience a crear imágenes utilizando un esquema de adquisición de varias etapas con una función de enfoque automático al comienzo de cada área de visión general. Como los tubos polínicos surgirán del estilo ~ 1 h después de incubar la muestra, retrase la adquisición por 2 h o hasta que los tubos polínicos hayan alcanzado el micropilo. Asegúrese de que el enfoque automático esté configurado con un rango de 100 μm (pasos grandes de 7 μm y pasos finos de 1 μm) para mantener los óvulos enfocados a medida que los septos se mueven ligeramente y se hunden con el tiempo.
- Detenga la adquisición de imágenes ~ 9 h después de comenzar la incubación de la muestra, ya que en este momento, la mayoría de los óvulos deberían haber atraído y recibido un tubo de polen.
NOTA: Si un número bajo de óvulos atrae tubos de polen, la observación cuidadosa del plato bajo un estereoscopio es útil para determinar cómo se podría mejorar la orientación del óvulo o del estilo la próxima vez.
Resultados
Para evaluar el momento de la degeneración nuclear en el sinérgico receptivo con respecto a la ruptura del tubo polínico en Arabidopsis , así como para observar si el sinérgico izquierdo o derecho está predestinado a convertirse en el sinérgico receptivo, se empleó el método SIV cum septum descrito aquí utilizando un marcador nuclear gametofito hembra apilado con un marcador citosólico sinérgico (pFG: roGFP2-ORP1-NLS, pMYB98:roGFP2-ORP1) como donante de tabique y marcador de gametof...
Discusión
Este manuscrito introduce un protocolo eficiente para la obtención de imágenes de la recepción del tubo polínico y la doble fertilización en Arabidopsis. El método mejorado, SIV cum septum, aumenta en gran medida el porcentaje y el número total de eventos exitosos de recepción del tubo polínico que son observables por sesión de imagen. Los resultados representativos que se muestran aquí demuestran una sesión de imagen con 41 eventos exitosos de recepción del tubo polínico y 10 óvulos que ...
Divulgaciones
Los autores no informan conflictos de intereses.
Agradecimientos
Agradecemos a Sara Simonini y Stefano Bencivenga por donar la construcción pFG:roGFP2-ORP1-NLS y a Christof Eichenberger, Johann Almendinger, Vincent Sutter y Celia Baroux por sus consejos sobre microscopía. Agradecemos amablemente el consejo de Ravi Palanivelu, Philipp Denninger, Sharon Kessler, Mark Johnson, Tomokazu Kawashima y todos los demás en la Conferencia Internacional sobre Reproducción Sexual de Plantas 2022 que mostraron interés en un protocolo sobre SIV cum septum. Este trabajo fue apoyado por la Universidad de Zurich y subvenciones de la Fundación Nacional Suiza de Ciencias a la U.G.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mm glass slide | Epredia | 16211551 | |
| 35 mm glass bottom dish (14 mm well) | Mattek | P35G-1.5-14-C | |
| Calcium Chloride | Roth | CN93.1 | |
| Columbia (Col-0) | Nottingham Arabidopsis Stock Centre (NASC) | stigma donor | |
| Dissecting Scope | Olympus | SZX2-ILLT | |
| Insulin needle (0.3 G) | BD | 304000 | |
| Landsberg erecta (Ler-0) | Nottingham Arabidopsis Stock Centre (NASC) | septum donor | |
| Magnesium Sulfate | Merck | 5886 | |
| Potassium Chloride | Roth | 6781.1 | |
| Razor blade | Beldura | 7026797 | |
| Scotch double sided tape | Scotch | 768720 | Less thick and good for stigma dissection |
| Sodium Chloride | Roth | 3957.1 | |
| Sucrose | ITW reagents | A2211,1000 | |
| Tesa double sided tape | Tesa | 05681-00018 | Very sticky and good for septum dissection |
| Ultra low gelling temperature agarose | FMC SeaPrep | 50302 |
Referencias
- Huck, N., Moore, J. M., Federer, M., Grossniklaus, U. The Arabidopsis mutant feronia disrupts the female gametophytic control of pollen tube reception. Development. 130 (10), 2149-2159 (2003).
- Rotman, N., et al. Female control of male gamete delivery during fertilization in Arabidopsis thaliana. Current Biology. 13 (5), 432-436 (2003).
- Palanivelu, R., Preuss, D. Distinct short-range ovule signals attract or repel Arabidopsis thaliana pollen tubes in vitro. BMC Plant Biology. 6, 7 (2006).
- Susaki, D., Maruyama, D., Yelagandula, R., Berger, F., Kawashima, T. Live-cell imaging of F-actin dynamics during fertilization in Arabidopsis thaliana. Methods in Molecular Biology. 1669, 47-54 (2017).
- Iwano, M., et al. Cytoplasmic Ca2+ changes dynamically during the interaction of the pollen tube with synergid cells. Development. 139 (22), 4202-4209 (2012).
- Ngo, Q., Vogler, H., Lituiev, D., Nestorova, A., Grossniklaus, U. A calcium dialog mediated by the FERONIA signal transduction pathway controls plant sperm delivery. Developmental Cell. 29 (4), 491-500 (2014).
- Denninger, P., et al. Male-female communication triggers calcium signatures during fertilization in Arabidopsis. Nature Communications. 5, 4645 (2014).
- Hamamura, Y., et al. Live imaging of calcium spikes during double fertilization in Arabidopsis. Nature Communications. 5, 4722 (2014).
- Ponvert, N., Johnson, M. Synergid calcium ion oscillations define a new feature of pollen tube reception critical for blocking interspecific hybridization. bioRxiv. , (2020).
- Hamamura, Y., et al. Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Current Biology. 21 (6), 497-502 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados