Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Arabidopsis Polen Tüpü Alımı ve Çift Döllenmenin Semi-In Vitro Cum Septum Yöntemi Kullanılarak Canlı Görüntülenmesi
Bu Makalede
Özet
Burada, Arabidopsis thaliana'da polen tüpü rehberliğini ve alımını gözlemlemek için ovüllerin alıcılığını artıran yarı in vitro (SIV) yöntemin geliştirilmesini açıklıyoruz. Yüksek verimli SIV cum septum yöntemi, dinamik döllenme sürecini izlemek için gametofit işaretleyici çizgileri ve genetik olarak kodlanmış biyosensörlerle birleştirilebilir.
Özet
Çiçekli bitkilerde, polen tüpünün (erkek gametofit) pistil içindeki büyümesi ve yönlendirilmesi ve polen tüpünün dişi gametofit tarafından alınması, çift döllenme ve sonraki tohum gelişimi için gereklidir. Polen tüpü alımı sırasında erkek ve dişi gametofitler arasındaki etkileşimler, polen tüpü rüptürü ve çift döllenmeyi etkilemek için iki sperm hücresinin salınması ile sonuçlanır. Polen tüpü büyümesi ve çift döllenme çiçeğin dokularında derinden gizlendiğinden, bu süreci in vivo olarak gözlemlemek zordur.
Arabidopsis thaliana model bitkisinde döllenmenin canlı hücre görüntülemesi için yarı in vitro (SIV) bir yöntem geliştirilmiş ve çeşitli araştırmalarda uygulanmıştır. Bu çalışmalar, çiçekli bitkilerde döllenme sürecinin nasıl gerçekleştiğinin ve erkek ve dişi gametofitlerin etkileşimi sırasında hangi hücresel ve moleküler değişikliklerin meydana geldiğinin temel özelliklerinin aydınlatılmasına yardımcı olmuştur. Bununla birlikte, bu canlı hücre görüntüleme deneyleri bireysel ovüllerin eksizyonunu içerdiğinden, görüntüleme seansı başına düşük sayıda gözlemle sınırlıdır, bu da bu yaklaşımı sıkıcı ve çok zaman alıcı hale getirir. Diğer teknik zorlukların yanı sıra, polen tüplerinin ovülleri in vitro olarak döllemedeki başarısızlığı sıklıkla bildirilmektedir ve bu da bu tür analizleri ciddi şekilde karıştırmaktadır.
Burada, polen tüpü alımının ve döllenmesinin otomatik ve yüksek verimli bir şekilde görüntülenmesi için ayrıntılı bir video protokolü sağlanmıştır ve görüntüleme seansı başına 40 adede kadar polen tüpü alımı ve kopması gözlemine izin vermektedir. Genetik olarak kodlanmış biyosensörlerin ve işaretleyici hatlarının kullanımı ile birleştiğinde, bu yöntem daha az zaman yatırımı ile büyük numune boyutlarının oluşturulmasını sağlar. Çiçek evreleme, diseksiyon, orta hazırlık ve görüntüleme dahil olmak üzere tekniğin nüansları ve kritik noktaları, polen tüpü rehberliği, alımı ve çift gübrelemenin dinamikleri hakkında gelecekteki araştırmaları kolaylaştırmak için video formatında açıkça detaylandırılmıştır.
Giriş
Cinsel olarak üreyen organizmalarda genetik olarak benzersiz yavruların oluşumu, erkek ve dişi gametlerin başarılı bir şekilde kaynaşmasına bağlıdır. Çiçekli bitkilerde, çift döllenme sırasında iki erkek gametin (sperm hücreleri) iki dişi gamet (yumurta hücresi ve merkezi hücre) ile etkileşimi, polen tüpünden (erkek gametofit) sperm salınımına bağlıdır. Polen tüpü alımı olarak adlandırılan bu süreç, büyük ölçüde embriyo kesesi (dişi gametofit) içinde bulunan sinergid hücreler tarafından kontrol edilir1,2. Polen tüpü alımı çiçeğin derinliklerinde gerçekleştiğinden, yarı in vitro (SIV) polen tüpü alımı adı verilen işlemin canlı hücre görüntülemesine izin veren bir yöntem oluşturulmuştur3. Bu yöntemle, eksize edilmiş Arabidopsis ovülleri yarı sıvı polen çimlenme ortamına yerleştirilir ve stil ileten trakt kavşağı 3,4'te kopmuş bir pistilin damgası ve stili ile büyüyen polen tüpleri tarafından hedeflenir. Bu tekniğin geliştirilmesinden bu yana, ayrıntılı gözlemler polen tüpü rehberliği, alımı ve gübrelemesini çevreleyen çeşitli keşiflere yol açmıştır. Diğerlerinin yanı sıra, bu keşifler arasında stigma3 yoluyla büyüme yoluyla polen tüpü hedefleme yetkinliğinin kazanılması, polen tüpügelişi 5,6,7,8,9 üzerine sinerjlerde hücre içi kalsiyum salınımlarının başlaması ve polen tüpü patlaması üzerine sperm hücresi salınımı ve döllenme dinamikleri10 bulunmaktadır . Bununla birlikte, bu teknik ovüllerin eksizyonuna dayandığından, döllenme gözlemleri sayıca sınırlıdır ve polen tüpü alımı genellikle anormaldir ve polen tüpü rüptürünün başarısızlığına neden olur (Video 1 ve Ek Dosya 1). Bu nedenle, polen tüpü alımı ve gübrelemesinin yüksek verimli analizlerine izin veren daha verimli bir yaklaşıma ihtiyaç vardır.
Bu protokolün geliştirilmesinde, polen tüpü alımını analiz etmek için en "in vitro" yöntemlerden en "in vivo" yöntemlere kadar uzanan birkaç yeni yaklaşım test edildi ve günde 40 adede kadar döllenme gözlemine izin veren tüm septumun eksizyonuna dayanan etkili bir teknik üzerinde duruldu. Burada, çiçek evreleme, diseksiyon, orta hazırlık ve görüntüleme ayarları dahil olmak üzere tekniğin nüansları ve kritik noktaları özetlenmiştir. Bu protokolü izleyerek, polen tüpü rehberliği, polen tüpü alımı ve çift döllenmeye odaklanan araştırmalar kolaylaştırılmalıdır. Yöntemin izin verdiği daha yüksek örneklem boyutlarının, canlı görüntüleme deneylerinden elde edilen sonuçların bilimsel sağlamlığını desteklemesi beklenmektedir. Bu tekniğin potansiyel uygulamaları, genetik olarak kodlanmış biyosensörlerin kullanımı yoluyla gametofit etkileşimleri sırasında sitozolik kalsiyum konsantrasyonlarındaki ([Ca2 +] sit), pH veya H2O2'dekimoleküler ve fizyolojik değişikliklerin gözlemlerini içerir, ancak bunlarla sınırlı değildir. Ayrıca, alıcı sinerjinin dejenerasyonu, sperm hücresi göçü veya karyogami gibi sitolojik değişiklikler, bu gelişmiş yöntem kullanılarak daha kolay gözlemlenebilir. Son olarak, döllenmenin farklı aşamalarının zamanlaması geniş alan mikroskobu altında izlenebilir ve daha sonra daha yüksek çözünürlük ve 3D rekonstrüksiyon için konfokal lazer tarama mikroskobu (CLSM) veya iki foton uyarma mikroskobu (2PEM) kullanılarak daha ayrıntılı analizler yapılabilir.
Protokol
NOT: Bu protokolde kullanılan malzeme ve ekipmanların bir listesi için Malzeme Tablosuna bakınız.
1. Görüntüleme deneyini tasarlarken dikkat edilmesi gerekenler
- Gözlemlenmek istenen fenomeni yakalamak için gereken görüntüleme süresini ve örnekleme sıklığını önceden belirleyin. Örneğin, Nyquist'in örnekleme teoremini takiben, örnekleme frekansı, giriş örneğinin en yüksek frekansının iki katından büyük olmalıdır. Bu nedenle, sinergid [Ca2 +] cyt salınımlarını doğru bir şekilde yakalamak için, yaklaşık her 10 saniyede bir görüntüleme yapın, ancak polen tüpü deşarjı üzerine sperm hücrelerinin hızını ölçmek için, 1 s10'dan daha az bir zamansal çözünürlük sağlayın.
- Arka plan otofloresansının ötesinde yeterince parlak olan ilgili hücreler için floresan belirteçleri seçin. Biyosensörlerin kullanımı için, genellikle daha hassas oldukları ve daha az maruz kalma süresi gerektirdikleri için hücre işlevini bozmayan en parlak çizgileri seçin.
- İstenilen fenomeni yakalamak için hangi tür floresan mikroskobu ve büyütmenin en uygun olduğunu düşünün. Daha büyük bir alan derinliğinden ışık yakalamak ve zaman içinde odağı korumak, tüm ovüller gibi daha büyük nesneleri görüntülemek veya kromatik kayma artefaktlarına duyarlı oransal sensörler kullanmak için geniş alan mikroskobu ve düşük büyütme hedeflerini kullanın. Hücresel ve hücre altı nesnelerin daha iyi çözünürlüğü için CLSM veya 2PEM'i yüksek büyütme hedefleriyle kullanın, ancak zaman içinde odağı korumanın zorluğuna dikkat edin.
- Deneme başına görüntülenecek örnek sayısını tahmin edin. Örneğin, üç septayı görüntülemek ve otofokuslama ve çok aşamalı edinme işlevleri için gereken süre nedeniyle deney başına 40 adede kadar döllenme olayını görüntülemek için minimum örnekleme süresi ~ 30 s olan 10x hedefli bir hedef kullanın.
2. Polen çimlenme ortamı hazırlığı
- -20 °C'de depolanan her mikro besin maddesinin 1 M aliquot stokunu kullanarak sıvı polen çimlenme ortamını (5mM CaCl2, 1mM MgSO4, 5mM KCl,% 0.01 [w / v] H 3 BO3ve% 10 [w / v] sakaroz) hazırlayın. 0,1 M KOH ile pH'ı 7,5'e ayarlayın. Ortamı 4 ° C'de 2 haftaya kadar saklayın.
NOT: pH zamanla düşebilir. - 10 mL'lik bir beherin içine 2,5 mL sıvı ortam ekleyin ve kümelenmeyi önlemek için hızlı dönen bir karıştırma çubuğu ile yavaşça 32 mg ultra düşük erime noktası agarozu (~% 1,3) ekleyin.
- Agarozu 65 ° C'de bir ocak üzerinde eritin ve yanlardan herhangi bir yoğuşma toplamak için beheri kurutun.
- 130 μL orta boy pipetini 35 mm'lik cam tabanlı bir kabın 14 mm'lik kuyusuna yerleştirin ve ortam kuyuyu kaplayana kadar kabı döndürün.
- Çanağın ortasından bir pipetle toplam 40 μL aspire edin ve toplam 90 μL'lik bir hacmi geride bırakın.
NOT: Daha düşük bir toplam hacim elde etmek için kuyudan daha fazla ortam aspire edilebilir; Bu, düşük çalışma mesafelerine sahip yüksek büyütme hedefleri için gerekli olabilir. Bununla birlikte, agar pedi ne kadar ince olursa, o kadar çabuk kurur. - Eşit soğutma sağlamak için çanağı bir nem odasındaki alüminyum bir blok üzerinde soğutun. Plakaları ertesi sabah kullanmak üzere gece boyunca 4 ° C'de saklayın.
3. Septum donörlerinin, stigma donörlerinin ve polen donörlerinin çiçek evrelemesi
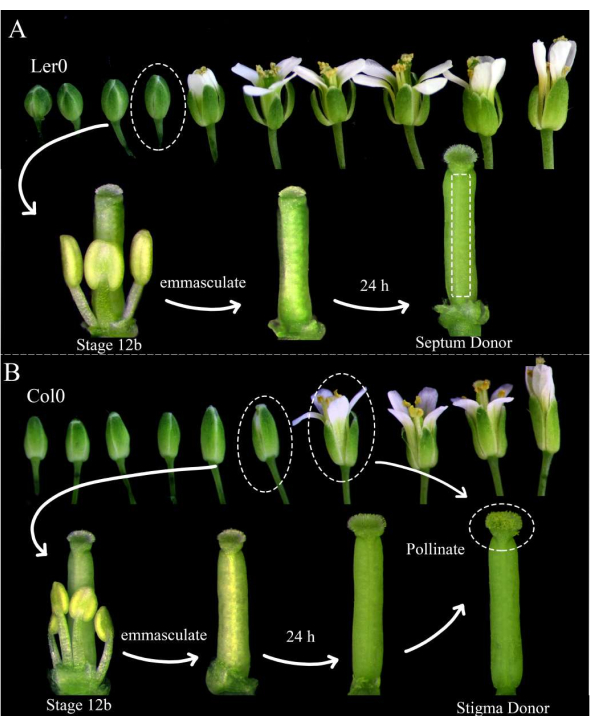
Şekil 1: Septum donörlerinin, stigma donörlerinin ve polen donörlerinin çiçek evrelemesi. (A) Arabidopsis çiçeklerinin (Ler-0) bir çiçeklenme içindeki aşamaları. Açılmak üzere olan yaprakları ve sarı hissiz anterleri olan 12B evresindeki tomurcuklar, tüm sepalleri, yaprakları ve organları çıkararak iğdiş edilmelidir. Pistils (dişi gametofit üreticisini barındıran) daha sonra 24 saat sonra septum donörleri olarak kullanılabilir. (B) Arabidopsis çiçeklerinin (Col-0) bir çiçeklenme içindeki aşamaları. Yapraklarından zar zor çıkan sarı hiscent anterlere ve stigmalara sahip olan 12B evresindeki tomurcuklar, tüm sepalleri, yaprakları ve organları çıkararak iğdiş edilmelidir. Pistiller daha sonra 24 saat sonra, açık ve polen döken çiçekler (erkek gametofit belirtecini barındıran) tarafından tozlaştırılmaları gerektiğinde stigma donörleri olarak kullanılabilir. Tozlaşmış stigmalar tozlaşmadan sonraki 1 saat içinde diseke edilmelidir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Görüntülemeden önceki sabah, septum donörleri ve stigma donörleri olarak kullanılacak Arabidopsis bitkilerini seçin; Sağlıklı olduklarından ve son zamanlarda silika üretmeye başladıklarından emin olun.
NOT: Landsberg erecta (Ler-0), septası sağlam olduğundan ve ovüller arasında küçük internodlar bulunduğundan, septum donörü olarak kullanım için iyi bir katılımdır. Columbia (Col-0), stigma donörü olarak kullanmak için iyi bir katılımdır, çünkü polen tüpü büyümesine elverişli görünmektedirler. - En az üç aşamalı 12B septum donör çiçeğini ve 12 aşamalı 12B stigma donör çiçeklerini organlarını, sepallerini ve yapraklarını çıkararak iğdiş edin (Şekil 1A, B). Aynı çiçeklenme üzerindeki eski çiçekleri de çıkarın, bu da iğdiş edilmiş çiçeği potansiyel olarak tozlaştırabilir.
- Sabah, 24 saat sonra, stigma donörlerini, kolayca polen döken polen donör çiçekleriyle (örneğin, polen tüpü veya sperm hücresi belirteçlerini barındıran) tozlaştırın. Stigmalar neredeyse tamamen polenle kaplandığında tozlaşma tamamlanır (Şekil 1B).
4. Septum diseksiyonu
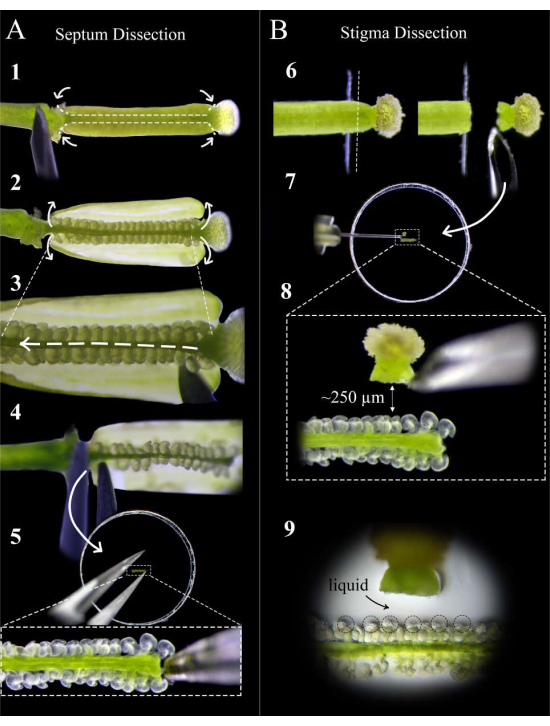
Şekil 2: Septum ve stigma diseksiyonu için hızlı bir kılavuz. (A) Septum diseksiyon adımları. Pisili bir insülin şırınga iğnesi ile çift taraflı bant üzerine sabitleyin ve stil-yumurtalık kavşağında ve yumurtalık-pedikül kavşağında kesikler yapın, ardından her iki karpelin septumu boyunca sığ bir kesim yapın (Adım 1). Karpel duvarlarını tekrar bandın üzerine soyun (Adım 2). Replum'u üst septumun altında kesin (Adım 3). Septumu stilde kesin ve pediseldeki forseps kullanarak çıkarın (Adım 4). Septumu agar ortamına yerleştirin ve forseps ile yavaşça gömün. (B) Stigma diseksiyonunun adımları. Pistil'i (tozlaşan <1 saat önce) çift taraflı bant üzerine sabitleyin ve stil-yumurtalık bağlantısında bir tıraş bıçağı ile kesin (Adım 6). Stigmayı septumun yanında bir insülin iğnesi ile agar ortamına yerleştirin ve mesafeyi yaklaşık 250 μm'ye ayarlayın (Adım 7-8). Mikropillerin ve stillerin tabanının etrafında yarı sıvı bir havuz oluştuğundan emin olun (Adım 9). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Tozlaşmadan otuz dakika sonra, pedikülde sağlıklı ve olgun septum donör pistilleri toplayın ve bunları bir cam slayt üzerine monte edilmiş taze çift taraflı yapışkan bant üzerine yerleştirin, stigma bandın hemen kenarına yapışır.
NOT: Mümkün olduğunca kısa olduğundan emin olmak için pistillerin yapışkan bant üzerinde bulunduğu diseksiyon süresini sınırlayın. Diseksiyon, slaydın yanına bir nemlendirici yerleştirilerek elde edilebilecek yüksek nemde yapılmalıdır. - Emaskülasyondan kalan sepal, taç yaprağı ve stamen kalıntılarını çıkarmadan önce yeni bir insülin şırınga iğnesinin arka tarafını kullanarak pedikül üzerine ve yumurtalık boyunca hafifçe bastırarak pistili banda güvenli bir şekilde sabitleyin.
- Bir stereoskop altında, stil-yumurtalık kavşağında ve yumurtalık-pedikül kavşağında karpel başına iki kesim yapmak için bir insülin şırınga iğnesi kullanın, ardından her karpelin septumu boyunca sığ kesikler yapın (Şekil 2, adım 1).
NOT: Septum boyunca çok derin kesmek, funiculus'taki ovülleri koparır. - Yumurtalık duvarlarını dikkatlice bandın üzerine soyun (Şekil 2, adım 2) ve ovülleri rahatsız etmeden pistilin tüm uzunluğu boyunca replum'u kesmek için iğneyi iki septa arasında hafifçe kaydırın (Şekil 2, adım 3).
NOT: Üst septumdaki ovüllerin mümkün olduğunca az rahatsız edildiğinden emin olmak için replum'u stilden pediküle doğru kesin. - Üst septumu hem stil ile hem de pedikül ile birleşme noktasında yavaşça kesin ve septumu pedikül tarafından forseps ile çıkarın (Şekil 2, adım 4).
NOT: Septumun düz kalması ve kıvrılmaması için bu kesimi düz ve yumuşak tutun. - Septumu, ovüllerin mikropilleri yüzü yukarı bakacak ve aynı odak düzleminde olacak şekilde ortama mümkün olduğunca düz yerleştirin. Ovüller ortama hafifçe gömülene kadar septumu yavaşça ortamın içine bastırın (Şekil 2, adım 5).
NOT: Septumun, ovüllerin mikropillerinin polen tüpleri tarafından erişilebileceği şekilde yerleştirilmesi çok önemlidir (erişilemeyen herhangi bir ovül bir iğne ile nazikçe yeniden düzenlenebilir). Gömme işleminden sonra septumun etrafında küçük bir sıvı havuzu oluşmalıdır. - En fazla iki pistil için 4.1-4.6 arasındaki adımları tekrarlayın ve septayı uçtan uca yerleştirin.
5. Stigma diseksiyonu
- Tozlaşmış stigma donör pistillerini, yumurtalık tarzı bağlantı bandın kenarından çıkacak şekilde cam bir slayt üzerine monte edilmiş taze çift taraflı yapışkan bant üzerine yerleştirin (Şekil 2, adım 6).
- Stili düz bir şekilde kesmek için yeni bir tıraş bıçağı kullanın ve damgayı bıçağa bağlı tutmak için kaldırın (Şekil 2, adım 6).
NOT: En temiz kesim için bandın kenarından kesin. - Bir insülin şırınga iğnesi ile damgayı bıçaktan çıkarın ve ovüllerden yaklaşık 250-300 μm uzağa düz bir şekilde yerleştirin (Şekil 2, adım 7-8).
NOT: Stil, yan tarafına yatay olarak yönlendirilmelidir; Aksi takdirde, polen tüplerinin çoğu septumun altında büyüyecektir. Stilin girişinde küçük bir sıvı havuzu, 1 dakika boyunca ortam üzerinde yattıktan sonra görünmelidir; Bu iyi bir işarettir, çünkü polen tüpleri stilden yumuşak bir çıkışa sahip olacaktır. - En fazla 12 damgalama için 5.1-5.3 arasındaki adımları tekrarlayın ve her septumun her iki tarafına iki tane yerleştirin. Ovüllerin mikropilinin etrafında oluşan küçük bir sıvı havuzu arayın; bu, polen tüplerinin embriyo keselerine erişilebilirliğine ve hedeflemesine yardımcı olur (Şekil 2, adım 9).
NOT: Ortamın ve ovüllerin kurumasını önlemek için kabın açık olduğu süreyi sınırlayın.
6. Görüntüleme
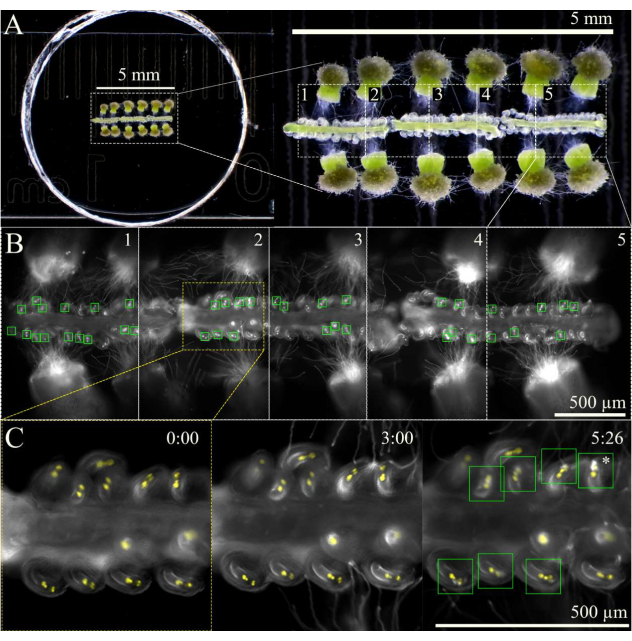
Şekil 3: SIV cum septum görüntüleme şeması. (A) Bir stereoskoptan görüldüğü gibi, 12 tozlaşmış stigma ve 3 septa ile tam SIV cum septum kurulumu. (B) İnkübasyondan 5 saat sonra A'da görülen tam SIV cum septum kurulumunun birleştirilmiş görüntüleri, 10x hedefi kullanılarak, beş genel bakış alanı (her biri ~ 1 mm) çok aşamalı edinim için işaretlenmiştir. Yeşil kutular, sinerjilerde patlayıcı bir patlamaya maruz kalan polen tüplerini alan ovülleri göstermektedir. (C) Farklı zaman noktalarında genel bakış alanı 2'nin daha yakından görünümü. Mikroskoptaki nem odasında inkübe edildikten yaklaşık 3 saat sonra, polen tüpleri mikropillerin yanına gelmeli ve 6 saatlik görüntüleme ile çoğu ovül polen tüplerini (yeşil kareler) uygun şekilde almış olmalıdır; Bu yumurtalar daha sonra patlayıcı polen tüpü patlamasına (yıldız işareti) maruz kalır. Ölçek çubukları = (A) 5 mm, (B,C) 500 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Diseksiyon yapıldıktan ve çanak görüntülenmeye hazır olduğunda,% 92 bağıl nem ve 21 ° C'de tutulan mikroskoptaki bir nem odasında inkübe edilmesine izin verin.
NOT: Mikroskop için nem haznesi yoksa, kapağın ve kabın dış kenarlarını az miktarda suyla kaplamak, tabakta yüksek nem seviyesinin korunmasına yardımcı olacaktır. - Numuneleri düşük ışık yoğunluğunda parlak alan altında odak noktasına getirin ve ardından görüntülenecek sahne genel bakışında numunenin alanlarını işaretleyerek floresan ışığa geçin.
NOT: 10x büyütmede, toplam üç septa için yaklaşık beş alan işaretlenebilir (Şekil 3). Fototoksisiteyi veya numunenin floresan ışığı tarafından ısınmasını en aza indirmek için genel bakış alanlarını işaretlemek için kullanılan süreyi sınırlayın. - Her genel bakış alanının başında otomatik netleme işlevi bulunan çok aşamalı bir alma şeması kullanarak görüntülemeye başlayın. Polen tüpleri, numuneyi inkübe ettikten ~ 1 saat sonra stilden çıkacağından, edinimi 2 saat veya polen tüpleri mikropile ulaşana kadar geciktirin. Septa hafifçe hareket edip zamanla batarken ovülleri odakta tutmak için otomatik netlemenin 100 μm aralıkla (7 μm büyük adımlar ve 1 μm ince adımlar) ayarlandığından emin olun.
- Örnek inkübasyona başladıktan ~ 9 saat sonra görüntü alımını durdurun, çünkü bu zamana kadar ovüllerin çoğu bir polen tüpü çekmiş ve almış olmalıdır.
NOT: Düşük sayıda ovül polen tüplerini çekiyorsa, çanağın stereoskop altında dikkatli bir şekilde gözlemlenmesi, yumurtlamanın veya stil oryantasyonunun bir dahaki sefere nasıl geliştirilebileceğini belirlemek için yararlıdır.
Sonuçlar
Arabidopsis'teki polen tüpü rüptürüne göre alıcı sinerjideki nükleer dejenerasyonun zamanlamasını değerlendirmek ve sol veya sağ sinergidin alıcı sinergid olmaya önceden belirlenmiş olup olmadığını gözlemlemek için, burada açıklanan SIV cum septum yöntemi, bir sinergid sitozolik belirteç (pFG: septum donörü olarak roGFP2-ORP1-NLS, pMYB98:roGFP2-ORP1) ve polen donörü olarak bir erkek gametofit belirteci (pLAT52:R-GECO). Septa ve tozlaşmış stigmalar, pro...
Tartışmalar
Bu yazı, Arabidopsis'te polen tüpü alımı ve çift döllenmenin görüntülenmesinde etkili bir protokol sunmaktadır. Geliştirilmiş yöntem olan SIV cum septum, görüntüleme seansı başına gözlemlenebilen başarılı polen tüpü alım olaylarının yüzdesini ve toplam sayısını büyük ölçüde artırır. Burada gösterilen temsili sonuçlar, 41 başarılı polen tüpü alım olayı ve alım kusurları gösteren 10 ovül (~% 80 verimlilik) içeren bir görüntüleme seansını gösterme...
Açıklamalar
Yazarlar çıkar çatışması olmadığını bildirmektedir.
Teşekkürler
Sara Simonini ve Stefano Bencivenga'ya pFG:roGFP2-ORP1-NLS yapısını bağışladıkları için ve Christof Eichenberger, Johann Almendinger, Vincent Sutter ve Celia Baroux'ya mikroskopi konusundaki tavsiyeleri için teşekkür ederiz. Ravi Palanivelu, Philipp Denninger, Sharon Kessler, Mark Johnson, Tomokazu Kawashima ve Uluslararası Cinsel Bitki Üreme Konferansı 2022'de SIV cum septum ile ilgili bir protokole ilgi gösteren herkesin tavsiyelerini kabul ediyoruz. Bu çalışma Zürih Üniversitesi tarafından desteklendi ve İsviçre Ulusal Bilim Vakfı'ndan ABD'ye hibe edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mm glass slide | Epredia | 16211551 | |
| 35 mm glass bottom dish (14 mm well) | Mattek | P35G-1.5-14-C | |
| Calcium Chloride | Roth | CN93.1 | |
| Columbia (Col-0) | Nottingham Arabidopsis Stock Centre (NASC) | stigma donor | |
| Dissecting Scope | Olympus | SZX2-ILLT | |
| Insulin needle (0.3 G) | BD | 304000 | |
| Landsberg erecta (Ler-0) | Nottingham Arabidopsis Stock Centre (NASC) | septum donor | |
| Magnesium Sulfate | Merck | 5886 | |
| Potassium Chloride | Roth | 6781.1 | |
| Razor blade | Beldura | 7026797 | |
| Scotch double sided tape | Scotch | 768720 | Less thick and good for stigma dissection |
| Sodium Chloride | Roth | 3957.1 | |
| Sucrose | ITW reagents | A2211,1000 | |
| Tesa double sided tape | Tesa | 05681-00018 | Very sticky and good for septum dissection |
| Ultra low gelling temperature agarose | FMC SeaPrep | 50302 |
Referanslar
- Huck, N., Moore, J. M., Federer, M., Grossniklaus, U. The Arabidopsis mutant feronia disrupts the female gametophytic control of pollen tube reception. Development. 130 (10), 2149-2159 (2003).
- Rotman, N., et al. Female control of male gamete delivery during fertilization in Arabidopsis thaliana. Current Biology. 13 (5), 432-436 (2003).
- Palanivelu, R., Preuss, D. Distinct short-range ovule signals attract or repel Arabidopsis thaliana pollen tubes in vitro. BMC Plant Biology. 6, 7 (2006).
- Susaki, D., Maruyama, D., Yelagandula, R., Berger, F., Kawashima, T. Live-cell imaging of F-actin dynamics during fertilization in Arabidopsis thaliana. Methods in Molecular Biology. 1669, 47-54 (2017).
- Iwano, M., et al. Cytoplasmic Ca2+ changes dynamically during the interaction of the pollen tube with synergid cells. Development. 139 (22), 4202-4209 (2012).
- Ngo, Q., Vogler, H., Lituiev, D., Nestorova, A., Grossniklaus, U. A calcium dialog mediated by the FERONIA signal transduction pathway controls plant sperm delivery. Developmental Cell. 29 (4), 491-500 (2014).
- Denninger, P., et al. Male-female communication triggers calcium signatures during fertilization in Arabidopsis. Nature Communications. 5, 4645 (2014).
- Hamamura, Y., et al. Live imaging of calcium spikes during double fertilization in Arabidopsis. Nature Communications. 5, 4722 (2014).
- Ponvert, N., Johnson, M. Synergid calcium ion oscillations define a new feature of pollen tube reception critical for blocking interspecific hybridization. bioRxiv. , (2020).
- Hamamura, Y., et al. Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Current Biology. 21 (6), 497-502 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır