È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging dal vivo della ricezione del tubo di polline di Arabidopsis e doppia fecondazione utilizzando il metodo semi-in vitro del setto di cum
In questo articolo
Riepilogo
Qui, descriviamo un miglioramento del metodo semi-in vitro (SIV) per osservare la guida e la ricezione del tubo pollinico in Arabidopsis thaliana, che aumenta la ricettività degli ovuli. Il metodo SIV cum septum ad alta produttività può essere accoppiato con linee marcatrici di gametofiti e biosensori geneticamente codificati per monitorare il processo dinamico di fecondazione.
Abstract
Nelle piante da fiore, la crescita e la guida del tubo pollinico (gametofito maschile) all'interno del pistillo e la ricezione del tubo pollinico da parte del gametofito femminile sono essenziali per la doppia fecondazione e il successivo sviluppo del seme. Le interazioni tra gametofiti maschili e femminili durante la ricezione del tubo pollinico culminano nella rottura del tubo pollinico e nel rilascio di due spermatozoi per effettuare una doppia fecondazione. Poiché la crescita del tubo pollinico e la doppia fecondazione sono profondamente nascoste all'interno dei tessuti del fiore, questo processo è difficile da osservare in vivo.
Un metodo semi-in vitro (SIV) per l'imaging di cellule vive della fecondazione nella pianta modello Arabidopsis thaliana è stato sviluppato e implementato in diverse indagini. Questi studi hanno contribuito a chiarire le caratteristiche fondamentali di come avviene il processo di fecondazione nelle piante da fiore e quali cambiamenti cellulari e molecolari si verificano durante l'interazione dei gametofiti maschili e femminili. Tuttavia, poiché questi esperimenti di imaging di cellule vive comportano l'escissione di singoli ovuli, sono limitati a un basso numero di osservazioni per sessione di imaging, rendendo questo approccio noioso e molto dispendioso in termini di tempo. Tra le altre difficoltà tecniche, viene spesso segnalata un'incapacità dei tubi pollinici di fertilizzare gli ovuli in vitro, il che confonde gravemente tali analisi.
Qui viene fornito un protocollo video dettagliato per l'imaging della ricezione e della fecondazione del tubo pollinico in modo automatizzato e ad alta produttività, consentendo fino a 40 osservazioni della ricezione e della rottura del tubo pollinico per sessione di imaging. Abbinato all'uso di biosensori e linee di marcatori geneticamente codificati, questo metodo consente la generazione di campioni di grandi dimensioni con un investimento di tempo ridotto. Le sfumature e i punti critici della tecnica, tra cui la messa in scena dei fiori, la dissezione, la preparazione del mezzo e l'imaging, sono chiaramente dettagliati in formato video per facilitare la ricerca futura sulle dinamiche della guida, della ricezione e della doppia fecondazione del tubo pollinico.
Introduzione
La generazione di prole geneticamente unica negli organismi che si riproducono sessualmente dipende dalla fusione riuscita di gameti maschili e femminili. Nelle piante da fiore, l'interazione di due gameti maschili (spermatozoi) con due gameti femminili (cellula uovo e cellula centrale) durante la doppia fecondazione dipende dal rilascio di spermatozoi dal tubo pollinico (il gametofito maschile). Questo processo, chiamato ricezione del tubo pollinico, è in gran parte controllato dalle cellule sinergiche che risiedono all'interno del sacco embrionale (il gametofito femminile)1,2. Poiché la ricezione del tubo pollinico avviene in profondità all'interno del fiore, è stato stabilito un metodo che consente l'imaging delle cellule vive del processo, chiamato ricezione del tubo pollinico semi-in vitro (SIV),3. Con questo metodo, gli ovuli di Arabidopsis asportati vengono posti su un mezzo di germinazione del polline semi-liquido e presi di mira da tubi pollinici che crescono attraverso lo stigma e lo stile di un pistillo reciso alla giunzione del tratto di trasmissione dello stile 3,4. Dopo lo sviluppo di questa tecnica, osservazioni dettagliate hanno portato a diverse scoperte riguardanti la guida, la ricezione e la fecondazione del tubo pollinico. Tra le altre, queste scoperte includono l'acquisizione della competenza di targeting del tubo pollinico attraverso la crescita attraverso lo stigma3, l'inizio delle oscillazioni intracellulari del calcio nei sinergidi all'arrivo del tubo pollinico 5,6,7,8,9 e la dinamica del rilascio e della fecondazione delle cellule spermatiche allo scoppio del tubo pollinico10 . Tuttavia, poiché questa tecnica si basa sull'escissione degli ovuli, le osservazioni della fecondazione sono limitate in numero e la ricezione del tubo pollinico è spesso aberrante, con conseguente fallimento della rottura del tubo pollinico (Video 1 e File supplementare 1). Pertanto, vi è la necessità di un approccio più efficiente che consenta analisi ad alto rendimento della ricezione e della fecondazione del tubo pollinico.
Nello sviluppo di questo protocollo, sono stati testati diversi nuovi approcci per analizzare la ricezione del tubo pollinico, che vanno dai metodi più "in vitro" a quelli più "in vivo", ed è stata stabilita una tecnica efficiente basata sull'escissione dell'intero setto, che consente fino a 40 osservazioni di fecondazione al giorno. Qui vengono delineate le sfumature e i punti critici della tecnica, tra cui la messa in scena dei fiori, la dissezione, la preparazione del mezzo e le impostazioni di imaging. Seguendo questo protocollo, la ricerca incentrata sulla guida del tubo pollinico, sulla ricezione del tubo pollinico e sulla doppia fecondazione dovrebbe essere facilitata. Le dimensioni del campione più elevate consentite dal metodo dovrebbero rafforzare la solidità scientifica delle conclusioni tratte dagli esperimenti di imaging dal vivo. Le potenziali applicazioni di questa tecnica includono, ma non sono limitate a, l'esecuzione di osservazioni dei cambiamenti molecolari e fisiologici nelle concentrazioni citosoliche di calcio ([Ca2+]cyt), pH o H 2 O2durante le interazioni gametofite attraverso l'uso di biosensori geneticamente codificati. Inoltre, i cambiamenti citologici, come la degenerazione del sinergico ricettivo, la migrazione delle cellule spermatiche o il karyogamy, possono essere osservati più facilmente utilizzando questo metodo migliorato. Infine, i tempi delle diverse fasi della fecondazione possono essere monitorati con microscopia a campo largo, e quindi analisi più dettagliate utilizzando la microscopia a scansione laser confocale (CLSM) o la microscopia di eccitazione a due fotoni (2PEM) possono essere condotte per una risoluzione più elevata e la ricostruzione 3D.
Protocollo
NOTA: Vedere la tabella dei materiali per un elenco dei materiali e delle attrezzature utilizzati in questo protocollo.
1. Considerazioni per la progettazione dell'esperimento di imaging
- Predeterminare la durata dell'imaging e la frequenza di campionamento necessarie per catturare il fenomeno desiderato da osservare. Ad esempio, seguendo il teorema di campionamento di Nyquist, la frequenza di campionamento deve essere maggiore del doppio della frequenza più alta del campione di input. Pertanto, per catturare con precisione le oscillazioni sinergiche [Ca2+]cyt , eseguire l'imaging circa ogni 10 s, ma per misurare la velocità degli spermatozoi allo scarico del tubo pollinico, assicurarsi una risoluzione temporale inferiore a 1 s10.
- Selezionare marcatori fluorescenti per le cellule di interesse che siano sufficientemente luminose oltre l'autofluorescenza di fondo. Per l'uso dei biosensori, selezionare le linee più luminose che non perturbano la funzione cellulare, poiché sono generalmente più sensibili e richiedono meno tempo di esposizione.
- Considerare quale tipo di microscopia a fluorescenza e ingrandimento sono più adatti per catturare il fenomeno desiderato. Utilizzare la microscopia a campo largo e gli obiettivi a basso ingrandimento per catturare la luce da una maggiore profondità di campo e mantenere la messa a fuoco nel tempo, visualizzare oggetti più grandi come ovuli interi o utilizzare sensori raziometrici sensibili agli artefatti di spostamento cromatico. Utilizzare CLSM o 2PEM con obiettivi ad alto ingrandimento per una migliore risoluzione degli oggetti cellulari e subcellulari, ma notare la difficoltà nel mantenere la messa a fuoco nel tempo.
- Stimare il numero di campioni da visualizzare per esperimento. Ad esempio, utilizzare un obiettivo 10x con un tempo di campionamento minimo di ~30 s per l'imaging di tre setti e l'imaging fino a 40 eventi di fecondazione per esperimento a causa del tempo richiesto per le funzioni di autofocus e acquisizione multistadio.
2. Preparazione del mezzo di germinazione del polline
- Preparare il terreno liquido di germinazione del polline (5mM CaCl2, 1mM MgSO4, 5mM KCl, 0,01% [p/v] H 3 BO3e 10% [p/v] saccarosio) utilizzando 1 M di aliquote di ciascun micronutriente, che sono immagazzinate a -20 °C. Regolare il pH a 7,5 con 0,1 M KOH. Conservare il fluido a 4 °C per un massimo di 2 settimane.
NOTA: Il pH può diminuire nel tempo. - Aggiungere 2,5 ml di mezzo liquido in un becher da 10 ml e aggiungere lentamente 32 mg di agarosio a bassissimo punto di fusione (~ 1,3%) con una barra di agitazione a rotazione rapida per evitare l'aggregazione.
- Fondere l'agarosio su una piastra riscaldante a 65 °C e nutare il becher per raccogliere l'eventuale condensa dai lati.
- Pipettare 130 μL di terreno nel pozzetto da 14 mm di un piatto inferiore di vetro da 35 mm e ruotare il piatto fino a quando il mezzo copre il pozzetto.
- Aspirare un totale di 40 μL con una pipetta dal centro del piatto, lasciando dietro di sé un volume totale di 90 μL.
NOTA: più mezzo può essere aspirato dal pozzo per ottenere un volume totale inferiore; Ciò può essere necessario per obiettivi ad alto ingrandimento con basse distanze di lavoro. Tuttavia, più sottile è il pad di agar, più velocemente si asciugherà. - Raffreddare il piatto su un blocco di alluminio in una camera di umidità per garantire un raffreddamento uniforme. Conservare le piastre a 4 °C durante la notte per l'uso la mattina successiva.
3. Messa in scena floreale di donatori di setto, donatori di stigma e donatori di polline
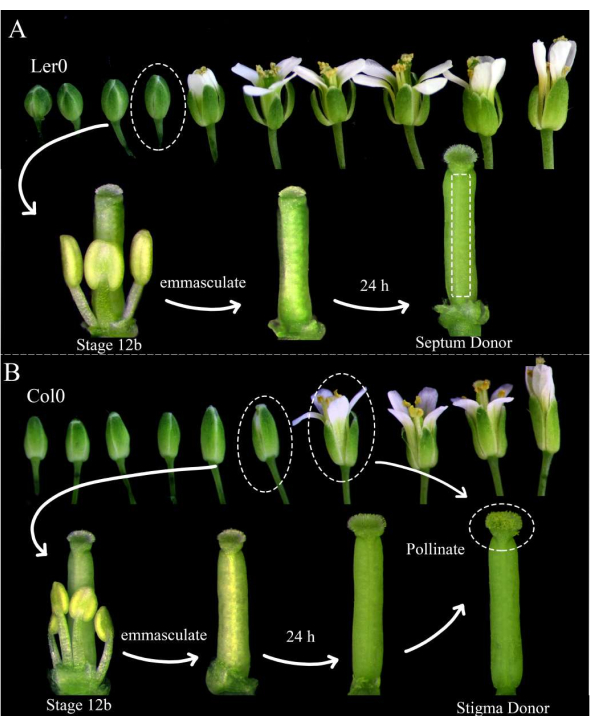
Figura 1: Stadiazione floreale di donatori di setto, donatori di stigma e donatori di polline. (A) Stadi dei fiori di Arabidopsis (Ler-0) all'interno di un'infiorescenza. Le gemme allo stadio 12B, che hanno petali che stanno per aprirsi e antere gialle indeiscenti , dovrebbero essere evirate rimuovendo tutti i sepali, i petali e gli stami. I pistilli (che ospitano il produttore di gametofiti femminili) sono quindi utilizzabili come donatori di setto 24 ore dopo. (B) Stadi dei fiori di Arabidopsis (Col-0) all'interno di un'infiorescenza. Le gemme allo stadio 12B, che hanno antere gialle indeiscenti e stimmi che emergono appena dai petali, dovrebbero essere evirati rimuovendo tutti i sepali, i petali e gli stami. I pistilli sono quindi utilizzabili come donatori di stigma 24 ore dopo, quando dovrebbero essere impollinati da fiori (che ospitano il marcatore del gametofito maschile) che sono aperti e spargono polline. Gli stimmi impollinati devono essere sezionati entro 1 ora dall'impollinazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
- La mattina prima dell'imaging, scegli le piante di Arabidopsis da utilizzare come donatrici di setto e donatrici di stigma; assicurarsi che siano sani e abbiano recentemente iniziato a produrre siliques.
NOTA: Landsberg erecta (Ler-0) è una buona adesione per l'uso come donatore di setto, poiché i suoi setti sono robusti e ci sono piccoli internodi tra gli ovuli. Columbia (Col-0) è una buona adesione da utilizzare come donatore di stigma perché sembrano essere favorevoli alla crescita del tubo pollinico. - Evirare almeno tre fiori donatori di setto 12B stadio e 12 fiori donatori stigmatizzati stadio 12B rimuovendo i loro stami, sepali e petali (Figura 1A, B). Rimuovere anche i fiori più vecchi sulla stessa infiorescenza, che potrebbero potenzialmente impollinare il fiore evirato.
- Al mattino, 24 ore dopo, impollinare i donatori di stigma con i fiori del donatore di polline (ad esempio, che ospitano il tubo pollinico o i marcatori delle cellule spermatiche) che stanno prontamente spargendo polline. L'impollinazione è completa quando gli stimmi sono quasi completamente ricoperti di polline (Figura 1B).
4. Dissezione del setto
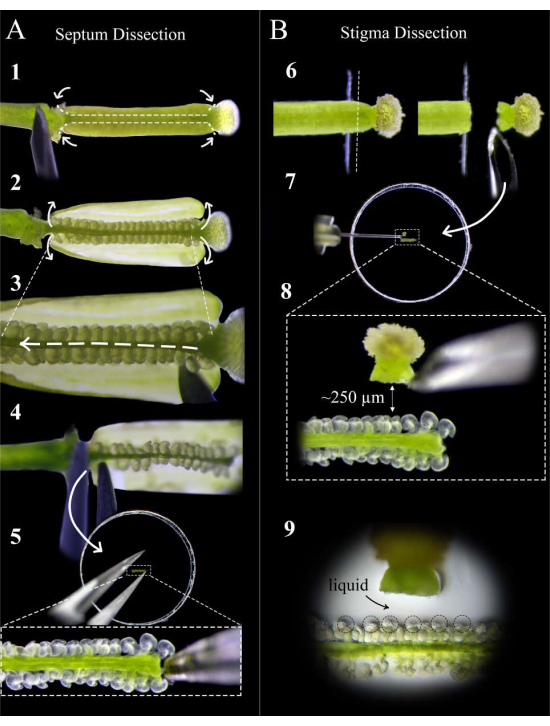
Figura 2: Una guida rapida alla dissezione del setto e dello stigma . (A) Fasi della dissezione del setto. Appuntare il pistillo su nastro biadesivo con un ago da siringa da insulina ed effettuare tagli alla giunzione stile-ovaio e alla giunzione ovaio-peduncolo, seguiti da un taglio poco profondo lungo il setto di entrambi i carpelli (Fase 1). Sbucciare nuovamente le pareti del cartello sul nastro (passaggio 2). Tagliare il replum sotto il setto superiore (Step 3). Tagliare il setto allo stilo e rimuovere usando una pinza sul pedicello (passaggio 4). Posizionare il setto su un mezzo di agar e incorporarlo delicatamente con una pinza. (B) Fasi della dissezione dello stigma. Appuntare il pistillo (impollinato <1 ora prima) su nastro biadesivo e tagliare la giunzione stile-ovaio con una lametta da barba (Passo 6). Posizionare lo stigma su un terreno di agar con un ago da insulina vicino al setto e regolare la distanza a circa 250 μm (Passi 7-8). Assicurarsi che si formi una piscina semi-liquida attorno ai micropili e alla base degli stili (Passo 9). Fare clic qui per visualizzare una versione ingrandita di questa figura.
- Trenta minuti dopo l'impollinazione, raccogli i pistilli sani e maturi del donatore di setto al peduncolo e mettili su nastro adesivo biadesivo fresco montato su un vetrino, con lo stigma che si attacca appena fuori dal bordo del nastro.
NOTA: Limitare il tempo di dissezione per il quale i pistilli sono sul nastro adesivo per assicurarsi che sia il più breve possibile. La dissezione deve essere condotta ad alta umidità, che può essere ottenuta posizionando un umidificatore accanto al vetrino. - Fissare saldamente il pistillo sul nastro premendo delicatamente sul peduncolo e lungo l'ovaio usando il lato posteriore di un nuovo ago da siringa da insulina prima di rimuovere i detriti di sepalo, petalo e stame rimasti dall'evirazione.
- Sotto uno stereoscopio, utilizzare un ago da siringa da insulina per effettuare due tagli per carpello alla giunzione stile-ovaio e alla giunzione ovaio-peduncolo, seguiti da tagli poco profondi lungo il setto di ciascun carpello (Figura 2, fase 1).
NOTA: Tagliare troppo profondamente lungo il setto recide gli ovuli al funicolare. - Staccare accuratamente le pareti dell'ovaio sul nastro (Figura 2, fase 2) e far scorrere delicatamente l'ago tra i due setti per tagliare il replum lungo l'intera lunghezza del pistillo senza disturbare gli ovuli (Figura 2, fase 3).
NOTA: Tagliare il replum nella direzione dallo stilo al peduncolo per assicurarsi che gli ovuli sul setto superiore siano disturbati il meno possibile. - Tagliare delicatamente il setto superiore sia alla giunzione con lo stilo che con il peduncolo e rimuovere il setto con una pinza dal lato del peduncolo (Figura 2, passo 4).
NOTA: Mantenere questo taglio dritto e delicato in modo che il setto rimanga piatto e non si pieghi. - Posizionare il setto il più piatto possibile sul terreno in modo che i micropili degli ovuli siano rivolti verso l'alto e sullo stesso piano focale. Premere delicatamente il setto nel mezzo fino a quando gli ovuli sono leggermente incorporati nel mezzo (Figura 2, fase 5).
NOTA: È fondamentale che il setto sia posizionato in modo tale che i micropili degli ovuli siano accessibili ai tubi pollinici (eventuali ovuli inaccessibili possono essere delicatamente riorganizzati con un ago). Una piccola piscina di liquido dovrebbe formarsi attorno al setto dopo l'incorporazione. - Ripetere i passaggi 4.1-4.6 per un massimo di altri due pistilli, posizionando i setti da un capo all'altro.
5. Dissezione dello stigma
- Posizionare i pistilli del donatore di stigma impollinato su nastro adesivo biadesivo fresco montato su un vetrino, in modo tale che la giunzione in stile ovaio sia fuori dal bordo del nastro (Figura 2, passaggio 6).
- Utilizzare una nuova lama di rasoio per tagliare lo stilo verso il basso e sollevare per mantenere lo stigma attaccato alla lama (Figura 2, passaggio 6).
NOTA: Tagliare sul bordo del nastro per il taglio più pulito. - Rimuovere lo stigma dalla lama con un ago da siringa da insulina e posizionarlo piatto a circa 250-300 μm dagli ovuli (Figura 2, passaggi 7-8).
NOTA: lo stile deve essere orientato orizzontalmente su un lato; Altrimenti, la maggior parte dei tubi pollinici crescerà sotto il setto. Una piccola pozza di liquido all'ingresso dello stile dovrebbe apparire dopo che è stata sdraiata sul supporto per 1 minuto; Questo è un buon segno, poiché i tubi pollinici avranno un'uscita liscia dallo stile. - Ripeti i passaggi 5.1-5.3 per un massimo di 12 stigmi, posizionandone due su entrambi i lati di ciascun setto. Cerca una piccola pozza di liquido che si forma attorno al micropilo degli ovuli; ciò aiuta l'accessibilità e il targeting dei tubi pollinici verso le sacche embrionali (Figura 2, fase 9).
NOTA: Limitare la quantità di tempo in cui il piatto è aperto per evitare che il mezzo e gli ovuli si secchino.
6. Imaging
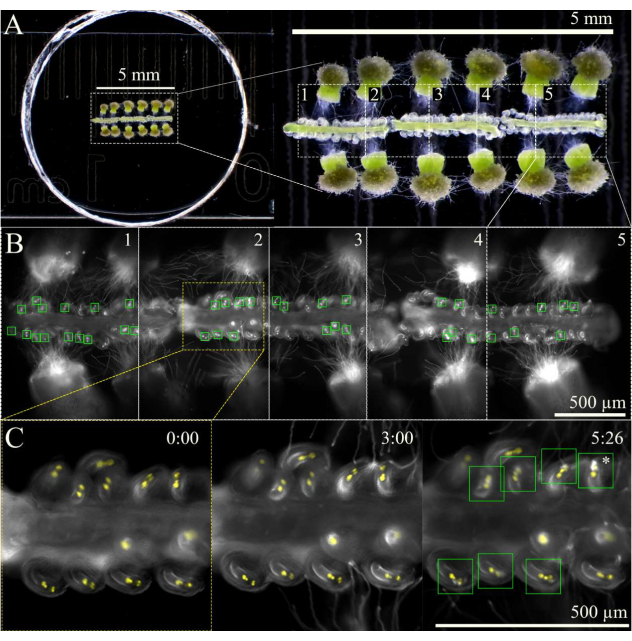
Figura 3: Schema di imaging SIV cum septum. (A) Configurazione completa SIV cum settum con 12 stimmi impollinati e 3 setti, visti attraverso uno stereoscopio. (B) Immagini unite dell'intera configurazione SIV con setto visto in A 5 ore dopo l'incubazione utilizzando un obiettivo 10x, con le cinque aree panoramiche (~ 1 mm ciascuna) contrassegnate per l'acquisizione multistadio. Le caselle verdi mostrano gli ovuli che hanno ricevuto tubi pollinici subendo un'esplosione esplosiva nei sinergici. (C) Vista ravvicinata dell'area panoramica 2 in diversi punti temporali. Circa 3 ore dopo l'incubazione nella camera di umidità al microscopio, i tubi pollinici dovrebbero arrivare vicino ai micropili e, entro 6 ore di imaging, la maggior parte degli ovuli dovrebbe aver ricevuto correttamente i tubi pollinici (quadrati verdi); Questi ovuli subiscono quindi lo scoppio esplosivo del tubo pollinico (asterisco). Barre di scala = (A) 5 mm, (B,C) 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Una volta che la dissezione è fatta e il piatto è pronto per essere ripreso, lasciarlo incubare in una camera di umidità sul microscopio mantenuto al 92% di umidità relativa e 21 ° C.
NOTA: Se non è disponibile una camera di umidità per il microscopio, rivestire i bordi esterni del coperchio e del piatto con un piccolo volume d'acqua contribuirà a mantenere un alto livello di umidità nel piatto. - Mettere a fuoco i campioni in campo chiaro a bassa intensità luminosa, quindi passare alla luce fluorescente, contrassegnando le aree del campione sulla panoramica dello stage da riprendere.
NOTA: Con un ingrandimento 10x, è possibile contrassegnare circa cinque aree per un totale di tre setti (Figura 3). Limitare la quantità di tempo utilizzata per contrassegnare le aree di panoramica per ridurre al minimo la fototossicità o il riscaldamento del campione da parte della luce fluorescente. - Inizia a scattare immagini utilizzando uno schema di acquisizione multistadio con una funzione di messa a fuoco automatica all'inizio di ogni area panoramica. Poiché i tubi pollinici emergeranno dallo stile ~ 1 h dopo aver incubato il campione, ritardare l'acquisizione di 2 ore o fino a quando i tubi pollinici hanno raggiunto il micropilo. Assicurarsi che l'autofocus sia impostato con un intervallo di 100 μm (passi grandi 7 μm e passi sottili di 1 μm) per mantenere gli ovuli a fuoco mentre i setti si muovono leggermente e affondano nel tempo.
- Interrompere l'acquisizione dell'immagine ~ 9 ore dopo aver iniziato l'incubazione del campione, poiché a questo punto, la maggior parte degli ovuli dovrebbe aver attratto e ricevuto un tubo pollinico.
NOTA: Se un basso numero di ovuli attira i tubi pollinici, un'attenta osservazione del piatto sotto uno stereoscopio è utile per determinare come l'orientamento dell'ovulo o dello stile potrebbe essere migliorato la prossima volta.
Risultati
Per valutare i tempi della degenerazione nucleare nel sinergide ricettivo rispetto alla rottura del tubo pollinico in Arabidopsis , nonché per osservare se il sinergico sinistro o destro è predestinato a diventare il sinergico ricettivo, il metodo SIV cum septum qui descritto è stato impiegato utilizzando un marcatore nucleare gametofito femminile impilato con un marcatore citosolico sinergico (pFG: roGFP2-ORP1-NLS, pMYB98:roGFP2-ORP1) come donatore di setto e marcatore di gametofito maschil...
Discussione
Questo manoscritto introduce un protocollo efficiente per l'imaging della ricezione del tubo pollinico e della doppia fecondazione in Arabidopsis. Il metodo migliorato, SIV cum septum, aumenta notevolmente la percentuale e il numero totale di eventi di ricezione del tubo pollinico osservabili con successo per sessione di imaging. I risultati rappresentativi mostrati qui dimostrano una sessione di imaging con 41 eventi di ricezione del tubo pollinico di successo e 10 ovuli che mostrano difetti di ricezio...
Divulgazioni
Gli autori non segnalano conflitti di interesse.
Riconoscimenti
Ringraziamo Sara Simonini e Stefano Bencivenga per aver donato il costrutto pFG:roGFP2-ORP1-NLS e Christof Eichenberger, Johann Almendinger, Vincent Sutter e Celia Baroux per i loro consigli sulla microscopia. Riconosciamo gentilmente i consigli di Ravi Palanivelu, Philipp Denninger, Sharon Kessler, Mark Johnson, Tomokazu Kawashima e tutti gli altri alla Conferenza internazionale sulla riproduzione sessuale delle piante 2022 che hanno mostrato interesse per un protocollo su SIV cum septum. Questo lavoro è stato sostenuto dall'Università di Zurigo e da sovvenzioni del Fondo nazionale svizzero per la ricerca scientifica a U.G.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mm glass slide | Epredia | 16211551 | |
| 35 mm glass bottom dish (14 mm well) | Mattek | P35G-1.5-14-C | |
| Calcium Chloride | Roth | CN93.1 | |
| Columbia (Col-0) | Nottingham Arabidopsis Stock Centre (NASC) | stigma donor | |
| Dissecting Scope | Olympus | SZX2-ILLT | |
| Insulin needle (0.3 G) | BD | 304000 | |
| Landsberg erecta (Ler-0) | Nottingham Arabidopsis Stock Centre (NASC) | septum donor | |
| Magnesium Sulfate | Merck | 5886 | |
| Potassium Chloride | Roth | 6781.1 | |
| Razor blade | Beldura | 7026797 | |
| Scotch double sided tape | Scotch | 768720 | Less thick and good for stigma dissection |
| Sodium Chloride | Roth | 3957.1 | |
| Sucrose | ITW reagents | A2211,1000 | |
| Tesa double sided tape | Tesa | 05681-00018 | Very sticky and good for septum dissection |
| Ultra low gelling temperature agarose | FMC SeaPrep | 50302 |
Riferimenti
- Huck, N., Moore, J. M., Federer, M., Grossniklaus, U. The Arabidopsis mutant feronia disrupts the female gametophytic control of pollen tube reception. Development. 130 (10), 2149-2159 (2003).
- Rotman, N., et al. Female control of male gamete delivery during fertilization in Arabidopsis thaliana. Current Biology. 13 (5), 432-436 (2003).
- Palanivelu, R., Preuss, D. Distinct short-range ovule signals attract or repel Arabidopsis thaliana pollen tubes in vitro. BMC Plant Biology. 6, 7 (2006).
- Susaki, D., Maruyama, D., Yelagandula, R., Berger, F., Kawashima, T. Live-cell imaging of F-actin dynamics during fertilization in Arabidopsis thaliana. Methods in Molecular Biology. 1669, 47-54 (2017).
- Iwano, M., et al. Cytoplasmic Ca2+ changes dynamically during the interaction of the pollen tube with synergid cells. Development. 139 (22), 4202-4209 (2012).
- Ngo, Q., Vogler, H., Lituiev, D., Nestorova, A., Grossniklaus, U. A calcium dialog mediated by the FERONIA signal transduction pathway controls plant sperm delivery. Developmental Cell. 29 (4), 491-500 (2014).
- Denninger, P., et al. Male-female communication triggers calcium signatures during fertilization in Arabidopsis. Nature Communications. 5, 4645 (2014).
- Hamamura, Y., et al. Live imaging of calcium spikes during double fertilization in Arabidopsis. Nature Communications. 5, 4722 (2014).
- Ponvert, N., Johnson, M. Synergid calcium ion oscillations define a new feature of pollen tube reception critical for blocking interspecific hybridization. bioRxiv. , (2020).
- Hamamura, Y., et al. Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Current Biology. 21 (6), 497-502 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon