Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Живая визуализация приема пыльцевой трубки Arabidopsis и двойного оплодотворения с использованием метода полу-in vitro cum septum
В этой статье
Резюме
Здесь мы описываем усовершенствование метода полу-in vitro (SIV) для наблюдения за наведением и приемом пыльцевой трубки у Arabidopsis thaliana, что повышает восприимчивость яйцеклеток. Высокопроизводительный метод SIV cum septum может быть связан с маркерными линиями гаметофитов и генетически кодируемыми биосенсорами для мониторинга динамического процесса оплодотворения.
Аннотация
У цветковых растений рост и направление пыльцевой трубки (мужского гаметофита) внутри пестика и прием пыльцевой трубки женским гаметофитом необходимы для двойного оплодотворения и последующего развития семян. Взаимодействие между мужскими и женскими гаметофитами во время приема пыльцевой трубки завершается разрывом пыльцевой трубки и высвобождением двух сперматозоидов для осуществления двойного оплодотворения. Поскольку рост пыльцевой трубки и двойное оплодотворение глубоко скрыты в тканях цветка, этот процесс трудно наблюдать in vivo.
Метод полу-in vitro (SIV) для визуализации оплодотворения в живых клетках модельного растения Arabidopsis thaliana был разработан и внедрен в нескольких исследованиях. Эти исследования помогли выяснить фундаментальные особенности того, как происходит процесс оплодотворения у цветковых растений и какие клеточные и молекулярные изменения происходят при взаимодействии мужских и женских гаметофитов. Однако, поскольку эти эксперименты по визуализации живых клеток включают удаление отдельных яйцеклеток, они ограничены небольшим количеством наблюдений за сеанс визуализации, что делает этот подход утомительным и очень трудоемким. Среди других технических трудностей часто сообщается о неспособности пыльцевых трубок оплодотворить яйцеклетки in vitro , что серьезно затрудняет такие анализы.
Здесь представлен подробный видеопротокол для визуализации приема и оплодотворения пыльцевой трубки автоматизированным и высокопроизводительным способом, что позволяет проводить до 40 наблюдений за приемом и разрывом пыльцевой трубки за сеанс визуализации. В сочетании с использованием генетически кодируемых биосенсоров и маркерных линий этот метод позволяет генерировать большие размеры выборки с меньшими затратами времени. Нюансы и критические моменты метода, включая постановку цветка, вскрытие, подготовку среды и визуализацию, четко детализированы в видеоформате, чтобы облегчить будущие исследования динамики наведения, приема и двойного оплодотворения пыльцевой трубки.
Введение
Рождение генетически уникального потомства у организмов, размножающихся половым путем, зависит от успешного слияния мужских и женских гамет. У цветковых растений взаимодействие двух мужских гамет (сперматозоидов) с двумя женскими гаметами (яйцеклеткой и центральной клеткой) при двойном оплодотворении зависит от высвобождения сперматозоидов из пыльцевой трубки (мужского гаметофита). Этот процесс, называемый рецепцией пыльцевой трубки, в значительной степени контролируется синергидными клетками, которые находятся в зародышевом мешке (женский гаметофит)1,2. Поскольку прием пыльцевой трубки происходит глубоко внутри цветка, был создан метод, позволяющий визуализировать процесс в живых клетках, называемый приемом пыльцевой трубки полуin vitro (SIV)3. С помощью этого метода иссеченные семяпочки Arabidopsis помещают на полужидкую среду для прорастания пыльцы и нацелены на пыльцевые трубки, которые прорастают через рыльце и стиль пестика, разорванного на стыке 3,4, передающего стиль. С момента разработки этого метода подробные наблюдения привели к нескольким открытиям, связанным с руководством, приемом и оплодотворением пыльцевых трубок. Среди прочего, эти открытия включают приобретение способности нацеливания на пыльцевые трубки путем роста через стигму3, начало внутриклеточных колебаний кальция в синергидах при поступлении пыльцевой трубки 5,6,7,8,9 и динамику высвобождения и оплодотворения сперматозоидов при разрыве пыльцевой трубки10 . Тем не менее, поскольку этот метод основан на иссечении яйцеклеток, количество наблюдений за оплодотворением ограничено, а прием пыльцевой трубки часто является аберрантным, что приводит к отказу от разрыва пыльцевой трубки (видео 1 и дополнительный файл 1). Поэтому существует потребность в более эффективном подходе, позволяющем проводить высокопроизводительный анализ приема и оплодотворения пыльцевых трубок.
При разработке этого протокола было протестировано несколько новых подходов к анализу приема пыльцевой трубки, охватывающих от самых «пробирочных» до самых «естественных методов», и была разработана эффективная методика, основанная на иссечении всей перегородки, которая позволяет проводить до 40 наблюдений за оплодотворением в день. Здесь описываются нюансы и критические моменты техники, включая постановку цветов, вскрытие, подготовку среды и настройки изображения. Следуя этому протоколу, следует облегчить исследования, посвященные наведению пыльцевой трубки, приему пыльцевой трубки и двойному оплодотворению. Ожидается, что более высокие размеры выборки, допускаемые методом, поддержат научную обоснованность выводов, сделанных из экспериментов с визуализацией в реальном времени. Потенциальные применения этого метода включают, но не ограничиваются этим, выполнение наблюдений за молекулярными и физиологическими изменениями цитозольных концентраций кальция ([Ca2+] цит), рН или H 2 O2 вовремя взаимодействия гаметофитов с использованием генетически кодируемых биосенсоров. Кроме того, цитологические изменения, такие как дегенерация рецептивного синергида, миграция сперматозоидов или кариогамия, можно легче наблюдать с помощью этого улучшенного метода. Наконец, сроки различных стадий оплодотворения можно контролировать с помощью широкопольной микроскопии, а затем можно провести более подробный анализ с использованием конфокальной лазерной сканирующей микроскопии (CLSM) или двухфотонной микроскопии возбуждения (2PEM) для более высокого разрешения и 3D-реконструкции.
протокол
ПРИМЕЧАНИЕ: См. Таблицу материалов для получения списка материалов и оборудования, используемых в этом протоколе.
1. Соображения по планированию эксперимента по визуализации
- Заранее определите продолжительность визуализации и частоту выборки, необходимые для захвата желаемого наблюдаемого явления. Например, в соответствии с теоремой Найквиста частота дискретизации должна быть более чем в два раза больше самой высокой частоты входной выборки. Поэтому, чтобы точно улавливать синергидные [Ca2+] колебания цитов , выполняйте визуализацию примерно каждые 10 с, но для измерения скорости сперматозоидов при выделении пыльцевой трубки обеспечьте временное разрешение менее 1 с10.
- Выберите флуоресцентные маркеры для интересующих клеток, которые достаточно яркие за пределами фоновой автофлуоресценции. Для использования биосенсоров выбирайте самые яркие линии, которые не нарушают функцию клеток, так как они, как правило, более чувствительны и требуют меньшего времени воздействия.
- Рассмотрим, какой тип флуоресцентной микроскопии и увеличения наиболее подходит для захвата нужного явления. Используйте широкопольную микроскопию и объективы с малым увеличением, чтобы улавливать свет с большей глубины резкости и сохранять фокусировку с течением времени, получать изображения более крупных объектов, таких как целые яйцеклетки, или использовать ратиометрические датчики, чувствительные к артефактам хроматического сдвига. Используйте CLSM или 2PEM с объективами с большим увеличением для лучшего разрешения клеточных и субклеточных объектов, но обратите внимание на трудности в поддержании фокусировки с течением времени.
- Оцените количество образцов, которые будут визуализированы в каждом эксперименте. Например, используйте 10-кратный объектив с минимальным временем выборки ~ 30 с для визуализации трех перегородок и визуализации до 40 событий оплодотворения за эксперимент из-за времени, необходимого для функций автофокусировки и многоступенчатого захвата.
2. Подготовка среды для проращивания пыльцы
- Приготовьте жидкую среду для проращивания пыльцы (5 мМ CaCl2, 1 мМ MgSO4, 5 мМ KCl, 0,01% [мас./об.] H 3 BO3и 10% [мас./об.] сахарозы) с использованием 1 М аликвотных запасов каждого микроэлемента, которые хранятся при -20 °C. Отрегулируйте рН до 7,5 с помощью 0,1 М КОН. Храните среду при температуре 4 °C до 2 недель.
ПРИМЕЧАНИЕ: pH со временем может упасть. - Добавьте 2,5 мл жидкой среды в стакан объемом 10 мл и медленно добавьте 32 мг агарозы со сверхнизкой температурой плавления (~ 1,3%) с помощью быстро вращающейся мешалки, чтобы избежать образования комков.
- Растопите агарозу на плите при температуре 65 ° C и измельчите стакан, чтобы собрать конденсат с боков.
- Пипетка 130 мкл среды в 14-миллиметровый лунок стеклянной нижней чашки диаметром 35 мм и вращайте посуду, пока среда не покроет лунку.
- Аспирируйте в общей сложности 40 мкл с помощью пипетки из центра чашки, оставляя общий объем 90 мкл.
ПРИМЕЧАНИЕ: Из скважины можно отсасывать больше среды для достижения меньшего общего объема; Это может быть необходимо для объективов с большим увеличением и малыми рабочими расстояниями. Однако чем тоньше агаровая подушка, тем быстрее она высохнет. - Охладите блюдо на алюминиевом блоке во влажной камере, чтобы обеспечить равномерное охлаждение. Храните пластины при температуре 4 °C на ночь, чтобы использовать их на следующее утро.
3. Цветочная постановка доноров перегородки, доноров стигмы и доноров пыльцы
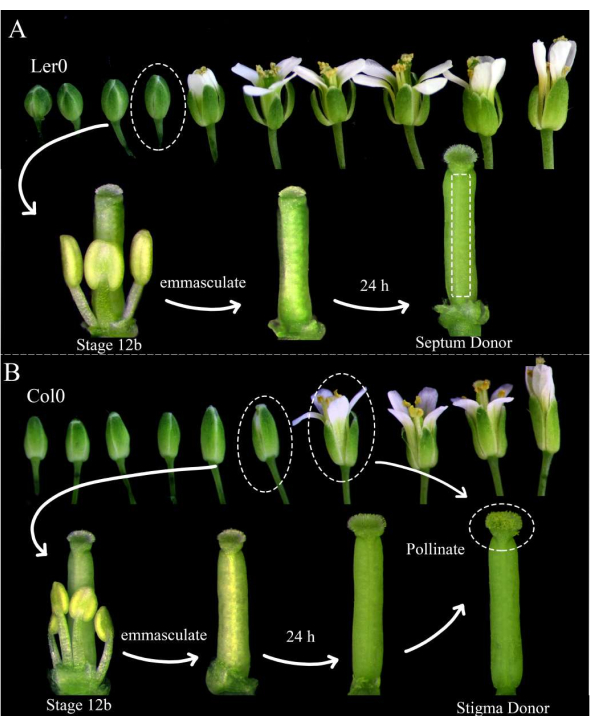
Рисунок 1: Цветочная постановка доноров перегородки, доноров стигмы и доноров пыльцы. (A) Стадии цветков арабидопсиса (Ler-0) в соцветии. Бутоны на стадии 12В, у которых лепестки вот-вот раскроются и желтеют нераскрывающиеся пыльники, следует выхолостить, удалив все чашелистики, лепестки и тычинки. Пестики (укрывающие самку-производителя гаметофита) затем могут быть использованы в качестве доноров перегородки через 24 часа. (B) Стадии цветков арабидопсиса (Col-0) в соцветии. Бутоны на стадии 12B, которые имеют желтые нераскрывающиеся пыльники и рыльца, которые едва выходят из лепестков, следует выхолостить, удалив все чашелистики, лепестки и тычинки. Пестики затем можно использовать в качестве доноров рыльца через 24 часа, когда они должны быть опылены цветами (содержащими мужской маркер гаметофита), которые открыты и сбрасывают пыльцу. Опыляемые рыльца должны быть рассечены в течение 1 ч после опыления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Утром перед визуализацией выберите растения арабидопсиса , которые будут использоваться в качестве доноров перегородки и доноров стигмы; Убедитесь, что они здоровы и недавно начали производить силики.
ПРИМЕЧАНИЕ: Landsberg erecta (Ler-0) является хорошим дополнением для использования в качестве донора перегородки, так как ее перегородки прочные, а между яйцеклетками есть небольшие междоузлия. Columbia (Col-0) является хорошим дополнением для использования в качестве донора стигмы, потому что они, по-видимому, способствуют росту пыльцевых трубок. - Выхолащивайте по крайней мере три цветка-донора перегородки 12-й стадии 12B и цветы-доноры 12-го этапа 12B, удаляя их тычинки, чашелистики и лепестки (рис. 1A, B). Удалите также более старые цветы на том же соцветии, которые потенциально могут опылить выхолощенный цветок.
- Утром, через 24 часа, опыляйте доноров рыльца цветами-донорами пыльцы (например, содержащими пыльцевую трубку или маркеры сперматозоидов), которые легко сбрасывают пыльцу. Опыление завершается, когда рыльца почти полностью покрыты пыльцой (рис. 1Б).
4. Рассечение перегородки
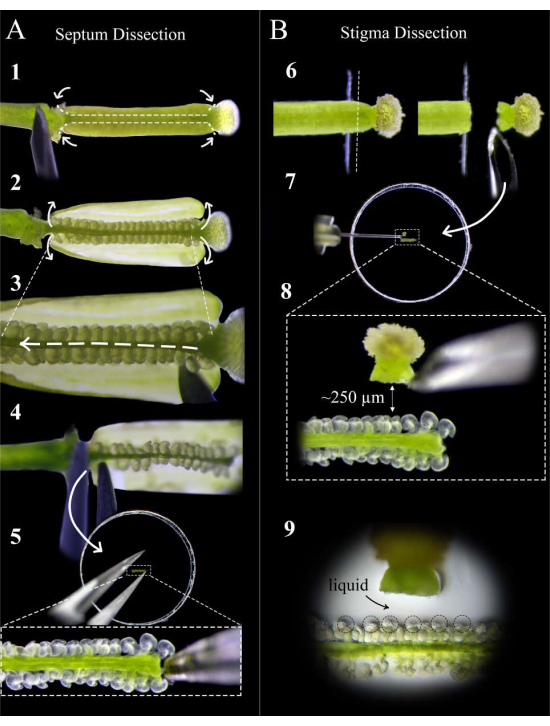
Рисунок 2: Краткое руководство по вскрытию перегородки и стигмы . (А) Этапы рассечения перегородки. Закрепите пестик на двустороннем скотче иглой инсулинового шприца и сделайте надрезы на стыке стыка яичника и ножки, а затем неглубокий разрез вдоль перегородки любого плодолистика (шаг 1). Снимите стенки плодолистика обратно на ленту (шаг 2). Срежьте сливу под верхней перегородкой (шаг 3). Разрежьте перегородку в месте укладки и удалите щипцами на цветоножке (шаг 4). Поместите перегородку на агаровую среду и аккуратно вставьте щипцами. (B) Этапы вскрытия стигматизации. Приколите пестик (опыленный за <1 час до этого) к двустороннему скотчу и разрежьте лезвием бритвы на стыке стиля и завязи (шаг 6). Поместите рыльце на агаровую среду инсулиновой иглой рядом с перегородкой и отрегулируйте расстояние примерно до 250 мкм (шаги 7-8). Убедитесь, что вокруг микропил и основания стилей образуется полужидкий бассейн (шаг 9). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Через тридцать минут после опыления соберите здоровые и зрелые пестики-доноры перегородки на цветоножке и поместите их на свежую двустороннюю липкую ленту, установленную на предметном стекле, при этом рыльце торчит прямо с края ленты.
ПРИМЕЧАНИЕ: Ограничьте время вскрытия, в течение которого пестики находятся на липкой ленте, чтобы оно было как можно короче. Вскрытие следует проводить при повышенной влажности воздуха, чего можно добиться, разместив рядом с предметным стеклом увлажнитель воздуха. - Надежно прижмите пестик к ленте, осторожно надавливая на ножку и вдоль яичника с помощью тыльной стороны новой иглы инсулинового шприца, прежде чем удалить чашелистик, лепесток и остатки тычинок, оставшиеся от выхолащивания.
- Под стереоскопом с помощью иглы инсулинового шприца сделайте два надреза на плодолистик на стыке стыка-яичника и стыке яичника и ножки, а затем неглубокие надрезы вдоль перегородки каждого плодолистика (рис. 2, шаг 1).
ПРИМЕЧАНИЕ: Слишком глубокий разрез вдоль перегородки приведет к разрыву яйцеклеток в фуникулюсе. - Осторожно снимите стенки яичника на ленту (рис. 2, шаг 2) и осторожно проведите иглой между двумя перегородками, чтобы разрезать репликатор по всей длине пестика, не нарушая семяпочки (рис. 2, шаг 3).
ПРИМЕЧАНИЕ: Срежьте реплюм по направлению от стиля к ножке, чтобы как можно меньше нарушать семяпочки на верхней перегородке. - Аккуратно разрежьте верхнюю перегородку как на стыке со стилем, так и на ножке и удалите перегородку щипцами со стороны ножки (рисунок 2, шаг 4).
ПРИМЕЧАНИЕ: Держите этот разрез прямым и нежным, чтобы перегородка оставалась плоской и не искривлялась. - Поместите перегородку как можно более плоско на среду так, чтобы микропилы семяпочек были обращены вверх и находились в одной фокальной плоскости. Осторожно вдавливайте перегородку в среду, пока семяпочки не будут слегка встроены в среду (рисунок 2, шаг 5).
ПРИМЕЧАНИЕ: Очень важно, чтобы перегородка была размещена таким образом, чтобы микропилы семяпочек были доступны для пыльцевых трубок (любые недоступные яйцеклетки можно аккуратно переставить с помощью иглы). После заделки вокруг перегородки должна образоваться небольшая лужица жидкости. - Повторите шаги 4.1-4.6 еще до двух пестиков, располагая перегородки встык.
5. Вскрытие стигмы
- Поместите опыляемые пестики-доноры рыльца на свежую двустороннюю клейкую ленту, установленную на стеклянном предметном стекле, так, чтобы соединение в виде завязи оторвалось от края ленты (рис. 2, шаг 6).
- С помощью свежего лезвия бритвы срежьте стиль прямо вниз и отнимите, чтобы рыльце оставалось прикрепленным к лезвию (рисунок 2, шаг 6).
ПРИМЕЧАНИЕ: Разрежьте по краю ленты для максимально чистого среза. - Удалите рыльце с лезвия с помощью иглы инсулинового шприца и поместите его на расстоянии примерно 250-300 мкм от семяпочек (рис. 2, шаги 7-8).
ПРИМЕЧАНИЕ: Стиль должен быть ориентирован горизонтально на бок; В противном случае большая часть пыльцевых трубок будет прорастать вниз под перегородкой. Небольшая лужица жидкости на входе стиля должна появиться после того, как она пролежала на среде 1 мин; Это хороший знак, так как пыльцевые трубки будут иметь плавный выход из стиля. - Повторите шаги 5.1-5.3 до 12 рыльц, поместив по два с каждой стороны от каждой перегородки. Ищите небольшой бассейн жидкости, образующийся вокруг микропилы семяпочек; это способствует доступу и нацеливанию пыльцевых трубок на зародышевые мешочки (рис. 2, шаг 9).
ПРИМЕЧАНИЕ: Ограничьте время, в течение которого блюдо открыто, чтобы предотвратить высыхание среды и семяпочек.
6. Визуализация
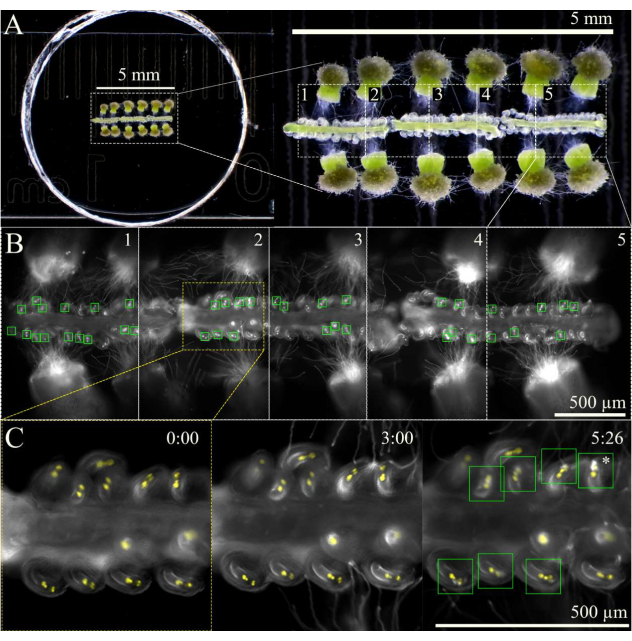
Рисунок 3: Схема визуализации перегородки. (A) Полная установка SIV cum septum с 12 опыляемыми рыльцами и 3 перегородками, как видно через стереоскоп. (B) Объединенные изображения полной установки перегородки SIV, видимые через 5 ч после инкубации с использованием 10-кратного объектива, с пятью областями обзора (~ 1 мм каждая), отмеченными для многоступенчатого захвата. Зеленые прямоугольники показывают яйцеклетки, получившие пыльцевые трубки, претерпевающие взрывной взрыв в синергидах. (C) Более пристальный обзор обзорной области 2 в различные моменты времени. Примерно через 3 ч после инкубации в камере влажности на микроскопе пыльцевые трубки должны прибыть к микропилам, а через 6 ч после визуализации большинство семяпочек должны были правильно получить пыльцевые трубки (зеленые квадраты); Затем эти яйцеклетки подвергаются взрывному взрыву пыльцевой трубки (звездочка). Масштабные линейки = (A) 5 мм, (B,C) 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- После того, как вскрытие будет завершено и чашка будет готова к визуализации, дайте ей инкубироваться в камере влажности на микроскопе при относительной влажности 92% и температуре 21 °C.
ПРИМЕЧАНИЕ: Если для микроскопа нет камеры влажности, выровняйте внешние края крышки и чашки небольшим объемом воды, чтобы поддерживать высокий уровень влажности в чашке. - Сфокусируйте образцы в ярком поле при низкой интенсивности света, а затем переключитесь на флуоресцентный свет, отмечая области образца на обзоре предметного столика для изображения.
ПРИМЕЧАНИЕ: При 10-кратном увеличении можно отметить около пяти областей, в общей сложности три перегородки (рис. 3). Ограничьте время, затрачиваемое на маркировку областей обзора, чтобы свести к минимуму фототоксичность или нагрев образца флуоресцентным светом. - Начните визуализацию с помощью многоступенчатой схемы сбора данных с функцией автофокусировки в начале каждой области обзора. Поскольку пыльцевые трубки выйдут из образца через ~ 1 ч после инкубации образца, отложите сбор на 2 ч или до тех пор, пока пыльцевые трубки не достигнут микропилы. Убедитесь, что автофокусировка настроена на диапазон 100 мкм (большие шаги 7 мкм и тонкие шаги 1 мкм), чтобы удерживать яйцеклетки в фокусе, поскольку перегородки слегка двигаются и опускаются с течением времени.
- Прекратите получение изображения через ~9 ч после начала инкубации образца, так как к этому времени большая часть яйцеклеток должна была притянуться и получить пыльцевую трубку.
ПРИМЕЧАНИЕ: Если небольшое количество яйцеклеток привлекает пыльцевые трубки, полезно внимательно наблюдать за чашкой под стереоскопом, чтобы определить, как в следующий раз можно улучшить яйцеклетку или ориентацию стиля.
Результаты
Для оценки времени ядерной дегенерации в рецептивном синергиде в отношении разрыва пыльцевой трубки у Arabidopsis , а также для наблюдения за тем, предопределено ли левому или правому синергиду стать рецептивным синергидом, был использован описанный здесь метод SIV cum septum с использо...
Обсуждение
В этой рукописи представлен эффективный протокол визуализации приема пыльцевой трубки и двойного оплодотворения у арабидопсиса. Усовершенствованный метод, SIV cum septum, значительно увеличивает процент и общее количество успешных событий приема пыльцевой трубки, которые наблюд...
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов.
Благодарности
Мы благодарим Сару Симонини и Стефано Бенсивенгу за пожертвование конструкции pFG:roGFP2-ORP1-NLS , а также Кристофа Эйхенбергера, Иоганна Альмендингера, Винсента Саттера и Селию Бару за их советы по микроскопии. Мы благодарим за советы Рави Паланивелу, Филиппа Деннингера, Шэрон Кесслер, Марка Джонсона, Томокадзу Кавасимы и всех остальных участников Международной конференции по репродукции половых растений 2022 года, которые проявили интерес к протоколу SIV cum septum. Эта работа была поддержана Цюрихским университетом и грантами Швейцарского национального научного фонда для У.Г.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mm glass slide | Epredia | 16211551 | |
| 35 mm glass bottom dish (14 mm well) | Mattek | P35G-1.5-14-C | |
| Calcium Chloride | Roth | CN93.1 | |
| Columbia (Col-0) | Nottingham Arabidopsis Stock Centre (NASC) | stigma donor | |
| Dissecting Scope | Olympus | SZX2-ILLT | |
| Insulin needle (0.3 G) | BD | 304000 | |
| Landsberg erecta (Ler-0) | Nottingham Arabidopsis Stock Centre (NASC) | septum donor | |
| Magnesium Sulfate | Merck | 5886 | |
| Potassium Chloride | Roth | 6781.1 | |
| Razor blade | Beldura | 7026797 | |
| Scotch double sided tape | Scotch | 768720 | Less thick and good for stigma dissection |
| Sodium Chloride | Roth | 3957.1 | |
| Sucrose | ITW reagents | A2211,1000 | |
| Tesa double sided tape | Tesa | 05681-00018 | Very sticky and good for septum dissection |
| Ultra low gelling temperature agarose | FMC SeaPrep | 50302 |
Ссылки
- Huck, N., Moore, J. M., Federer, M., Grossniklaus, U. The Arabidopsis mutant feronia disrupts the female gametophytic control of pollen tube reception. Development. 130 (10), 2149-2159 (2003).
- Rotman, N., et al. Female control of male gamete delivery during fertilization in Arabidopsis thaliana. Current Biology. 13 (5), 432-436 (2003).
- Palanivelu, R., Preuss, D. Distinct short-range ovule signals attract or repel Arabidopsis thaliana pollen tubes in vitro. BMC Plant Biology. 6, 7 (2006).
- Susaki, D., Maruyama, D., Yelagandula, R., Berger, F., Kawashima, T. Live-cell imaging of F-actin dynamics during fertilization in Arabidopsis thaliana. Methods in Molecular Biology. 1669, 47-54 (2017).
- Iwano, M., et al. Cytoplasmic Ca2+ changes dynamically during the interaction of the pollen tube with synergid cells. Development. 139 (22), 4202-4209 (2012).
- Ngo, Q., Vogler, H., Lituiev, D., Nestorova, A., Grossniklaus, U. A calcium dialog mediated by the FERONIA signal transduction pathway controls plant sperm delivery. Developmental Cell. 29 (4), 491-500 (2014).
- Denninger, P., et al. Male-female communication triggers calcium signatures during fertilization in Arabidopsis. Nature Communications. 5, 4645 (2014).
- Hamamura, Y., et al. Live imaging of calcium spikes during double fertilization in Arabidopsis. Nature Communications. 5, 4722 (2014).
- Ponvert, N., Johnson, M. Synergid calcium ion oscillations define a new feature of pollen tube reception critical for blocking interspecific hybridization. bioRxiv. , (2020).
- Hamamura, Y., et al. Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Current Biology. 21 (6), 497-502 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены