Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Live-Bildgebung der Arabidopsis-Pollensondenaufnahme und Doppelbefruchtung mit der Semi-In-vitro-Cum-Septum-Methode
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Verbesserung der Semi-in-vitro (SIV) Methode zur Beobachtung der Pollenschlauchführung und -aufnahme bei Arabidopsis thaliana, die die Empfänglichkeit der Eizellen erhöht. Die Hochdurchsatz-SIV-cum-Septum-Methode kann mit Gametophyten-Markerlinien und genetisch kodierten Biosensoren gekoppelt werden, um den dynamischen Prozess der Befruchtung zu überwachen.
Zusammenfassung
Bei Blütenpflanzen sind das Wachstum und die Führung des Pollenschlauchs (männlicher Gametophyt) innerhalb des Stempels und die Aufnahme des Pollenschlauchs durch den weiblichen Gametophyten essentiell für die Doppelbefruchtung und die anschließende Samenentwicklung. Die Interaktionen zwischen männlichen und weiblichen Gametophyten während der Pollenschlauchaufnahme gipfeln in einem Pollenschlauchriss und der Freisetzung von zwei Samenzellen, um eine doppelte Befruchtung zu bewirken. Da das Wachstum der Pollenschläuche und die doppelte Befruchtung tief im Gewebe der Blüte verborgen sind, ist dieser Prozess in vivo schwer zu beobachten.
Eine semi-in vitro (SIV) Methode zur Lebendzell-Bildgebung der Befruchtung in der Modellpflanze Arabidopsis thaliana wurde entwickelt und in mehreren Untersuchungen umgesetzt. Diese Studien haben dazu beigetragen, die grundlegenden Merkmale aufzuklären, wie der Befruchtungsprozess in Blütenpflanzen abläuft und welche zellulären und molekularen Veränderungen während der Interaktion der männlichen und weiblichen Gametophyten auftreten. Da diese Lebendzell-Imaging-Experimente jedoch die Exzision einzelner Eizellen beinhalten, sind sie auf eine geringe Anzahl von Beobachtungen pro Bildgebungssitzung beschränkt, was diesen Ansatz mühsam und sehr zeitaufwändig macht. Neben anderen technischen Schwierigkeiten wird häufig über ein Versagen der Pollenschläuche bei der Befruchtung der Eizellen in vitro berichtet, was solche Analysen stark beeinträchtigt.
Hier wird ein detailliertes Videoprotokoll für die Bildgebung der Pollenschlauchaufnahme und -befruchtung in einer automatisierten und Hochdurchsatzmethode bereitgestellt, das bis zu 40 Beobachtungen der Pollenschlauchaufnahme und -ruptur pro Bildgebungssitzung ermöglicht. In Verbindung mit dem Einsatz von genetisch kodierten Biosensoren und Markerlinien ermöglicht diese Methode die Generierung großer Stichprobengrößen mit reduziertem Zeitaufwand. Nuancen und kritische Punkte der Technik, einschließlich der Inszenierung von Blüten, der Präparation des Mediums und der Bildgebung, werden im Videoformat klar detailliert beschrieben, um zukünftige Forschungen zur Dynamik der Pollenschlauchführung, -aufnahme und -befruchtung zu erleichtern.
Einleitung
Die Erzeugung genetisch einzigartiger Nachkommen in sexuell reproduzierenden Organismen hängt von der erfolgreichen Verschmelzung männlicher und weiblicher Gameten ab. Bei Blütenpflanzen hängt die Interaktion zweier männlicher Gameten (Samenzellen) mit zwei weiblichen Gameten (Eizelle und Zentralzelle) während der Doppelbefruchtung von der Spermienfreisetzung aus dem Pollenschlauch (dem männlichen Gametophyten) ab. Dieser Prozess, der als Pollenschlauchempfang bezeichnet wird, wird weitgehend von den synergistischen Zellen gesteuert, die sich im Embryosack befinden (dem weiblichen Gametophyten)1,2. Da die Pollenschlauchaufnahme tief im Inneren der Blüte stattfindet, wurde eine Methode etabliert, die eine Bildgebung des Prozesses in lebenden Zellen ermöglicht, die als Semi-in-vitro (SIV) Pollenschlauchempfang bezeichnetwird 3. Bei dieser Methode werden herausgeschnittene Arabidopsis-Eizellen auf halbflüssiges Pollenkeimmedium gelegt und von Pollenschläuchen angegriffen, die durch das Stigma und den Stil eines Stempels wachsen, der an der stilübertragenden Traktverbindung 3,4 durchtrennt wird. Seit der Entwicklung dieser Technik haben detaillierte Beobachtungen zu mehreren Entdeckungen in Bezug auf die Führung, Aufnahme und Befruchtung von Pollenschläuchen geführt. Zu diesen Entdeckungen gehören unter anderem der Erwerb von Pollenschlauch-Targeting-Kompetenz durch Wachstum durch das Stigma3, das Einsetzen intrazellulärer Calciumoszillationen in den Synergieden bei Pollenschlauchankunft 5,6,7,8,9 und die Dynamik der Spermienfreisetzung und Befruchtung nach Pollenschlauchplatzen10 . Da diese Technik jedoch auf der Entfernung von Eizellen beruht, sind die Beobachtungen der Befruchtung in ihrer Anzahl begrenzt, und die Pollenschlauchaufnahme ist oft abweichend, was zum Versagen der Pollenschlauchruptur führt (Video 1 und Zusatzdatei 1). Daher besteht ein Bedarf an einem effizienteren Ansatz, der Hochdurchsatzanalysen der Pollenschlauchaufnahme und -befruchtung ermöglicht.
Bei der Entwicklung dieses Protokolls wurden mehrere neue Ansätze zur Analyse des Pollenschlauchempfangs getestet, die von den meisten "in vitro"- bis zu den "in vivo"-Methoden reichen, und es wurde eine effiziente Technik entwickelt, die auf der Exzision des gesamten Septums basiert und bis zu 40 Befruchtungsbeobachtungen pro Tag ermöglicht. Hier werden die Nuancen und kritischen Punkte der Technik skizziert, einschließlich der Inszenierung von Blumen, der Dissektion, der Vorbereitung des Mediums und der Bildgebungseinstellungen. Durch die Befolgung dieses Protokolls sollte die Forschung mit Schwerpunkt auf der Pollenschlauchführung, der Pollenschlauchaufnahme und der Doppelbefruchtung erleichtert werden. Es wird erwartet, dass die höheren Stichprobengrößen, die die Methode ermöglicht, die wissenschaftliche Solidität der Schlussfolgerungen aus Live-Bildgebungsexperimenten stärken. Zu den möglichen Anwendungen dieser Technik gehören unter anderem die Durchführung von Beobachtungen der molekularen und physiologischen Veränderungen der zytosolischen Calciumkonzentrationen ([Ca 2+ ]cyt), des pH-Werts oder H 2 O2während Gametophyteninteraktionen unter Verwendung genetisch kodierter Biosensoren. Darüber hinaus können zytologische Veränderungen, wie z.B. die Degeneration des rezeptiven Synergieds, die Migration von Samenzellen oder die Karyogamie, mit dieser verbesserten Methode leichter beobachtet werden. Schließlich kann das Timing der verschiedenen Stadien der Befruchtung unter Weitfeldmikroskopie überwacht werden, und dann können detailliertere Analysen mit konfokaler Laser-Scanning-Mikroskopie (CLSM) oder Zwei-Photonen-Anregungsmikroskopie (2PEM) für eine höhere Auflösung und 3D-Rekonstruktion durchgeführt werden.
Protokoll
HINWEIS: In der Materialtabelle finden Sie eine Liste der in diesem Protokoll verwendeten Materialien und Geräte.
1. Überlegungen zur Gestaltung des bildgebenden Experiments
- Legen Sie die Bilddauer und die Abtastfrequenz fest, die erforderlich sind, um das gewünschte zu beobachtende Phänomen zu erfassen. Nach dem Abtasttheorem von Nyquist muss die Abtastfrequenz beispielsweise größer als doppelt so hoch sein wie die höchste Frequenz der Eingabestichprobe. Um synergistische [Ca2+]cyt-Oszillationen genau zu erfassen, führen Sie daher etwa alle 10 s eine Bildgebung durch, aber um die Geschwindigkeit der Samenzellen beim Pollenschlauchausfluss zu messen, stellen Sie eine zeitliche Auflösung von weniger als 1 s10 sicher.
- Wählen Sie Fluoreszenzmarker für die interessierenden Zellen, die über die Hintergrundautofluoreszenz hinaus ausreichend hell sind. Wählen Sie für den Einsatz von Biosensoren die hellsten Linien, die die Zellfunktion nicht stören, da diese in der Regel empfindlicher sind und weniger Belichtungszeit benötigen.
- Überlegen Sie, welche Art von Fluoreszenzmikroskopie und Vergrößerung am besten geeignet ist, um das gewünschte Phänomen zu erfassen. Verwenden Sie Weitfeldmikroskopie und Objektive mit geringer Vergrößerung, um Licht aus einer größeren Schärfentiefe einzufangen und den Fokus über die Zeit beizubehalten, größere Objekte wie ganze Eizellen abzubilden oder ratiometrische Sensoren zu verwenden, die empfindlich auf chromatische Verschiebungsartefakte reagieren. Verwenden Sie CLSM oder 2PEM mit Objektiven mit hoher Vergrößerung für eine bessere Auflösung von zellulären und subzellulären Objekten, aber beachten Sie die Schwierigkeit, den Fokus im Laufe der Zeit aufrechtzuerhalten.
- Schätzen Sie die Anzahl der Proben, die pro Experiment abgebildet werden sollen. Verwenden Sie beispielsweise ein 10-faches Objektiv mit einer minimalen Abtastzeit von ~30 s für die Abbildung von drei Septen und die Abbildung von bis zu 40 Befruchtungsereignissen pro Experiment aufgrund der Zeit, die für die Autofokus- und mehrstufigen Erfassungsfunktionen benötigt wird.
2. Vorbereitung des Pollenkeimmediums
- Flüssiges Pollenkeimmedium (5 mM CaCl2, 1 mMMgSO4, 5 mM KCl, 0,01 % [w/v] H3BO3und 10 % [w/v] Saccharose) wird unter Verwendung von 1 M aliquoten Vorräten jedes Mikronährstoffs hergestellt, die bei -20 °C gelagert werden. Stellen Sie den pH-Wert auf 7,5 mit 0,1 M KOH ein. Lagern Sie das Medium bis zu 2 Wochen bei 4 °C.
HINWEIS: Der pH-Wert kann mit der Zeit sinken. - Geben Sie 2,5 ml flüssiges Medium in ein 10-ml-Becherglas und fügen Sie langsam 32 mg Agarose mit extrem niedrigem Schmelzpunkt (~ 1,3 %) mit einem schnell rotierenden Rührstab hinzu, um ein Verklumpen zu vermeiden.
- Agarose auf einer Kochplatte bei 65 °C schmelzen und das Becherglas nutieren, um Kondenswasser von den Seiten aufzufangen.
- Pipettieren Sie 130 μl Medium in die 14-mm-Vertiefung einer 35-mm-Glasbodenschale und drehen Sie die Schale, bis das Medium die Vertiefung bedeckt.
- Saugen Sie insgesamt 40 μl mit einer Pipette aus der Mitte der Schale ab, wobei ein Gesamtvolumen von 90 μl zurückbleibt.
HINWEIS: Es kann mehr Medium aus dem Bohrloch abgesaugt werden, um ein geringeres Gesamtvolumen zu erreichen. Dies kann bei Objektiven mit hoher Vergrößerung und geringen Arbeitsabständen erforderlich sein. Je dünner das Agarpad jedoch ist, desto schneller trocknet es aus. - Kühlen Sie die Schüssel auf einem Aluminiumblock in einer Feuchtigkeitskammer ab, um eine gleichmäßige Kühlung zu gewährleisten. Lagern Sie die Platten über Nacht bei 4 °C für den nächsten Morgen.
3. Florale Inszenierung von Septumspendern, Stigmaspendern und Pollenspendern
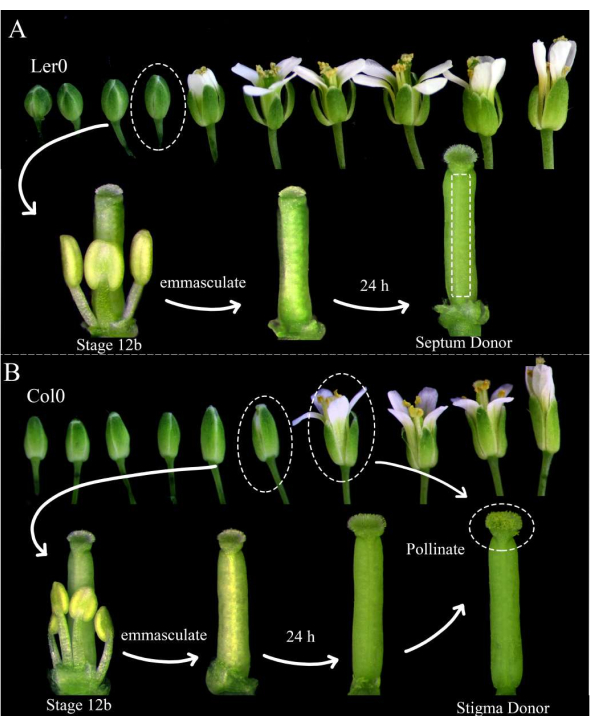
Abbildung 1: Florale Inszenierung von Septumspendern, Stigmaspendern und Pollenspendern. (A) Stadien der Arabidopsis-Blüten (Ler-0) innerhalb eines Blütenstandes. Knospen im Stadium 12B, die Blütenblätter haben, die sich kurz davor öffnen, und gelbe Staubbeutel, sollten entmannt werden, indem alle Kelchblätter, Blütenblätter und Staubblätter entfernt werden. Stempel (die den weiblichen Gametophytenmacher beherbergen) sind dann 24 h später als Septumspender verwendbar. (B) Stadien der Arabidopsis-Blüten (Col-0) innerhalb eines Blütenstandes. Knospen im Stadium 12B, die gelbe Staubbeutel und Narben haben, die gerade noch aus den Blütenblättern herausragen, sollten entmannt werden, indem alle Kelchblätter, Blütenblätter und Staubblätter entfernt werden. Die Stempel sind dann 24 Stunden später als Narbenspender verwendbar, wenn sie von Blüten (die den männlichen Gametophytenmarker beherbergen) bestäubt werden sollten, die offen sind und Pollen abwerfen. Bestäubte Narben sollten innerhalb von 1 Stunde nach der Bestäubung seziert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Wählen Sie am Morgen vor der Bildgebung Arabidopsis-Pflanzen aus, die als Septumspender und Stigmaspender verwendet werden sollen. Stellen Sie sicher, dass sie gesund sind und vor kurzem mit der Produktion von Kieselsäuren begonnen haben.
HINWEIS: Landsberg erecta (Ler-0) ist ein guter Zugang zur Verwendung als Septumspender, da seine Septen robust sind und sich kleine Internodien zwischen den Eizellen befinden. Columbia (Col-0) ist ein guter Zugang zur Verwendung als Stigmaspender, da sie dem Wachstum von Pollenschläuchen förderlich zu sein scheinen. - Entmannen Sie mindestens drei Septumspenderblüten im Stadium 12B und 12 Stigmaspenderblüten im Stadium 12B, indem Sie ihre Staubblätter, Kelchblätter und Blütenblätter entfernen (Abbildung 1A, B). Entfernen Sie auch ältere Blüten am gleichen Blütenstand, die möglicherweise die entmannte Blüte bestäuben könnten.
- Bestäuben Sie die Stigmaspender morgens, 24 Stunden später, mit den Pollenspenderblüten (z. B. Pollenschlauch- oder Samenzellmarker), die leicht Pollen abwerfen. Die Bestäubung ist abgeschlossen, wenn die Narben fast vollständig mit Pollen bedeckt sind (Abbildung 1B).
4. Dissektion des Septums
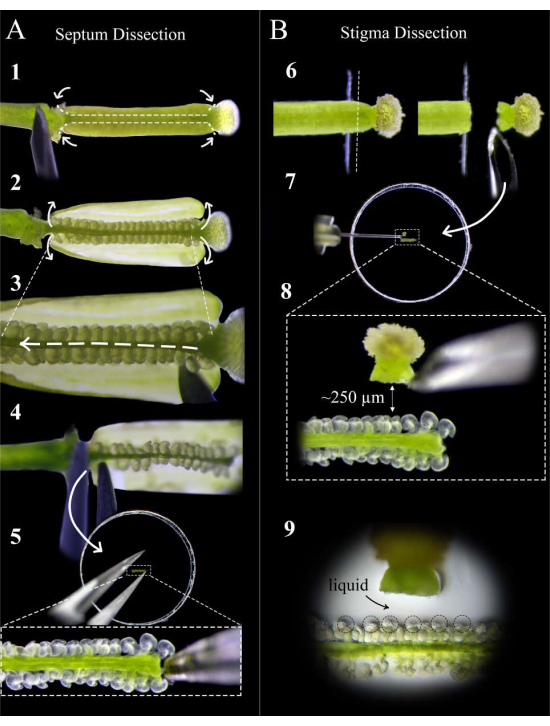
Abbildung 2: Eine Kurzanleitung zur Septum- und Stigma-Dissektion . (A) Schritte der Septumdissektion. Stecken Sie den Stempel mit einer Insulinspritzennadel auf doppelseitiges Klebeband und machen Sie Schnitte an der Stil-Eierstock-Verbindung und der Eierstock-Stiel-Verbindung, gefolgt von einem flachen Schnitt entlang des Septums beider Fruchtblätter (Schritt 1). Ziehen Sie die Fruchtblattwände wieder auf das Klebeband ab (Schritt 2). Schneiden Sie die Replum unter das obere Septum (Schritt 3). Schneiden Sie das Septum am Stil ab und entfernen Sie es mit einer Pinzette am Stiel (Schritt 4). Legen Sie das Septum auf Agarmedien und betten Sie es vorsichtig mit einer Pinzette ein. (B) Schritte der Stigma-Dissektion. Stecken Sie den Stempel (bestäubt <1 h vorher) auf doppelseitiges Klebeband und schneiden Sie ihn mit einer Rasierklinge an der Stil-Eierstock-Verbindung ab (Schritt 6). Legen Sie das Stigma mit einer Insulinnadel neben das Septum auf Agarmedium und stellen Sie den Abstand auf etwa 250 μm ein (Schritte 7-8). Stellen Sie sicher, dass sich ein halbflüssiger Pool um die Mikropylen und die Basis der Stile bildet (Schritt 9). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Sammeln Sie dreißig Minuten nach der Bestäubung gesunde und reife Septumspenderstempel am Stiel und legen Sie sie auf frisches doppelseitiges Klebeband, das auf einem Objektträger montiert ist, wobei die Narbe direkt am Rand des Klebebandes haftet.
HINWEIS: Begrenzen Sie die Zerlegungszeit, für die sich die Stempel auf dem Klebeband befinden, um sicherzustellen, dass sie so kurz wie möglich ist. Die Dissektion sollte bei hoher Luftfeuchtigkeit durchgeführt werden, was durch Aufstellen eines Luftbefeuchters neben dem Objektträger erreicht werden kann. - Stecken Sie den Stempel fest auf das Klebeband, indem Sie mit der Rückseite einer neuen Insulinspritzennadel vorsichtig auf den Stiel und entlang des Eierstocks drücken, bevor Sie die von der Entmannung übrig gebliebenen Kelch-, Blütenblatt- und Staubblattreste entfernen.
- Verwenden Sie unter einem Stereoskop eine Insulinspritzennadel, um zwei Schnitte pro Fruchtblatt an der Stil-Eierstock-Verbindung und der Eierstock-Stiel-Verbindung durchzuführen, gefolgt von flachen Schnitten entlang des Septums jedes Fruchtblatts (Abbildung 2, Schritt 1).
HINWEIS: Wenn Sie zu tief entlang des Septums schneiden, werden die Eizellen am Funiculus durchtrennt. - Ziehen Sie die Eierstockwände vorsichtig auf das Klebeband zurück (Abbildung 2, Schritt 2) und schieben Sie die Nadel vorsichtig zwischen die beiden Septen, um die Pflaume über die gesamte Länge des Stempels zu schneiden, ohne die Eizellen zu stören (Abbildung 2, Schritt 3).
HINWEIS: Schneiden Sie das Replum in Richtung vom Stil bis zum Stiel, um sicherzustellen, dass die Eizellen am oberen Septum so wenig wie möglich gestört werden. - Schneiden Sie das obere Septum vorsichtig sowohl an der Verbindung mit dem Stil als auch mit dem Stiel ab und entfernen Sie das Septum mit einer Pinzette von der Stielseite (Abbildung 2, Schritt 4).
HINWEIS: Halten Sie diesen Schnitt gerade und sanft, damit das Septum flach bleibt und sich nicht krümmt. - Legen Sie das Septum so flach wie möglich auf das Medium, so dass die Mikropylen der Eizellen nach oben und in derselben Fokusebene liegen. Drücken Sie das Septum vorsichtig in das Medium, bis die Eizellen nur noch leicht in das Medium eingebettet sind (Abbildung 2, Schritt 5).
HINWEIS: Es ist wichtig, dass das Septum so platziert wird, dass die Mikropylen der Eizellen für die Pollenschläuche zugänglich sind (alle unzugänglichen Eizellen können vorsichtig mit einer Nadel neu angeordnet werden). Nach dem Einbetten sollte sich um das Septum herum eine kleine Flüssigkeitslache bilden. - Wiederholen Sie die Schritte 4.1-4.6 für bis zu zwei weitere Stempel und platzieren Sie die Septen aneinander.
5. Stigma-Dissektion
- Legen Sie die bestäubten Narbenspenderstempel auf frisches doppelseitiges Klebeband, das auf einem Objektträger montiert ist, so dass sich die eierstockartige Verbindung vom Rand des Bandes entfernt befindet (Abbildung 2, Schritt 6).
- Verwenden Sie eine frische Rasierklinge, um den Stil gerade nach unten zu schneiden, und heben Sie ihn ab, um die Narbe an der Klinge zu halten (Abbildung 2, Schritt 6).
HINWEIS: Schneiden Sie am Rand des Klebebandes ab, um den saubersten Schnitt zu erzielen. - Entfernen Sie die Narbe mit einer Insulinspritzennadel von der Klinge und legen Sie sie etwa 250-300 μm von den Eizellen entfernt flach (Abbildung 2, Schritte 7-8).
HINWEIS: Der Stil sollte horizontal auf der Seite ausgerichtet sein. Andernfalls wachsen die meisten Pollenschläuche unter dem Septum nach. Eine kleine Flüssigkeitsansammlung am Eingang des Stils sollte erscheinen, nachdem er 1 Minute lang auf dem Medium gelegen hat. Dies ist ein gutes Zeichen, da die Pollenschläuche einen reibungslosen Austritt aus dem Stil haben. - Wiederholen Sie die Schritte 5.1-5.3 für bis zu 12 Narben, wobei Sie zwei auf jeder Seite jedes Septums platzieren. Suchen Sie nach einer kleinen Flüssigkeitslache, die sich um die Mikropyle der Eizellen bildet. Dies unterstützt die Zugänglichkeit und Ausrichtung der Pollenschläuche auf die Embryosäcke (Abbildung 2, Schritt 9).
HINWEIS: Begrenzen Sie die Zeit, in der die Schale geöffnet ist, um zu verhindern, dass das Medium und die Eizellen austrocknen.
6. Bildgebung
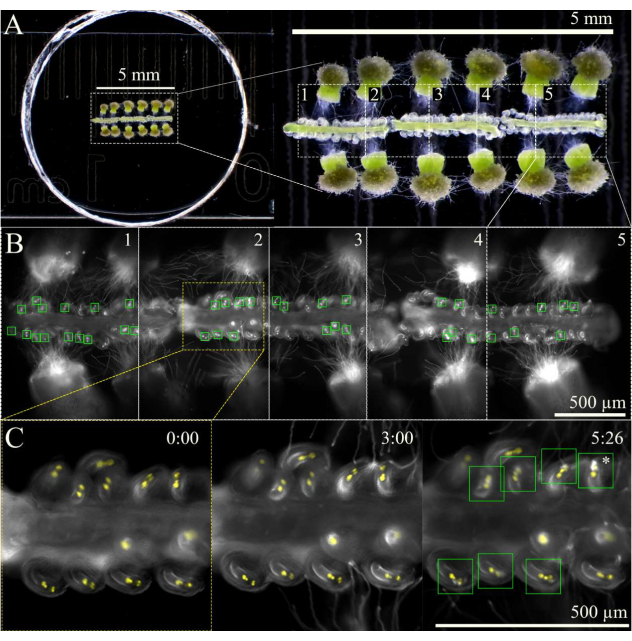
Abbildung 3: SIV-Cum-Septum-Bildgebungsschema. (A) Vollständiges SIV-cum-Septum-Setup mit 12 bestäubten Narben und 3 Septen, wie durch ein Stereoskop gesehen. (B) Zusammengeführte Bilder des vollständigen SIV-Cum-Septum-Aufbaus, die in A 5 h nach der Inkubation mit einem 10-fachen Objektiv zu sehen sind, wobei die fünf Übersichtsbereiche (jeweils ~ 1 mm) für die mehrstufige Erfassung markiert sind. Die grünen Kästchen zeigen die Eizellen, die Pollenschläuche erhalten haben und einen explosiven Ausbruch in den Synergien durchlaufen. (C) Nähere Betrachtung des Übersichtsbereichs 2 zu verschiedenen Zeitpunkten. Ungefähr 3 Stunden nach der Inkubation in der Feuchtigkeitskammer am Mikroskop sollten die Pollenschläuche in der Nähe der Mikropylen ankommen, und nach 6 Stunden Bildgebung sollten die meisten Eizellen die Pollenschläuche (grüne Quadrate) richtig erhalten haben. Diese Eizellen erleiden dann einen explosiven Pollenschlauchplatzer (Sternchen). Maßstabsbalken = (A) 5 mm, (B,C) 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Sobald die Dissektion abgeschlossen ist und die Schale bildfertig ist, lassen Sie sie in einer Feuchtigkeitskammer am Mikroskop bei 92 % relativer Luftfeuchtigkeit und 21 °C inkubieren.
HINWEIS: Wenn keine Feuchtigkeitskammer für das Mikroskop verfügbar ist, trägt das Auskleiden der Außenkanten des Deckels und der Schale mit einer kleinen Wassermenge dazu bei, eine hohe Luftfeuchtigkeit in der Schale aufrechtzuerhalten. - Bringen Sie die Proben unter Hellfeld mit geringer Lichtintensität in den Fokus und schalten Sie dann auf Fluoreszenzlicht um, um die Bereiche der Probe auf der abzubildenden Tischübersicht zu markieren.
HINWEIS: Bei 10-facher Vergrößerung können etwa fünf Bereiche für insgesamt drei Septen markiert werden (Abbildung 3). Begrenzen Sie den Zeitaufwand für die Markierung der Übersichtsbereiche, um die Phototoxizität oder die Erwärmung der Probe durch das Fluoreszenzlicht zu minimieren. - Beginnen Sie die Bildgebung mit einem mehrstufigen Aufnahmeschema mit einer Autofokusfunktion am Anfang jedes Übersichtsbereichs. Da die Pollenschläuche ~1 h nach der Inkubation der Probe aus dem Stil austreten, verzögern Sie die Erfassung um 2 Stunden oder bis die Pollenschläuche die Mikropyle erreicht haben. Stellen Sie sicher, dass der Autofokus mit einem Bereich von 100 μm (7 μm große Schritte und 1 μm feine Schritte) eingestellt ist, um die Eizellen im Fokus zu halten, wenn sich die Septen im Laufe der Zeit leicht bewegen und sinken.
- Stoppen Sie die Bildaufnahme ~9 Stunden nach Beginn der Probeninkubation, da zu diesem Zeitpunkt die meisten Eizellen einen Pollenschlauch angezogen und erhalten haben sollten.
HINWEIS: Wenn eine geringe Anzahl von Eizellen Pollenschläuche anzieht, ist eine sorgfältige Beobachtung der Schale unter einem Stereoskop nützlich, um festzustellen, wie die Ausrichtung der Eizelle oder des Stils beim nächsten Mal verbessert werden könnte.
Ergebnisse
Um den Zeitpunkt der nuklearen Degeneration in der rezeptiven synergistischen in Bezug auf die Pollenschlauchruptur in Arabidopsis zu beurteilen und zu beobachten, ob die linke oder rechte synergistisch prädestiniert ist, die rezeptive synergistisch zu werden, wurde die hier beschriebene SIV-cum-Septum-Methode unter Verwendung eines weiblichen Gametophyten-Kernmarkers verwendet, der mit einem synergistischen zytosolischen Marker (pFG: roGFP2-ORP1-NLS, pMYB98:roGFP2-ORP1) als Septumspender und ...
Diskussion
Dieses Manuskript stellt ein effizientes Protokoll für die Bildgebung der Pollenschlauchaufnahme und der Doppelbefruchtung bei Arabidopsis vor. Die verbesserte Methode, SIV cum septum, erhöht den Prozentsatz und die Gesamtzahl der erfolgreichen Pollenschlauch-Empfangsereignisse, die pro Bildgebungssitzung beobachtbar sind, erheblich. Die hier gezeigten repräsentativen Ergebnisse zeigen eine Bildgebungssitzung mit 41 erfolgreichen Pollenschlauchempfangsereignissen und 10 Eizellen, die Empfangsdefekte ...
Offenlegungen
Die Autoren berichten über keine Interessenkonflikte.
Danksagungen
Wir danken Sara Simonini und Stefano Bencivenga für die Spende des pFG:roGFP2-ORP1-NLS-Konstrukts und Christof Eichenberger, Johann Almendinger, Vincent Sutter und Celia Baroux für ihre Beratung zur Mikroskopie. Wir danken den Ratschlägen von Ravi Palanivelu, Philipp Denninger, Sharon Kessler, Mark Johnson, Tomokazu Kawashima und allen anderen auf der International Conference on Sexual Plant Reproduction 2022, die Interesse an einem Protokoll über SIV cum Septum gezeigt haben. Diese Arbeit wurde von der Universität Zürich und Beiträgen des Schweizerischen Nationalfonds an die U.G.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mm glass slide | Epredia | 16211551 | |
| 35 mm glass bottom dish (14 mm well) | Mattek | P35G-1.5-14-C | |
| Calcium Chloride | Roth | CN93.1 | |
| Columbia (Col-0) | Nottingham Arabidopsis Stock Centre (NASC) | stigma donor | |
| Dissecting Scope | Olympus | SZX2-ILLT | |
| Insulin needle (0.3 G) | BD | 304000 | |
| Landsberg erecta (Ler-0) | Nottingham Arabidopsis Stock Centre (NASC) | septum donor | |
| Magnesium Sulfate | Merck | 5886 | |
| Potassium Chloride | Roth | 6781.1 | |
| Razor blade | Beldura | 7026797 | |
| Scotch double sided tape | Scotch | 768720 | Less thick and good for stigma dissection |
| Sodium Chloride | Roth | 3957.1 | |
| Sucrose | ITW reagents | A2211,1000 | |
| Tesa double sided tape | Tesa | 05681-00018 | Very sticky and good for septum dissection |
| Ultra low gelling temperature agarose | FMC SeaPrep | 50302 |
Referenzen
- Huck, N., Moore, J. M., Federer, M., Grossniklaus, U. The Arabidopsis mutant feronia disrupts the female gametophytic control of pollen tube reception. Development. 130 (10), 2149-2159 (2003).
- Rotman, N., et al. Female control of male gamete delivery during fertilization in Arabidopsis thaliana. Current Biology. 13 (5), 432-436 (2003).
- Palanivelu, R., Preuss, D. Distinct short-range ovule signals attract or repel Arabidopsis thaliana pollen tubes in vitro. BMC Plant Biology. 6, 7 (2006).
- Susaki, D., Maruyama, D., Yelagandula, R., Berger, F., Kawashima, T. Live-cell imaging of F-actin dynamics during fertilization in Arabidopsis thaliana. Methods in Molecular Biology. 1669, 47-54 (2017).
- Iwano, M., et al. Cytoplasmic Ca2+ changes dynamically during the interaction of the pollen tube with synergid cells. Development. 139 (22), 4202-4209 (2012).
- Ngo, Q., Vogler, H., Lituiev, D., Nestorova, A., Grossniklaus, U. A calcium dialog mediated by the FERONIA signal transduction pathway controls plant sperm delivery. Developmental Cell. 29 (4), 491-500 (2014).
- Denninger, P., et al. Male-female communication triggers calcium signatures during fertilization in Arabidopsis. Nature Communications. 5, 4645 (2014).
- Hamamura, Y., et al. Live imaging of calcium spikes during double fertilization in Arabidopsis. Nature Communications. 5, 4722 (2014).
- Ponvert, N., Johnson, M. Synergid calcium ion oscillations define a new feature of pollen tube reception critical for blocking interspecific hybridization. bioRxiv. , (2020).
- Hamamura, Y., et al. Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Current Biology. 21 (6), 497-502 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten