Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estimulación combinada de nervios periféricos y estimulación magnética transcraneal de parámetros de pulso controlable para sondear el control sensoriomotor y el aprendizaje
* Estos autores han contribuido por igual
En este artículo
Resumen
La inhibición aferente de latencia corta (SAI) es un protocolo de estimulación magnética transcraneal para sondear la integración sensoriomotora. Este artículo describe cómo se puede usar SAI para estudiar los bucles sensoriomotores convergentes en la corteza motora durante el comportamiento sensoriomotor.
Resumen
La capacidad motora experta depende de la integración eficiente de la aferencia sensorial en los comandos motores apropiados. La inhibición aferente proporciona una herramienta valiosa para investigar la influencia procedimental y declarativa sobre la integración sensoriomotora durante las acciones motoras especializadas. Este manuscrito describe la metodología y las contribuciones de la inhibición aferente de latencia corta (SAI) para comprender la integración sensoriomotora. SAI cuantifica el efecto de una descarga aferente convergente sobre la salida motora corticoespinal evocada por la estimulación magnética transcraneal (EMT). La descarga aferente se desencadena por la estimulación eléctrica de un nervio periférico. El estímulo TMS se entrega a una ubicación sobre la corteza motora primaria que provoca una respuesta motora confiable en un músculo servido por ese nervio aferente. El grado de inhibición en la respuesta motora evocada refleja la magnitud de la descarga aferente que converge en la corteza motora e implica contribuciones GABAérgicas y colinérgicas centrales. La participación colinérgica en la EFS hace de la EFS un posible marcador de interacciones declarativas-procedimentales en el rendimiento sensoriomotor y el aprendizaje. Más recientemente, los estudios han comenzado a manipular la dirección actual de TMS en SAI para separar la importancia funcional de los distintos circuitos sensoriomotores en la corteza motora primaria para las acciones motoras especializadas. La capacidad de controlar parámetros de pulso adicionales (por ejemplo, el ancho de pulso) con el parámetro de pulso controlable TMS (cTMS) de última generación ha mejorado la selectividad de los circuitos sensoriomotores sondeados por el estímulo TMS y ha brindado la oportunidad de crear modelos más refinados de control sensoriomotor y aprendizaje. Por lo tanto, el presente manuscrito se centra en la evaluación de las EFS utilizando cTMS. Sin embargo, los principios descritos aquí también se aplican a SAI evaluados utilizando estimuladores TMS convencionales de ancho de pulso fijo y otras formas de inhibición aferente, como la inhibición aferente de latencia prolongada (LAI).
Introducción
Múltiples bucles sensoriomotores convergen en la corteza motora para dar forma a las proyecciones del tracto piramidal a las neuronas motoras espinales e interneuronas1. Sin embargo, cómo interactúan estos bucles sensoriomotores para dar forma a las proyecciones corticoespinales y al comportamiento motor sigue siendo una pregunta abierta. La inhibición aferente de latencia corta (SAI) proporciona una herramienta para sondear las propiedades funcionales de los bucles sensoriomotores convergentes en la salida de la corteza motora. SAI combina la estimulación magnética transcraneal cortical motora (TMS) con la estimulación eléctrica del nervio aferente periférico correspondiente.
TMS es un método no invasivo para estimular de forma segura las neuronas motoras piramidales transsinápticamente en el cerebro humano 2,3. TMS implica pasar una corriente eléctrica grande y transitoria a través de un cable enrollado colocado en el cuero cabelludo. La naturaleza transitoria de la corriente eléctrica crea un campo magnético que cambia rápidamente y induce una corriente eléctrica en el cerebro4. En el caso de un solo estímulo TMS, la corriente inducida activa una serie de entradas excitatorias a las neuronas motoras piramidales 5-7. Si la fuerza de las entradas excitatorias generadas es suficiente, la actividad descendente provoca una respuesta muscular contralateral conocida como potencial evocado motor (MEP). La latencia del MEP refleja el tiempo de conducción corticomotora8. La amplitud del MEP indexa la excitabilidad de las neuronas corticoespinales9. El estímulo TMS único que provoca el MEP también puede ser precedido por un estímulo condicionante10,11,12. Estos paradigmas de pulso pareado se pueden utilizar para indexar los efectos de varios grupos de interneuronas en la producción corticoespinal. En el caso de SAI, el estímulo de acondicionamiento eléctrico periférico se utiliza para sondear el impacto de la descarga aferente sobre la excitabilidad cortical motora11,13,14,15. El tiempo relativo del estímulo TMS y la estimulación eléctrica periférica alinea la acción del estímulo TMS en la corteza motora con la llegada de las proyecciones aferentes a la corteza motora. Para SAI en los músculos distales de las extremidades superiores, el estímulo del nervio mediano típicamente precede al estímulo TMS por 18-24 ms11,13,15,16. Al mismo tiempo, SAI aumenta a medida que aumenta la fuerza de la descarga aferente inducida por el estímulo periférico 13,17,18.
A pesar de su fuerte asociación con las propiedades extrínsecas de la proyección aferente a la corteza motora, SAI es un fenómeno maleable implicado en muchos procesos de control motor. Por ejemplo, la SAI se reduce en los músculos relevantes para la tarea antes de un movimiento inminente 19,20,21, pero se mantiene en representaciones motoras adyacentes irrelevantes para la tarea19,20,22. Se plantea la hipótesis de que la sensibilidad a la relevancia de la tarea refleja un mecanismo de inhibición envolvente23 que tiene como objetivo reducir el reclutamiento de efectores no deseados. Más recientemente, se propuso que la reducción de la EFS en el efector relevante para la tarea puede reflejar un fenómeno de activación relacionado con el movimiento diseñado para suprimir la aferencia sensorial esperada21 y facilitar las correcciones durante la planificación y ejecución sensoriomotora24. Independientemente del rol funcional específico, la EFS se correlaciona con la reducción de la destreza manual y la eficiencia del procesamiento25. La SAI alterada también se asocia con un mayor riesgo de caídas en adultos mayores 26 y función sensoriomotora comprometida en la enfermedad de Parkinson 26,27,28 e individuos con distonía focal de la mano 29.
La evidencia clínica y farmacológica indica que las vías inhibitorias que median la EFS son sensibles a la modulación colinérgica central30. Por ejemplo, la administración del antagonista muscarínico del receptor de acetilcolina escopolamina reduce SAI31. Por el contrario, el aumento de la vida media de la acetilcolina a través de los inhibidores de la acetilcolinesterasa mejora la IAS32,33. De acuerdo con la evidencia farmacológica, la EFS es sensible a varios procesos cognitivos con afectación colinérgica central, incluyendo la excitación 34, la recompensa35, la asignación de atención 21,36,37 y la memoria38,39,40. La EFS también está alterada en poblaciones clínicas con déficits cognitivos asociados a la pérdida de neuronas colinérgicas, como la enfermedad de Alzheimer 41,42,43,44,45,46,47, la enfermedad de Parkinson (con deterioro cognitivo leve)48,49,50 y el deterioro cognitivo leve 47,51,52. La modulación diferencial de SAI por varias benzodiazepinas con afinidades diferenciales para varios tipos de subunidades del receptor del ácido γ-aminobutírico tipo A (GABAA) sugiere que las vías inhibitorias de SAI son distintas de las vías que median otras formas de inhibición de pulso pareado30. Por ejemplo, el lorazepam disminuye la SAI pero mejora la inhibición cortical de intervalo corto (SICI)53. Zolpidem reduce la SAI pero tiene poco efecto sobre SICI53. El diazepam aumenta el SICI pero tiene poco impacto en la EFS53. La reducción de SAI por estos moduladores alostéricos positivos de la función del receptor GABAA, junto con la observación de que GABA controla la liberación de acetilcolina en el tronco cerebral y la corteza54, ha llevado a la hipótesis de que GABA modula la vía colinérgica que se proyecta a la corteza sensoriomotora para influir en SAI55.
Recientemente, SAI se ha utilizado para investigar las interacciones entre los bucles sensoriomotores que establecen los procesos de control motor procedimental y aquellos que alinean los procesos de procedimiento con objetivos explícitos de arriba hacia abajo y los procesos de control cognitivo 21,36,37,38. La participación colinérgica central en la EFS31 sugiere que la EFS puede indexar una influencia ejecutiva sobre el control sensoriomotor procedimental y el aprendizaje. Es importante destacar que estos estudios han comenzado a identificar los efectos únicos de la cognición en circuitos sensoriomotores específicos mediante la evaluación de SAI utilizando diferentes direcciones de corriente TMS. Los estudios SAI suelen emplear corriente inducida por posterior-anterior (PA), mientras que sólo un puñado de estudios SAI han empleado corriente inducida por anterior-posterior (AP)55. Sin embargo, el uso de TMS para inducir PA en comparación con la corriente de PA durante la evaluación de SAI recluta circuitos sensoriomotores distintos16,56. Por ejemplo, los circuitos sensitivos a AP, pero no a los sensibles a PA, son alterados por la modulación cerebelosa37,56. Además, los circuitos sensoriomotores sensibles a AP, pero no a los sensibles a PA, son modulados por la carga de atención36. Finalmente, la atención y las influencias cerebelosas pueden converger en los mismos circuitos sensitivo-motores AP, llevando a alteraciones desadaptativas en esos circuitos37.
Los avances en la tecnología TMS proporcionan flexibilidad adicional para manipular la configuración del estímulo TMS empleado durante aplicaciones de pulso único, pulso pareado y repetitivas57,58. Los estimuladores TMS de parámetros de pulso controlables (cTMS) ahora están disponibles comercialmente para uso de investigación en todo el mundo, y proporcionan un control flexible sobre el ancho y la forma del pulso57. La mayor flexibilidad surge del control de la duración de descarga de dos condensadores independientes, cada uno responsable de una fase separada del estímulo TMS. La naturaleza bifásica o monofásica del estímulo se rige por la amplitud de descarga relativa de cada condensador, un parámetro llamado relación M. Los estudios de TMTc han combinado la manipulación del ancho de pulso con diferentes direcciones de corriente para demostrar que los anchos de pulso fijos utilizados por los estimuladores TMS convencionales (70-82 μs)59,60 probablemente reclutan una mezcla de circuitos sensoriomotores funcionalmente distintos durante SAI 56. Por lo tanto, cTMS es una herramienta emocionante para desentrañar aún más el significado funcional de varios bucles sensoriomotores convergentes en el rendimiento sensoriomotor y el aprendizaje.
Este manuscrito detalla un enfoque único de SAI para estudiar la integración sensoriomotora que integra la estimulación eléctrica periférica con la EMTc durante los comportamientos sensoriomotores. Este enfoque mejora el enfoque SAI típico al evaluar el efecto de las proyecciones aferentes en poblaciones interneuronales seleccionadas en la corteza motora que gobiernan la producción corticoespinal durante el comportamiento sensoriomotor continuo. Aunque relativamente nuevo, la EMTc proporciona una clara ventaja en el estudio de la integración sensoriomotora en poblaciones típicas y clínicas. Además, el enfoque actual puede adaptarse fácilmente para su uso con estimuladores TMS convencionales y para cuantificar otras formas de inhibición y facilitación aferente, como la inhibición aferente de latencia prolongada (LAI)13 o la facilitación aferente de latencia corta (SAF)15.
Protocolo
El siguiente protocolo se puede aplicar a varios experimentos. La información proporcionada detalla un experimento en el que SAI se utiliza para cuantificar la integración sensoriomotora durante la respuesta de un dedo a una sonda válida o inválidamente señalada. En este protocolo, SAI se evalúa sin una tarea, luego simultáneamente durante la tarea sensoriomotora señalada, y luego nuevamente sin una tarea. El estimulador cTMS puede ser reemplazado por cualquier estimulador TMS convencional disponible comercialmente. Sin embargo, el ancho de pulso del estimulador TMS convencional se fijaría entre 70-82 μs dependiendo del hardware específico59,60. Este estudio fue aprobado por la Oficina de Ética de Investigación de la Universidad de Waterloo. Todos los participantes dieron su consentimiento informado por escrito.
1. Requisitos de hardware/software
NOTA: La Figura 1 muestra un esquema de los requisitos de hardware para integrar los estimuladores eléctricos periféricos y TMS con una tarea sensoriomotora controlada por computadora. La Figura 2A muestra la configuración de SAI para corriente inducida por PA y AP. La Figura 2B ilustra la secuencia de eventos para la tarea sensoriomotora señalada y el momento relativo de la evaluación de la EFS. Se recomienda encarecidamente un sistema de guía estereotáctica para rastrear la orientación de la bobina TMS en relación con el participante para reducir la variabilidad ensayo por ensayo en la respuesta fisiológica asociada con la variación en la posición y trayectoria de la bobina61.
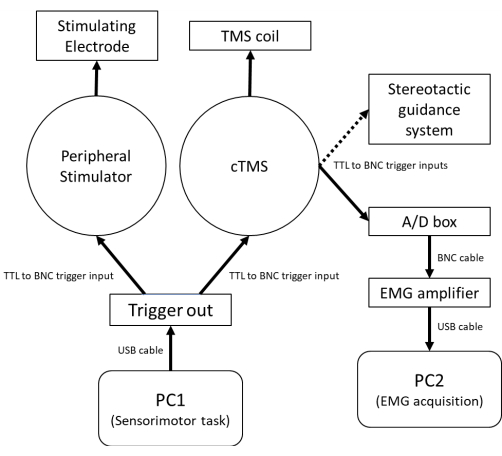
Figura 1: Un esquema del hardware utilizado para evaluar la SAI en reposo y durante el comportamiento sensoriomotor concurrente. PC1, que se utiliza para controlar la tarea sensoriomotora y la sincronización del estímulo cTMS / estimulación eléctrica periférica, está conectado a un convertidor digital a analógico capaz de generar un disparador de salida TTL de 5 V a través de un cable USB. Para ensayos no condicionados, el disparador del canal de entrada-salida digital 1 se envía al estimulador cTMS a través de un cable BNC. Para los ensayos condicionados, el disparador del canal digital de entrada-salida 1, que se envía al estimulador cTMS, está precedido por un disparador del canal digital de entrada-salida 2 al estimulador eléctrico periférico. Un cable BNC desde el canal de salida de disparo en la unidad cTMS se envía a la placa analógica a digital del sistema EMG para activar la grabación del amplificador EMG y la visualización / almacenamiento de los datos por el software de adquisición EMG en PC2. También se envía un cable BNC opcional desde el disparador cTMS al sistema de guía estereotáctica para registrar la posición y la trayectoria de la bobina en el momento del estímulo cTMS. Abreviaturas: PC = computadora personal; USB = bus serie universal; TTL = cable de disparo lógico transistor-transistor; BNC = conector Bayoneta Neill-Concelman; cTMS = estimulador magnético transcraneal del parámetro de pulso controlable; TMS = estimulación magnética transcraneal; A/D = analógico-digital; EMG = electromiografía. Haga clic aquí para ver una versión más grande de esta figura.
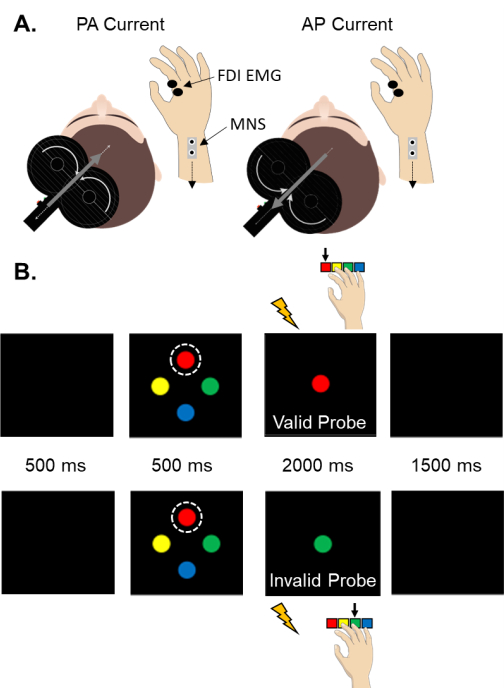
Figura 2: Configuración de SAI y la tarea sensoriomotora. (A) Un esquema de la configuración para la evaluación de SAI en el músculo FDI. Cabe destacar que la corriente inducida en el cerebro es opuesta a la dirección de la corriente en la bobina TMS. (B) Una representación de un ensayo válido de señal del dedo índice (arriba) y del dedo índice no válido (abajo). La señal siempre se representa como el estímulo superior (resaltado por el círculo discontinuo). El color de la señal corresponde a una respuesta específica del dedo. Los participantes recibieron instrucciones de responder al color de la sonda de la manera más rápida y precisa posible. Las señales y sondas pueden ser de cualquier color. La probabilidad de una señal válida fue del 70%. Se produjeron señales no válidas en el 30% de los ensayos. Abreviaturas: SAI = inhibición aferente de latencia corta; PA = posterior-anterior; PA = anterior-posterior; IED = primer interóseo dorsal; EMG = electromiografía; MNS = estímulo nervioso mediano. Haga clic aquí para ver una versión más grande de esta figura.
- Equipe una computadora personal (PC1) con software para controlar la tarea sensoriomotora a través de una placa digital-analógica USB (o puerto serie) con dos canales de salida digital.
- Establezca una rutina de software sin tareas para controlar el orden de los estímulos no condicionados de TMc y los estímulos de TMc que estarán condicionados por la estimulación eléctrica periférica con un intervalo interestímulo (ISI) de 21 ms. Aleatorice el intervalo entre dos estímulos cualesquiera (por ejemplo, condicionados o no condicionados) utilizando una distribución rectangular con una duración entre 5-8 s.
- Asegúrese de que la rutina envía un disparador de salida digital al disparador en el puerto de la unidad cTMS para los estímulos no condicionados. Asegúrese de que la rutina envía salidas digitales separadas a la unidad cTMS y al estimulador eléctrico periférico para los estímulos condicionados.
- Asegúrese de que el disparador del estimulador periférico preceda al disparador de la EMTc en 21 ms. Asegúrese de que el número de estímulos no condicionados y condicionados esté entre 8 y 24. Idealmente, el orden de los ensayos no condicionados y condicionados debe ser aleatorio.
- Configure una rutina de software para controlar la tarea sensoriomotora. Asegúrese de que este software también bloquee el tiempo de los disparadores de salida digital enviados a los estimuladores eléctricos periféricos y cTMS a un punto específico durante el comportamiento.
NOTA: El experimento descrito utilizó una tarea sensoriomotora (Figura 2B). Los desencadenantes del estimulador periférico y el estimulador de la EMTc se programaron para ocurrir 225-275 ms después del inicio de la señal de respuesta utilizando una distribución rectangular. El objetivo de este momento fue evaluar los cambios en la integración sensoriomotora según la validez entre la señal de respuesta y la señal de preparación previa, que fue válida en el 70% de todos los ensayos. - Equipe una segunda computadora personal (PC2) con un amplificador de electromiografía de dos canales (EMG) conectado a un convertidor analógico-digital. Asegúrese de que el convertidor digital-analógico tenga un canal de entrada digital para bloquear el tiempo del EMG al estímulo TMS. Asegúrese de que PC2 esté equipado con software de adquisición de datos EMG para registrar las respuestas musculares evocadas por TMS.
NOTA: PC1 se puede utilizar para controlar la tarea sensoriomotora y registrar la EMG. Sin embargo, los investigadores deben verificar de forma independiente el momento de los desencadenantes del estimulador TMS, el estimulador periférico y el sistema EMG. Varios dispositivos conectados a un solo PC aumentan el potencial de conflictos en el procesador central, lo que lleva a la inestabilidad en el tiempo relativo de los marcadores de eventos. - Configure el software de adquisición de datos EMG con los siguientes ajustes: tres canales de grabación, 2 EMG, un disparador de entrada, grabaciones activadas con una época de -0,3 s a 0,5 s alrededor del disparador TTL, un factor de amplificación EMG de 1.000x, una frecuencia de muestreo de 4.000 Hz, un filtro de paso de banda de 3 Hz a 1 kHz y un filtro de red (opcional).
NOTA: El protocolo actual utiliza un método de grabación de época. El software de adquisición EMG monitorea continuamente la señal EMG. Sin embargo, solo se muestran y registran los datos de época bloqueados en el tiempo para el estímulo TMS. - Conecte un canal de salida digital de PC1 a la entrada de disparo del estimulador cTMS. Conecte el segundo canal de salida digital de PC1 a la entrada de disparo del estimulador eléctrico periférico. Cuando utilice el sistema operativo del PC, confirme de forma independiente el tiempo relativo de las dos salidas digitales de PC1.
- Conecte la salida del disparador a la entrada digital del sistema EMG. Si se utiliza un sistema de guía estereotáctica, puede ser posible dividir la salida del gatillo en el sistema de guía para registrar la posición de prueba por prueba de la bobina cTMS en el momento del estímulo cTMS.
2. Evaluación de los participantes y consentimiento informado
- Examinar al participante para detectar contraindicaciones para TMS 9,62,63,64,65.
- Informar al participante sobre los objetivos y procedimientos del estudio. Revise los riesgos descritos en el documento de consentimiento aprobado por la junta de revisión ética de la institución. Responda cualquier pregunta sobre los riesgos potenciales. Obtenga el consentimiento informado por escrito antes de comenzar cualquier procedimiento de estudio.
3. Colocación de electrocardiogramas (EMG)
- Indique al participante que se siente en la silla experimental con los codos apoyados en los brazos de la silla y doblados para permitir que la muñeca / mano descanse cómodamente en el espacio de trabajo del escritorio. Ajuste la altura del espacio de trabajo de la silla y el escritorio según sea necesario.
- Limpie la piel sobre el primer interóseo dorsal (IED), el abductor del pollicis brevis (APB) y la apófisis estiloides cubital con una crema ligeramente abrasiva colocada sobre un disco redondo de algodón. Limpie cualquier residuo con una almohadilla de preparación de alcohol.
- Para cada músculo, coloque un electrodo adhesivo desechable de Ag-AgCl sobre el vientre muscular. Coloque un segundo electrodo en un punto de referencia óseo cercano como referencia. Finalmente, coloque un electrodo adhesivo Ag-AgCl adicional en el proceso estiloides cubital para que sirva como tierra.
NOTA: Un sitio de referencia común de IED es la prominencia ósea en la base de la segunda falange proximal en el lado radial de la mano. Un sitio de referencia común de APB es la prominencia ósea de la falange proximal en el lado radial del pulgar. - Conecte cada par de electrodos y la tierra al amplificador EMG y al sistema de adquisición de datos. Utilice el canal 1 para la IED y el canal 2 para la APB.
4. Colocación del electrodo del estimulador eléctrico periférico
- Conecte el disparador de salida digital del estimulador periférico al canal de entrada de disparo en el sistema EMG para activar la grabación EMG cuando se entrega el estímulo periférico.
- Use una crema ligeramente abrasiva para limpiar la piel en el interior del antebrazo. Comience desde el pliegue de flexión de la muñeca y extienda hasta ~6 cm proximal. Extienda la limpieza al área desde la línea media de la muñeca hasta el lado radial del antebrazo. Limpie cualquier residuo con una almohadilla de preparación de alcohol.
- Aplique gel conductor a un electrodo de barra estimulante reutilizable. Use el gel suficiente para cubrir los discos metálicos de los puntos de contacto anódico y catódico. Coloque el electrodo estimulante sobre la piel en el lado palmar de la muñeca con el cátodo proximal al ánodo. Coloque el cátodo ligeramente medial y proximal a la apófisis estiloides radial.
- No use gel excesivo. Si el gel crea un puente entre el ánodo y los terminales del cátodo, limpie el electrodo para eliminar todo el gel y vuelva a aplicarlo. Un puente de gel entre el ánodo y el cátodo desviará corrientes sustanciales a lo largo de la piel, lo que dificultará la estimulación del nervio mediano.
- En el estimulador periférico, ajuste el selector de tipo de estímulo a monofásico, establezca la duración del estímulo en 200 μs y seleccione un voltaje y amperaje apropiados, verificando dos veces cualquier factor de multiplicación. El voltaje (Vmax) se estableció en 200 V para el hardware utilizado aquí, con un amperaje inicial de 0,05 x 10 mA.
- Mientras sostiene el electrodo estimulante, administre un solo estímulo eléctrico presionando el interruptor de disparo en el estimulador de corriente constante. Luego, inspeccione visualmente el músculo APB y la pantalla EMG (canal 2) para detectar evidencia de una contracción muscular. La contracción muscular, conocida como onda M, es provocada por la activación directa del axón motor por el estímulo eléctrico y debe ocurrir entre 6-9 ms después del artefacto de estímulo eléctrico periférico.
- Si no hay evidencia de una contracción muscular, pregúntele al participante si sintió una sensación de hormigueo que se irradiaba hacia los dedos o inmediatamente debajo del electrodo. La posición óptima será la posición del electrodo que provoque la contracción muscular APB más significativa a la intensidad del estímulo actual.
- Si no se informa sensación o la sensación está restringida a la piel inmediatamente debajo del electrodo, aumente el amperaje en incrementos de 0.05 (multiplicado por un factor de 10) hasta que el participante informe una sensación de hormigueo que se irradia hasta los dedos / pulgar. Si se informa una sensación de radiación en un dígito que no sea el pulgar, cambie la posición del electrodo moviendo el electrodo radialmente hasta que la sensación se irradie al pulgar.
- Una vez que se haya determinado la posición óptima del electrodo estimulante, asegure el electrodo a la muñeca con tres trozos de cinta. Coloque la primera pieza sobre el centro del electrodo y luego use la segunda y tercera piezas para asegurar la parte superior e inferior del electrodo.
NOTA: Según la experiencia, se sugiere asegurar primero la banda de cinta adhesiva a la parte posterior del electrodo y luego pasar la cinta por el costado del electrodo hasta la piel. Este enfoque parece asegurar el electrodo y minimiza el potencial de movimiento lateral durante el experimento. - Después de asegurar el electrodo, pídale al participante que asuma la orientación deseada de la extremidad que se utilizará durante la estimulación TMS. Verifique que todavía se produzca una contracción del pulgar.
5. Determinación de la intensidad del estímulo del nervio mediano
- Determinar el umbral de estímulo periférico ajustando el amperaje de la intensidad del estímulo periférico hasta que se obtenga una onda M de 0,2 mV37,56. Si la onda M excede la amplitud objetivo deseada de 0,2 mV en tres estímulos sucesivos, disminuya el amperaje. Si la onda M está por debajo de la amplitud objetivo deseada de 0,2 mV en tres estímulos posteriores, aumente el amperaje. El umbral es el primer valor de amperaje cuando la onda M supera los 0,2 mV.
NOTA: Una alternativa común es establecer la intensidad en 3x el umbral sensorial perceptual o 1x el umbral motor 11,16,17,66,67,68. El umbral sensorial es la intensidad del estímulo en el que los participantes informan correctamente una sensación en 5 de 10 estímulos eléctricos. El umbral motor es la intensidad del estímulo en la que se produce una contracción visible en 5 de 10 estímulos.
6. Determinación de la trayectoria óptima de la bobina para la estimulación magnética transcraneal
- Utilice un archivo de imagen de resonancia magnética (MRI) de plantilla para crear un nuevo archivo de proyecto de sistema de guía estereotáctica para monitorear la posición del participante y la orientación de la bobina. A continuación, conecte el disparador de salida digital del estimulador TMS al canal de entrada de disparo en el sistema EMG para activar la grabación EMG cuando se entrega el estímulo TMS.
NOTA: Cuando esté disponible, se puede usar una resonancia magnética específica del sujeto. Sin embargo, el MEP es suficiente para determinar la posición óptima de la bobina para los estudios de estimulación de la corteza motora. - Fije la herramienta de seguimiento de bobinas del sistema de guía a la bobina PA TMS. Utilice la herramienta de calibración de bobinas para calibrar la orientación de la herramienta de seguimiento de bobinas hasta el punto medio de la bobina TMS. Repita este paso utilizando una segunda herramienta de seguimiento de bobinas para una bobina AP con geometría idéntica a la bobina PA.
- Fije la herramienta de seguimiento de sujetos del sistema de guía en la frente del participante utilizando dos electrodos EMG. Use un marcador de borrado en seco de punta fina o un aplicador de delineador de ojos para colocar marcas en el centro de la punta de la nariz, la nasión y las fosas preauriculares izquierda y derecha. Utilice la herramienta de calibración de sujetos del sistema de guía para tocar y registrar la posición de cada marcador.
- Establezca una posición inicial de la bobina colocando la bobina en la cabeza del participante y registrando la trayectoria de la bobina. Asegúrese de que la superficie central de la bobina sea tangencial al cuero cabelludo. Alinee la línea media de la bobina a 45° con respecto al plano sagital medio de la cabeza del participante.
- Para obtener una aproximación inicial del punto caliente de la corteza motora, imagine una línea tangencial que conecta un punto 5 cm anterior al vértice y 5 cm lateral al vértice, y coloque una bobina de 70 mm a aproximadamente 2 cm del punto anterior a lo largo de la línea tangencial.
NOTA: Un enfoque alternativo para aproximar el punto caliente motor cortical para los músculos distales de la mano contralateral es que el experimentador coloque su dedo índice izquierdo (si es estimulante sobre la corteza motora izquierda del participante) en el vértice de la cabeza y el pulgar de la mano izquierda en el punto preauricular de la oreja izquierda. La posición de la articulación metacarpofalángica del dedo índice se puede utilizar para visualizar una posición aproximada en la que colocar el centro de la bobina.
- Para obtener una aproximación inicial del punto caliente de la corteza motora, imagine una línea tangencial que conecta un punto 5 cm anterior al vértice y 5 cm lateral al vértice, y coloque una bobina de 70 mm a aproximadamente 2 cm del punto anterior a lo largo de la línea tangencial.
- En el estimulador cTMS, configure el selector de tipo de pulso en Monophasic-Positive para inducir una corriente de PA en el tejido neural subyacente. A continuación, establezca la relación M en 0.2 y la intensidad del estímulo (también conocida como potencia) en el 30% de la salida máxima del estimulador. Finalmente, establezca el ancho de pulso (también conocido como duración de fase positiva) en 120 μs (el ancho de pulso más largo utilizado en el estudio).
NOTA: La posición y la trayectoria de la bobina determinadas utilizando la corriente inducida por PA se emplearán para la corriente inducida por AP 16,36,37,38,56,69. - Administrar de tres a cinco estímulos TMS mientras el participante mantiene una ligera contracción del músculo FDI (~ 5% -10% de la contracción voluntaria máxima). Si no se obtiene un potencial evocado por el motor (MEP), aumente la intensidad del estimulador en un 10% y entregue de tres a cinco estímulos TMS adicionales.
- Repita el paso anterior hasta que se obtenga un MEP de al menos 0,2 mV para cada estímulo, o hasta que la intensidad del estimulador alcance el 60% -70% de la producción máxima del estimulador. Si no se obtiene un MEP confiable, mantenga constantes los parámetros de estimulación y mueva el estimulador TMS en un círculo con ~ 2 cm de diámetro alrededor del sitio de estimulación original. Aumente el diámetro del círculo en 1 cm si todavía no se obtiene un MEP confiable en ningún punto del círculo original.
- Una vez que se obtenga un MEP confiable, confirme el punto caliente del motor FDI manteniendo constantes los parámetros de estimulación y moviendo el estimulador TMS 2 cm al norte, este, sur y oeste de la ubicación actual de la bobina. Entregar de tres a cinco estímulos TMS en cada ubicación70. Registre la nueva posición y trayectoria de la bobina si se obtiene un MEP consistentemente más grande en cualquiera de los cuatro cuadrantes. Utilice la nueva posición y trayectoria de la bobina como punto caliente motor cortical.
7. Determinación de la intensidad del estímulo para la estimulación magnética transcraneal
- Lanzar la herramienta de evaluación del umbral motor TMS (MTAT 2.1)71,72,73 disponible gratuitamente para determinar la intensidad del estímulo requerida para obtener un MEP de 1 mV (umbral de 1 mV)16,67,74. Establezca el método de estimación en Sin información a priori y haga clic en Iniciar.
NOTA: El protocolo actual utiliza una intensidad TMS de 1 mV16. Sin embargo, algunos estudios prefieren establecer la intensidad como el 120% del umbral motor en reposo del individuo. Para la corriente AP, es posible que no se pueda obtener un MEP de 1 mV. En tales casos, determine la salida del estimulador que provoca el MEP máximo provocado por la configuración de estímulo AP, siempre que el MEP máximo sea de al menos 0,5 mV. - Determine la salida máxima del estimulador disponible para el ancho de pulso de 120 μs. Luego, use una tabla de conversión para reescalar el rango de la salida del estimulador de 0 a 100 para que la salida del estimulador coincida con la escala del software MTAT 2.1.
NOTA: Para el modelo utilizado en el presente estudio, la salida máxima del estimulador para un ancho de pulso de 120 μs es del 50%. Por lo tanto, los valores proporcionados por el software MTAT 2.1 se dividen por 2 para determinar el valor establecido en el estimulador. Para un ancho de pulso de 70 μs, la salida máxima del estimulador es del 66%, por lo que todos los valores proporcionados por el software MTAT 2.1 se multiplican por 0,66 (y se redondean al 0,5% más cercano). Para un ancho de pulso de 30 μs, la salida máxima del estimulador es del 100%. Por lo tanto, no es necesario ningún ajuste de escala. - Ajuste la intensidad del estimulador TMS al porcentaje inicial de salida máxima del estimulador indicado por el software MTAT 2.1 y entregue un solo estímulo TMS. Si el MEP grabado en el rango de tiempo de 20-50 ms después del estímulo TMS excede 1 mV, indique "sí" presionando la tecla Y . Si el MEP grabado es inferior a 1 mV, indique "no" pulsando la tecla N . Repita este paso hasta que la intensidad de estímulo mostrada por el software MTAT cambie de negro a verde.
NOTA: El valor inicial indicado por el software MTAT 2.1 es siempre 37%. Para un ancho de pulso de 120 μs, el valor real del estimulador es 18.5%. Para un ancho de pulso de 70 μs, el valor real del estimulador es del 24%. Para un ancho de pulso de 30 μs, el valor del estimulador es del 37%. - Repita para cada combinación de dirección actual y duración del estímulo. Para la corriente AP, gire la dirección de la corriente a 180 ° girando físicamente la bobina para inducir la corriente PA en 180 °, o utilice una bobina personalizada fabricada para inducir la corriente AP.
NOTA: Cuando se utilizan varias direcciones de corriente TMS y anchos de pulso, todos los umbrales se pueden determinar antes de la recopilación de datos o justo antes de utilizar esa combinación específica de dirección de corriente y ancho de pulso en el protocolo.
8. Inhibición aferente de latencia corta (sin línea de base de tarea)
- Conecte la bobina que inducirá la corriente PA en el cerebro al estimulador cTMS. Establezca el tipo de pulso en Monofásico-positivo y la relación M en 0,2. Ajuste el ancho de pulso a 120 μs. Finalmente, establezca la intensidad del estímulo en el umbral de 1 mV determinado en el paso 7.
NOTA: Si se utilizan las instrucciones actuales de PA y AP, el orden en que se realiza el paso 8 debe ser aleatorio entre los participantes. Si se utilizan varios anchos de pulso, el orden en que se realiza el paso 8 debe equilibrarse entre los participantes. PA120 y AP30 fueron las únicas configuraciones actuales empleadas en el experimento descrito. - Ajuste la intensidad del estímulo eléctrico periférico a la intensidad determinada en el paso 5. Luego, inicie la rutina de software sin tareas en PC1. A continuación, establezca el intervalo interestímulo entre los estímulos eléctricos periféricos y TMS en 21 ms.
- Coloque la bobina TMS sobre el punto caliente del motor FDI determinado en el paso 6. Pídale al participante que mantenga una ligera contracción del músculo FDI (~ 5% -10% de la contracción voluntaria máxima). A continuación, ejecute el software sin tareas en PC1 para activar los estimuladores periféricos y cTMS.
- Repita los pasos para la configuración de corriente AP30 utilizando la bobina que induce la corriente AP en el cerebro.
NOTA: Se recomienda que la línea base sin tarea se repita al final del experimento, si el tiempo lo permite. Se recomienda encarecidamente las evaluaciones de EFS previas y posteriores a la no tarea para proporcionar una línea de base de EFS y establecer cualquier diferencia preexistente entre los grupos (si corresponde).
9. Inhibición aferente de baja latencia (tarea sensoriomotora)
- Conecte la bobina de PA al estimulador cTMS. Establezca el tipo de pulso en Monofásico-positivo y la relación M en 0,2. Ajuste el ancho de pulso a 120 μs. Finalmente, establezca la intensidad del estímulo en el umbral de 1 mV determinado en el paso 7.
NOTA: Cuando se utilizan múltiples configuraciones de corriente TMS (por ejemplo, PA120, AP30), la configuración actual empleada durante la tarea sensoriomotora debe ser contrarrestada entre los participantes. Se recomienda utilizar el mismo contrapeso utilizado para determinar el orden de la evaluación de línea base sin tarea. - Ajuste la intensidad del estímulo eléctrico periférico a la intensidad determinada en el paso 5. Luego, inicie la rutina del software de tareas sensoriomotoras en PC1. Ajuste el intervalo interestímulo entre los estímulos eléctricos periféricos y TMS a 21 ms.
- Coloque la bobina TMS sobre el punto caliente del motor FDI determinado en el paso 6. Pídale al participante que mantenga una ligera contracción del músculo FDI (~ 5% -10% de la contracción voluntaria máxima).
- Ejecute la rutina del software de tareas sensoriomotoras para controlar la tarea sensoriomotora y envíe los disparadores digitales bloqueados por comportamiento a los estimuladores periféricos y cTMS. Mantenga el número deseado de ensayos no condicionados y condicionados entre 8 y 24 estímulos por condición.
- Repita los pasos para la configuración de corriente AP30 utilizando la bobina para inducir corriente AP en el cerebro.
10. Tratamiento y análisis de datos
- Inspeccione visualmente los datos de EMG sin conexión y descarte cualquier rastro en el que el cuadrado medio raíz de la EMG preestímulo (−50 al inicio del estímulo) exceda la amplitud de un criterio. Calcule el error cuadrático medio de raíz para cada ensayo de la siguiente manera:
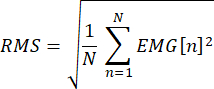
donde N es el número de puntos de datos entre −50 y el inicio del estímulo, y el EMG es el voltaje en el punto n. Para SAI realizado con el músculo en reposo, utilizar una amplitud de criterio de 10-15 μV. Para la EFS evaluada con una ligera contracción tónica, utilice una amplitud de criterio que sea el RMSE promedio en todos los ensayos más dos desviaciones estándar, suponiendo que los niveles de contracción se monitorizaron durante el estudio. - Para cada ensayo, calcule la amplitud MEP pico a pico para la IED como la diferencia entre los valores mínimo y máximo en la ventana de tiempo entre 20 ms y 50 ms después del artefacto de estímulo post-TMS en el canal 170.
- Para los ensayos condicionados, calcule la amplitud de onda M de pico a pico para la APB como la amplitud pico a pico de 5 ms a 15 ms del artefacto de estímulo postperiférico en el canal 2.
NOTA: El cálculo de la amplitud de la onda M pico a pico es un método para confirmar que la intensidad del estímulo no varió entre las condiciones a lo largo del experimento. - Calcule la amplitud media de la MEP para los ensayos no condicionados y condicionados y la onda M media para los ensayos condicionados para cada combinación de dirección de corriente TMS, ancho de pulso y condición de comportamiento.
- Exprese la amplitud MEP condicionada como una relación de la amplitud MEP no condicionada para cada participante usando la ecuación debajo de11:
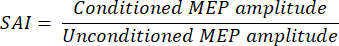
NOTA: Las proporciones más bajas reflejan una inhibición más potente. Multiplicar la relación por 100% es común expresar la amplitud MEP condicionada como un porcentaje de la amplitud MEP no condicionada. - Calcule la media de todos los participantes para cada dirección de corriente TMS, ancho de pulso y combinación de condición de comportamiento. Informe de estos valores. Aunque generalmente se informan los valores medios, demuestre los datos individuales en cifras siempre que sea posible.
Resultados
La Figura 3 ilustra ejemplos de MEPs no condicionados y condicionados de un solo participante obtenidos en el músculo FDI durante la tarea sensoriomotora utilizando corriente inducida PA120- y AP30- (subíndice denota ancho de pulso). Los gráficos de barras en la columna central ilustran las amplitudes MEP promedio brutas de pico a pico para los ensayos no condicionados y condicionados. Los gráficos de barras a la derecha muestran las latencias de inicio SAI y MEP pa...
Discusión
El método SAI descrito aquí sondea un subconjunto de vías neuronales que desempeñan un papel en el rendimiento sensoriomotor y el aprendizaje. La evaluación de SAI mientras los participantes realizan tareas sensoriomotoras controladas es fundamental para desenredar las complejas contribuciones de los numerosos bucles sensoriomotores que convergen en las neuronas motoras corticoespinales para dar forma a la producción motora en poblaciones sanas y clínicas. Por ejemplo, se ha utilizado una metodología similar para...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen la financiación del Consejo de Investigación de Ciencias Naturales e Ingeniería (NSERC), la Fundación Canadiense para la Innovación (CFI) y el Fondo de Investigación de Ontario (ORF) otorgados a S.K.M.
Materiales
| Name | Company | Catalog Number | Comments |
| Acquisition software (for EMG) | AD Instruments, Colorado Springs, CO, USA | PL3504/P | LabChart Pro version 8 |
| Alcohol prep pads | Medline Canada Corporation, Mississauga, ON, Canada | 211-MM-05507 | Alliance Sterile Medium, Antiseptic Isopropyl Alcohol Pad (200 per box) |
| Amplifier (for EMG) | AD Instruments, Colorado Springs, CO, USA | FE234 | Quad Bio Amp |
| Cotton round | Cliganic, San Francisco, CA, USA | CL-BE-019-6PK | Premium Cotton Rounds (6-pack, 90 per package) |
| cTMS coils | Rogue Research, Montréal, QC, Canada | COIL70F80301 | 70 mm Medium Inductance Figure-8 coil |
| cTMS coils | Rogue Research, Montréal, QC, Canada | COIL70F80301-IC | 70 mm Medium Inductance Figure-8 coil (Inverted Current) |
| cTMS stimulator | Rogue Research, Montréal, QC, Canada | CTMSMU0101 | Elevate cTMS stimulator |
| Data acquisition board (for EMG) | AD Instruments, Colorado Springs, CO, USA | PL3504 | PowerLab 4/35 |
| Digital to analog board | National Instruments, Austin, TX, USA | 782251-01 | NI USB-6341, X Series DAQ Device with BNC Termination |
| Dispoable adhesive electrodes (for EMG) | Covidien, Dublin, Ireland | 31112496 | Kendal 130 Foam Electrodes |
| Electrogel | Electrodestore.com | E9 | Electro-Gel for Electro-Cap (16 oz jar) |
| Nuprep | Weaver and Company, Aurora, CO, USA | 10-30 | Nuprep skin prep gel (3-pack of 4 oz tubes) |
| Peripheral electrical stimulator | Digitimer, Hertfordshire, UK | DS7R | DS7R High Voltage Constant Current Stimulator |
| Reusable bar electrode | Electrodestore.com | DDA-30 | Black Bar Electrode, Flat, Cathode Distal |
| Software (for behaviour and stimulator triggering) | National Instruments, Austin, TX, USA | 784503-35 | Labview 2020 |
| TMS stereotactic coil guidance system | Rogue Research, Montréal, QC, Canada | KITBSF0404 | BrainSight Neuronavigation System |
| Transpore tape | 3M, Saint Paul, MN, USA | 50707387794571 | Transpore Medical Tape (1 in x 10 yds) |
Referencias
- Bizzi, E., Ajemian, R. From motor planning to execution: a sensorimotor loop perspective. Journal of Neurophysiology. 124 (6), 1815-1823 (2020).
- Chen, R. Studies of human motor physiology with transcranial magnetic stimulation. Muscle & Nerve Supplement. 9, S26-S32 (2000).
- Hallett, M. Transcranial magnetic stimulation: A primer. Neuron. 55 (2), 187-199 (2007).
- Hallett, M. Transcranial magnetic stimulation and the human brain. Nature. 406 (6792), 147-150 (2000).
- Day, B. L., et al. Electric and magnetic stimulation of human motor cortex - Surface EMG and single motor unit responses. Journal of Physiology. 412, 449-473 (1989).
- Di Lazzaro, V., et al. Comparison of descending volleys evoked by transcranial magnetic and electric stimulation in conscious humans. Electroencephalography and Clinical Neurophysiology/Electromyography and Motor Control. 109 (5), 397-401 (1998).
- Di Lazzaro, V., Rothwell, J. C. Corticospinal activity evoked and modulated by non-invasive stimulation of the intact human motor cortex. Journal of Physiology. 592 (19), 4115-4128 (2014).
- Chen, R., et al. The clinical diagnostic utility of transcranial magnetic stimulation: Report of an IFCN committee. Clinical Neurophysiology. 119 (3), 504-532 (2008).
- Rossini, P. M. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N. Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Kujirai, T., et al. Corticocortical inhibition in human motor cortex. The Journal of Physiology. 471, 501-519 (1993).
- Tokimura, H., et al. Short latency inhibition of human hand motor cortex by somatosensory input from the hand. The Journal of Physiology. 523, 503-513 (2000).
- Nakamura, H., Kitagawa, H., Kawaguchi, Y., Tsuji, H. Intracortical facilitation and inhibition after transcranial magnetic stimulation in conscious humans. The Journal of Physiology. 498, 817-823 (1997).
- Chen, R., Corwell, B., Hallett, M. Modulation of motor cortex excitability by median nerve and digit stimulation. Experimental Brain Research. 129 (1), 77-86 (1999).
- Asmussen, M. J., Jacobs, M. F., Lee, K. G., Zapallow, C. M., Nelson, A. J. Short-latency afferent inhibition modulation during finger movement. PLoS One. 8 (4), e60496 (2013).
- Devanne, H. Afferent-induced facilitation of primary motor cortex excitability in the region controlling hand muscles in humans. European Journal of Neuroscience. 30 (3), 439-448 (2009).
- Ni, Z., et al. Transcranial magnetic stimulation in different current directions activates separate cortical circuits. Journal of Neurophysiology. 105 (2), 749-756 (2011).
- Bailey, A. Z., Asmussen, M. J., Nelson, A. J. Short-latency afferent inhibition determined by the sensory afferent volley. Journal of Neurophysiology. 116 (2), 637-644 (2016).
- Fischer, M., Orth, M. Short-latency sensory afferent inhibition: conditioning stimulus intensity, recording site, and effects of 1 Hz repetitive TMS. Brain Stimulation. 4 (4), 202-209 (2011).
- Voller, B., et al. Short-latency afferent inhibition during selective finger movement. Experimental Brain Research. 169 (2), 226-231 (2006).
- Asmussen, M. J., et al. Modulation of short-latency afferent inhibition depends on digit and task-relevance. PLoS One. 9 (8), e104807 (2014).
- Suzuki, L. Y., Meehan, S. K. Attention focus modulates afferent input to motor cortex during skilled action. Human Movement Science. 74, 102716 (2020).
- Bonassi, G., et al. Selective sensorimotor modulation operates during cognitive representation of movement. Neuroscience. 409, 16-25 (2019).
- Beck, S., Hallett, M. Surround inhibition in the motor system. Experimental Brain Research. 210 (2), 165-172 (2011).
- Seki, K., Fetz, E. E. Gating of sensory input at spinal and cortical levels during preparation and execution of voluntary movement. Journal of Neuroscience. 32 (3), 890-902 (2012).
- Young-Bernier, M., Davidson, P. S., Tremblay, F. Paired-pulse afferent modulation of TMS responses reveals a selective decrease in short latency afferent inhibition with age. Neurobiology of Aging. 33 (4), 1-11 (2012).
- Pelosin, E., et al. Attentional control of gait and falls: Is cholinergic dysfunction a common substrate in the elderly and Parkinson's disease. Frontiers in Aging Neuroscience. 8, 104 (2016).
- Dubbioso, R., Manganelli, F., Siebner, H. R., Di Lazzaro, V. Fast intracortical sensory-motor integration: A window into the pathophysiology of Parkinson's disease. Frontiers in Human Neuroscience. 13, 111 (2019).
- Oh, E., et al. Olfactory dysfunction in early Parkinson's disease is associated with short latency afferent inhibition reflecting central cholinergic dysfunction. Clinical Neurophysiology. 128 (6), 1061-1068 (2017).
- Richardson, S. P., et al. Changes in short afferent inhibition during phasic movement in focal dystonia. Muscle & Nerve. 37 (3), 358-363 (2008).
- Ziemann, U., et al. TMS and drugs revisited 2014. Clinical Neurophysiology. 126 (10), 1847-1868 (2015).
- Di Lazzaro, V. Muscarinic receptor blockade has differential effects on the excitability of intracortical circuits in the human motor cortex. Experimental Brain Research. 135 (4), 455-461 (2000).
- Di Lazzaro, V., et al. Neurophysiological predictors of long term response to AChE inhibitors in AD patients. Journal of Neurology, Neurosurgery and Psychiatry. 76 (8), 1064-1069 (2005).
- Fujiki, M., Hikawa, T., Abe, T., Ishii, K., Kobayashi, H. Reduced short latency afferent inhibition in diffuse axonal injury patients with memory impairment. Neuroscience Letters. 405 (3), 226-230 (2006).
- Koizume, Y., Hirano, M., Kubota, S., Tanaka, S., Funase, K. Relationship between the changes in M1 excitability after motor learning and arousal state as assessed by short-latency afferent inhibition. Behavioral Brain Research. 330, 56-62 (2017).
- Thabit, M. N., et al. Momentary reward induce changes in excitability of primary motor cortex. Clinical Neurophysiology. 122 (9), 1764-1770 (2011).
- Mirdamadi, J. L., Suzuki, L. Y., Meehan, S. K. Attention modulates specific motor cortical circuits recruited by transcranial magnetic stimulation. Neuroscience. 359, 151-158 (2017).
- Mirdamadi, J. L., Meehan, S. K. Specific sensorimotor interneuron circuits are sensitive to cerebellar-attention interactions. Frontiers in Human Neuroscience. 16, 920526 (2022).
- Suzuki, L. Y., Meehan, S. K. Verbal working memory modulates afferent circuits in motor cortex. European Journal of Neuroscience. 48 (10), 3117-3125 (2018).
- Mineo, L., et al. Modulation of sensorimotor circuits during retrieval of negative autobiographical memories: Exploring the impact of personality dimensions. Neuropsychologia. 110, 190-196 (2018).
- Bonnì, S., Ponzo, V., Di Lorenzo, F., Caltagirone, C., Koch, G. Real-time activation of central cholinergic circuits during recognition memory. European Journal of Neuroscience. 45 (11), 1485-1489 (2017).
- Nardone, R., et al. Abnormal short latency afferent inhibition in early Alzheimer's disease: A transcranial magnetic demonstration. Journal of Neural Transmission. 115 (11), 1557-1562 (2008).
- Nardone, R., Bratti, A., Tezzon, F. Motor cortex inhibitory circuits in dementia with Lewy bodies and in Alzheimer's disease. Journal of Neural Transmission. 113 (11), 1679-1684 (2006).
- Di Lazzaro, V., et al. In vivo cholinergic circuit evaluation in frontotemporal and Alzheimer dementias. Neurology. 66 (7), 1111-1113 (2006).
- Di Lazzaro, V., et al. Functional evaluation of cerebral cortex in dementia with Lewy bodies. NeuroImage. 37 (2), 422-429 (2007).
- Di Lazzaro, V., et al. In vivo functional evaluation of central cholinergic circuits in vascular dementia. Clinical Neurophysiology. 119 (11), 2494-2500 (2008).
- Marra, C., et al. Central cholinergic dysfunction measured "in vivo" correlates with different behavioral disorders in Alzheimer's disease and dementia with Lewy body. Brain Stimulation. 5 (4), 533-538 (2012).
- Mimura, Y., et al. Neurophysiological biomarkers using transcranial magnetic stimulation in Alzheimer's disease and mild cognitive impairment: A systematic review and meta-analysis. Neuroscience & Biobehavioral Reviews. 121, 47-59 (2021).
- Yarnall, A. J., et al. Short latency afferent inhibition: a biomarker for mild cognitive impairment in Parkinson's disease. Movement Disorders. 28 (9), 1285-1288 (2013).
- Celebi, O., Temuçin, C. M., Elibol, B., Saka, E. Short latency afferent inhibition in Parkinson's disease patients with dementia. Movement Disorders. 27 (8), 1052-1055 (2012).
- Martin-Rodriguez, J. F., Mir, P. Short-afferent inhibition and cognitive impairment in Parkinson's disease: A quantitative review and challenges. Neuroscience Letters. 719, 133679 (2020).
- Nardone, R., et al. Short latency afferent inhibition differs among the subtypes of mild cognitive impairment. Journal of Neural Transmission. 119 (4), 463-471 (2012).
- Tsutsumi, R., et al. Reduced interhemispheric inhibition in mild cognitive impairment. Experimental Brain Research. 218 (1), 21-26 (2012).
- Di Lazzaro, V., et al. Segregating two inhibitory circuits in human motor cortex at the level of GABAA receptor subtypes: A TMS study. Clinical Neurophysiology. 118 (10), 2207-2214 (2007).
- Giorgetti, M., et al. Local GABAergic modulation of acetylcholine release from the cortex of freely moving rats. European Journal of Neuroscience. 12 (6), 1941-1948 (2000).
- Turco, C. V., Toepp, S. L., Foglia, S. D., Dans, P. W., Nelson, A. J. Association of short- and long-latency afferent inhibition with human behavior. Clinical Neurophysiology. 132 (7), 1462-1480 (2021).
- Hannah, R., Rothwell, J. C. Pulse duration as well as current direction determines the specificity of transcranial magnetic stimulation of motor cortex during contraction. Brain Stimulation. 10 (1), 106-115 (2017).
- Peterchev, A. V., D'Ostilio, K., Rothwell, J. C., Murphy, D. L. Controllable pulse parameter transcranial magnetic stimulator with enhanced circuit topology and pulse shaping. Journal of Neural Engineering. 11 (5), 056023 (2014).
- Peterchev, A. V., Murphy, D. L., Lisanby, S. H. Repetitive transcranial magnetic stimulator with controllable pulse parameters (cTMS). Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2010, 2922-2926 (2010).
- Rothkegel, H., Sommer, M., Paulus, W., Lang, N. Impact of pulse duration in single pulse TMS. Clinical Neurophysiology. 121 (11), 1915-1921 (2010).
- MagPro Family User Guide. MagVenture A/S Available from: https://tsgdoc.socsci.ru.nl/images/a/ac/Magpro_family.pdf (2022)
- Bashir, S., Edwards, D., Pascual-Leone, A. Neuronavigation increases the physiologic and behavioral effects of low-frequency rTMS of primary motor cortex in healthy subjects. Brain Topography. 24 (1), 54-64 (2011).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Screening questionnaire before TMS: An update. Clinical Neurophysiology. 122 (8), 1686 (2011).
- Keel, J. C., Smith, M. J., Wassermann, E. M. A safety screening questionnaire for transcranial magnetic stimulation. Clinical Neurophysiology. 112 (4), 720 (2001).
- Wassermann, E. M. Risk and safety of repetitive transcranial magnetic stimulation: report and suggested guidelines from the International Workshop on the Safety of Repetitive Transcranial Magnetic Stimulation, June 5-7, 1996. Electroencephalography and Clinical Neurophysiology. 108 (1), 1-16 (1998).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert guidelines. Clinical Neurophysiology. 132 (1), 269-306 (2021).
- Udupa, K., Ni, Z., Gunraj, C., Chen, R. Effects of short latency afferent inhibition on short interval intracortical inhibition. Journal of Neurophysiology. 111 (6), 1350-1361 (2013).
- Udupa, K., Ni, Z., Gunraj, C., Chen, R. Interactions between short latency afferent inhibition and long interval intracortical inhibition. Experimental Brain Research. 199 (2), 177-183 (2009).
- Turco, C. V., El-Sayes, J., Fassett, H. J., Chen, R., Nelson, A. J. Modulation of long-latency afferent inhibition by the amplitude of sensory afferent volley. Journal of Neurophysiology. 118 (1), 610-618 (2017).
- Sakai, K., et al. Preferential activation of different I waves by transcranial magnetic stimulation with a figure-of-eight-shaped coil. Experimental Brain Research. 113 (1), 24-32 (1997).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: Report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- . ClinicalResearcher.org Available from: https://www.clinicalresearcher.org/software.htm (2022)
- Awiszus, F. TMS and threshold hunting. Supplements to Clinical Neurophysiology. 56, 13-23 (2003).
- Silbert, B. I., Patterson, H. I., Pevcic, D. D., Windnagel, K. A., Thickbroom, G. W. A comparison of relative-frequency and threshold-hunting methods to determine stimulus intensity in transcranial magnetic stimulation. Clinical Neurophysiology. 124 (4), 708-712 (2013).
- Cash, R. F., Isayama, R., Gunraj, C. A., Ni, Z., Chen, R. The influence of sensory afferent input on local motor cortical excitatory circuitry in humans. Journal of Physiology. 593 (7), 1667-1684 (2015).
- Hayes, K. D., Khan, M. E. R., Barclay, N. E., Meehan, S. K. The persistent effects of sports-related concussion during adolescence on sensorimotor integration. Canadian Association for Neuroscience Meeting. , (2022).
- Turco, C. V., et al. Short- and long-latency afferent inhibition; Uses, mechanisms and influencing factors. Brain Stimulation. 11 (1), 59-74 (2018).
- Casula, E. P., Rocchi, L., Hannah, R., Rothwell, J. C. Effects of pulse width, waveform and current direction in the cortex: A combined cTMS-EEG study. Brain Stimulation. 11 (5), 1063-1070 (2018).
- D'Ostilio, K., et al. Effect of coil orientation on strength-duration time constant and I-wave activation with controllable pulse parameter transcranial magnetic stimulation. Clinical Neurophysiology. 127 (1), 675-683 (2016).
- Barclay, N. E., Graham, K. R., Hayes, K. D., Meehan, S. K. Program No. 474.08.The contribution of oscillatory activity to the modulation of different sensorimotor circuits under varying working memory load. Society for Neuroscience Annual Meeting. , (2022).
- Dubbioso, R., Raffin, E., Karabanov, A., Thielscher, A., Siebner, H. R. Centre-surround organization of fast sensorimotor integration in human motor hand area. NeuroImage. 158, 37-47 (2017).
- Adams, F. C., et al. Tactile sensorimotor training does not alter short- and long-latency afferent inhibition. Neuroreport. 34 (3), 123-127 (2023).
- Paparella, G., Rocchi, L., Bologna, M., Berardelli, A., Rothwell, J. Differential effects of motor skill acquisition on the primary motor and sensory cortices in healthy humans. Journal of Physiology. 598 (18), 4031-4045 (2020).
- Deveci, S., et al. Effect of the brain-derived neurotrophic factor gene Val66Met polymorphism on sensory-motor integration during a complex motor learning exercise. Brain Research. 1732, 146652 (2020).
- Turco, C. V., Locke, M. B., El-Sayes, J., Tommerdahl, M., Nelson, A. J. Exploring behavioral correlates of afferent inhibition. Brain Sciences. 8 (4), 64 (2018).
- Mang, C. S., Bergquist, A. J., Roshko, S. M., Collins, D. F. Loss of short-latency afferent inhibition and emergence of afferent facilitation following neuromuscular electrical stimulation. Neuroscience Letters. 529 (1), 80-85 (2012).
- Mirdamadi, J. L., Block, H. J. Somatosensory changes associated with motor skill learning. Journal of Neurophysiology. 123 (3), 1052-1062 (2020).
- Bologna, M., et al. Bradykinesia in Alzheimer's disease and its neurophysiological substrates. Clinical Neurophysiology. 131 (4), 850-858 (2020).
- Schirinzi, T. Amyloid-mediated cholinergic dysfunction in motor impairment related to Alzheimer's disease. Journal of Alzheimer's Disease. 64 (2), 525-532 (2018).
- Cohen, L. G., Starr, A. Localization, timing and specificity of gating of somatosensory evoked potentials during active movement in man. Brain. 110 (2), 451-467 (1987).
- Brown, K. E., et al. The reliability of commonly used electrophysiology measures Active and resting motor threshold are efficiently obtained with adaptive threshold hunting. Brain Stimulation. 10 (6), 1102-1111 (2017).
- Turco, C. V., Pesevski, A., McNicholas, P. D., Beaulieu, L. D., Nelson, A. J. Reliability of transcranial magnetic stimulation measures of afferent inhibition. Brain Research. 1723, 146394 (2019).
- Rehsi, R. S., et al. Investigating the intra-session reliability of short and long latency afferent inhibition. Clinical Neurophysiology Practice. 8, 16-23 (2023).
- Toepp, S. L., Turco, C. V., Rehsi, R. S., Nelson, A. J. The distribution and reliability of TMS-evoked short- and long-latency afferent interactions. PLoS One. 16 (12), e0260663 (2021).
- Alle, H., Heidegger, T., Krivanekova, L., Ziemann, U. Interactions between short-interval intracortical inhibition and short-latency afferent inhibition in human motor cortex. Journal of Physiology-London. 587 (21), 5163-5176 (2009).
- Noda, Y., et al. A combined TMS-EEG study of short-latency afferent inhibition in the motor and dorsolateral prefrontal cortex. Journal of Neurophysiology. 116 (3), 938-948 (2016).
- Noda, Y. Reduced prefrontal short-latency afferent inhibition in older adults and its relation to executive function: A TMS-EEG study. Frontiers in Aging Neuroscience. 9, 119 (2017).
- Noda, Y., et al. Reduced short-latency afferent inhibition in prefrontal but not motor cortex and its association with executive function in schizophrenia: A combined TMS-EEG study. Schizophrenia Bulletin. 44 (1), 193-202 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados