Method Article
Modelo porcino de infección por biofilm y heridas invisibles
En este artículo
Resumen
Las heridas crónicas resistentes a los antibióticos son una gran amenaza para el sistema sanitario. Las infecciones por biofilm son persistentes y hostiles y pueden causar un cierre funcional deficiente de la herida. Presentamos un modelo porcino clínicamente relevante de heridas crónicas de espesor total infectadas con biofilm. Este modelo es poderoso para estudios mecanicistas, así como para probar intervenciones.
Resumen
La infección por biofilm es uno de los principales factores que contribuyen a la cronicidad de las heridas. El establecimiento de una infección experimental de biofilm de heridas clínicamente relevante requiere la participación del sistema inmunitario del huésped. Los cambios iterativos en el huésped y el patógeno durante la formación de dicha biopelícula clínicamente relevante solo pueden ocurrir in vivo. El modelo de herida porcina es reconocido por sus ventajas como un poderoso modelo preclínico. Existen varios enfoques reportados para el estudio de las biopelículas de heridas. Los sistemas in vitro y ex vivo son deficientes en cuanto a la respuesta inmunitaria del huésped. Los estudios in vivo a corto plazo implican respuestas agudas y, por lo tanto, no permiten la maduración de la biopelícula, como se sabe que ocurre clínicamente. El primer estudio de biopelícula de heridas porcinas a largo plazo se publicó en 2014. El estudio reconoció que las heridas infectadas con biopelícula pueden cerrarse según lo determinado por la planimetría, pero la función de barrera de la piel del sitio afectado puede no restaurarse. Posteriormente, esta observación fue validada clínicamente. Así nació el concepto de cierre funcional de heridas. Las heridas cerradas pero deficientes en la función de barrera de la piel pueden ser vistas como heridas invisibles. En este trabajo, buscamos reportar los detalles metodológicos necesarios para reproducir el modelo porcino a largo plazo de lesión por quemaduras severas infectadas con biofilm, que es clínicamente relevante y tiene valor traslacional. Este protocolo proporciona una guía detallada sobre cómo establecer una infección por biofilm de la herida a las 8 semanas utilizando P. aeruginosa (PA01). Se crearon ocho heridas por quemaduras de espesor total simétricamente en el dorso de cerdos blancos domésticos, que fueron inoculados con (PA01) en el día 3 después de la quemadura; posteriormente, se realizaron evaluaciones no invasivas de la cicatrización de la herida en diferentes momentos mediante imágenes de moteado láser (LSI), ultrasonido de alta resolución (HUSD) y pérdida de agua transepidérmica (TEWL). Las quemaduras inoculadas se cubrieron con un apósito de cuatro capas. Las biopelículas, según lo establecido y confirmado estructuralmente por SEM en el día 7 después de la inoculación, comprometieron el cierre funcional de la herida. Un resultado adverso de este tipo está sujeto a reversión en respuesta a las intervenciones adecuadas.
Introducción
La infección por biofilm complica las quemaduras y las heridas crónicas y causa cronicidad 1,2,3,4,5. En microbiología, se estudian principalmente los mecanismos de las biopelículas, con un enfoque en los microbios 1,6. Las lecciones aprendidas de estos estudios son de suma importancia desde el punto de vista de las ciencias biológicas, pero no necesariamente pueden ser aplicables a biopelículas patógenas clínicamente relevantes 6,7,8. Los agregados estructurales de biopelículas clínicamente relevantes deben incluir factores microbianos y del huésped 8,9,10. Este microambiente permite la inclusión de interacciones iterativas huésped-microbio, que son fundamentales para el desarrollo de una biopelícula clínicamente relevante 7,8. En este proceso, la participación de las células inmunitarias y de los factores transmitidos por la sangre es fundamental11,12. Las interacciones huésped-microbio que subyacen a las biopelículas patógenas clínicas, como se observa en las heridas crónicas, ocurren durante un largo período de tiempo. Por lo tanto, cualquier enfoque experimental dirigido a desarrollar un modelo traslacionalmente relevante de infección por biopelícula debe tener en cuenta estos factores. Por lo tanto, buscamos desarrollar un modelo de infección crónica por biopelícula porcina clínicamente reproducible.
Si bien los estudios en humanos representan claramente el mejor enfoque para estudiar los resultados de la curación, a menudo no son los más adecuados para abordar los mecanismos subyacentes y los nuevos paradigmas mecanicistas. Las preocupaciones éticas limitan el uso de diseños de estudios que requieren la recolección de múltiples biopsias de una herida crónica en diferentes momentos. Por lo tanto, es fundamental contar con un modelo animal bien establecido y reproducible que permita realizar estudios invasivos para el examen exhaustivo del destino de la biopelícula 7,13. La selección de un modelo animal depende de varios factores, entre ellos la relevancia científica/traslacional y la logística. El sistema porcino es ampliamente reconocido como el modelo experimental más valioso desde el punto de vista traslacional para estudiar las heridas de la piel humana7. Por lo tanto, este trabajo reporta un modelo porcino establecido de lesión por quemaduras de espesor total infectadas con biopelícula. Este trabajo se basa en varias publicaciones originales reportadas en la literatura 2,7,13,14,15,16,17. En este estudio, se eligió un aislado clínico de Pseudomonas aeruginosa multirresistente (PA01) para infectar la herida. P. aeruginosa es una causa frecuente de infecciones de heridas 2,18,19,20. Es una bacteria Gram negativa que puede ser difícil de tratar debido a su resistencia a algunos antibióticos11,19,21. Ninguno de los modelos de biopelícula porcina reportados hasta el momento involucró estudios a largo plazo de 8 semanas 22,23,24,25,26. Las heridas crónicas son aquellas que permanecen abiertas durante 4 semanas o más 14,27,28. No hay otros modelos de biopelícula de heridas crónicas reportados en la literatura. Este trabajo aborda la noción de cierre funcional de heridas 2,7,13,15,17,29.
Protocolo
Todos los estudios en animales se realizaron de acuerdo con los protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) #21147. El estudio se llevó a cabo en el Centro de Recursos para Animales de Laboratorio (LARC, por sus siglas en inglés) de la Universidad de Indiana. Utilizamos una hembra de cerdo blanco doméstico (70-80 lb) en este protocolo.
1. Aclimatación de los animales
- A la llegada de los cerdos a las instalaciones, aloje a los animales individualmente dentro de la misma habitación durante al menos 3 días para su aclimatación e interacción social.
- Alimenta a los cerdos con una dieta bien balanceada. Decida la cantidad de alimento en función del peso y siga las recomendaciones del fabricante.
- Asegúrese de que el animal esté en ayunas durante 6-12 horas antes del procedimiento para evitar náuseas, vómitos y la aspiración de fluidos estomacales mientras está bajo anestesia.
2. Montaje del quirófano
- Prepare la máquina de anestesia y asegúrese de que esté lista con el circuito de reinhalación.
- Organice la habitación para la cirugía, como se describe a continuación (Figura 1A).
- Cubra la mesa de procedimientos con un paño estéril y coloque una manta de agua circulante debajo para ayudar en la termorregulación.
- Prepare una mesa con suministros de inducción y materiales de preparación para la cirugía. Coloque una mesa con los dispositivos de quemador y las cajas de control. Configure el equipo de imágenes y asegúrese de que esté encendido.
3. Sedación del cerdo
- Sedar al cerdo con una inyección intramuscular de TKX (Telazol 4,4 mg/kg; ketamina 2,2 mg/kg; xilacina 2,2 mg/kg) a una dosis de 1 mL/50 lb. Mantener al cerdo en la sala de procedimientos con isoflurano al 1%-3% administrado a través de una máscara.
- Administrar los analgésicos (preoperatorios) a los cerdos de acuerdo con el protocolo de la IACUC; algunos ejemplos son los siguientes: buprenorfina 0,3 mg/mL, 0,01-0,05 mg/kg IM; carprofeno 50 mg/mL, 4 mg/kg IM o SQ; fentanilo transdérmico 100 mcg/h colocado en el pabellón auricular de la oreja; gabapentina 300 mg cápsulas, 3-10 mg/kg VO.
NOTA: Para todos los procedimientos de quemaduras y biopsias, se administrará 1 dosis de gabapentina el día anterior a la cirugía y se administrará 1 dosis de carprofeno el día del procedimiento. Para el procedimiento de quemadura principal, se colocará un parche de fentanilo y se administrará 1 dosis completa de buprenorfina durante la preparación quirúrgica.
4. Inducción de la anestesia
- Esterilice el oído alternando un exfoliante de clorhexidina al 2% y alcohol al menos tres veces. Inserte el catéter intravenoso A 22-18 G 1 en la vena marginal del oído y confirme el flujo sanguíneo. Enjuague el catéter con solución salina y fíjelo con cinta quirúrgica (Figura 1B).
- Intubar al cerdo con un tubo endotraqueal de tamaño adecuado (7-9 mm) una vez que se haya logrado la relajación muscular mediante la inhalación de anestesia a través de la máscara. Comprobar la relajación muscular mediante la observación de una pérdida de tono mandibular y un reflejo palpebral.
- Abra el tubo y pruebe la fuga del manguito con una jeringa de aire. Inserte el tubo con la ayuda de un laringoscopio30.
- Infle el manguito y asegure el tubo una vez que se confirme la colocación correcta. Conecte el cerdo al circuito de reinhalación.
NOTA: El tubo se ata en su lugar sobre el hocico y se usa una gasa enrollable para asegurarlo. La auscultación del tórax se realiza con un estetoscopio para confirmar la colocación adecuada del tubo.
NOTA: Durante la anestesia, se suministra aire cada 5-10 minutos cerrando la válvula de escape y presionando la bolsa de reinhalación hasta que el manómetro de presión alcance los 20 mm/Hg para evitar la atelectasia posicional.
- Vigile al animal y la profundidad de la anestesia.
- Conecte el cerdo a un monitor multiparamétrico. El monitor leerá continuamente la saturación de oxígeno (SpO 2), la frecuencia del pulso, el dióxido de carbono al final de la espiración (EtCO2), la frecuencia respiratoria y la temperatura. Registre los signos vitales cada 10 minutos durante todo el procedimiento.
- Evalúe la profundidad de la anestesia probando los reflejos del dolor con un pellizco en el dedo del pie de la pata trasera antes de comenzar la herida.
NOTA: Cuando sea necesario, ajuste el vaporizador anestésico para administrar anestesia adicional, o espere unos minutos. Revise los reflejos del dolor y los reflejos palpebrales con regularidad durante toda la cirugía.
5. Preparación animal para heridas por quemaduras
- Desconecte al cerdo de la máquina de anestesia y muévalo a la mesa de procedimientos. Coloque al cerdo en decúbito recostado y asegúrese de asegurar todas las líneas y tubos conectados (Figura 1C).
- Vuelva a conectar el cerdo a la máquina de anestesia y mantenga el O2 a 0,8-1,5 L/min y el isoflurano al 1%-3% hasta el final del procedimiento.
- Administrar líquidos intravenosos (LRS) al cerdo a una velocidad de goteo de 8-10 ml/kg/h. Controle la anestesia como en el paso 4.3.
6. Preparación antiséptica y marcado del sitio de la quemadura de la piel
- Prepare el área de la herida afeitándose y aplicando la crema depilatoria, como se describe a continuación (Figura 2).
- Afeitar el dorso de cerdo en un área de aproximadamente 25 cm de ancho desde la columna vertebral hasta la axila en ambos lados con una maquinilla eléctrica.
- Aplique la crema depilatoria en el área recortada y deje reposar durante 3-7 minutos. Retira la crema junto con el cabello con toallas absorbentes limpias.
- Preparación del lugar de la quema
- Frote el área a la herida alternando un exfoliante de clorhexidina al 2% y alcohol isopropílico al 70% al menos tres veces durante aproximadamente 5 minutos. Asegúrese de que el exfoliante sea aplicado en un patrón de diana (comenzando en el centro y moviéndose hacia afuera en una espiral) por personal que use guantes estériles.
- Marque los sitios de la herida con una plantilla de quemadura estéril y un marcador cutáneo quirúrgico (Figura 2B). Marque de seis a ocho heridas (2 pulgadas x 2 pulgadas) simétricamente en el dorso.
- Cubra las áreas alrededor de los sitios marcados con un paño estéril para reducir la contaminación (Figura 2C).
7. Procedimiento de heridas por quemaduras
- Use un dispositivo de quemado, como un quemador personalizado fabricado internamente que consista en un bloque de acero inoxidable de 2 pulgadas x 2 pulgadas (peso: 352 g) conectado a un lápiz óptico de metal, un microstato electrónico y una báscula electrónica (peso total: 1,714 g; Figura 3).
- Ajuste el quemador a la temperatura deseada. Ajuste la temperatura objetivo para heridas de espesor total a 150 °C (Figura 3A). Para ello, ajuste el punto de ajuste (SP) de la unidad de control a 150 °C. Ajuste el punto de ajuste bajo a 145 °C y el punto de ajuste alto a 155 °C (Figura 1D).
- Cree una herida por quemadura de espesor completo de 2 pulgadas x 2 pulgadas usando bloques de acero inoxidable calentados conectados al dispositivo de quemaduras y colocándolos sobre la piel durante 60 s (Figura 3B, C). Durante la aplicación de la quema, use la báscula electrónica para asegurarse de que el quemador aplique una presión uniforme.
8. Evaluación e imágenes de heridas por quemaduras
- Fotografía digital
- Tome imágenes de las heridas con una cámara DSLR y una lente ultrasónica gran angular de 17-55 mm de enfoque trasero corto (EFS) con enfoque eléctrico y una linterna.
- Tome una foto digital de todo el lomo del cerdo, incluyendo un cartel con la identificación del cerdo, el punto de tiempo y la fecha. Luego, tome imágenes para cada herida por separado que muestren un cartel con la identificación del cerdo, la identificación de la herida y el punto de tiempo, y una regla.
- Calcule el área de la herida como el porcentaje del tamaño original de la herida en cada punto de tiempo de recolección hasta el día 56.
NOTA: En este trabajo, el área de la herida se calculó en cada punto de tiempo (d0, d7, d14, d28 y d56) como un porcentaje del área original de la herida en d0.
- Imágenes de moteado láser (LSI)
- Para la obtención de imágenes de manchas láser, utilice un generador de imágenes de perfusión sanguínea basado en la tecnología de análisis de contraste de manchas láser (LASCA) para evaluar la perfusión microvascular de la herida en tiempo real.
- Toma las imágenes de todas las heridas en una sola grabación. Ajuste el valor medido de la distancia de trabajo desde la cámara láser hasta la herida para que sea consistente para la obtención de imágenes de cada herida (Figura 4A).
- Registre la perfusión mediante una serie de imágenes tomadas en un lapso de 10-15 s. Después de obtener imágenes de una herida, la grabación se detiene automáticamente y la grabación se reanuda una vez que la cámara se ajusta para la herida posterior. Cada vez que la grabación se detiene, se agrega un marcador para identificar la herida.
- Pérdida de agua transepidérmica (TEWL)
- Mida la TEWL para cada herida utilizando una unidad estándar, una sonda TEWL y un software (Figura 4B). Para cada herida, coloque una cubierta limpia de la sonda sobre la punta de la sonda, que estará en contacto con el tejido de la herida.
- Coloque la sonda suave y uniformemente sobre la piel e inicie la lectura presionando el botón Inicio de la unidad.
- Mide cada herida cinco veces, primero en el centro y luego en cada esquina. Luego, exporte todas las lecturas a una hoja de cálculo (Figura 4B).
- Ultrasonido armónico (HUSD)
- Realice el mapeo del HUSD escaneando la herida con una sonda de ultrasonido (US) desde la línea media (columna vertebral) comenzando desde la piel normal hacia el lado lateral del cerdo donde nuevamente hay piel normal. Siga este patrón de exploración para cada herida tanto en el modo B como en el modo de elastografía tisular utilizando la máquina de ultrasonido (Figura 4C).
- Para la exploración en modo B, aplique gel de ultrasonido estéril en el área de la herida y aplique un poco en la sonda de alta resolución ML-615. Anote cada grabación con la etiqueta de identificación de la herida. Inicie la grabación y mueva la sonda lentamente desde la línea media hacia abajo de la herida hasta que se alcance la piel normal del otro lado.
NOTA: Una vez finalizado el escaneo, la grabación se guarda y se exporta desde la máquina para su análisis. - Para la elastografía, cambie la máquina de ultrasonido al modo elasto presionando el botón Elasto . Vuelva a escanear la herida de la misma manera que en el escaneo en modo B, asegurándose de que se mantenga una presión uniforme de la sonda para permitir que el indicador de color de la elastografía (barras verdes) permanezca visible durante toda la grabación.
NOTA: La presión apropiada se puede determinar mediante la barra de escala en la grabación, que aparece en verde cuando se realiza el contacto correcto (Figura 4D). - Cambie la anotación después de que se visualice cada herida tanto en el modo B como en el modo elasto (dos grabaciones por herida). Cambie el comentario en el software para incluir la información de la siguiente herida y repita el proceso para las heridas posteriores.
- Para la exploración en modo B, aplique gel de ultrasonido estéril en el área de la herida y aplique un poco en la sonda de alta resolución ML-615. Anote cada grabación con la etiqueta de identificación de la herida. Inicie la grabación y mueva la sonda lentamente desde la línea media hacia abajo de la herida hasta que se alcance la piel normal del otro lado.
- Realice el mapeo del HUSD escaneando la herida con una sonda de ultrasonido (US) desde la línea media (columna vertebral) comenzando desde la piel normal hacia el lado lateral del cerdo donde nuevamente hay piel normal. Siga este patrón de exploración para cada herida tanto en el modo B como en el modo de elastografía tisular utilizando la máquina de ultrasonido (Figura 4C).
9. Vendaje y vendaje
- Cubra las heridas de las quemaduras individualmente con apósitos de película transparente o con el apósito de prueba (Figura 5A, B). Coloque un apósito de película transparente más grande sobre toda el área de la herida (Figura 5C).
- Aplique una segunda capa de gasa en rollo sin apretar alrededor de todo el tronco del cerdo para absorber cualquier exudado de líquido que provenga de las heridas. Enrolla al cerdo hacia adelante y hacia atrás desde su costado hasta ligeramente sobre su espalda para envolver el material de vendaje alrededor del cerdo.
- Cubra la gasa sin apretar con una capa de vendaje elástico flexible (Figura 5D). Asegúrese de que el vendaje no esté demasiado apretado, ya que aplicarlo demasiado apretado puede restringir la respiración y ejercer presión sobre el abdomen, lo que puede provocar un prolapso rectal u otras complicaciones.
NOTA: El vendaje elástico es elástico y se puede apretar demasiado fácilmente durante la aplicación. Sacarlo del rollo y dejar que quede sobre el borde de la envoltura anterior puede ayudar a evitar que se apriete demasiado. - Cubra el vendaje elástico con una capa final de 4 en cinta elástica (Figura 4E). Una vez más, asegúrese de que la aplicación no esté demasiado apretada, pero asegúrese de que el apósito esté asegurado en el borde superior e inferior para evitar que se deslice hacia abajo a medida que el cerdo se mueve después del procedimiento.
10. Recuperación de los animales y cuidados postoperatorios
- Recuperación
- Suspenda el gas anestésico una vez finalizada la herida, el procedimiento de diagnóstico por imágenes y el vendaje. Deje que el cerdo permanezca con oxígeno durante al menos 5 minutos.
- Mueva al cerdo, después de regresar al recinto principal, de la mesa de transporte/elevación a una alfombra de recuperación de espuma en la jaula. Levante el bebedero automático y retire el comedero J para evitar lesiones al cerdo durante la recuperación.
- Cubra al cerdo con mantas (incluida una manta de aire caliente) si hay hipotermia. Controle y registre los signos vitales, incluida la temperatura, el pulso, la frecuencia respiratoria y la SpO2 cada 10-15 minutos.
- Vigile continuamente al cerdo hasta que sea capaz de mantener la decúbito esternal de forma independiente. Una vez que el cerdo esté completamente recuperado, baje el bebedero de tetina y luego también se puede alimentar al cerdo.
- Evaluación del dolor
- Realice una evaluación del dolor postoperatorio utilizando un formulario de puntuación de dolor de Glasgow modificado. Asegúrese de que las evaluaciones del dolor sean completadas por el personal de laboratorio o LARC al menos cada 12 h durante los primeros 3-4 días después de la operación. La frecuencia de la puntuación del dolor es determinada por el veterinario tratante. Si el animal obtiene una puntuación superior a 5, administre analgesia de rescate (buprenorfina o hidromorfona).
- Proporcionar analgesia administrando una dosis de buprenorfina de 0,01-0,05 mg/kg IM antes del procedimiento, con una segunda dosis administrada 8-12 h después.
- Coloque un parche de fentanilo (100 mcg/h) en el pabellón auricular de la oreja antes de la quemadura.
- Inyecte carprofeno 4 mg/kg IM o SQ antes del procedimiento, y luego una vez al día IM, SQ o VO durante 2 días o según las indicaciones del veterinario de LARC.
- Administre gabapentina 3-10 mg/kg por vía oral, administrando una dosis el día anterior al procedimiento, la mañana del procedimiento, la noche siguiente al procedimiento y luego cada 12 h durante 3-5 días.
- Dieta
- Asegúrese de que los cerdos estén recuperados y luego permita el libre acceso al agua y la comida de acuerdo con su ración basada en el peso dos veces al día.
- Proporcione alimentos enriquecidos (frutas y verduras frescas, frutas congeladas, malvaviscos, yogur, pudín, etc.) y utilícelos para incitar a comer si se observa una disminución del apetito.
- Cambio de apósito
- Cambie los vendajes al menos una vez a la semana o con más frecuencia si los vendajes se ensucian o para adaptarse a las estrategias de tratamiento.
- Cambie los vendajes después de la obtención de imágenes mientras aún está bajo anestesia, o seda al cerdo solo con TKX para un cambio de apósito.
- Para reemplazar el vendaje, comience por quitar con cuidado el vendaje sucio con tijeras de vendaje Lister o tijeras para traumatismos, teniendo cuidado de no permitir que el exterior del apósito entre en contacto con las heridas.
- Limpie el área alrededor de las heridas si es necesario usando NaCl al 0.9% en una gasa limpia y seque el área suavemente. Siga los pasos del procedimiento para el vendaje descritos en la sección 9.
NOTA: Si se están aplicando apósitos experimentales, estos se pueden aplicar antes de cubrir las heridas con el apósito de película transparente.
- Frecuencia de obtención de imágenes
- Obtener imágenes (fotos digitales, LSI, TEWL y HUSD) en varios momentos a lo largo del estudio. Recopile datos de imágenes el día 3 (herida por quemadura), el día 0 (inoculación) y el día 7, el día 14, el día 28, el día 35 y el día 56 después de la inoculación.
11. Preparación e inoculación de biopelículas
- Preparación del inóculo
- Prepare una placa de inicio a partir de un congelador de glicerol de Pseudomonas aeruginosa (PA01) para un cultivo puro de la bacteria. Cultivar un cultivo de P. aeruginosa en agar Luria-Bertani (LBA) bajo en sal e incubar a 37 °C durante la noche.
- Inocular 5 mL de caldo Luria−Bertani bajo en sal (LBB) con una sola colonia de P. aeruginosa al día siguiente, e incubar durante la noche a 37 °C con agitación a 200 rpm.
- Para obtener células en fase logarítmica, se inoculan 200 μL del cultivo nocturno en 5 mL de LBB, e incubar en el agitador a 200 rpm a 37 °C durante 2,5 h.
- Mida la densidad óptica a 600 nm (OD600) con un espectrofotómetro. Preparar diluciones seriadas de hasta 1 x 10−9 utilizando 100 μL del cultivo en 900 μL de LBB estéril.
NOTA: Comenzamos con muestras sin diluir y terminamos con 1 x 10 7 UFC/mL. Obtuvimos colonias contables en la dilución 1 x 107, por lo que consideramos esta dilución como la dilución final. - Esparcir 100 μL de cada dilución sobre LBA e incubar durante la noche a 37 °C. De acuerdo con los protocolos microbiológicos estándar, utilice diluciones que muestren colonias contables (30-300) para el recuento de colonias y obtenga las unidades formadoras de colonias (UFC).
- Inoculación de la herida
- Inocular 200 μL del cultivo durante la noche en 5 mL de caldo LB e incubar en el agitador a 37 °C durante 2,5 h.
- Mida la densidad óptica del cultivo diurno a 600 nm (OD600). Para la inoculación de PA01, utilice 3 x 10 8 UFC/ml (se inoculan 250 μl de 1 x 108 UFC/ml de PA01 por herida). Transportar el inóculo a la instalación de animales en un contenedor de riesgo biológico.
- Disperse el inóculo por la superficie de las heridas expuestas el día 3 después de la quemadura con una pipeta y extiéndalo uniformemente con un esparcidor desechable (Figura 6). Mantenga las heridas abiertas durante aproximadamente 15 minutos antes de vendarlas.
NOTA: Todos los procedimientos quirúrgicos, la inoculación, las biopsias de tejido, las imágenes y los vendajes se realizan bajo anestesia general como en las secciones 3 y 4.
- Confirmación del establecimiento de la infección
NOTA: Para confirmar que las heridas se han infectado con éxito después de la inoculación, se utilizan varios enfoques y las muestras de la herida se comparan con las muestras recogidas de la piel normal; A continuación se muestran algunos ejemplos.- Para el análisis basado en la patología de las muestras recogidas en diferentes momentos, se utiliza el recuento de unidades formadoras de colonias para estimar una infección (UFC; Figura 7E, F).
- Recolectar 6 mm de tejido de la herida mediante biopsia por punción. Etiquete y pese los tubos vacíos de fondo redondo de 5 ml. Transfiera las muestras a los tubos y pese los tubos con las muestras.
- Corta el pañuelo en dados con un bisturí sobre una superficie estéril. Realice todos los pasos en una campana BSL2.
NOTA: Para asegurarse de que los tejidos se homogeneicen fácilmente, el tamaño debe ser muy pequeño (pero no inferior a 0,5 mm) - Coloque la muestra en el tubo y agregue 1 ml de PBS. Mezcle y muela el tejido con una sonda de molienda de tejido duro.
- Diluir en serie (sin diluir a 1 x 10−5) el homogeneizado, y colocar 50 μL de cada dilución en medios selectivos (agar de aislamiento de Pseudomonas, PIA) y no selectivos (LBA).
- Incubar todas las diluciones en condiciones aeróbicas a 37 °C durante 18-24 h. Visualice las placas con las condiciones de iluminación adecuadas.
- Seleccione placas con 30-300 colonias, si ninguna de las placas ha alcanzado esa concentración, use la placa sin diluir. Utilice ImageJ para contar el número de colonias y calcule la UFC por placa multiplicando el valor promedio por el factor de dilución final.
- Adquiera las imágenes de las muestras recogidas del día 7 después de la inoculación y otros puntos temporales mediante microscopía electrónica de barrido (SEM) para confirmar la presencia de las biopelículas bacterianas (Figura 7G).
NOTA: Se seleccionó el día 7 post-inoculación por ser el día de establecimiento de la infección por biofilm y el inicio del ablandamiento de las escaras quemadas, lo que permite la penetración de las ondas de la US y, por lo tanto, la visualización de los tejidos más profundos. En la Figura 4, consulte la imagen de la herida por quemadura en EE. UU. del día 3, que muestra la escara gruesa y coriácea que impide que las ondas de EE. UU. pasen a través de los tejidos más profundos. - Teñir las secciones de las biopsias de la herida con anticuerpos específicos contra P. aeruginosa para confirmar la presencia de la bacteria específica, como se muestra en una publicación anterior13 (Figura 7H).
- Realizar secuenciación de nueva generación (NGS), tal y como se publica en Sinha et al.31. Cuantificar el 16srRNA de las bacterias de las heridas infectadas y las muestras normales de piel no infectada recogidas en diferentes puntos temporales desde el día 7 después de la inoculación hasta el final del estudio.
- Para el análisis basado en la patología de las muestras recogidas en diferentes momentos, se utiliza el recuento de unidades formadoras de colonias para estimar una infección (UFC; Figura 7E, F).
12. Recolección de biopsia
- Recolectar las biopsias de tejido para su análisis después de la toma de imágenes el día 7, el día 14, el día 28 y el día 56 después de la inoculación. Recoja biopsias de cada herida solo una vez para minimizar la interferencia con el proceso de curación.
NOTA: Todos los procedimientos quirúrgicos, la inoculación, las biopsias de tejido, las imágenes y los vendajes se realizan bajo anestesia general como en las secciones 3 y 4.- Infiltrar el área alrededor de la herida con bupivacaína al 0,5%. Cortar una tira de 3-4 mm de ancho de un borde a otro de la herida, manteniendo pequeños márgenes de piel normal en ambos lados, utilizando un bisturí desechable con una hoja de tamaño 10. Coloque la tira en un tubo cónico etiquetado lleno de formalina tamponada al 4% para su fijación.
NOTA: Para los procedimientos de diagnóstico por imágenes y biopsia en los primeros plazos, se administrará una dosis completa de buprenorfina durante la preparación quirúrgica. Para los procedimientos de biopsia de última hora, se administrará media dosis de buprenorfina durante la preparación quirúrgica. Después de todos los procedimientos de quemaduras y biopsias, se administrará gabapentina dos veces al día durante un máximo de 7 días, según lo aconsejado por el veterinario tratante. El carprofeno se administrará durante días después de la operación o según lo aconseje el veterinario tratante. - Cortar una biopsia con sacabocados de 6 mm de la herida (ya sea del lecho de la herida o del borde de la herida). Recoger del borde de la herida, incluyendo parte de la piel normal y el lecho de la herida, para diferentes tipos de análisis.
- Retire la muestra con pinzas esterilizadas y tijeras de disección. Coloque la muestra de biopsia en el tubo o casete apropiado para su procesamiento y análisis.
- Para UFC, SEM, ARN y FPPE, conserve las muestras en tubos con un tampón adecuado. Por ejemplo, las muestras se pueden colocar en OCT en casetes para microscopía de captura láser (LCM) e inmunohistoquímica (IHC).
- Lograr la hemostasia después de la recolección de las muestras presionando suavemente la herida con una gasa estéril. Cubra la herida con un apósito no adherente y vendaje como en la sección 9.
- Infiltrar el área alrededor de la herida con bupivacaína al 0,5%. Cortar una tira de 3-4 mm de ancho de un borde a otro de la herida, manteniendo pequeños márgenes de piel normal en ambos lados, utilizando un bisturí desechable con una hoja de tamaño 10. Coloque la tira en un tubo cónico etiquetado lleno de formalina tamponada al 4% para su fijación.
13. Eutanasia y recolección de tejidos
- Sedar al cerdo el día de la eutanasia con TKX, y anestesiar con isoflurano. Colocar un catéter intravenoso en la vena marginal del oído siguiendo los pasos descritos en la sección 3. Intubar al cerdo siguiendo los pasos de la sección 4.
- Retire el vendaje una vez que el cerdo esté anestesiado y limpie el área alrededor de las heridas.
- Fotografía digital completa, imágenes LSI, TEWL y HUSD. Recoger las muestras de las heridas y de la piel normal siguiendo los pasos descritos en la sección 12.
- Una vez que se hayan recolectado todas las muestras requeridas, eutanasia humanitaria del cerdo mientras aún está bajo anestesia mediante una inyección intravenosa de solución de eutanasia disponible comercialmente (pentobarbital sódico). Utilice un estetoscopio para auscultar y confirmar el cese de los latidos del corazón y la respiración espontánea.
- Realizar un método secundario de eutanasia, según lo requerido por SOM IACUC, mediante el uso de un bisturí para inducir neumotórax. Transfiera el cadáver del cerdo a un barril y transpórtelo al congelador para recogerlo para su incineración.
Resultados
Se utilizó un dispositivo de quemadura estandarizado para crear heridas por quemaduras de espesor total a 150 °C durante 1 min, lo que resultó en una quemadura profunda homogénea con un margen uniforme de eritema e inflamación (Figura 3 y Figura 7). Cada cerdo recibió ocho quemaduras de espesor completo en la espalda, como se muestra en la Figura 3C.
La evaluación no invasiva en tiempo real de las heridas por quemaduras mediante ecografía de alta resolución en modo B para confirmar la profundidad de la herida y la progresión de la cicatrización de la herida a lo largo del tiempo mostró la destrucción de todas las capas de la piel hasta la grasa subcutánea (Figura 4). Se utilizó la imagen de moteado láser (LSI) para una mayor caracterización de la perfusión de la herida (Figura 4A).
Las heridas por quemaduras mostraron una gruesa membrana piógena en la superficie de la herida al día 7 después de la inoculación, lo que confirmó la infección y el establecimiento de la biopelícula de la herida por quemadura (Figura 7A). La planimetría digital mostró un aumento del área de la herida en el día 3 después de la inoculación con PAO1 debido a la respuesta inflamatoria en el sitio de la herida y los márgenes (Figura 7A,B). Aunque el área de la herida comenzó a reducirse en el día 14 después de la inoculación, se observó una cicatrización incompleta de aproximadamente el 25% del tamaño original de la herida en el día 56, lo que indica la cronicidad de las heridas (Figura 7B). La cronicidad de la herida y el deterioro de la cicatrización de la herida fueron confirmados por el TEWL, que mostró una alta pérdida de agua transepidérmica. Los resultados de TEWL reflejaron la pérdida de la función de barrera de la piel en comparación con la piel normal en todos los puntos de tiempo medidos, lo que indica un deterioro funcional de la cicatrización de la herida de la quemadura (Figura 7B). Esto también se confirmó por la supresión de las proteínas de unión estrecha ZO-1 y 213 y el deterioro de la restauración de la función de barrera cutánea, como se refleja en los altos valores de TEWL observados en el día 35 (medio) y el día 56 (tardío) a pesar del cierre visual de la herida (Figura 7I).
La profundidad de la quemadura se validó aún más mediante tinción de H&E, que mostró distorsión y necrosis de todas las capas histológicas de la piel, como se muestra en la Figura 7C. La biopelícula establecida de PA01 se validó aún más en el día 7 después de la inoculación mediante UFC (Figura 7E, F), imágenes SEM (Figura 7G) y tinción de inmunofluorescencia (Figura 7H).

Figura 1: Configuración del procedimiento . (A) Preparación de la mesa quirúrgica. (B) Canulación de las venas del oído para líquidos intravenosos y administración de fármacos. (C) Manta térmica para proteger al cerdo de la hipotermia durante el procedimiento. (D) Configuración del quemador y del temporizador. Haga clic aquí para ver una versión más grande de esta figura.
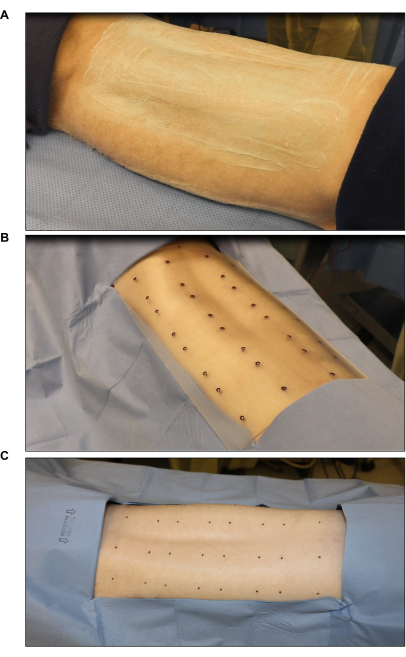
Figura 2: Esterilización y marcaje del sitio quirúrgico . (A) Corte y esterilización del cabello. (B) Marcado del sitio de la quemadura con una plantilla estándar estéril de ocho heridas (cada herida mide 2 pulgadas x 2 pulgadas). (C) Marcado final con un marcador cutáneo estéril. Haga clic aquí para ver una versión más grande de esta figura.
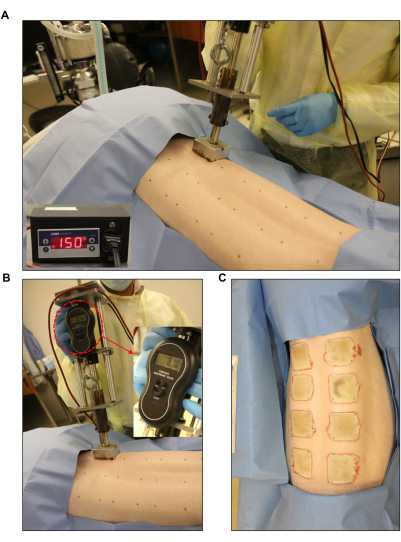
Figura 3: Inducción de la herida por quemadura. (A,B) Quemador estandarizado con un manómetro y una unidad controladora automatizada (2 pulgadas x 2 pulgadas) aplicada al sitio de la herida previamente marcado. (C) Toda la espalda mostrando las ocho heridas de quemaduras de espesor completo. Haga clic aquí para ver una versión más grande de esta figura.
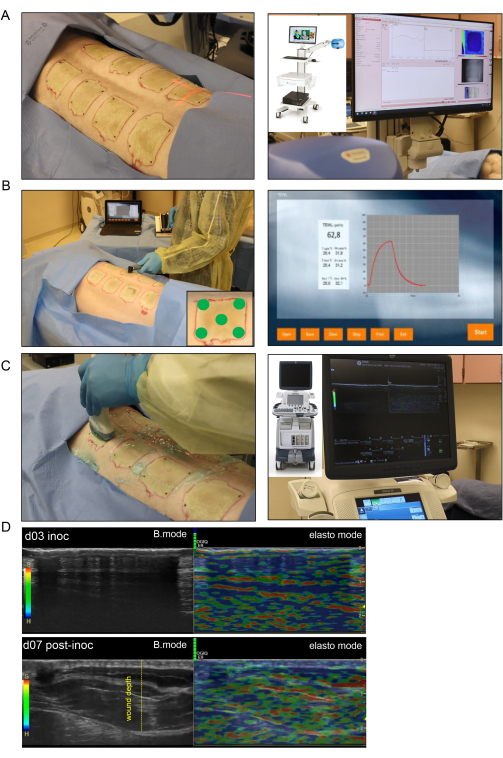
Figura 4: Imágenes y evaluación no invasivas de heridas por quemaduras. (A) En la imagen del lado izquierdo se muestran imágenes de moteado láser (LSI) con la orientación adecuada del indicador del rayo láser hacia el centro de la herida; la imagen del lado derecho muestra el dispositivo LSI y el mapa de perfusión vascular de la piel en tiempo real. (B) La aplicación de la sonda de pérdida de agua transepidérmica (TEWL) en el sitio de la herida en cinco puntos diferentes (cuatro esquinas de la herida y el centro que se muestra en la imagen de la esquina inferior derecha) se muestra en la imagen del lado izquierdo; la imagen del lado derecho es una pantalla representativa capturada en tiempo real de la medición TEWL. (C) La exploración por ultrasonido armónico de la herida quemada utilizando una sonda de ultrasonido de alta resolución de 16 MHz se muestra en el lado izquierdo; La imagen del lado derecho muestra el dispositivo de ultrasonido y la grabación de pantalla en tiempo real. (D) Imágenes estructurales (imágenes en modo B, ultrasonido en escala de grises) y biomecánicas (elastografía, ultrasonido en color) del sitio de la herida de la quemadura en el día de inoculación y el día 7 después de la inoculación. La profundidad de la herida se indica mediante la línea discontinua amarilla. Haga clic aquí para ver una versión más grande de esta figura.
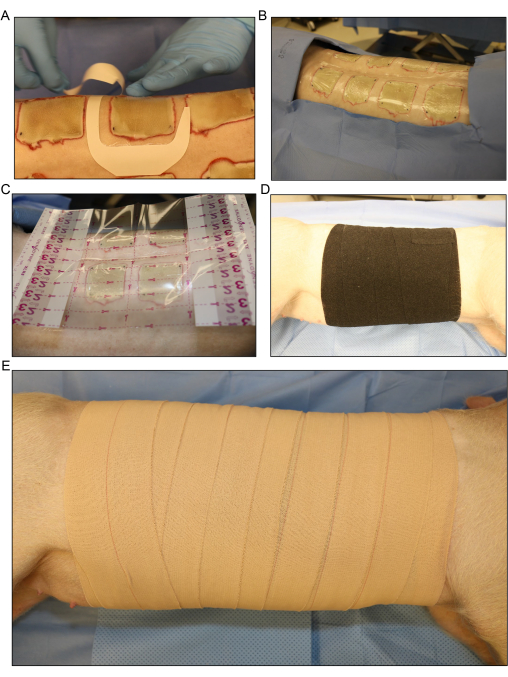
Figura 5: Apósito y vendaje de la herida. (A) Aplicación del apósito de película transparente para cada herida por separado. (B) Todas las heridas por quemaduras inoculadas dorsales se cubren con la primera capa de apósito. (C) Se coloca un apósito de película transparente más grande sobre toda el área de la herida. (D) Aplicación de la segunda capa de gasa y una capa suelta de vendaje elástico elástico alrededor de todo el tronco del cerdo para absorber cualquier exudado de líquido que provenga de las heridas. (E) Cubrir toda el área de la herida con una capa final de 4 en apósito adhesivo. Haga clic aquí para ver una versión más grande de esta figura.
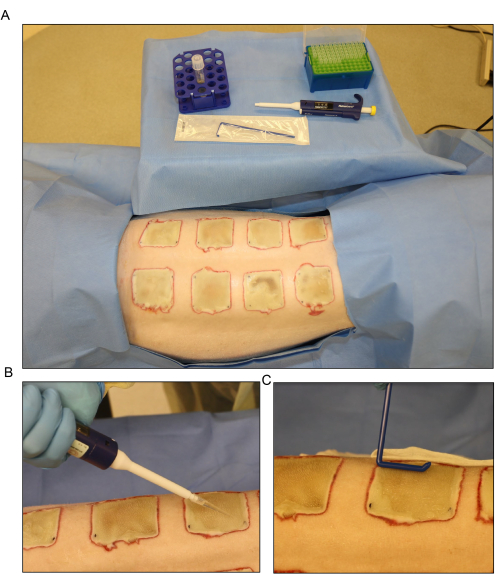
Figura 6: Inoculación bacteriana . (A) Configuración para la inoculación de Pseudomonas aeruginosa (PA01) en el día 3 después de la quemadura. (B) Aplicación tópica del inóculo con una pipeta utilizando un volumen de 500 μL para cada herida. (C) El inóculo se dispersa uniformemente por la superficie de la herida utilizando un esparcidor desechable estéril. Haga clic aquí para ver una versión más grande de esta figura.
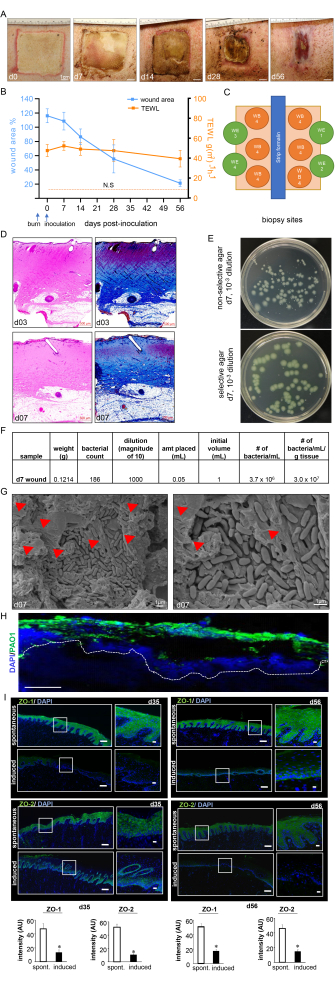
Figura 7: Evolución de la cicatrización de la herida y confirmación del biofilm. (A) Imágenes representativas del cierre de la herida a lo largo de la línea de tiempo del estudio. Barra de escala = 1 cm. (B) Cuantificación del área de la herida y de las mediciones de TEWL a lo largo de la línea de tiempo del estudio (n = 6). Los datos se representan como media ± SD. N.S. se refiere al valor TEWL de la piel normal. (C) Diagrama esquemático que muestra los diferentes sitios de biopsia de la herida. D. Tinción H&E con su correspondiente tinción tricrómica de Masson que muestra distorsión y necrosis de todas las capas de la piel en el día 3 post-quemadura y en el día 7 post-inoculación. Barra de escala = 500 μm. (E) Imágenes digitales representativas de agar no selectivo (agar Luria-Bertani) y agar selectivo (agar de aislamiento de Pseudomonas) con colonias bacterianas cultivadas a partir de tejido del lecho de heridas porcinas. El medio selectivo permite el recuento preciso de las colonias de PA01 solamente. (F) Se muestra un cálculo de la unidad formadora de colonias (UFC) de la muestra a partir de los recuentos de colonias tomados de las biopsias de heridas procesadas después de la inoculación del día 7. (G) Imágenes representativas de microscopía electrónica de barrido (SEM) de las heridas por quemaduras inoculadas en el día 7 después de la inoculación que muestren la biopelícula PA01 establecida, con una imagen ampliada en el lado derecho. Barra de escala = 1 μm. Las puntas de flecha rojas apuntan a sustancias poliméricas extracelulares (EPS). (H) P. aeruginosa en las heridas por quemaduras se visualizaron utilizando anticuerpos anti-Pseudomonas (verde); las imágenes de inmunofluorescencia de las biopsias de heridas posteriores a la inoculación del día 7 muestran una fuerte colonización de los tejidos de la herida por P. aeruginosa. Barra de escala = 100 μm. (I) Mosaico representativo (barra de escala = 200 μm) e imágenes ampliadas correspondientes (barra de escala = 50 μm) de secciones teñidas con ZO-1 y ZO-2 en el día 35 y el día 56 después de la inoculación, que demuestran una expresión reducida de las proteínas después de la infección inducida. Las secciones congeladas incluidas en OCT (10 μm) se tiñeron con anti-ZO-1 (verde) o anti-ZO-2 (verde). Las secciones se contratiñeron con DAPI. Los gráficos de barras presentan la cuantificación de la intensidad de la señal ZO-1 y ZO-2. Los datos se presentan como media ± DE (n = 3); * p < 0,05 en comparación con los espontáneos. Se realizaron pruebas de análisis de varianza unidireccional de Mann-Whitney o Kruskal-Wallis para probar la significación. La Figura 7H,I ha sido modificada a partir de Roy et al.13. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este informe proporciona un protocolo detallado para establecer un modelo porcino de infección crónica por biofilm de heridas para estudios experimentales. Varios modelos de biopelícula porcina han sido reportados previamente 22,23,24,25,26, pero ninguno de ellos es un modelo porcino que involucre estudios a largo plazo de 8 semanas. Las heridas crónicas son aquellas que permanecen abiertas durante 4 semanas o más 14,27,28. No hay otros modelos de biopelícula de heridas crónicas reportados en la literatura. Este trabajo aborda la noción de cierre funcional de heridas 2,7,13,15,17,29. Un estudio realizado en 2014 fue el primero en reportar que las heridas infectadas con biofilm pueden cerrarse sin la restauración de la función de barrera7. En este trabajo se reporta la medición de la función de barrera cutánea en la herida cicatrizante mediante pérdida de agua transepidérmica (TEWL).
Anatómica y fisiológicamente, la piel porcina, en comparación con la piel de otros animales pequeños, es más parecida a la piel humana32,33,34. Tanto la piel del cerdo como la humana tienen una epidermis gruesa 33, y la relación de grosor dérmico-epidérmico oscila entre 10:1 y13:1 en el cerdo, que es comparable a la humana34,35. Desde el punto de vista histológico y biomecánico, la piel de humanos y cerdos muestra similitudes en las crestas de la red, la grasa subdérmica, el colágeno dérmico, la distribución del pelo, las estructuras anexiales y el tamaño y la distribución de los vasos sanguíneos36,37,38. Funcionalmente, tanto los cerdos como los humanos comparten similitudes en la composición de los componentes lipídicos, proteicos y de queratina de la capa epidérmica, así como patrones inmunohistológicos comparables37,38. El sistema inmunitario porcino, en comparación con el de otros animales pequeños, comparte mayores similitudes con el sistema inmunitario humano, lo que significa que los cerdos son un modelo apropiado para los estudios sobre las interacciones del huésped que son parte integral de las complejidades de la biopelícula patológica en las infecciones de heridas39. La evaluación crítica de los pros y los contras que ofrecen diversos modelos animales ha llevado al consenso de que los cerdos representan un modelo eficiente para el estudio de la cicatrización de heridas34,38. Además, los cerdos domésticos desarrollan espontáneamente infecciones bacterianas crónicas, como se observa en los seres humanos10. El dispositivo de quemaduras utilizado para crear las heridas es un dispositivo de quemaduras avanzado y automatizado que suministra energía térmica basada en una lectura de temperatura del sitio de la piel objetivo22,40. Este enfoque mejora el rigor y la reproducibilidad de la lesión por quemadura. El uso de aislados clínicos humanos de bacterias para infectar las heridas de cerdo añade valor como modelo preclínico.
Las lesiones por quemaduras son complejas y causan varias perturbaciones sistémicas20,41. Por lo tanto, es importante reanimar al cerdo con líquidos adecuados y prevenir la hipotermia durante la anestesia y la recuperación. Varios factores pueden interferir con la cicatrización de la herida, incluida la nutrición posterior a la quemadura, los líquidos y el dolor42. Por lo tanto, es importante realizar un seguimiento estrecho de las evaluaciones nutricionales y del dolor. El dolor posterior a la quemadura puede ser intenso e influir en el comportamiento y la dieta del animal. Las intervenciones para abordar los problemas de comportamiento deben considerarse activamente. Es imprescindible una puntuación y un tratamiento regulares y continuos del dolor. En este protocolo se incluye una hoja de evaluación del dolor exhaustiva con un plan de manejo del dolor muy detallado. Para evitar la contaminación cruzada entre las heridas, se debe prestar especial atención a aplicar la primera capa del apósito en cada herida por separado. Se debe tener un cuidado crítico al manipular todos los materiales biopeligrosos y al realizar la desinfección completa del equipo, las herramientas y toda la sala quirúrgica. La aplicación de múltiples capas del apósito evita que el cerdo exponga las heridas durante su esfuerzo por frotar o rascarse la espalda con picazón.
El cerdo en el modelo actual no estaba comprometido por trastornos metabólicos subyacentes (por ejemplo, diabetes) y, por lo tanto, el efecto que se estaba estudiando era puramente el impacto de la infección bacteriana de la biopelícula en la cicatrización de heridas. Sin embargo, el modelo se presta a la inducción de diabetes (usando estreptozotocina, por ejemplo) y podría usarse para estudiar la infección de la biopelícula en relación con un trastorno metabólico subyacente. La otra limitación del modelo es el entorno de infección controlada utilizando P. aeruginosa, una bacteria. Se espera que la microflora normal de la piel del cerdo también pueda estar creciendo en la herida y podría afectar la cicatrización. Es necesario realizar más análisis utilizando NGS u otras técnicas avanzadas para delinear el contenido microbiano de la herida. El modelo actual también podría aplicarse a infecciones mixtas con diferentes especies microbianas (por ejemplo, fúngicas, virales, etc.). Este es un elemento importante, ya que es probable que las heridas clínicamente relevantes estén pobladas por microbios mixtos, lo que puede afectar la cicatrización de las heridas de manera diferente.
Hay muchas ventajas potenciales en este modelo, incluida la similitud con la complejidad y las secuelas a largo plazo de las heridas crónicas humanas, el proceso de quemadura automatizado y reproducible, y el uso de especies bacterianas clínicamente aisladas. El uso de múltiples modalidades de imagen no invasivas representa un enfoque poderoso para recopilar datos fisiológicos útiles que caractericen la herida. Por último, la evaluación de la cicatrización funcional de heridas a través de la restauración de la función de barrera cutánea basada en TEWL es fundamental. En conclusión, en este trabajo se muestra un protocolo robusto, simple, detallado y fácil de usar para desarrollar una lesión por quemadura severa infectada con biopelícula utilizando un sistema modelo porcino.
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Nos gustaría agradecer al Centro de Recursos para Animales de Laboratorio (LARC) de la Universidad de Indiana por su apoyo y el cuidado veterinario de los animales durante el estudio. Este trabajo fue financiado en parte por las subvenciones de los Institutos Nacionales de Salud NR015676, NR013898 y DK125835 y la subvención W81XWH-11-2-0142 del Departamento de Defensa. Además, este trabajo se benefició de los siguientes premios de los Institutos Nacionales de Salud: GM077185, GM069589, DK076566, AI097511 y NS42617.
Materiales
| Name | Company | Catalog Number | Comments |
| Sedation | |||
| Ketamine | Zoetis | 10004027 | 100mg/ml |
| Telazol | Zoetis | 106-111 | 100mg/ml |
| Xylazine | Pivetal | 04606-6750-02 | 100mg/ml Anased |
| 3ml syringe w/ 20g needle | Covidien-Monoject | 8881513033 | |
| Winged infusion set 21g | Jorgensen Labs | J0454B | |
| Anesthetic | |||
| Isoflurane | Pivetal | 21295097 | |
| Surgery | |||
| Hair clippers | Wahl | 8787-450A | |
| Nair | Church and Dwight Co. Inc | 70506572 | |
| Chlorhexidine Solution | First Priority Inc. | 179925722 | |
| 70% Isopropyl Alcohol | Uline | S-17474 | |
| 0.9% Saline Solution | ICU Medical | RL-7282 | |
| Non-woven gauze | Pivetal | 21295051 | |
| Paper tape | McKesson | 455531 | |
| 2" Elastic tape | Pivetal | 21300869 | |
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Spay hook | Jorgensen Labs | J0112A | |
| Sterile lube | McKesson | 16-8942 | |
| Laryngoscope | Jorgensen Labs | J0449S | |
| Roll gauze | Pivetal | 21295032 | |
| Endotracheal tube (7-9mm) | Covidien | 86112 | Shiley Hi-Lo Oral Nasal Tracheal Tube Cuffed |
| 15gtt/ml IV administration set | ICU Medical | 12672-28 | |
| LRS 1000ml bag | ICU Medical | 07953-09 | |
| Three Quarter Drape Sheet | McKesson | 16-i80-12110G | |
| Analgesia | |||
| Buprenorphine | RX Generics | 42023-0179-05 | 0.3mg/ml |
| Fentanyl Transdermal | |||
| Carprofen | 21294548 | Pivetal | 50mg/ml Levafen |
| Bandaging | |||
| Transparent film dressing 26x30 | Genadyne Biotechnologies | A4-S00F5 | |
| Film dressing 4 x 4-3/4 Frame Style | McKesson | 886408 | |
| Vetrap | 3M | 1410BK BULK | |
| Elastic tape 4" | Pivetal | 21300931 | |
| Kerlix Roll Gauze | Cardinal Health | 3324 | |
| Imaging | |||
| Canon EOS 80D | Canon | 1263C004 | |
| Speedlight 600EX II-RT | Canon | 1177C002 | |
| EFS 17-55mm Ultrasonic | Canon | 1242B002 | |
| GE Logiq E9 | GE | 5197104-2 | |
| ML6-15 Probe | GE | 5199103 | |
| PeriCamPSI | Perimed | 90-00070 | |
| DermaLab | Cortex Technologies Inc | 4608D78 | |
| Biopsy/Tissue Collection | |||
| 6mm punch biopsy | Integra Lifesciences | 33-36 | |
| bupivicaine 0.5% | Auromedics Pharma | 55150017030 | |
| Size 10 Disposable Scalpel | McKesson | 16-63810 | |
| Dissection scissors | Pivetal | 21294806 | |
| Rat tooth thumb tissue forceps | Aesculap | BD512R | |
| Non-adherent Dressing | Covidien | 2132 | Telfa |
| 50ml Conical tube | Falcon | 352070 | |
| Eppendorf/microcentrifuge tube | Fisherbrand | 02-681-320 | |
| OCT Cassette | |||
| Non Woven Gauze 4x4 | Pivetal | 21295051 | |
| Inoculum | |||
| Low salt LB agar | Invitrogen | 22700-025 | |
| Low salt LB broth | Fisher scientific | BP1427-500 | |
| Petri plate | Falcon | REF-351029 | |
| Polyprophyline round bottom tubes (14 ml) | Falcon | REF-352059 | |
| Pseudomonas Agar Base (Dehydrated) | Thermo Scientific | OXCM0559B | |
| LB Agar, powder (Lennox L agar) | Thermo Fisher Scientific (Life Technologies) | 22700025 | |
| Gibco™ DPBS, calcium, magnesium | Gibco | 14040133 | |
| Euthanasia | |||
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Fatal Plus | Vortech Pharmaceuticals | 9373 |
Referencias
- Goodwine, J., et al. Pyruvate-depleting conditions induce biofilm dispersion and enhance the efficacy of antibiotics in killing biofilms in vitro and in vivo. Scientific Reports. 9 (1), 3763 (2019).
- Sen, C. K., Roy, S., Mathew-Steiner, S. S., Gordillo, G. M. Biofilm management in wound care. Plastic and Reconstructive Surgery. 148 (2), 275-288 (2021).
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clinical Microbiology Reviews. 19 (2), 403-434 (2006).
- Nguyen, T. T., Gilpin, D. A., Meyer, N. A., Herndon, D. N. Current treatment of severely burned patients. Annals of Surgery. 223 (1), 14-25 (1996).
- Eriksson, E., et al. Chronic wounds: Treatment consensus. Wound Repair and Regeneration. 30 (2), 156-171 (2022).
- Lebeaux, D., Chauhan, A., Rendueles, O., Beloin, C. From in vitro to in vivo models of bacterial biofilm-related infections. Pathogens. 2 (2), 288-356 (2013).
- Ganesh, K., et al. Chronic wound biofilm model. Advances in Wound Care. 4 (7), 382-388 (2015).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Stewart, P. S. Biophysics of biofilm infection. Pathogens and Disease. 70 (3), 212-218 (2014).
- Jensen, L. K., Johansen, A. S. B., Jensen, H. E. Porcine models of biofilm infections with focus on pathomorphology. Frontiers in Microbiology. 8, 1961 (2017).
- Mah, T. F., O'Toole, G. A. Mechanisms of biofilm resistance to antimicrobial agents. Trends in Microbiology. 9 (1), 34-39 (2001).
- Gonzalez, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023 (2018).
- Roy, S., et al. Mixed-species biofilm compromises wound healing by disrupting epidermal barrier function. Journal of Pathology. 233 (4), 331-343 (2014).
- Sen, C. K. Human wound and its burden: Updated 2020. Compendium of Estimates. Advances in Wound Care. 10 (5), 281-292 (2021).
- Barki, K. G., et al. Electric field based dressing disrupts mixed-species bacterial biofilm infection and restores functional wound healing. Annals of Surgery. 269 (4), 756-766 (2019).
- Dusane, D. H., et al. Electroceutical treatment of Pseudomonas aeruginosa biofilms. Scientific Reports. 9 (1), 2008 (2019).
- Roy, S., et al. Staphylococcus aureus biofilm infection compromises wound healing by causing deficiencies in granulation tissue collagen. Annals of Surgery. 271 (6), 1174-1185 (2020).
- Ghanbari, A., et al. Inoculation density and nutrient level determine the formation of mushroom-shaped structures in Pseudomonas aeruginosa biofilms. Scientific Reports. 6, 32097 (2016).
- Yin, R., Cheng, J., Wang, J., Li, P., Lin, J. Treatment of Pseudomonas aeruginosa infectious biofilms: Challenges and strategies. Frontiers in Microbiology. 13, 955286 (2022).
- Norbury, W., Herndon, D. N., Tanksley, J., Jeschke, M. G., Finnerty, C. Infection in burns. Surgical Infections. 17 (2), 250-255 (2016).
- Nitz, F., et al. Molecular detection of drug-resistance genes of bla(OXA-23)-bla(OXA-51) and mcr-1 in clinical isolates of Pseudomonas aeruginosa. Microorganisms. 9 (4), 786 (2021).
- Davis, S. C., et al. Microscopic and physiologic evidence for biofilm-associated wound colonization in vivo. Wound Repair and Regeneration. 16 (1), 23-29 (2008).
- Breuing, K., Kaplan, S., Liu, P., Onderdonk, A. B., Eriksson, E. Wound fluid bacterial levels exceed tissue bacterial counts in controlled porcine partial-thickness burn infections. Plastic and Reconstructive Surgery. 111 (2), 781-788 (2003).
- Nusbaum, A. G., et al. Effective method to remove wound bacteria: Comparison of various debridement modalities in an in vivo porcine model. Journal of Surgical Research. 176 (2), 701-707 (2012).
- Hirsch, T., et al. Enhanced susceptibility to infections in a diabetic wound healing model. BMC Surgery. 8, 5 (2008).
- Roche, E. D., et al. Increasing the presence of biofilm and healing delay in a porcine model of MRSA-infected wounds. Wound Repair and Regeneration. 20 (4), 537-543 (2012).
- Hartoch, R. S., McManus, J. G., Knapp, S., Buettner, M. F. Emergency management of chronic wounds. Emergency Medical Clinics of North America. 25 (1), 203-221 (2007).
- Mustoe, T. Understanding chronic wounds: a unifying hypothesis on their pathogenesis and implications for therapy. American Journal of Surgery. 187 (5), 65-70 (2004).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Sinha, M., et al. Pseudomonas aeruginosa theft biofilm require host lipids of cutaneous wound. Annals of Surgery. 277 (3), e634-e647 (2023).
- Fan, G. Y., et al. Severe burn injury in a swine model for clinical dressing assessment. Journal of Visualized Experiments. (141), e57942 (2018).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Meyer, W., Schwarz, R., Neurand, K. The skin of domestic mammals as a model for the human skin, with special reference to the domestic pig. Current Problems in Dermatology. 7, 39-52 (1978).
- Vardaxis, N. J., Brans, T. A., Boon, M. E., Kreis, R. W., Marres, L. M. Confocal laser scanning microscopy of porcine skin: implications for human wound healing studies. Journal of Anatomy. 190, 601-611 (1997).
- Heinrich, W., Lange, P. M., Stirtz, T., Iancu, C., Heidemann, E. Isolation and characterization of the large cyanogen bromide peptides from the alpha1- and alpha2-chains of pig skin collagen. FEBS Letters. 16 (1), 63-67 (1971).
- Marcarian, H. Q., Calhoun, M. L. Microscopic anatomy of the integument of adult swine. American Journal of Veterinary Research. 27 (118), 765-772 (1966).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Dawson, H. D., et al. Structural and functional annotation of the porcine immunome. BMC Genomics. 14, 332 (2013).
- Kim, J. Y., Dunham, D. M., Supp, D. M., Sen, C. K., Powell, H. M. Novel burn device for rapid, reproducible burn wound generation. Burns. 42 (2), 384-391 (2016).
- Nielson, C. B., Duethman, N. C., Howard, J. M., Moncure, M., Wood, J. G. Burns: Pathophysiology of systemic complications and current management. Journal of Burn Care and Research. 38 (1), e469-e481 (2017).
- Rowan, M. P., et al. Burn wound healing and treatment: Review and advancements. Critical Care. 19 (1), 243 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados