Method Article
Modello suino di infezione da biofilm e ferite invisibili
In questo articolo
Riepilogo
Le ferite croniche resistenti agli antibiotici rappresentano una grave minaccia per il sistema sanitario. Le infezioni da biofilm sono ostinate e ostili e possono causare una chiusura funzionale carente della ferita. Riportiamo un modello suino clinicamente rilevante di ferite croniche a tutto spessore infette da biofilm. Questo modello è potente sia per gli studi meccanicistici che per testare gli interventi.
Abstract
L'infezione da biofilm è uno dei principali fattori che contribuiscono alla cronicità della ferita. L'instaurazione di un'infezione sperimentale del biofilm della ferita clinicamente rilevante richiede il coinvolgimento del sistema immunitario dell'ospite. I cambiamenti iterativi nell'ospite e nell'agente patogeno durante la formazione di tale biofilm clinicamente rilevante possono verificarsi solo in vivo. Il modello di ferita suina è riconosciuto per i suoi vantaggi come potente modello preclinico. Ci sono diversi approcci segnalati per lo studio dei biofilm delle ferite. I sistemi in vitro ed ex vivo sono carenti in termini di risposta immunitaria dell'ospite. Gli studi in vivo a breve termine comportano risposte acute e, quindi, non consentono la maturazione del biofilm, come è noto che avviene clinicamente. Il primo studio a lungo termine sul biofilm delle ferite suine è stato pubblicato nel 2014. Lo studio ha riconosciuto che le ferite infette da biofilm possono chiudersi come determinato dalla planimetria, ma la funzione di barriera cutanea del sito interessato potrebbe non essere ripristinata. Successivamente, questa osservazione è stata convalidata clinicamente. Nasce così il concetto di chiusura funzionale della ferita. Le ferite chiuse ma carenti nella funzione di barriera cutanea possono essere viste come ferite invisibili. In questo lavoro, cerchiamo di riportare i dettagli metodologici necessari per riprodurre il modello suino a lungo termine di grave ustione da biofilm, che è clinicamente rilevante e ha un valore traslazionale. Questo protocollo fornisce una guida dettagliata per stabilire un'infezione da biofilm della ferita di 8 settimane utilizzando P. aeruginosa (PA01). Otto ferite da ustione a tutto spessore sono state create simmetricamente sul dorso di suini bianchi domestici, a cui è stato inoculato (PA01) al giorno 3 dopo l'ustione; successivamente, sono state condotte valutazioni non invasive della guarigione della ferita in diversi momenti utilizzando l'imaging laser speckle (LSI), gli ultrasuoni ad alta risoluzione (HUSD) e la perdita di acqua transepidermica (TEWL). Le ferite da ustione inoculate sono state coperte con una medicazione a quattro strati. I biofilm, come stabilito e confermato strutturalmente dal SEM al giorno 7 dopo l'inoculazione, hanno compromesso la chiusura funzionale della ferita. Tale esito avverso è soggetto a inversione in risposta a interventi appropriati.
Introduzione
L'infezione da biofilm complica le ustioni e le ferite croniche e causa cronicità 1,2,3,4,5. In microbiologia, vengono studiati principalmente i meccanismi del biofilm, con particolare attenzione ai microbi 1,6. Le lezioni apprese da questi studi sono di fondamentale importanza dal punto di vista delle scienze biologiche, ma potrebbero non essere necessariamente applicabili a biofilm patogeni clinicamente rilevanti 6,7,8. Gli aggregati strutturali del biofilm clinicamente rilevanti dovrebbero includere i fattori microbici e dell'ospite 8,9,10. Tale microambiente consente l'inclusione di interazioni iterative ospite-microbo, che sono fondamentali per lo sviluppo di un biofilm clinicamente rilevante 7,8. In tale processo, la partecipazione delle cellule immunitarie e dei fattori trasmissibili per via ematica è fondamentale11,12. Le interazioni ospite-microbo alla base dei biofilm patogeni clinici, come si vede nelle ferite croniche, si verificano per un lungo periodo di tempo. Pertanto, qualsiasi approccio sperimentale volto a sviluppare un modello traslazionale rilevante di infezione da biofilm deve tenere conto di questi fattori. Quindi, abbiamo cercato di sviluppare un modello di infezione cronica da biofilm suino clinicamente riproducibile.
Sebbene gli studi sull'uomo rappresentino chiaramente l'approccio migliore per studiare i risultati della guarigione, spesso non sono i più adatti ad affrontare i meccanismi sottostanti e i nuovi paradigmi meccanicistici. Le preoccupazioni etiche limitano l'uso di disegni di studio che richiedono la raccolta di più biopsie da una ferita cronica in diversi momenti. È quindi fondamentale disporre di un modello animale ben consolidato e riproducibile per consentire studi invasivi per l'esame approfondito del destino del biofilm 7,13. La scelta di un modello animale dipende da diversi fattori, tra cui la rilevanza scientifica/traslazionale e la logistica. Il sistema suino è ampiamente riconosciuto come il modello sperimentale più prezioso dal punto di vista traslazionale per lo studio delle ferite cutanee umane7. Pertanto, questo lavoro riporta un modello suino consolidato di lesione da ustione a tutto spessore infettata da biofilm. Questo lavoro si basa su diverse pubblicazioni originali riportate in letteratura 2,7,13,14,15,16,17. In questo studio, è stato scelto un isolato clinico di Pseudomonas aeruginosa multiresistente (PA01) per infettare la ferita. P. aeruginosa è una causa comune di infezioni della ferita 2,18,19,20. È un batterio Gram-negativo che può essere difficile da trattare a causa della sua resistenza ad alcuni antibiotici11,19,21. Nessuno dei modelli di biofilm suino riportati finora ha coinvolto studi a lungo termine di 8 settimane 22,23,24,25,26. Le ferite croniche sono quelle che rimangono aperte per 4 settimane o più 14,27,28. Non ci sono altri modelli di biofilm cronico della ferita riportati in letteratura. Questo lavoro affronta la nozione di chiusura funzionale della ferita 2,7,13,15,17,29.
Protocollo
Tutti gli studi sugli animali sono stati condotti in conformità con i protocolli approvati dall'Institutional Animal Care and Use Committee (IACUC) #21147. Lo studio è stato condotto presso il Laboratory Animal Resource Center (LARC) dell'Università dell'Indiana. In questo protocollo abbiamo utilizzato una femmina di maiale bianco domestico (70-80 libbre).
1. Acclimatazione degli animali
- All'arrivo dei suini in struttura, alloggiare gli animali singolarmente all'interno della stessa stanza per almeno 3 giorni per l'acclimatazione e l'interazione sociale.
- Nutri i maiali con una dieta ben bilanciata. Decidi la quantità somministrata in base al peso e segui le raccomandazioni del produttore.
- Assicurarsi che l'animale sia a digiuno per 6-12 ore prima della procedura per prevenire nausea, vomito e l'aspirazione di liquidi gastrici durante l'anestesia.
2. Allestimento della sala operatoria
- Preparare la macchina per anestesia e assicurarsi che sia pronta con il circuito di respirazione.
- Organizzare la stanza per l'intervento chirurgico, come descritto di seguito (Figura 1A).
- Coprire il tavolo operatorio con un telo sterile e posizionare una coperta d'acqua circolante sotto per favorire la termoregolazione.
- Allestisci un tavolo con forniture per l'induzione e materiali per la preparazione all'intervento chirurgico. Allestire un tavolo con i dispositivi del bruciatore e le scatole di controllo. Configurare l'apparecchiatura di imaging e assicurarsi che sia accesa.
3. Sedazione del maiale
- Sedare il suino con un'iniezione intramuscolare di TKX (Telazolo 4,4 mg/kg; ketamina 2,2 mg/kg; xilazina 2,2 mg/kg) alla dose di 1 ml/50 lb. Mantenere il suino in sala operatoria con isoflurano all'1%-3% erogato tramite una maschera.
- Somministrare gli analgesici (pre-operatori) ai suini secondo il protocollo IACUC; alcuni esempi sono i seguenti: buprenorfina 0,3 mg/mL, 0,01-0,05 mg/kg IM; carprofene 50 mg/mL, 4 mg/kg IM o SQ; fentanil transdermico 100 mcg/h posizionato sul padiglione auricolare; gabapentin 300 mg capsule, 3-10 mg/kg PO.
NOTA: Per tutte le procedure di ustione e biopsia, 1 dose di gabapentin verrà somministrata il giorno prima dell'intervento chirurgico e 1 dose di carprofene verrà somministrata il giorno della procedura. Per la procedura di bruciatura principale, verrà posizionato un cerotto di fentanyl e verrà somministrata 1 dose completa di buprenorfina durante la preparazione chirurgica.
4. Induzione dell'anestesia
- Sterilizzare l'orecchio con uno scrub alternato al 2% di clorexidina e alcol almeno tre volte. Inserire A 22-18 G 1 nel catetere endovenoso nella vena dell'orecchio marginale e confermare il flusso sanguigno. Sciacquare il catetere con soluzione fisiologica e fissare il catetere con nastro chirurgico (Figura 1B).
- Intubare il suino con un tubo endotracheale di dimensioni adeguate (7-9 mm) una volta ottenuto il rilassamento muscolare mediante l'inalazione di anestesia tramite la maschera. Controllare il rilassamento muscolare osservando una perdita di tono della mandibola e un riflesso palpebrale.
- Aprire il tubo e testare la perdita del bracciale utilizzando una siringa d'aria. Inserire il tubo con l'aiuto di un laringoscopio30.
- Gonfiare il bracciale e fissare il tubo una volta confermato il corretto posizionamento. Collegare il maiale al circuito di respirazione.
NOTA: Il tubo è legato in posizione sopra il muso e per fissarlo viene utilizzata una garza a rullo. L'auscultazione del torace viene eseguita con uno stetoscopio per confermare il corretto posizionamento del tubo.
NOTA: Durante l'anestesia, l'aria viene fornita ogni 5-10 minuti chiudendo la valvola pop-off e premendo la sacca di respirazione fino a quando il manometro di pressione raggiunge i 20 mm/Hg per prevenire l'atelettasia posizionale.
- Monitorare l'animale e la profondità dell'anestesia.
- Collegare il pig a un monitor multiparametrico. Il monitor leggerà continuamente la saturazione di ossigeno (SpO 2), la frequenza del polso, l'anidride carbonica di fine marea (EtCO2 ), la frequenza respiratoria e la temperatura. Registrare i parametri vitali ogni 10 minuti durante la procedura.
- Valutare la profondità dell'anestesia testando i riflessi del dolore con un pizzico del dito della zampa posteriore prima di iniziare la ferita.
NOTA: Se necessario, regolare il vaporizzatore anestetico per somministrare ulteriore anestesia o attendere alcuni minuti. Controllare regolarmente i riflessi del dolore e i riflessi palpebrali durante l'intervento.
5. Preparazione dell'animale per le ustioni
- Scollegare il maiale dalla macchina per anestesia e spostarlo sul tavolo operatorio. Posizionare il maiale in posizione di decubito sternale e assicurarsi di fissare tutte le linee e i tubi collegati (Figura 1C).
- Ricollegare il maiale alla macchina per anestesia e mantenere l'O2 a 0,8-1,5 L/min e l'isoflurano all'1%-3% fino alla fine della procedura.
- Somministrare liquidi per via endovenosa (LRS) al suino a una velocità di gocciolamento di 8-10 ml/kg/h. Monitorare l'anestesia come al punto 4.3.
6. Preparazione antisettica e marcatura del sito dell'ustione cutanea
- Preparare l'area della ferita rasandosi e applicando la crema depilatoria, come descritto di seguito (Figura 2).
- Radere il dorso del maiale in un'area di circa 25 cm di larghezza dalla colonna vertebrale fino all'ascella su entrambi i lati utilizzando un tagliacapelli elettrico.
- Applicare la crema depilatoria sull'area tagliata e lasciare agire per 3-7 minuti. Rimuovere la crema insieme ai capelli utilizzando asciugamani assorbenti puliti.
- Preparazione del sito dell'ustione
- Strofinare l'area da ferire con uno scrub alternato al 2% di clorexidina e alcol isopropilico al 70% almeno tre volte per circa 5 minuti. Assicurarsi che lo scrub venga applicato a occhio di bue (partendo dal centro e spostandosi verso l'esterno a spirale) dal personale che indossa guanti sterili.
- Contrassegnare i siti della ferita utilizzando una sagoma sterile per ustioni e un marcatore cutaneo chirurgico (Figura 2B). Segna da sei a otto ferite (2 pollici x 2 pollici) simmetricamente sul dorso.
- Coprire le aree intorno ai siti contrassegnati con un telo sterile per ridurre la contaminazione (Figura 2C).
7. Procedura di ferita da ustione
- Utilizzare un dispositivo di combustione, come un bruciatore personalizzato fabbricato internamente costituito da un blocco di acciaio inossidabile da 2 pollici x 2 pollici (peso: 352 g) collegato a uno stilo metallico, un microstato elettronico e una bilancia elettronica (peso totale: 1,714 g; Figura 3).
- Impostare il bruciatore alla temperatura desiderata. Regolare la temperatura target per le ferite a tutto spessore a 150 °C (Figura 3A). A tale scopo, impostare il set point (SP) sull'unità di controllo a 150 °C. Impostare il setpoint basso a 145 °C e il setpoint alto a 155 °C (Figura 1D).
- Creare una ferita da ustione a tutto spessore di 2 pollici x 2 pollici utilizzando blocchi di acciaio inossidabile riscaldati collegati al dispositivo di ustione e posizionandoli sulla pelle per 60 s (Figura 3B, C). Durante l'applicazione della bruciatura, utilizzare la bilancia elettronica per garantire che il bruciatore applichi una pressione uniforme.
8. Valutazione e imaging della ferita da ustione
- Fotografia digitale
- Riprendi le ferite utilizzando una fotocamera DSLR e un obiettivo grandangolare a ultrasuoni EFS (Short-Back Focus) con messa a fuoco elettrostatica (EFS) e una torcia.
- Scatta una foto digitale dell'intero maiale, incluso un cartello con l'identificazione del maiale, il punto temporale e la data. Quindi, scatta immagini per ogni ferita separatamente che mostrino un cartello con l'ID del maiale, l'ID della ferita e il punto temporale e un righello.
- Calcola l'area della ferita come percentuale della dimensione originale della ferita in ogni momento di raccolta fino al giorno 56.
NOTA: In questo lavoro, l'area della ferita è stata calcolata in ogni punto temporale (d0, d7, d14, d28 e d56) come percentuale dell'area della ferita originale su d0.
- Imaging a speckle laser (LSI)
- Per l'imaging a speckle laser, utilizzare un imager per perfusione sanguigna basato sulla tecnologia LASCA (Laser Speckle Contrast Analysis) per valutare la perfusione microvascolare della ferita in tempo reale.
- Scatta le immagini di tutte le ferite in un'unica registrazione. Regolare il valore misurato della distanza di lavoro dalla telecamera laser alla ferita in modo che sia coerente per l'imaging di ciascuna ferita (Figura 4A).
- Registrare la perfusione con una serie di immagini scattate in un arco di 10-15 s. Dopo aver ripreso l'immagine di una ferita, la registrazione viene automaticamente messa in pausa e la registrazione viene ripresa una volta che la fotocamera è stata regolata per la ferita successiva. Ogni volta che la registrazione si interrompe, viene aggiunto un marcatore per identificare la ferita.
- Perdita d'acqua transepidermica (TEWL)
- Misurare il TEWL per ogni ferita utilizzando un'unità standard, una sonda TEWL e un software (Figura 4B). Per ogni ferita, posizionare un coperchio pulito sulla punta della sonda, che sarà a contatto con il tessuto della ferita.
- Posizionare la sonda delicatamente e uniformemente sulla pelle e avviare la lettura premendo il pulsante Start sull'unità.
- Misura ogni ferita cinque volte, prima al centro e poi su ogni angolo. Quindi, esporta tutte le letture in un foglio di calcolo (Figura 4B).
- Ecografia armonica (HUSD)
- Eseguire la mappatura HUSD scansionando la ferita con una sonda ecografica (US) dalla linea mediana (colonna vertebrale) partendo dalla pelle normale verso il lato laterale del maiale dove c'è di nuovo pelle normale. Seguire questo schema di scansione per ogni ferita sia in modalità B che in modalità elastografia tissutale utilizzando l'ecografo (Figura 4C).
- Per la scansione in modalità B, applicare un gel sterile per ultrasuoni sull'area della ferita e applicarne un po' sulla sonda ad alta risoluzione ML-615. Annotare ogni registrazione con l'etichetta di identificazione della ferita. Avviare la registrazione e spostare lentamente la sonda dalla linea mediana verso il basso lungo la ferita fino a raggiungere la pelle normale sull'altro lato.
NOTA: Al termine della scansione, la registrazione viene salvata ed esportata dalla macchina per l'analisi. - Per l'elastografia, impostare l'ecografo in modalità elasto premendo il pulsante Elasto . Eseguire nuovamente la scansione della ferita nello stesso modo della scansione in modalità B, assicurandosi che venga mantenuta una pressione uniforme della sonda per consentire all'indicatore del colore dell'elastografia (barre verdi) di rimanere visibile durante la registrazione.
NOTA: La pressione appropriata può essere determinata dalla barra della scala sulla registrazione, che appare verde quando viene effettuato il contatto corretto (Figura 4D). - Modificare l'annotazione dopo che ogni ferita è stata ripresa sia in modalità B che in modalità elasto (due registrazioni per ferita). Modificare il commento nel software per includere le informazioni per la ferita successiva e ripetere il processo per le ferite successive.
- Per la scansione in modalità B, applicare un gel sterile per ultrasuoni sull'area della ferita e applicarne un po' sulla sonda ad alta risoluzione ML-615. Annotare ogni registrazione con l'etichetta di identificazione della ferita. Avviare la registrazione e spostare lentamente la sonda dalla linea mediana verso il basso lungo la ferita fino a raggiungere la pelle normale sull'altro lato.
- Eseguire la mappatura HUSD scansionando la ferita con una sonda ecografica (US) dalla linea mediana (colonna vertebrale) partendo dalla pelle normale verso il lato laterale del maiale dove c'è di nuovo pelle normale. Seguire questo schema di scansione per ogni ferita sia in modalità B che in modalità elastografia tissutale utilizzando l'ecografo (Figura 4C).
9. Bendaggio e medicazione
- Coprire le ferite da ustione singolarmente con medicazioni di pellicola trasparente o con la medicazione di prova (Figura 5A, B). Applicare una medicazione con pellicola trasparente più grande su tutta l'area della ferita (Figura 5C).
- Applicare un secondo strato di garza a rotolo intorno all'intero tronco del maiale per assorbire l'essudato fluido che fuoriesce dalle ferite. Arrotola il maiale avanti e indietro da un lato all'altro leggermente sulla schiena per avvolgere il materiale della benda attorno al maiale.
- Coprire la garza con uno strato di benda elastica flessibile (Figura 5D). Assicurati che la benda non sia troppo stretta, poiché applicarla troppo stretta può limitare la respirazione e esercitare pressione sull'addome, il che può provocare prolasso rettale o altre complicazioni.
NOTA: La benda elastica è elastica e può essere facilmente serrata eccessivamente durante l'applicazione. Estrarlo dal rotolo e lasciarlo appoggiare sul bordo dell'involucro precedente può aiutare a evitare un serraggio eccessivo. - Coprite la benda elastica con uno strato finale di 4 strati di nastro elastico (Figura 4E). Anche in questo caso, assicurati che l'applicazione non sia troppo stretta, ma assicurati che la medicazione sia fissata sul bordo superiore e inferiore per evitare che scivoli verso il basso mentre il maiale si muove dopo la procedura.
10. Recupero degli animali e cure postoperatorie
- Guarigione
- Interrompere il gas anestetico al termine della ferita, della procedura di imaging e del bendaggio. Lasciare che il maiale rimanga sotto ossigeno per almeno 5 minuti.
- Spostare il maiale, dopo essere tornato nel recinto primario, dal tavolo di trasporto/sollevamento a un tappetino di recupero in schiuma nella gabbia. Sollevare l'abbeveratoio automatico e rimuovere l'alimentatore j per evitare lesioni al maiale durante il recupero.
- Coprire il maiale con coperte (compresa una coperta ad aria calda) se è presente ipotermia. Monitora e registra i parametri vitali tra cui temperatura, polso, frequenza respiratoria e SpO2 ogni 10-15 minuti.
- Monitorare continuamente il suino fino a quando non è in grado di mantenere la decubito sternale in modo indipendente. Una volta che il maiale si è completamente ripreso, abbassa l'abbeveratoio per capezzoli, quindi anche il maiale può essere nutrito.
- Valutazione del dolore
- Eseguire una valutazione del dolore post-operatorio utilizzando un modulo di valutazione del dolore di Glasgow modificato. Assicurarsi che le valutazioni del dolore siano completate dal personale di laboratorio o LARC almeno ogni 12 ore per i primi 3-4 giorni dopo l'intervento. La frequenza del punteggio del dolore è determinata dal veterinario curante. Se l'animale ottiene un punteggio superiore a 5, somministrare analgesia di salvataggio (buprenorfina o idromorfone).
- Somministrare analgesia somministrando una dose di buprenorfina 0,01-0,05 mg/kg IM prima della procedura, con una seconda dose somministrata 8-12 ore dopo.
- Posizionare un cerotto di fentanyl (100 mcg/h) sul padiglione auricolare prima della ferita da ustione.
- Iniettare carprofene 4 mg/kg IM o SQ prima della procedura, quindi una volta al giorno IM, SQ o PO per 2 giorni o come indicato dal veterinario LARC.
- Somministrare gabapentin 3-10 mg/kg per via orale, somministrando una dose il giorno prima della procedura, la mattina della procedura, la sera successiva alla procedura e poi ogni 12 ore per 3-5 giorni.
- Dieta
- Assicurarsi che i maiali siano recuperati, quindi consentire il libero accesso all'acqua e al cibo in base alla loro razione basata sul peso due volte al giorno.
- Fornire un arricchimento alimentare (frutta e verdura fresca, frutta surgelata, marshmallow, yogurt, budino, ecc.) e usarli per invogliare a mangiare se si osserva una diminuzione dell'appetito.
- Cambio di medicazione
- Cambiare le bende almeno una volta alla settimana o più spesso se le bende si sporcano o per adattarsi alle strategie di trattamento.
- Cambiare le bende dopo l'imaging mentre si è ancora sotto anestesia o sedare il maiale con solo TKX per un cambio di medicazione.
- Per sostituire la benda, inizia rimuovendo con cura la benda sporca usando le forbici per bendaggi Lister o le cesoie per traumi, facendo attenzione a non permettere che l'esterno della medicazione entri in contatto con le ferite.
- Pulisci l'area intorno alle ferite, se necessario, usando NaCl allo 0,9% su una garza pulita e asciuga delicatamente l'area. Seguire i passaggi della procedura per il bendaggio descritti nella sezione 9.
NOTA: Se vengono applicate medicazioni sperimentali, queste possono essere applicate prima di coprire le ferite con la medicazione a pellicola trasparente.
- Frequenza di imaging
- Ottenere immagini (foto digitali, LSI, TEWL e HUSD) in vari punti temporali durante lo studio. Raccogliere i dati di imaging il giorno -3 (ustione), il giorno 0 (inoculazione) e il giorno 7, il giorno 14, il giorno 28, il giorno 35 e il giorno 56 dopo l'inoculazione.
11. Preparazione e inoculazione del biofilm
- Preparazione dell'inoculo
- Preparare un piatto iniziale da una scorta di glicerolo congelato di Pseudomonas aeruginosa (PA01) per una coltura pura del batterio. Coltiva una coltura di P. aeruginosa in agar Luria−Bertani (LBA) a basso contenuto di sale e incuba a 37 °C per una notte.
- Inoculare 5 mL di brodo Luria−Bertani a basso contenuto di sale (LBB) con una singola colonia di P. aeruginosa il giorno successivo e incubare per una notte a 37 °C agitando a 200 giri/min.
- Per ottenere cellule in fase log, inoculare 200 μL di coltura notturna in 5 mL di LBB e incubare nell'agitatore a 200 rpm a 37 °C per 2,5 ore.
- Misurare la densità ottica a 600 nm (OD600) utilizzando uno spettrofotometro. Preparare diluizioni seriali fino a 1 x 10−9 utilizzando 100 μL dalla coltura in 900 μL di LBB sterile.
NOTA: Abbiamo iniziato con campioni non diluiti e abbiamo terminato con 1 x 107 CFU/mL. Abbiamo ottenuto colonie numerabili nella diluizione 1 x 107 , quindi abbiamo considerato questa diluizione come la diluizione finale. - Distribuire 100 μL di ciascuna diluizione su LBA e incubare per una notte a 37 °C. Come da protocolli microbiologici standard, utilizzare diluizioni che mostrino colonie numerabili (30-300) per il conteggio delle colonie e ottenere le unità formanti colonie (CFU).
- Inoculazione della ferita
- Inoculare 200 μL dalla coltura notturna in 5 ml di brodo LB e incubare nell'agitatore a 37 °C per 2,5 ore.
- Misurare la densità ottica della coltura diurna a 600 nm (OD600). Per l'inoculazione di PA01, utilizzare 3 x 10 8 CFU/mL (250 μL di 1 x 108 CFU/mL di PA01 vengono inoculati per ferita). Trasportare l'inoculo alla struttura per animali in un contenitore a rischio biologico.
- Disperdere l'inoculo sulla superficie delle ferite esposte il giorno 3 dopo l'ustione utilizzando una pipetta e distribuirlo uniformemente utilizzando uno spandiconcime monouso (Figura 6). Tenere le ferite aperte per circa 15 minuti prima di bendare.
NOTA: Tutte le procedure chirurgiche, l'inoculazione, le biopsie tissutali, l'imaging e il bendaggio vengono eseguiti in anestesia generale come nelle sezioni 3 e 4.
- Conferma dell'instaurazione dell'infezione
NOTA: Per confermare che le ferite si sono infettate con successo dopo l'inoculazione, vengono utilizzati diversi approcci e i campioni di ferita vengono confrontati con i campioni raccolti da pelle normale; Di seguito sono riportati alcuni esempi.- Per l'analisi patologica di campioni raccolti in diversi punti temporali, utilizzare il conteggio delle unità formanti colonie per stimare un'infezione (CFU; Figura 7E, F).
- Prelevare 6 mm di tessuto della ferita mediante biopsia a punzone. Etichettare e pesare provette vuote a fondo tondo da 5 ml. Trasferire i campioni nelle provette e pesare le provette con i campioni.
- Tagliare il tessuto con un bisturi su una superficie sterile. Eseguire tutti i passaggi in una cappa BSL2.
NOTA: Per assicurarsi che i tessuti siano facilmente omogeneizzati, la dimensione deve essere molto piccola (ma non inferiore a 0,5 mm) - Mettere il campione nella provetta e aggiungere 1 ml di PBS. Mescolare e macinare il tessuto utilizzando una sonda per la macinazione dei tessuti duri.
- Diluire in serie (non diluito a 1 x 10−5) l'omogenato e placcare 50 μL di ciascuna diluizione in terreni selettivi (Pseudomonas Isolation Agar, PIA) e non selettivi (LBA).
- Incubare tutte le diluizioni in condizioni aerobiche a 37 °C per 18-24 ore. Visualizzare le lastre con condizioni di illuminazione adeguate.
- Selezionare piastre con 30-300 colonie, se nessuna delle piastre ha raggiunto tale concentrazione, utilizzare la piastra non diluita. Utilizzare ImageJ per contare il numero di colonie e calcolare l'UFC per piastra moltiplicando il valore medio per il fattore di diluizione finale.
- Acquisire le immagini dai campioni raccolti dal giorno 7 dopo l'inoculazione e da altri punti temporali utilizzando la microscopia elettronica a scansione (SEM) per confermare la presenza dei biofilm batterici (Figura 7G).
NOTA: Il giorno 7 post-inoculazione è stato selezionato perché è il giorno dell'instaurazione dell'infezione da biofilm e dell'inizio dell'ammorbidimento dell'escara dell'ustione, che consente la penetrazione delle onde US e, quindi, la visualizzazione dei tessuti più profondi. Nella Figura 4, controllare l'immagine della ferita da ustione del giorno 3, che mostra la spessa escara coriacea che impedisce alle onde ecografiche di passare attraverso i tessuti più profondi. - Colorare le sezioni delle biopsie della ferita con anticorpi specifici contro P. aeruginosa per confermare la presenza del batterio specifico, come mostrato in una precedente pubblicazione13 (Figura 7H).
- Eseguire il sequenziamento di nuova generazione (NGS), come pubblicato su Sinha et al.31. Quantificare il batterio 16srRNA dalle ferite infette e i campioni di pelle normale non infetti raccolti in diversi punti temporali a partire dal giorno 7 dopo l'inoculazione fino alla fine dello studio.
- Per l'analisi patologica di campioni raccolti in diversi punti temporali, utilizzare il conteggio delle unità formanti colonie per stimare un'infezione (CFU; Figura 7E, F).
12. Prelievo della biopsia
- Raccogliere le biopsie tissutali per l'analisi dopo l'imaging il giorno 7, il giorno 14, il giorno 28 e il giorno 56 dopo l'inoculazione. Raccogliere le biopsie da ogni ferita una sola volta per ridurre al minimo l'interferenza con il processo di guarigione.
NOTA: Tutte le procedure chirurgiche, l'inoculazione, le biopsie tissutali, l'imaging e il bendaggio vengono eseguiti in anestesia generale come nelle sezioni 3 e 4.- Infiltrare l'area intorno alla ferita con bupivacaina allo 0,5%. Tagliare una striscia larga 3-4 mm da un bordo all'altro della ferita, mantenendo piccoli margini di pelle normale su entrambi i lati, utilizzando un bisturi monouso con lama misura 10. Posizionare la striscia in un tubo conico etichettato riempito con formalina tamponata al 4% per il fissaggio.
NOTA: Per l'imaging timepoint precoce e le procedure di biopsia, verrà somministrata una dose completa di buprenorfina durante la preparazione chirurgica. Per le procedure di biopsia tardiva, durante la preparazione chirurgica verrà somministrata una mezza dose di buprenorfina. Dopo tutte le procedure di ustione e biopsia, al gabapentin verrà somministrato BID per un massimo di 7 giorni, come consigliato dal veterinario curante. Il carprofene verrà somministrato per giorni dopo l'operazione o come consigliato dal veterinario curante. - Tagliare una biopsia di 6 mm dalla ferita (dal letto della ferita o dal bordo della ferita). Raccogliere dal bordo della ferita, compresa parte della pelle normale e il letto della ferita, per diversi tipi di analisi.
- Rimuovere il campione utilizzando una pinza sterilizzata e forbici da dissezione. Posizionare il campione bioptico nella provetta o cassetta appropriata per l'elaborazione e l'analisi.
- Per CFU, SEM, RNA e FPPE, conservare i campioni in provette con un tampone appropriato. Ad esempio, i campioni possono essere inseriti nell'OCT in cassette per la microscopia a cattura laser (LCM) e l'immunoistochimica (IHC).
- Ottenere l'emostasi dopo la raccolta dei campioni premendo delicatamente la ferita con una garza sterile. Coprire la ferita con una medicazione non aderente e bendare come nella sezione 9.
- Infiltrare l'area intorno alla ferita con bupivacaina allo 0,5%. Tagliare una striscia larga 3-4 mm da un bordo all'altro della ferita, mantenendo piccoli margini di pelle normale su entrambi i lati, utilizzando un bisturi monouso con lama misura 10. Posizionare la striscia in un tubo conico etichettato riempito con formalina tamponata al 4% per il fissaggio.
13. Eutanasia e raccolta dei tessuti
- Sedare il maiale il giorno dell'eutanasia con TKX e anestetizzare con isoflurano. Posizionare un catetere endovenoso nella vena marginale dell'orecchio seguendo i passaggi descritti nel paragrafo 3. Intubare il suino seguendo la procedura descritta al paragrafo 4.
- Rimuovere la benda una volta che il maiale è anestetizzato e pulire l'area intorno alle ferite.
- Fotografia digitale completa, imaging LSI, TEWL e HUSD. Raccogliere i campioni dalle ferite e dalla pelle normale seguendo i passaggi descritti nel paragrafo 12.
- Una volta raccolti tutti i campioni necessari, sopprimere umanamente il maiale mentre è ancora sotto anestesia tramite un'iniezione endovenosa di soluzione di eutanasia disponibile in commercio (pentobarbital di sodio). Utilizzare uno stetoscopio per auscultare per confermare la cessazione del battito cardiaco e la respirazione spontanea.
- Eseguire un metodo secondario di eutanasia, come richiesto da SOM IACUC, utilizzando un bisturi per indurre lo pneumotorace. Trasferire la carcassa di maiale in un barile e trasportarla nel congelatore per essere prelevata per l'incenerimento.
Risultati
È stato utilizzato un dispositivo standardizzato per ustioni per creare ferite da ustione a tutto spessore a 150 °C per 1 minuto, che ha provocato un'ustione profonda omogenea con un margine uniforme di eritema e infiammazione (Figura 3 e Figura 7). Ogni maiale ha ricevuto otto ustioni a tutto spessore sulla schiena, come illustrato nella Figura 3C.
La valutazione non invasiva in tempo reale delle ferite da ustione mediante ecografia ad alta risoluzione B-mode per confermare la profondità della ferita e la progressione della guarigione della ferita nel tempo ha mostrato la distruzione di tutti gli strati cutanei fino al grasso sottocutaneo (Figura 4). L'imaging laser speckle (LSI) è stato utilizzato per un'ulteriore caratterizzazione della perfusione della ferita (Figura 4A).
Le ferite da ustione hanno mostrato una spessa membrana piogenica sulla superficie della ferita entro il giorno 7 dopo l'inoculazione, confermando così l'infezione e l'instaurarsi del biofilm della ferita da ustione (Figura 7A). La planimetria digitale ha mostrato un aumento dell'area della ferita al giorno 3 dopo l'inoculazione di PAO1 a causa della risposta infiammatoria nel sito della ferita e nei margini (Figura 7A,B). Sebbene l'area della ferita abbia iniziato a ridursi entro il giorno 14 dopo l'inoculazione, al giorno 56 è stata osservata una guarigione incompleta fino a circa il 25% delle dimensioni originali della ferita, indicando la cronicità delle ferite (Figura 7B). La cronicità della ferita e la compromissione della guarigione della ferita sono state ulteriormente confermate dal TEWL, che ha mostrato un'elevata perdita di acqua transepidermica. I risultati del TEWL riflettevano la perdita della funzione di barriera cutanea rispetto alla pelle normale in tutti i punti temporali misurati, indicando così una compromissione funzionale della guarigione della ferita da ustione (Figura 7B). Ciò è stato confermato anche dalla soppressione delle proteine giunzionali strette ZO-1 e 213 e dalla compromissione del ripristino della funzione di barriera cutanea, come si evince dagli elevati valori di TEWL osservati al giorno 35 (medio) e al giorno 56 (tardi) nonostante la chiusura visiva della ferita (Figura 7I).
La profondità dell'ustione è stata ulteriormente convalidata dalla colorazione H&E, che ha mostrato distorsione e necrosi di tutti gli strati istologici della pelle, come mostrato nella Figura 7C. Il biofilm stabilito di PA01 è stato ulteriormente convalidato al giorno 7 dopo l'inoculazione mediante CFU (Figura 7E,F), imaging SEM (Figura 7G) e colorazione in immunofluorescenza (Figura 7H).

Figura 1: Impostazione per la procedura . (A) Preparazione del tavolo operatorio. (B) Incannulamento della vena dell'orecchio per fluidi endovenosi e somministrazione di farmaci. (C) Copertura termica per proteggere il suino dall'ipotermia durante la procedura. (D) Impostazione del bruciatore e del timer. Fare clic qui per visualizzare una versione più grande di questa figura.
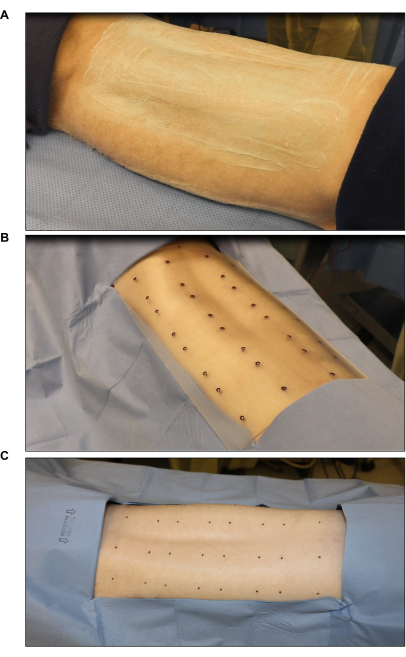
Figura 2: Sterilizzazione e marcatura del sito chirurgico . (A) Taglio e sterilizzazione dei capelli. (B) Marcatura del sito dell'ustione utilizzando una dima standard sterile a otto ferite (ogni ferita è di 2 pollici x 2 pollici). (C) Marcatura finale con un pennarello cutaneo sterile. Fare clic qui per visualizzare una versione più grande di questa figura.
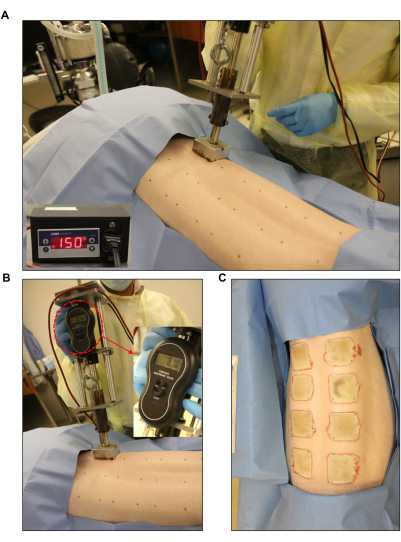
Figura 3: Induzione della ferita da ustione. (A,B) Bruciatore standardizzato con manometro e unità di controllo automatizzato (2 pollici x 2 pollici) applicata al sito di ferita premarcato. (C) L'intera schiena mostra le otto ferite da ustione a tutto spessore. Fare clic qui per visualizzare una versione più grande di questa figura.
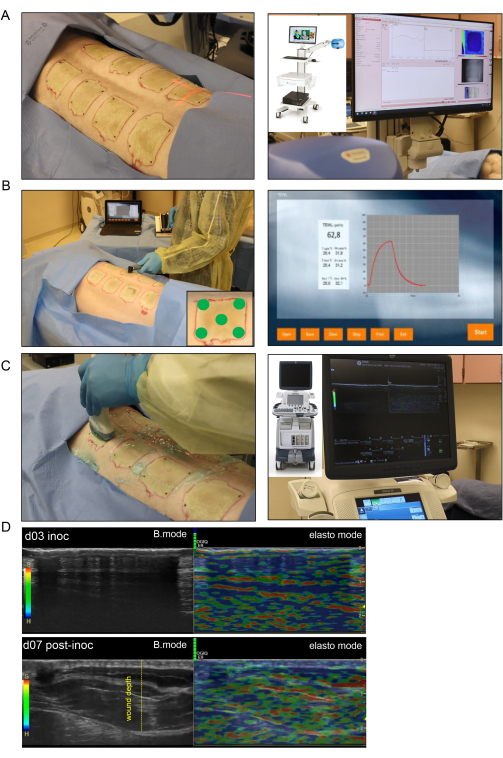
Figura 4: Imaging e valutazione non invasivi delle ferite da ustione. (A) L'imaging a speckle laser (LSI) con il corretto orientamento dell'indicatore del raggio laser al centro della ferita è mostrato nell'immagine a sinistra; l'immagine a destra mostra il dispositivo LSI e la mappa di perfusione vascolare cutanea in tempo reale. (B) L'applicazione della sonda per la perdita d'acqua transepidermica (TEWL) al sito della ferita in cinque punti diversi (quattro angoli della ferita e il centro mostrato nell'immagine nell'angolo in basso a destra) è mostrata nell'immagine a sinistra; l'immagine sul lato destro è una schermata rappresentativa catturata in tempo reale della misurazione TEWL. (C) Sul lato sinistro è mostrata la scansione ecografica armonica della ferita da ustione utilizzando una sonda ecografica ad alta risoluzione da 16 MHz; L'immagine a destra mostra il dispositivo a ultrasuoni e la registrazione dello schermo in tempo reale. (D) Immagini strutturali (immagini B-mode, ultrasuoni in scala di grigi) e biomeccaniche (elastografia, ecografia a colori) del sito della ferita da ustione al giorno dell'inoculazione e al giorno 7 dopo l'inoculazione. La profondità della ferita è indicata dalla linea tratteggiata gialla. Fare clic qui per visualizzare una versione più grande di questa figura.
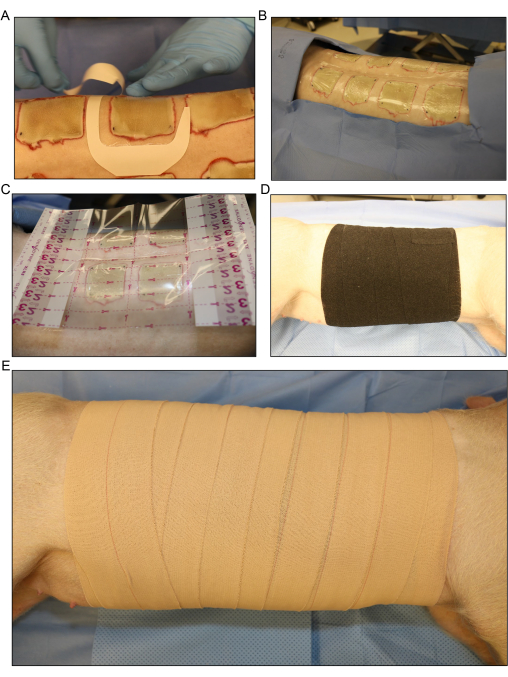
Figura 5: Medicazione e bendaggio della ferita . (A) Applicazione della medicazione con pellicola trasparente per ogni ferita separatamente. (B) Tutte le ferite da ustione inoculate dorsalmente sono coperte con il primo strato di medicazione. (C) Una medicazione con pellicola trasparente più grande viene posizionata su tutta l'area della ferita. (D) Applicazione del secondo strato di garza e di uno strato sciolto di benda elastica elastica attorno all'intero tronco del suino per assorbire l'essudato fluido che fuoriesce dalle ferite. (E) Copertura dell'intera area della ferita con uno strato finale di 4 in medicazione adesiva. Fare clic qui per visualizzare una versione più grande di questa figura.
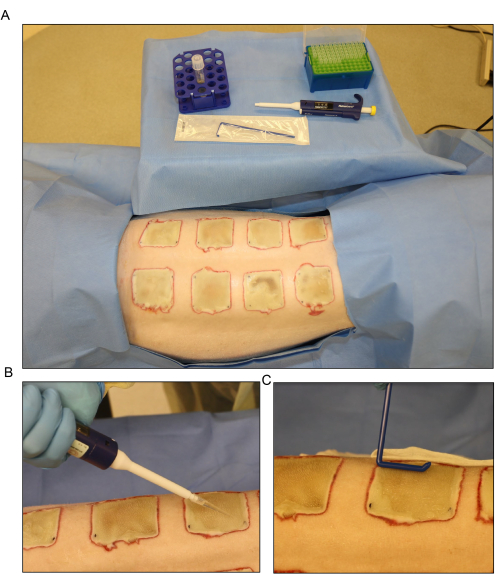
Figura 6: Inoculazione batterica . (A) Preparazione per l'inoculazione di Pseudomonas aeruginosa (PA01) al giorno 3 dopo l'ustione. (B) Applicazione topica dell'inoculo con una pipetta con un volume di 500 μL per ogni ferita. (C) L'inoculo viene disperso uniformemente sulla superficie della ferita utilizzando uno spandiconcime sterile monouso. Fare clic qui per visualizzare una versione più grande di questa figura.
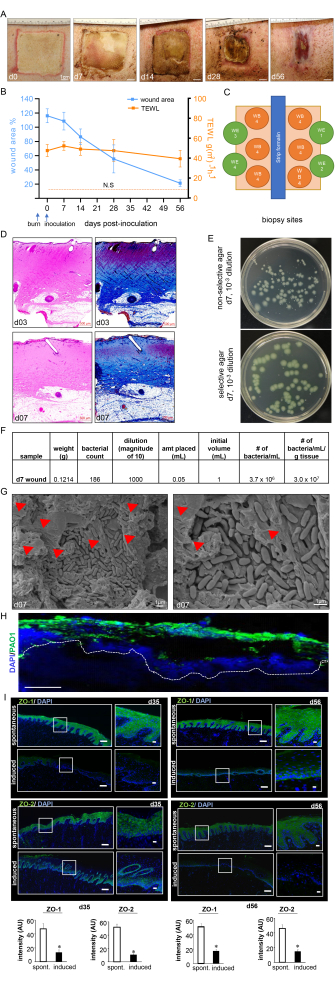
Figura 7: Progressi nella guarigione della ferita e conferma del biofilm. (A) Immagini rappresentative della chiusura della ferita nel corso della sequenza temporale dello studio. Barra della scala = 1 cm. (B) Quantificazione dell'area della ferita e delle misurazioni TEWL sulla linea temporale dello studio (n = 6). I dati sono rappresentati come media ± SD. N.S. si riferisce al valore TEWL della pelle normale. (C) Diagramma schematico che mostra i diversi siti di biopsia della ferita. D. Colorazione H&E con la corrispondente colorazione tricromica di Masson che mostra distorsione e necrosi di tutti gli strati cutanei al giorno 3 post-ustione e al giorno 7 dopo l'inoculazione. Barra della scala = 500 μm. (E) Immagini digitali rappresentative di agar non selettivo (Luria-Bertani agar) e agar selettivo (Pseudomonas Isolation Agar) con colonie batteriche cresciute da tessuto suino del letto della ferita. Il mezzo selettivo consente il conteggio accurato delle sole colonie di PA01. (F) Viene mostrato un calcolo dell'unità formante colonia (CFU) del campione dai conteggi delle colonie prelevati dalle biopsie della ferita post-inoculazione del giorno 7 processate. (G) Immagini rappresentative al microscopio elettronico a scansione (SEM) delle ferite da ustione inoculate al giorno 7 dopo l'inoculazione che mostrano il biofilm PA01 stabilito, con un'immagine ingrandita sul lato destro. Barra della scala = 1 μm. Le punte di freccia rosse indicano le sostanze polimeriche extracellulari (EPS). (H) P. aeruginosa sulle ferite da ustione sono state visualizzate utilizzando l'anticorpo anti-Pseudomonas (verde); le immagini di immunofluorescenza delle biopsie della ferita post-inoculazione del giorno 7 mostrano una forte colonizzazione dei tessuti della ferita da parte di P. aeruginosa. Barra della scala = 100 μm. (I) Mosaico rappresentativo (barra della scala = 200 μm) e corrispondenti immagini ingrandite (barra della scala = 50 μm) di sezioni colorate con ZO-1 e ZO-2 al giorno 35 e al giorno 56 dopo l'inoculazione, dimostrando una ridotta espressione delle proteine a seguito dell'infezione indotta. Le sezioni congelate incorporate nell'OCT (10 μm) sono state colorate utilizzando anti-ZO-1 (verde) o anti-ZO-2 (verde). Le sezioni sono state controcolorate utilizzando DAPI. I grafici a barre presentano la quantificazione dell'intensità del segnale ZO-1 e ZO-2. I dati sono presentati come media ± DS (n = 3); * p < 0,05 rispetto a quelli spontanei. Per verificarne la significatività, è stata eseguita un'analisi unidirezionale di Mann-Whitney o Kruskal-Wallis dei test di varianza. La Figura 7H,I è stata modificata da Roy et al.13. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo rapporto fornisce un protocollo dettagliato per la creazione di un modello suino di infezione cronica del biofilm della ferita per studi sperimentali. Diversi modelli di biofilm suino sono stati segnalati in precedenza 22,23,24,25,26, ma nessuno di essi è un modello suino che coinvolge studi a lungo termine di 8 settimane. Le ferite croniche sono quelle che rimangono aperte per 4 settimane o più 14,27,28. Non ci sono altri modelli di biofilm cronico della ferita riportati in letteratura. Questo lavoro affronta la nozione di chiusura funzionale della ferita 2,7,13,15,17,29. Uno studio condotto nel 2014 è stato il primo a riportare che le ferite infette da biofilm possono chiudersi senza il ripristino della funzione di barriera7. In questo lavoro è riportata la misurazione della funzione di barriera cutanea nella ferita in via di guarigione utilizzando la perdita d'acqua transepidermica (TEWL).
Anatomicamente e fisiologicamente, la pelle suina, rispetto alla pelle di altri piccoli animali, è più vicina alla pelle umana32,33,34. Sia la pelle di maiale che quella umana hanno un'epidermide spessa 33 e il rapporto di spessore dermo-epidermico varia da 10:1 a13:1 nel maiale, che è paragonabile all'uomo34,35. Istologicamente e biomeccanicamente, la pelle degli esseri umani e dei suini mostra somiglianze nelle creste della rete, nel grasso sottocutaneo, nel collagene dermico, nella distribuzione dei peli, nelle strutture annessiali e nelle dimensioni e nella distribuzione dei vasi sanguigni36,37,38. Dal punto di vista funzionale, sia i suini che gli esseri umani condividono somiglianze nella composizione dei componenti lipidici, proteici e cheratinici dello strato epidermico, nonché modelli immunoistologici comparabili37,38. Il sistema immunitario dei suini, rispetto a quello di altri piccoli animali, condivide maggiori somiglianze con il sistema immunitario umano, il che significa che i suini sono un modello appropriato per gli studi sulle interazioni con l'ospite che sono parte integrante delle complessità del biofilm patologico nelle infezioni delle ferite39. La valutazione critica dei pro e dei contro offerti da vari modelli animali ha portato al consenso sul fatto che i suini rappresentano un modello efficiente per lo studio della guarigione delle ferite34,38. Inoltre, i suini domestici sviluppano spontaneamente infezioni batteriche croniche, come osservato nell'uomo10. Il dispositivo di ustione utilizzato per creare le ferite è un dispositivo di ustione avanzato e automatizzato che fornisce energia termica in base a una temperatura letta dal sito cutaneo mirato22,40. Tale approccio migliora il rigore e la riproducibilità della lesione da ustione. L'uso di isolati clinici umani di batteri per infettare le ferite del maiale aggiunge valore come modello preclinico.
Le ustioni sono complesse e causano diverse perturbazioni sistemiche20,41. Pertanto, è importante rianimare il maiale con liquidi adeguati e prevenire l'ipotermia durante l'anestesia e il recupero. Diversi fattori possono interferire con la guarigione della ferita, tra cui l'alimentazione post-ustione, i liquidi e il dolore42. È quindi importante un attento monitoraggio della nutrizione e delle valutazioni del dolore. Il dolore post-ustione può essere grave e influenzare il comportamento e la dieta dell'animale. Gli interventi per affrontare i problemi comportamentali devono essere presi in considerazione attivamente. La valutazione e la gestione del dolore regolari e continue sono indispensabili. In questo protocollo è inclusa una scheda di valutazione del dolore approfondita con un piano di gestione del dolore molto dettagliato. Per evitare la contaminazione incrociata tra le ferite, è necessario prestare particolare attenzione ad applicare il primo strato della medicazione su ciascuna ferita separatamente. È necessario prestare molta attenzione nella manipolazione di tutti i materiali a rischio biologico e nell'eseguire la disinfezione accurata delle apparecchiature, degli strumenti e dell'intera sala chirurgica. L'applicazione di più strati di medicazione impedisce al maiale di esporre le ferite durante lo sforzo di strofinare o grattare il prurito.
Il maiale nel modello attuale non era compromesso da disturbi metabolici sottostanti (ad esempio, il diabete) e, quindi, l'effetto studiato era puramente l'impatto dell'infezione da biofilm batterico sulla guarigione delle ferite. Tuttavia, il modello si presta all'induzione del diabete (utilizzando la streptozotocina per esempio) e potrebbe essere utilizzato per studiare l'infezione da biofilm in relazione a un disturbo metabolico sottostante. L'altra limitazione del modello è l'impostazione dell'infezione controllata utilizzando P. aeruginosa, un batterio. Si prevede che anche la normale microflora cutanea del maiale possa crescere nella ferita e possa influire sulla guarigione. Sono necessarie ulteriori analisi utilizzando NGS o altre tecniche avanzate per delineare il contenuto microbico della ferita. Il modello attuale potrebbe essere applicato anche a infezioni miste con diverse specie microbiche (ad esempio, fungine, virali, ecc.). Questo è un elemento importante, poiché è probabile che le ferite clinicamente rilevanti siano popolate da microbi misti, che possono influire in modo differenziato sulla guarigione delle ferite.
Ci sono molti potenziali vantaggi in questo modello, tra cui la somiglianza con la complessità e le sequele a lungo termine delle ferite croniche umane, il processo di ustione automatizzato e riproducibile e l'uso di specie batteriche clinicamente isolate. L'uso di molteplici modalità di imaging non invasive rappresenta un potente approccio per la raccolta di dati fisiologici utili per la caratterizzazione della ferita. Infine, la valutazione della guarigione funzionale della ferita attraverso il ripristino della funzione di barriera cutanea basata su TEWL è fondamentale. In conclusione, in questo lavoro viene mostrato un protocollo robusto, semplice, dettagliato e facile da usare per sviluppare una grave lesione da ustione infettata da biofilm utilizzando un sistema modello suino.
Divulgazioni
Gli autori dichiarano di non avere interessi contrastanti.
Riconoscimenti
Vorremmo ringraziare il Laboratory Animal Resource Center (LARC), Università dell'Indiana, per il loro supporto e la cura veterinaria degli animali durante lo studio. Questo lavoro è stato in parte sostenuto dalle sovvenzioni del National Institutes of Health NR015676, NR013898 e DK125835 e dalla sovvenzione W81XWH-11-2-0142 del Dipartimento della Difesa. Inoltre, questo lavoro ha beneficiato dei seguenti premi del National Institutes of Health: GM077185, GM069589, DK076566, AI097511 e NS42617.
Materiali
| Name | Company | Catalog Number | Comments |
| Sedation | |||
| Ketamine | Zoetis | 10004027 | 100mg/ml |
| Telazol | Zoetis | 106-111 | 100mg/ml |
| Xylazine | Pivetal | 04606-6750-02 | 100mg/ml Anased |
| 3ml syringe w/ 20g needle | Covidien-Monoject | 8881513033 | |
| Winged infusion set 21g | Jorgensen Labs | J0454B | |
| Anesthetic | |||
| Isoflurane | Pivetal | 21295097 | |
| Surgery | |||
| Hair clippers | Wahl | 8787-450A | |
| Nair | Church and Dwight Co. Inc | 70506572 | |
| Chlorhexidine Solution | First Priority Inc. | 179925722 | |
| 70% Isopropyl Alcohol | Uline | S-17474 | |
| 0.9% Saline Solution | ICU Medical | RL-7282 | |
| Non-woven gauze | Pivetal | 21295051 | |
| Paper tape | McKesson | 455531 | |
| 2" Elastic tape | Pivetal | 21300869 | |
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Spay hook | Jorgensen Labs | J0112A | |
| Sterile lube | McKesson | 16-8942 | |
| Laryngoscope | Jorgensen Labs | J0449S | |
| Roll gauze | Pivetal | 21295032 | |
| Endotracheal tube (7-9mm) | Covidien | 86112 | Shiley Hi-Lo Oral Nasal Tracheal Tube Cuffed |
| 15gtt/ml IV administration set | ICU Medical | 12672-28 | |
| LRS 1000ml bag | ICU Medical | 07953-09 | |
| Three Quarter Drape Sheet | McKesson | 16-i80-12110G | |
| Analgesia | |||
| Buprenorphine | RX Generics | 42023-0179-05 | 0.3mg/ml |
| Fentanyl Transdermal | |||
| Carprofen | 21294548 | Pivetal | 50mg/ml Levafen |
| Bandaging | |||
| Transparent film dressing 26x30 | Genadyne Biotechnologies | A4-S00F5 | |
| Film dressing 4 x 4-3/4 Frame Style | McKesson | 886408 | |
| Vetrap | 3M | 1410BK BULK | |
| Elastic tape 4" | Pivetal | 21300931 | |
| Kerlix Roll Gauze | Cardinal Health | 3324 | |
| Imaging | |||
| Canon EOS 80D | Canon | 1263C004 | |
| Speedlight 600EX II-RT | Canon | 1177C002 | |
| EFS 17-55mm Ultrasonic | Canon | 1242B002 | |
| GE Logiq E9 | GE | 5197104-2 | |
| ML6-15 Probe | GE | 5199103 | |
| PeriCamPSI | Perimed | 90-00070 | |
| DermaLab | Cortex Technologies Inc | 4608D78 | |
| Biopsy/Tissue Collection | |||
| 6mm punch biopsy | Integra Lifesciences | 33-36 | |
| bupivicaine 0.5% | Auromedics Pharma | 55150017030 | |
| Size 10 Disposable Scalpel | McKesson | 16-63810 | |
| Dissection scissors | Pivetal | 21294806 | |
| Rat tooth thumb tissue forceps | Aesculap | BD512R | |
| Non-adherent Dressing | Covidien | 2132 | Telfa |
| 50ml Conical tube | Falcon | 352070 | |
| Eppendorf/microcentrifuge tube | Fisherbrand | 02-681-320 | |
| OCT Cassette | |||
| Non Woven Gauze 4x4 | Pivetal | 21295051 | |
| Inoculum | |||
| Low salt LB agar | Invitrogen | 22700-025 | |
| Low salt LB broth | Fisher scientific | BP1427-500 | |
| Petri plate | Falcon | REF-351029 | |
| Polyprophyline round bottom tubes (14 ml) | Falcon | REF-352059 | |
| Pseudomonas Agar Base (Dehydrated) | Thermo Scientific | OXCM0559B | |
| LB Agar, powder (Lennox L agar) | Thermo Fisher Scientific (Life Technologies) | 22700025 | |
| Gibco™ DPBS, calcium, magnesium | Gibco | 14040133 | |
| Euthanasia | |||
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Fatal Plus | Vortech Pharmaceuticals | 9373 |
Riferimenti
- Goodwine, J., et al. Pyruvate-depleting conditions induce biofilm dispersion and enhance the efficacy of antibiotics in killing biofilms in vitro and in vivo. Scientific Reports. 9 (1), 3763(2019).
- Sen, C. K., Roy, S., Mathew-Steiner, S. S., Gordillo, G. M. Biofilm management in wound care. Plastic and Reconstructive Surgery. 148 (2), 275-288 (2021).
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clinical Microbiology Reviews. 19 (2), 403-434 (2006).
- Nguyen, T. T., Gilpin, D. A., Meyer, N. A., Herndon, D. N. Current treatment of severely burned patients. Annals of Surgery. 223 (1), 14-25 (1996).
- Eriksson, E., et al. Chronic wounds: Treatment consensus. Wound Repair and Regeneration. 30 (2), 156-171 (2022).
- Lebeaux, D., Chauhan, A., Rendueles, O., Beloin, C. From in vitro to in vivo models of bacterial biofilm-related infections. Pathogens. 2 (2), 288-356 (2013).
- Ganesh, K., et al. Chronic wound biofilm model. Advances in Wound Care. 4 (7), 382-388 (2015).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Stewart, P. S. Biophysics of biofilm infection. Pathogens and Disease. 70 (3), 212-218 (2014).
- Jensen, L. K., Johansen, A. S. B., Jensen, H. E. Porcine models of biofilm infections with focus on pathomorphology. Frontiers in Microbiology. 8, 1961(2017).
- Mah, T. F., O'Toole, G. A. Mechanisms of biofilm resistance to antimicrobial agents. Trends in Microbiology. 9 (1), 34-39 (2001).
- Gonzalez, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023(2018).
- Roy, S., et al. Mixed-species biofilm compromises wound healing by disrupting epidermal barrier function. Journal of Pathology. 233 (4), 331-343 (2014).
- Sen, C. K. Human wound and its burden: Updated 2020. Compendium of Estimates. Advances in Wound Care. 10 (5), 281-292 (2021).
- Barki, K. G., et al. Electric field based dressing disrupts mixed-species bacterial biofilm infection and restores functional wound healing. Annals of Surgery. 269 (4), 756-766 (2019).
- Dusane, D. H., et al. Electroceutical treatment of Pseudomonas aeruginosa biofilms. Scientific Reports. 9 (1), 2008(2019).
- Roy, S., et al. Staphylococcus aureus biofilm infection compromises wound healing by causing deficiencies in granulation tissue collagen. Annals of Surgery. 271 (6), 1174-1185 (2020).
- Ghanbari, A., et al. Inoculation density and nutrient level determine the formation of mushroom-shaped structures in Pseudomonas aeruginosa biofilms. Scientific Reports. 6, 32097(2016).
- Yin, R., Cheng, J., Wang, J., Li, P., Lin, J. Treatment of Pseudomonas aeruginosa infectious biofilms: Challenges and strategies. Frontiers in Microbiology. 13, 955286(2022).
- Norbury, W., Herndon, D. N., Tanksley, J., Jeschke, M. G., Finnerty, C. Infection in burns. Surgical Infections. 17 (2), 250-255 (2016).
- Nitz, F., et al. Molecular detection of drug-resistance genes of bla(OXA-23)-bla(OXA-51) and mcr-1 in clinical isolates of Pseudomonas aeruginosa. Microorganisms. 9 (4), 786(2021).
- Davis, S. C., et al. Microscopic and physiologic evidence for biofilm-associated wound colonization in vivo. Wound Repair and Regeneration. 16 (1), 23-29 (2008).
- Breuing, K., Kaplan, S., Liu, P., Onderdonk, A. B., Eriksson, E. Wound fluid bacterial levels exceed tissue bacterial counts in controlled porcine partial-thickness burn infections. Plastic and Reconstructive Surgery. 111 (2), 781-788 (2003).
- Nusbaum, A. G., et al. Effective method to remove wound bacteria: Comparison of various debridement modalities in an in vivo porcine model. Journal of Surgical Research. 176 (2), 701-707 (2012).
- Hirsch, T., et al. Enhanced susceptibility to infections in a diabetic wound healing model. BMC Surgery. 8, 5(2008).
- Roche, E. D., et al. Increasing the presence of biofilm and healing delay in a porcine model of MRSA-infected wounds. Wound Repair and Regeneration. 20 (4), 537-543 (2012).
- Hartoch, R. S., McManus, J. G., Knapp, S., Buettner, M. F. Emergency management of chronic wounds. Emergency Medical Clinics of North America. 25 (1), 203-221 (2007).
- Mustoe, T. Understanding chronic wounds: a unifying hypothesis on their pathogenesis and implications for therapy. American Journal of Surgery. 187 (5), 65-70 (2004).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Sinha, M., et al. Pseudomonas aeruginosa theft biofilm require host lipids of cutaneous wound. Annals of Surgery. 277 (3), e634-e647 (2023).
- Fan, G. Y., et al. Severe burn injury in a swine model for clinical dressing assessment. Journal of Visualized Experiments. (141), e57942(2018).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Meyer, W., Schwarz, R., Neurand, K. The skin of domestic mammals as a model for the human skin, with special reference to the domestic pig. Current Problems in Dermatology. 7, 39-52 (1978).
- Vardaxis, N. J., Brans, T. A., Boon, M. E., Kreis, R. W., Marres, L. M. Confocal laser scanning microscopy of porcine skin: implications for human wound healing studies. Journal of Anatomy. 190, 601-611 (1997).
- Heinrich, W., Lange, P. M., Stirtz, T., Iancu, C., Heidemann, E. Isolation and characterization of the large cyanogen bromide peptides from the alpha1- and alpha2-chains of pig skin collagen. FEBS Letters. 16 (1), 63-67 (1971).
- Marcarian, H. Q., Calhoun, M. L. Microscopic anatomy of the integument of adult swine. American Journal of Veterinary Research. 27 (118), 765-772 (1966).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Dawson, H. D., et al. Structural and functional annotation of the porcine immunome. BMC Genomics. 14, 332(2013).
- Kim, J. Y., Dunham, D. M., Supp, D. M., Sen, C. K., Powell, H. M. Novel burn device for rapid, reproducible burn wound generation. Burns. 42 (2), 384-391 (2016).
- Nielson, C. B., Duethman, N. C., Howard, J. M., Moncure, M., Wood, J. G. Burns: Pathophysiology of systemic complications and current management. Journal of Burn Care and Research. 38 (1), e469-e481 (2017).
- Rowan, M. P., et al. Burn wound healing and treatment: Review and advancements. Critical Care. 19 (1), 243(2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon