Method Article
Schweinemodell für Biofilminfektion und unsichtbare Wunden
In diesem Artikel
Zusammenfassung
Chronische Wunden, die gegen Antibiotika resistent sind, stellen eine große Bedrohung für das Gesundheitssystem dar. Biofilminfektionen sind hartnäckig und feindlich und können zu einem mangelhaften funktionellen Wundverschluss führen. Wir berichten über ein klinisch relevantes Schweinemodell von Biofilm-infizierten chronischen Wunden voller Dicke. Dieses Modell eignet sich sowohl für mechanistische Studien als auch für das Testen von Interventionen.
Zusammenfassung
Biofilminfektionen tragen wesentlich zur Wundchronizität bei. Die Etablierung einer klinisch relevanten experimentellen Wundbiofilminfektion erfordert die Beteiligung des Immunsystems des Wirts. Iterative Veränderungen des Wirts und des Erregers während der Bildung eines solchen klinisch relevanten Biofilms können nur in vivo auftreten. Das Schweinewundmodell ist für seine Vorteile als leistungsfähiges präklinisches Modell anerkannt. Es gibt mehrere Berichte über Ansätze zur Untersuchung von Wundbiofilmen. In-vitro - und Ex-vivo-Systeme weisen Defizite in Bezug auf die Immunantwort des Wirts auf. Kurzfristige In-vivo-Studien beinhalten ein akutes Ansprechen und erlauben daher keine Biofilmreifung, wie sie bekanntermaßen klinisch auftritt. Die erste Langzeitstudie zum Wundbiofilm von Schweinen wurde 2014 veröffentlicht. In der Studie wurde erkannt, dass sich mit Biofilm infizierte Wunden zwar planimetrisch geschlossen werden können, die Hautbarrierefunktion der betroffenen Stelle jedoch möglicherweise nicht wiederhergestellt wird. Später wurde diese Beobachtung klinisch validiert. Das Konzept des funktionellen Wundverschlusses war geboren. Geschlossene Wunden, bei denen die Hautbarrierefunktion jedoch unzureichend ist, können als unsichtbare Wunden angesehen werden. In dieser Arbeit versuchen wir, die methodischen Details zu berichten, die notwendig sind, um das langfristige Schweinemodell der Biofilm-infizierten schweren Verbrennungsverletzung zu reproduzieren, das klinisch relevant ist und einen translationalen Wert hat. Dieses Protokoll enthält eine detaillierte Anleitung zum Nachweis einer 8-wöchigen Wundbiofilminfektion mit P. aeruginosa (PA01). Acht Brandwunden in voller Dicke wurden symmetrisch auf dem Rücken von weißen Hausschweinen angelegt, die am Tag 3 nach der Verbrennung mit (PA01) geimpft wurden; Anschließend wurden nicht-invasive Beurteilungen der Wundheilung zu verschiedenen Zeitpunkten mittels Laser-Speckle-Imaging (LSI), hochauflösendem Ultraschall (HUSD) und transepidermalem Wasserverlust (TEWL) durchgeführt. Die geimpften Brandwunden wurden mit einem vierlagigen Verband abgedeckt. Biofilme, die am Tag 7 nach der Inokulation durch REM festgestellt und strukturell bestätigt wurden, beeinträchtigten den funktionellen Wundverschluss. Ein solches unerwünschtes Ergebnis kann als Reaktion auf geeignete Interventionen rückgängig gemacht werden.
Einleitung
Eine Biofilminfektion erschwert Verbrennungen und chronische Wunden und verursacht eine Chronifizierung 1,2,3,4,5. In der Mikrobiologie werden vor allem Biofilmmechanismen untersucht, wobei der Schwerpunkt auf den Mikrobenliegt 1,6. Die aus diesen Studien gewonnenen Erkenntnisse sind aus biowissenschaftlicher Sicht von größter Bedeutung, müssen aber nicht unbedingt auf klinisch relevante pathogene Biofilme anwendbar sein 6,7,8. Klinisch relevante Biofilm-Strukturaggregate sollten sowohl mikrobielle als auch Wirtsfaktorenenthalten 8,9,10. Eine solche Mikroumgebung ermöglicht die Einbeziehung iterativer Wirt-Mikroben-Interaktionen, die für die Entwicklung eines klinisch relevanten Biofilms entscheidend sind 7,8. Bei einem solchen Prozess ist die Beteiligung von Immunzellen und durch Blut übertragenen Faktoren von entscheidender Bedeutung11,12. Die Wirt-Mikroben-Interaktionen, die klinisch pathogenen Biofilmen zugrunde liegen, wie sie bei chronischen Wunden beobachtet werden, treten über einen langen Zeitraum auf. Daher muss jeder experimentelle Ansatz, der darauf abzielt, ein translational relevantes Modell der Biofilminfektion zu entwickeln, diese Faktoren berücksichtigen. Daher haben wir versucht, ein klinisch reproduzierbares Modell für chronische Biofilminfektionen bei Schweinen zu entwickeln.
Während Studien am Menschen eindeutig den besten Ansatz zur Untersuchung von Heilungsergebnissen darstellen, sind sie oft nicht am besten geeignet, um die zugrunde liegenden Mechanismen und neuen mechanistischen Paradigmen zu untersuchen. Ethische Bedenken schränken die Verwendung von Studiendesigns ein, die die Entnahme mehrerer Biopsien aus einer chronischen Wunde zu verschiedenen Zeitpunkten erfordern. Es ist daher von entscheidender Bedeutung, über ein gut etabliertes und reproduzierbares Tiermodell zu verfügen, um invasive Studien zur gründlichen Untersuchung des Biofilm-Verbleibs zu ermöglichen 7,13. Die Auswahl eines Tiermodells hängt von mehreren Faktoren ab, darunter die wissenschaftliche/translationale Relevanz und die Logistik. Das porcine System gilt weithin als das translational wertvollste experimentelle Modell zur Untersuchung menschlicher Hautwunden7. So wird in dieser Arbeit ein etabliertes Schweinemodell für Biofilm-infizierte Verbrennungen in voller Dicke vorgestellt. Diese Arbeit basiert auf mehreren Originalpublikationen, die inder Literatur 2,7,13,14,15,16,17 veröffentlicht wurden. In dieser Studie wurde ein klinisches Isolat von multiresistentem Pseudomonas aeruginosa (PA01) ausgewählt, um die Wunde zu infizieren. P. aeruginosa ist eine häufige Ursache für Wundinfektionen 2,18,19,20. Es handelt sich um ein gramnegatives Bakterium, das aufgrund seiner Resistenz gegen einige Antibiotika schwer zu behandeln sein kann11,19,21. Keines der bisher berichteten Biofilmmodelle von Schweinen umfasste 8-wöchige Langzeitstudien 22,23,24,25,26. Chronische Wunden sind solche, die 4 Wochen oder länger offen bleiben 14,27,28. In der Literatur gibt es keine anderen Biofilmmodelle für chronische Wunde. Diese Arbeit befasst sich mit dem Begriff des funktionellen Wundverschlusses 2,7,13,15,17,29.
Protokoll
Alle Tierstudien wurden in Übereinstimmung mit Protokollen durchgeführt, die vom Institutional Animal Care and Use Committee (IACUC) #21147 genehmigt wurden. Die Studie wurde am Laboratory Animal Resource Center (LARC) der Indiana University durchgeführt. Wir haben in diesem Protokoll ein weibliches weißes Hausschwein (70-80 lb) verwendet.
1. Akklimatisierung der Tiere
- Nach der Ankunft der Schweine in der Einrichtung sollten die Tiere mindestens 3 Tage lang einzeln im selben Raum untergebracht werden, um sich zu akklimatisieren und soziale Interaktion zu ermöglichen.
- Füttern Sie die Schweine mit einer ausgewogenen Ernährung. Entscheiden Sie die gefütterte Menge anhand des Gewichts und befolgen Sie die Empfehlungen des Herstellers.
- Stellen Sie sicher, dass das Tier vor dem Eingriff 6-12 Stunden nüchtern ist, um Übelkeit, Erbrechen und das Absaugen von Magenflüssigkeit während der Narkose zu verhindern.
2. Einrichtung des Operationssaals
- Bereiten Sie das Anästhesiegerät vor und stellen Sie sicher, dass es mit dem Atemkreislauf bereit ist.
- Richten Sie den Raum für die Operation ein, wie unten beschrieben (Abbildung 1A).
- Decken Sie den Behandlungstisch mit einem sterilen Tuch ab und legen Sie eine zirkulierende Wasserdecke darunter, um die Wärmeregulierung zu unterstützen.
- Stellen Sie einen Tisch mit Induktionsmaterial und Materialien zur Vorbereitung der Operation auf. Stellen Sie einen Tisch mit den Brennergeräten und Steuerkästen auf. Richten Sie das Bildgebungsgerät ein, und stellen Sie sicher, dass es eingeschaltet ist.
3. Sedierung des Schweins
- Das Schwein wird mit einer intramuskulären Injektion von TKX (Telazol 4,4 mg/kg; Ketamin 2,2 mg/kg; Xylazin 2,2 mg/kg) in einer Dosis von 1 ml/50 lb sediert. Halten Sie das Schwein im Behandlungsraum mit 1%-3% Isofluran, das über eine Maske verabreicht wird.
- Verabreichung der (präoperativen) Analgetika an die Schweine gemäß dem IACUC-Protokoll; einige Beispiele sind wie folgt: Buprenorphin 0,3 mg/ml, 0,01-0,05 mg/kg i.m.; Carprofen 50 mg/ml, 4 mg/kg i.m. oder SQ; Fentanyl transdermal 100 mcg/h auf die Ohrmuschel aufgetragen; Gabapentin 300 mg Kapseln, 3-10 mg/kg PO.
HINWEIS: Bei allen Verbrennungs- und Biopsieverfahren wird 1 Dosis Gabapentin am Tag vor der Operation und 1 Dosis Carprofen am Tag des Eingriffs verabreicht. Für das Hauptverbrennungsverfahren wird ein Fentanyl-Pflaster platziert und während der chirurgischen Vorbereitung wird 1 volle Dosis Buprenorphin verabreicht.
4. Einleitung der Anästhesie
- Sterilisieren Sie das Ohr mindestens dreimal abwechselnd mit 2%igem Chlorhexidin-Peeling und Alkohol. A 22-18 G 1 in einem intravenösen Katheter in die marginale Ohrvene einführen und den Blutfluss bestätigen. Spülen Sie den Katheter mit Kochsalzlösung und fixieren Sie den Katheter mit chirurgischem Klebeband (Abbildung 1B).
- Intubieren Sie das Schwein mit einem entsprechend großen Endotrachealtubus (7-9 mm), sobald die Muskelentspannung durch Inhalation der Anästhesie über die Maske erreicht wurde. Kontrollieren Sie die Muskelentspannung durch einen Verlust des Kiefertonus und die Beobachtung eines Lidreflexes.
- Öffnen Sie das Röhrchen und testen Sie das Leck der Manschette mit einer Luftspritze. Führen Sie das Röhrchen mit Hilfe eines Laryngoskops30 ein.
- Blasen Sie die Manschette auf und befestigen Sie den Schlauch, sobald die richtige Platzierung bestätigt ist. Schließen Sie den Molch an den Rückatmungskreislauf an.
HINWEIS: Das Rohr wird über die Schnauze gebunden und mit Rollgaze gesichert. Die Auskultation des Brustkorbs wird mit einem Stethoskop durchgeführt, um die korrekte Platzierung des Tubus zu bestätigen.
HINWEIS: Während der Anästhesie wird alle 5-10 Minuten Luft zugeführt, indem das Pop-Off-Ventil geschlossen und der Atembeutel gedrückt wird, bis das Druckmanometer 20 mm/Hg erreicht, um eine Positionsatelektase zu verhindern.
- Überwachen Sie das Tier und die Narkosetiefe.
- Schließen Sie den Molch an einen Multiparameter-Monitor an. Der Monitor misst kontinuierlich die Sauerstoffsättigung (SpO 2), die Pulsfrequenz, das Kohlendioxid (EtCO2), die Atemfrequenz und die Temperatur. Zeichnen Sie die Vitalwerte während des gesamten Eingriffs alle 10 Minuten auf.
- Beurteilen Sie die Tiefe der Anästhesie, indem Sie die Schmerzreflexe mit einem Kneifen der Zehen im Hinterbein testen, bevor Sie mit der Verwundung beginnen.
HINWEIS: Stellen Sie bei Bedarf den Anästhesie-Verdampfer ein, um eine zusätzliche Anästhesie zu verabreichen, oder warten Sie einige Minuten. Kontrollieren Sie die Schmerzreflexe und Lidreflexe während der gesamten Operation regelmäßig.
5. Tierische Vorbereitung für Brandwunden
- Trennen Sie das Schwein vom Anästhesiegerät und legen Sie es auf den Behandlungstisch. Bringen Sie den Molch in die Brustbein-Liegeposition und stellen Sie sicher, dass alle angeschlossenen Leitungen und Schläuche gesichert sind (Abbildung 1C).
- Schließen Sie das Schwein wieder an das Anästhesiegerät an und halten Sie denO2-Wert bis zum Ende des Eingriffs bei 0,8-1,5 l/min und den Isofluran bei 1%-3%.
- Verabreichen Sie dem Schwein intravenöse Flüssigkeiten (LRS) mit einer Tropfrate von 8-10 ml/kg/h. Überwachen Sie die Anästhesie wie in Schritt 4.3 beschrieben.
6. Antiseptische Vorbereitung und Markierung der Hautverbrennungsstelle
- Bereiten Sie den Wundbereich vor, indem Sie sich rasieren und die Haarentfernungscreme auftragen, wie unten beschrieben (Abbildung 2).
- Rasieren Sie den Schweinerücken in einem ca. 25 cm breiten Bereich von der Wirbelsäule bis zur Achselhöhle beidseitig mit einer elektrischen Haarschneidemaschine.
- Tragen Sie die Haarentfernungscreme auf die abgeschnittene Stelle auf und lassen Sie sie 3-7 Minuten einwirken. Entfernen Sie die Creme zusammen mit den Haaren mit sauberen, saugfähigen Handtüchern.
- Vorbereitung der Brandstelle
- Schrubben Sie die zu verwundende Stelle mindestens dreimal ca. 5 Minuten lang abwechselnd mit 2 % Chlorhexidin-Peeling und 70 % Isopropylalkohol. Stellen Sie sicher, dass das Peeling in einem Bullseye-Muster (beginnend in der Mitte und spiralförmig nach außen) vom Personal mit sterilen Handschuhen aufgetragen wird.
- Markieren Sie die Wundstellen mit einer sterilen Verbrennungsschablone und einem chirurgischen Hautmarker (Abbildung 2B). Markieren Sie sechs bis acht Wunden (2 Zoll x 2 Zoll) symmetrisch auf dem Rücken.
- Decken Sie die Bereiche um die markierten Stellen mit einem sterilen Tuch ab, um eine Kontamination zu reduzieren (Abbildung 2C).
7. Verfahren zur Verwundung von Verbrennungen
- Verwenden Sie ein Brenngerät, z. B. einen eigens hergestellten Brenner, der aus einem 2 Zoll x 2 Zoll großen Edelstahlblock (Gewicht: 352 g) besteht, der mit einem Metallstift, einem elektronischen Mikrostat und einer elektronischen Waage (Gesamtgewicht: 1.714 g; Abbildung 3).
- Stellen Sie den Brenner auf die gewünschte Temperatur ein. Stellen Sie die Zieltemperatur für Wunden in voller Dicke auf 150 °C ein (Abbildung 3A). Stellen Sie dazu den Sollwert (SP) am Steuergerät auf 150 °C ein. Stellen Sie den unteren Sollwert auf 145 °C und den oberen Sollwert auf 155 °C ein (Abbildung 1D).
- Erzeugen Sie eine Brandwunde mit voller Dicke von 2 Zoll x 2 Zoll, indem Sie erhitzte Edelstahlblöcke verwenden, die mit dem Brenngerät verbunden sind, und diese 60 s lang auf die Haut legen (Abbildung 3B, C). Verwenden Sie während des Auftragens der Verbrennung die elektronische Waage, um sicherzustellen, dass der Brenner einen gleichmäßigen Druck ausübt.
8. Beurteilung und Bildgebung von Brandwunden
- Digitale Fotografie
- Fotografieren Sie die Wunden mit einer DSLR-Kamera und einem 17-55-mm-Ultraschall-Weitwinkelobjektiv mit Elektrofokus und einer Taschenlampe.
- Machen Sie ein digitales Foto des gesamten Schweinerückens, einschließlich eines Plakats mit der Schweineidentifikation, dem Zeitpunkt und dem Datum. Nehmen Sie dann Bilder für jede Wunde separat auf, auf denen ein Plakat mit der Schweine-ID, der Wund-ID und dem Zeitpunkt sowie ein Lineal zu sehen ist.
- Berechnen Sie die Wundfläche als Prozentsatz der ursprünglichen Wundgröße zu jedem Zeitpunkt der Entnahme bis Tag 56.
ANMERKUNG: In dieser Arbeit wurde die Wundfläche zu jedem Zeitpunkt (d0, d7, d14, d28 und d56) als Prozentsatz der ursprünglichen Wundfläche auf d0 berechnet.
- Laser-Speckle-Bildgebung (LSI)
- Verwenden Sie für die Laser-Speckle-Bildgebung einen Blutperfusions-Imager, der auf der Laser-Speckle-Kontrast-Analyse (LASCA)-Technologie basiert, um die mikrovaskuläre Wundperfusion in Echtzeit zu beurteilen.
- Nehmen Sie die Bilder aller Wunden in einer einzigen Aufnahme auf. Stellen Sie den Messwert des Arbeitsabstands von der Laserkamera zur Wunde so ein, dass er für die Bildgebung jeder Wunde konsistent ist (Abbildung 4A).
- Erfassen Sie die Perfusion durch eine Reihe von Bildern, die über einen Zeitraum von 10-15 s aufgenommen wurden. Nachdem eine Wunde aufgenommen wurde, wird die Aufzeichnung automatisch angehalten, und die Aufzeichnung wird fortgesetzt, sobald die Kamera auf die nachfolgende Wunde eingestellt ist. Jedes Mal, wenn die Aufzeichnung unterbrochen wird, wird eine Markierung hinzugefügt, um die Wunde zu identifizieren.
- Transepidermaler Wasserverlust (TEWL)
- Messen Sie den TEWL für jede Wunde mit einem Standardgerät, einer TEWL-Sonde und einer Software (Abbildung 4B). Legen Sie für jede Wunde eine saubere Sondenabdeckung über die Sondenspitze, die mit dem Wundgewebe in Kontakt kommt.
- Legen Sie die Sonde vorsichtig und gleichmäßig auf die Haut und starten Sie die Messung, indem Sie die Start-Taste am Gerät drücken.
- Messen Sie jede Wunde fünfmal, zuerst in der Mitte und dann an jeder Ecke. Exportieren Sie dann alle Messwerte in eine Tabelle (Abbildung 4B).
- Harmonischer Ultraschall (HUSD)
- Führen Sie eine HUSD-Kartierung durch, indem Sie die Wunde mit einer Ultraschallsonde (US-Sonde) von der Mittellinie (Wirbelsäule) aus in Richtung der seitlichen Seite des Schweins scannen, wo sich wieder normale Haut befindet. Befolgen Sie dieses Scanmuster für jede Wunde sowohl im B-Modus als auch im Gewebeelastographie-Modus mit dem Ultraschallgerät (Abbildung 4C).
- Tragen Sie für das B-Mode-Scannen steriles Ultraschallgel auf den Wundbereich auf und tragen Sie etwas davon auf die hochauflösende Sonde ML-615 auf. Versehen Sie jede Aufnahme mit dem Etikett zur Wundidentifikation. Starten Sie die Aufzeichnung und bewegen Sie die Sonde langsam von der Mittellinie entlang der Wunde, bis die normale Haut auf der anderen Seite erreicht ist.
HINWEIS: Nach Beendigung des Scanvorgangs wird die Aufzeichnung gespeichert und zur Analyse aus dem Gerät exportiert. - Für die Elastographie schalten Sie das Ultraschallgerät in den Elasto-Modus, indem Sie die Elasto-Taste drücken. Scannen Sie die Wunde erneut auf die gleiche Weise wie beim B-Modus-Scannen und stellen Sie sicher, dass der gleichmäßige Druck der Sonde aufrechterhalten wird, damit der Elastographie-Farbindikator (grüne Balken) während der gesamten Aufnahme sichtbar bleibt.
HINWEIS: Der geeignete Druck kann durch die Skalenleiste auf der Aufzeichnung bestimmt werden, die grün erscheint, wenn der richtige Kontakt hergestellt wird (Abbildung 4D). - Ändern Sie die Anmerkung, nachdem jede Wunde sowohl im B-Modus als auch im Elasto-Modus (zwei Aufzeichnungen pro Wunde) abgebildet wurde. Ändern Sie den Kommentar in der Software so, dass er die Informationen für die nächste Wunde enthält, und wiederholen Sie den Vorgang für die nachfolgenden Wunden.
- Tragen Sie für das B-Mode-Scannen steriles Ultraschallgel auf den Wundbereich auf und tragen Sie etwas davon auf die hochauflösende Sonde ML-615 auf. Versehen Sie jede Aufnahme mit dem Etikett zur Wundidentifikation. Starten Sie die Aufzeichnung und bewegen Sie die Sonde langsam von der Mittellinie entlang der Wunde, bis die normale Haut auf der anderen Seite erreicht ist.
- Führen Sie eine HUSD-Kartierung durch, indem Sie die Wunde mit einer Ultraschallsonde (US-Sonde) von der Mittellinie (Wirbelsäule) aus in Richtung der seitlichen Seite des Schweins scannen, wo sich wieder normale Haut befindet. Befolgen Sie dieses Scanmuster für jede Wunde sowohl im B-Modus als auch im Gewebeelastographie-Modus mit dem Ultraschallgerät (Abbildung 4C).
9. Verband und Verband
- Decken Sie die Brandwunden einzeln mit transparenten Folienverbänden oder dem Testverband ab (Abbildung 5A, B). Legen Sie einen größeren transparenten Folienverband über die gesamte Wundfläche (Abbildung 5C).
- Tragen Sie eine zweite Schicht Rollgaze locker um den gesamten Rumpf des Schweins auf, um das flüssige Exsudat aus den Wunden aufzusaugen. Rollen Sie das Schwein von der Seite bis leicht auf dem Rücken hin und her, um das Verbandsmaterial um das Schwein zu wickeln.
- Decken Sie die Gaze locker mit einer Schicht flexibler elastischer Binde ab (Abbildung 5D). Achten Sie darauf, dass der Verband nicht zu eng sitzt, da ein zu festes Anlegen die Atmung einschränken und Druck auf den Bauch ausüben kann, was zu einem Rektumprolaps oder verschiedenen Komplikationen führen kann.
HINWEIS: Die elastische Binde ist dehnbar und kann während der Anwendung leicht zu fest angezogen werden. Ziehen Sie es von der Rolle und lassen Sie es über den Rand des vorherigen Wickels legen, um ein zu starkes Anziehen zu verhindern. - Decken Sie den elastischen Verband mit einer letzten Schicht von 4 Stück elastischem Band ab (Abbildung 4E). Achten Sie auch hier darauf, dass die Anwendung nicht zu eng ist, aber stellen Sie sicher, dass der Verband am oberen und unteren Rand befestigt ist, um zu verhindern, dass er herunterrutscht, wenn sich das Schwein nach dem Eingriff bewegt.
10. Genesung und Nachsorge des Tieres
- Genesung
- Beenden Sie das Anästhesiegas nach Abschluss der Verwundung, des bildgebenden Verfahrens und des Verbandes. Lassen Sie das Schwein mindestens 5 Minuten lang mit Sauerstoff versorgt werden.
- Bringen Sie das Schwein nach der Rückkehr in das Hauptgehege vom Transport-/Hubtisch auf eine Schaumstoffrückgewinnungsmatte im Käfig. Heben Sie die automatische Tränke an und entfernen Sie den J-Feeder, um Verletzungen des Schweins während der Erholung zu vermeiden.
- Decken Sie das Schwein mit Decken (einschließlich einer Warmluftdecke) ab, wenn eine Unterkühlung vorliegt. Überwachen und zeichnen Sie alle 10-15 Minuten die Vitalwerte einschließlich Temperatur, Puls, Atemfrequenz und SpO2 auf.
- Überwachen Sie das Schwein kontinuierlich, bis es in der Lage ist, das Brustbein selbstständig aufrechtzuerhalten. Sobald sich das Schwein vollständig erholt hat, senken Sie die Nippeltränke ab, und dann kann auch das Schwein gefüttert werden.
- Beurteilung der Schmerzen
- Führen Sie eine postoperative Schmerzbeurteilung mit einem modifizierten Glasgow-Schmerzbewertungsformular durch. Stellen Sie sicher, dass die Schmerzbeurteilungen in den ersten 3-4 Tagen nach der Operation mindestens alle 12 Stunden von Labor- oder LARC-Mitarbeitern durchgeführt werden. Die Häufigkeit der Schmerzbewertung wird vom behandelnden Tierarzt festgelegt. Wenn der Wert des Tieres über 5 liegt, ist eine Notfallanalgesie (Buprenorphin oder Hydromorphon) zu verabreichen.
- Analgesie durch Verabreichung einer Dosis Buprenorphin 0,01-0,05 mg/kg i.m. vor dem Eingriff, wobei eine zweite Dosis 8-12 Stunden später verabreicht wird.
- Legen Sie ein Fentanyl-Pflaster (100 μg/h) vor der Brandwunde auf die Ohrmuschel.
- Injizieren Sie Carprofen 4 mg/kg i.m. oder SQ vor dem Eingriff und dann einmal täglich IM, SQ oder PO für 2 Tage oder nach Anweisung des LARC-Tierarztes.
- Verabreichen Sie Gabapentin 3-10 mg/kg oral, wobei eine Dosis am Tag vor dem Eingriff, am Morgen des Eingriffs, am Abend nach dem Eingriff und dann alle 12 Stunden für 3-5 Tage verabreicht wird.
- Diät
- Stellen Sie sicher, dass sich die Schweine erholen, und gewähren Sie dann zweimal täglich freien Zugang zu Wasser und Futter entsprechend ihrer gewichtsabhängigen Ration.
- Sorgen Sie für eine Anreicherung der Lebensmittel (frisches Obst und Gemüse, gefrorenes Obst, Marshmallows, Joghurt, Pudding usw.) und verwenden Sie diese, um zum Essen zu verleiten, wenn ein verminderter Appetit beobachtet wird.
- Verbandswechsel
- Wechseln Sie die Verbände mindestens einmal wöchentlich oder öfter, wenn die Verbände verschmutzt sind oder um Behandlungsstrategien zu berücksichtigen.
- Wechseln Sie die Verbände nach der Bildgebung noch unter Narkose oder sedieren Sie das Schwein nur mit TKX für einen Verbandswechsel.
- Um den Verband zu ersetzen, entfernen Sie den verschmutzten Verband zunächst vorsichtig mit einer Lister-Verbandschere oder einer Traumaschere, wobei Sie darauf achten sollten, dass die Außenseite des Verbandes nicht mit den Wunden in Berührung kommt.
- Reinigen Sie den Bereich um die Wunden bei Bedarf mit 0,9 % NaCl auf sauberer Gaze und trocknen Sie den Bereich vorsichtig ab. Befolgen Sie die in Abschnitt 9 beschriebenen Schritte zum Verbinden von Verbänden.
HINWEIS: Wenn experimentelle Verbände angelegt werden, können diese vor dem Abdecken der Wunden mit dem transparenten Filmverband angelegt werden.
- Häufigkeit der Bildgebung
- Erhalten Sie Bildgebung (Digitalfotos, LSI, TEWL und HUSD) zu verschiedenen Zeitpunkten während der Studie. Sammeln Sie Bildgebungsdaten an Tag −3 (Brandwunde), Tag 0 (Impfung) und Tag 7, Tag 14, Tag 28, Tag 35 und Tag 56 nach der Impfung.
11. Biofilmpräparation und -impfung
- Inokulum-Präparat
- Bereiten Sie eine Starterplatte aus einem Glycerin-Gefrierschrank von Pseudomonas aeruginosa (PA01) für eine Reinkultur des Bakteriums vor. Züchten Sie eine P. aeruginosa-Kultur in salzarmem Luria-Bertani-Agar (LBA) und inkubieren Sie sie bei 37 °C über Nacht.
- Am nächsten Tag werden 5 ml salzarme Luria-Bertani-Bouillon (LBB) mit einer einzelnen P. aeruginosa-Kolonie geimpft und über Nacht bei 37 °C unter Schütteln bei 200 U/min inkubiert.
- Um Log-Phase-Zellen zu erhalten, werden 200 μl der Übernachtkultur in 5 ml LBB inokuliert und im Schüttler bei 200 U/min bei 37 °C für 2,5 h inkubiert.
- Messen Sie die optische Dichte bei 600 nm (OD600) mit einem Spektralphotometer. Bereiten Sie serielle Verdünnungen bis zu 1 x 10−9 unter Verwendung von 100 μl aus der Kultur in 900 μl sterilem LBB vor.
ANMERKUNG: Wir begannen mit unverdünnten Proben und endeten mit 1 x 10 7 KBE/ml.Wir erhielten zählbare Kolonien in der 1 x 107-Verdünnung, so dass wir diese Verdünnung als Endverdünnung betrachteten. - 100 μl jeder Verdünnung auf LBA verteilen und über Nacht bei 37 °C inkubieren. Verwenden Sie gemäß den mikrobiologischen Standardprotokollen Verdünnungen, die zählbare Kolonien (30-300) für die Koloniezählung zeigen, und erhalten Sie die koloniebildenden Einheiten (KBE).
- Inokulation der Wunde
- 200 μl aus der Übernachtkultur in 5 ml LB-Brühe intubiert und im Schüttler bei 37 °C für 2,5 h inkubiert.
- Messen Sie die optische Dichte der Tageskultur bei 600 nm (OD600). Für die PA01-Inokulation sind 3 x 10 8 KBE/ml zu verwenden (250 μl von 1 x 108 KBE/ml PA01 werden pro Wunde geimpft). Transportieren Sie das Inokulum in einem Biohazard-Behälter zur Tierstation.
- Verteilen Sie das Inokulum am Tag 3 nach der Verbrennung mit einer Pipette auf der Oberfläche der exponierten Wunden und verteilen Sie es gleichmäßig mit einem Einwegstreuer (Abbildung 6). Halten Sie die Wunden ca. 15 Minuten lang offen, bevor Sie sie verbinden.
HINWEIS: Alle chirurgischen Eingriffe, Impfungen, Gewebebiopsien, Bildgebung und Verbände werden unter Vollnarkose durchgeführt, wie in den Abschnitten 3 und 4 beschrieben.
- Bestätigung der Etablierung einer Infektion
HINWEIS: Um zu bestätigen, dass sich die Wunden nach der Inokulation erfolgreich infiziert haben, werden verschiedene Ansätze verwendet und Wundproben mit Proben von normaler Haut verglichen. Im Folgenden finden Sie einige Beispiele.- Für die pathologiebasierte Analyse von Proben, die zu verschiedenen Zeitpunkten entnommen wurden, wird die Anzahl der koloniebildenden Einheiten verwendet, um eine Infektion (KBE; Abbildung 7E, F).
- Entnehmen Sie 6 mm Wundgewebe durch Stanzbiopsie. Etikettieren und wiegen Sie leere 5-ml-Röhrchen mit rundem Boden. Übertragen Sie die Proben in die Röhrchen und wiegen Sie die Röhrchen mit den Proben.
- Würfeln Sie das Gewebe mit einem Skalpell auf einer sterilen Oberfläche. Führen Sie alle Schritte in einer BSL2-Haube durch.
HINWEIS: Um sicherzustellen, dass das Gewebe leicht homogenisiert werden kann, sollte die Größe sehr klein sein (aber nicht weniger als 0,5 mm) - Geben Sie die Probe in das Röhrchen und fügen Sie 1 ml PBS hinzu. Mischen und zerkleinern Sie das Gewebe mit einer Hartgewebsschleifsonde.
- Das Homogenat wird seriell (unverdünnt auf 1 x 10−5) verdünnt und 50 μl jeder Verdünnung in selektiven (Pseudomonas Isolation Agar, PIA) und nichtselektiven (LBA) Medien aufgetragen.
- Alle Verdünnungen werden unter aeroben Bedingungen bei 37 °C für 18-24 Stunden inkubiert. Stellen Sie die Platten mit den richtigen Lichtverhältnissen ab.
- Wählen Sie Platten mit 30-300 Kolonien aus, wenn keine der Platten diese Konzentration erreicht hat, verwenden Sie die unverdünnte Platte. Verwenden Sie BildJ, um die Anzahl der Kolonien zu zählen, und berechnen Sie die KBE pro Platte, indem Sie den Durchschnittswert mit dem endgültigen Verdünnungsfaktor multiplizieren.
- Erfassen Sie die Bilder von Proben, die am Tag 7 nach der Inokulation und zu anderen Zeitpunkten entnommen wurden, mit Hilfe der Rasterelektronenmikroskopie (REM), um das Vorhandensein der bakteriellen Biofilme zu bestätigen (Abbildung 7G).
ANMERKUNG: Tag 7 nach der Inokulation wurde gewählt, weil es der Tag der Etablierung der Biofilminfektion und des Beginns der Erweichung des Verbrennungsschorfes ist, was das Eindringen der US-Wellen und damit die Visualisierung des tieferen Gewebes ermöglicht. Sehen Sie sich in Abbildung 4 das Bild der Brandwunde von Tag 3 in den USA an, das den dicken, ledrigen Schorf zeigt, der verhindert, dass die US-Wellen in das tiefere Gewebe eindringen. - Die Schnitte der Wundbiopsien werden mit spezifischen Antikörpern gegen P. aeruginosa gefärbt, um das Vorhandensein der spezifischen Bakterien zu bestätigen, wie in einer früheren Veröffentlichung13 gezeigt (Abbildung 7H).
- Führen Sie Next-Generation-Sequencing (NGS) durch, wie in Sinha et al.31 veröffentlicht. Quantifizieren Sie die bakterielle 16srRNA aus den infizierten Wunden und den normalen, nicht infizierten Hautproben, die zu verschiedenen Zeitpunkten entnommen wurden, beginnend am Tag 7 nach der Inokulation bis zum Ende der Studie.
- Für die pathologiebasierte Analyse von Proben, die zu verschiedenen Zeitpunkten entnommen wurden, wird die Anzahl der koloniebildenden Einheiten verwendet, um eine Infektion (KBE; Abbildung 7E, F).
12. Entnahme von Biopsien
- Entnehmen Sie die Gewebebiopsien zur Analyse nach der Bildgebung an Tag 7, Tag 14, Tag 28 und Tag 56 nach der Impfung. Entnehmen Sie Biopsien aus jeder Wunde nur einmal, um die Störung des Heilungsprozesses zu minimieren.
HINWEIS: Alle chirurgischen Eingriffe, Impfungen, Gewebebiopsien, Bildgebung und Verbände werden unter Vollnarkose durchgeführt, wie in den Abschnitten 3 und 4 beschrieben.- Infiltrieren Sie den Bereich um die Wunde mit 0,5% Bupivacain. Schneiden Sie mit einem Einwegskalpell mit einer Klinge der Größe 10 einen 3-4 mm breiten Streifen von einem Rand der Wunde zum anderen, wobei Sie auf beiden Seiten kleine Ränder normaler Haut beibehalten. Legen Sie den Streifen zur Fixierung in ein beschriftetes konisches Röhrchen, das mit 4% gepuffertem Formalin gefüllt ist.
HINWEIS: Bei frühen Bildgebungs- und Biopsieverfahren wird während der chirurgischen Vorbereitung eine volle Dosis Buprenorphin verabreicht. Bei späten Biopsieverfahren wird während der chirurgischen Vorbereitung eine halbe Dosis Buprenorphin verabreicht. Nach allen Verbrennungen und Biopsieverfahren wird Gabapentin nach Anweisung des behandelnden Tierarztes bis zu 7 Tage lang BID verabreicht. Carprofen wird tagelang nach der Operation oder nach Anweisung des behandelnden Tierarztes verabreicht. - Schneiden Sie eine 6-mm-Stanzbiopsie aus der Wunde (entweder vom Wundbett oder vom Wundrand). Entnehmen Sie vom Wundrand, einschließlich eines Teils der normalen Haut und des Wundbetts, für verschiedene Arten von Analysen.
- Entnehmen Sie die Probe mit einer sterilisierten Pinzette und einer Präparierschere. Geben Sie die Biopsieprobe zur Verarbeitung und Analyse in das entsprechende Röhrchen oder die entsprechende Kassette.
- Für CFU, REM, RNA und FPPE werden die Proben in Röhrchen mit einem geeigneten Puffer aufbewahrt. Zum Beispiel können Proben in Kassetten für die Lasereinfangmikroskopie (LCM) und Immunhistochemie (IHC) in OCT gegeben werden.
- Erreichen Sie die Hämostase nach der Entnahme der Proben, indem Sie die Wunde vorsichtig mit einer sterilen Gaze drücken. Decken Sie die Wunde mit einem nicht haftenden Verband ab und verbinden Sie sie wie in Abschnitt 9 beschrieben.
- Infiltrieren Sie den Bereich um die Wunde mit 0,5% Bupivacain. Schneiden Sie mit einem Einwegskalpell mit einer Klinge der Größe 10 einen 3-4 mm breiten Streifen von einem Rand der Wunde zum anderen, wobei Sie auf beiden Seiten kleine Ränder normaler Haut beibehalten. Legen Sie den Streifen zur Fixierung in ein beschriftetes konisches Röhrchen, das mit 4% gepuffertem Formalin gefüllt ist.
13. Euthanasie und Gewebeentnahme
- Betäuben Sie das Schwein am Tag der Euthanasie mit TKX und betäuben Sie es mit Isofluran. Legen Sie einen intravenösen Katheter in die marginale Ohrvene, indem Sie die in Abschnitt 3 beschriebenen Schritte befolgen. Intubieren Sie das Schwein gemäß den Schritten in Abschnitt 4.
- Entfernen Sie den Verband, sobald das Schwein betäubt ist, und reinigen Sie den Bereich um die Wunden.
- Vollständige digitale Fotografie, LSI-, TEWL- und HUSD-Bildgebung. Entnehmen Sie die Proben aus den Wunden und der normalen Haut, indem Sie die in Abschnitt 12 beschriebenen Schritte befolgen.
- Sobald alle erforderlichen Proben entnommen sind, wird das Schwein noch unter Narkose durch eine intravenöse Injektion einer handelsüblichen Euthanasielösung (Natrium-Pentobarbital) auf humane Weise eingeschläfert. Verwenden Sie ein Stethoskop zur Auskultation, um den Stillstand des Herzschlags und die spontane Atmung zu bestätigen.
- Führen Sie eine sekundäre Euthanasiemethode durch, wie sie von SOM IACUC gefordert wird, indem Sie ein Skalpell verwenden, um einen Pneumothorax zu induzieren. Den Schweinekadaver in ein Fass umfüllen und zum Gefrierschrank transportieren, wo er zur Verbrennung abgeholt wird.
Ergebnisse
Mit einem standardisierten Verbrennungsgerät wurden bei 150 °C für 1 Minute Brandwunden in voller Dicke erzeugt, was zu einer homogenen tiefen Verbrennung mit einem gleichmäßigen Erythem- und Entzündungsrand führte (Abbildung 3 und Abbildung 7). Jedes Schwein erlitt acht Brandwunden in voller Dicke auf dem Rücken, wie in Abbildung 3C dargestellt.
Die nicht-invasive Echtzeit-Beurteilung der Brandwunden mittels hochauflösendem B-Mode-Ultraschall zur Bestätigung der Wundtiefe und des Wundheilungsverlaufs über die Zeit zeigte die Zerstörung aller Hautschichten bis hin zum Unterhautfettgewebe (Abbildung 4). Das Laser-Speckle-Imaging (LSI) wurde zur weiteren Charakterisierung der Wundperfusion eingesetzt (Abbildung 4A).
Die Brandwunden zeigten am 7. Tag nach der Inokulation eine dicke pyogene Membran auf der Wundoberfläche, was die Infektion und die Etablierung des Biofilms der Brandwunde bestätigte (Abbildung 7A). Die digitale Planimetrie zeigte eine vergrößerte Wundfläche am Tag 3 nach der Inokulation mit PAO1 aufgrund der Entzündungsreaktion an der Wundstelle und den Rändern (Abbildung 7A,B). Obwohl die Wundfläche am 14. Tag nach der Inokulation zu schrumpfen begann, wurde an Tag 56 eine unvollständige Heilung auf etwa 25 % der ursprünglichen Wundgröße beobachtet, was auf die Chronizität der Wunden hindeutet (Abbildung 7B). Die Wundchronizität und die gestörte Wundheilung wurden auch durch den TEWL bestätigt, der einen hohen transepidermalen Wasserverlust zeigte. Die TEWL-Ergebnisse spiegelten den Verlust der Hautbarrierefunktion im Vergleich zu normaler Haut zu allen gemessenen Zeitpunkten wider und wiesen somit auf eine funktionelle Beeinträchtigung der Brandwundheilung hin (Abbildung 7B). Dies wurde auch durch die Suppression der Tight-Junctional-Proteine ZO-1 und 213 und die Beeinträchtigung der Wiederherstellung der Hautbarrierefunktion bestätigt, was sich in den hohen TEWL-Werten an Tag 35 (Mitte) und Tag 56 (spät) trotz visuellem Wundverschluss widerspiegelt (Abbildung 7I).
Die Verbrennungstiefe wurde durch H&E-Färbung weiter validiert, die eine Verzerrung und Nekrose aller histologischen Hautschichten zeigte, wie in Abbildung 7C dargestellt. Der etablierte Biofilm von PA01 wurde am Tag 7 nach der Inokulation durch KBE (Abbildung 7E,F), REM-Bildgebung (Abbildung 7G) und Immunfluoreszenzfärbung (Abbildung 7H) weiter validiert.

Abbildung 1: Aufbau des Eingriffs . (A) Vorbereitung des OP-Tisches. (B) Kanülierung der Ohrvenen für IV-Flüssigkeiten und Medikamentenverabreichung. (C) Wärmedeckenabdeckung zum Schutz des Schweins vor Unterkühlung während des Eingriffs. (D) Brenner- und Timer-Einstellung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
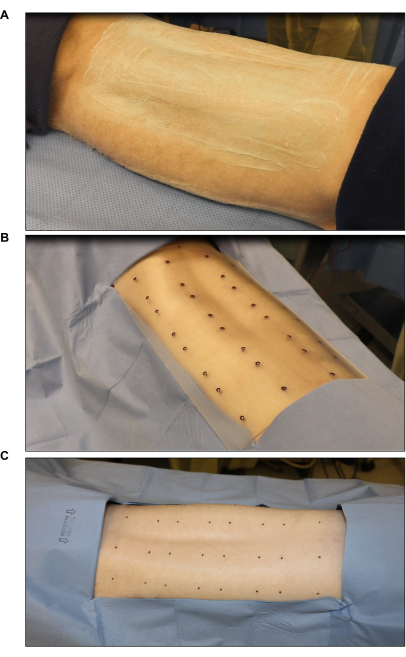
Abbildung 2: Sterilisation und Markierung an der Operationsstelle . (A) Haarschneiden und Sterilisation. (B) Markierung der Verbrennungsstelle mit einer sterilen Standardschablone für acht Wunden (jede Wunde ist 2 Zoll x 2 Zoll groß). (C) Abschließende Markierung mit einem sterilen Hautmarker. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
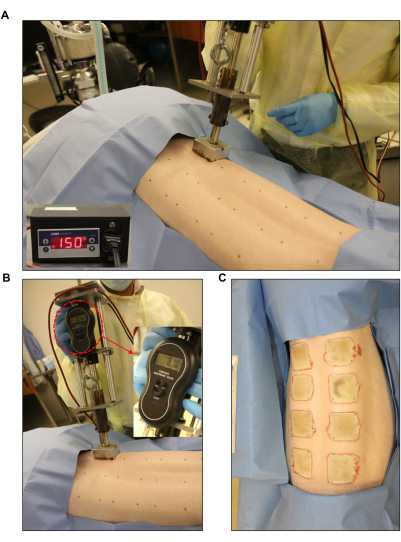
Abbildung 3: Induktion von Brandwunden. (A,B) Standardisierter Brenner mit einem Manometer und einer automatischen Steuereinheit (2 Zoll x 2 Zoll), die an der vormarkierten Wundstelle angebracht ist. (C) Der ganze Rücken zeigt die acht Brandwunden in voller Dicke. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
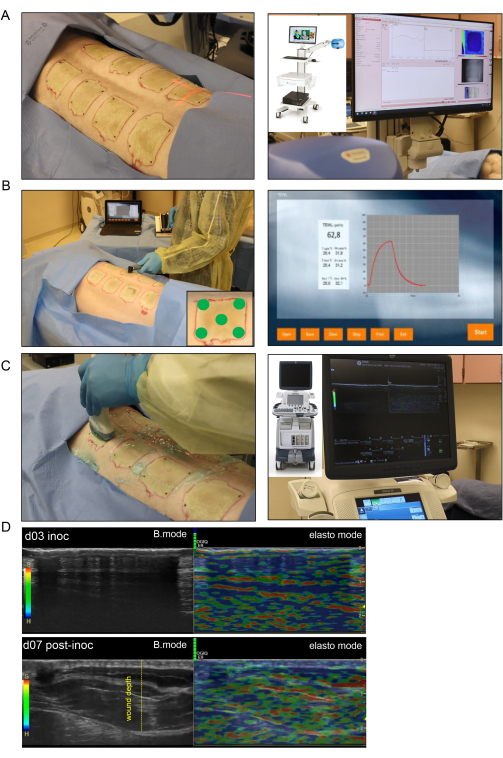
Abbildung 4: Nichtinvasive Bildgebung und Beurteilung von Brandwunden. (A) Laser-Speckle-Bildgebung (LSI) mit korrekter Ausrichtung des Laserstrahlindikators zur Mitte der Wunde ist im linken Bild dargestellt; Das rechte Bild zeigt das LSI-Gerät und die Echtzeit-Gefäßperfusionskarte der Haut. (B) Die Anwendung der Sonde für den transepidermalen Wasserverlust (TEWL) an fünf verschiedenen Stellen (vier Wundecken und die Mitte im Bild in der unteren rechten Ecke) ist im linken Bild dargestellt; Das Bild auf der rechten Seite ist ein repräsentativer Echtzeit-Bildschirm der TEWL-Messung. (C) Auf der linken Seite ist eine harmonische Ultraschalluntersuchung der Brandwunde mit einer hochauflösenden 16-MHz-Ultraschallsonde dargestellt. Das rechte Bild zeigt das Ultraschallgerät und die Echtzeit-Bildschirmaufzeichnung. (D) Strukturelle (B-Mode-Bilder, Graustufen-Ultraschall) und biomechanische (Elastographie, Farbultraschall) Bilder der Brandwunde am Tag und Tag 7 nach der Inokulation. Die Wundtiefe wird durch die gelb gestrichelte Linie angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
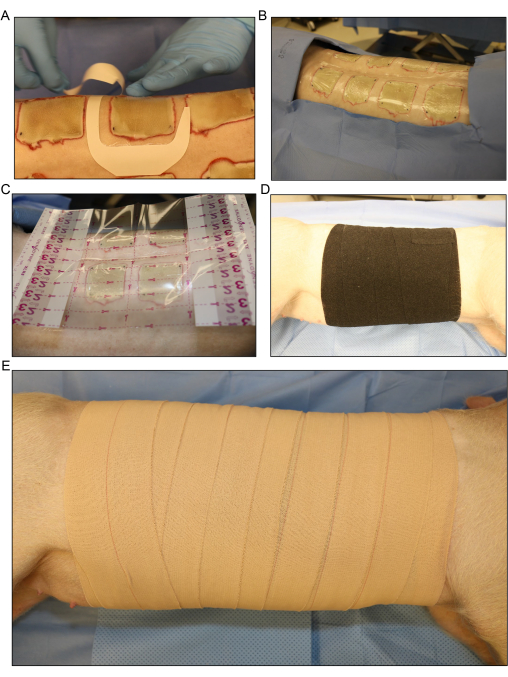
Abbildung 5: Wundauflage und Verband . (A) Anlegen des transparenten Folienverbandes für jede Wunde separat. (B) Alle dorsal inokulierten Brandwunden werden mit der ersten Schicht des Verbandes abgedeckt. (C) Ein größerer transparenter Filmverband wird über die gesamte Wundfläche gelegt. (D) Auftragen der zweiten Schicht Gaze und einer losen Schicht dehnbarer elastischer Binde um den gesamten Rumpf des Schweins, um das flüssige Exsudat, das aus den Wunden kommt, zu absorbieren. (E) Abdecken der gesamten Wundfläche mit einer abschließenden 4-fach-Schicht in einem selbstklebenden Verband. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
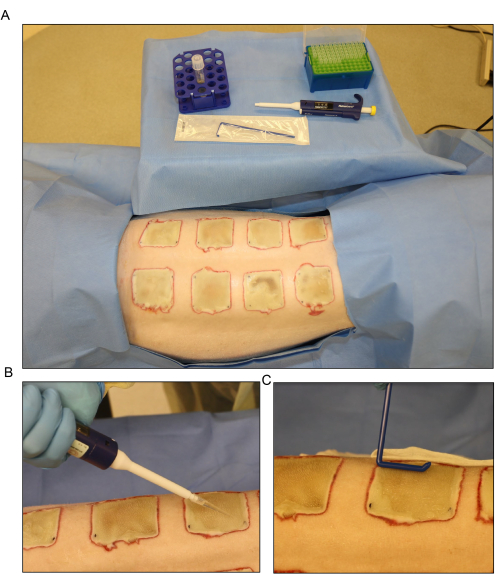
Abbildung 6: Bakterielle Inokulation . (A) Aufbau für die Injektion von Pseudomonas aeruginosa (PA01) am Tag 3 nach der Verbrennung. (B) Topische Anwendung des Inokulums mit einer Pipette unter Verwendung eines Volumens von 500 μl für jede Wunde. (C) Das Inokulum wird mit einem sterilen Einwegstreuer gleichmäßig über die Wundoberfläche verteilt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
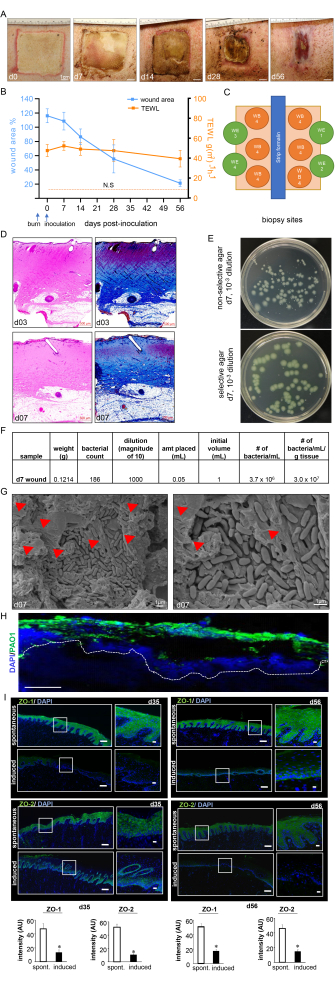
Abbildung 7: Wundheilungsfortschritt und Biofilm-Bestätigung. (A) Repräsentative Bilder des Wundverschlusses über den Zeitraum der Studie. Maßstabsbalken = 1 cm. (B) Quantifizierung der Wundfläche und TEWL-Messungen über den Zeitraum der Studie (n = 6). Die Daten werden als Mittelwert ± SD dargestellt. NS bezieht sich auf den TEWL-Wert normaler Haut. (C) Schematische Darstellung verschiedener Wundbiopsiestellen. D. Die H&E-Färbung mit der entsprechenden Masson-Trichrom-Färbung zeigt eine Verzerrung und Nekrose aller Hautschichten am Tag 3 nach der Verbrennung und am Tag 7 nach der Inokulation. Maßstabsbalken = 500 μm. (E) Repräsentative digitale Bilder von nicht-selektivem Agar (Luria-Bertani-Agar) und selektivem Agar (Pseudomonas-Isolationsagar) mit Bakterienkolonien, die aus Schweinewundgürtelgewebe gezüchtet wurden. Das selektive Medium ermöglicht nur die genaue Zählung der PA01-Kolonien. (F) Es wird eine Berechnung der koloniebildenden Einheit (KBE) aus den Koloniezahlen der verarbeiteten Wundbiopsien am Tag 7 nach der Inokulation gezeigt. (G) Repräsentative Rasterelektronenmikroskopie-Aufnahmen (REM) der inokulierten Brandwunden am Tag 7 nach der Inokulation zeigen den etablierten PA01-Biofilm mit einem vergrößerten Bild auf der rechten Seite. Maßstabsleiste = 1 μm. Die roten Pfeilspitzen weisen auf extrazelluläre polymere Substanzen (EPS) hin. (H) P. aeruginosa auf den Brandwunden wurden mit Anti-Pseudomonas-Antikörpern (grün) visualisiert; Die Immunfluoreszenzbilder der Wundbiopsien von Tag 7 nach der Inokulation zeigen eine starke Besiedlung des Wundgewebes durch P. aeruginosa. Maßstabsbalken = 100 μm. (I) Repräsentatives Mosaik (Maßstabsbalken = 200 μm) und entsprechende vergrößerte (Maßstabsbalken = 50 μm) von ZO-1- und ZO-2-gefärbten Schnitten an Tag 35 und Tag 56 nach der Inokulation, die eine reduzierte Expression der Proteine nach der induzierten Infektion zeigen. Die OCT-eingebetteten Gefrierschnitte (10 μm) wurden mit Anti-ZO-1 (grün) oder Anti-ZO-2 (grün) gefärbt. Die Schnitte wurden mittels DAPI gegengefärbt. Die Balkendiagramme zeigen die Quantifizierung der ZO-1- und ZO-2-Signalintensität. Die Daten werden als Mittelwert ± SD (n = 3) dargestellt; * p < 0,05 im Vergleich zu spontanen. Um die Signifikanz zu testen, wurde eine Mann-Whitney- oder Kruskal-Wallis-Einweganalyse von Varianztests durchgeführt. Abbildung 7H,I wurde von Roy et al.13 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieser Bericht enthält ein detailliertes Protokoll für die Erstellung eines Schweinemodells für chronische Wundbiofilminfektionen für experimentelle Studien. Mehrere Schweine-Biofilm-Modelle wurden zuvor beschrieben 22,23,24,25,26, aber keines davon sind Schweinemodelle mit 8-wöchigen Langzeitstudien. Chronische Wunden sind solche, die 4 Wochen oder länger offen bleiben 14,27,28. In der Literatur gibt es keine anderen Biofilmmodelle für chronische Wunde. Diese Arbeit befasst sich mit dem Begriff des funktionellen Wundverschlusses 2,7,13,15,17,29. Eine Studie aus dem Jahr 2014 war die erste, die berichtete, dass sich mit Biofilm infizierte Wunden schließen können, ohne dass die Barrierefunktion wiederhergestellt wird7. In dieser Arbeit wird über die Messung der Hautbarrierefunktion in der heilenden Wunde mittels transepidermalem Wasserverlust (TEWL) berichtet.
Anatomisch und physiologisch ist die Schweinehaut im Vergleich zur Haut anderer Kleintiere der menschlichen Haut näher 32,33,34. Sowohl die Haut von Schweinen als auch von Menschen hat eine dicke Epidermis 33, und das Verhältnis von dermaler und epidermaler Dicke liegt beim Schwein zwischen 10:1 und13:1, was mit dem des Menschen vergleichbar ist34,35. Histologisch und biomechanisch zeigt die Haut von Menschen und Schweinen Ähnlichkeiten in den Rete-Leisten, dem subdermalen Fett, dem dermalen Kollagen, der Haarverteilung, den Adnexstrukturen sowie der Größe und Verteilung der Blutgefäße36,37,38. Funktionell weisen sowohl Schweine als auch Menschen Ähnlichkeiten in der Zusammensetzung der Lipid-, Protein- und Keratinkomponenten der Epidermisschicht sowie vergleichbare immunhistologische Muster auf37,38. Das Immunsystem von Schweinen weist im Vergleich zu anderen Kleintieren größere Ähnlichkeiten mit dem menschlichen Immunsystem auf, was bedeutet, dass Schweine ein geeignetes Modell für Studien zu den Wirtsinteraktionen sind, die für die Komplexität des pathologischen Biofilms bei Wundinfektionen von wesentlicher Bedeutung sind39. Die kritische Abwägung der Vor- und Nachteile verschiedener Tiermodelle hat zu dem Konsens geführt, dass Schweine ein effizientes Modell zur Untersuchung der Wundheilung darstellen34,38. Darüber hinaus entwickeln Hausschweine spontan chronische bakterielle Infektionen, wie sie beim Menschen beobachtet werden10. Die Verbrennungsvorrichtung, die zur Erzeugung der Wunden verwendet wird, ist eine fortschrittliche und automatisierte Verbrennungsvorrichtung, die Wärmeenergie auf der Grundlage einer Temperatur abgibt, die von der Zielhautstelle22,40 ausgelesen wird. Ein solcher Ansatz verbessert die Strenge und Reproduzierbarkeit der Brandverletzung. Die Verwendung von humanen klinischen Bakterienisolaten zur Infektion der Schweinewunden stellt einen Mehrwert als präklinisches Modell dar.
Brandverletzungen sind komplex und verursachen mehrere systemische Störungen20,41. Daher ist es wichtig, das Schwein mit ausreichender Flüssigkeit wiederzubeleben und eine Unterkühlung während der Narkose und Genesung zu verhindern. Mehrere Faktoren können die Wundheilung beeinträchtigen, darunter die Ernährung nach der Verbrennung, Flüssigkeiten und Schmerzen42. Daher ist eine engmaschige Überwachung der Ernährungs- und Schmerzbeurteilungen von Bedeutung. Schmerzen nach Verbrennungen können stark sein und das Verhalten und die Ernährung des Tieres beeinflussen. Interventionen zur Bewältigung von Verhaltensproblemen müssen aktiv in Betracht gezogen werden. Eine regelmäßige und kontinuierliche Schmerzbewertung und -behandlung ist unerlässlich. Ein gründlicher Schmerzbeurteilungsbogen mit einem sehr detaillierten Schmerzbehandlungsplan ist in diesem Protokoll enthalten. Um eine Kreuzkontamination zwischen den Wunden zu vermeiden, sollte besonders darauf geachtet werden, die erste Schicht des Verbandes auf jede Wunde separat aufzutragen. Beim Umgang mit allen biogefährlichen Stoffen und bei der gründlichen Desinfektion der Geräte, Werkzeuge und des gesamten Operationssaals ist besondere Vorsicht geboten. Das Auftragen mehrerer Schichten des Verbandes verhindert, dass das Schwein die Wunden freilegt, während es versucht, den juckenden Rücken zu reiben oder zu kratzen.
Das Schwein im aktuellen Modell war nicht durch zugrunde liegende Stoffwechselstörungen (z. B. Diabetes) beeinträchtigt, und daher war der untersuchte Effekt ausschließlich der Einfluss der bakteriellen Biofilminfektion auf die Wundheilung. Das Modell eignet sich jedoch für die Induktion von Diabetes (z. B. mit Streptozotocin) und könnte verwendet werden, um Biofilminfektionen in Bezug auf eine zugrunde liegende Stoffwechselstörung zu untersuchen. Die andere Einschränkung des Modells ist die kontrollierte Infektion mit dem Bakterium P. aeruginosa. Es wird erwartet, dass auch die normale Hautflora des Schweins in der Wunde wächst und die Heilung beeinträchtigen könnte. Eine weitere Analyse mit NGS oder anderen fortschrittlichen Techniken zur Abgrenzung des mikrobiellen Inhalts der Wunde ist erforderlich. Das aktuelle Modell könnte auch auf Mischinfektionen mit unterschiedlichen mikrobiellen Spezies (z.B. Pilze, Viren etc.) angewendet werden. Dies ist ein wichtiges Element, da klinisch relevante Wunden wahrscheinlich von gemischten Mikroben besiedelt werden, was die Wundheilung unterschiedlich beeinflussen kann.
Dieses Modell bietet viele potenzielle Vorteile, darunter die Ähnlichkeit mit der Komplexität und den Langzeitfolgen chronischer Wunden beim Menschen, der automatisierte und reproduzierbare Verbrennungsprozess und die Verwendung klinisch isolierter Bakterienarten. Die Verwendung mehrerer nicht-invasiver Bildgebungsmodalitäten stellt einen leistungsstarken Ansatz dar, um nützliche physiologische Daten zur Charakterisierung der Wunde zu sammeln. Schließlich ist die Beurteilung der funktionellen Wundheilung über die Wiederherstellung der Hautbarrierefunktion auf Basis von TEWL entscheidend. Zusammenfassend wird in dieser Arbeit ein robustes, einfaches, detailliertes und leicht anzuwendendes Protokoll zur Entwicklung einer Biofilm-infizierten schweren Verbrennungsverletzung unter Verwendung eines porcinen Modellsystems gezeigt.
Offenlegungen
Die Autoren erklären, dass es keine konkurrierenden Interessen gibt.
Danksagungen
Wir danken dem Laboratory Animal Resource Center (LARC) der Indiana University für die Unterstützung und die tierärztliche Betreuung der Tiere während der Studie. Diese Arbeit wurde teilweise durch die National Institutes of Health Grants NR015676, NR013898 und DK125835 und den Zuschuss W81XWH-11-2-0142 des Verteidigungsministeriums unterstützt. Darüber hinaus profitierte diese Arbeit von den folgenden Auszeichnungen der National Institutes of Health: GM077185, GM069589, DK076566, AI097511 und NS42617.
Materialien
| Name | Company | Catalog Number | Comments |
| Sedation | |||
| Ketamine | Zoetis | 10004027 | 100mg/ml |
| Telazol | Zoetis | 106-111 | 100mg/ml |
| Xylazine | Pivetal | 04606-6750-02 | 100mg/ml Anased |
| 3ml syringe w/ 20g needle | Covidien-Monoject | 8881513033 | |
| Winged infusion set 21g | Jorgensen Labs | J0454B | |
| Anesthetic | |||
| Isoflurane | Pivetal | 21295097 | |
| Surgery | |||
| Hair clippers | Wahl | 8787-450A | |
| Nair | Church and Dwight Co. Inc | 70506572 | |
| Chlorhexidine Solution | First Priority Inc. | 179925722 | |
| 70% Isopropyl Alcohol | Uline | S-17474 | |
| 0.9% Saline Solution | ICU Medical | RL-7282 | |
| Non-woven gauze | Pivetal | 21295051 | |
| Paper tape | McKesson | 455531 | |
| 2" Elastic tape | Pivetal | 21300869 | |
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Spay hook | Jorgensen Labs | J0112A | |
| Sterile lube | McKesson | 16-8942 | |
| Laryngoscope | Jorgensen Labs | J0449S | |
| Roll gauze | Pivetal | 21295032 | |
| Endotracheal tube (7-9mm) | Covidien | 86112 | Shiley Hi-Lo Oral Nasal Tracheal Tube Cuffed |
| 15gtt/ml IV administration set | ICU Medical | 12672-28 | |
| LRS 1000ml bag | ICU Medical | 07953-09 | |
| Three Quarter Drape Sheet | McKesson | 16-i80-12110G | |
| Analgesia | |||
| Buprenorphine | RX Generics | 42023-0179-05 | 0.3mg/ml |
| Fentanyl Transdermal | |||
| Carprofen | 21294548 | Pivetal | 50mg/ml Levafen |
| Bandaging | |||
| Transparent film dressing 26x30 | Genadyne Biotechnologies | A4-S00F5 | |
| Film dressing 4 x 4-3/4 Frame Style | McKesson | 886408 | |
| Vetrap | 3M | 1410BK BULK | |
| Elastic tape 4" | Pivetal | 21300931 | |
| Kerlix Roll Gauze | Cardinal Health | 3324 | |
| Imaging | |||
| Canon EOS 80D | Canon | 1263C004 | |
| Speedlight 600EX II-RT | Canon | 1177C002 | |
| EFS 17-55mm Ultrasonic | Canon | 1242B002 | |
| GE Logiq E9 | GE | 5197104-2 | |
| ML6-15 Probe | GE | 5199103 | |
| PeriCamPSI | Perimed | 90-00070 | |
| DermaLab | Cortex Technologies Inc | 4608D78 | |
| Biopsy/Tissue Collection | |||
| 6mm punch biopsy | Integra Lifesciences | 33-36 | |
| bupivicaine 0.5% | Auromedics Pharma | 55150017030 | |
| Size 10 Disposable Scalpel | McKesson | 16-63810 | |
| Dissection scissors | Pivetal | 21294806 | |
| Rat tooth thumb tissue forceps | Aesculap | BD512R | |
| Non-adherent Dressing | Covidien | 2132 | Telfa |
| 50ml Conical tube | Falcon | 352070 | |
| Eppendorf/microcentrifuge tube | Fisherbrand | 02-681-320 | |
| OCT Cassette | |||
| Non Woven Gauze 4x4 | Pivetal | 21295051 | |
| Inoculum | |||
| Low salt LB agar | Invitrogen | 22700-025 | |
| Low salt LB broth | Fisher scientific | BP1427-500 | |
| Petri plate | Falcon | REF-351029 | |
| Polyprophyline round bottom tubes (14 ml) | Falcon | REF-352059 | |
| Pseudomonas Agar Base (Dehydrated) | Thermo Scientific | OXCM0559B | |
| LB Agar, powder (Lennox L agar) | Thermo Fisher Scientific (Life Technologies) | 22700025 | |
| Gibco™ DPBS, calcium, magnesium | Gibco | 14040133 | |
| Euthanasia | |||
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Fatal Plus | Vortech Pharmaceuticals | 9373 |
Referenzen
- Goodwine, J., et al. Pyruvate-depleting conditions induce biofilm dispersion and enhance the efficacy of antibiotics in killing biofilms in vitro and in vivo. Scientific Reports. 9 (1), 3763(2019).
- Sen, C. K., Roy, S., Mathew-Steiner, S. S., Gordillo, G. M. Biofilm management in wound care. Plastic and Reconstructive Surgery. 148 (2), 275-288 (2021).
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clinical Microbiology Reviews. 19 (2), 403-434 (2006).
- Nguyen, T. T., Gilpin, D. A., Meyer, N. A., Herndon, D. N. Current treatment of severely burned patients. Annals of Surgery. 223 (1), 14-25 (1996).
- Eriksson, E., et al. Chronic wounds: Treatment consensus. Wound Repair and Regeneration. 30 (2), 156-171 (2022).
- Lebeaux, D., Chauhan, A., Rendueles, O., Beloin, C. From in vitro to in vivo models of bacterial biofilm-related infections. Pathogens. 2 (2), 288-356 (2013).
- Ganesh, K., et al. Chronic wound biofilm model. Advances in Wound Care. 4 (7), 382-388 (2015).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Stewart, P. S. Biophysics of biofilm infection. Pathogens and Disease. 70 (3), 212-218 (2014).
- Jensen, L. K., Johansen, A. S. B., Jensen, H. E. Porcine models of biofilm infections with focus on pathomorphology. Frontiers in Microbiology. 8, 1961(2017).
- Mah, T. F., O'Toole, G. A. Mechanisms of biofilm resistance to antimicrobial agents. Trends in Microbiology. 9 (1), 34-39 (2001).
- Gonzalez, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023(2018).
- Roy, S., et al. Mixed-species biofilm compromises wound healing by disrupting epidermal barrier function. Journal of Pathology. 233 (4), 331-343 (2014).
- Sen, C. K. Human wound and its burden: Updated 2020. Compendium of Estimates. Advances in Wound Care. 10 (5), 281-292 (2021).
- Barki, K. G., et al. Electric field based dressing disrupts mixed-species bacterial biofilm infection and restores functional wound healing. Annals of Surgery. 269 (4), 756-766 (2019).
- Dusane, D. H., et al. Electroceutical treatment of Pseudomonas aeruginosa biofilms. Scientific Reports. 9 (1), 2008(2019).
- Roy, S., et al. Staphylococcus aureus biofilm infection compromises wound healing by causing deficiencies in granulation tissue collagen. Annals of Surgery. 271 (6), 1174-1185 (2020).
- Ghanbari, A., et al. Inoculation density and nutrient level determine the formation of mushroom-shaped structures in Pseudomonas aeruginosa biofilms. Scientific Reports. 6, 32097(2016).
- Yin, R., Cheng, J., Wang, J., Li, P., Lin, J. Treatment of Pseudomonas aeruginosa infectious biofilms: Challenges and strategies. Frontiers in Microbiology. 13, 955286(2022).
- Norbury, W., Herndon, D. N., Tanksley, J., Jeschke, M. G., Finnerty, C. Infection in burns. Surgical Infections. 17 (2), 250-255 (2016).
- Nitz, F., et al. Molecular detection of drug-resistance genes of bla(OXA-23)-bla(OXA-51) and mcr-1 in clinical isolates of Pseudomonas aeruginosa. Microorganisms. 9 (4), 786(2021).
- Davis, S. C., et al. Microscopic and physiologic evidence for biofilm-associated wound colonization in vivo. Wound Repair and Regeneration. 16 (1), 23-29 (2008).
- Breuing, K., Kaplan, S., Liu, P., Onderdonk, A. B., Eriksson, E. Wound fluid bacterial levels exceed tissue bacterial counts in controlled porcine partial-thickness burn infections. Plastic and Reconstructive Surgery. 111 (2), 781-788 (2003).
- Nusbaum, A. G., et al. Effective method to remove wound bacteria: Comparison of various debridement modalities in an in vivo porcine model. Journal of Surgical Research. 176 (2), 701-707 (2012).
- Hirsch, T., et al. Enhanced susceptibility to infections in a diabetic wound healing model. BMC Surgery. 8, 5(2008).
- Roche, E. D., et al. Increasing the presence of biofilm and healing delay in a porcine model of MRSA-infected wounds. Wound Repair and Regeneration. 20 (4), 537-543 (2012).
- Hartoch, R. S., McManus, J. G., Knapp, S., Buettner, M. F. Emergency management of chronic wounds. Emergency Medical Clinics of North America. 25 (1), 203-221 (2007).
- Mustoe, T. Understanding chronic wounds: a unifying hypothesis on their pathogenesis and implications for therapy. American Journal of Surgery. 187 (5), 65-70 (2004).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Sinha, M., et al. Pseudomonas aeruginosa theft biofilm require host lipids of cutaneous wound. Annals of Surgery. 277 (3), e634-e647 (2023).
- Fan, G. Y., et al. Severe burn injury in a swine model for clinical dressing assessment. Journal of Visualized Experiments. (141), e57942(2018).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Meyer, W., Schwarz, R., Neurand, K. The skin of domestic mammals as a model for the human skin, with special reference to the domestic pig. Current Problems in Dermatology. 7, 39-52 (1978).
- Vardaxis, N. J., Brans, T. A., Boon, M. E., Kreis, R. W., Marres, L. M. Confocal laser scanning microscopy of porcine skin: implications for human wound healing studies. Journal of Anatomy. 190, 601-611 (1997).
- Heinrich, W., Lange, P. M., Stirtz, T., Iancu, C., Heidemann, E. Isolation and characterization of the large cyanogen bromide peptides from the alpha1- and alpha2-chains of pig skin collagen. FEBS Letters. 16 (1), 63-67 (1971).
- Marcarian, H. Q., Calhoun, M. L. Microscopic anatomy of the integument of adult swine. American Journal of Veterinary Research. 27 (118), 765-772 (1966).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Dawson, H. D., et al. Structural and functional annotation of the porcine immunome. BMC Genomics. 14, 332(2013).
- Kim, J. Y., Dunham, D. M., Supp, D. M., Sen, C. K., Powell, H. M. Novel burn device for rapid, reproducible burn wound generation. Burns. 42 (2), 384-391 (2016).
- Nielson, C. B., Duethman, N. C., Howard, J. M., Moncure, M., Wood, J. G. Burns: Pathophysiology of systemic complications and current management. Journal of Burn Care and Research. 38 (1), e469-e481 (2017).
- Rowan, M. P., et al. Burn wound healing and treatment: Review and advancements. Critical Care. 19 (1), 243(2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten