Method Article
Modèle porcin d’infection par biofilm et de plaies invisibles
Dans cet article
Résumé
Les plaies chroniques résistantes aux antibiotiques constituent une menace majeure pour le système de santé. Les infections par biofilm sont tenaces et hostiles et peuvent entraîner une fermeture fonctionnelle déficiente de la plaie. Nous rapportons un modèle porcin cliniquement pertinent de plaies chroniques de pleine épaisseur infectées par un biofilm. Ce modèle est puissant pour les études mécanistiques ainsi que pour tester des interventions.
Résumé
L’infection par biofilm est un contributeur majeur à la chronicité des plaies. L’établissement d’une infection expérimentale du biofilm de la plaie cliniquement pertinente nécessite l’implication du système immunitaire de l’hôte. Les changements itératifs de l’hôte et de l’agent pathogène lors de la formation d’un tel biofilm cliniquement pertinent ne peuvent se produire qu’in vivo. Le modèle de plaie porcine est reconnu pour ses avantages en tant que modèle préclinique puissant. Il existe plusieurs approches rapportées pour étudier les biofilms des plaies. Les systèmes in vitro et ex vivo sont déficients en termes de réponse immunitaire de l’hôte. Les études in vivo à court terme impliquent des réponses aiguës et, par conséquent, ne permettent pas la maturation du biofilm, comme on sait que cela se produit cliniquement. La première étude à long terme sur le biofilm des plaies porcines a été publiée en 2014. L’étude a reconnu que les plaies infectées par le biofilm peuvent se refermer comme déterminé par la planimétrie, mais que la fonction de barrière cutanée du site affecté peut ne pas être restaurée. Plus tard, cette observation a été validée cliniquement. C’est ainsi qu’est né le concept de fermeture fonctionnelle des plaies. Les plaies fermées mais déficientes dans la fonction de barrière cutanée peuvent être considérées comme des plaies invisibles. Dans ce travail, nous cherchons à rapporter les détails méthodologiques nécessaires pour reproduire le modèle porcin à long terme de brûlures graves infectées par un biofilm, qui est cliniquement pertinent et a une valeur translationnelle. Ce protocole fournit des conseils détaillés sur l’établissement d’une infection par biofilm de la plaie de 8 semaines à l’aide de P. aeruginosa (PA01). Huit brûlures sur toute l’épaisseur ont été créées symétriquement sur le dos de porcs blancs domestiques, qui ont été inoculés avec (PA01) au jour 3 après la combustion ; Par la suite, des évaluations non invasives de la cicatrisation des plaies ont été effectuées à différents moments à l’aide de l’imagerie par taches laser (LSI), des ultrasons à haute résolution (HUSD) et de la perte d’eau transépidermique (TEWL). Les brûlures inoculées ont été recouvertes d’un pansement à quatre couches. Les biofilms, tels qu’établis et confirmés structurellement par MEB au jour 7 après l’inoculation, ont compromis la fermeture fonctionnelle de la plaie. Un tel résultat défavorable est susceptible d’être renversé en réponse à des interventions appropriées.
Introduction
L’infection par biofilm complique les brûlures et les plaies chroniques et provoque une chronicité 1,2,3,4,5. En microbiologie, les mécanismes du biofilm sont principalement étudiés, avec un accent particulier sur les microbes 1,6. Les leçons tirées de ces études sont d’une importance capitale du point de vue de la science biologique, mais ne sont pas nécessairement applicables aux biofilms pathogènes cliniquement pertinents 6,7,8. Les agrégats structurels de biofilm cliniquement pertinents doivent inclure les facteurs microbiens ainsi que les facteurs de l’hôte 8,9,10. Un tel microenvironnement permet d’inclure des interactions itératives hôte-microbe, qui sont essentielles au développement d’un biofilm cliniquement pertinent 7,8. Dans un tel processus, la participation des cellules immunitaires et des facteurs transmissibles par le sang est essentielle11,12. Les interactions hôte-microbe sous-jacentes aux biofilms pathogènes cliniques, telles qu’elles sont observées dans les plaies chroniques, se produisent sur une longue période de temps. Ainsi, toute approche expérimentale visant à développer un modèle d’infection par biofilm pertinent sur le plan translationnel doit tenir compte de ces facteurs. Nous avons donc cherché à développer un modèle d’infection chronique par biofilm porcin cliniquement reproductible.
Bien que les études humaines représentent clairement la meilleure approche pour étudier les résultats de la guérison, elles ne sont souvent pas les mieux adaptées pour aborder les mécanismes sous-jacents et les nouveaux paradigmes mécanistes. Des préoccupations éthiques limitent l’utilisation de modèles d’étude exigeant la collecte de plusieurs biopsies d’une plaie chronique à différents moments. Il est donc essentiel de disposer d’un modèle animal bien établi et reproductible pour permettre des études invasives pour l’examen approfondi du devenir du biofilm 7,13. Le choix d’un modèle animal dépend de plusieurs facteurs, notamment de la pertinence scientifique/translationnelle et de la logistique. Le système porcin est largement reconnu comme étant le modèle expérimental le plus précieux sur le plan translationnel pour étudier les plaies cutanées humaines7. Ainsi, ce travail fait état d’un modèle porcin établi de brûlures sur toute l’épaisseur infectées par un biofilm. Ce travail est basé sur plusieurs publications originales rapportées dans la littérature 2,7,13,14,15,16,17. Dans cette étude, un isolat clinique de Pseudomonas aeruginosa (PA01) multirésistant a été choisi pour infecter la plaie. P. aeruginosa est une cause fréquente d’infections des plaies 2,18,19,20. Il s’agit d’une bactérie à Gram négatif qui peut être difficile à traiter en raison de sa résistance à certains antibiotiques11,19,21. Aucun des modèles de biofilm porcin rapportés jusqu’à présent n’impliquait d’études à long terme de 8 semaines 22,23,24,25,26. Les plaies chroniques sont celles qui restent ouvertes pendant 4 semaines ou plus 14,27,28. Il n’y a pas d’autres modèles de biofilm de plaie chronique rapportés dans la littérature. Ce travail aborde la notion de fermeture fonctionnelle de la plaie 2,7,13,15,17,29.
Protocole
Toutes les études sur les animaux ont été réalisées conformément aux protocoles approuvés par le Comité institutionnel de protection et d’utilisation des animaux (IACUC) #21147. L’étude a été menée au Laboratory Animal Resource Center (LARC) de l’Université de l’Indiana. Nous avons utilisé un porc blanc domestique femelle (70-80 lb) dans ce protocole.
1. Acclimatation des animaux
- À l’arrivée des porcs dans l’établissement, logez les animaux individuellement dans la même pièce pendant au moins 3 jours pour l’acclimatation et l’interaction sociale.
- Donnez aux porcs une alimentation équilibrée. Décidez de la quantité donnée en fonction du poids et suivez les recommandations du fabricant.
- Assurez-vous que l’animal est à jeun pendant 6 à 12 h avant l’intervention pour éviter les nausées, les vomissements et l’aspiration des fluides gastriques sous anesthésie.
2. Configuration de la salle d’opération
- Préparez l’appareil d’anesthésie et assurez-vous qu’il est prêt avec le circuit de réinspiration.
- Aménagez la salle pour la chirurgie, comme décrit ci-dessous (Figure 1A).
- Couvrez la table d’intervention d’un champ stérile et placez une couverture d’eau en dessous pour faciliter la thermorégulation.
- Installez une table avec des fournitures d’induction et du matériel de préparation à la chirurgie. Installez une table avec les brûleurs et les boîtiers de commande. Configurez l’équipement d’imagerie et assurez-vous qu’il est allumé.
3. Sédation du porc
- Endormir le porc à l’aide d’une injection intramusculaire de TKX (Telazol 4,4 mg/kg ; kétamine 2,2 mg/kg ; xylazine 2,2 mg/kg) à une dose de 1 mL/50 lb. Maintenir le porc dans la salle d’intervention avec de l’isoflurane à 1 % à 3 % administré par un masque.
- Administrer les analgésiques (préopératoires) aux porcs selon le protocole de l’IACUC ; quelques exemples sont les suivants : buprénorphine 0,3 mg/mL, 0,01-0,05 mg/kg IM ; carprofène 50 mg/mL, 4 mg/kg IM ou SQ ; fentanyl transdermique 100 mcg/h placé sur le pavillon de l’oreille ; gélules de gabapentine 300 mg, 3-10 mg/kg PO.
REMARQUE : Pour toutes les procédures de brûlures et de biopsie, 1 dose de gabapentine sera administrée la veille de la chirurgie et 1 dose de carprofène sera administrée le jour de l’intervention. Pour la procédure de combustion principale, un timbre de fentanyl sera placé et 1 dose complète de buprénorphine sera administrée pendant la préparation chirurgicale.
4. Induction de l’anesthésie
- Stérilisez l’oreille en alternant un gommage à la chlorhexidine à 2 % et de l’alcool au moins trois fois. Insérez A 22-18 G 1 dans le cathéter intraveineux dans la veine marginale de l’oreille et confirmez le flux sanguin. Rincez le cathéter avec une solution saline et fixez-le avec du ruban chirurgical (Figure 1B).
- Intuber le porc à l’aide d’une sonde endotrachéale de taille appropriée (7-9 mm) une fois que la relaxation musculaire a été obtenue par l’inhalation d’anesthésie via le masque. Vérifier la relaxation musculaire par une perte de tonus de la mâchoire et l’observation d’un réflexe palpébral.
- Ouvrez le tube et testez la fuite du brassard à l’aide d’une seringue d’air. Insérez le tube à l’aide d’un laryngoscope30.
- Gonflez le brassard et fixez le tube une fois que le placement correct est confirmé. Connectez le racleur au circuit de réinspiration.
REMARQUE : Le tube est attaché en place sur le museau et une gaze en rouleau est utilisée pour le fixer. L’auscultation du thorax est réalisée à l’aide d’un stéthoscope pour confirmer la bonne mise en place du tube.
REMARQUE : Pendant l’anesthésie, de l’air est fourni toutes les 5 à 10 minutes en fermant la valve de réinhalation et en appuyant sur le sac de réinspiration jusqu’à ce que le manomètre de pression atteigne 20 mm/Hg pour éviter l’atélectasie positionnelle.
- Surveillez l’animal et la profondeur de l’anesthésie.
- Connectez le racleur à un moniteur multiparamètre. Le moniteur lira en continu la saturation en oxygène (SpO 2), la fréquence du pouls, le dioxyde de carbone en fin de marée (EtCO2), la fréquence respiratoire et la température. Enregistrez les signes vitaux toutes les 10 minutes tout au long de la procédure.
- Évaluez la profondeur de l’anesthésie en testant les réflexes de douleur avec un pincement de l’orteil de la patte arrière avant de commencer la blessure.
REMARQUE : Si nécessaire, ajustez le vaporisateur d’anesthésie pour administrer une anesthésie supplémentaire ou attendez quelques minutes. Vérifiez régulièrement les réflexes de douleur et les réflexes palpébraux tout au long de la chirurgie.
5. Préparation des animaux pour les brûlures
- Débranchez le porc de l’appareil d’anesthésie et déplacez-le sur la table d’intervention. Placez le porc en position couchée sternale et assurez-vous de fixer toutes les lignes et tous les tubes connectés (Figure 1C).
- Rebranchez le porc à l’appareil d’anesthésie et maintenez l’O2 à 0,8-1,5 L/min et l’isoflurane à 1 %-3 % jusqu’à la fin de l’intervention.
- Administrer des liquides IV (LRS) au porc à un débit de goutte à goutte de 8 à 10 mL/kg/h. Surveillez l’anesthésie comme à l’étape 4.3.
6. Préparation antiseptique et marquage du site de brûlure de la peau
- Préparez la zone de la plaie en vous rasant et en appliquant la crème dépilatoire, comme décrit ci-dessous (Figure 2).
- Rasez le dos du porc dans une zone d’environ 25 cm de largeur de la colonne vertébrale jusqu’à l’aisselle des deux côtés à l’aide d’une tondeuse électrique.
- Appliquez la crème dépilatoire sur la zone tondue et laissez reposer pendant 3 à 7 minutes. Retirez la crème avec les cheveux à l’aide de serviettes absorbantes propres.
- Préparation du site de brûlage
- Frottez la zone à blesser avec un gommage alterné à 2 % de chlorhexidine et d’alcool isopropylique à 70 % au moins trois fois pendant environ 5 minutes. Assurez-vous que le gommage est appliqué en forme de cible (en commençant par le centre et en se déplaçant vers l’extérieur en spirale) par du personnel portant des gants stériles.
- Marquez les sites de la plaie à l’aide d’un gabarit de brûlure stérile et d’un marqueur cutané chirurgical (figure 2B). Marquez six à huit plaies (2 po x 2 po) symétriquement sur le dos.
- Couvrir les zones autour des sites marqués avec un champ stérile pour réduire la contamination (figure 2C).
7. Procédure de brûlure
- Utilisez un dispositif de gravure, tel qu’un brûleur sur mesure fabriqué à l’interne composé d’un bloc d’acier inoxydable de 2 po x 2 po (poids : 352 g) relié à un stylet métallique, à un microstat électronique et à une balance électronique (poids total : 1 714 g ; Graphique 3).
- Réglez le brûleur à la température souhaitée. Ajustez la température cible pour les plaies de pleine épaisseur à 150 °C (Figure 3A). Pour ce faire, réglez le point de consigne (SP) de l’unité de commande à 150 °C. Réglez la consigne basse à 145 °C et la consigne haute à 155 °C (Figure 1D).
- Créez une plaie de brûlure pleine épaisseur de 2 po x 2 po en utilisant des blocs d’acier inoxydable chauffés reliés à l’appareil de brûlure et en les plaçant sur la peau pendant 60 s (Figure 3B, C). Pendant l’application de la combustion, utilisez la balance électronique pour vous assurer qu’une pression uniforme est appliquée par le brûleur.
8. Évaluation et imagerie des brûlures
- Photographie numérique
- Photographiez les plaies à l’aide d’un appareil photo reflex numérique et d’un objectif ultrasonique grand angle à ultrasons EFS de 17 à 55 mm et d’une lampe de poche.
- Prenez une photo numérique de l’ensemble du dos du porc, y compris une pancarte avec l’identification du porc, le moment et la date. Ensuite, prenez des images pour chaque plaie séparément montrant une pancarte avec l’identification du porc, l’identification de la plaie et le point temporel, ainsi qu’une règle.
- Calculez la surface de la plaie en pourcentage de la taille de la plaie d’origine à chaque point de prélèvement jusqu’au jour 56.
NOTE : Dans ce travail, la surface de la plaie a été calculée à chaque point temporel (d0, d7, d14, d28 et d56) en pourcentage de la surface de la plaie d’origine à d0.
- Imagerie laser par chatoiement (LSI)
- Pour l’imagerie laser de la gommerie, utilisez un imageur de perfusion sanguine basé sur la technologie LASCA (Laser Speckle Contrast Analysis) pour évaluer la perfusion microvasculaire de la plaie en temps réel.
- Prenez les images de toutes les blessures en un seul enregistrement. Ajustez la valeur mesurée de la distance de travail entre la caméra laser et la plaie de manière à ce qu’elle soit cohérente pour l’imagerie de chaque plaie (Figure 4A).
- Enregistrez la perfusion par une série d’images prises sur une période de 10 à 15 s. Une fois qu’une plaie est photographiée, l’enregistrement s’interrompt automatiquement et l’enregistrement reprend une fois que la caméra est réglée pour la plaie suivante. Chaque fois que l’enregistrement s’interrompt, un marqueur est ajouté pour identifier la plaie.
- Perte d’eau transépidermique (TEWL)
- Mesurez la TEWL pour chaque plaie à l’aide d’une unité standard, d’une sonde TEWL et d’un logiciel (Figure 4B). Pour chaque plaie, placez un couvercle de sonde propre sur l’embout de la sonde, qui sera en contact avec le tissu de la plaie.
- Placez la sonde doucement et uniformément sur la peau et commencez la lecture en appuyant sur le bouton Start de l’appareil.
- Mesurez chaque plaie cinq fois, d’abord au centre, puis à chaque coin. Ensuite, exportez toutes les lectures dans une feuille de calcul (Figure 4B).
- Ultrasons harmoniques (HUSD)
- Effectuez une cartographie HUSD en scannant la plaie à l’aide d’une sonde à ultrasons (US) à partir de la ligne médiane (colonne vertébrale) en partant de la peau normale vers le côté latéral du porc où il y a à nouveau une peau normale. Suivez ce schéma de balayage pour chaque plaie en mode B et en mode élastographie tissulaire à l’aide de l’échographe (Figure 4C).
- Pour le balayage en mode B, appliquez du gel à ultrasons stérile sur la zone de la plaie et appliquez-en sur la sonde haute résolution ML-615. Annotez chaque enregistrement à l’aide de l’étiquette d’identification de la plaie. Commencez l’enregistrement et déplacez lentement la sonde de la ligne médiane vers le bas de la plaie jusqu’à ce que la peau normale de l’autre côté soit atteinte.
REMARQUE : Une fois la numérisation terminée, l’enregistrement est enregistré et exporté à partir de l’appareil pour analyse. - Pour l’élastographie, mettez l’échographe en mode élastographe en appuyant sur le bouton Elato . Scannez à nouveau la plaie de la même manière que dans le balayage en mode B, en veillant à ce que la pression uniforme de la sonde soit maintenue pour permettre à l’indicateur de couleur de l’élastographie (barres vertes) de rester visible tout au long de l’enregistrement.
REMARQUE : La pression appropriée peut être déterminée par la barre d’échelle de l’enregistrement, qui apparaît en vert lorsque le contact correct est établi (Figure 4D). - Modifiez l’annotation après l’imagerie de chaque plaie en mode B et en mode élasto (deux enregistrements par plaie). Modifiez le commentaire dans le logiciel pour inclure les informations relatives à la plaie suivante et répétez le processus pour les plaies suivantes.
- Pour le balayage en mode B, appliquez du gel à ultrasons stérile sur la zone de la plaie et appliquez-en sur la sonde haute résolution ML-615. Annotez chaque enregistrement à l’aide de l’étiquette d’identification de la plaie. Commencez l’enregistrement et déplacez lentement la sonde de la ligne médiane vers le bas de la plaie jusqu’à ce que la peau normale de l’autre côté soit atteinte.
- Effectuez une cartographie HUSD en scannant la plaie à l’aide d’une sonde à ultrasons (US) à partir de la ligne médiane (colonne vertébrale) en partant de la peau normale vers le côté latéral du porc où il y a à nouveau une peau normale. Suivez ce schéma de balayage pour chaque plaie en mode B et en mode élastographie tissulaire à l’aide de l’échographe (Figure 4C).
9. Bandage et pansement
- Couvrir individuellement les brûlures avec des pansements transparents ou le pansement d’essai (Figure 5A, B). Placez un pansement en film transparent plus grand sur toute la zone de la plaie (Figure 5C).
- Appliquez une deuxième couche de gaze en rouleau sans serrer autour de tout le tronc du porc pour absorber tout exsudat liquide provenant des plaies. Faites rouler le porc d’avant en arrière de son côté à légèrement sur le dos pour enrouler le matériau de bandage autour du porc.
- Recouvrez la gaze sans serrer d’une couche de bandage élastique flexible (figure 5D). Assurez-vous que le bandage n’est pas trop serré, car l’appliquer trop serré peut restreindre la respiration et exercer une pression sur l’abdomen, ce qui peut entraîner un prolapsus rectal ou différentes complications.
REMARQUE : Le bandage élastique est extensible et peut facilement être trop serré pendant l’application. Le retirer du rouleau et le laisser reposer sur le bord de l’emballage précédent peut aider à éviter un serrage excessif. - Recouvrez le bandage élastique d’une dernière couche de ruban élastique de 4 pouces (Figure 4E). Encore une fois, assurez-vous que l’application n’est pas trop serrée, mais assurez-vous que le pansement est fixé aux bords supérieur et inférieur pour éviter qu’il ne glisse vers le bas lorsque le porc se déplace après la procédure.
10. Récupération de l’animal et soins postopératoires
- Récupération
- Arrêtez le gaz anesthésique à la fin de la blessure, de la procédure d’imagerie et du bandage. Laissez le porc rester sous oxygène pendant au moins 5 minutes.
- Après son retour dans l’enclos primaire, le racleur doit être déplacé de la table de transport/levage vers un tapis de récupération en mousse dans la cage. Soulevez l’abreuvoir automatique et retirez le j-feeder pour éviter de blesser le porc pendant la récupération.
- Couvrez le porc avec des couvertures (y compris une couverture d’air chaud) en cas d’hypothermie. Surveillez et enregistrez les signes vitaux, y compris la température, le pouls, la fréquence respiratoire et la SpO2 toutes les 10 à 15 minutes.
- Surveillez continuellement le porc jusqu’à ce qu’il soit capable de maintenir la décubition sternale de manière autonome. Une fois que le porc est complètement rétabli, abaissez l’abreuvoir à tétine, puis le porc peut également être nourri.
- Évaluation de la douleur
- Effectuez une évaluation de la douleur postopératoire à l’aide d’un formulaire de notation de la douleur de Glasgow modifié. Assurez-vous que les évaluations de la douleur sont effectuées par le personnel du laboratoire ou du LARC au moins toutes les 12 heures pendant les 3 à 4 premiers jours postopératoires. La fréquence de l’évaluation de la douleur est déterminée par le vétérinaire traitant. Si l’animal obtient un score supérieur à 5, administrer un analgésie de secours (buprénorphine ou hydromorphone).
- Fournir une analgésie en administrant une dose de buprénorphine de 0,01 à 0,05 mg / kg IM avant l’intervention, avec une deuxième dose administrée 8 à 12 h plus tard.
- Placez un timbre de fentanyl (100 mcg/h) sur le pavillon de l’oreille avant la brûlure.
- Injecter du carprofène 4 mg/kg IM ou SQ avant l’intervention, puis une fois par jour IM, SQ ou PO pendant 2 jours ou selon les directives du vétérinaire du LARC.
- Administrer de la gabapentine 3 à 10 mg/kg par voie orale, avec une dose administrée la veille de l’intervention, le matin de l’intervention, le soir suivant l’intervention, puis toutes les 12 h pendant 3 à 5 jours.
- Diète
- Assurez-vous que les porcs sont rétablis, puis laissez-leur libre accès à l’eau et à la nourriture en fonction de leur ration pondérale deux fois par jour.
- Offrez un enrichissement alimentaire (fruits et légumes frais, fruits surgelés, guimauves, yogourt, pudding, etc.) et utilisez-les pour inciter à manger si une diminution de l’appétit est observée.
- Changement de pansement
- Changez les pansements au moins une fois par semaine ou plus souvent si les pansements sont souillés ou pour s’adapter aux stratégies de traitement.
- Changez les pansements après l’imagerie alors qu’il est encore sous anesthésie, ou mettez le porc sous sédatif avec seulement du TKX pour un changement de pansement.
- Pour remplacer le pansement, commencez par retirer soigneusement le pansement souillé à l’aide de ciseaux à bandage Lister ou de cisailles à traumatisme, en veillant à ne pas laisser l’extérieur du pansement entrer en contact avec les plaies.
- Nettoyez la zone autour des plaies si nécessaire en utilisant 0,9% de NaCl sur de la gaze propre et séchez doucement la zone. Suivez les étapes de la procédure de pansement décrites à la section 9.
REMARQUE : Si des pansements expérimentaux sont appliqués, ceux-ci peuvent être appliqués avant de recouvrir les plaies avec le pansement en film transparent.
- Fréquence d’imagerie
- Obtenir des images (photos numériques, LSI, TEWL et HUSD) à différents moments de l’étude. Recueillez des données d’imagerie le jour −3 (brûlure), le jour 0 (inoculation) et le jour 7, le jour 14, le jour 28, le jour 35 et le jour 56 après l’inoculation.
11. Préparation et inoculation du biofilm
- Préparation de l’inoculum
- Préparez une plaque de démarrage à partir d’un stock de congélation de glycérol de Pseudomonas aeruginosa (PA01) pour une culture pure de la bactérie. Cultivez une culture de P. aeruginosa dans une gélose Luria−Bertani à faible teneur en sel (LBA) et incubez-la à 37 °C pendant la nuit.
- Inoculer 5 mL de bouillon Luria−Bertani à faible teneur en sel (LBB) avec une seule colonie de P. aeruginosa le lendemain, et incuber toute la nuit à 37 °C en agitant à 200 tr/min.
- Pour obtenir des cellules en phase logarithmique, inoculer 200 μL de la culture de nuit dans 5 mL de LBB et incuber dans l’agitateur à 200 tr/min à 37 °C pendant 2,5 h.
- Mesurer la densité optique à 600 nm (OD600) à l’aide d’un spectrophotomètre. Préparer des dilutions en série jusqu’à 1 x 10−9 en utilisant 100 μL de la culture dans 900 μL de LBB stérile.
NOTE : Nous avons commencé avec des échantillons non dilués et nous avons terminé avec 1 x 10 7 UFC/mL. Nous avons obtenu des colonies dénombrables dans la dilution 1 x 107, nous avons donc considéré cette dilution comme la dilution finale. - Étaler 100 μL de chaque dilution sur LBA et incuber toute la nuit à 37 °C. Selon les protocoles microbiologiques standard, utiliser des dilutions montrant des colonies dénombrables (30-300) pour le dénombrement des colonies, et obtenir les unités formant colonie (UFC).
- Inoculation de la plaie
- Inoculer 200 μL de la culture de nuit dans 5 ml de bouillon LB et incuber dans le shaker à 37 °C pendant 2,5 h.
- Mesurer la densité optique de la culture diurne à 600 nm (OD600). Pour l’inoculation de PA01, utiliser 3 x 10 8 UFC/mL (250 μL de 1 x 108 UFC/mL de PA01 sont inoculés par plaie). Transportez l’inoculum à l’animalerie dans un contenant présentant des risques biologiques.
- Dispersez l’inoculum sur la surface des plaies exposées le jour 3 après la brûlure à l’aide d’une pipette et étalez-le uniformément à l’aide d’un épandeur jetable (Figure 6). Gardez les plaies ouvertes pendant environ 15 minutes avant de panser.
REMARQUE : Toutes les interventions chirurgicales, l’inoculation, les biopsies tissulaires, l’imagerie et le pansement sont effectués sous anesthésie générale comme dans les sections 3 et 4.
- Confirmation de l’établissement de l’infection
REMARQUE : Pour confirmer que les plaies se sont infectées avec succès après l’inoculation, plusieurs approches sont utilisées, et les échantillons de plaies sont comparés aux échantillons prélevés sur la peau normale ; Vous trouverez ci-dessous quelques exemples.- Pour l’analyse pathologique d’échantillons prélevés à différents moments, utilisez le nombre d’unités formant colonie pour estimer une infection (UFC ; Figures 7E et F).
- Prélever 6 mm de tissus de la plaie par biopsie à l’emporte-pièce. Étiqueter et peser les tubes vides à fond rond de 5 ml. Transférez les échantillons dans les tubes et pesez les tubes avec les échantillons.
- Coupez le tissu en dés avec un scalpel sur une surface stérile. Effectuez toutes les étapes dans une hotte BSL2.
REMARQUE : Pour s’assurer que les tissus sont facilement homogénéisés, la taille doit être très petite (mais pas inférieure à 0,5 mm) - Mettez l’échantillon dans le tube et ajoutez 1 ml de PBS. Mélangez et broyez le tissu à l’aide d’une sonde de broyage pour tissus durs.
- Diluer en série (non dilué à 1 x 10−5) l’homogénat et plaquer 50 μL de chaque dilution dans un milieu sélectif (gélose d’isolement Pseudomonas, PIA) et non sélectif (LBA).
- Incuber toutes les dilutions dans des conditions aérobies à 37 °C pendant 18 à 24 h. Imaginez les plaques dans des conditions d’éclairage appropriées.
- Sélectionnez des plaques avec 30 à 300 colonies, si aucune des plaques n’a atteint cette concentration, utilisez la plaque non diluée. Utilisez ImageJ pour compter le nombre de colonies et calculez l’UFC par plaque en multipliant la valeur moyenne par le facteur de dilution final.
- Acquérir les images à partir d’échantillons prélevés à partir du jour 7 après l’inoculation et à d’autres moments à l’aide de la microscopie électronique à balayage (MEB) pour confirmer la présence de biofilms bactériens (Figure 7G).
NOTE : Le jour 7 après l’inoculation a été choisi parce que c’est le jour de l’établissement de l’infection par le biofilm et du début du ramollissement de l’escarre de brûlure, ce qui permet la pénétration des ondes US et, par conséquent, la visualisation des tissus plus profonds. Dans la figure 4, vérifiez l’image de la brûlure du jour 3 aux États-Unis, qui montre l’épaisse escarre coriace qui empêche les ondes aux États-Unis de passer à travers les tissus plus profonds. - Colorer les sections des biopsies de la plaie avec des anticorps spécifiques contre P. aeruginosa pour confirmer la présence de la bactérie spécifique, comme le montre une publication précédente13 (Figure 7H).
- Effectuer le séquençage de nouvelle génération (NGS), tel que publié dans Sinha et al.31. Quantifier l’ARNsr de la bactérie à partir des plaies infectées et des échantillons de peau normale non infectée prélevés à différents moments à partir du jour 7 après l’inoculation jusqu’à la fin de l’étude.
- Pour l’analyse pathologique d’échantillons prélevés à différents moments, utilisez le nombre d’unités formant colonie pour estimer une infection (UFC ; Figures 7E et F).
12. Prélèvement de biopsie
- Prélever les biopsies tissulaires pour analyse après l’imagerie aux jours 7, 14, 28 et 56 après l’inoculation. Prélever des biopsies sur chaque plaie une seule fois pour minimiser l’interférence avec le processus de guérison.
REMARQUE : Toutes les interventions chirurgicales, l’inoculation, les biopsies tissulaires, l’imagerie et le pansement sont effectués sous anesthésie générale comme dans les sections 3 et 4.- Infiltrez la zone autour de la plaie avec 0,5 % de bupivacaïne. Coupez une bande de 3 à 4 mm de large d’un bord à l’autre de la plaie, en gardant de petites marges de peau normale des deux côtés, à l’aide d’un scalpel jetable avec une lame de taille 10. Placez la bande dans un tube conique étiqueté rempli de formol tamponné à 4 % pour la fixation.
REMARQUE : Pour les procédures d’imagerie et de biopsie précoces, une dose complète de buprénorphine sera administrée pendant la préparation chirurgicale. Pour les procédures de biopsie tardives, une demi-dose de buprénorphine sera administrée pendant la préparation chirurgicale. Après toutes les procédures de brûlure et de biopsie, la gabapentine sera administrée pendant 7 jours maximum, selon les conseils du vétérinaire traitant. Le carprofène sera administré pendant les jours suivant l’opération ou selon les conseils du vétérinaire traitant. - Prélever une biopsie à l’emporte-pièce de 6 mm dans la plaie (soit dans le lit de la plaie, soit dans le bord de la plaie). Prélever sur le bord de la plaie, y compris une partie de la peau normale et le lit de la plaie, pour différents types d’analyse.
- Prélevez l’échantillon à l’aide d’une pince stérilisée et de ciseaux à dissection. Placez l’échantillon de biopsie dans le tube ou la cassette approprié pour le traitement et l’analyse.
- Pour l’UFC, le MEB, l’ARN et le FPPE, conservez les échantillons dans des tubes avec un tampon approprié. Par exemple, les échantillons peuvent être placés dans l’OCT dans des cassettes pour la microscopie à capture laser (LCM) et l’immunohistochimie (IHC).
- Réalisez l’hémostase après le prélèvement des échantillons en appuyant doucement sur la plaie avec une gaze stérile. Couvrir la plaie avec un pansement non adhérent et un bandage comme dans la section 9.
- Infiltrez la zone autour de la plaie avec 0,5 % de bupivacaïne. Coupez une bande de 3 à 4 mm de large d’un bord à l’autre de la plaie, en gardant de petites marges de peau normale des deux côtés, à l’aide d’un scalpel jetable avec une lame de taille 10. Placez la bande dans un tube conique étiqueté rempli de formol tamponné à 4 % pour la fixation.
13. Euthanasie et prélèvement de tissus
- Mettez le porc sous sédatif le jour de l’euthanasie avec TKX et anesthésiez-le avec de l’isoflurane. Placez un cathéter intraveineux dans la veine marginale de l’oreille en suivant les étapes décrites à la section 3. Intuber le porc en suivant les étapes de la section 4.
- Retirez le pansement une fois que le porc est anesthésié et nettoyez la zone autour des plaies.
- Photographie numérique complète, imagerie LSI, TEWL et HUSD. Prélever les échantillons sur les plaies et la peau normale en suivant les étapes décrites à la section 12.
- Une fois que tous les échantillons requis ont été prélevés, euthanasier sans cruauté le porc pendant qu’il est encore sous anesthésie au moyen d’une injection intraveineuse d’une solution d’euthanasie disponible dans le commerce (pentobarbital sodique). Utilisez un stéthoscope pour ausculter afin de confirmer l’arrêt des battements cardiaques et de la respiration spontanée.
- Effectuer une méthode secondaire d’euthanasie, comme l’exige SOM IACUC, en utilisant un scalpel pour induire un pneumothorax. Transférez la carcasse de porc dans un baril et transportez-la au congélateur pour qu’elle soit ramassée pour l’incinération.
Résultats
Un dispositif de brûlure normalisé a été utilisé pour créer des brûlures sur toute l’épaisseur à 150 °C pendant 1 min, ce qui a entraîné une brûlure profonde homogène avec une marge uniforme d’érythème et d’inflammation (Figure 3 et Figure 7). Chaque porc a reçu huit brûlures sur toute l’épaisseur du dos, comme le montre la figure 3C.
L’évaluation non invasive en temps réel des brûlures par échographie haute résolution en mode B pour confirmer la profondeur de la plaie et la progression de la cicatrisation au fil du temps a montré la destruction de toutes les couches de peau jusqu’à la graisse sous-cutanée (Figure 4). L’imagerie laser par chatoiement (LSI) a été utilisée pour une caractérisation plus poussée de la perfusion de la plaie (Figure 4A).
Les brûlures présentaient une épaisse membrane pyogène à la surface de la plaie au 7e jour après l’inoculation, confirmant ainsi l’infection et l’établissement du biofilm de la brûlure (figure 7A). La planimétrie numérique a montré une augmentation de la surface de la plaie au jour 3 après l’inoculation de PAO1 en raison de la réponse inflammatoire au site et aux marges de la plaie (Figure 7A,B). Bien que la zone de la plaie ait commencé à rétrécir au 14e jour après l’inoculation, une cicatrisation incomplète à environ 25 % de la taille initiale de la plaie a été observée au jour 56, ce qui indique la chronicité des plaies (figure 7B). La chronicité de la plaie et l’altération de la cicatrisation ont été confirmées par le TEWL, qui a montré une perte d’eau transépidermique élevée. Les résultats de l’étude TEWL ont reflété la perte de la fonction de barrière cutanée par rapport à la peau normale à tous les moments mesurés, indiquant ainsi une altération fonctionnelle de la cicatrisation de la brûlure (Figure 7B). Cela a également été confirmé par la suppression des protéines jonctionnelles serrées ZO-1 et 213 et l’altération de la restauration de la fonction barrière cutanée, comme en témoignent les valeurs élevées de TEWL observées au jour 35 (moyen) et au jour 56 (tard) malgré la fermeture visuelle de la plaie (Figure 7I).
La profondeur de la brûlure a été validée par la coloration H&E, qui a montré une distorsion et une nécrose de toutes les couches histologiques de la peau, comme le montre la figure 7C. Le biofilm établi de PA01 a été validé au jour 7 après l’inoculation par UFC (Figure 7E,F), imagerie MEB (Figure 7G) et coloration par immunofluorescence (Figure 7H).

Figure 1 : Configuration de l’intervention. (A) Préparation de la table d’opération. (B) Canulation veineuse de l’oreille pour les liquides intraveineux et l’administration de médicaments. (C) Couverture thermique pour protéger le porc de l’hypothermie pendant la procédure. (D) Réglage du brûleur et de la minuterie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
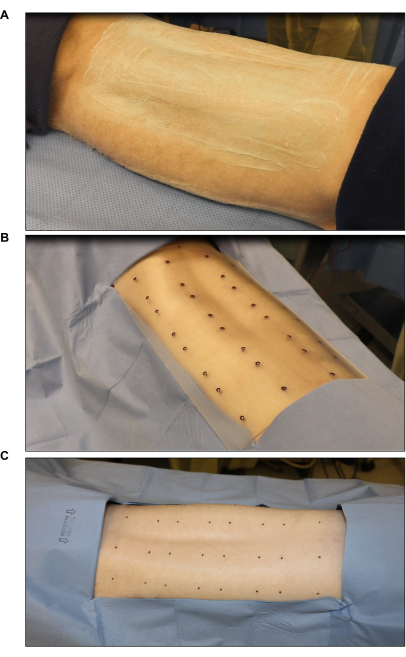
Figure 2 : Stérilisation et marquage du site chirurgical. (A) Tonte et stérilisation des cheveux. (B) Marquage du site de la brûlure à l’aide d’un gabarit étalon stérile à huit plaies (chaque plaie mesure 2 po x 2 po). (C) Marquage final à l’aide d’un marqueur cutané stérile. Veuillez cliquer ici pour voir une version agrandie de cette figure.
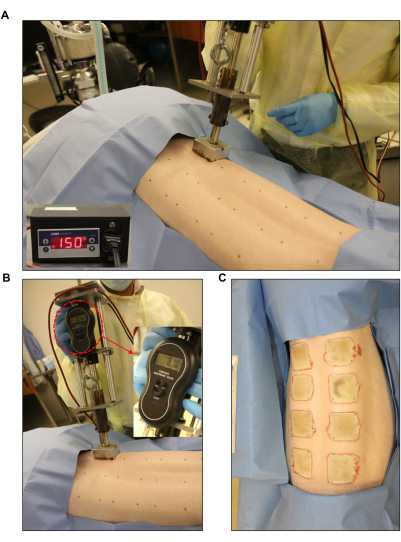
Figure 3 : Induction de la plaie par brûlure. (A,B) Brûleur normalisé muni d’un manomètre et d’une unité de contrôle automatisée (2 po x 2 po) appliqué sur le site de la plaie prémarquée. (C) Tout le dos montrant les huit brûlures sur toute l’épaisseur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
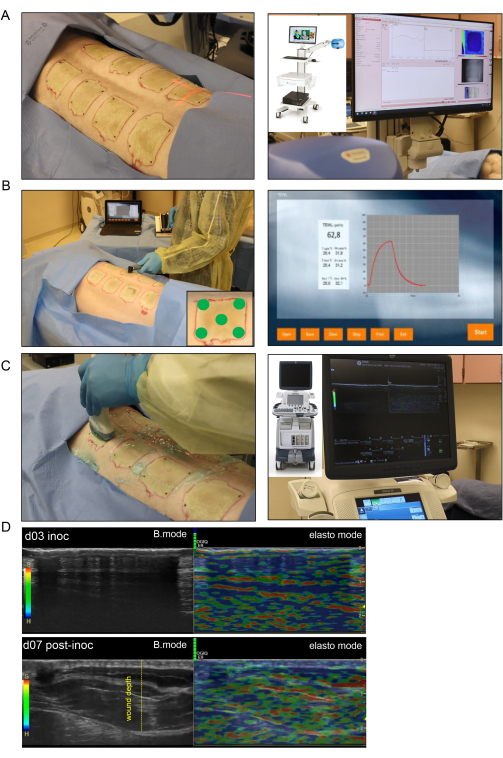
Figure 4 : Imagerie et évaluation non invasives des brûlures. (A) L’imagerie par chatoiement laser (LSI) avec une orientation correcte de l’indicateur de faisceau laser vers le centre de la plaie est illustrée dans l’image de gauche ; l’image de droite montre le dispositif LSI et la carte de perfusion vasculaire cutanée en temps réel. (B) L’application de la sonde de perte d’eau transépidermique (TEWL) sur le site de la plaie à cinq endroits différents (quatre coins de la plaie et le centre illustrés dans l’image du coin inférieur droit) est illustrée dans l’image de gauche ; l’image de droite est un écran représentatif capturé en temps réel de la mesure TEWL. (C) L’échographie harmonique de la brûlure à l’aide d’une sonde à ultrasons à haute résolution de 16 MHz est représentée sur le côté gauche ; L’image de droite montre l’appareil à ultrasons et l’enregistrement d’écran en temps réel. (D) Images structurelles (images en mode B, échographie en niveaux de gris) et biomécaniques (élastographie, échographie couleur) du site de la brûlure au jour de l’inoculation et au jour 7 après l’inoculation. La profondeur de la plaie est indiquée par la ligne pointillée jaune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
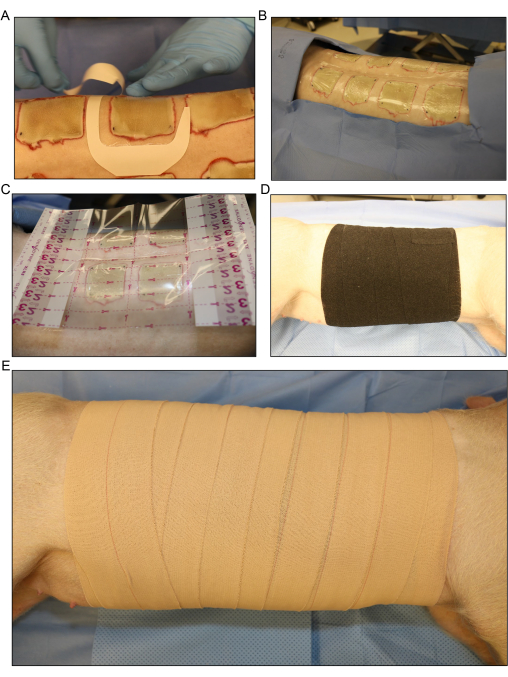
Figure 5 : Pansement et bandage. (A) Application du pansement en film transparent pour chaque plaie séparément. (B) Toutes les brûlures inoculées dorsales sont recouvertes de la première couche de pansement. (C) Un pansement en film transparent plus grand est placé sur toute la zone de la plaie. (D) Application de la deuxième couche de gaze et d’une couche lâche de bandage élastique extensible autour de tout le tronc du porc pour absorber tout exsudat liquide provenant des plaies. (E) Revêtement de toute la zone de la plaie avec une dernière couche de 4 pansements adhésifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
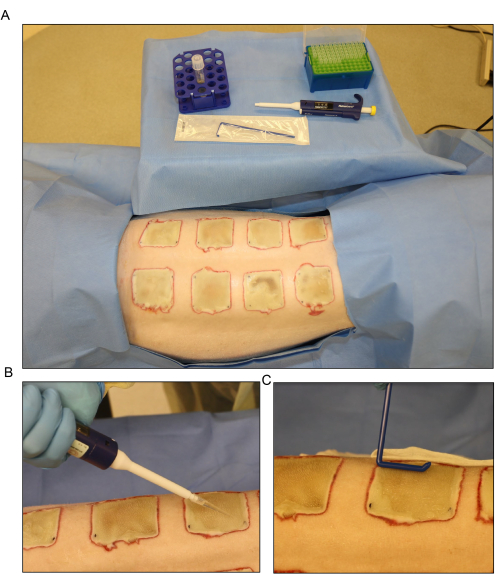
Figure 6 : Inoculation bactérienne. (A) Mise en place de l’inoculation de Pseudomonas aeruginosa (PA01) au jour 3 après le brûlage. (B) Application topique de l’inoculum à l’aide d’une pipette à l’aide d’un volume de 500 μL pour chaque plaie. (C) L’inoculum est dispersé uniformément sur la surface de la plaie à l’aide d’un épandeur stérile jetable. Veuillez cliquer ici pour voir une version agrandie de cette figure.
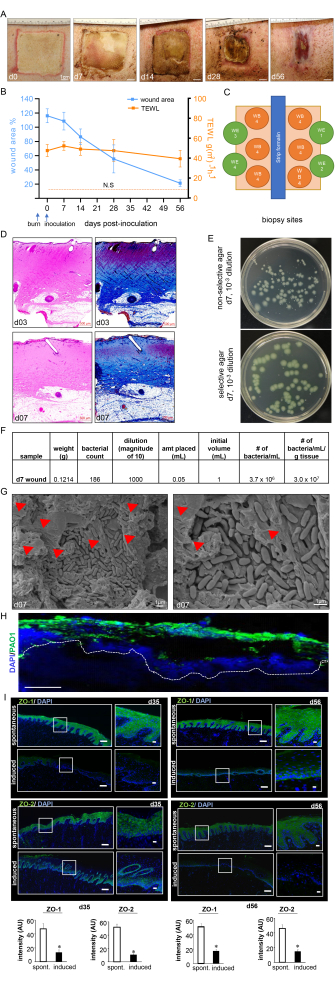
Figure 7 : Progression de la cicatrisation de la plaie et confirmation du biofilm. (A) Images représentatives de la fermeture de la plaie sur la chronologie de l’étude. Barre d’échelle = 1 cm. (B) Quantification de la zone de la plaie et mesures de la TEWL sur la chronologie de l’étude (n = 6). Les données sont représentées sous la forme d’une moyenne ± SD. N.S. fait référence à la valeur TEWL d’une peau normale. (C) Schéma de principe montrant les différents sites de biopsie de la plaie. D. Coloration H&E avec sa coloration trichrome de Masson correspondante montrant une distorsion et une nécrose de toutes les couches de la peau au jour 3 après la combustion et au jour 7 après l’inoculation. Barre d’échelle = 500 μm. (E) Images numériques représentatives d’une gélose non sélective (gélose Luria-Bertani) et d’une gélose sélective (gélose d’isolement Pseudomonas) avec des colonies bactériennes cultivées à partir de tissus de lit de plaie porcine. Le milieu sélectif permet le comptage précis des colonies de PA01 uniquement. (F) Un calcul de l’unité formant colonie (UFC) de l’échantillon à partir du nombre de colonies prélevé sur les biopsies des plaies post-inoculation traitées au jour 7 est présenté. (G) Images représentatives de la microscopie électronique à balayage (MEB) des brûlures inoculées au jour 7 après l’inoculation montrant le biofilm PA01 établi, avec une image agrandie sur le côté droit. Barre d’échelle = 1 μm. Les pointes de flèche rouges indiquent les substances polymériques extracellulaires (EPS). (H) P. aeruginosa sur les brûlures a été visualisé à l’aide d’anticorps anti-Pseudomonas (verts) ; les images d’immunofluorescence des biopsies post-inoculation de la plaie au jour 7 montrent une forte colonisation des tissus de la plaie par P. aeruginosa. Barre d’échelle = 100 μm. (I) Mosaïque représentative (barre d’échelle = 200 μm) et images agrandies correspondantes (barre d’échelle = 50 μm) de coupes colorées par ZO-1 et ZO-2 aux jours 35 et 56 après l’inoculation, démontrant une expression réduite des protéines après l’infection induite. Les coupes congelées enrobées d’OCT (10 μm) ont été colorées à l’aide d’anti-ZO-1 (vert) ou d’anti-ZO-2 (vert). Les sections ont été contre-colorées à l’aide de DAPI. Les diagrammes à barres présentent la quantification de l’intensité des signaux ZO-1 et ZO-2. Les données sont présentées sous forme de moyenne ± écart-type (n = 3) ; * p < 0,05 par rapport aux spontanés. Des tests de variance à un facteur d’analyse de Mann-Whitney ou de Kruskal-Wallis ont été effectués pour tester la signification. La figure 7H,I a été modifiée à partir de Roy et al.13. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce rapport fournit un protocole détaillé pour la mise en place d’un modèle porcin d’infection chronique du biofilm de la plaie pour les études expérimentales. Plusieurs modèles de biofilm porcin ont déjà été rapportés 22,23,24,25,26, mais aucun d’entre eux n’est un modèle porcin impliquant des études à long terme de 8 semaines. Les plaies chroniques sont celles qui restent ouvertes pendant 4 semaines ou plus 14,27,28. Il n’y a pas d’autres modèles de biofilm de plaie chronique rapportés dans la littérature. Ce travail aborde la notion de fermeture fonctionnelle de la plaie 2,7,13,15,17,29. Une étude menée en 2014 a été la première à rapporter que les plaies infectées par le biofilm peuvent se refermer sans la restauration de la fonction barrière7. La mesure de la fonction de barrière cutanée dans la plaie cicatrisante à l’aide de la perte d’eau transépidermique (TEWL) est rapportée dans ce travail.
Anatomiquement et physiologiquement, la peau du porc, comparée à celle d’autres petits animaux, est plus proche de la peau humaine32,33,34. La peau du porc et celle de l’homme ont un épiderme épais 33, et le rapport d’épaisseur dermo-épidermique varie de 10 :1 à13 :1 chez le porc, ce qui est comparable à l’homme34,35. Histologiquement et biomécaniquement, la peau des humains et des porcs présente des similitudes dans les crêtes de rete, la graisse sous-cutanée, le collagène dermique, la distribution des cheveux, les structures annexielles et la taille et la distribution des vaisseaux sanguins36,37,38. Sur le plan fonctionnel, les porcs et les humains partagent des similitudes dans la composition des composants lipidiques, protéiques et kératiniques de la couche épidermique, ainsi que des profils immunohistologiques comparables37,38. Le système immunitaire porcin, comparé à celui d’autres petits animaux, partage des similitudes plus élevées avec le système immunitaire humain, ce qui signifie que les porcs sont un modèle approprié pour les études sur les interactions avec l’hôte qui font partie intégrante des complexités du biofilm pathologique dans les infections des plaies39. L’évaluation critique des avantages et des inconvénients offerts par divers modèles animaux a conduit au consensus sur le fait que les porcs représentent un modèle efficace pour étudier la cicatrisation des plaies34,38. De plus, les porcs domestiques développent spontanément des infections bactériennes chroniques, comme cela a été observé chez l’homme10. Le dispositif de brûlure utilisé pour créer les plaies est un dispositif de brûlure avancé et automatisé qui fournit de l’énergie thermique en fonction d’une température lue à partir du site cutané ciblé22,40. Une telle approche améliore la rigueur et la reproductibilité de la brûlure. L’utilisation d’isolats cliniques humains de bactéries pour infecter les plaies de porc ajoute de la valeur en tant que modèle préclinique.
Les brûlures sont complexes et causent plusieurs perturbations systémiques20,41. Ainsi, il est important de réanimer le porc avec des liquides adéquats et de prévenir l’hypothermie pendant l’anesthésie et la récupération. Plusieurs facteurs peuvent interférer avec la cicatrisation de la plaie, notamment la nutrition post-brûlure, les liquides et la douleur42. Il est donc important de surveiller de près l’évaluation de la nutrition et de la douleur. La douleur post-brûlure peut être intense et influencer le comportement et l’alimentation de l’animal. Les interventions visant à résoudre les problèmes de comportement doivent être activement envisagées. Il est impératif d’évaluer et de gérer la douleur de façon régulière et continue. Une fiche d’évaluation complète de la douleur avec un plan de gestion de la douleur très détaillé est incluse dans ce protocole. Pour éviter la contamination croisée entre les plaies, une attention particulière doit être portée à l’application de la première couche du pansement sur chaque plaie séparément. Des précautions critiques doivent être prises lors de la manipulation de toutes les matières biologiques dangereuses et lors de la désinfection complète de l’équipement, des outils et de l’ensemble de la salle d’opération. L’application de plusieurs couches de pansement empêche le porc d’exposer les plaies pendant son effort pour frotter ou gratter le dos qui démange.
Le porc dans le modèle actuel n’était pas compromis par des troubles métaboliques sous-jacents (par exemple, le diabète) et, par conséquent, l’effet étudié était purement l’impact de l’infection du biofilm bactérien sur la cicatrisation des plaies. Cependant, le modèle se prête à l’induction du diabète (en utilisant la streptozotocine par exemple) et pourrait être utilisé pour étudier l’infection par le biofilm en relation avec un trouble métabolique sous-jacent. L’autre limite du modèle est le cadre d’infection contrôlée à l’aide de P. aeruginosa, une bactérie. On s’attend à ce que la microflore cutanée normale du porc se développe également dans la plaie et puisse avoir un impact sur la cicatrisation. Une analyse plus approfondie à l’aide de NGS ou d’autres techniques avancées pour délimiter le contenu microbien de la plaie est nécessaire. Le modèle actuel pourrait également être appliqué à des infections mixtes avec différentes espèces microbiennes (p. ex., fongiques, virales, etc.). Il s’agit d’un élément important, car les plaies cliniquement pertinentes sont susceptibles d’être peuplées de microbes mixtes, ce qui peut avoir un impact différentiel sur la cicatrisation des plaies.
Ce modèle présente de nombreux avantages potentiels, notamment la similitude avec la complexité et les séquelles à long terme des plaies chroniques humaines, le processus de brûlure automatisé et reproductible et l’utilisation d’espèces bactériennes cliniquement isolées. L’utilisation de multiples modalités d’imagerie non invasives représente une approche puissante pour recueillir des données physiologiques utiles caractérisant la plaie. Enfin, l’évaluation de la cicatrisation fonctionnelle des plaies via la restauration de la fonction barrière cutanée sur la base de la TEWL est essentielle. En conclusion, un protocole robuste, simple, détaillé et facile à utiliser pour développer une brûlure grave infectée par un biofilm à l’aide d’un système modèle porcin est présenté dans ce travail.
Déclarations de divulgation
Les auteurs ne déclarent pas d’intérêts concurrents.
Remerciements
Nous tenons à remercier le Laboratory Animal Resource Center (LARC) de l’Université de l’Indiana pour son soutien et les soins vétérinaires prodigués aux animaux pendant l’étude. Ce travail a été en partie soutenu par les subventions NR015676, NR013898 et DK125835 des National Institutes of Health et par la subvention W81XWH-11-2-0142 du ministère de la Défense. De plus, ce travail a bénéficié des prix suivants des National Institutes of Health : GM077185, GM069589, DK076566, AI097511 et NS42617.
matériels
| Name | Company | Catalog Number | Comments |
| Sedation | |||
| Ketamine | Zoetis | 10004027 | 100mg/ml |
| Telazol | Zoetis | 106-111 | 100mg/ml |
| Xylazine | Pivetal | 04606-6750-02 | 100mg/ml Anased |
| 3ml syringe w/ 20g needle | Covidien-Monoject | 8881513033 | |
| Winged infusion set 21g | Jorgensen Labs | J0454B | |
| Anesthetic | |||
| Isoflurane | Pivetal | 21295097 | |
| Surgery | |||
| Hair clippers | Wahl | 8787-450A | |
| Nair | Church and Dwight Co. Inc | 70506572 | |
| Chlorhexidine Solution | First Priority Inc. | 179925722 | |
| 70% Isopropyl Alcohol | Uline | S-17474 | |
| 0.9% Saline Solution | ICU Medical | RL-7282 | |
| Non-woven gauze | Pivetal | 21295051 | |
| Paper tape | McKesson | 455531 | |
| 2" Elastic tape | Pivetal | 21300869 | |
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Spay hook | Jorgensen Labs | J0112A | |
| Sterile lube | McKesson | 16-8942 | |
| Laryngoscope | Jorgensen Labs | J0449S | |
| Roll gauze | Pivetal | 21295032 | |
| Endotracheal tube (7-9mm) | Covidien | 86112 | Shiley Hi-Lo Oral Nasal Tracheal Tube Cuffed |
| 15gtt/ml IV administration set | ICU Medical | 12672-28 | |
| LRS 1000ml bag | ICU Medical | 07953-09 | |
| Three Quarter Drape Sheet | McKesson | 16-i80-12110G | |
| Analgesia | |||
| Buprenorphine | RX Generics | 42023-0179-05 | 0.3mg/ml |
| Fentanyl Transdermal | |||
| Carprofen | 21294548 | Pivetal | 50mg/ml Levafen |
| Bandaging | |||
| Transparent film dressing 26x30 | Genadyne Biotechnologies | A4-S00F5 | |
| Film dressing 4 x 4-3/4 Frame Style | McKesson | 886408 | |
| Vetrap | 3M | 1410BK BULK | |
| Elastic tape 4" | Pivetal | 21300931 | |
| Kerlix Roll Gauze | Cardinal Health | 3324 | |
| Imaging | |||
| Canon EOS 80D | Canon | 1263C004 | |
| Speedlight 600EX II-RT | Canon | 1177C002 | |
| EFS 17-55mm Ultrasonic | Canon | 1242B002 | |
| GE Logiq E9 | GE | 5197104-2 | |
| ML6-15 Probe | GE | 5199103 | |
| PeriCamPSI | Perimed | 90-00070 | |
| DermaLab | Cortex Technologies Inc | 4608D78 | |
| Biopsy/Tissue Collection | |||
| 6mm punch biopsy | Integra Lifesciences | 33-36 | |
| bupivicaine 0.5% | Auromedics Pharma | 55150017030 | |
| Size 10 Disposable Scalpel | McKesson | 16-63810 | |
| Dissection scissors | Pivetal | 21294806 | |
| Rat tooth thumb tissue forceps | Aesculap | BD512R | |
| Non-adherent Dressing | Covidien | 2132 | Telfa |
| 50ml Conical tube | Falcon | 352070 | |
| Eppendorf/microcentrifuge tube | Fisherbrand | 02-681-320 | |
| OCT Cassette | |||
| Non Woven Gauze 4x4 | Pivetal | 21295051 | |
| Inoculum | |||
| Low salt LB agar | Invitrogen | 22700-025 | |
| Low salt LB broth | Fisher scientific | BP1427-500 | |
| Petri plate | Falcon | REF-351029 | |
| Polyprophyline round bottom tubes (14 ml) | Falcon | REF-352059 | |
| Pseudomonas Agar Base (Dehydrated) | Thermo Scientific | OXCM0559B | |
| LB Agar, powder (Lennox L agar) | Thermo Fisher Scientific (Life Technologies) | 22700025 | |
| Gibco™ DPBS, calcium, magnesium | Gibco | 14040133 | |
| Euthanasia | |||
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Fatal Plus | Vortech Pharmaceuticals | 9373 |
Références
- Goodwine, J., et al. Pyruvate-depleting conditions induce biofilm dispersion and enhance the efficacy of antibiotics in killing biofilms in vitro and in vivo. Scientific Reports. 9 (1), 3763(2019).
- Sen, C. K., Roy, S., Mathew-Steiner, S. S., Gordillo, G. M. Biofilm management in wound care. Plastic and Reconstructive Surgery. 148 (2), 275-288 (2021).
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clinical Microbiology Reviews. 19 (2), 403-434 (2006).
- Nguyen, T. T., Gilpin, D. A., Meyer, N. A., Herndon, D. N. Current treatment of severely burned patients. Annals of Surgery. 223 (1), 14-25 (1996).
- Eriksson, E., et al. Chronic wounds: Treatment consensus. Wound Repair and Regeneration. 30 (2), 156-171 (2022).
- Lebeaux, D., Chauhan, A., Rendueles, O., Beloin, C. From in vitro to in vivo models of bacterial biofilm-related infections. Pathogens. 2 (2), 288-356 (2013).
- Ganesh, K., et al. Chronic wound biofilm model. Advances in Wound Care. 4 (7), 382-388 (2015).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Stewart, P. S. Biophysics of biofilm infection. Pathogens and Disease. 70 (3), 212-218 (2014).
- Jensen, L. K., Johansen, A. S. B., Jensen, H. E. Porcine models of biofilm infections with focus on pathomorphology. Frontiers in Microbiology. 8, 1961(2017).
- Mah, T. F., O'Toole, G. A. Mechanisms of biofilm resistance to antimicrobial agents. Trends in Microbiology. 9 (1), 34-39 (2001).
- Gonzalez, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023(2018).
- Roy, S., et al. Mixed-species biofilm compromises wound healing by disrupting epidermal barrier function. Journal of Pathology. 233 (4), 331-343 (2014).
- Sen, C. K. Human wound and its burden: Updated 2020. Compendium of Estimates. Advances in Wound Care. 10 (5), 281-292 (2021).
- Barki, K. G., et al. Electric field based dressing disrupts mixed-species bacterial biofilm infection and restores functional wound healing. Annals of Surgery. 269 (4), 756-766 (2019).
- Dusane, D. H., et al. Electroceutical treatment of Pseudomonas aeruginosa biofilms. Scientific Reports. 9 (1), 2008(2019).
- Roy, S., et al. Staphylococcus aureus biofilm infection compromises wound healing by causing deficiencies in granulation tissue collagen. Annals of Surgery. 271 (6), 1174-1185 (2020).
- Ghanbari, A., et al. Inoculation density and nutrient level determine the formation of mushroom-shaped structures in Pseudomonas aeruginosa biofilms. Scientific Reports. 6, 32097(2016).
- Yin, R., Cheng, J., Wang, J., Li, P., Lin, J. Treatment of Pseudomonas aeruginosa infectious biofilms: Challenges and strategies. Frontiers in Microbiology. 13, 955286(2022).
- Norbury, W., Herndon, D. N., Tanksley, J., Jeschke, M. G., Finnerty, C. Infection in burns. Surgical Infections. 17 (2), 250-255 (2016).
- Nitz, F., et al. Molecular detection of drug-resistance genes of bla(OXA-23)-bla(OXA-51) and mcr-1 in clinical isolates of Pseudomonas aeruginosa. Microorganisms. 9 (4), 786(2021).
- Davis, S. C., et al. Microscopic and physiologic evidence for biofilm-associated wound colonization in vivo. Wound Repair and Regeneration. 16 (1), 23-29 (2008).
- Breuing, K., Kaplan, S., Liu, P., Onderdonk, A. B., Eriksson, E. Wound fluid bacterial levels exceed tissue bacterial counts in controlled porcine partial-thickness burn infections. Plastic and Reconstructive Surgery. 111 (2), 781-788 (2003).
- Nusbaum, A. G., et al. Effective method to remove wound bacteria: Comparison of various debridement modalities in an in vivo porcine model. Journal of Surgical Research. 176 (2), 701-707 (2012).
- Hirsch, T., et al. Enhanced susceptibility to infections in a diabetic wound healing model. BMC Surgery. 8, 5(2008).
- Roche, E. D., et al. Increasing the presence of biofilm and healing delay in a porcine model of MRSA-infected wounds. Wound Repair and Regeneration. 20 (4), 537-543 (2012).
- Hartoch, R. S., McManus, J. G., Knapp, S., Buettner, M. F. Emergency management of chronic wounds. Emergency Medical Clinics of North America. 25 (1), 203-221 (2007).
- Mustoe, T. Understanding chronic wounds: a unifying hypothesis on their pathogenesis and implications for therapy. American Journal of Surgery. 187 (5), 65-70 (2004).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Sinha, M., et al. Pseudomonas aeruginosa theft biofilm require host lipids of cutaneous wound. Annals of Surgery. 277 (3), e634-e647 (2023).
- Fan, G. Y., et al. Severe burn injury in a swine model for clinical dressing assessment. Journal of Visualized Experiments. (141), e57942(2018).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Meyer, W., Schwarz, R., Neurand, K. The skin of domestic mammals as a model for the human skin, with special reference to the domestic pig. Current Problems in Dermatology. 7, 39-52 (1978).
- Vardaxis, N. J., Brans, T. A., Boon, M. E., Kreis, R. W., Marres, L. M. Confocal laser scanning microscopy of porcine skin: implications for human wound healing studies. Journal of Anatomy. 190, 601-611 (1997).
- Heinrich, W., Lange, P. M., Stirtz, T., Iancu, C., Heidemann, E. Isolation and characterization of the large cyanogen bromide peptides from the alpha1- and alpha2-chains of pig skin collagen. FEBS Letters. 16 (1), 63-67 (1971).
- Marcarian, H. Q., Calhoun, M. L. Microscopic anatomy of the integument of adult swine. American Journal of Veterinary Research. 27 (118), 765-772 (1966).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Dawson, H. D., et al. Structural and functional annotation of the porcine immunome. BMC Genomics. 14, 332(2013).
- Kim, J. Y., Dunham, D. M., Supp, D. M., Sen, C. K., Powell, H. M. Novel burn device for rapid, reproducible burn wound generation. Burns. 42 (2), 384-391 (2016).
- Nielson, C. B., Duethman, N. C., Howard, J. M., Moncure, M., Wood, J. G. Burns: Pathophysiology of systemic complications and current management. Journal of Burn Care and Research. 38 (1), e469-e481 (2017).
- Rowan, M. P., et al. Burn wound healing and treatment: Review and advancements. Critical Care. 19 (1), 243(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon