Method Article
バイオフィルム感染と不可視創傷のブタモデル
要約
抗生物質に耐性のある慢性創傷は、医療システムにとって大きな脅威です。バイオフィルム感染症は頑固で敵対的であり、機能不全の創傷閉鎖を引き起こす可能性があります。我々は、バイオフィルムに感染した全層慢性創傷の臨床的に関連する豚モデルを報告する。このモデルは、メカニズム研究だけでなく、介入のテストにも強力です。
要約
バイオフィルム感染は、創傷慢性化の主な原因です。臨床的に関連する実験的創傷バイオフィルム感染の確立には、宿主免疫系の関与が必要です。このような臨床的に関連するバイオフィルムの形成中の宿主および病原体の反復的変化は、 in vivoでのみ 起こり得る。豚創傷モデルは、強力な前臨床モデルとしての利点が認められています。創傷バイオフィルムを研究するためのいくつかのアプローチが報告されています。 in vitro および ex vivo 系は、宿主の免疫応答の点で欠如しています。短期間の in vivo 試験では急性反応を伴うため、臨床的に起こることが知られているようなバイオフィルムの成熟は認められません。2014年に初めて豚の創傷バイオフィルムの長期研究が報告されました。この研究では、バイオフィルムに感染した創傷は、プラニメトリーによって決定されたように閉じる可能性がありますが、患部の皮膚バリア機能は回復しない可能性があることが認識されました。その後、この観察は臨床的に検証されました。こうして、機能的創傷閉鎖の概念が生まれました。閉じているが皮膚のバリア機能が欠如している傷は、目に見えない傷と見なすことができます。この研究では、バイオフィルムに感染した重度の熱傷の長期ブタモデルを再現するために必要な方法論的詳細を報告しようとしています。このプロトコルは、 緑膿菌 (PA01)を使用して8週間の創傷バイオフィルム感染を確立するための詳細なガイダンスを提供します。家畜の白豚の背部に8つの全層の熱傷が対称的に作成され、火傷後3日目に(PA01)を接種されました。その後、レーザースペックルイメージング(LSI)、高解像度超音波(HUSD)、および経表皮水分損失(TEWL)を使用して、さまざまな時点で創傷治癒の非侵襲的評価を実施しました。接種した火傷は4層の包帯で覆われていました。バイオフィルムは、接種後7日目にSEMによって構造的に確立され、確認されたように、機能的な創傷閉鎖を損ないました。このような有害な結果は、適切な介入に応じて逆転する可能性があります。
概要
バイオフィルム感染は、火傷や慢性創傷を複雑にし、慢性化を引き起こします1,2,3,4,5。微生物学では、主に微生物に焦点をあててバイオフィルムのメカニズムが研究されている1,6。これらの研究から得られた教訓は、生物科学の観点から最も重要であるが、臨床的に関連する病原性バイオフィルムに必ずしも適用できるとは限らない6,7,8。臨床的に関連するバイオフィルム構造凝集体には、微生物因子と宿主因子が含まれている必要があります8,9,10。このような微小環境は、臨床的に関連するバイオフィルムの開発に不可欠な宿主-微生物反復相互作用の包含を可能にする7,8。このようなプロセスでは、免疫細胞と血液媒介因子の関与が重要です11,12。慢性創傷に見られるように、臨床病原性バイオフィルムの根底にある宿主と微生物の相互作用は、長期間にわたって発生します。したがって、バイオフィルム感染の翻訳関連モデルの開発を目的とした実験的アプローチは、これらの要因を考慮する必要があります。そこで、臨床的に再現可能なブタ慢性バイオフィルム感染モデルの開発を目指しました。
人間の研究は明らかに治癒の結果を研究するための最良のアプローチを表していますが、多くの場合、根本的なメカニズムや新しいメカニズムのパラダイムに取り組むのには最適ではありません。倫理的懸念により、慢性創傷から異なる時点で複数の生検を採取する必要がある研究デザインの使用が制限されます。したがって、バイオフィルムの運命を徹底的に調べるための侵襲的研究を可能にするために、確立され再現性のある動物モデルを持つことは非常に重要です7,13。動物モデルの選択は、科学的/トランスレーショナルな関連性やロジスティックスなど、いくつかの要因によって異なります。ブタ系は、ヒトの皮膚創傷を研究するための最も翻訳的に価値のある実験モデルであると広く認められています7。したがって、この研究は、バイオフィルムに感染した全層熱傷の確立されたブタモデルを報告します。この作業は、文献2,7,13,14,15,16,17で報告されているいくつかの元の出版物に基づいています。この研究では、多剤耐性緑膿菌(PA01)の臨床分離株が創傷に感染するために選択されました。緑膿菌は創傷感染症の一般的な原因です2,18,19,20。グラム陰性菌であり、一部の抗生物質に対する耐性があるため、治療が困難な場合があります11,19,21。これまでに報告されたブタバイオフィルムモデルは、8週間の長期研究22、23、24、25、26を含みませんでした。慢性創傷は、4週間以上開いたままの創傷です14,27,28。文献には他の慢性創傷バイオフィルムモデルが報告されていません。この研究は、機能的創傷閉鎖の概念を扱っています2,7,13,15,17,29。
プロトコル
すべての動物実験は、Institutional Animal Care and Use Committee(IACUC)#21147によって承認されたプロトコルに従って実施されました。この研究は、インディアナ大学の実験動物リソースセンター(LARC)で実施されました。このプロトコルでは、雌の家畜白豚(70〜80ポンド)を使用しました。
1.動物の順応
- 豚が施設に到着したら、順応と社会的交流のために、少なくとも3日間、同じ部屋に動物を個別に収容します。
- 豚にバランスの取れた食事を与えます。体重に基づいて給餌量を決定し、メーカーの推奨事項に従ってください。
- 麻酔中の吐き気、嘔吐、胃液の誤嚥を防ぐために、処置の前に動物を6〜12時間絶食させてください。
2. 手術室の設営
- 麻酔器を準備し、再呼吸回路の準備ができていることを確認します。
- 以下に説明するように、手術用の部屋を配置します(図1A)。
- 処置台を滅菌ドレープで覆い、その下に循環水ブランケットを敷いて体温調節を助けます。
- 誘導用品と手術準備資料をテーブルに設置します。バーナー装置とコントロールボックスを備えたテーブルを設置します。イメージング機器をセットアップし、電源が入っていることを確認します。
3.豚の鎮静
- 1 mL / 50ポンドの用量でTKX(テラゾール4.4 mg / kg、ケタミン2.2 mg / kg、キシラジン2.2 mg / kg)の筋肉内注射で豚を鎮静させます。.処置室で、マスク を介して 送達された1%〜3%のイソフルランで豚を維持します。
- IACUCプロトコルに従って(術前の)鎮痛薬を豚に投与します。いくつかの例は次のとおりです:ブプレノルフィン0.3 mg / mL、0.01-0.05 mg / kg IM;カルプロフェン 50 mg/mL、4 mg/kg IM または SQ;フェンタニル経皮吸収型100mcg / hを耳の耳介に置きます。ガバペンチン300mgカプセル、3-10 mg / kg PO。
注:すべての火傷および生検手順では、手術の前日にガバペンチンを1回投与し、処置当日にカルプロフェンを1回投与します。主な燃焼手順では、フェンタニルパッチを配置し、手術の準備中にブプレノルフィンを1回全量投与します。
4.麻酔の導入
- 2%クロルヘキシジンスクラブとアルコールを交互に少なくとも3回使用して耳を消毒します。A 22-18 G 1 in 静脈カテーテルを耳辺縁静脈に挿入し、血流を確認します。カテーテルを生理食塩水で洗い流し、サージカルテープでカテーテルを固定します(図1B)。
- マスク を介して 麻酔を吸入して筋肉の弛緩が達成されたら、適切なサイズの気管内チューブ(7〜9 mm)で豚を挿管します。.顎の緊張の喪失と眼瞼反射が観察されることで、筋肉の弛緩を確認します。
- チューブを開き、空気の注射器を使用してカフの漏れをテストします。喉頭鏡30の助けを借りてチューブを挿入します。
- カフを膨らませ、適切な配置が確認されたらチューブを固定します。ブタを再呼吸回路に接続します。
注意: チューブは鼻の上で所定の位置に結び付けられ、ロールガーゼを使用して固定されます。胸部の聴診は聴診器で行われ、チューブの適切な配置を確認します。
注意: 麻酔中は、体位無気肺を防ぐために、圧力圧力計が20 mm / Hgに達するまで、ポップオフバルブを閉じ、再呼吸バッグを押し下げることにより、5〜10分ごとに空気が供給されます。
- 動物と麻酔の深さを監視します。
- ブタをマルチパラメータモニターに接続します。モニターは、酸素飽和度(SpO 2)、脈拍数、終潮二酸化炭素(EtCO2)、呼吸数、および温度を継続的に読み取ります。手順全体を通して10分ごとにバイタルを記録します。
- 創傷を開始する前に、後ろ足のつま先をつまんで痛みの反射をテストして、麻酔の深さを評価します。
注意: 必要に応じて、麻酔薬気化器を調整して追加の麻酔を投与するか、数分待ちます。手術中は、疼痛反射と眼瞼反射を定期的にチェックしてください。
5.火傷傷のための動物の準備
- 豚を麻酔器から外し、処置台に移します。豚を胸骨横臥位に置き、接続されているすべてのラインとチューブを固定してください(図1C)。
- 豚を麻酔器に再接続し、手順が終了するまで、O2 を0.8〜1.5 L / minに、イソフルランを1%〜3%に維持します。
- 8〜10 mL / kg / hの点滴速度で豚にIV輸液(LRS)を投与します。ステップ4.3のように麻酔を監視します。
6.皮膚の火傷部位の防腐剤の準備とマーキング
- 以下に説明するように、毛を剃って脱毛クリームを塗布して、傷口を準備します(図2)。
- 電気バリカンを使用して、脊柱から両側の腋窩まで幅約25cmの領域で豚の背部を剃ります。
- 刈り取った部分に脱毛クリームを塗り、3〜7分間放置します。清潔な吸収性タオルを使用して、髪と一緒にクリームを取り除きます。
- 焼却部位の準備
- 2%クロルヘキシジンスクラブと70%イソプロピルアルコールを交互に約5分間、少なくとも3回こすります。滅菌手袋を着用した担当者が、スクラブをブルズアイパターン(中央から始めてらせん状に外側に移動する)で塗布されていることを確認します。
- 滅菌熱傷テンプレートと外科用皮膚マーカーを使用して創傷部位に印を付けます(図2B)。背部に6〜8個の傷(2インチx 2インチ)を対称的にマークします。
- 汚染を減らすために、マークされた部位の周囲を滅菌ドレープで覆います(図2C)。
7.火傷の傷の手順
- 金属製のスタイラスに接続された2インチx 2インチのステンレス鋼ブロック(重量:352 g)、電子マイクロスタット、電子スケール(総重量:1,714 g; 図3)。
- バーナーを希望の温度に設定します。全層創傷の目標温度を150°Cに調整します(図3A)。これを行うには、コントロールユニットの設定値(SP)を150°Cに調整します。 下限設定値を145°Cに、上限設定値を155°Cに設定します(図1D)。
- 火傷装置に接続された加熱されたステンレス鋼ブロックを使用し、それらを60秒間皮膚に置くことにより、2インチx 2インチの全層火傷傷を作成します(図3B、C)。火傷の適用中は、電子スケールを使用して、バーナーによって均一な圧力が加えられていることを確認します。
8.火傷の診断とイメージング
- デジタル写真
- デジタル一眼レフカメラとエレクトロフォーカスショートバックフォーカス(EFS)、17-55mm超音波広角レンズ、懐中電灯を使用して傷を画像化します。
- 豚の識別番号、時刻、日付が記載されたプラカードを含め、豚全体のデジタル写真を撮ります。次に、豚のID、傷のIDと時点、および定規が記載されたプラカードを示す各傷の画像を個別に撮影します。
- 創傷面積を、56日目までの収集の各時点での元の創傷サイズのパーセンテージとして計算します。
注:この研究では、各時点(d0、d7、d14、d28、およびd56)で、d0の元の創傷面積のパーセンテージとして創傷面積が計算されました。
- レーザースペックルイメージング(LSI)
- レーザースペックルイメージングでは、レーザースペックルコントラスト分析(LASCA)技術に基づく血液灌流イメージャーを使用して、創傷微小血管灌流をリアルタイムで評価します。
- 1回の録画ですべての傷の画像を撮影します。レーザーカメラから創傷までの作動距離の測定値を調整して、各創傷のイメージングで一致するようにします(図4A)。
- 10〜15秒のスパンで撮影された一連の画像によって灌流を記録します。傷口が撮影されると、録画は自動的に一時停止し、その後の傷口に合わせてカメラが調整されると、録画が再開されます。記録が一時停止するたびに、傷を識別するためのマーカーが追加されます。
- 経表皮水分損失(TEWL)
- 標準ユニット、TEWLプローブ、およびソフトウェアを使用して、各創傷のTEWLを測定します(図4B)。創傷ごとに、創傷組織と接触するプローブ先端に清潔なプローブカバーを置きます。
- プローブを皮膚に優しく均等に置き、ユニットの スタート ボタンを押して読み取りを開始します。
- 各傷口を5回、最初に中央で、次に各角で測定します。次に、すべての測定値をスプレッドシートにエクスポートします(図4B)。
- 高調波超音波(HUSD)
- 正中線(脊柱)から正中線(脊柱)から正常な皮膚が再び正常な皮膚があるブタの外側に向かって超音波(US)プローブで創傷をスキャンして、HUSDマッピングを実行します。超音波装置を使用して、Bモードモードと組織エラストグラフィモードの両方で、各創傷についてこのスキャンパターンに従います(図4C)。
- Bモードスキャンの場合は、滅菌超音波ジェルを創傷部位に塗布し、ML-615高解像度プローブに塗布します。各録音に創傷識別ラベルの注釈を付けます。記録を開始し、反対側の正常な皮膚に到達するまで、プローブを正中線から創傷までゆっくりと動かします。
注意: スキャンが終了すると、記録は保存され、分析のためにマシンからエクスポートされます。 - エラストグラフィの場合は、 Elesto ボタンを押して超音波装置をエラストモードに切り替えます。Bモードスキャンと同じ方法で創傷を再度スキャンし、プローブの圧力が均一に保たれ、エラストグラフィカラーインジケーター(緑色のバー)が記録中ずっと見えるようにします。
メモ: 適切な圧力は、正しい接触が行われていると緑色で表示される記録のスケールバーによって決定できます(図4D)。 - 各創傷がBモードとエラストモードの両方で画像化された後(創傷ごとに2つの記録)アノテーションを変更します。ソフトウェアのコメントを変更して、次の傷の情報を含め、後続の傷についても同じ手順を繰り返します。
- Bモードスキャンの場合は、滅菌超音波ジェルを創傷部位に塗布し、ML-615高解像度プローブに塗布します。各録音に創傷識別ラベルの注釈を付けます。記録を開始し、反対側の正常な皮膚に到達するまで、プローブを正中線から創傷までゆっくりと動かします。
- 正中線(脊柱)から正中線(脊柱)から正常な皮膚が再び正常な皮膚があるブタの外側に向かって超音波(US)プローブで創傷をスキャンして、HUSDマッピングを実行します。超音波装置を使用して、Bモードモードと組織エラストグラフィモードの両方で、各創傷についてこのスキャンパターンに従います(図4C)。
9.包帯と包帯
- 火傷の傷口を透明フィルムドレッシングまたはテストドレッシングで個別に覆います(図5A、B)。大きな透明フィルムドレッシングを創傷領域全体に置きます(図5C)。
- 豚の胴体全体にロールガーゼの2層目をゆるく塗り、傷口から出る液体の滲出液を吸収します。豚を横から少し仰向けに前後に転がして、包帯を豚に巻き付けます。
- ガーゼを柔軟な弾性包帯の層でゆるく覆います(図5D)。包帯をきつく貼りすぎると呼吸が制限され、腹部に圧力がかかり、直腸脱やさまざまな合併症を引き起こす可能性があるため、包帯がきつすぎないようにしてください。
注意: 弾性包帯は伸縮性があり、適用中に簡単に締めすぎる可能性があります。ロールから引き離し、前のラップの端の上に置くと、締めすぎを防ぐのに役立ちます。 - 弾性包帯を最終層4で弾性テープで覆います(図4E)。繰り返しになりますが、塗布がきつすぎないようにしますが、処置後に豚が動き回るときにドレッシングが滑り落ちないように、ドレッシングが上端と下端で固定されていることを確認してください。
10.動物の回復と術後のケア
- 回復
- 創傷、画像診断、包帯の完了時に麻酔ガスを中止します。.豚を少なくとも5分間酸素にとどめます。
- 主囲いに戻った後、豚を輸送/リフトテーブルからケージ内のフォーム回収マットに移動します。自動給水器を上げ、回復中の豚の怪我を防ぐためにjフィーダーを取り外します。
- 低体温症がある場合は、豚を毛布(暖かい空気の毛布を含む)で覆います。10〜15分ごとに、体温、脈拍、呼吸数、SpO2 などのバイタルを監視および記録します。
- 豚が胸骨臥位を独立して維持できるようになるまで、豚を継続的に監視します。.豚が完全に回復したら、乳首給水器を下げてから、豚にも餌を与えることができます。
- 疼痛評価
- 修正されたグラスゴー疼痛スコアリングフォームを使用して、術後の疼痛評価を実行します。術後最初の3〜4日間は、少なくとも12時間ごとにラボまたはLARCスタッフが疼痛評価を完了してください。疼痛スコアリングの頻度は、主治医によって決定されます。動物のスコアが5を超える場合は、レスキュー鎮痛薬(ブプレノルフィンまたはヒドロモルフォン)を投与します。.
- 処置前にブプレノルフィン0.01〜0.05 mg / kg IMの用量を投与し、8〜12時間後に2回目の投与を行うことで鎮痛を提供します。.
- 火傷の傷の前に、耳の耳介にフェンタニルパッチ(100 mcg / h)を置きます。.
- カルプロフェン 4 mg/kg IM または SQ 前処置を注射し、その後、1 日 1 回 IM、SQ、または PO を 2 日間、または LARC 獣医師の指示に従って注射します。
- ガバペンチン3〜10 mg / kgを経口投与し、処置の前日、処置の朝、処置の翌日の夕方、その後3〜5日間12時間ごとに投与します。.
- ダイエット
- 豚が回復していることを確認し、1日2回、体重に応じた飼料に応じて水と餌を自由に使えるようにします。
- 食品(新鮮な果物や野菜、冷凍果物、マシュマロ、ヨーグルト、プリンなど)を提供し、食欲減退が観察された場合はこれらを使用して食事を誘惑します。
- ドレッシング交換
- 包帯が汚れた場合、または治療戦略に対応するために、少なくとも週に1回、またはそれ以上の頻度で包帯を交換してください。
- 麻酔下での画像撮影後に包帯を交換するか、TKXのみで豚を鎮静させてドレッシングを交換します。
- 包帯を交換するには、まず、リスター包帯ハサミまたは外傷ばさみを使用して、包帯の外側が傷口に触れないように注意しながら、汚れた包帯を慎重に取り除きます。
- 必要に応じて、清潔なガーゼに0.9%NaClを使用して傷口の周囲を清掃し、その領域を穏やかに乾かします。セクション9で概説されている包帯の手順に従ってください。
注:実験的な包帯を塗布する場合は、透明フィルムの被覆材で創傷を覆う前に塗布することができます。
- 撮像周波数
- 研究中のさまざまな時点で画像(デジタル写真、LSI、TEWL、およびHUSD)を取得します。接種後-3日目(火傷)、0日目(接種)、および7日目、14日目、28日目、35日目、および56日目の画像データを収集します。
11.バイオフィルムの調製と接種
- 接種剤の調製
- 緑膿菌(PA01)のグリセロールフリーザーストックからスタータープレートを調製し、細菌の純粋培養を行います。緑膿菌培養液を低塩Luria-Bertani寒天培地(LBA)で増殖させ、37°Cで一晩インキュベートします。
- 翌日、5 mLの低塩Luria-Bertaniブロス(LBB)に 緑膿菌 のコロニーを1つ接種し、200rpmで振とうしながら37°Cで一晩インキュベートします。
- 対数期細胞を得るには、200 μLの一晩培養液を5 mLのLBBに接種し、シェーカー内で200 rpm、37°C、2.5時間インキュベートします。
- 分光光度計を用いて600nm(OD600)の光学濃度を測定する。900 μL の滅菌 LBB で培養した 100 μL を使用して、1 x 10-9 までの段階希釈液を調製します。
注:希釈していないサンプルから開始し、1 x 10 7 CFU/mLで終了しました。1 x 107 希釈で可算コロニーが得られたため、この希釈を終了希釈と見なしました。 - 各希釈液100 μLをLBAに広げ、37°Cで一晩インキュベートします。 標準的な微生物学的プロトコルに従って、コロニー数に可算コロニー(30〜300)を示す希釈液を使用し、コロニー形成単位(CFU)を取得します。
- 創傷の接種
- 一晩培養した200μLを5mLのLBブロスに接種し、シェーカーで37°Cで2.5時間インキュベートします。
- 600nm(OD600)で日培養の光学濃度を測定します。PA01 接種には、3 x 10 8 CFU/mL を使用します (1 x 108 CFU/mL の PA01 を 1 創傷あたり 250 μL 接種します)。接種物をバイオハザード容器に入れて動物施設に輸送します。
- 火傷後3日目にピペットを使用して露出した創傷の表面に接種物を分散させ、使い捨てのスプレッダーを使用して均等に広げます(図6)。包帯を巻く前に、傷口を約15分間開いたままにします。
注:すべての外科的処置、接種、組織生検、画像診断、および包帯は、セクション3および4と同様に全身麻酔下で行われます。
- 感染の確定確認
注:接種後に創傷が正常に感染したことを確認するために、いくつかのアプローチが利用され、創傷サンプルが正常な皮膚から収集されたサンプルと比較されます。以下はその一例です。- 異なる時点で収集されたサンプルの病理学ベースの分析では、コロニー形成単位の数を使用して感染を推定します(CFU; 図7E、F)。
- パンチ生検で6mmの創傷組織を採取します。空の5 mL丸底チューブにラベルを貼り、計量します。サンプルをチューブに移し、サンプルと一緒にチューブの重量を量ります。
- 滅菌表面にメスで組織をさいの目に切る。BSL2フードですべての手順を実行します。
注:組織が簡単に均質化されるようにするには、サイズを非常に小さくする必要があります(ただし、0.5 mm以上) - サンプルをチューブに入れ、PBSを1mL添加します。硬組織粉砕プローブを使用して組織を混合し、粉砕します。
- ホモジネートを段階希釈(1 x 10-5に希釈)し、各希釈液50 μLを選択的(シュードモナス単離寒天培地、PIA)および非選択的(LBA)培地にプレートします。
- すべての希釈液を好気性条件下で37°Cで18〜24時間インキュベートします。適切な照明条件でプレートを画像化します。
- 30〜300コロニーのプレートを選択し、どのプレートもその濃度に達していない場合は、希釈されていないプレートを使用します。ImageJ を使用してコロニー数をカウントし、平均値に最終希釈係数を掛けてプレートあたりの CFU を計算します。
- 走査型電子顕微鏡(SEM)を使用して、接種後7日目およびその他の時点から収集したサンプルから画像を取得し、細菌バイオフィルムの存在を確認します(図7G)。
注:接種後7日目は、バイオフィルム感染が確立され、火傷痂皮の軟化が始まる日であり、米国の波が浸透し、より深い組織の視覚化が可能になるため、選択されました。 図4では、米国の熱傷の3日目の画像を確認すると、米国の波が深部組織に伝わるのを防ぐ厚い革のような痂皮が示されています。 - 創傷生検の切片を緑 膿菌 に対する特異的抗体で染色し、以前の出版物13 (図7H)に示されているように、特定の細菌の存在を確認します。
- Sinha et al.31 で発表されている次世代シーケンシング (NGS) を実行します。感染した創傷と、接種後 7 日目から研究終了までのさまざまな時点で収集された正常な非感染皮膚サンプルからの細菌 16srRNA を定量します。
- 異なる時点で収集されたサンプルの病理学ベースの分析では、コロニー形成単位の数を使用して感染を推定します(CFU; 図7E、F)。
12.生検収集
- 接種後7日目、14日目、28日目、および56日目の画像診断後の分析のために組織生検を収集します。治癒過程への干渉を最小限に抑えるために、各創傷から生検を1回だけ収集します。
注:すべての外科的処置、接種、組織生検、画像診断、および包帯は、セクション3および4と同様に全身麻酔下で行われます。- 0.5%ブピバカインで傷の周囲に浸潤します。.サイズ10のブレードを備えた使い捨てメスを使用して、傷口の一方の端からもう一方の端まで3〜4 mm幅のストリップを切り取り、両側に正常な皮膚の小さなマージンを保ちます。固定のために4%緩衝ホルマリンで満たされたラベル付きコニカルチューブにストリップを入れます。
注:初期の時点イメージングおよび生検手順では、手術の準備中に全用量のブプレノルフィンが投与されます。後期の生検手順では、手術の準備中にブプレノルフィンの半分の用量が投与されます。すべての火傷と生検の手順の後、ガバペンチンは、主治医のアドバイスに従って最大7日間BIDを投与されます。カルプロフェンは、術後数日間、または主治医のアドバイスに従って投与されます。 - 創傷から6mmのパンチ生検を切り取ります(創傷床または創傷縁のいずれかから)。正常な皮膚の一部や創傷床を含む創傷縁から収集し、さまざまなタイプの分析を行います。
- 滅菌した鉗子と解剖ハサミを使用してサンプルを取り除きます。生検サンプルを適切なチューブまたはカセットに入れて、処理と分析を行います。
- CFU、SEM、RNA、およびFPPEの場合、サンプルは適切なバッファーとともにチューブに保存してください。例えば、レーザー捕捉顕微鏡(LCM)や免疫組織化学(IHC)のために、サンプルをカセットに入れてOCTに入れることができます。
- 検体が採取された後、滅菌ガーゼで創傷をそっと押して止血します。非癒着性包帯で傷口を覆い、セクション9のように包帯を巻く。
- 0.5%ブピバカインで傷の周囲に浸潤します。.サイズ10のブレードを備えた使い捨てメスを使用して、傷口の一方の端からもう一方の端まで3〜4 mm幅のストリップを切り取り、両側に正常な皮膚の小さなマージンを保ちます。固定のために4%緩衝ホルマリンで満たされたラベル付きコニカルチューブにストリップを入れます。
13.安楽死と組織採取
- 安楽死の日にTKXで豚を鎮静させ、イソフルランで麻酔します。セクション3で概説されている手順に従って、辺縁耳静脈に静脈内カテーテルを配置します。セクション4の手順に従って豚を挿管します。
- 豚に麻酔をかけたら包帯を外し、傷口の周りをきれいにします。
- 完全なデジタル写真、LSI、TEWL、およびHUSDイメージング。セクション12で概説されている手順に従って、創傷と正常な皮膚からサンプルを収集します。
- 必要なサンプルがすべて採取されたら、市販の安楽死溶液(ペントバルビタールナトリウム)の静脈内注射 により 、麻酔下で豚を人道的に安楽死させます。聴診器を使用して聴診を行い、心拍の停止と自発呼吸を確認します。
- SOM IACUCの要求に応じて、メスを使用して気胸を誘発することにより、安楽死の二次的な方法を実行します。豚の死骸を樽に移し、冷凍庫に運んで焼却のために拾います。
結果
標準化された熱傷装置を使用して、150°Cで1分間全層の熱傷を作成し、紅斑と炎症の縁が均一な均質な深熱傷をもたらしました(図3および図7)。各ブタの背中には、図3Cに描かれているように、8つの全層の火傷傷がありました。
創傷の深さと創傷治癒の経時的な進行を確認するためのBモード高解像度超音波による熱傷の非侵襲的リアルタイム評価では、皮下脂肪までのすべての皮膚層が破壊されていることが示されました(図4)。レーザースペックルイメージング(LSI)を使用して、創傷灌流のさらなる特性評価を行いました(図4A)。
熱傷は、接種後7日目までに創傷表面に厚い化膿膜を示し、感染と熱傷創傷バイオフィルムの確立を確認しました(図7A)。デジタル空間測定では、PAO1接種後3日目に、創傷部位と縁での炎症反応により、創傷面積の増加が示されました(図7A、B)。接種後14日目には創傷面積が縮小し始めたが、56日目には元の創傷サイズの約25%まで治癒が不完全であることが観察され、創傷の慢性化が示された(図7B)。創傷の慢性化と創傷治癒障害は、高い経表皮水分損失を示したTEWLによってさらに確認されました。TEWLの結果は、測定されたすべての時点で正常な皮膚と比較して皮膚バリア機能の喪失を反映しており、したがって、熱傷創傷治癒の機能障害を示しています(図7B)。このことは、タイトジャンクションタンパク質ZO-1および213 の抑制と、視覚創傷閉鎖にもかかわらず、35日目(中期)および56日目(後期)に見られた高いTEWL値に反映されているように、皮膚バリア機能の回復の障害によっても確認されました(図7I)。
熱傷の深さは、H&E染色によってさらに検証され、 図7Cに示すように、すべての組織学的皮膚層の歪みと壊死が示されました。PA01の確立されたバイオフィルムは、接種後7日目にCFU(図7E、F)、SEMイメージング(図7G)、および免疫蛍光染色(図7H)によってさらに検証されました。

図1:手順のセットアップ。 (A)手術台の準備。(B)点滴および薬物投与のための耳静脈カニューレ挿入。(C)処置中の低体温症から豚を保護するためのサーマルブランケットカバー。(D)バーナーとタイマーのセットアップ。 この図の拡大版をご覧になるには、ここをクリックしてください。
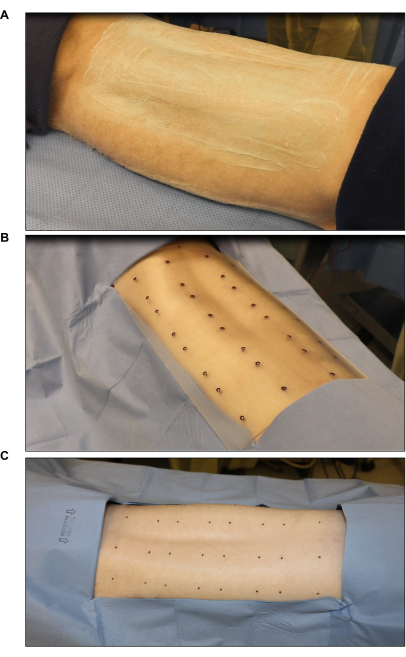
図2:手術部位の滅菌とマーキング。 (A)ヘアクリッピングと滅菌。(B)滅菌8創標準テンプレート(各創傷は2インチx2インチ)を使用した熱傷部位のマーキング。(C)滅菌皮膚マーカーを用いた最終マーキング。 この図の拡大版をご覧になるには、ここをクリックしてください。
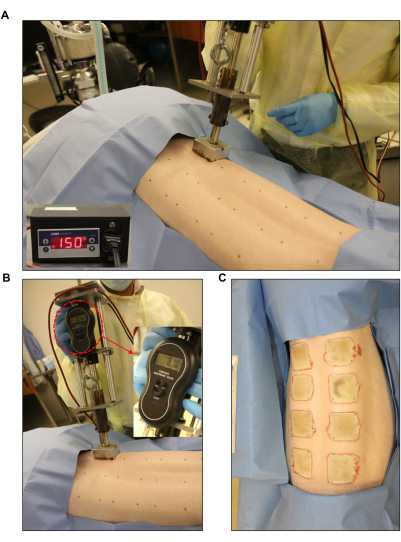
図3:火傷による誘導 。 (A、B)圧力計と自動コントローラーユニット(2インチ x 2インチ)を備えた標準化されたバーナーを、事前にマークされた創傷部位に適用します。(C)背中全体、8つの全層の火傷を示す。 この図の拡大版をご覧になるには、ここをクリックしてください。
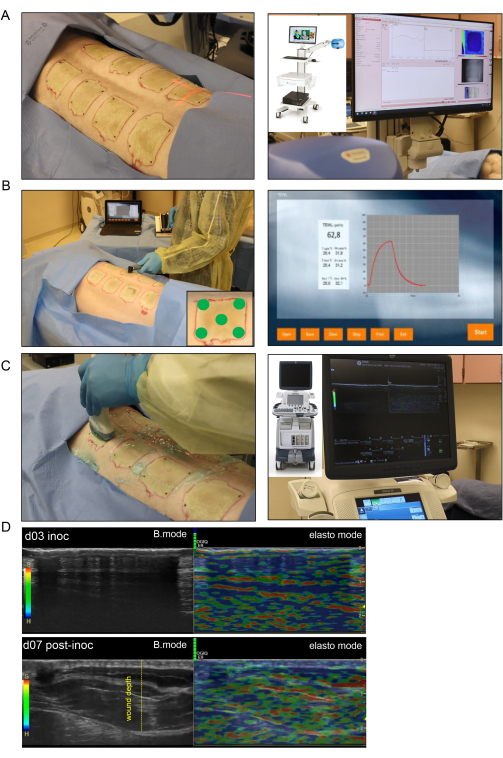
図4:非侵襲的熱傷創の画像診断と評価 。 (A)レーザービームインジケーターを創傷の中心に適切に向けたレーザースペックルイメージング(LSI)を左側の画像に示します。右側の画像は、LSIデバイスとリアルタイムの皮膚血管灌流マップを示しています。(B)5つの異なるスポット(4つの創傷コーナーと右下隅の画像に示されている中央)の創傷部位への経表皮水分損失(TEWL)プローブの適用が左側の画像に示されています。右側の画像は、TEWL測定の代表的なリアルタイムキャプチャ画面です。(C)高解像度16MHz超音波プローブを使用した火傷創の高調波超音波スキャンが左側に示されています。右側の画像は、超音波装置とリアルタイムの画面記録を示しています。(D)接種日および接種後7日目の熱傷部位の構造画像(Bモード画像、グレースケール超音波)および生体力学的画像(エラストグラフィ、カラー超音波)。傷の深さは黄色の破線で示されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
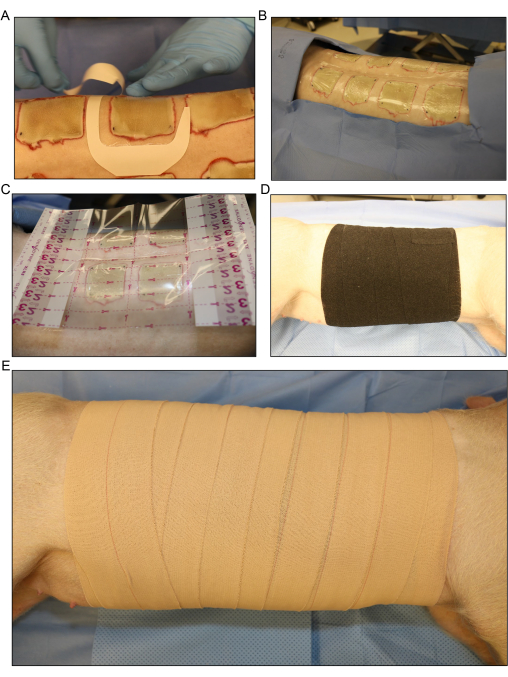
図5:創傷被覆材と包帯 。 (A)各創傷に透明フィルムドレッシングを別々に塗布する。(B)すべての背側接種された火傷は、ドレッシングの最初の層で覆われています。(C)より大きな透明フィルムドレッシングが創傷領域全体に配置されます。(D)傷口から出る滲出液を吸収するために、豚の体幹全体にガーゼの2層目と伸縮性弾性包帯の緩い層を塗布します。(E)接着性ドレッシングで4の最終層で創傷領域全体を覆う。 この図の拡大版をご覧になるには、ここをクリックしてください。
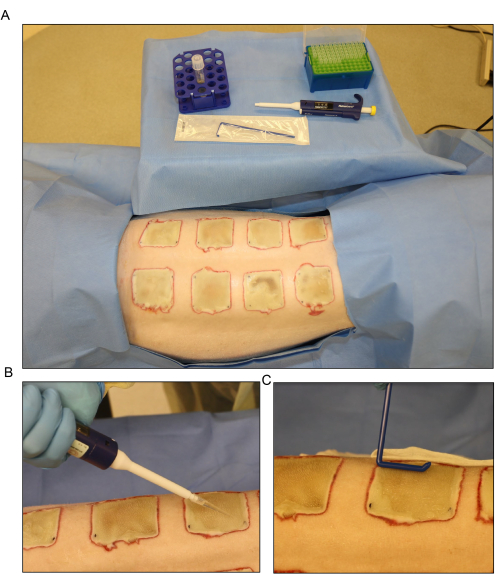
図6:細菌の接種。 (A)火傷後3日目の 緑膿菌 (PA01)接種のセットアップ。(B)各創傷に500μLの容量を使用して、ピペットで接種物を局所適用します。(C)接種物は、滅菌ディスポーザブルスプレッダーを使用して創傷表面全体に均等に分散されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
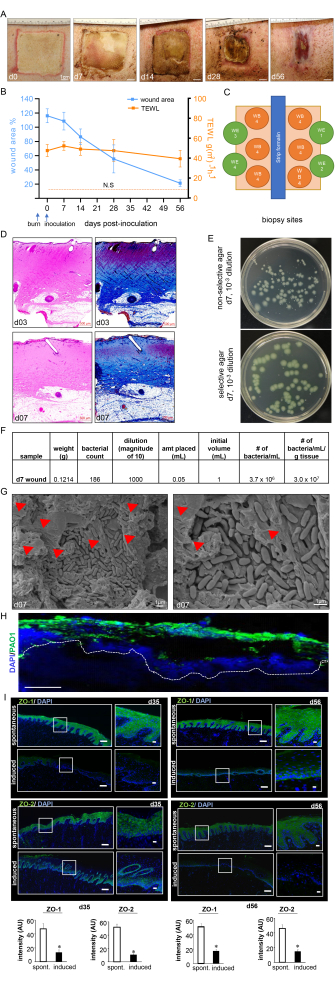
図7:創傷治癒の経過とバイオフィルムの確認。 (A)研究のタイムラインにおける創傷閉鎖の代表的な画像。スケールバー = 1 cm。 (B) 研究のタイムラインにおける創傷領域と TEWL 測定の定量 (n = 6)。データは平均±SDで表されます。 NSは、正常な皮膚のTEWL値を指します。(c)異なる創傷生検部位を示す模式図。D.H&E染色とそれに対応するMasson's trichrome染色は、火傷後3日目および接種後7日目にすべての皮膚層の歪みと壊死を示します。スケールバー = 500 μm。 (E)ブタの創傷床組織から増殖した細菌コロニーを有する非選択的寒天培地(Luria-Bertani寒天培地)および選択的寒天培地(Pseudomonas Isolation Agar)の代表的なデジタル画像。選択培地により、PA01コロニーのみを正確に計数できます。(f)処理された接種後7日目の創傷生検から採取されたコロニー数からのサンプルコロニー形成単位(CFU)の計算が示されている。(G)接種後7日目の接種熱傷の代表的な走査型電子顕微鏡(SEM)画像で、確立されたPA01バイオフィルムを示し、右側に拡大画像があります。スケールバー = 1 μm。赤い矢印は細胞外高分子物質(EPS)を指しています。(H)熱傷創の緑膿菌を抗シュードモナス(緑)抗体を用いて可視化した。接種後7日目の創傷生検の免疫蛍光画像は、緑膿菌による創傷組織の重度のコロニー形成を示しています。スケールバー = 100 μm。 (I)接種後35日目および56日目のZO-1およびZO-2染色切片の代表的なモザイク画像(スケールバー=200μm)および対応する拡大画像(スケールバー=50μm)で、誘発された感染後のタンパク質の発現低下を実証する。OCT包埋凍結切片(10 μm)を抗ZO-1(緑)または抗ZO-2(緑)で染色しました。切片はDAPIを用いて対比染色した。棒グラフは、ZO-1 および ZO-2 シグナル強度の定量を示しています。データは平均±SD(n = 3)として表されます。* P<自発的なものと比較して0.05。有意性を検定するために、Mann-WhitneyまたはKruskal-Wallisの一元配置分散分析検定を実施しました。図7H,Iは、Roy et al.13から修正したものである。この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
このレポートは、実験的研究のために慢性創傷バイオフィルム感染の豚モデルを設定するための詳細なプロトコルを提供します。22,23,24,25,26以前にいくつかのブタバイオフィルムモデルが報告されていますが、それらのどれも8週間の長期研究を含むブタモデルではありません。慢性創傷は、4週間以上開いたままの創傷です14,27,28。文献には他の慢性創傷バイオフィルムモデルが報告されていません。この研究は、機能的創傷閉鎖の概念を扱っています2,7,13,15,17,29。2014年に実施された研究は、バイオフィルムに感染した創傷がバリア機能を回復せずに閉じる可能性があることを初めて報告しました7。本研究では、経表皮水分損失(TEWL)を用いた治癒創における皮膚バリア機能の測定について報告する。
解剖学的および生理学的に、ブタの皮膚は、他の小動物の皮膚と比較して、人間の皮膚に近い32,33,34。ブタとヒトの皮膚はどちらも表皮が厚く33、ブタの真皮と表皮の厚さ比は10:1から13:1の範囲であり、ヒト34,35に匹敵します。組織学的および生体力学的に、ヒトとブタの皮膚は、毛隆起、皮下脂肪、真皮コラーゲン、毛髪分布、付属器構造、および血管のサイズと分布に類似性を示しています36,37,38。機能的には、ブタとヒトの両方が、表皮層の脂質、タンパク質、ケラチン成分の組成、および同等の免疫組織学的パターンにおいて類似性を共有しています37,38。ブタの免疫系は、他の小動物の免疫系と比較して、ヒトの免疫系と高い類似性を共有しており、ブタは、創傷感染における病理学的バイオフィルムの複雑さに不可欠な宿主の相互作用に関する研究に適したモデルであることを意味する39。さまざまな動物モデルによって提供される長所と短所の批判的評価は、ブタが創傷治癒を研究するための効率的なモデルであるというコンセンサスにつながりました34,38。さらに、家畜ブタは、ヒトで観察されるように、自発的に慢性細菌感染症を発症します10。創傷を作成するために使用される火傷装置は、標的皮膚部位から読み出された温度に基づいて熱エネルギーを供給する高度で自動化された火傷装置である22,40。このようなアプローチにより、火傷の厳密さと再現性が向上します。ブタの傷口に細菌を感染させるためにヒト臨床分離株を使用することは、前臨床モデルとしての価値を付加します。
火傷は複雑であり、いくつかの全身性摂動を引き起こします20,41。したがって、十分な水分で豚を蘇生させ、麻酔中および回復中の低体温症を防ぐことが重要です。火傷後の栄養、水分、痛みなど、いくつかの要因が創傷治癒を妨げる可能性があります42。したがって、栄養と疼痛の評価を綿密に監視することが重要です。火傷後の痛みはひどく、動物の行動や食事に影響を与える可能性があります。行動上の懸念に対処するための介入は積極的に検討されなければならない。定期的かつ継続的な疼痛のスコアリングと管理が不可欠です。このプロトコルには、非常に詳細な疼痛管理計画を含む徹底的な疼痛評価シートが含まれています。創傷間の相互汚染を避けるために、各創傷にドレッシングの最初の層を別々に適用するように特別な注意を払う必要があります。すべてのバイオハザード物質の取り扱い、および機器、ツール、および手術室全体の徹底的な消毒を行う際には、重要な注意を払う必要があります。ドレッシングを何層にも重ねることで、豚がかゆみをこすったり引っ掻いたりしている間に傷口が露出するのを防ぎます。
現在のモデルのブタは、基礎となる代謝障害(糖尿病など)によって損なわれていなかったため、研究されている効果は、純粋に細菌バイオフィルム感染が創傷治癒に与える影響でした。しかし、このモデルは糖尿病の誘発に適しており(例えばストレプトゾトシンを使用)、根本的な代謝障害に関連するバイオフィルム感染の研究に使用できる可能性がある。このモデルのもう1つの制限は、細菌である 緑膿菌を使用した感染設定の制御です。ブタの正常な皮膚微生物叢も創傷で増殖している可能性があり、治癒に影響を与える可能性があると予想されます。創傷の微生物含有量を描写するために、NGSまたはその他の高度な技術を使用したさらなる分析が必要です。現在のモデルは、異なる微生物種(真菌、ウイルスなど)との混合感染にも適用できます。臨床的に重要な創傷には混合微生物が生息している可能性が高く、創傷治癒に異なる影響を与える可能性があるため、これは重要な要素です。
このモデルには、ヒトの慢性創傷の複雑さと長期的な後遺症との類似性、自動化された再現性のある燃焼プロセス、臨床的に分離された細菌種の使用など、多くの潜在的な利点があります。複数の非侵襲的イメージングモダリティの使用は、創傷を特徴付ける有用な生理学的データを収集するための強力なアプローチを表しています。最後に、TEWLに基づく皮膚バリア機能の回復 による 機能的創傷治癒の評価が重要です。結論として、ブタモデルシステムを使用してバイオフィルム感染の重度の熱傷を開発するための堅牢でシンプル、詳細、かつ使いやすいプロトコルがこの作業に示されています。
開示事項
著者らは、競合する利害関係がないことを宣言します。
謝辞
インディアナ大学の実験動物リソースセンター(LARC)の支援と、研究中の獣医師のケアに感謝します。この研究は、米国国立衛生研究所(NIH)の助成金NR015676、NR013898、DK125835および国防総省の助成金W81XWH-11-2-0142によって部分的に支援されました。さらに、この研究は、米国国立衛生研究所(NIH)のGM077185、GM069589、DK076566、AI097511、NS42617の賞を受賞しました。
資料
| Name | Company | Catalog Number | Comments |
| Sedation | |||
| Ketamine | Zoetis | 10004027 | 100mg/ml |
| Telazol | Zoetis | 106-111 | 100mg/ml |
| Xylazine | Pivetal | 04606-6750-02 | 100mg/ml Anased |
| 3ml syringe w/ 20g needle | Covidien-Monoject | 8881513033 | |
| Winged infusion set 21g | Jorgensen Labs | J0454B | |
| Anesthetic | |||
| Isoflurane | Pivetal | 21295097 | |
| Surgery | |||
| Hair clippers | Wahl | 8787-450A | |
| Nair | Church and Dwight Co. Inc | 70506572 | |
| Chlorhexidine Solution | First Priority Inc. | 179925722 | |
| 70% Isopropyl Alcohol | Uline | S-17474 | |
| 0.9% Saline Solution | ICU Medical | RL-7282 | |
| Non-woven gauze | Pivetal | 21295051 | |
| Paper tape | McKesson | 455531 | |
| 2" Elastic tape | Pivetal | 21300869 | |
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Spay hook | Jorgensen Labs | J0112A | |
| Sterile lube | McKesson | 16-8942 | |
| Laryngoscope | Jorgensen Labs | J0449S | |
| Roll gauze | Pivetal | 21295032 | |
| Endotracheal tube (7-9mm) | Covidien | 86112 | Shiley Hi-Lo Oral Nasal Tracheal Tube Cuffed |
| 15gtt/ml IV administration set | ICU Medical | 12672-28 | |
| LRS 1000ml bag | ICU Medical | 07953-09 | |
| Three Quarter Drape Sheet | McKesson | 16-i80-12110G | |
| Analgesia | |||
| Buprenorphine | RX Generics | 42023-0179-05 | 0.3mg/ml |
| Fentanyl Transdermal | |||
| Carprofen | 21294548 | Pivetal | 50mg/ml Levafen |
| Bandaging | |||
| Transparent film dressing 26x30 | Genadyne Biotechnologies | A4-S00F5 | |
| Film dressing 4 x 4-3/4 Frame Style | McKesson | 886408 | |
| Vetrap | 3M | 1410BK BULK | |
| Elastic tape 4" | Pivetal | 21300931 | |
| Kerlix Roll Gauze | Cardinal Health | 3324 | |
| Imaging | |||
| Canon EOS 80D | Canon | 1263C004 | |
| Speedlight 600EX II-RT | Canon | 1177C002 | |
| EFS 17-55mm Ultrasonic | Canon | 1242B002 | |
| GE Logiq E9 | GE | 5197104-2 | |
| ML6-15 Probe | GE | 5199103 | |
| PeriCamPSI | Perimed | 90-00070 | |
| DermaLab | Cortex Technologies Inc | 4608D78 | |
| Biopsy/Tissue Collection | |||
| 6mm punch biopsy | Integra Lifesciences | 33-36 | |
| bupivicaine 0.5% | Auromedics Pharma | 55150017030 | |
| Size 10 Disposable Scalpel | McKesson | 16-63810 | |
| Dissection scissors | Pivetal | 21294806 | |
| Rat tooth thumb tissue forceps | Aesculap | BD512R | |
| Non-adherent Dressing | Covidien | 2132 | Telfa |
| 50ml Conical tube | Falcon | 352070 | |
| Eppendorf/microcentrifuge tube | Fisherbrand | 02-681-320 | |
| OCT Cassette | |||
| Non Woven Gauze 4x4 | Pivetal | 21295051 | |
| Inoculum | |||
| Low salt LB agar | Invitrogen | 22700-025 | |
| Low salt LB broth | Fisher scientific | BP1427-500 | |
| Petri plate | Falcon | REF-351029 | |
| Polyprophyline round bottom tubes (14 ml) | Falcon | REF-352059 | |
| Pseudomonas Agar Base (Dehydrated) | Thermo Scientific | OXCM0559B | |
| LB Agar, powder (Lennox L agar) | Thermo Fisher Scientific (Life Technologies) | 22700025 | |
| Gibco™ DPBS, calcium, magnesium | Gibco | 14040133 | |
| Euthanasia | |||
| 18-22g Intravenous Angiocath | SurVet | (01)14806017512306 | |
| Fatal Plus | Vortech Pharmaceuticals | 9373 |
参考文献
- Goodwine, J., et al. Pyruvate-depleting conditions induce biofilm dispersion and enhance the efficacy of antibiotics in killing biofilms in vitro and in vivo. Scientific Reports. 9 (1), 3763 (2019).
- Sen, C. K., Roy, S., Mathew-Steiner, S. S., Gordillo, G. M. Biofilm management in wound care. Plastic and Reconstructive Surgery. 148 (2), 275-288 (2021).
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clinical Microbiology Reviews. 19 (2), 403-434 (2006).
- Nguyen, T. T., Gilpin, D. A., Meyer, N. A., Herndon, D. N. Current treatment of severely burned patients. Annals of Surgery. 223 (1), 14-25 (1996).
- Eriksson, E., et al. Chronic wounds: Treatment consensus. Wound Repair and Regeneration. 30 (2), 156-171 (2022).
- Lebeaux, D., Chauhan, A., Rendueles, O., Beloin, C. From in vitro to in vivo models of bacterial biofilm-related infections. Pathogens. 2 (2), 288-356 (2013).
- Ganesh, K., et al. Chronic wound biofilm model. Advances in Wound Care. 4 (7), 382-388 (2015).
- Bjarnsholt, T., et al. The in vivo biofilm. Trends in Microbiology. 21 (9), 466-474 (2013).
- Stewart, P. S. Biophysics of biofilm infection. Pathogens and Disease. 70 (3), 212-218 (2014).
- Jensen, L. K., Johansen, A. S. B., Jensen, H. E. Porcine models of biofilm infections with focus on pathomorphology. Frontiers in Microbiology. 8, 1961 (2017).
- Mah, T. F., O'Toole, G. A. Mechanisms of biofilm resistance to antimicrobial agents. Trends in Microbiology. 9 (1), 34-39 (2001).
- Gonzalez, J. F., Hahn, M. M., Gunn, J. S. Chronic biofilm-based infections: Skewing of the immune response. Pathogens and Disease. 76 (3), 023 (2018).
- Roy, S., et al. Mixed-species biofilm compromises wound healing by disrupting epidermal barrier function. Journal of Pathology. 233 (4), 331-343 (2014).
- Sen, C. K. Human wound and its burden: Updated 2020. Compendium of Estimates. Advances in Wound Care. 10 (5), 281-292 (2021).
- Barki, K. G., et al. Electric field based dressing disrupts mixed-species bacterial biofilm infection and restores functional wound healing. Annals of Surgery. 269 (4), 756-766 (2019).
- Dusane, D. H., et al. Electroceutical treatment of Pseudomonas aeruginosa biofilms. Scientific Reports. 9 (1), 2008 (2019).
- Roy, S., et al. Staphylococcus aureus biofilm infection compromises wound healing by causing deficiencies in granulation tissue collagen. Annals of Surgery. 271 (6), 1174-1185 (2020).
- Ghanbari, A., et al. Inoculation density and nutrient level determine the formation of mushroom-shaped structures in Pseudomonas aeruginosa biofilms. Scientific Reports. 6, 32097 (2016).
- Yin, R., Cheng, J., Wang, J., Li, P., Lin, J. Treatment of Pseudomonas aeruginosa infectious biofilms: Challenges and strategies. Frontiers in Microbiology. 13, 955286 (2022).
- Norbury, W., Herndon, D. N., Tanksley, J., Jeschke, M. G., Finnerty, C. Infection in burns. Surgical Infections. 17 (2), 250-255 (2016).
- Nitz, F., et al. Molecular detection of drug-resistance genes of bla(OXA-23)-bla(OXA-51) and mcr-1 in clinical isolates of Pseudomonas aeruginosa. Microorganisms. 9 (4), 786 (2021).
- Davis, S. C., et al. Microscopic and physiologic evidence for biofilm-associated wound colonization in vivo. Wound Repair and Regeneration. 16 (1), 23-29 (2008).
- Breuing, K., Kaplan, S., Liu, P., Onderdonk, A. B., Eriksson, E. Wound fluid bacterial levels exceed tissue bacterial counts in controlled porcine partial-thickness burn infections. Plastic and Reconstructive Surgery. 111 (2), 781-788 (2003).
- Nusbaum, A. G., et al. Effective method to remove wound bacteria: Comparison of various debridement modalities in an in vivo porcine model. Journal of Surgical Research. 176 (2), 701-707 (2012).
- Hirsch, T., et al. Enhanced susceptibility to infections in a diabetic wound healing model. BMC Surgery. 8, 5 (2008).
- Roche, E. D., et al. Increasing the presence of biofilm and healing delay in a porcine model of MRSA-infected wounds. Wound Repair and Regeneration. 20 (4), 537-543 (2012).
- Hartoch, R. S., McManus, J. G., Knapp, S., Buettner, M. F. Emergency management of chronic wounds. Emergency Medical Clinics of North America. 25 (1), 203-221 (2007).
- Mustoe, T. Understanding chronic wounds: a unifying hypothesis on their pathogenesis and implications for therapy. American Journal of Surgery. 187 (5), 65-70 (2004).
- Bhattacharya, M., et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing. Proceedings of the National Academy of Sciences of the United States of America. 115 (28), 7416-7421 (2018).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Sinha, M., et al. Pseudomonas aeruginosa theft biofilm require host lipids of cutaneous wound. Annals of Surgery. 277 (3), e634-e647 (2023).
- Fan, G. Y., et al. Severe burn injury in a swine model for clinical dressing assessment. Journal of Visualized Experiments. (141), e57942 (2018).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Meyer, W., Schwarz, R., Neurand, K. The skin of domestic mammals as a model for the human skin, with special reference to the domestic pig. Current Problems in Dermatology. 7, 39-52 (1978).
- Vardaxis, N. J., Brans, T. A., Boon, M. E., Kreis, R. W., Marres, L. M. Confocal laser scanning microscopy of porcine skin: implications for human wound healing studies. Journal of Anatomy. 190, 601-611 (1997).
- Heinrich, W., Lange, P. M., Stirtz, T., Iancu, C., Heidemann, E. Isolation and characterization of the large cyanogen bromide peptides from the alpha1- and alpha2-chains of pig skin collagen. FEBS Letters. 16 (1), 63-67 (1971).
- Marcarian, H. Q., Calhoun, M. L. Microscopic anatomy of the integument of adult swine. American Journal of Veterinary Research. 27 (118), 765-772 (1966).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration. 9 (2), 66-76 (2001).
- Dawson, H. D., et al. Structural and functional annotation of the porcine immunome. BMC Genomics. 14, 332 (2013).
- Kim, J. Y., Dunham, D. M., Supp, D. M., Sen, C. K., Powell, H. M. Novel burn device for rapid, reproducible burn wound generation. Burns. 42 (2), 384-391 (2016).
- Nielson, C. B., Duethman, N. C., Howard, J. M., Moncure, M., Wood, J. G. Burns: Pathophysiology of systemic complications and current management. Journal of Burn Care and Research. 38 (1), e469-e481 (2017).
- Rowan, M. P., et al. Burn wound healing and treatment: Review and advancements. Critical Care. 19 (1), 243 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved