Method Article
Tuina en un modelo de rata de hombro congelado: un protocolo eficiente y reproducible
En este artículo
Resumen
Este estudio desarrolla un protocolo de Tuina eficiente y reproducible para el tratamiento de la paleta congelada establecido en un modelo de rata. Este enfoque ayudará a estudiar el método de tratamiento de la terapia Tuina para los hombros congelados.
Resumen
El hombro congelado (FS) es una afección común sin una terapia óptima definida. La terapia Tuina, una técnica de medicina tradicional china (MTC) utilizada para tratar a pacientes con SF en hospitales chinos, ha demostrado excelentes resultados, pero sus mecanismos no se comprenden completamente. Sobre la base de un estudio previo, este trabajo tuvo como objetivo desarrollar un protocolo Tuina para un modelo de rata FS. Dividimos aleatoriamente 20 ratas SD en grupos control (C; n = 5), modelo FS (M; n = 5), tratamiento Tuina modelo FS (MT; n = 5) y tratamiento oral modelo FS (MO; n = 5). En este estudio se utilizó el método de inmovilización con yeso para establecer el modelo de rata FS. Se evaluó el efecto de Tuina y dexametasona oral sobre el rango de movimiento glenohumeral (ROM) y se evaluaron los hallazgos histológicos. Nuestro estudio demostró que Tuina y la dexametasona oral fueron capaces de mejorar el ROM activo del hombro y preservar la estructura de la cápsula, demostrando ser la terapia con Tuina más eficaz que la dexametasona oral. En conclusión, el protocolo de Tuina establecido en este estudio fue altamente efectivo para el SF.
Introducción
El hombro congelado (FS), también conocido como capsulitis adhesiva del hombro, es una enfermedad autolimitada caracterizada por dolor de hombro y déficits de movilidad. Suele afectar a personas de entre 30 y 70 años, con una edad media de 50 años, y tiene una prevalencia de alrededor del 5% en la población china1. Se ha reportado que las mujeres tienen una incidencia 1,6 veces mayor de SF en comparación con los hombres2. La prevalencia de SF es mayor en personas con diabetes, trastornos del metabolismo de la glucosa y los lípidos u otras enfermedades relacionadas, oscilando entre el 10% y el 36%2,3. Los tratamientos clínicos actuales para el SF incluyen fisioterapia, medicamentos esteroides y tratamientos quirúrgicos4.
Se ha demostrado que la tuina, una terapia de medicina tradicional china (MTC), alivia eficazmente el dolor de hombro en pacientes con SF, mejorando su calidad de vida 5,6. Sin embargo, los mecanismos subyacentes de este tratamiento no se comprenden bien. Por lo tanto, el uso de modelos animales para estudiar los efectos y mecanismos de Tuina en el tratamiento del SF es crucial.
La articulación del hombro de rata tiene una estructura compleja similar a la del hombro humano y se utiliza a menudo en estudios mecanicistas de FS7. El modelo de rata FS se caracteriza por una disminución del ROM glenohumeral y de la fibrosis de la cápsula8. Además, este modelo permite la observación de la cápsula del hombro y posibilita la investigación patológica en la reparación de la lesión9. Además, los corticoides orales se utilizan a menudo como grupo control en la investigación sobre el tratamiento del SF10. Este estudio tiene como objetivo desarrollar un protocolo de Tuina para el modelo de rata FS y demuestra la viabilidad de realizar experimentos con animales en la investigación de Tuina comparando la eficacia de la terapia con Tuina y la dexametasona oral.
Protocolo
Este estudio fue aprobado por el Comité de Ética del Hospital Afiliado de la Universidad de Medicina Tradicional China de Shandong (Número: AWE-2022-023).
1. Animales de experimentación
- Veinte ratas macho Sprague-Dawley (SD) (7 semanas de edad, 250-280 g) se alojaron en condiciones estándar (temperatura ambiente [RT] 20-24 °C, humedad 40%-60% y un ciclo de luz/oscuridad de 12 h/12 h).
2. Método de agrupación
- Agrupe las ratas SD en el grupo control (C), el grupo control modelo FS (M), el grupo de tratamiento Tuina modelo FS (MT) y el grupo de tratamiento oral modelo FS (MO), cada uno de los cuales consta de 5 ratas. Mantenga 5 ratas por jaula (mismo grupo).
- Después de 7 días de aclimatación, inmovilice un hombro de las ratas de los grupos M, MT y MO utilizando inmovilización con yeso durante 3 semanas para imitar el FS como se describe en la siguiente sección.
- Administrar el tratamiento con Tuina a las ratas del grupo MT durante 2 semanas, tal y como se describe en la sección 4 (Figura 1).
- Calcule la dosis requerida de dexametasona por cada kilogramo de ratas (0,0675 mg/día) en función de la dosis para adultos (0,75 mg/día) y la relación entre la superficie de la rata y el cuerpo humano (0,018).
- Administrar diariamente una solución de dexametasona intragástrica a ratas del grupo MO a 0,067 mg/kg/día a las 7:00 AM durante 2 semanas.
NOTA: Utilice este método de agrupación para confirmar el efecto del protocolo Tuina en este estudio. Realizar el método de agrupamiento según fines experimentales en diferentes estudios.
3. Desarrollo del modelo del servicio fijo
- Anestesiar ratas con tribromoetanol (250 mg/kg, por inyección intraperitoneal)11.
NOTA: De acuerdo con los requisitos del comité de ética de la institución, se almacenó a 4 °C una solución madre compuesta por tribomoetanol (10 g) y alcohol terc-amílico (10 mL). Antes de su uso, se diluyó al 2% con agua destilada. - Aplicar vendajes empapados de yeso en el hombro derecho y el pecho de las ratas, manteniendo la extremidad anterior derecha a 90° de rotación interna de la articulación del hombro durante 3 semanas (Figura 2)12.
NOTA: Vigile a las ratas para asegurarse de que puedan realizar actividades fisiológicas normales, como caminar, comer y beber. Vuelva a colocar el vendaje de yeso si las ratas no pueden realizar actividades fisiológicas normales. - Confirmar el establecimiento exitoso del modelo FS mediante la observación del desarrollo de síntomas como rigidez en la articulación del hombro derecho, contracción de la extremidad superior derecha, atrofia muscular y cojera en ratas13.
4. Método Tuina
NOTA: Durante todo el procedimiento, el investigador debe usar equipo de protección personal. Solo un médico profesional de Tuina debe realizar todas las manipulaciones (Figura 3, Figura 4 y Figura 5).
- Entrene mediante el sistema de determinación de parámetros de la técnica de masaje inteligente, que incluye un mecanorreceptor y una computadora (Figura 3A).
- Realice manipulaciones en el mecanorreceptor y fuerce los parámetros en tres direcciones que se muestran a través del software (Figura 3B).
- Utilice el dedo pulgar para realizar el método de amasamiento rotatorio en un movimiento rotatorio con una fuerza de 0,5 kg y una frecuencia de 100-120 veces/min (Figura 3C).
- Utilice la yema del dedo pulgar para realizar el método de presión puntual con una fuerza de 0,5 kg (Figura 3D).
- Realice Tuina en las ratas manteniendo la pantalla mecánica mencionada en los pasos 4.1.2 y 4.1.3 durante 1 min.
- Sostén a la rata hasta que se calme (~2 min). A continuación, realice la manipulación. Coloque a la rata en posición recostada lateralmente, pero la posición puede cambiar según los diferentes métodos de manipulación.
- Use el dedo índice y el dedo medio derecho para sujetar la extremidad delantera derecha de la rata y flexionarla y extenderla varias veces para determinar las posiciones de la articulación del hombro, la articulación del codo y el húmero de la rata.
- Amasar el hombro derecho, la extremidad delantera y la espalda de la rata rotándola en el sentido de las agujas del reloj con la pulpa del pulgar a una fuerza de 0,5 kg y una frecuencia de 100-120 veces/min durante 3 min (Figura 4A-C).
- Manipule los músculos de las extremidades anteriores en posición lateral recostada.
- Manipule los músculos de los hombros y la espalda en posición prona.
- Presione el punto de acupuntura LI15 (Jianyu), SI11 (Tianzong), HT01 (Jiquan) y LI11 (Quchi) verticalmente con la yema del dedo pulgar 30 veces por punto de acupuntura a una fuerza de 0,5 kg (Figura 4D-G).
- Utilice el atlas de ratas y puntos de acupuntura para definir la ubicación de cada punto de acupuntura (Figura 5)14,15.
- Presione LI15, ubicado en la depresión antero-inferior al extremo acromial, en posición prona.
- Presione SI11, ubicado en la depresión de la fosa infraespinosa en el punto medio de la espina escapular, en decúbito prono.
- Presione HT01, ubicado en el centro de la axila, en posición supina.
- Presione LI11 ubicado en la depresión medial al extensor radial del carpo en el extremo lateral del pliegue cubital en posición lateral reclinada.
- Sostenga la articulación del hombro con el pulgar y el dedo medio izquierdos, y estire la extremidad anterior en las posiciones de aducción, abducción, extensión anterior y extensión posterior durante 10 s (Figura 4H-K).
NOTA: Este método de estiramiento debe realizarse sin resistencia en ratas. - Pausa el procedimiento de Tuina si la rata se agita. Acaricia a la rata durante 10 segundos para calmarla y luego continúa con la prueba.
- Realice el procedimiento diariamente durante 2 semanas.
5. Medición del ROM glenohumeral
NOTA: Es importante completar el proceso de medición lo más rápido posible para evitar la degeneración del tejido de la cápsula articular.
- Extirpar la escápula y los dos tercios proximales del húmero en bloque después de sacrificar a la rata con una dosis excesiva de tribromoetanol (3 veces la dosis inicial, por inyección intraperitoneal), dejando al descubierto el borde inferior de la escápula.
- Inserte una aguja de inyección (1,2 cm x 0,45 mm) a lo largo de la diáfisis humeral hasta la cabeza humeral.
- Inserte dos agujas de inyección verticalmente en las esquinas superior e inferior de la escápula sobre espuma plástica envuelta con una lámina quirúrgica estéril.
- Coloque un hilo fino en la aguja de inyección en la diáfisis humeral y tire de ella en el otro extremo con una fuerza de 5 g para que quede paralela a la diáfisis humeral. Mida el ángulo entre el borde inferior de la escápula y la diáfisis humeral (Figura 6).
NOTA: Para garantizar resultados confiables, haga que un investigador independiente realice las mediciones. - Reporte los datos como medias ±desviación estándar (DE) utilizando una aplicación de software de análisis estadístico.
NOTA: Aquí se utilizó el software SPSS (SPSS, versión 25.0). - Analice las diferencias entre los grupos mediante el análisis de varianza de un factor (ANOVA).
- Obtenga gráficos de barras utilizando el software adecuado.
NOTA: Aquí se utilizó GraphPad Prism 8. - Evalúe la patología de la cápsula mediante la tinción de H&E y Masson después de la medición.
6. Preparación de la sección
- Después de evaluar la ROM glenohumeral, fijar muestras enteras en PFA al 4% durante 3 días, seguido de descalcificación en solución de EDTA (pH 7,2) durante 2 meses más.
- Después de la deshidratación, cortar los bloques de tejido incrustados que contienen las muestras en rodajas de 5 μm16.
- Secar la loncha a 65 °C durante 60 min.
- Desparafina la rebanada.
- Remoje la rebanada en xileno I, xileno II y xileno III durante 7 minutos, seguido de una serie de etanol descendente (etanol anhidro, 5 min; etanol al 95%, 2 min; etanol al 80%, 2 min, y etanol al 70%, 2 min) y, finalmente, en agua ultrapura durante 2 minutos.
7. Tinción de H&E
- Teñir las secciones con hematoxilina durante 5 min, enjuagar con etanol de ácido clorhídrico al 1% durante 3 s y lavar con agua corriente durante 5 min.
- Tiñe la sección con eosina durante 3 minutos y lávala con agua del grifo.
- Remojar la sección en una serie de etanol (etanol al 95% I, 3 s; etanol II al 95%, 3 s; etanol anhidro I, 3 s, y etanol anhidro II, 1 min) y luego sumergirla en una serie de xileno (xileno I, 1 min; xileno II, 1 min).
- Coloque una gota de sellador de goma neutro en cada muestra. Selle cada muestra con un cubreobjetos.
- Tome imágenes con un microscopio de fluorescencia invertida (barra de escala = 100 μm).
8. Tinción de Masson
- Con una pluma inmunohistoquímica, dibuje un círculo alrededor de las secciones y luego incube las secciones en la solución de Bouin durante 2 h a 37 °C hasta mordiente. Posteriormente, lavar las secciones con agua hasta que desaparezca el color amarillo.
- Tratar las muestras con tinte azul lapislázuli durante 3 min y luego lavarlas con agua destilada.
- Después de teñir las secciones con hematoxilina (Mayer) durante 2 min, tratar las secciones durante 3 s en la solución ácida de diferenciación de etanol. Luego, lave las secciones con agua corriente durante 10 minutos.
- Tiñe las secciones con una solución de tinte magenta ponceau durante 10 minutos y posteriormente lávalas con agua.
- Sumerja las secciones en la solución de ácido fosfomolíbdico durante 10 min.
- Agregue una solución de tinción de azul de anilina a las secciones durante 5 minutos y luego lávelas con una solución de trabajo ácida débil durante 2 minutos.
- Deshidrate y haga que las secciones sean transparentes como se describe en el paso 7.3.
- Coloque una gota de agente sellador de goma neutro en cada sección y cúbrala con un cubreobjetos. Deje secar las secciones en una campana extractora.
- Recopile imágenes como se describe en el paso 7.5.
Resultados
Se observó la actividad física de ratas para evaluar el éxito o fracaso del modelo FS. Un estudio anterior mostró que la inmovilización del yeso redujo significativamente la distancia recorrida y la velocidad de la caminata en comparacióncon las ratas normales. Otra investigación sugirió que el SF no afectó la distancia recorrida, y la cojera fue el síntoma de presentación más común13. Este estudio mostró rigidez en la articulación del hombro derecho, contracción de la extremidad superior derecha, atrofia muscular y cojera en ratas después del modelado. Estas lesiones en los grupos MT y MO se resolvieron completamente a las 2 semanas de intervención. Pero no hubo cambios significativos en el grupo M.
El criterio primario para evaluar la efectividad de Tuina en el SF es la medición de ROM glenohumeral18. Se observó que los valores promedio de ROM glenohumeral fueron 149,3° ± 5,9° en el grupo C, 111,1° ± 3,9° en el grupo M, 128,5° ± 2,8° en el grupo MT y 119,56° ± 2,9° en el grupo MO. Como se muestra en la Figura 7, el ROM glenohumeral de las ratas del grupo M fue significativamente menor que el del grupo C (P < 0,0001). Además, el ROM en el grupo MT y en el grupo MO fue significativamente mayor que en el grupo M (P < 0,05, P < 0,0001). Sin embargo, el ROM en el grupo MO fue significativamente menor que en el grupo MT (P < 0,0001). Este hallazgo sugiere que Tuina puede mejorar significativamente la función de la articulación del hombro en ratas FS.
Además, la tinción de H&E y la tinción de Masson pueden demostrar aún más los efectos de Tuina en la preservación de la estructura y la reducción de la fibrosis en la cápsula. Para facilitar la observación, se utilizó la cápsula de la articulación glenohumeral para los hallazgos histológicos. La cápsula de la articulación del hombro está formada por las capas sinovial y fibrosa19. La tinción con H&E reveló proliferación de sinoviocitos, pliegues sinoviales aplanados, estasis eritrocitaria y proliferación vascular en el grupo M, que son características típicas del SF (Figura 8A,B). Estas características disminuyeron en cierta medida después de la terapia con Tuina y dexametasona oral (Figura 8C,D). En comparación con el grupo MT, el grupo MO también mostró muchas células sinoviales. La tinción de Masson mostró la disposición de los haces de fibras en cada grupo (flechas amarillas). La cápsula comprende una red suelta de fibras reticulares con haces de fibras dispuestos en una dirección ordenada (Figura 8E). En el grupo M, los haces de fibras estaban dispuestos de forma desordenada, lo que indica fibrosis de la cápsula (Figura 8F). Las cápsulas de ratas en el grupo MT mostraron que los haces de fibras están clara y ordenadamente estratificados, pero permanecen ligeramente desordenados en el grupo MO (Figura 8G, H).
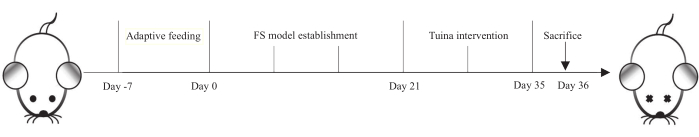
Figura 1: Protocolo para el establecimiento del modelo FS e intervención de Tuina. Las ratas recibieron alimentación adaptativa durante 7 días, establecimiento modelo FS durante 21 días y terapia con Tuina se realizó diariamente durante 14 días. En el día 36, todas las ratas fueron sacrificadas. Haga clic aquí para ver una versión más grande de esta figura.
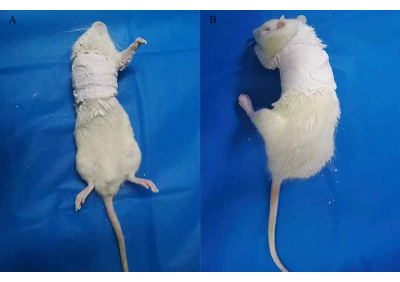
Figura 2: Inmovilización de yeso para establecer un modelo de rata de FS. Haga clic aquí para ver una versión más grande de esta figura.
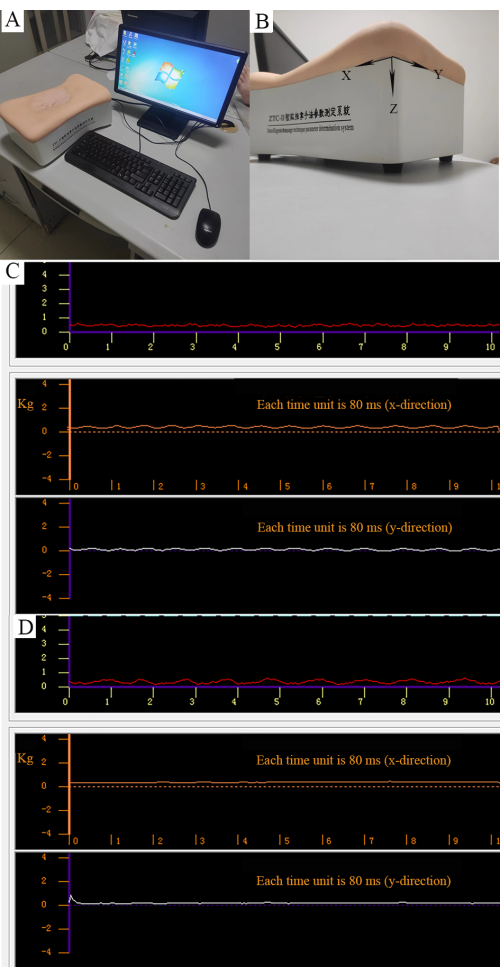
Figura 3: Control cuantitativo de la manipulación . (A) Sistema inteligente de determinación de parámetros de la técnica de masaje. (B) Se pueden medir tres fuerzas como fuerza paralela a lo largo de la dirección X, fuerza longitudinal a lo largo de la dirección Y y fuerza vertical a lo largo de la dirección Z. (C) Fuerza del método de amasado rotatorio. La curva roja representa la fuerza vertical estabilizada (0,5 kg). La curva naranja representa la fuerza paralela regular. La curva blanca representa la fuerza longitudinal regular. (D) La fuerza del método de presión puntual. La curva roja representa la fuerza vertical (0,5 kg). Las curvas naranjas y blancas representan fuerzas longitudinales y no paralelas. Haga clic aquí para ver una versión más grande de esta figura.
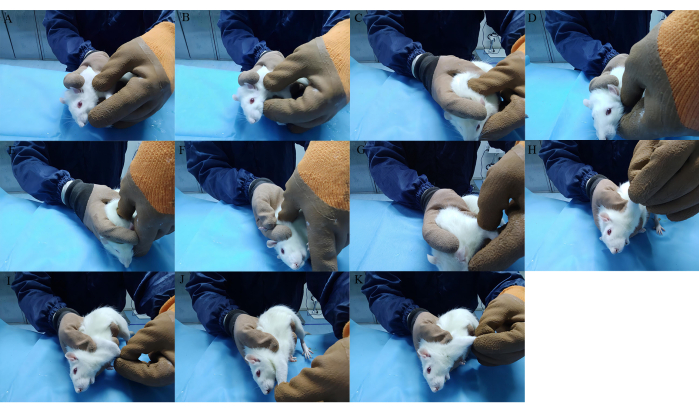
Figura 4: Manipulación utilizada en la terapia Tuina. (A-C) Amasar los músculos de los hombros derechos, las extremidades anteriores y la espalda. (D-G) Presione con el punto LI15, SI11, HT01 y LI11. (H-K) Estire la extremidad anterior en las posiciones de aducción, abducción, extensión anterior y extensión posterior. Haga clic aquí para ver una versión más grande de esta figura.
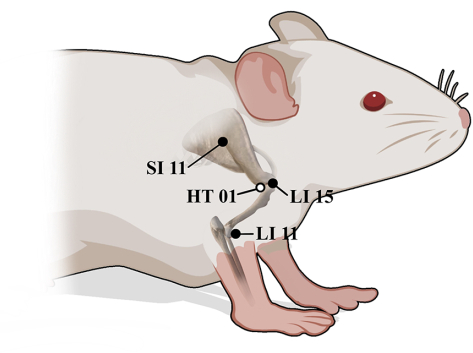
Figura 5: Posiciones anatómicas de LI15, SI11, HT01 y LI11 en ratas. ● Superficie lateral, ○ Superficie medial. Haga clic aquí para ver una versión más grande de esta figura.
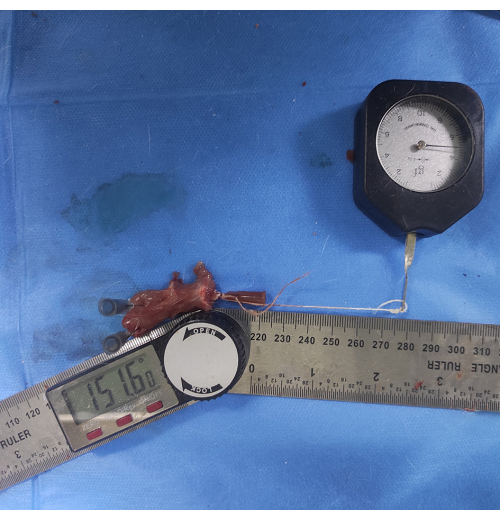
Figura 6: Medición de ROM glenohumeral. Se une un hilo fino a una aguja de inyección que se inserta en la diáfisis humeral y se tira del otro extremo con una fuerza de 5 g para que quede paralela a la diáfisis humeral. El ángulo entre el borde inferior de la escápula y la diáfisis humeral se mide como ROM glenohumeral. Haga clic aquí para ver una versión más grande de esta figura.
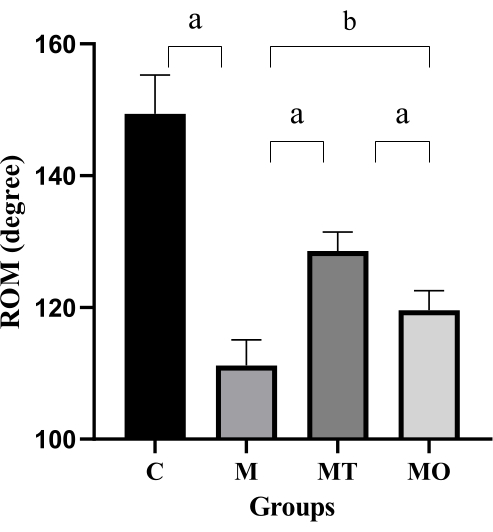
Figura 7: ROM glenohumeral en tres grupos de ratas. Los valores son medias ± S.D., n = 5. Las diferencias significativas se indican mediante ANOVA de un factor (a P < 0,001 y bP < 0,0001). Haga clic aquí para ver una versión más grande de esta figura.
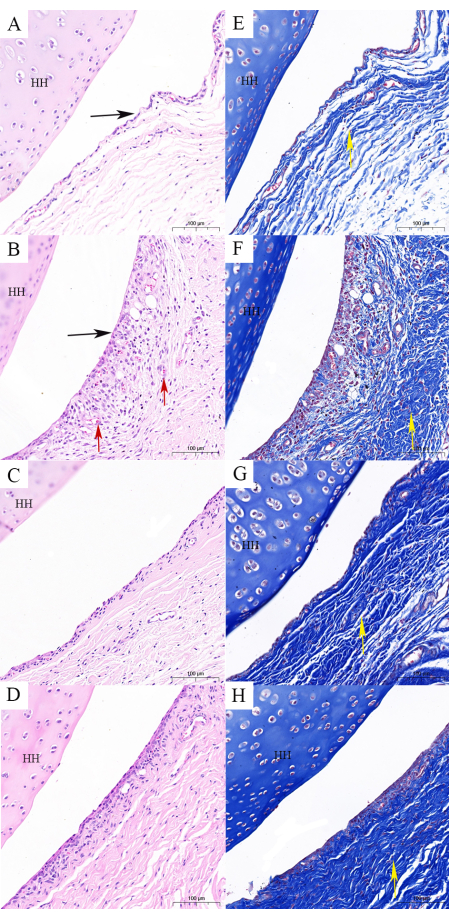
Figura 8: Hallazgos histológicos de la cápsula del hombro. (A,E) El grupo control contiene una estructura de cápsula normal (tinción de H&E y Masson). (B,F) El grupo modelo FS ilustra los cambios en la estructura de la cápsula de la siguiente manera: pliegues sinoviales aplanados, fibrosis de la cápsula y haces de fibras alterados (tinción de H&E y Masson). (C,G). El modelo FS combinado con el grupo Tuina ilustra que la estructura de la cápsula es cercana a la normal y que la fibrosis no es evidente (tinción de H&E y Masson). (D,H) El modelo FS combinado con dexametasona oral muestra que la estructura de la cápsula es cercana a la normalidad y la fibrosis es evidente (tinción de H&E y Masson). Barra de escala = 100 μm. HH: cabeza del húmero; flecha negra: pliegues sinoviales; flecha roja: estasis eritrocitaria y proliferación vascular; Flecha amarilla: haces de fibras. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El primer paso crítico es la selección del modelo. Debido a la dificultad en la implementación del modelo primario de FS, la inmovilización con yeso y la fijación quirúrgica interna se utilizan a menudo para establecer modelos de ratas FS 9,12. La restricción más severa de la movilidad del hombro y la fibrosis de la cápsula se observaron en el modelo de SF establecido por inmovilización con yeso durante 3 semanas12,20. En este estudio, las tasas de éxito del modelo FS fueron excelentes, con un 100% de éxito.
El segundo paso crítico son las manipulaciones utilizadas en este protocolo. En este estudio se utilizaron tres manipulaciones (amasamiento, presión y estiramiento). La manipulación del amasamiento de tejidos blandos se aplicó en el hombro, la escápula y la parte superior del brazo para relajar los músculos. La manipulación del prensado se realizó mediante la aplicación de presión en puntos de acupuntura como LI15, SI11, HT01 y LI11, que son los más utilizados en la práctica clínica para el SF 5,21. LI15, SI11 y HT01 se encuentran en posiciones alrededor de la cápsula del hombro y pueden ser eficaces para mejorar el ROM y la función del hombro22. El LI11 se utiliza a menudo para el deterioro motor de las extremidades superiores y se encuentra en el mismo meridiano que el LI15. Este método de coincidencia de puntos de acupuntura ayuda a mejorar la eficacia de LI1523. Después de la relajación completa, se utilizaron técnicas de estiramiento para restaurar las actividades funcionales.
El posible problema en este protocolo es que las ratas exhiben una intensa resistencia durante el Tuina, que puede ser causada por el miedo en lugar de exceder la tolerancia de las ratas. En este punto, las manipulaciones deben detenerse hasta que las ratas se calmen (acariciar durante 10 segundos calma a las ratas). Además, el grado de estiramiento debe ajustarse de acuerdo con los síntomas de las ratas. Inicialmente, la limitación de la articulación del hombro era obvia y la amplitud de estiramiento era pequeña. Junto con la intervención, la función articular del hombro de las ratas se recuperó gradualmente y la amplitud del estiramiento aumentó progresivamente. El estándar es que las ratas pueden aceptar el método de estiramiento sin resistencia. Por último, las ratas tienen cierto grado de agresividad, y Tuina requiere un contacto prolongado con las ratas, por lo que es importante llevar equipo de protección personal.
El control cuantitativo de la manipulación es el más difícil en los experimentos de Tuina. Si bien se puede utilizar un simulador de manipulación de masaje para controlar la fuerza y la frecuencia de una sola manipulación, este método es limitado cuando se involucran múltiples manipulaciones y sitios de tratamiento24,25. En la práctica clínica, la Tuina suele ser realizada directamente por los profesionales y, en este estudio, fue difícil intervenir con equipos médicos. Para controlar la estimulación, el sistema inteligente de determinación de parámetros de la técnica de masaje se puede utilizar para estandarizar el entrenamiento de Tuina. Después del entrenamiento, el investigador puede aplicar la misma fuerza a cada rata hasta cierto punto. La principal limitación de este protocolo es que las manipulaciones no se pueden controlar por completo.
La terapia de la MTC Tuina tiene una rica historia de uso en toda China, con varios médicos en hospitales que utilizan diferentes combinaciones de manipulación y sitios de tratamiento. Por lo tanto, es importante establecer protocolos replicables y efectivos tanto para experimentos con animales como para estudios clínicos. En este estudio, las manipulaciones y puntos de acupuntura utilizados se basaron en un estudio previo de nuestro equipo, combinando nuestra experiencia clínica con las características del modelo animal FS21. Este estudio demostró la eficacia del protocolo Tuina desarrollado para mejorar la función de la articulación del hombro y reducir la fibrosis de la cápsula en ratas FS. Estos hallazgos proporcionan una base para futuras investigaciones sobre los mecanismos subyacentes al tratamiento con Tuina. Además, el protocolo puede ser útil para los investigadores interesados en explorar la eficacia de tratamientos médicos alternativos para el SF.
Un estudio previo encontró que el mecanismo de intervención de Tuina sobre la fibrosis puede estar relacionado con la regulación negativa de TGF-β y CTGF, al tiempo que regula el equilibrio de MMP-1/TIMP-1, aliviando así la producción de matriz extracelular (MEC)26. El efecto de Tuina sobre la fibrosis de la cápsula del hombro puede lograrse a través de la regulación de varios mecanismos. Sin embargo, se requiere más investigación para comprender completamente los mecanismos involucrados en esta mejora.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo contó con el apoyo del Plan de Desarrollo de Ciencia y Tecnología 2020 en la ciudad de Jinan (subvención número 202019059), el Proyecto de Ciencia y Tecnología de la Medicina Tradicional China de la provincia de Shandong (subvención número 2021Q080) y el Proyecto de Hereda de la Escuela de Medicina Tradicional China Qilu (subvención número [2022]93).
Materiales
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | Solarbio | P1110 | |
| Embedding machine | Changzhou Paisijie Medical Equipment Co., Ltd | BM450A | |
| Ethylene Diamine Tetraacetic Acid (EDTA) | Solarbio | E1171 | |
| Hematoxylin eosin (HE) staining kit | Sparkjade | EE0012 | |
| Intelligent-massage technique parameter determination system | Shanghai Dukang Intrument Equipment Co. Ltd | ZTC- | |
| Microtome | Leica | 531CM-Y43 | |
Modified Masson Trichrome Staining Solution | Shanghai yuanye Bio-Technology Co., Ltd | R20381-8 | Bouin 50 mL; lapis lazuli blue dye 50 mL; Hematoxylin (Mayer) 50 mL; acidic ethanol differentiation solution 50 mL; ponceau magenta dye solution 50 mL; phosphomolybdic acid solution 50 mL; aniline blue staining solution 50 mL; weak acid 50 mL |
| Tribromoethanol | Macklin | T903147-5 |
Referencias
- Li, W., LU, N. Z., Xu, H. L., Wang, H. F., Huang, J. Case control study of risk factors for frozen shoulder in China. International Journal of Rheumatic Diseases. 18 (5), 508-513 (2015).
- Degreef, I., Steeno, P., De Smet, L. A survey of clinical manifestations and risk factors in women with Dupuytren's disease. Acta Orthopaedica Belgica. 74 (4), 456-460 (2008).
- Tighe, C. B., Oakley, W. S. The prevalence of a diabetic condition and adhesive capsulitis of the shoulder. Southern Medical Journal. 101 (6), 591-595 (2008).
- Cho, C. H., Bae, K. C., Kim, D. H. Treatment strategy for frozen shoulder. Clinics in Orthopedic Surgery. 11 (3), 249-257 (2019).
- Liu, M., et al. Effects of massage and acupuncture on the range of motion and daily living ability of patients with frozen shoulder complicated with cervical spondylosis. American Journal of Translational Research. 13 (4), 2804-2812 (2021).
- Ai, J., Dong, Y. K., Tian, Q. D., Wang, C. L., Fang, M. Tuina for periarthritis of shoulder: A systematic review protocol. Medicine. 99 (11), e19332 (2020).
- Norlin, R., Hoe-Hansen, C., Oquist, G., Hildebrand, C. Shoulder region of the rat: anatomy and fiber composition of some suprascapular nerve branches. The Anatomical Record. 239 (3), 332-342 (1994).
- Okajima, S. M., et al. Rat model of adhesive capsulitis of the shoulder. Journal of Visualized Experiments: JoVE. (139), 58335 (2018).
- Zhao, H. K., et al. Tetrandrine inhibits the occurrence and development of frozen shoulder by inhibiting inflammation, angiogenesis, and fibrosis. Biomedicine & Pharmacotherapy. 140, 111700 (2021).
- nar, B. M., Battal, V. E., Bal, N., Güler, &. #. 2. 2. 0. ;. &. #. 2. 1. 4. ;., Beyaz, S. Comparison of efficacy of oral versus intra-articular corticosteroid application in the treatment of frozen shoulder: An experimental study in rats. Acta Orthopaedica et Traumatologica Turcica. 56 (1), 64-70 (2022).
- Dias, Q. M., Rossaneis, A. C., Fais, R. S., Prado, W. A. An improved experimental model for peripheral neuropathy in rats. Brazilian Journal of Medical and Biological Research. 46 (3), 253-256 (2013).
- Kim, D. H., et al. Characterization of a frozen shoulder model using immobilization in rats. Journal of Orthopaedic Surgery and Research. 11 (1), 160 (2016).
- Feusi, O., et al. Platelet-rich plasma as a potential prophylactic measure against frozen shoulder in an in vivo shoulder contracture model. Archives of Orthopaedic and Trauma Surgery. 142 (3), 363-372 (2022).
- Yin, C. S., et al. A proposed transpositional acupoint system in a mouse and rat model. Research in Veterinary Science. 84 (2), 159-165 (2008).
- Guo, X. R., et al. Study on the regulatory mechanism of electroacupuncture based on thyroid pathway for mammary gland hyperplasia rats. Zhongguo Zhen Jiu. 38 (8), 857-863 (2018).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Taguchi, H., et al. A rat model of frozen shoulder demonstrating the effect of transcatheter arterial embolization on angiography, histopathology, and physical activity. Journal of Vascular and Interventional Radiology: JVIR. 32 (3), 376-383 (2021).
- Oki, S., et al. Generation and characterization of a novel shoulder contracture mouse model. Journal of Orthopaedic Research. 33 (11), 1732-1738 (2015).
- Kubo, H., et al. Histologic examination of the shoulder capsule shows new layer of elastic fibres between synovial and fibrous membrane. Journal of Orthopaedics. 22, 251-255 (2020).
- Cho, C. H., Lho, Y. M., Hwang, I., Kim, D. H. Role of matrix metalloproteinases 2 and 9 in the development of frozen shoulder: human data and experimental analysis in a rat contracture model. Journal of Shoulder and Elbow Surgery. 28 (7), 1265-1272 (2019).
- Wang, J. M., et al. Efficacy and safety of Tuina and intermediate frequency electrotherapy for frozen shoulder: MRI-based observation evidence. American Journal of Translation Research. 15 (3), 1766-1778 (2023).
- Ben-Arie, E., et al. The effectiveness of acupuncture in the treatment of frozen shoulder: A systematic review and meta-analysis. Evidence-Based Complementary and Alternative Medicine: eCAM. 2020, 9790470 (2020).
- Zou, F., et al. The impact of electroacupuncture at hegu, shousanli, and quchi based on the theory "Treating flaccid paralysis by Yangming alone" on stroke patients' EEG: A pilot study. Evidence-Based Complementary and Alternative Medicine: eCAM. 2020, 8839491 (2020).
- Lv, T. T., et al. Using RNA-Seq to explore the repair mechanism of the three methods and three-acupoint technique on DRGs in sciatic nerve injured rats. Pain research & Management. 2020, 7531409 (2020).
- Niu, F., et al. Spinal tuina improves cognitive impairment in cerebral palsy rats through inhibiting pyroptosis induced by NLRP3 and Caspase-1. Evidence-Based Complementary and Alternative Medicine: eCAM. 2021, 1028909 (2021).
- Na, Z., et al. The combination of electroacupuncture and massage therapy alleviates myofibroblast transdifferentiation and extracellular matrix production in blunt trauma-induced skeletal muscle fibrosis. Evidence-Based Complementary and Alternative Medicine: eCAM. 2021, 5543468 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados