Method Article
Puntuación de la inflamación del sistema nervioso central, la desmielinización y la lesión axonal en la encefalomielitis autoinmune experimental
En este artículo
Resumen
La encefalomielitis autoinmune experimental (EAE) sirve como modelo animal de esclerosis múltiple. En este artículo se describe un enfoque para la puntuación de la inflamación, desmielinización y lesión axonal de la médula espinal en EAE. Además, se presenta un método para cuantificar los niveles de luz de neurofilamentos solubles en el suero de ratones, lo que facilita la evaluación de la lesión axonal en ratones vivos.
Resumen
La encefalomielitis autoinmune experimental (EAE) es un modelo común de esclerosis múltiple (EM) basado en el sistema inmunitario. Esta enfermedad puede ser inducida en roedores por inmunización activa con componentes proteicos de la vaina de mielina y adyuvante de Freund completo (CFA) o por la transferencia de células T efectoras específicas de mielina de roedores cebados con proteína de mielina/CFA a roedores naïf. La gravedad de la EAE se suele puntuar en una escala clínica de 5 puntos que mide el grado de parálisis ascendente, pero esta escala no es óptima para evaluar el grado de recuperación de la EAE. Por ejemplo, las puntuaciones clínicas siguen siendo altas en algunos modelos de EAE (p. ej., modelo de EAE inducido por péptidos de glicoproteína de oligodendrocitos de mielina [MOG]) a pesar de la resolución de la inflamación. Por lo tanto, es importante complementar el scoring clínico con el scoring histológico de EAE, que también proporciona un medio para estudiar los mecanismos subyacentes de la lesión celular en el sistema nervioso central (SNC).
Aquí, se presenta un protocolo simple para preparar y teñir secciones de la médula espinal y el cerebro de ratones y para puntuar la inflamación, la desmielinización y la lesión axonal en la médula espinal. El método de puntuación de la infiltración leucocitaria en la médula espinal también se puede aplicar para puntuar la inflamación cerebral en la EAE. También se describe un protocolo para medir la luz de neurofilamentos solubles (sNF-L) en el suero de ratones utilizando un ensayo de molécula pequeña (SIMOA), que proporciona información sobre el alcance de la lesión general del SNC en ratones vivos.
Introducción
La encefalomielitis autoinmune experimental (EAE) es el modelo murino más común para la enfermedad desmielinizante humana, la Esclerosis Múltiple (EM)1. La patología inflamatoria clásica de la EM, que incluye la infiltración de IFN-γ (gamma) y células T auxiliares productoras de IL-172, la infiltración de monocitos inflamatorios3, la formación de lesiones desmielinizantes inflamatorias perivasculares y submeníngeas4 y la aparición de lesión axonal4 en el sistema nervioso central (SNC), también se observa en EAE 5,6,7,8,9 . La similitud en los mecanismos inmunitarios entre la EAE y la EM ha convertido a la EAE en un modelo preclínico adecuado para probar la eficacia y los mecanismos de acción de una serie de terapias inmunológicas aprobadas para la EM, como el natalizumab, el fingolimod, el dimetilfumarato y el acetato de glatirámero (revisado en 1,5). Ciertos regímenes EAE modelan otros aspectos de la patología progresiva de la EM más allá de la lesión axonal, incluido el desarrollo de inflamación submeníngea en el cerebro, la desmielinización crónica, la atrofia de la médula espinal, la sinapsis y la pérdida de neuronas 6,10,11,12. Por lo tanto, EAE tiene utilidad para evaluar la eficacia de las terapias neuroprotectoras para la EM.
La EAE se induce en roedores de varias maneras. La inmunización activa es el método de inducción más común e implica la inmunización de roedores con antígenos de mielina (proteínas enteras o péptidos) emulsionados en CFA suplementados con Mycobacterium tuberculosis muerto por calor 13. Dependiendo de la cepa de ratón, la toxina de la tos ferina (PTX) también se administra el día 0 y el día 2 de la inmunización para aumentar la penetrancia de la enfermedad13. La EAE también puede ser inducida mediante la transferencia adoptiva de células T específicas de mielina obtenidas de ratones cebados con mielina/CFA a ratones sanos14 o puede desarrollarse espontáneamente en ratones que sobreexpresan receptores de células T específicos para los principales antígenos de mielina5.
La gravedad y la progresión de la enfermedad EAE se puntúan comúnmente mediante una escala clínica discreta de 5 puntos: 1 - flacidez de la cola, 2 - debilidad de las extremidades posteriores o del pie, 3 - parálisis completa en una o ambas extremidades posteriores, 4 - debilidad de las extremidades anteriores, 5 - moribundo o muerto13. Este sistema de puntuación clínica es sólido para documentar la progresión de la parálisis ascendente que se produce al inicio de la enfermedad, pero es menos sensible para captar el grado de recuperación de los ataques inflamatorios del SNC. Por ejemplo, tanto a los ratones que deambulan con dificultad como a los ratones que deambulan con facilidad pero que presentan debilidad para agarrar los pies se les asigna una puntuación de 2 en la escala EAE. Las puntuaciones pueden permanecer elevadas en la fase post-aguda de la EAE debido a la presencia de lesión o pérdida permanente de axones, incluso a pesar de la resolución de la respuesta inflamatoria9. Ha habido una variedad de intentos de desarrollar sistemas de puntuación más refinados, pruebas conductuales, medidas de las extremidades posteriores y la fuerza de agarre, y sistemas de monitorización infrarroja para capturar mejor las diferencias en los déficits clínicos en EAE 9,16,17,18; Sin embargo, estas medidas de puntuación más complejas no distinguen la contribución de la inflamación frente a la lesión tisular a los déficits neurológicos subyacentes. Por lo tanto, el enfoque de referencia para puntuar la gravedad de la EAE es realizar una puntuación tanto clínica como histológica.
Aquí, se describe un protocolo sobre cómo diseccionar e incrustar muestras de médula espinal y cerebro de ratón en parafina de una manera que capture el proceso estocástico de formación de lesiones que ocurre en EAE. También se presenta un protocolo de cómo teñir secciones con azul rápido de Luxol (LFB), creado originalmente por Kluver y Barrera19, que detecta mielina en el SNC. Las secciones se tiñen con LFB solo (para el análisis de desmielinización) o se contratiñen con hematoxilina y eosina (H&E) para ayudar a visualizar y puntuar las lesiones inflamatorias. También se proporcionan protocolos para cuantificar la presencia de leucocitos totales (CD45), la pérdida de mielina y el número de axones lesionados (SMI-32) en la médula espinal utilizando anticuerpos disponibles comercialmente, técnicas inmunohistoquímicas (IHQ) y software de acceso público. El protocolo utilizado para cuantificar los leucocitos en la médula espinal también se puede aplicar para cuantificar los leucocitos en el cerebro.
La evaluación histológica de la pérdida y lesión axonal en el cerebro es comparativamente más difícil que en la médula espinal, ya que los tractos de sustancia blanca del cerebro no corren paralelos entre sí. La medición de la luz de neurofilamentos séricos (sNF-L) se ha convertido en un biomarcador prometedor para la lesión neuronal en la EM20,21. Estudios recientes han extendido esta tecnología a EAE 22,23,24. Aquí, se presenta un método para medir la luz de neurofilamentos séricos (sNF-L) en ratones vivos utilizando un ensayo de molécula pequeña (SIMOA). Este método requiere solo una pequeña cantidad de suero y se puede realizar en ratones vivos en solo medio día, lo que proporciona una retroalimentación rápida sobre cómo una terapia probada está afectando la lesión general del SNC. Todos los métodos descritos aquí se pueden aplicar a ratones de cualquier sexo o cepa.
Protocolo
Todos los experimentos realizados con ratones se realizaron bajo protocolos de uso animal aprobados por el Comité de Cuidado Animal de Unity Health Toronto, siguiendo las pautas establecidas por el Consejo Canadiense de Cuidado Animal. Asegúrese de usar una bata de laboratorio, guantes protectores y anteojos durante los procedimientos de laboratorio.
1. Extracción y fijación del cerebro y la médula espinal
- Sacrificar al ratón de acuerdo con las políticas institucionales. Coloque al ratón boca abajo sobre una mesa de disección y decapítelo con unas tijeras quirúrgicas (cortando hacia abajo).
- Con unas pinzas de Adson (en la mano no dominante), agarra la piel de la parte superior de la cabeza del ratón. A continuación, haga una incisión de 2,5 cm en la piel de la parte superior de la cabeza con unas tijeras quirúrgicas.
- Usa los dedos para empujar la piel de la cabeza lateralmente para visualizar el cráneo subyacente.
- Estabilice la cabeza del ratón agarrando las cuencas de los ojos con unas pinzas Adson estándar.
- Con unas tijeras finas (mano dominante), haga pequeños cortes en el cráneo a lo largo de la línea media desde la columna cervical hasta los bulbos olfatorios.
NOTA: Incruste solo unos pocos milímetros de puntas de tijera debajo del cráneo a la vez para evitar dañar el cerebro subyacente. - Use pinzas de Adson con dientes para reflejar el cráneo lateralmente y revelar el cerebro subyacente.
- Sostén la cabeza con la mano no dominante. Sosteniendo las tijeras cerradas (mano dominante), saque la médula espinal de la columna cervical y empuje suavemente el cerebro hacia afuera del cráneo, cortando los nervios craneales.
- Coloque el cerebro en un tubo cónico que contenga 10 ml de formalina tamponada neutra al 10% que esté etiquetada con la identificación del animal.
- Haz una incisión en el pelaje a lo largo de la línea media del torso del ratón, desde el cuello hasta la cola.
- Use los dedos para empujar la piel lateralmente para visualizar la columna vertebral.
- Con unas tijeras quirúrgicas, corte hacia abajo a través de la columna vertebral al nivel donde los fémures se unen a la cadera.
- Use tijeras quirúrgicas para cortar la pared del cuerpo a cada lado de la columna vertebral desde la cadera hasta el cuello. Recorta todos los órganos adheridos.
- Coloque la columna vertebral que contiene la médula espinal en el mismo tubo de formol que contiene el cerebro. Deje que el cerebro y la columna vertebral se fijen durante 5 a 7 días.
NOTA: El momento de la fijación es importante. Algunos anticuerpos no funcionarán si el tejido está demasiado fijado. Si el tejido está subfijado, es difícil extruir la médula espinal de la columna vertebral en el paso 2.
2. Macroscopía y procesamiento de la médula espinal y el cerebro
NOTA: Los siguientes pasos se llevan a cabo en una campana extractora. Antes de comenzar, prepare 2 placas de Petri limpias de 10 cm, un matraz Erlenmeyer equipado con un embudo forrado con papel de filtro, dos bisturíes (uno para cortar hueso y otro para cortar tejidos del SNC), papel para lentes, un lápiz, casetes de inclusión y frascos de muestras precargados con formalina al 10%.
- Con unas tijeras, corta un pequeño trozo de papel para lentes (del mismo ancho pero el doble de largo que el casete) y colócalo en una placa de Petri.
- Etiquete un casete de plástico con la identificación de la muestra con un lápiz.
- Vierta el tubo que contiene el cerebro y la columna vertebral fijos en el embudo. Transfiera la columna vertebral y el cerebro a la placa de Petri vacía.
NOTA: La formalina usada se filtrará a través del matraz Erlenmeyer y se puede reutilizar en el paso 2.13. - Divide el cerebro en seis partes coronales con un bisturí. Haz un corte caudal al cerebelo, uno en el medio del cerebelo, uno rostral al cerebelo y dos cortes en el cerebro rostral restante, creando 3 cortes coronales adicionales de igual grosor.
- Con fórceps, transfiera muestras de cerebro a la mitad del papel de la lente en la placa de Petri.
- Corta la médula espinal en tres pedazos con el bisturí: el primer corte se hace en la parte inferior de la caja torácica y el segundo corte se hace justo debajo de la curvatura de la columna cervical.
- Con el mismo bisturí, recorte la pieza de la columna sacra en el extremo caudal hasta que se pueda visualizar la médula espinal.
- Levanta la columna torácica (mano no dominante). Sostenga las pinzas Adson con los dientes bien cerrados (mano dominante) y empuje suavemente el extremo de las pinzas hacia la abertura más pequeña de la columna vertebral con un movimiento de torsión suave. El cordón debe salir del otro extremo.
NOTAS: Cualquier instrumento de extremo redondo que sea del tamaño de la médula espinal funcionará para este propósito. Si la médula espinal no se sale de forma natural, no la fuerce. En su lugar, use unas tijeras finas para cortar los huesos a lo largo del costado de la columna vertebral y refleje que se abra para revelar la médula espinal. Alternativamente, fije la médula espinal y el cerebro durante unos días adicionales en formol; sin embargo, se debe aplicar el mismo tiempo de fijación a todas las muestras para evitar la introducción de variabilidad en la tinción de anticuerpos. - Toma las pinzas Adson estándar (mano dominante). Todavía sosteniendo la pieza de la médula espinal con la mano menos dominante, use fórceps para sacar suavemente la médula emergida de la columna. Coloque la pieza de la médula espinal en la placa de Petri que contiene el papel de la lente.
- Repita este proceso para las piezas de la columna lumbar/sacra y cervical.
- Divida las tres piezas de la médula espinal (cervical, torácica, lumbar/sacra) en piezas transversales más pequeñas con un bisturí. Corta al menos 15 segmentos, cada uno de los cuales debe tener menos de 2 mm de grosor.
NOTA: Asegúrese de que los segmentos sean más cortos que anchos, lo que hará que las secciones caigan más fácilmente en sección transversal durante el proceso de incrustación en el paso 3. - Coloque las piezas de la médula espinal en la misma mitad del papel de la lente que contiene las piezas del cerebro. Dobla el papel de la lente para intercalar los trozos de pañuelo y colócalo en el casete etiquetado.
NOTA: El papel para lentes evita que pequeños trozos de tejido se escapen del casete durante el procesamiento. - Transfiera el casete a un frasco de muestra que contenga formalina reciclada o fresca.
- Repita los pasos 2.1 a 2.13 para los especímenes restantes.
- Después de 5-7 días de fijación, transfiera los casetes del recipiente de la muestra al primer baño de formalina en el procesador automático de tejidos (consulte la Tabla de materiales). Haga funcionar el procesador de tejidos durante la noche de acuerdo con el programa descrito en la Tabla complementaria 1. Las muestras se mantienen en cera de parafina tibia hasta su inclusión.
3. Incrustación y corte de secciones del cerebro y la médula espinal
- Transfiera los casetes del procesador a la cámara de retención caliente de la estación de inclusión de parafina (consulte la Tabla de materiales).
- Incruste las secciones transversales de la médula espinal y el cerebro de cada ratón en un solo bloque de parafina de la siguiente manera (Figura 1):
- Primero, vierte cera de parafina solo para cubrir el fondo del molde. Con pinzas finas, coloque las piezas de la sección transversal de la corona cerebral y la médula espinal en la parafina en el fondo del molde.
- Transfiera el molde a la superficie de enfriamiento durante varios segundos para fijar las piezas del cerebro y la médula espinal en su lugar. Vuelva a colocar el molde en la superficie calentada y llénelo hasta arriba con parafina caliente.
- Coloque la tapa del casete (que está etiquetada con la identificación de la muestra) en la parte superior del molde. Vierte más parafina encima de la tapa del casete. Transfiera el molde a la estación de enfriamiento para permitir que la cera se asiente (enfríe durante 30-60 minutos).
NOTA: La inclusión de secciones de la médula espinal requiere práctica. Para mejorar el éxito, utilice longitudes más cortas de la médula espinal (<2 mm), ya que es más probable que caigan en sección transversal. Se pueden usar lupas quirúrgicas para los ojos para ayudar a distinguir si las piezas de la médula espinal están en sección transversal. - Monte el bloque de parafina en el micrótomo giratorio. Recorte el bloque hasta que aparezcan los tejidos de interés en la sección de parafina.
- Cortar cintas de 5 μM de secciones de cada bloque y transferirlas a un baño de agua a 42 °C.
- Recoja secciones en portaobjetos y colóquelos en un estante de vidrio para portaobjetos.
- Hornee las secciones a 37 °C en un horno seco durante la noche. Enfríe los portaobjetos antes de proceder a la tinción.
4. Desparafinación y rehidratación de secciones en preparación para la tinción
NOTA: Los pasos se realizan en una campana extractora. Antes de comenzar, prepare baños de solventes. Prepare 5 L de 1x PBS (1 L ddH2O, 8 g NaCl, 0,2 g KCl, 1,44 g Na2HPO4, 0,24 g KH2PO4; pH = 7,4) con 0,05% Tween-20 (PBS-T) para todos los pasos de lavado.
- Desparafinar colocando portaobjetos en dos baños consecutivos de xileno o un disolvente sin base de xileno en un agitador durante 5 minutos cada uno con una agitación suave.
- Rehidratar los tejidos transfiriendo portaobjetos a través de baños sucesivos de porcentajes descendentes de etanol: 2 x etanol al 100% (5 min cada uno), 2 x etanol al 95% (3 min cada uno) y 1 x etanol al 70% (3 min). Retener etanol al 95 % para la tinción de LFB y rehidratar a etanol al 70 %, y mantener PBS-T para inmunohistoquímica (IHQ).
5. LFB para mielina con H&E
- Prepare una solución de LFB al 0,1% (0,2 g de LFB, ver Tabla de Materiales, 200 mL de etanol al 95%, 0,5 mL de ácido acético glacial). Mezclar y filtrar en un matraz Erlenmeyer. Almacenar en un frasco oscuro hasta su uso.
- Transfiera secciones de etanol al 95% a una rejilla de vidrio para portaobjetos que se coloca en un plato de tinción que contiene LFB. Cubra el plato y séllelo con una película de parafina para evitar la evaporación.
- Incubar los tramos a 56 °C en el horno durante la noche (máximo 16 h).
- A la mañana siguiente, transfiera los portaobjetos a un baño ddH2O y manténgalos presionados.
- Mientras tanto, prepare (1) una solución fresca de carbonato de litio al 0,05% (0,05 g de carbonato de litio, 100 ml ddH2O); (2) Solución de eosina Y (añadir 2 g de sal de eosina a 40 mL ddH20 y mezclar hasta que se disuelva y luego mezclar con 160 mL de etanol al 95%).
- Prepare los siguientes baños: 1 x carbonato de litio, 3 x etanol al 70%, 3 x etanol al 95%, 2 x etanol al 100%, 3 x ddH20. Coloque los baños en orden de uso (véase la Tabla complementaria 2).
- Siga los pasos descritos en la Tabla complementaria 2.
- Después de que los portaobjetos estén secos, visualice las lesiones desmielinizantes bajo el microscopio.
6. LFB para mielina sin H&E
- Realice este procedimiento de tinción para el análisis de mielina.
NOTA: El procedimiento es idéntico al del paso 5 (ver Tabla complementaria 2), pero tiene un flujo de trabajo abreviado. Después del paso 4, continúe el procedimiento comenzando en el paso 10.
7. Recuperación de antígenos y extinción de peroxidasas para tinciones inmunohistoquímicas (IHQ)
NOTA: Antes de comenzar, prepare 100 ml de peróxido de hidrógeno en metanol (1 parte de solución de peróxido de hidrógeno al 30% en 9 partes de metanol al 100%, en una campana extractora). Preparar 1 L de tampón de citrato de 10 mM con Tween-20 (2,94 g de citrato trisódico, disuelto en 1 L de ddH20 en un vaso de precipitados sobre plato de agitación, llevar el pH a 6,0 y añadir 500 μl de Tween-20). Prepare PBS-T (consulte el paso 4). Todos los lavados se realizan en baños de PBS-T con agitación suave (en una coctelera) a menos que se indique lo contrario.
- Apague la peroxidasa endógena colocando portaobjetos en peróxido de hidrógeno al 3% en metanol durante 15 minutos (en una campana extractora). Lave los portaobjetos dos veces en PBS-T (2 min cada uno).
- Transfiera los portaobjetos a un portaobjetos de metal y colóquelos en 1 L de tampón de citrato en una olla a presión. Selle la tapa y agregue un tapón de goma en la parte superior de la ventilación de escape de vapor.
- Cocine a fuego alto en el microondas hasta que aparezca la lengüeta amarilla de la olla a presión, lo que indica que se ha alcanzado la presión máxima. Cocine durante 5 minutos más a presión máxima y luego retire la olla a presión del microondas con guantes protectores.
- Despresurice quitando el tapón. Retire la tapa y deje que los portaobjetos se enfríen en el tampón de citrato durante 20 minutos y luego proceda al método de tinción deseado.
PRECAUCIÓN: Aléjese cuando libere el vapor, ya que puede causar una lesión por quemaduras.
8. Inmunohistoquímica CD45
NOTA: Este método de IHQ se utiliza para visualizar leucocitos infiltrantes. Los pasos de bloqueo de avidina/biotina se combinan con los pasos de bloqueo e incubación primaria de anticuerpos.
- Prepare el tampón de bloqueo (2% BSA, 2% suero de conejo en 1x PBS).
- Transfiera los portaobjetos a una bandeja de vidrio y lávelos dos veces con PBS-T (2 minutos cada uno). Preparar la solución de avidina/bloqueo (4 gotas/ml de avidina en suero de conejo al 2% de BSA/2% en 1 x PBS, ver Tabla de Materiales).
- Seque el exceso de PBS-T alrededor del pañuelo de papel con un pañuelo de papel de laboratorio. Con un bolígrafo hidrofóbico, dibuje un círculo alrededor del pañuelo y coloque el portaobjetos en la cámara húmeda.
- Aplique la solución de avidina/bloqueo en cada sección (400 μL/portaobjetos).
- Cubra la cámara húmeda e incube durante 30 minutos a temperatura ambiente. Durante este paso, prepare el anticuerpo anti-CD45 (Tabla suplementaria 3) en un tampón de bloqueo que contenga biotina (4 gotas/ml de biotina, 2% de BSA/2% de suero de conejo en 1x PBS).
- Retire la solución de bloqueo del portaobjetos y colóquela en una toallita de laboratorio sin pelusa. Aplíquelo alrededor del pañuelo con una toallita de laboratorio para eliminar el exceso de líquido.
- Vuelva a colocar el portaobjetos en una cámara húmeda. Agregue 400 μL de solución de anticuerpos CD45 (ver Tabla de materiales) a la sección. Incubar durante la noche a 4 °C en una cámara húmeda cubierta.
- Al día siguiente, drene el anticuerpo primario y lave los portaobjetos 3 veces en PBS-T (5 min cada uno).
- Seque el área alrededor de la sección utilizando un laboratorio sin pelusa y luego agregue 400 μL de anticuerpo secundario (dilución 1:200 en tampón de bloqueo) en cada sección. Incubar a temperatura ambiente durante 1 h.
- Mientras tanto, prepare el reactivo ABC (ver Tabla de Materiales) agregando 2 gotas del reactivo A a 5 mL de 1x PBS y mezcle. Agregue 2 gotas de reactivo B a la misma solución y mezcle (prepare ~ 30 min antes de usar).
- Lave los portaobjetos en 3 cambios de 1x PBS-T (5 min cada uno) y coloque los portaobjetos en una cámara húmeda.
- Añadir 400 μL de reactivo ABC a las secciones. Cubra la cámara húmeda e incube durante 30 minutos a temperatura ambiente.
- Lave los portaobjetos en 3 cambios de 1x PBS-T (5 min cada uno). Mientras tanto, prepare una cantidad adecuada de solución DAB en un tubo de centrífuga de 15 ml cubierto con papel de aluminio de acuerdo con las instrucciones del fabricante (consulte la Tabla de materiales).
- Tome un portaobjetos y concéntrese en una sección de la médula espinal bajo un microscopio. Agregue 400 μL DAB al portaobjetos e inicie el temporizador de laboratorio.
- Visualice la sección mientras se está desarrollando y detenga el temporizador cuando los leucocitos estén marrones. Transfiera el portaobjetos a un baño ddH20 para detener la reacción. Mantenga en agua durante 5 minutos. Se utiliza el mismo tiempo de revelado para las diapositivas restantes.
PRECAUCIÓN: El DAB es un carcinógeno. Deseche los residuos DAB y los DDH2Oposteriores a DAB como residuos peligrosos. - Contratinción de portaobjetos con hematoxilina de Mayer durante ~4-10 min (ver Tabla Suplementaria 2). Enjuague los portaobjetos con agua corriente del grifo durante 10 minutos.
- Deshidratar en etanol al 95% (1 x 3 min), seguido de etanol absoluto al 100% (2 x 3 min cada uno).
- Pasando a una campana extractora, transfiera los portaobjetos a xileno o a un disolvente sustituto del xileno durante 5 min. Cubra el deslizamiento con el medio de montaje y deje que los portaobjetos se sequen durante 1-2 días en la campana extractora.
PRECAUCIÓN: Si usa xileno, use guantes dobles y pinzas para manipular los portaobjetos cuando se cubran, ya que es tóxico y puede disolver los guantes. - Limpie los portaobjetos con xileno y escanee con un escáner de portaobjetos con un aumento de 20x.
9. SMI-32 IHQ para daño axonal
NOTA: Este protocolo utiliza un anticuerpo SMI-32 de ratón, que reacciona contra el neurofilamento pesado no fosforilado, que puede acumularse en los axones lesionados25. Dado que este anticuerpo se ha elevado en ratones y detecta un antígeno de ratón, se recomienda utilizar un kit de ratón contra ratón (MOM). En este procedimiento, el paso de bloqueo de avidina/biotina se realiza como un paso separado de la incubación primaria de anticuerpos. Antes de comenzar este protocolo, desparafine, rehidrate, apague la actividad de la peroxidasa endógena y realice la recuperación del antígeno como se describe en los pasos 4 y 7.
- Lave las secciones dos veces con 2 x PBS-T (2 min cada una). Retire el exceso de líquido alrededor de las secciones con un pañuelo de papel de laboratorio y dibuje un círculo alrededor de los pañuelos con un bolígrafo hidrofóbico.
- Añadir 400 μL de tampón de bloqueo (2% (p/v) de suero de cabra en 1x PBS-T) con avidina (4 gotas/mL) a las secciones. Incubar durante 15 min a temperatura ambiente.
- Sumerja los portaobjetos dos veces en 1x PBS-T. Añadir 400 μL de tampón de bloqueo con biotina (4 gotas/mL) al portaobjetos e incubar durante 15 min a temperatura ambiente.
- Lave los portaobjetos en un baño de 1 x PBS-T durante 2 min. Mientras tanto, prepare el reactivo de bloqueo de MOM agregando 2 gotas de solución madre (consulte la Tabla de materiales) a 2,5 ml de 1x PBS.
- Añadir 400 μL de reactivo MOM a la sección. Incubar durante 1 h a temperatura ambiente.
- Lave los portaobjetos dos veces en un baño de 1 PBS-T durante 2 minutos. Mientras tanto, prepare el diluyente MOM agregando 300 μL de solución madre de concentrado de proteína a 3,75 mL de 1x PBS.
- Añadir 400 μL de diluyente MOM e incubar durante 5 min a temperatura ambiente. Mientras tanto, diluya el anticuerpo SMI-32 (ver Tabla de Materiales) en el diluyente MOM.
- Retire el diluyente de los portaobjetos y agregue 400 μL de solución de anticuerpos SMI-32 en la sección. Cubra la cámara húmeda e incube durante 30 minutos a temperatura ambiente.
- Lave los portaobjetos dos veces en un baño de 1 PBS-T durante 2 minutos, cada uno con una agitación suave. Mientras tanto, diluya el reactivo de trabajo MOM anti-mouse IgG en el diluyente (10 μL de caldo en 2,5 mL de diluyente).
- Añadir 400 μL de reactivo de trabajo IgG anti-ratón por portaobjetos. Incubar durante 10 min.
- Lave los portaobjetos dos veces en un baño de 1 PBS-T durante 2 minutos cada uno. Continúe con la tinción siguiendo los pasos descritos en el protocolo de tinción de CD45 (paso 8.11 – 8.19).
10. Puntuación LFB y H&E para la presencia de lesiones desmielinizantes
NOTA: El siguiente es un enfoque de análisis que se puede aplicar para obtener información rápida sobre la gravedad de la desmielinización inflamatoria. Este análisis se realiza en secciones del cordón muestreadas a diferentes niveles (cervical, torácico y lumbar, al menos 3 secciones por nivel). Consulte el Allen Brain Atlas for Mouse spinal cord26 para ayudar a identificar el nivel anatómico de la médula espinal. Este análisis requiere archivos TIFF. Si las imágenes escaneadas están en formato .czi, siga las instrucciones de la Tabla complementaria 4 para convertir archivos czi a archivos TIFF.
- Abra la imagen TIFF de la sección que se va a analizar arrastrando y soltando el archivo en ImageJ. Observar la sección de la médula espinal en 4 cuadrantes: dorsal, lateral izquierdo, lateral derecho y anterior (Figura 2A,B).
- Puntuación de la presencia de lesiones desmielinizantes en cada cuadrante como se muestra en la Figura 2.
NOTA: La presencia de una lesión da como resultado una puntuación de 1 en ese cuadrante, para un total de 4 puntos posibles por sección. Se asigna una puntuación de 1 incluso si hay múltiples lesiones dentro de un cuadrante. - Suma todos los puntos de cada ratón y divídelos por el número total de cuadrantes muestreados para obtener la fracción de cuadrantes con lesiones submeníngeas.
11. Cálculo de la fracción de área de tinción de LFB en la sustancia blanca de la médula espinal
NOTA: Este análisis mide el porcentaje de la fracción de área de la sustancia blanca de la médula espinal que se tiñe con LFB.
- Abra una sección manchada con LFB guardada como un archivo TIFF arrastrando/soltando el archivo en ImageJ.
- Haga clic en la imagen > escriba > 8 bits para producir una imagen en escala de grises. Haga clic en la imagen > ajustar > umbral. Ajuste el control deslizante inferior para que la superposición roja capture todas las regiones oscuras (mielina) que se ven a simple vista (Figura 2C-E). Haga clic en Aplicar.
- Haga clic en Analizar herramientas de > > Administrar ROIr para abrir el Administrador de ROI.
- Seleccione la herramienta de dibujo de polígonos en la barra de herramientas de ImageJ. Esta herramienta de dibujo permite delinear una región de la médula espinal con el mouse de la computadora.
- Delinee la región dorsal de la médula espinal y agregue el polígono al Administrador de ROI haciendo clic en t en el teclado.
- Esboza la región anterolateral de la sustancia blanca de la médula espinal y añade el polígono al gestor de ROI.
NOTA: Al trazar, excluya los vasos sanguíneos grandes, los desgarros en el tejido, los artefactos y las áreas adyacentes al asta dorsal (Figura 2A, flecha B ), que normalmente están menos mielinizadas. Sea lo más preciso posible al trazar, ya que incluir demasiado fondo blanco sesgará los resultados. - Haga clic en Analizar > Establecer medidas y seleccione Fracción de área.
- Haga clic en Medir en el Administrador de ROI. Esto dará la fracción del área delineada que está teñida con LFB.
- En el cuadro de resultados recién producido, copie los valores en Excel y cierre la ventana de la imagen. Calcule el % promedio de área de fracción teñida para las regiones dorsal y ventrolateral. Promedie estos para obtener un valor para esa sección.
- Repita los pasos 11.1 a 11.9 para las secciones cervical, torácica y lumbar (N = 3/nivel/ratón).
- Calcule el porcentaje promedio de la fracción de mielina para todas las secciones de cada ratón. El porcentaje de desmielinización se calcula restando el porcentaje de tinción de área de 100.
12. Análisis del número de células CD45+ y ovoides axónicos SMI-32+
- Arrastre y suelte una imagen TIFF teñida con CD45 o SMI-32 en ImageJ. Haga clic en Analizar > Establecer escala > Global > Aceptar para establecer la barra de escala en todas las imágenes. Tenga en cuenta que esto se hace solo para la primera imagen.
- Seleccione la herramienta de dibujo de polígonos y trace alrededor de la materia gris con el mouse de la computadora. Haga clic en Analizar > medir y registre los resultados en Excel como "Área de materia gris".
- Con el polígono dibujado aún en la imagen, elimine la materia gris de la imagen haciendo clic en la tecla Eliminar (teclado). Esta acción deja solo la materia blanca para ser analizada.
- Delinea toda la sección de la médula espinal con la herramienta de dibujo de polígonos . Excluya cualquier región de tejido que falte o esté dañada.
- Haga clic en Analizar > medir y registre los resultados como "Área total de tejido" en el archivo de Excel.
- Haga clic en la imagen > color > deconvolución de color. En la ventana desplegable vectores, seleccione H DAB. Aparecerán tres nuevas ventanas: mantenga la ventana de tono marrón (canal DAB) y elimine otras ventanas de imagen.
- Haga clic en la imagen > ajustar > umbral. Ajuste el control deslizante inferior para limitar el umbral de la imagen, de modo que la superposición roja capture la misma cantidad de manchas marrones detectadas a simple vista. Haga clic en Aplicar.
- Haga clic en Procesar > binario > cuenca hidrográfica. En este paso, compare la imagen original y la imagen binaria para asegurarse de que están de acuerdo.
- Haga clic en Analizar > Analizar partículas. Seleccione Mostrar superposición y modifique la configuración: Tamaño = 5 - 150 μm2, Circularidad = 0,4 - 1. Haga clic en Aceptar.
NOTA: Esta configuración permite que se incluyan celdas individuales y pequeños grupos de celdas que no se dividieron con la función Cuenca hidrográfica en lugar de excluirlas en el análisis. - En la ventana de resultados, registre el último número en la columna situada más a la izquierda en Excel, que representa el recuento total de partículas. A continuación, calcule el área de la sustancia blanca (área total del tejido – área de la materia gris enmm 2). Exprese el recuento total de partículas por área de materia blanca (recuento/mm2).
- Repita los pasos para cada imagen RGB guardada. Una vez que se hayan analizado todas las secciones de la médula espinal de un ratón, promedie el recuento de partículas por tejido mm2 para ese ratón.
NOTA: El flujo de trabajo utilizado para analizar los leucocitos de la médula espinal también se puede aplicar a las regiones del cerebro.
13. Medición de sNF-L mediante un ensayo SIMOA
- Recolectar de 100 a 200 μL de sangre de ratones vivos mediante sangrado safeno utilizando tubos de microtainación capilar o mediante punción cardíaca con una jeringa y una aguja de 25 G (procedimiento terminal). Para este último, transfiera sangre a un tubo de microcentrífuga de 1,5 ml.
- Deje que la sangre coagule a temperatura ambiente durante 30 a 60 minutos.
- Centrifugar las muestras a 2660 x g durante 5 min a 4 °C y pipetear la fracción superior (suero) en un nuevo tubo de microcentrífuga. Conservar el sérum a -80 °C hasta que esté listo para su uso.
- Preparación: Deje que los calibradores y controles (kit de ensayo NF-light, consulte la Tabla de materiales) se calienten a temperatura ambiente durante 1 h antes de su uso. Saque el sustrato enzimático (RGP) del refrigerador y colóquelo en un baño de agua a 30 °C durante al menos 30 minutos, agitando el vórtice cada 10 minutos.
- Descongele las muestras de suero en hielo. Una vez descongelado, las muestras de vórtice suave y centrifugar a 10000 x g durante 5 minutos para granular cualquier residuo.
- Carga de la placa: Vórtice los calibradores y los controles. Cargue los calibradores por duplicado, los controles por duplicado y las muestras de suero por duplicado en la placa de 96 pocillos provista con el kit. Las muestras de suero se diluyen en una proporción de 1:3 con el diluyente incluido en el kit. Selle la placa.
- Encienda la máquina SIMOA (consulte la Tabla de materiales) en el orden de la computadora, el programa y luego la máquina. Permita que la máquina se inicialice y ejecute el mantenimiento de inicio del día .
- Vórtice las perlas magnéticas durante 30 s.
- Cargue reactivos en la pantalla, haga doble clic en la posición de la rejilla donde se colocará el frasco de reactivo y, a continuación, escanee el código de barras del frasco.
- Coloque las perlas magnéticas en la posición de agitación en la rejilla (posiciones 1-3).
- Continúe cargando el detector, el reactivo SBG y el reactivo RGP en la máquina.
- Haga clic en configuración en el software. Asegúrese de que el modo de muestra esté en la placa. En la pestaña de ejecución de configuración, asigne un nombre al experimento.
- Asigne pocillos en la placa para los calibradores de la siguiente manera: Haga clic en el pocillo y, a continuación, seleccione el ensayo. Seleccione calibrar A y luego haga clic en ascendente. Resalte los pocillos A1-8 y, a continuación, haga clic en réplicas (2) para asignar las coordenadas de los calibradores que se ejecutarán por duplicado. Ejecute usando el protocolo neat.
NOTA: Consulte el certificado de análisis (sitio web del fabricante) para obtener las concentraciones de cada calibrador para cada número de lote en particular. Una vez que se asignan los pozos, no es posible navegar fuera de esta pantalla sin perder el trabajo, hasta que la placa esté bloqueada en su lugar. - Asigne las muestras siguiendo los pasos que se indican a continuación:
- En la parte inferior derecha de la pantalla, haga clic en el botón para asignar las muestras. Resalte los pocillos donde se ubicarán las muestras.
- Marque el ensayo que se va a ejecutar de la lista, elija el número de réplicas y especifique la dilución integrada de 4x.
- Con los pocillos aún resaltados, introduzca un prefijo para el ID de la muestra y el número inicial y, a continuación, haga clic en generar para producir ID secuenciales para las muestras. Repita los pasos para las muestras de control.
- Cargue la placa en el soporte de la placa (A1 a A12).
- En la interfaz de la pantalla, haga clic en muestras de programación terminadas y vaya a la pestaña de recursos del sistema. Compruebe que todos los recipientes de reactivos estén llenos y que los contenedores de residuos estén vacíos.
- Haga clic en Ejecutar.
- Una vez finalizada la ejecución, compruebe la curva de calibración en la pestaña "Reducción de datos" seleccionando el ensayo y el nombre de la placa.
- Vaya a "Historial de ejecución" y use los filtros para encontrar la ejecución más reciente. Seleccione ejecutar y, a continuación, todos los resultados. Haga clic en exportar y guarde el archivo .csv. Haga clic en informe y, a continuación, seleccione informe de calibración por lotes y seleccione la ejecución reciente. Obtenga una vista previa del informe y expórtelo.
- Realice el mantenimiento al final del día recomendado por el fabricante. Apague el programa, la máquina y, a continuación, la computadora.
Resultados
En la figura 3 se muestra la tinción histoquímica y de IHQ representativa, con ejemplos de lesiones agudas (izquierda) y de EAE más antiguas (derecha). La tinción representativa de CD45 con contratinción de hematoxilina se muestra en la Figura 3A, B. Las Figuras 3C-F muestran ejemplos de tinción de LFB con (Figura 3C,D) o sin (Figura 3E,F) de la contratinción H&E. Aunque la hematoxilina no es específica de las células inmunitarias, los núcleos de las células inmunitarias se tiñen de forma más oscura y pueden distinguirse de las células residentes del SNC. La figura 3G, H muestra la tinción representativa de los axones SMI-32+, contrateñidos con hematoxilina. Obsérvese el aumento de la aparición de esta tinción en las lesiones EAE más antiguas.
El daño de las vías mielinizadas es más prevalente en la médula espinal en la EAE murina activa y este es el principal impulsor de la parálisis en esta enfermedad 7,9. Por lo tanto, la puntuación de la presencia de inflamación y daño tisular en la médula espinal se prioriza en los análisis histológicos. Las lesiones EAE se presentan esporádicamente en diferentes regiones (anterior, lateral o dorsal) (Figura 2A,B) y a diferentes niveles (sacro, lumbar, torácico, cervical) de la médula espinal. El método de inclusión descrito garantiza una buena toma de muestras de las lesiones en toda la médula. Se incrustan más secciones de las que se analizan, ya que algunas secciones pueden dañarse en el proceso de procesamiento o seccionamiento. Para garantizar un muestreo representativo, se analizan un mínimo de 3 secciones representativas a nivel cervical, torácico y lumbar de la médula espinal para cada ratón. La identidad de cada espécimen se oculta para que la persona que realiza el análisis no esté sesgada al seleccionar secciones representativas para el análisis.
Para obtener una visión rápida de las diferencias en la gravedad histológica de la EAE, se puede puntuar la presencia de lesiones desmielinizantes submeníngeas en los cuadrantes de la médula espinal en secciones seleccionadas (Figura 2A, B). Este es un método rápido que se puede realizar en imágenes escaneadas o usando un microscopio óptico. Este análisis es lo suficientemente sensible como para detectar diferencias en la severidad histológica de la EAE entre grupos cuando la EAE es grave en un grupo y leve en otro. Por ejemplo, en el experimento de la Figura 4, se indujo EAE en hembras de tipo salvaje (WT) y ratones con una deleción en OGR1 (OGR1 KO) utilizando MOG p35-55/CFA más PTX. Los ratones del grupo WT desarrollaron EAE grave con parálisis completa, mientras que el grupo OGR1 knockout desarrolló una enfermedad leve. Esta diferencia en la puntuación clínica correspondió a una diferencia en la fracción de cuadrantes que presentaban lesiones submeníngeas (Figura 4C).
Es importante complementar la puntuación de las lesiones desmielinizantes con la fracción porcentual de área de la tinción de mielina para capturar el grado de pérdida de mielina y/o axones mielinizados durante el ataque autoinmune. En el ejemplo de la Figura 4, el porcentaje de fracción de mielina también difirió significativamente entre los ratones OGR1 y WT (Figura 4D). El porcentaje de fracción de mielina también se correlaciona significativamente con la puntuación acumulada de EAE en ratones con EAE (Figura 4E) y, por lo tanto, sirve como una buena medida del daño tisular general en esta enfermedad. Tenga en cuenta que este protocolo no distingue la intensidad de la tinción de mielina. Si este es el resultado deseado, se debe realizar una tinción de inmunofluorescencia para proteínas de mielina como la proteína proteolípida o la proteína básica de mielina y medir la intensidad de esta tinción.
En el caso de que la EAE sea grave en ambos grupos de comparación, una mayor fracción de los cuadrantes de la médula espinal contendrá lesiones inflamatorias/desmielinizantes. En este caso, un enfoque más sensible para la inflamación de la puntuación es contar el número de leucocitos CD45+ pormm2 de sustancia blanca (ver tinción representativa en la Figura 3A). El clon de anticuerpos CD45 descrito aquí detecta todos los leucocitos infiltrantes, y solo tiñe microglías ocasionales que regulan al alza la expresión de CD45 en EAE (ver flecha abierta en la Figura 3B) y, por lo tanto, es útil para capturar la infiltración de células inmunitarias periféricas.
En estudios EAE a más largo plazo (>20 días), se recomienda realizar también un análisis de lesión axonal. La tinción SMI-32 en secciones de la médula espinal es un método sensible para detectar axones dañados. Aunque la inflamación en la médula espinal disminuye con el tiempo y los axones que no se conservan pueden volver a mielinizarse, los axones supervivientes presentan una extensión diferencial de lesión residual9 (Figura 3G,H). Por ejemplo, en el modelo de EAE inducido por MOG p35-55 en ratones C57BL6/J, el grado de lesión y pérdida axonal es un factor determinante de las puntuaciones clínicas después de que el proceso inflamatorio haya disminuido9. La Figura 5 muestra un ejemplo de esto en un experimento EAE en ratones machos y hembras, ratones WT y ratones que son deficientes en un gen llamado receptor delta activado por proliferador de peroxisomas (PPAR-delta) en el compartimento mieloide (LysMCre: Ppardfl/fl). En los machos, los ratones WT recuperaron la función de las extremidades posteriores, pero las puntuaciones clínicas se mantuvieron altas en el grupo macho LysMCre: Ppardfl/fl. Por el contrario, en el experimento en las hembras, ambos grupos experimentales tuvieron puntuaciones altas en todo momento. A primera vista, este resultado sugería que PPAR-delta tenía un efecto específico por sexo en EAE; sin embargo, la puntuación patológica de la médula espinal reveló que los ratones de ambos sexos en el grupo LysMCre: Ppardfl/fl tenían una mayor lesión axonal en comparación con sus homólogos WT (Figura 5B). Es probable que no se observara un efecto genotípico en las puntuaciones clínicas en las hembras porque los ratones hembra WT tendían a exhibir un aumento de la lesión axonal, que se manifestaba en déficits neurológicos crónicos.
En este mismo experimento, se descubrió que las hembras de ratón hembra LysMCre: Ppardfl/fl tenían una infiltración de células T más extensa en el cerebelo, lo que proporciona un ejemplo de cómo la puntuación de la inflamación cerebral puede ser útil en EAE. En la EAE, la inflamación en el cerebro se encuentra predominantemente en el cerebelo y el tronco encefálico (Figura 6A, D, G), pero también se puede encontrar en las meninges (vistas debajo del hipocampo en la Figura 6C), cerca de los ventrículos (Figura 6F) y otros tractos de sustancia blanca, incluidos el nervio óptico y el cuerpo coloso (Figura 6B, E). La puntuación de la inflamación cerebral se realiza en una región específica del cerebro (p. ej., la sustancia blanca cerebelosa) contando el número de células CD45 por región de tejidomm2 utilizando la misma metodología descrita para el protocolo de la médula espinal. En el método macroscópico descrito aquí, se realiza un corte en el medio del cerebelo, lo que proporciona la perspectiva del cerebelo y el tronco encefálico, como se muestra en la Figura 6A.
La medición de sNF-L mediante un ensayo SIMOA se ha convertido en un biomarcador útil para evaluar la lesión axonal en curso y las respuestas al tratamiento en la EM remitente-recurrente 20,21,27,28. El mismo kit de ensayo SIMOA utilizado para medir el sNF-L en humanos se puede aplicar para medir el sNFL 22,23,24 del ratón. Para explorar qué tan bien funciona este ensayo en la detección de lesiones axonales en EAE, se midió sNF-L en ratones hembra C57BL6/J en el punto final de un experimento EAE y se compararon los niveles con los de ratones control sanos emparejados por sexo que no tenían EAE. Se encontró que los ratones con EAE tenían niveles mucho más altos de sNF-L que en ratones sanos (Figura 7A) y estos niveles se correlacionaron con la densidad de axones SMI-32+ en la médula espinal (Figura 7B). En comparación con la puntuación histológica de la lesión axonal, el ensayo SIMOA es más rápido (desde el sangrado de los ratones hasta los resultados se pueden lograr en poco más de medio día) y, por lo tanto, proporciona una retroalimentación rápida de cómo está funcionando un tratamiento en ratones vivos. Este ensayo también tiene la ventaja de que refleja la lesión axonal tanto en la médula espinal como en el cerebro.

Figura 1: Bloque representativo de parafina de secciones de encéfalo y médula espinal. Las 5 secciones coronales del cerebro y las secciones transversales de la médula espinal (de 1,5 a 2 mm de grosor) están incrustadas en el mismo bloque para que puedan cortarse en una sola sección. Se deben incrustar al menos 15 secciones de la médula espinal, lo que permite una selección adecuada de las secciones para el análisis. Haga clic aquí para ver una versión más grande de esta figura.
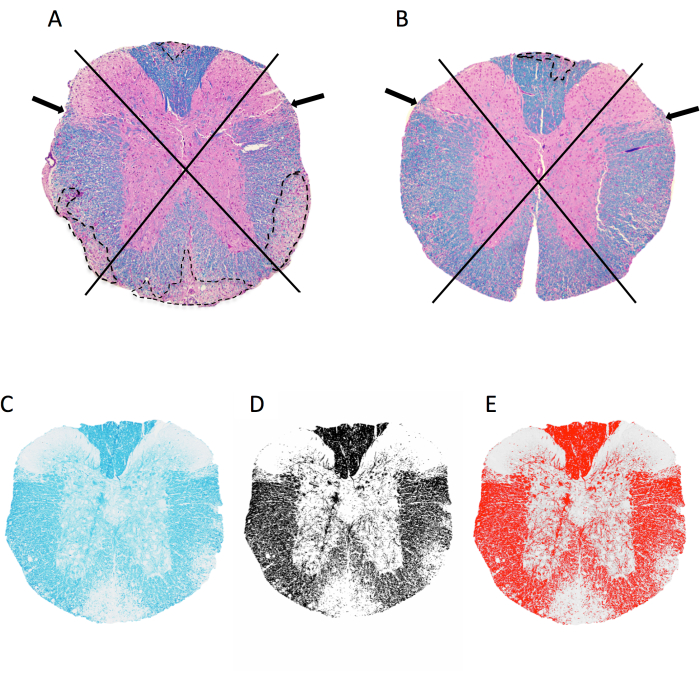
Figura 2: Puntuación de la inflamación meníngea y porcentaje de área de mielina a nivel de la médula espinal torácica. (A,B) muestran imágenes de la médula espinal torácica de un ratón hembra C57BL6/J con EAE inducida por MOG p35-55 teñida con LFB/H&E. Se muestra el enfoque utilizado para visualizar cuadrantes y ejemplos de lesiones desmielinizantes (trazadas en línea punteada). El ratón de A tiene 4 de 4 cuadrantes con lesiones desmielinizantes confluentes, mientras que el ratón de B tiene 1 de 4 cuadrantes afectados. El ratón en B tiene algo de inflamación en otros cuadrantes, pero esto no se ha manifestado en una lesión confluente y, por lo tanto, no se puntúa. (C-E) Ejemplo de imagen LFB y la imagen en escala de grises y umbral en imageJ. Haga clic aquí para ver una versión más grande de esta figura.
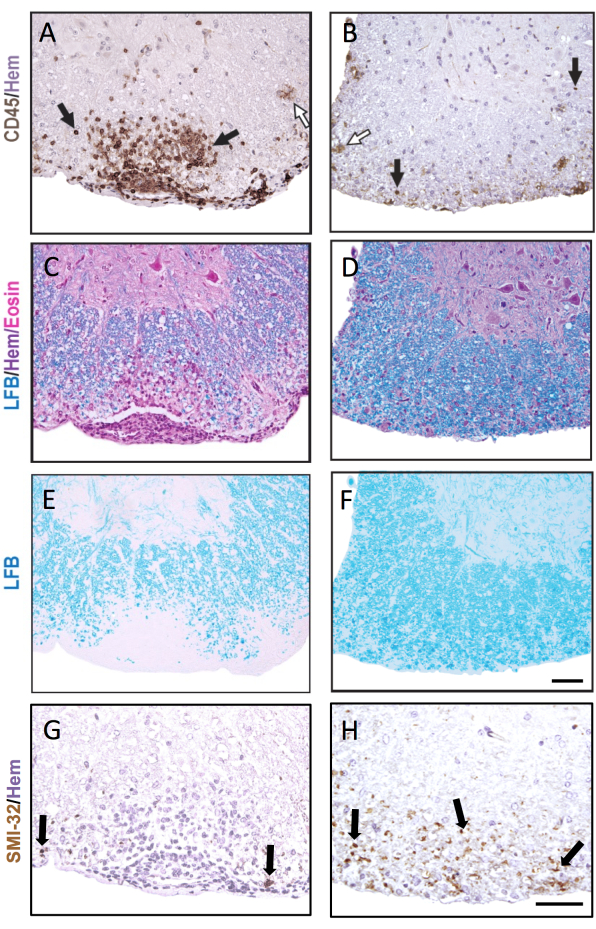
Figura 3: Secciones de la médula espinal teñidas con CD45, LFB H&E, LFB y SMI-32. Ejemplos de una lesión submeníngea temprana (A,C,E,G) y tardía (B,D,F,H) en la médula espinal teñida para anticuerpos CD45 (A,B), LFB/H&E (C,D), LFB solo (E,F) y anticuerpos SMI-32 (G,H). Las flechas negras muestran ejemplos de células teñidas con cada anticuerpo respectivo. Las flechas blancas muestran microglía putativa que ha sido teñida como CD45+. Barra de escala = 50 μm. Esta figura muestra una tinción representativa de lesiones en la médula espinal de un ratón hembra C57BL6/J durante la EAE y pone de manifiesto cómo la patología puede ser diferente en diferentes secciones de la médula espinal. Haga clic aquí para ver una versión más grande de esta figura.
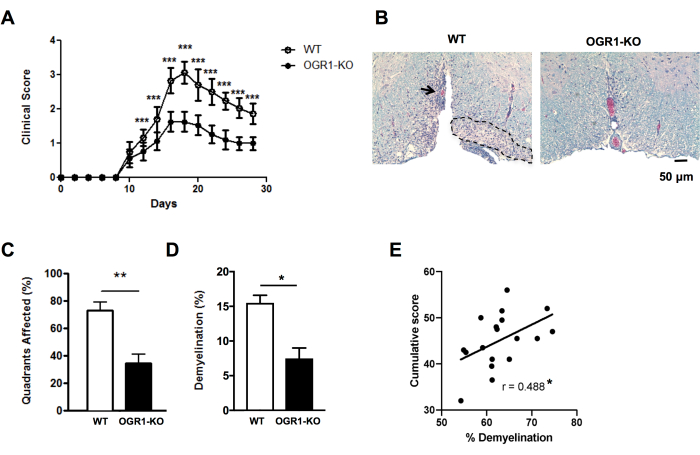
Figura 4: Aplicación de la puntuación para lesiones y porcentaje de desmielinización en EAE. Se muestra un ejemplo de un experimento EAE en el que ratones hembra deficientes en el gen del receptor 1 acoplado a la proteína G (OGR1) del cáncer de ovario en el fondo C57BL6/J desarrollaron EAE clínico menos grave que los ratones hembra C57BL6/J de tipo salvaje (WT). La EAE fue inducida por inmunización con MOG p35-55/CFA más PTX y los ratones fueron puntuados según la siguiente escala clínica: 1 = parálisis de cola. 2 = debilidad de las extremidades posteriores y de los pies, 3 = parálisis de las extremidades posteriores, 4 = debilidad de las extremidades anteriores, 5 = moribundo. (A) Media + puntuaciones clínicas SEM de ratones a lo largo del tiempo. (B) Se muestra un ejemplo de tinción de LFB/H&E en la médula espinal ventral. Barra de escala = 50 μm. (C) Media + porcentaje de cuadrantes SEM que contenían lesiones desmielinizantes. (D) Media + porcentaje de desmielinización SEM en cada grupo. (E) muestra el resultado de otro experimento en EAE inducida por MOG p35-55 en ratones C57BL6/J donde las puntuaciones EAE de ratones individuales se sumaron durante los 30 días de observación y se correlacionaron con el porcentaje de desmielinización en la médula espinal. Las correlaciones se realizaron mediante una prueba de Spearman. Los paneles de (A-D) son una adaptación de Souza C et al.29. Los datos indicados en (E) son datos originales. *P<0.05, **P<0.01, ***P<0.001. Haga clic aquí para ver una versión más grande de esta figura.
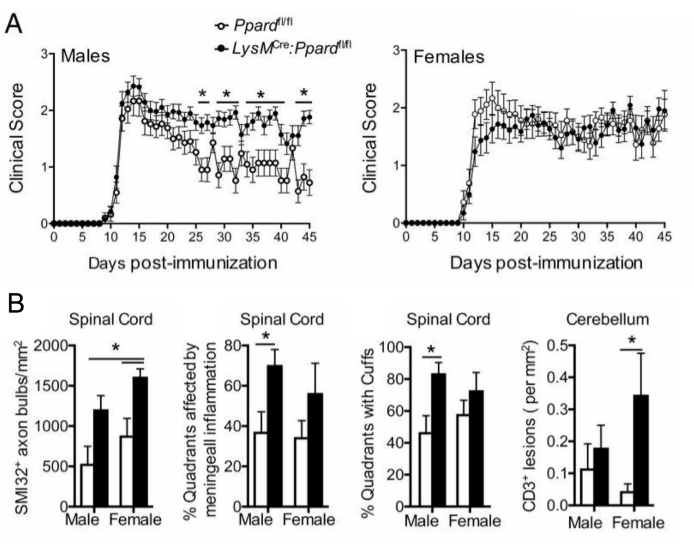
Figura 5: Aplicación de la tinción SMI-32 para comprender el efecto de un genotipo en el fenotipo clínico de EAE. Esta figura muestra un ejemplo de un experimento EAE en el que ratones machos y hembras de tipo salvaje (portadores del alelo floxed de Ppard) y ratones mutantes de Ppard específicos mieloides (LysMCre: Ppardfl/fl) en el fondo C57BL6/J fueron inmunizados con MOG p35-55/CFA y PTX y fueron seguidos durante 45 días. (A) muestra la media + puntuaciones clínicas SEM de ratones. (B) muestra los resultados medios + SEM de la puntuación histológica del número de axones SMI-32+ en la médula espinal, % de cuadrantes con lesiones submeníngeas, porcentaje de cuadrantes con manguitos perivasculares y #CD3 lesiones en el cerebelo por tejido mm2 . Este experimento mostró un efecto genotípico en la tinción de SMI-32. Esta figura es una adaptación de Drohomyrecky. et al.15. Haga clic aquí para ver una versión más grande de esta figura.
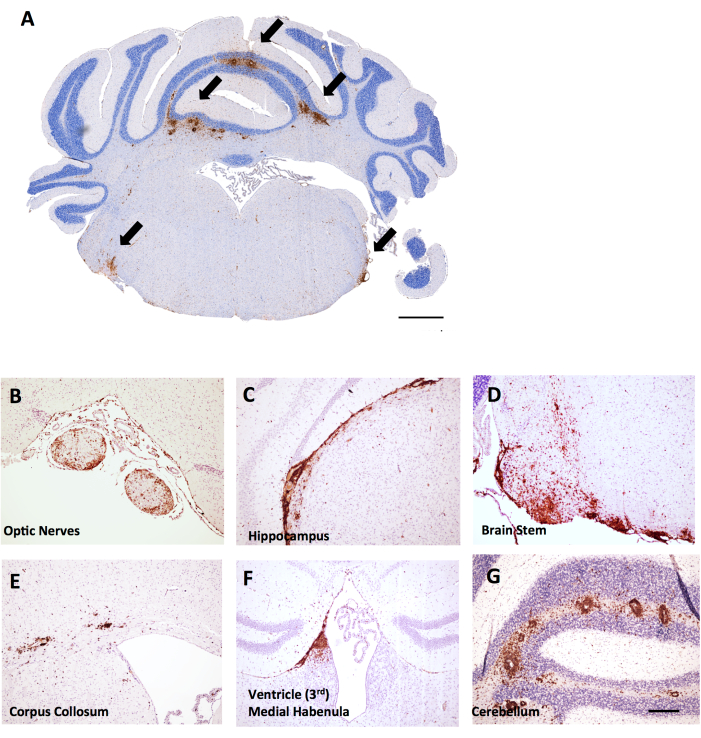
Figura 6: Ejemplos de tinción de CD45+/hematoxilina en secciones coronales cerebrales en EAE inducida por MOG p35-55 en ratones hembra C57BL6/J. Las lesiones CD45+ se muestran en color marrón. (A) Lesiones CD45+ en el tronco encefálico de cortes coronales. Barra de escala = 150 μm. (B-G) Ejemplos de lesiones CD45+ en los nervios ópticos (B), extensiones meníngeas debajo del hipocampo (C), el tronco encefálico (D), el cuerpo coloso (E), la habénula medial cerca del ventrículo (F) y el cerebelo (G). Barra de escala: (B–G) = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
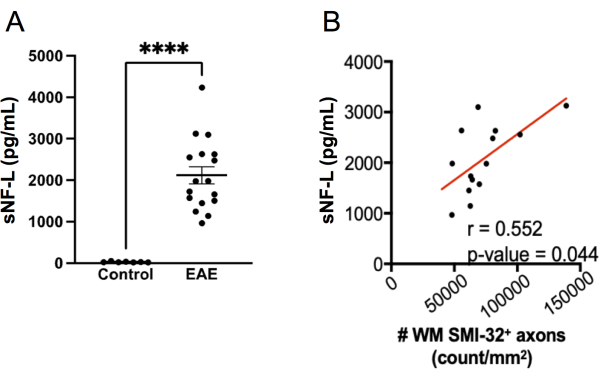
Figura 7: Niveles de sNF-L en suero en EAE inducida por MOG p35-55. (A) Niveles séricos de NFL recogidos de ratones hembra control y EAE en el punto final de un experimento. Los datos se analizaron mediante una prueba de Mann Whitney de dos colas. (****p valor < 0,0001). (B) Las secciones de la médula espinal se extrajeron en el punto final y se tiñeron con SMI-32. Se determinó el número de células positivas por área de tejido de sustancia blanca y se correlacionó con NF-L sérico en el punto final mediante una prueba de Spearman. Haga clic aquí para ver una versión más grande de esta figura.
Tabla suplementaria 1: Descripción de los baños utilizados en el procesamiento de tejidos. Los casetes se mueven automáticamente a través de esta serie de baños utilizando un procesador automatizado. Haga clic aquí para descargar este archivo.
Tabla complementaria 2: Pasos en la tinción con azul rápido de Luxol y hematoxilina y eosina. Esta tabla describe el orden de los pasos en el protocolo de tinción de Luxol Fast Blue y Hematoxilina y Eosina. Haga clic aquí para descargar este archivo.
Tabla suplementaria 3: Anticuerpos utilizados para la tinción inmunohistoquímica. Se describen los anticuerpos que se utilizan en este protocolo, así como los que se pueden utilizar para explorar más a fondo la inflamación, la microgliosis y la astrogliosis. Haga clic aquí para descargar este archivo.
Tabla complementaria 4: Cómo convertir archivos .czi a TIFF. Tenga en cuenta que es óptimo utilizar una imagen de alta resolución, pero las imágenes de resolución media se pueden guardar en su lugar si la memoria de trabajo de la computadora es limitada. Es imperativo utilizar imágenes de la misma resolución en todos los análisis. Además, tenga en cuenta que la última imagen de la serie es la etiqueta de la diapositiva. Evite leer la etiqueta para asegurarse de que el análisis esté ciego. 30,31 Haga clic aquí para descargar este archivo.
Discusión
La tinción histológica de la médula espinal es una herramienta importante para evaluar la gravedad de la enfermedad EAE, especialmente en los casos en los que existen diferencias entre los grupos de tratamiento en el grado de recuperación de la enfermedad en la fase postaguda de la enfermedad. La tinción para la infiltración de células inmunitarias (CD45), la mielina (LFB) y la lesión axonal (SMI-32) ayuda a caracterizar la causa subyacente de las puntuaciones clínicas alteradas en ratones. El protocolo de tinción histológica descrito aquí proporciona una perspectiva de la inflamación, así como de la extensión de la mielina y la lesión axonal. Además, los resultados mostrados validan la medición de sNF-L como método para evaluar la extensión del daño neuronal global en EAE.
Los parámetros críticos para este análisis son garantizar que los investigadores no conozcan la identidad de las secciones y que haya un muestreo equivalente en cada nivel de la médula espinal en los diferentes ratones. Esto se debe a que la gravedad de la inflamación puede ser mayor en los niveles más bajos del cordón. Otro parámetro crítico es el tamaño de los grupos experimentales. Por lo general, la médula espinal y el cerebro se extraen de 6 a 8 ratones por grupo en el punto final para ver diferencias significativas entre los grupos con tratamientos o genotipos que tienen tamaños de efecto modestos. También es importante asegurarse de que los ratones seleccionados, cuando se promedian, tengan puntuaciones medias representativas de todo el grupo. Con respecto a la resolución de problemas, un problema común que encuentran aquellos que no tienen experiencia con el protocolo es que la médula espinal se fija durante un período de tiempo insuficiente y no se extruye fácilmente de la columna vertebral. Si este es el caso, la médula espinal se puede diseccionar manualmente de la columna recortando a lo largo de las apófisis espinosas con unas tijeras finas y abriendo la columna para revelar la médula espinal. Alternativamente, los tejidos se pueden fijar durante unos días más sin interferir con el éxito de la tinción de anticuerpos. Los clones de anticuerpos que aquí se describen actúan en tejido fijado hasta 2 semanas en formol.
La incrustación de las piezas de la médula espinal requiere habilidad y práctica. Se recomienda que se usen lupas para los ojos y que se dirija una lámpara sobre la estación de inclusión para visualizar mejor si las secciones caen en sección transversal o en sección longitudinal. Mantener las longitudes de las piezas de la médula espinal a menos de 2 mm durante la macrofosa ayudará a que caigan en sección transversal. Otro problema común que se encuentra para los usuarios menos experimentados es que el LFB se evapora durante la incubación durante la noche, dejando la mitad del portaobjetos teñido y la otra mitad sin teñir. Para evitar la evaporación, la placa de tinción de vidrio debe sellarse con una película termoplástica y luego con una envoltura de plástico. Si se produce evaporación y las secciones se tiñen de manera desigual, se recomienda desazular completamente los portaobjetos con carbonato de litio y volver a teñirlos en LFB durante la noche. Otro problema común es que los usuarios no eliminan completamente la materia gris después de LFB. Es fundamental examinar secciones individuales bajo el microscopio para asegurarse de que se ha alcanzado una cantidad suficiente de deazulado antes de continuar con otros pasos del protocolo. Además, aunque las tinciones IHC CD45 y SMI-32 tienen un rendimiento sólido, sigue siendo importante solucionar problemas de concentraciones de anticuerpos en experimentos preliminares para cada nuevo lote de anticuerpos recibido. Esto se puede hacer mediante la prueba de una variedad de concentraciones del anticuerpo en una sección de control positivo (EAE médula espinal). La tinción por primera vez también debe incluir un control negativo que consista en un anticuerpo secundario solo sin la adición de anticuerpos primarios. Por último, es fundamental en el análisis de imágenes establecer umbrales de imágenes individuales, ya que la tinción puede ser desigual entre diapositivas o secciones.
Este protocolo utiliza software de libre acceso. Si uno no tiene acceso a un procesador, un embebridor o un micrótomo, estos pasos pueden obtenerse en un núcleo de patología hospitalario que ofrezca estos servicios. Además, si no se tiene acceso a un escáner de diapositivas, se puede utilizar un microscopio óptico equipado con una cámara de vídeo para guardar imágenes TIFF de la médula espinal o de las regiones cerebrales. Para un flujo de trabajo basado en microscopio, capture secciones de LFB o LFB/H&E a baja potencia (aumento de 40x) y para tinción de CD45 y SMI-32, obtenga imágenes de al menos cuatro ventanas centradas en las partes ventral, dorsal y lateral de la médula espinal (aumento de 200x para CD45 y aumento de 400x para SMI-32). Se puede realizar un análisis de imágenes en estas imágenes para cuantificar la tinción de una manera similar a la descrita.
La decisión de qué abordaje histológico adoptar para puntuar la EAE depende de cuánto difieren las puntuaciones clínicas entre los grupos. Por ejemplo, si hay diferencias drásticas en la puntuación clínica de EAE (un grupo recibió EAE y otro no), esto generalmente se relaciona con diferencias en la inflamación mediada por periférica. En este caso, la puntuación de la presencia de lesiones desmielinizantes en los cortes teñidos con LFB/H&E es suficiente y revelará diferencias entre los grupos. Si los grupos son más similares en la puntuación clínica al inicio y, en cambio, hay diferencias en el grado de recuperación clínica (por ejemplo, el experimento de la Figura 5A), es mejor aplicar el flujo de trabajo histológico completo que se describe aquí, incluida la puntuación de la inflamación cerebral en el tronco encefálico y el cerebelo, para distinguir si las diferencias en la cronicidad de la enfermedad se relacionan con diferencias en la inflamación o el daño tisular. Si se encuentran diferencias en la inflamación evaluadas por el recuento de CD45, se pueden realizar más estudios de IHQ para teñir las células T (anti-CD3), los monocitos/macrófagos infiltrantes (Mac3) y la microglía (Iba-1/TMEM119) (los clones de anticuerpos recomendados se encuentran en la Tabla Suplementaria 3). La activación de la microglía se refleja en un aumento en la intensidad de la tinción de Iba-1 en la microglía de doble marcado Iba-1+TMEM-19+ y un aumento de la retracción de los procesos de microglía que se pueden evaluar mediante el análisis de Sholl en las secciones32. Además, se pueden aplicar técnicas como la citometría de flujo o la secuenciación de ARN unicelular para realizar una caracterización más profunda de la frecuencia y el fenotipo de las poblaciones inmunitarias en el cerebro y la médula espinal.
El recuento de axones SMI-32+ es un método sensible para detectar lesiones axónicas en EAE32,33 y en MS34. SMI-32, que detecta la forma no fosforilada de neurofilamento pesado o medio que se acumula en los bulbos finales de las neuronas seccionadas. Una alternativa para detectar axones lesionados es la tinción con proteína precursora amiloide (APP) que puede acumularse en los axones como resultado de la interrupción del transporte de axones33. El patrón de tinción para SMI-32 y APP, aunque ambos reflejan una lesión axonal, no suelen superponerse, lo que indica que están detectando diferentes patologías33. También se pueden complementar las medidas histológicas de la lesión axonal midiendo el sNF-L, que es una medida rápida y sensible de la lesión axonal en curso tanto en la médula espinal como en el cerebro. Ofrece la ventaja de que se puede hacer en medio día en ratones vivos. Un inconveniente de este método es que los kits son caros y la máquina está muy especializada. La empresa que vende el kit sNF-L ofrece una tarifa por servicio para aquellos que no tienen acceso a una máquina SIMOA. Una alternativa a la evaluación de la lesión axonal es puntuar la pérdida de axones contando los axones en las secciones de la médula espinal teñidas con azul de toluidina12 o contando los haces de neurofilamentos detectados por SMI-31 en áreas de la sustancia blanca de la médula espinal32. Ambos son enfoques más laboriosos que la medición SMI-32 o sNF-L.
Si las puntuaciones clínicas de EAE difieren entre los grupos, pero las puntuaciones de inflamación, desmielinización y lesión axonal no revelan diferencias entre los grupos, puede ser útil teñir la activación de los astrocitos mediante GFAP (ver Tabla suplementaria 3 para el clon de anticuerpos recomendado). La activación de los astrocitos se asocia con un aumento de la tinción de GFAP y se ha demostrado que esto se correlaciona con la progresión de la EAE en algunos modelos de EAE, incluida la EAE crónica en la rata DA35.
En conclusión, este protocolo describe métodos y proporciona un flujo de trabajo de análisis para realizar la puntuación histológica de EAE.
Divulgaciones
Shannon Dunn es consultora de FSD Lucid Psycheceuticals.
Agradecimientos
Agradecemos al Dr. Raymond Sobel (Universidad de Stanford) por mostrarnos su método de macroscopía y fijación de secciones cerebrales y de médula espinal. Agradecemos a Kyle Roberton y Milan Ganguly, del Centro de Fenogenómica de Toronto, por aprender el método de inclusión y por cortar muchas de nuestras secciones cerebrales y de la médula espinal. Agradecemos al Dr. Matthew Cussick y al Dr. Robert Fujinami (Universidad de Utah) por compartir sus protocolos para calificar la inflamación submeníngea y perivascular en la médula espinal. Agradecemos a Shalina Ousman por compartir el clon del anticuerpo CD45. Agradecemos a Xiofang Lu por la capacitación en el procesador de tejidos y la estación de inclusión de tejidos y por el mantenimiento de este equipo en el Centro de Investigación Keenan de Investigación Biomédica en el Hospital St. Michael. Este trabajo fue apoyado por una beca biomédica de MS Canadá (a SED). Carmen Ucciferri cuenta con el apoyo de una beca del Gobierno de Canadá. Nuria Álvarez-Sánchez cuenta con el apoyo de una beca postdoctoral Keenan.
Materiales
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
Referencias
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados