Method Article
对实验性自身免疫性脑脊髓炎中的中枢神经系统炎症、脱髓鞘和轴突损伤进行评分
摘要
实验性自身免疫性脑脊髓炎 (EAE) 是多发性硬化症的动物模型。本文介绍了一种对 EAE 中脊髓炎症、脱髓鞘和轴突损伤进行评分的方法。此外,还提出了一种量化小鼠血清中可溶性神经丝光水平的方法,有助于评估活小鼠的轴突损伤。
摘要
实验性自身免疫性脑脊髓炎 (EAE) 是一种常见的基于免疫的多发性硬化症 (MS) 模型。这种疾病可以通过对髓鞘和完全弗氏佐剂 (CFA) 的蛋白质成分进行主动免疫,或者通过将髓鞘特异性 T 效应细胞从用髓鞘蛋白/CFA 引发的啮齿动物转移到幼稚啮齿动物中来诱导这种疾病。EAE 的严重程度通常以 5 分临床量表进行评分,该量表衡量上行性麻痹的程度,但该量表对于评估 EAE 的恢复程度并不是最佳选择。例如,尽管炎症消退,但某些 EAE 模型(例如,髓鞘少突胶质细胞糖蛋白 [MOG] 肽诱导的 EAE 模型)的临床评分仍然很高。因此,用 EAE 的组织学评分来补充临床评分很重要,这也为研究中枢神经系统 (CNS) 细胞损伤的潜在机制提供了一种手段。
在这里,提出了一个简单的方案,用于制备和染色小鼠的脊髓和脑切片,并对脊髓中的炎症、脱髓鞘和轴突损伤进行评分。脊髓中白细胞浸润的评分方法也可用于对 EAE 中的脑部炎症进行评分。还描述了使用小分子测定法(SIMOA)测定法测量小鼠血清中可溶性神经丝光(sNF-L)的方案,该方案提供了关于活小鼠整体CNS损伤程度的反馈。
引言
实验性自身免疫性脑脊髓炎 (EAE) 是人类脱髓鞘疾病多发性硬化症 (MS)1 最常见的小鼠模型。在 EAE5、6、7、8、9 中也观察到经典的 MS 炎症病理学,包括 IFN-γ (γ) 和产生 IL-17 的 T 辅助细胞2 的浸润、炎性单核细胞3 的浸润、血管周围和脑膜下炎性脱髓鞘病变4 的形成以及中枢神经系统 (CNS) 中轴突损伤4 的发生.EAE 和 MS 之间免疫机制的相似性使 EAE 成为测试许多已批准的 MS 免疫疗法的疗效和作用机制的合适临床前模型,包括那他珠单抗、芬戈莫德、富马酸二甲酯和醋酸格拉默(1,5 中已综述)。某些 EAE 方案模拟了轴突损伤以外的进行性 MS 病理学的其他方面,包括脑部下炎症、慢性脱髓鞘、脊髓萎缩、突触和神经元丢失的发展 6,10,11,12。因此,EAE 可用于筛选 MS 神经保护疗法的疗效。
EAE在啮齿动物中以多种方式诱导。主动免疫是最常见的诱导方法,涉及使用髓鞘抗原(全蛋白或肽)对啮齿动物进行免疫,髓鞘抗原(全蛋白或肽)在补充有热杀灭的结核分枝杆菌13 的 CFA 中乳化。根据小鼠品系的不同,百日咳毒素(PTX)也应在免疫接种的第0天和第2天施用,以增加疾病13的外显率。EAE也可以通过过继地将从髓鞘/CFA引发的小鼠中获得的髓鞘特异性T细胞转移到健康小鼠中来诱导14,或者可以在过表达对主要髓鞘抗原特异性的T细胞受体的小鼠中自发发育5。
EAE 疾病的严重程度和进展通常使用离散的 5 分临床量表进行评分:1 – 尾部跛行,2 – 后肢或足部无力,3 – 单侧或双侧后肢完全瘫痪,4 – 前肢无力,5 – 垂死或死亡13.该临床评分系统在记录疾病发作时发生的上行性麻痹的进展方面是合理的,但在捕捉中枢神经系统炎症发作的恢复程度方面不太敏感。例如,行走困难的小鼠和容易行走但表现出抓足无力的小鼠在 EAE 量表上得分为 2。在EAE的急性期后,由于存在永久性轴突损伤或损失,即使炎症反应消退,评分仍可能保持高水平9。已经进行了各种尝试来开发更精细的评分系统、行为测试、后肢和握力测量以及红外监测系统,以更好地捕捉 EAE9、16、17、18 中临床缺陷的差异;然而,这些更复杂的评分措施并不能区分炎症与组织损伤对潜在神经功能缺损的贡献。因此,对 EAE 严重程度进行评分的金标准方法是进行临床和组织学评分。
在这里,描述了如何解剖小鼠脊髓和脑标本并将其嵌入石蜡中的协议,以捕获EAE中发生的病变形成的随机过程。还介绍了如何用 Luxol 固蓝 (LFB) 对切片进行染色的方案,该方案最初由 Kluver 和 Barrera19 创建,可检测中枢神经系统中的髓鞘。切片要么单独用 LFB 染色(用于脱髓鞘分析),要么用苏木精和伊红 (H&E) 复染,以帮助观察和评分炎症性病变。还提供了方案,以使用市售抗体、免疫组织化学 (IHC) 技术和可公开访问的软件来量化脊髓中总白细胞 (CD45) 的存在、髓鞘的丢失和受损轴突 (SMI-32) 的数量。用于量化脊髓中白细胞的方案也可用于量化大脑中的白细胞。
大脑中轴突丢失和损伤的组织学评估比脊髓中相对困难,因为脑白质束彼此不平行运行。血清神经丝光 (sNF-L) 的测量已成为 MS20,21 中神经元损伤的有前途的生物标志物。最近的研究已将该技术扩展到 EAE22、23、24。在这里,提出了一种使用小分子测定法(SIMOA)测定法测量活小鼠血清神经丝光(sNF-L)的方法。这种方法只需要少量的血清,并且可以在半天内在活小鼠中完成,从而提供有关测试疗法如何影响整体中枢神经系统损伤的快速反馈。这里描述的所有方法都可以应用于任何性别或品系的小鼠。
研究方案
所有用小鼠进行的实验都是根据Unity Health Toronto动物护理委员会批准的动物使用协议进行的,遵循加拿大动物护理委员会制定的指南。确保在整个实验室程序中穿实验室外套、防护手套和眼镜。
1.采集和固定大脑和脊髓
- 根据机构政策对小鼠实施安乐死。将小鼠俯卧在解剖台上,并使用手术剪刀(向下切割)斩首。
- 使用Adson镊子(在非惯用手中),抓住鼠标头顶的皮肤。然后用手术剪刀在头顶的皮肤上做一个2.5厘米的切口。
- 用手指将头部的皮肤横向推动,以可视化下面的颅骨。
- 通过使用标准 Adson 镊子抓住眼窝来稳定鼠标的头部。
- 使用细剪刀(惯用手),沿着从颈椎到嗅球的中线在颅骨上剪小剪。
注意:一次只在颅骨下方嵌入几毫米的剪刀尖,以避免损坏下面的大脑。 - 使用带有牙齿的 Adson 镊子横向反射颅骨,以露出下面的大脑。
- 用非惯用手握住头部。握住剪刀(惯用手),将脊髓从颈椎中挖出,轻轻地将大脑从颅骨中推出,剪断颅神经。
- 将大脑放入含有 10 mL 10% 中性缓冲福尔马林的锥形管中,该管上标有动物的 ID。
- 沿着老鼠躯干的中线从脖子到尾巴切开皮毛。
- 用手指横向推动皮肤以可视化脊柱。
- 使用手术剪刀,在股骨与髋部连接的水平处向下切开脊柱。
- 使用手术剪刀从臀部到颈部切割脊柱两侧的体壁。修剪掉任何附着的器官。
- 将含有脊髓的脊柱放在含有大脑的福尔马林管中。让大脑和脊柱固定 5-7 天。
注意:固定的时机很重要。如果组织过度固定,某些抗体将不起作用。如果组织固定不足,则很难在步骤 2 中将脊髓从脊柱中挤出。
2. 脊髓和大脑的粗加工和处理
注意: 以下步骤在通风橱中进行。在开始之前,准备 2 x 10 厘米干净的培养皿、一个装有衬有滤纸的漏斗的锥形瓶、两把手术刀(一把用于切割骨头,一把用于切割中枢神经系统组织)、镜头纸、一支铅笔、嵌入盒和预装有 10% 福尔马林的标本罐。
- 用剪刀剪下一小块镜头纸(宽度相同,但长度是暗盒的两倍),然后将其放入一个培养皿中。
- 用铅笔在塑料盒上贴上标本 ID 的标签。
- 将装有固定大脑和脊柱的管子倒入漏斗中。将脊柱和大脑转移到空的培养皿中。
注意:用过的福尔马林将过滤到锥形瓶中,可以在步骤 2.13 中重复使用。 - 用手术刀将大脑粗略地分成六个冠状体。在小脑尾部切一个,在小脑中间做一个切口,一个小脑在喙部切一个,在剩余的喙脑上切两个,形成 3 个厚度相等的额外冠状切片。
- 使用镊子,将脑标本转移到培养皿中透镜纸的一半上。
- 用手术刀将脊髓切成三块:第一个切口在肋骨底部,第二个切口在颈椎曲率下方。
- 使用相同的手术刀,修剪尾端的骶棘片,直到脊髓可见。
- 捡起胸椎(非惯用手)。握住 Adson 镊子,牙齿紧闭(惯用手),然后用轻柔的扭转动作轻轻地将镊子的末端推入脊柱的较小开口。脐带应从另一端伸出。
注意:任何脊髓大小的圆头器械都可以用于此目的。如果脊髓没有自然弹出,不要强迫它。取而代之的是,用细剪刀沿着脊柱侧面夹住骨头,并将其反射开来,露出脊髓。或者,在福尔马林中将脊髓和大脑固定几天;但是,应将相同的固定时间应用于所有标本,以避免在抗体染色中引入变异性。 - 拿起标准的Adson镊子(惯用手)。仍然用不太占优势的手握住脊髓片,用镊子轻轻地将出现的脊髓从柱子中拉出。将脊髓片放入装有镜片纸的培养皿中。
- 对腰/骶和颈柱重复此过程。
- 使用手术刀将三个脊髓片(颈椎、胸椎、腰椎/骶骨)分成较小的横截面片。切至少 15 段,每段厚度应小于 2 毫米。
注意:确保线段短于宽度,这将使截面在步骤 3 的嵌入过程中更容易落在横截面上。 - 将脊髓片排列在含有脑片的镜片纸的同一半部分。将镜头纸折叠起来,将纸巾夹在中间,然后将其放入贴有标签的暗盒中。
注意: 镜头纸可防止小块纸在加工过程中从盒中逸出。 - 将盒转移到装有回收或新鲜福尔马林的标本罐中。
- 对剩余的标本重复步骤2.1-2.13。
- 固定5-7天后,将样品盒从标本容器转移到自动组织处理器中的第一个福尔马林浴中(见 材料表)。根据 补充表1中描述的程序运行组织处理器过夜。将标本保持在温热的石蜡中直至嵌入。
3. 嵌入和切割脑和脊髓切片
- 将盒从处理器转移到石蜡包埋站的温室(参见 材料表)。
- 将每只小鼠的脊髓和脑横截面嵌入单个石蜡块中,如下所示(图1):
- 首先,倒入石蜡以覆盖模具底部。使用细镊子,将脑冠状动脉和脊髓横截面片放入模具底部的石蜡中。
- 将模具转移到冷却表面几秒钟,以将大脑和脊髓部件固定到位。将模具移回加热表面,并用热石蜡填充到顶部。
- 将盒盖(标有样品 ID)放在模具顶部。将更多的石蜡倒在盒盖上。将模具转移到冷却站,让蜡凝固(冷却 30-60 分钟)。
注意:嵌入脊髓切片需要练习。为了提高成功率,请使用较短的脊髓长度(<2 毫米),因为这些脊髓更有可能落在横截面上。可以佩戴外科放大镜以帮助区分脊髓碎片是否横截面。 - 将石蜡块安装在旋转切片机上。修剪块,直到感兴趣的组织出现在石蜡切片中。
- 切下每个块的5μM条带,并将它们转移到42°C水浴中。
- 收集载玻片上的部分,并将载玻片放在载玻片架中。
- 在37°C的干燥烤箱中烘烤切片过夜。在进行染色之前冷却载玻片。
4. 切片的脱蜡和复水,准备染色
注意: 步骤在通风橱中执行。在开始之前,准备溶剂浴。制备5L的1x PBS(1L ddH 2O,8g NaCl,0.2gKCl,1.44gNa2HPO4,0.24g KH2PO4;pH = 7.4)与0.05%吐温-20(PBS-T)用于所有洗涤步骤。
- 通过将载玻片置于振荡器上连续两个二甲苯或非二甲苯基溶剂浴中5分钟,并轻轻搅拌,进行脱蜡。
- 通过将载玻片转移通过连续的乙醇百分比下降的浴液来补充组织水分:2×100%乙醇(每个5分钟),2×95%乙醇(每个3分钟)和1×70%乙醇(3分钟)。保持在 95% 乙醇中用于 LFB 染色,并重新水化至 70% 乙醇,并保持在 PBS-T 中用于免疫组织化学 (IHC)。
5. 髓鞘与 H&E 的 LFB
- 制备0.1%LFB(0.2g LFB,参见 材料表,200mL 95%乙醇,0.5mL冰醋酸)的溶液。混合并过滤到锥形瓶中。 存放在深色瓶子中直至使用。
- 将切片从95%乙醇转移到玻璃载玻片架中,该载玻片架放置在含有LFB的染色皿中。盖上盘子并用石蜡膜密封以防止蒸发。
- 将切片在56°C烘箱中孵育过夜(最多16小时)。
- 第二天早上,将载玻片转移到ddH2O浴中并保持。
- 同时,配制(1)新鲜的0.05%碳酸锂溶液(0.05g碳酸锂,100mL ddH2O);(2)曙红Y溶液(在40mL ddH20中加入2g曙红盐,混合至溶解,然后与160mL 95%乙醇混合)。
- 准备以下浴液:1 x 碳酸锂,3 x 70%乙醇,3 x 95%乙醇,2 x 100%乙醇,3 x ddH20。按使用顺序放置浴槽(见 附表2)。
- 按照 补充表 2 中概述的步骤操作。
- 载玻片干燥后,在显微镜下观察脱髓鞘病变。
6. 无 H&E 的髓鞘 LFB
- 执行此染色程序以分析髓鞘。
注意:该过程与步骤 5 相同(参见 补充表 2),但工作流程有所简化。在步骤 4 之后,继续从步骤 10 开始的过程。
7. 免疫组织化学 (IHC) 染色的抗原修复和过氧化物酶淬灭
注意:在开始之前,在通风橱中制备 100 mL 过氧化氢的甲醇溶液(1 份 30% 过氧化氢溶液在 9 份 100% 甲醇中)。用吐温-20(2.94g柠檬酸三钠,溶解在搅拌板上的烧杯中的1L ddH20中,使pH至6.0,并加入500μl吐温-20)制备1L 10mM柠檬酸盐缓冲液。准备 PBS-T(参见步骤 4)。除非另有说明,否则所有洗涤均在PBS-T浴中轻轻搅拌(在振荡器上)进行。
- 通过将载玻片置于甲醇中的3%过氧化氢中15分钟(在通风橱中)来淬灭内源性过氧化物酶。在PBS-T中洗涤载玻片两次(每次2分钟)。
- 将载玻片转移到金属载玻片支架上,并放入高压锅中的1L柠檬酸盐缓冲液中。密封盖子并在蒸汽排放口顶部添加橡胶塞。
- 在微波炉中高温烹饪,直到压力锅上的黄色标签弹出,表示已达到最大压力。在最大压力下再煮 5 分钟,然后戴上防护手套从微波炉中取出压力锅。
- 通过取下塞子来减压。 取下盖子,让载玻片在柠檬酸盐缓冲液中冷却20分钟,然后继续进行所需的染色方法。
注意: 释放蒸汽时向后站,因为它会导致烫伤。
8. CD45免疫组化
注意:这种 IHC 方法用于可视化浸润的白细胞。亲和素/生物素封闭步骤与封闭和一抗孵育步骤相结合。
- 准备封闭缓冲液(2%BSA,2%兔血清,溶于1x PBS)。
- 将载玻片转移到载玻片托盘上,并用PBS-T洗涤两次(每次2分钟)。制备亲和素/封闭溶液(4滴/mL亲和素在2%BSA / 2%兔血清中,溶于1 x PBS中,参见 材料表)。
- 使用实验室纸巾擦干组织周围多余的PBS-T。使用疏水笔,在组织周围画一个圆圈,然后将载玻片放入潮湿的室内。
- 将亲和素/封闭溶液涂抹在每个切片上(400μL/载玻片)。
- 盖上湿润的腔室,在室温下孵育30分钟。 在此步骤中,在含有生物素(4滴/ mL生物素,2%BSA / 2%兔血清的1x PBS溶液)的封闭缓冲液中制备抗CD45抗体(补充表3)。
- 将阻塞溶液从滑块上滑到无绒实验室擦拭布上。使用实验室湿巾轻拍组织以去除多余的液体。
- 将载玻片放回潮湿的腔室中。在切片上加入 400 μL CD45 抗体溶液(参见 材料表)。在有盖的潮湿室中以4°C孵育过夜。
- 第二天,排出一抗并在PBS-T中洗涤载玻片3次(每次5分钟)。
- 使用无绒实验室干燥切片周围的区域,然后在每个切片上加入 400 μL 二抗(在封闭缓冲液中以 1:200 稀释度)。在室温下孵育1小时。
- 同时,通过将 2 滴试剂 A 加入 5 mL 1x PBS 中并混合来制备 ABC 试剂(参见 材料表)。将 2 滴试剂 B 加入同一溶液中并混合(使用前准备 ~30 分钟)。
- 用1x PBS-T(每次5分钟)的3次更换洗涤载玻片,并将载玻片置于潮湿的室内。
- 向切片中加入 400 μL ABC 试剂。盖上湿润的腔室,在室温下孵育30分钟。
- 用1x PBS-T(每次5分钟)洗涤载玻片3次。同时,根据制造商的说明,在铝箔覆盖的 15 mL 离心管中制备适量的 DAB 溶液(见 材料表)。
- 取一张载玻片,在显微镜下聚焦于脊髓切片。向载玻片中加入 400 μL DAB 并启动实验室计时器。
- 在切片发育时可视化切片,并在白细胞呈棕色时停止计时器。将载玻片转移到ddH20浴中以停止反应。在水中保持5分钟。其余幻灯片使用相同的显影时间。
注意:DAB是一种致癌物。将 DAB 废物和 DAB 后的 ddH2O 作为危险废物处理。 - 用Mayer's苏木精复染载玻片~4-10分钟(见 补充表2)。用流动的自来水冲洗载玻片 10 分钟。
- 在95%乙醇中脱水(1×3分钟),然后用无水100%乙醇(每次2×3分钟)。
- 移入通风橱,将载玻片转移到二甲苯或二甲苯替代溶剂中5分钟。盖玻片与安装介质,让载玻片在通风橱中干燥 1-2 天。
注意: 如果使用二甲苯,请在盖子滑落时使用双层手套和镊子处理载玻片,因为它有毒并且会溶解手套。 - 使用二甲苯清洁载玻片,并使用载玻片扫描仪以 20 倍放大倍率进行扫描。
9. SMI-32 IHC治疗轴突损伤
注意:该方案使用小鼠SMI-32抗体,其对非磷酸化的神经丝重度发生反应,该神经丝可以积聚在受伤的轴突25中。由于该抗体已在小鼠中产生并可检测小鼠抗原,因此建议使用小鼠对小鼠 (MOM) 试剂盒。在此过程中,亲和素/生物素阻断步骤作为与一抗孵育分开的步骤进行。 在开始该方案之前,如步骤4和步骤7所述,脱蜡,再水化,淬灭内源性过氧化物酶活性并进行抗原修复。
- 用 2 x PBS-T(每次 2 分钟)洗涤切片两次。使用实验室纸巾去除切片周围多余的液体,并使用疏水笔在组织周围画一个圆圈。
- 向切片中加入 400 μL 封闭缓冲液(2% (w/v) 山羊血清,溶于 1x PBS-T 中)和亲和素(4 滴/mL)。在室温下孵育15分钟。
- 将载玻片浸入 1x PBS-T 中两次。向载玻片中加入 400 μL 含有生物素(4 滴/mL)的封闭缓冲液,并在室温下孵育 15 分钟。
- 在1×PBS-T浴中洗涤载玻片2分钟。同时,通过向 2.5 mL 的 1x PBS 中加入 2 滴储备溶液(参见 材料表)来制备 MOM 封闭试剂。
- 向切片上加入 400 μL MOM 试剂。在室温下孵育1小时。
- 在 1x PBS-T 浴中洗涤载玻片两次 2 分钟。同时,通过将 300 μL 浓缩蛋白储备液加入 3.75 mL 1x PBS 中来制备 MOM 稀释剂。
- 加入 400 μL MOM 稀释剂,并在室温下孵育 5 分钟。同时稀释MOM稀释剂中的SMI-32抗体(见 材料表)。
- 从载玻片中取出稀释剂,并在切片上加入 400 μL SMI-32 抗体溶液。盖上湿润的腔室,在室温下孵育30分钟。
- 在1x PBS-T浴中洗涤载玻片两次2分钟,每次轻轻搅拌。同时,在稀释剂中稀释MOM抗小鼠IgG工作试剂(10μL原液在2.5mL稀释剂中)。
- 每载玻片加入 400 μL 抗小鼠 IgG 工作试剂。孵育 10 分钟。
- 在1x PBS-T浴中洗涤载玻片两次,每次2分钟。按照CD45染色方案中概述的步骤继续染色(步骤8.11 – 8.19)。
10. 脱髓鞘病变的 LFB 和 H&E 评分
注意:以下是一种分析方法,可用于快速了解炎症性脱髓鞘的严重程度。该分析在不同水平(颈椎、胸椎和腰椎,每个水平至少 3 个部分)采样的脊髓部分进行。请参阅 Allen Brain Atlas for Mouse spinal cord26 ,以帮助确定脊髓的解剖水平。此分析需要 TIFF 文件。如果扫描的图像为 .czi 格式,请按照 补充表 4 中的说明将 czi 文件转换为 TIFF 文件。
- 通过将文件拖放到 ImageJ 中,打开要分析的部分的 TIFF 图像。观察 4 个象限的脊髓切片:背侧、左外侧、右外侧和前侧(图 2A、B)。
- 如 图 2 所示,每个象限中是否存在脱髓鞘病变的评分。
注意:病变的存在导致该象限的得分为 1,每个部分总共有 4 个可能的分数。即使象限内有多个病变,也会分配 1 分。 - 将每只小鼠的所有点相加,然后除以采样的象限总数,以获得具有脑膜下病变的象限的比例。
11.计算脊髓白质中LFB染色的面积分数
注意:该分析测量用 LFB 染色的脊髓白质的面积百分比。
- 通过将文件拖放到 ImageJ 中,打开另存为 TIFF 文件的 LFB 染色部分。
- 单击“图像>键入 > 8 位以生成灰度图像。单击图像>调整>阈值。调整底部滑块,使红色覆盖层捕获肉眼看到的所有黑暗区域(髓鞘)(图2C-E)。单击“应用”。
- 单击 Analyze > Tools > ROI Manager 以打开 ROI 管理器。
- 在 ImageJ 工具栏上选择 多边形 绘图工具。这个绘图工具允许人们用电脑鼠标勾勒出脊髓区域。
- 勾勒出脊髓的背侧区域,然后单击键盘上的 t 将多边形添加到 ROI 管理器中。
- 勾勒出脊髓白质的前外侧区域,并将多边形添加到 ROI 管理器中。
注意:追踪时,排除大血管、组织撕裂、伪影和背角附近区域(图 2A、B 箭头),这些区域通常髓鞘较少。跟踪时要尽可能准确,因为包含过多的白色背景会使结果出现偏差。 - 单击 “分析>集测量 ”,然后选择 “面积分数”。
- 单击 ROI 管理器中的“测量 ”。这将给出用 LFB 染色的轮廓区域的比例。
- 从新生成的结果框中,将值复制到 Excel 中,然后关闭图像窗口。计算背侧和腹外侧区域染色的平均百分比分数面积。对这些数字进行平均,以获得该部分的值。
- 对颈椎、胸椎和腰椎切片重复步骤 11.1–11.9(N = 3/水平/小鼠)。
- 计算每只小鼠所有部分的平均髓鞘分数百分比。脱髓鞘百分比是通过从 100 中减去面积染色百分比来估计的。
12. CD45+ 细胞和SMI-32+ 轴突卵形数分析
- 将 CD45 或 SMI-32 染色的 TIFF 图像拖放到 ImageJ 中。单击 “分析>设置比例”>“全局>确定 ”以在所有图像中设置比例尺。请注意,这仅针对第一个图像执行。
- 选择 多边形 绘图工具,并使用计算机鼠标在灰质周围进行描摹。单击 “分析>测量 ”并将结果记录在Excel中为“灰质区域”。
- 在绘制的多边形仍在图像上的情况下,通过单击 Delete 键(键盘)从图像中删除灰质。这个动作只留下白质进行分析。
- 使用 多边形 绘图工具勾勒出整个脊髓切片的轮廓。排除任何缺失或受损的组织区域。
- 单击 “分析>测量 ”,并将结果记录为“总组织面积”,并记录在Excel文件中。
- 单击 “图像>颜色”>“颜色反卷积”。从矢量下拉窗口中,选择 H DAB。将出现三个新窗口 - 保留棕色色调的窗口(DAB 通道)并删除其他图像窗口。
- 单击 图像>调整>阈值。调整底部滑块以阈值化图像,以便红色叠加层捕获与肉眼检测到的相同数量的棕色染色。单击 “应用”。
- 单击 Process > Binary > Watershed。在此步骤中,比较原始图像和二进制图像以确保它们一致。
- 单击 “分析”>“分析粒子”。 选择 “显示叠加 ”并修改设置:尺寸 = 5 - 150 μm2,圆度 = 0.4 – 1。单击 “确定”。
注: 这些设置允许将未使用分水岭函数拆分的单个像元和一小组像元包括在内,而不是在分析中排除。 - 在结果窗口中,记录 Excel 最左边列中的最后一个数字,该数字表示总粒子计数。然后,计算白质面积(总组织面积 - 灰质面积,单位为mm 2)。表示每个白质区域的总颗粒计数(计数/mm2)。
- 对每个保存的 RGB 图像重复步骤。一旦分析了一只小鼠的所有脊髓切片,就平均该小鼠每 mm2 组织的颗粒计数。
注意:用于分析脊髓白细胞的工作流程也可以应用于大脑区域。
13. 使用SIMOA测定法测量sNF-L
- 使用毛细血管微管通过隐静脉出 血或使用 注射器和 25 G 针头通过心脏穿刺(终末手术)从活小鼠收集 100–200 μL 血液。对于后者,将血液转移到 1.5 mL 微量离心管中。
- 让血液在室温下凝结 30-60 分钟。
- 在4°C下以2660× g 离心样品5分钟,并将上部馏分(血清)移液到新的微量离心管中。将血清储存在-80°C直至准备使用。
- 制备:使用前将校准品和对照品(NF-光测定试剂盒,参见 材料表)加热至室温1小时。 将酶底物(RGP)从冰箱中取出,置于30°C水浴中至少30分钟,每10分钟涡旋一次。
- 将血清样品在冰上解冻。解冻后,轻轻涡旋样品并以10000× g 离心5分钟以沉淀任何碎片。
- 加载板:涡旋校准器和控制器。将校准品一式两份,对照品一式两份,血清样品一式两份加载到试剂盒随附的 96 孔板上。血清样品以1:3的比例稀释,稀释剂在试剂盒中提供。 密封板。
- 按照计算机、程序和机器的顺序打开 SIMOA 机器(参见 材料表)。允许计算机初始化并运行 “开始一天的 维护”。
- 涡旋磁珠30秒。
- 屏幕上的“加载试剂”选项卡,双击要放置试剂瓶的架子位置,然后扫描试剂瓶的条形码。
- 将磁珠置于架子上的摇晃位置(位置 1-3)。
- 继续,将检测器、SBG 试剂和 RGP 试剂装入机器中。
- 单击软件上的 设置 。确保样品模式在板上。在“设置运行”选项卡中,为试验命名。
- 在板上为校准品分配孔,如下所示:单击孔,然后选择检测方法。选择 校准 A ,然后单击 升序。突出显示孔 A1-8,然后单击 重复 (2) 以分配要重复运行的校准器的坐标。使用简洁的协议运行。
注意:请参阅分析证书(制造商网站)以获取每个特定批号的每个校准品的浓度。一旦分配了孔,就不可能在不丢失工作的情况下离开此屏幕,直到板锁定到位。 - 按照以下步骤分配示例:
- 在屏幕的右下角,单击 按钮 以分配样本。突出显示样品所在的孔。
- 从列表中勾选要运行的检测,选择重复次数,并指定 4 倍的板载稀释度。
- 在孔仍突出显示的情况下,输入样品 ID 和起始编号的前缀,然后单击 “生成 ”以生成样品的顺序 ID。对照样品重复步骤。
- 将板装入板架(A1 至 A12)。
- 在屏幕界面上,单击 “完成编程示例 ”,然后进入“系统资源”选项卡。检查所有试剂容器是否已满,废物容器是否为空。
- 单击 “运行”。
- 运行完成后,通过选择测定和板名称来检查“数据缩减”选项卡下的校准曲线。
- 转到“运行历史记录”并使用过滤器查找最近的运行。选择 “运行 ”,然后选择 “所有结果”。单击 导出,然后保存.csv文件。单击“报告 ”,然后选择 “批量校准报告 ”,然后选择最近的运行。预览报表并将其导出。
- 运行制造商建议的日终维护。关闭程序、本机,然后关闭计算机。
结果
图 3 显示了具有代表性的 IHC 和组织化学染色,以及急性(左)和较早的 EAE 病变(右)的示例。苏木精复染的代表性CD45染色如图3A,B所示。 图3C-F显示了使用(图3C,D)或不使用(图3E,F)H&E复染剂进行LFB染色的示例。虽然苏木精对免疫细胞不具有特异性,但免疫细胞的细胞核染色得更深,可以与中枢神经系统驻留细胞区分开来。图3G,H显示了用苏木精复染的SMI-32+轴突的代表性染色。请注意,这种染色在较旧的 EAE 病变中出现得更多。
有髓鞘轨道的损伤在活动性小鼠 EAE 的脊髓中最为普遍,这是这种疾病瘫痪的主要驱动因素 7,9。因此,在组织学分析中,对脊髓中是否存在炎症和组织损伤进行评分是优先考虑的。EAE病变零星发生在脊髓的不同区域(前部,外侧或背侧)(图2A,B)和不同水平(骶部,腰部,胸椎,颈部)。所描述的包埋方法可确保对整个脊髓的病变进行良好的采样。嵌入的截面多于分析的截面,因为某些截面可能会在处理或切片过程中损坏。为确保具有代表性的采样,在每只小鼠的脊髓颈椎、胸椎和腰椎水平上至少分析 3 个代表性切片。每个标本的身份都是盲法的,以便进行分析的人在选择具有代表性的切片进行分析时不会有偏见。
为了快速了解 EAE 组织学严重程度的差异,可以对选定切片中脊髓象限中是否存在脑膜下脱髓鞘病变进行评分(图 2A、B)。这是一种快速方法,可以在扫描图像上或使用光学显微镜进行。该分析足够灵敏,可以检测当一组 EAE 严重而另一组轻度时组间组织学 EAE 严重程度的差异。例如,在 图 4 的实验中,使用 MOG p35-55/CFA 加 PTX 在雌性野生型 (WT) 和 OGR1 缺失的小鼠中诱导 EAE。WT组的小鼠出现严重的EAE并伴有完全瘫痪,而OGR1敲除组的小鼠出现轻度疾病。临床评分的这种差异对应于具有脑膜下病变的象限比例的差异(图4C)。
重要的是,使用髓鞘染色的面积百分比分数来补充脱髓鞘病变的评分,以捕捉自身免疫攻击期间髓鞘和/或有髓轴突的丢失程度。在 图4的示例中,OGR1和WT小鼠之间的髓鞘百分比分数也存在显着差异(图4D)。髓鞘分数百分比也与EAE小鼠的累积EAE评分显着相关(图4E),因此可以很好地衡量这种疾病的整体组织损伤。请注意,该方案不区分髓鞘染色的强度。如果这是预期的结果,则应对髓鞘蛋白(如蛋白脂质蛋白或髓鞘碱性蛋白)进行免疫荧光染色,并测量这种染色的强度。
在两个比较组的 EAE 都严重的情况下,更高比例的脊髓象限将包含炎症/脱髓鞘病变。在这种情况下,对炎症进行评分的更灵敏的方法是计算每mm2白质的CD45 +白细胞数量(参见图3A中的代表性染色)。本文描述的 CD45 抗体克隆可检测所有浸润性白细胞,并且仅对偶尔上调 EAE 中 CD45 表达的小胶质细胞进行染色(参见图 3B 中的开放箭头),因此可用于捕获外周免疫细胞浸润。
在长期EAE研究(>20天)中,建议同时进行轴突损伤分析。脊髓切片中的 SMI-32 染色是检测受损轴突的灵敏方法。尽管脊髓中的炎症会随着时间的推移而消退,并且保留的轴突可以重新髓鞘化,但幸存的轴突表现出不同程度的残余损伤9(图3G,H)。例如,在 C57BL6/J 小鼠的 MOG p35-55 诱导的 EAE 模型中,轴突损伤和丢失的程度是炎症过程消退后临床评分的驱动因素9.图 5 显示了雄性和雌性小鼠 WT 小鼠和 MR 的 EAE 实验中的一个例子,这些小鼠缺乏髓系隔室 (LysMCre: Ppardfl/fl) 中称为过氧化物酶体增殖物激活受体-δ (PPAR-delta) 的基因。在雄性小鼠中,WT小鼠恢复了后肢功能,但雄性LysMCre:Ppardfl / fl组的临床评分仍然很高。相比之下,在女性的实验中,两个实验组的得分都很高。乍一看,这一结果表明PPAR-delta在EAE中具有性别特异性效应;然而,脊髓的病理学评分显示,与WT组相比,LysMCre:Ppardfl / fl组中的两性小鼠的轴突损伤增加(图5B)。在雌性小鼠中可能没有观察到基因型对临床评分的影响,因为WT雌性小鼠往往表现出增加的轴突损伤,这表现为慢性神经功能缺损。
在同一实验中,发现雌性 LysMCre:Ppardfl/fl 雌性小鼠在小脑中具有更广泛的 T 细胞浸润,这提供了一个示例,说明脑部炎症评分如何在 EAE 中发挥作用。在EAE中,大脑中的炎症主要存在于小脑和脑干(图6A,D,G),但也可以在脑膜(见于图6C中的海马体下),心室附近(图6F)和其他白质束(图6B,E)。脑部炎症的评分是在特定的大脑区域(例如小脑白质)中完成的,方法是使用与脊髓方案相同的方法计算每 mm2 组织区域的 CD45 细胞数。在这里概述的粗大方法中,切口位于小脑中间,它提供了小脑和脑干的视角,如图 6A 所示。
使用 SIMOA 测定法测量 sNF-L 已成为评估复发缓解型 MS20、21、27、28 中持续轴突损伤和对治疗反应的有用生物标志物。用于测量 sNF-L 人类的相同 SIMOA 检测试剂盒可用于测量小鼠 sNFL22、23、24。为了探索该测定在检测 EAE 轴突损伤方面的表现如何,在 EAE 实验结束时在雌性 C57BL6/J 小鼠中测量了 sNF-L,并将水平与没有 EAE 的性别匹配的健康对照小鼠的水平进行比较。结果发现,具有EAE的小鼠的sNF-L水平比健康小鼠高得多(图7A),并且这些水平与脊髓中SMI-32 + 轴突的密度相关(图7B)。与轴突损伤的组织学评分相比,SIMOA测定速度更快(从出血小鼠到结果只需半天多一点即可获得),因此可以快速反馈治疗在活体小鼠中的作用。该测定法还具有反映脊髓和大脑轴突损伤的优点。

图1:脑和脊髓切片的代表性石蜡块。将 5 个冠状脑切片和脊髓横截面(1.5-2 毫米厚)嵌入同一块中,以便将它们切成一截。应嵌入至少 15 个脊髓切片,以便充分选择切片进行分析。 请点击这里查看此图的较大版本.
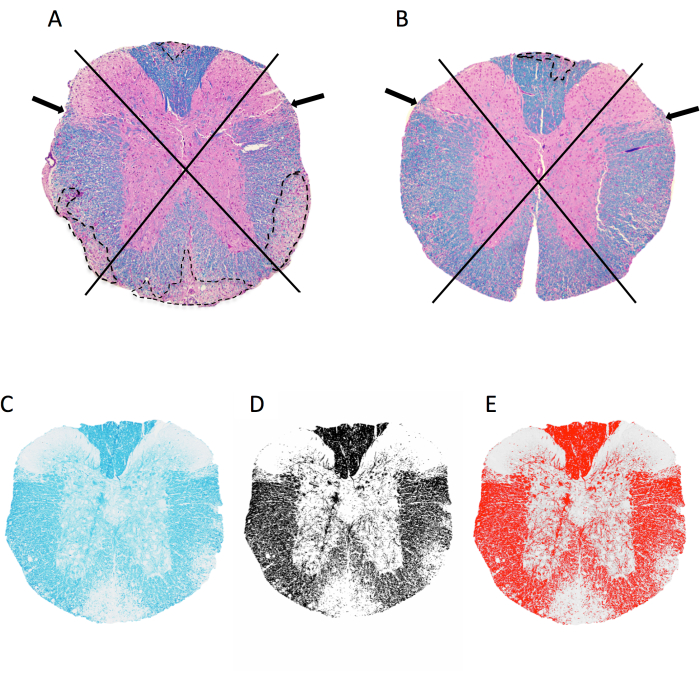
图 2: 对胸脊髓水平的脑膜炎症和髓鞘面积百分比进行评分。(A,B)显示了雌性C57BL6 / J小鼠的胸椎脊髓图像,该小鼠具有MOG p35-55诱导的EAE,并用LFB / H&E染色。A 中的小鼠有 4 个象限中的 4 个象限有融合性脱髓鞘病变,而 B 中的小鼠有 4 个象限中的 1 个受影响。B中的小鼠在其他象限中确实有一些炎症,但这并没有表现为融合性病变,因此没有评分。(C-E)LFB 图像示例,以及 imageJ 中的灰度和阈值图像。 请点击这里查看此图的较大版本.
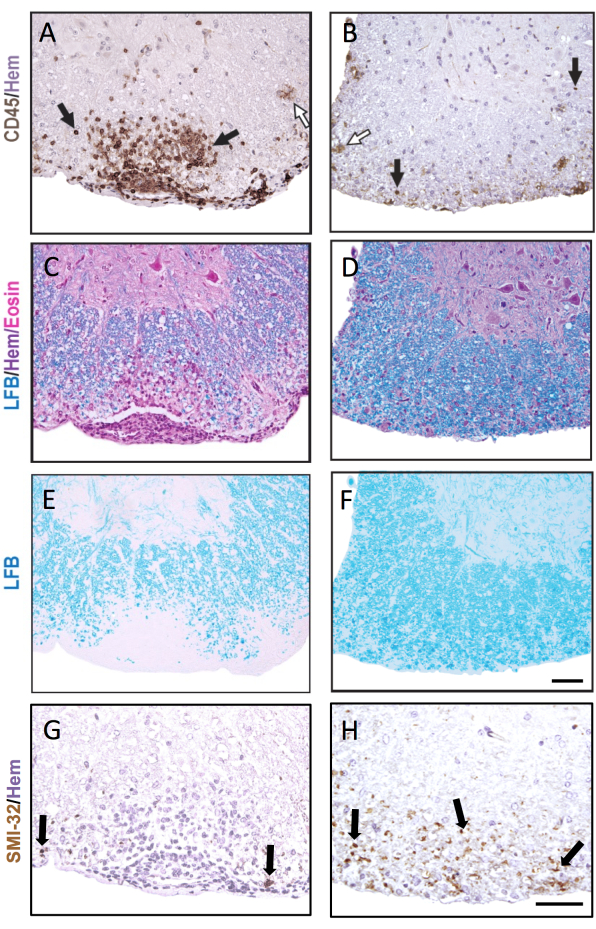
图 3:用 CD45、LFB H&E、LFB 和 SMI-32 染色的脊髓切片。脊髓早期 (A、C、E、G) 和晚期 (B、D、F、H) 脑膜下病变的示例,对 CD45 抗体 (A,B)、LFB/H&E (C,D)、单独 LFB (E,F) 和 SMI-32 抗体 (G,H) 进行染色。黑色箭头表示用每种抗体染色的细胞示例。白色箭头表示推定的小胶质细胞,这些小胶质细胞已被染色为 CD45+。比例尺 = 50 μm。该图显示了 EAE 期间雌性 C57BL6/J 小鼠脊髓病变的代表性染色,并强调了不同脊髓切片的病理学差异。 请点击这里查看此图的较大版本.
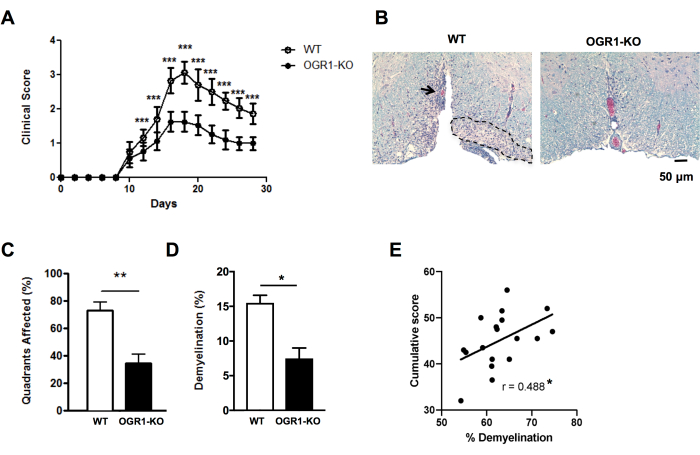
图 4:EAE 中病变评分和脱髓鞘百分比的应用。 所示是 EAE 实验的一个例子,其中 C57BL6/J 背景上缺乏卵巢癌 G 蛋白偶联受体 1 (OGR1) 基因的雌性小鼠的临床 EAE 比野生型 (WT) 雌性 C57BL6/J 小鼠的严重程度要低。通过用 MOG p35-55/CFA 加 PTX 免疫诱导 EAE,并根据以下临床量表对小鼠进行评分:1 = 尾部麻痹。2 = 后肢和足无力,3 = 后肢瘫痪,4 = 前肢无力,5 = 垂死。(A) 小鼠随时间变化的平均值 + SEM 临床评分。(B) 所示是腹侧脊髓中 LFB/H&E 染色的一个例子。比例尺 = 50 μm。 (C) 包含脱髓鞘病变的平均值 + SEM 百分比象限。(D) 每组平均值 + SEM 脱髓鞘百分比。(E) 显示了 C57BL6/J 小鼠中 MOG p35-55 诱导的 EAE 的另一项实验的结果,其中在 30 天的观察中将个体小鼠的 EAE 评分相加,并与脊髓脱髓鞘百分比相关。使用 Spearman 检验进行相关性。(A-D)中的面板改编自Souza C等人29。(E)中的数据是原始数据。*P<0.05, **P<0.01, ***P<0.001. 请点击这里查看此图的较大版本.
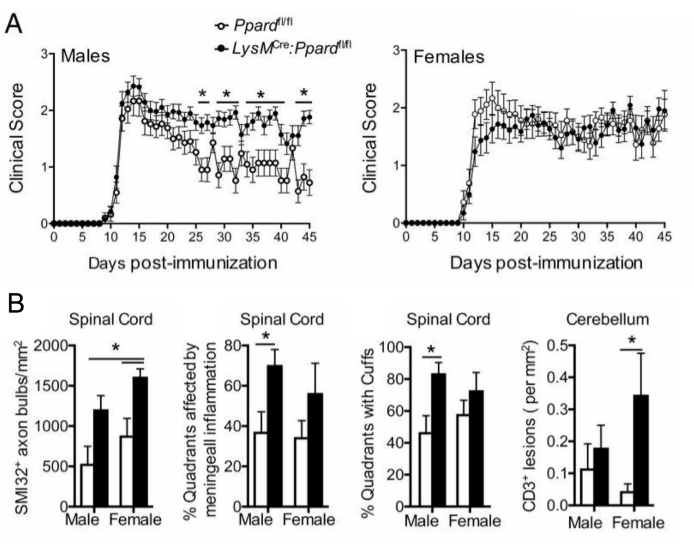
图 5:应用 SMI-32 染色了解基因型对临床 EAE 表型的影响。该图显示了 EAE 实验的示例,其中雄性和雌性野生型(携带 Ppard 的斑点等位基因)和髓系特异性 Ppard 突变小鼠(LysMCre:Ppardfl/fl)在 C57BL6/J 背景下用 MOG p35-55/CFA 和 PTX 免疫并随访 45 天。(A)显示小鼠的平均值+SEM临床评分。(B) 显示脊髓中 SMI-32+ 轴突数量、脑膜下病变的象限百分比、血管周围袖带的百分比象限和小脑中每 mm2 组织中 #CD3 病变的组织学评分的平均 + SEM 结果。该实验显示了对 SMI-32 染色的基因型效应。此图改编自 Drohomyrecky。等人。15. 请点击此处查看此图的较大版本。
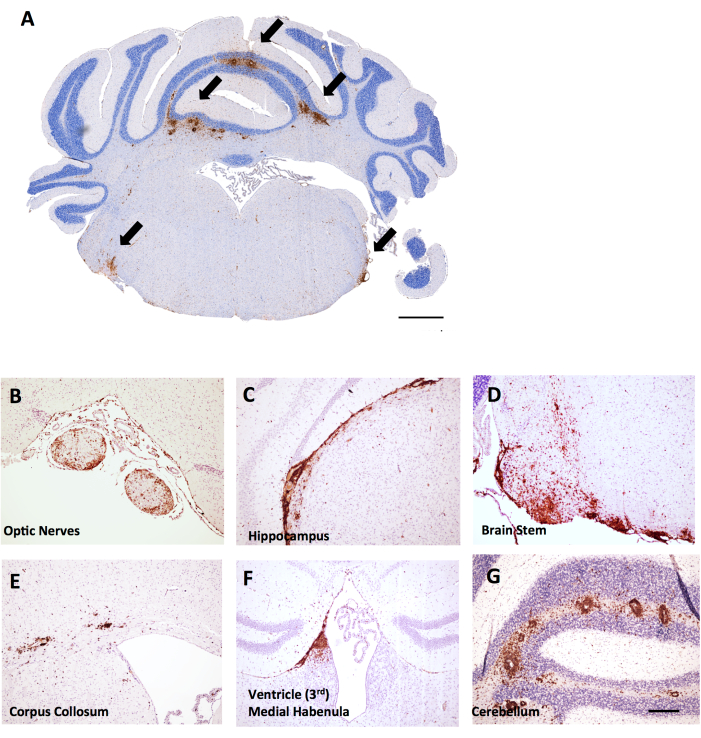
图 6:雌性 C57BL6/J 小鼠 MOG p35-55 诱导的 EAE 脑冠状切片中 CD45+/苏木精染色的示例。CD45+ 病变显示为棕色。(A) 冠状切片脑干中的CD45+病变。 比例尺 = 150 μm。(B-G) 视神经 (B)、海马下脑膜延伸 (C)、脑干 (D)、脑体 (E)、心室附近的内侧 habenula (F) 和小脑 (G) 中的 CD45+ 病变示例。 比例尺:(B–G) = 50 μm。 请点击这里查看此图的较大版本。
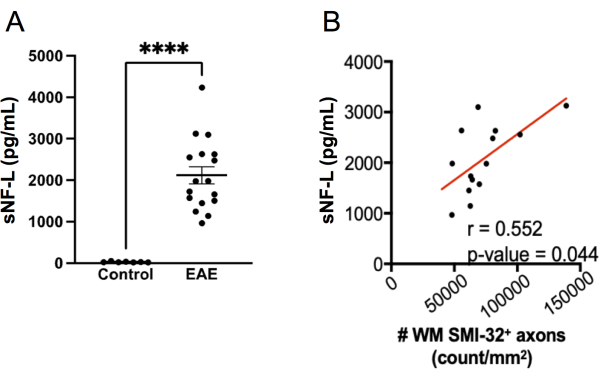
图 7:MOG p35-55 诱导的 EAE 中血清中的 sNF-L 水平。(A)在一项实验结束时从雌性对照和EAE小鼠收集的血清NFL水平。使用双尾 Mann Whitney 检验分析数据。(****p 值 < 0.0001)。(B) 在终点采集脊髓切片并用 SMI-32 染色。使用 Spearman 检验确定每个白质组织区域的阳性细胞数,并与终点的血清 NF-L 相关。 请点击这里查看此图的较大版本.
附表1:组织处理中使用的浴液说明。 使用自动处理器自动移动盒在这些系列的浴槽中移动。 请点击这里下载此文件。
补充表2:Luxol Fast Blue和苏木精和伊红染色的步骤。 下表概述了 Luxol Fast Blue 和苏木精和伊红染色方案中的步骤顺序。 请点击这里下载此文件。
附表3:用于免疫组化染色的抗体。 描述了该协议中使用的抗体以及可用于进一步探索炎症,小胶质细胞增生和星形胶质细胞增生的抗体。 请点击这里下载此文件。
补充表4:如何将.czi转换为TIFF文件。请注意,最好使用高分辨率图像,但如果计算机的工作内存有限,则可以保存中等分辨率的图像。在分析中使用相同分辨率的图像是必不可少的。另请注意,该系列的最后一张图像是幻灯片标签。避免阅读标签,以确保分析是盲目的。30,31 请点击这里下载此文件。
讨论
脊髓组织学染色是评估 EAE 疾病严重程度的重要工具,尤其是在治疗组之间在疾病急性期后疾病恢复程度存在差异的情况下。免疫细胞浸润 (CD45)、髓鞘 (LFB) 和轴突损伤 (SMI-32) 染色有助于表征小鼠临床评分改变的根本原因。这里描述的组织学染色方案提供了炎症以及髓鞘和轴突损伤的程度。此外,显示的结果验证了 sNF-L 测量作为评估 EAE 中整体神经元损伤程度的方法。
该分析的关键参数是确保研究人员对切片的身份不知情,并且不同小鼠的脊髓的每个水平都有等效的采样。这是因为在脐带的较低水平上,炎症的严重程度可能更大。另一个关键参数是实验组的大小。脊髓和大脑通常在终点每组从6-8只小鼠中收获,以观察具有适度效应大小的治疗或基因型的组之间的显着差异。同样重要的是,要确保选定的小鼠在平均时具有整个组的代表性平均分数。关于故障排除,那些对协议没有经验的人遇到的一个常见问题是脊髓固定的时间不够长,并且不容易从脊柱中挤出。如果是这种情况,可以使用细剪刀沿着棘突剪下脊髓,然后打开柱子以露出脊髓,从而手动将脊髓从柱子上解剖出来。或者,可以将组织再固定几天,而不会影响抗体染色的成功。这里描述的抗体克隆在福尔马林中固定长达 2 周的组织中起作用。
嵌入脊髓碎片需要技巧和练习。建议佩戴放大镜,并将灯对准嵌入站,以更好地观察截面是横截面还是纵向截面。在粗加工过程中,将脊髓片的长度保持在 2 毫米以内将有助于它们落在横截面上。对于经验不足的用户来说,遇到的另一个常见问题是 LFB 在过夜孵育过程中蒸发,使载玻片的一半染色,一半未染色。为避免蒸发,玻璃染色盘应先用热塑性薄膜密封,然后用保鲜膜包裹。如果发生蒸发并且切片染色不均匀,建议用碳酸锂对载玻片进行完全脱蓝,并在 LFB 中重新染色过夜。另一个常见问题是用户在 LFB 后没有完全去除灰质的蓝光。在进行方案中的其他步骤之前,在显微镜下检查各个切片以确保已达到足够的去蓝光量至关重要。此外,尽管 CD45 和 SMI-32 IHC 染料性能稳健,但在初步实验中对收到的每个新抗体批次的抗体浓度进行故障排除仍然很重要。这可以通过在阳性对照部分(EAE 脊髓)上测试各种浓度的抗体来完成。首次染色还应包括阴性对照,该对照仅由二抗组成,不添加一抗。最后,在图像分析中,对单个图像进行阈值至关重要,因为载玻片或切片之间的染色可能不均匀。
该协议使用免费提供的软件。如果无法使用处理器、包埋机或切片机,则这些步骤可以提供给提供这些服务的医院病理学核心。此外,如果无法使用载玻片扫描仪,可以使用装有摄像机的光学显微镜来保存脊髓或大脑区域的 TIFF 图像。对于基于显微镜的工作流程,以低倍(40 倍放大倍率)捕获 LFB 或 LFB/H&E 切片,对于 CD45 和 SMI-32 染色,对位于脊髓腹侧、背侧和侧侧部分中心的至少四个窗口进行成像(CD45 为 200 倍放大倍数,SMI-32 为 400 倍放大倍数)。可以在这些图像上进行图像分析,以与描述类似的方式量化染色。
决定采用哪种组织学方法对 EAE 进行评分取决于各组之间的临床评分差异有多大。例如,如果 EAE 临床评分存在巨大差异(一组获得 EAE,一组没有),这通常与外周介导的炎症的差异有关。在这种情况下,对 LFB/H&E 染色切片上是否存在脱髓鞘病变进行评分就足够了,并且将揭示组间差异。如果各组在发病时的临床评分更相似,而临床恢复程度却存在差异(例如图 5A中的实验),则最好应用此处概述的完整组织学工作流程,包括脑干和小脑脑炎症的评分,以区分疾病慢性差异是否与炎症或组织损伤的差异有关。 如果通过 CD45 计数发现炎症差异,可以进行进一步的 IHC 研究以染色 T 细胞(抗 CD3)、浸润性单核细胞/巨噬细胞 (Mac3) 和小胶质细胞 (Iba-1/TMEM119)(推荐的抗体克隆见 补充表 3)。小胶质细胞活化反映在双标记的 Iba-1+TMEM-19+ 小胶质细胞上 Iba-1 染色强度的增加和小胶质细胞过程的回缩增加,这可以通过第32 节的 Sholl 分析进行评估。此外,流式细胞术或单细胞RNA测序等技术可用于对大脑和脊髓中免疫群体的频率和表型进行更深入的表征。
SMI-32+ 轴突计数是检测 EAE32,33 和 MS34 中轴突损伤的灵敏方法。SMI-32 可检测重或中等神经丝的非磷酸化形式,积聚在横断神经元的末端球茎中。检测受损轴突的另一种方法是用淀粉样蛋白前体蛋白 (APP) 染色,由于轴突转运中断,淀粉样蛋白前体蛋白 (APP) 会积聚在轴突中33。SMI-32 和 APP 的染色模式虽然都反映了轴突损伤,但通常不会重叠,表明它们正在检测不同的病理33。还可以通过测量 sNF-L 来补充轴突损伤的组织学测量,sNF-L 是脊髓和大脑中持续轴索损伤的快速而敏感的测量方法。它的优点是可以在活小鼠中在半天内完成。这种方法的一个缺点是套件价格昂贵,并且机器高度专业化。销售 sNF-L 套件的公司确实为无法使用 SIMOA 机器的人提供服务费用。评估轴突损伤的另一种方法是通过计算脊髓甲苯胺蓝色染色切片中的轴突12 或计数 SMI-31 在脊髓白质区域检测到的神经丝束32 来对轴突丢失进行评分。这两种方法都比 SMI-32 或 sNF-L 测量更费力。
如果 EAE 临床评分在各组之间不同,但炎症、脱髓鞘和轴突损伤的评分不能显示组间差异,则使用 GFAP 对星形胶质细胞活化进行染色可能有用(推荐的抗体克隆见 补充表 3 )。星形胶质细胞活化与GFAP染色的增加有关,这已被证明与某些EAE模型中的EAE进展相关,包括DA大鼠的慢性EAE35。
总之,该协议描述了对EAE进行组织学评分的方法并提供了分析工作流程。
披露声明
Shannon Dunn 为 FSD Lucid Psycheceuticals 提供咨询。
致谢
我们感谢Raymond Sobel博士(斯坦福大学)向我们展示了他粗略和修复大脑和脊髓切片的方法。我们感谢多伦多表型基因组学中心的Kyle Roberton和Milan Ganguly学习了嵌入方法,并切割了我们的大脑和脊髓切片。我们感谢 Matthew Cussick 博士和 Robert Fujinami 博士(犹他大学)分享他们对脊髓中脑膜下和血管周围炎症进行评分的方案。感谢 Shalina Ousman 分享 CD45 抗体的克隆。我们感谢 Xiofang Lu 在圣迈克尔医院的 Keenan 生物医学研究中心接受组织处理器和组织包埋站的培训并维护这些设备。这项工作得到了加拿大MS(SED)的生物医学资助。Carmen Ucciferri得到了加拿大政府的学生资助。努里亚·阿尔瓦雷斯-桑切斯(Nuria Alvarez-Sanchez)得到了Keenan博士后奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
参考文献
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。