Method Article
Bewertung von Entzündungen, Demyelinisierung und Axonverletzungen des Zentralnervensystems bei experimenteller autoimmuner Enzephalomyelitis
In diesem Artikel
Zusammenfassung
Die experimentelle autoimmune Enzephalomyelitis (EAE) dient als Tiermodell der Multiplen Sklerose. Dieser Artikel beschreibt einen Ansatz zur Bewertung von Rückenmarksentzündungen, Demyelinisierung und axonalen Verletzungen bei EAE. Darüber hinaus wird eine Methode zur Quantifizierung des löslichen Neurofilament-Lichtspiegels im Mäuseserum vorgestellt, die die Beurteilung der axonalen Schädigung in lebenden Mäusen erleichtert.
Zusammenfassung
Die experimentelle autoimmune Enzephalomyelitis (EAE) ist ein gängiges immunbasiertes Modell der Multiplen Sklerose (MS). Diese Erkrankung kann bei Nagetieren durch aktive Immunisierung mit Proteinkomponenten der Myelinscheide und Complete Freund's Adjuvans (CFA) oder durch den Transfer von myelinspezifischen T-Effektorzellen von Nagetieren, die mit Myelinprotein/CFA präpariert wurden, in naive Nagetiere induziert werden. Der Schweregrad der EAE wird in der Regel auf einer klinischen 5-Punkte-Skala bewertet, die den Grad der aufsteigenden Lähmung misst, aber diese Skala ist nicht optimal, um das Ausmaß der Genesung von EAE zu beurteilen. Zum Beispiel bleiben die klinischen Werte in einigen EAE-Modellen (z. B. Myelin-Oligodendrozyten-Glykoprotein-[MOG]-Peptid-induziertes EAE-Modell) trotz des Abklingens der Entzündung hoch. Daher ist es wichtig, das klinische Scoring durch das histologische Scoring der EAE zu ergänzen, das auch die Möglichkeit bietet, die zugrunde liegenden Mechanismen der Zellschädigung im Zentralnervensystem (ZNS) zu untersuchen.
Hier wird ein einfaches Protokoll vorgestellt, um Rückenmark- und Gehirnschnitte von Mäusen vorzubereiten und zu färben und Entzündungen, Demyelinisierung und axonale Verletzungen im Rückenmark zu bewerten. Die Methode zur Bewertung der Leukozyteninfiltration im Rückenmark kann auch zur Bewertung von Hirnentzündungen bei EAE angewendet werden. Ein Protokoll zur Messung von löslichem Neurofilamentlicht (sNF-L) im Serum von Mäusen mit einem Small Molecule Assay (SIMOA) Assay wird ebenfalls beschrieben, das Rückmeldung über das Ausmaß der Gesamtschädigung des ZNS bei lebenden Mäusen gibt.
Einleitung
Die experimentelle autoimmune Enzephalomyelitis (EAE) ist das häufigste Mausmodell für die humane demyelinisierende Erkrankung Multiple Sklerose (MS)1. Die klassische MS-Entzündungspathologie, einschließlich der Infiltration von IFN-γ (gamma) und IL-17-produzierenden T-Helferzellen2, der Infiltration von entzündlichen Monozyten3, der Bildung perivaskulärer und submeningealer entzündlicher demyelinisierender Läsionen4 und des Auftretens einer Axonverletzung4 im Zentralnervensystem (ZNS), wird auch bei EAEbeobachtet 5,6,7,8,9 . Die Ähnlichkeit der Immunmechanismen zwischen EAE und MS hat die EAE zu einem geeigneten präklinischen Modell gemacht, um die Wirksamkeit und die Wirkmechanismen einer Reihe zugelassener immunbasierter Therapien für MS zu testen, darunter Natalizumab, Fingolimod, Dimethylfumarat und Glatirameracetat (siehe 1,5). Bestimmte EAE-Therapien modellieren andere Aspekte der progressiven MS-Pathologie, die über die axonale Verletzung hinausgehen, einschließlich der Entwicklung einer submeningealen Entzündung im Gehirn, chronischer Demyelinisierung, Rückenmarksatrophie, Synapse und Neuronenverlust 6,10,11,12. Daher ist EAE nützlich, um die Wirksamkeit neuroprotektiver Therapien für MS zu überprüfen.
EAE wird bei Nagetieren auf verschiedene Weise induziert. Die aktive Immunisierung ist die gebräuchlichste Induktionsmethode und beinhaltet die Immunisierung von Nagetieren mit Myelin-Antigenen (entweder ganze Proteine oder Peptide), die in CFA emulgiert sind, ergänzt mit hitzeabgetötetem Mycobacterium tuberculosis13. Je nach Mausstamm wird auch Pertussistoxin (PTX) an Tag 0 und Tag 2 der Immunisierung verabreicht, um die Penetranz der Erkrankung zu erhöhen13. EAE kann auch durch adoptive Übertragung von myelinspezifischen T-Zellen, die aus Myelin/CFA-geprimten Mäusen gewonnen wurden, in gesunde Mäuse induziert werden14 oder kann sich spontan in Mäusen entwickeln, die T-Zell-Rezeptoren überexprimieren, die für die wichtigsten Myelinantigenespezifisch sind 5.
Der Schweregrad und das Fortschreiten der EAE-Erkrankung werden in der Regel anhand einer diskreten 5-Punkte-Skala bewertet: 1 – Schwanzschlaffheit, 2 – Hinter- oder Fußschwäche, 3 – vollständige Lähmung einer oder beider Hintergliedmaßen, 4 – Schwäche der Vordergliedmaßen, 5 – todgeweiht oder tot13. Dieses klinische Scoring-System dokumentiert das Fortschreiten der aufsteigenden Lähmung, die zu Beginn der Krankheit auftritt, ist jedoch weniger empfindlich bei der Erfassung des Ausmaßes der Genesung von ZNS-Entzündungsattacken. Zum Beispiel werden sowohl Mäusen, die Schwierigkeiten beim Gehen haben, als auch Mäusen, die leicht gehen können, aber eine Schwäche beim Fassen der Füße aufweisen, eine Punktzahl von 2 auf der EAE-Skala zugewiesen. Die Werte können in der postakuten Phase der EAE aufgrund des Vorhandenseins einer dauerhaften Axonverletzung oder eines dauerhaften Axonverlusts hoch bleiben, selbst trotz des Abklingens der Entzündungsreaktion9. Es gab eine Vielzahl von Versuchen, verfeinerte Bewertungssysteme, Verhaltenstests, Messungen der Hintergliedmaßen- und Griffkraft sowie Infrarot-Überwachungssysteme zu entwickeln, um Unterschiede in den klinischen Defiziten bei EAE 9,16,17,18 besser zu erfassen; Diese komplizierteren Scoring-Messungen unterscheiden jedoch nicht zwischen dem Beitrag von Entzündungen und Gewebeverletzungen zu den zugrunde liegenden neurologischen Defiziten. Daher besteht der Goldstandardansatz zur Bewertung des Schweregrads der EAE darin, sowohl ein klinisches als auch ein histologisches Scoring durchzuführen.
Hier wird ein Protokoll beschrieben, wie Rückenmarks- und Gehirnproben von Mäusen in Paraffin so präpariert und eingebettet werden können, dass der stochastische Prozess der Läsionsbildung, der bei EAE auftritt, erfasst wird. Es wird auch ein Protokoll vorgestellt, wie Schnitte mit Luxol Fast Blue (LFB) gefärbt werden können, das ursprünglich von Kluver und Barrera19 entwickelt wurde und Myelin im ZNS nachweist. Die Schnitte werden entweder mit LFB allein gefärbt (für die Demyelinisierungsanalyse) oder mit Hämatoxylin und Eosin (H&E) gegengefärbt, um entzündliche Läsionen sichtbar zu machen und zu bewerten. Es werden auch Protokolle zur Quantifizierung des Vorhandenseins von Gesamtleukozyten (CD45), des Verlusts von Myelin und der Anzahl verletzter Axone (SMI-32) im Rückenmark unter Verwendung kommerziell erhältlicher Antikörper, immunhistochemischer (IHC) Techniken und öffentlich zugänglicher Software bereitgestellt. Das Protokoll zur Quantifizierung von Leukozyten im Rückenmark kann auch auf die Quantifizierung von Leukozyten im Gehirn angewendet werden.
Die histologische Beurteilung von axonalen Verlusten und Verletzungen im Gehirn ist vergleichsweise schwieriger als im Rückenmark, da die Bahnen der weißen Substanz im Gehirn nicht parallel zueinander verlaufen. Die Messung des Serum-Neurofilament-Lichts (sNF-L) hat sich als vielversprechender Biomarker für neuronale Verletzungen bei MSherausgestellt 20,21. Jüngste Studien haben diese Technologie auf EAE 22,23,24 ausgeweitet. In dieser Arbeit wird eine Methode zur Messung des Serum-Neurofilament-Lichts (sNF-L) in lebenden Mäusen mit einem Small Molecule Assay (SIMOA) Assay vorgestellt. Diese Methode erfordert nur eine kleine Menge Serum und kann an lebenden Mäusen in nur einem halben Tag durchgeführt werden, was eine schnelle Rückmeldung darüber liefert, wie sich eine getestete Therapie auf die Gesamtschädigung des ZNS auswirkt. Alle hier beschriebenen Methoden können auf Mäuse jeden Geschlechts und Stammes angewendet werden.
Protokoll
Alle Experimente, die mit Mäusen durchgeführt wurden, wurden im Rahmen von Tierverwendungsprotokollen durchgeführt, die vom Unity Health Toronto Animal Care Committee genehmigt wurden, gemäß den Richtlinien des Canadian Council on Animal Care. Stellen Sie sicher, dass Sie während der gesamten Laborabläufe einen Laborkittel, Schutzhandschuhe und eine Brille tragen.
1. Entnahme und Fixierung des Gehirns und des Rückenmarks
- Euthanasieren Sie die Maus gemäß den institutionellen Richtlinien. Legen Sie die Maus in Bauchlage auf einen Seziertisch und enthaupten Sie sie mit einer chirurgischen Schere (Schnitt nach unten).
- Greife mit einer Adson-Pinzette (in der nicht-dominanten Hand) die Haut auf der Oberseite des Kopfes der Maus. Machen Sie dann mit einer chirurgischen Schere einen 2,5 cm langen Schnitt in die Haut auf der Oberseite des Kopfes.
- Schieben Sie die Haut am Kopf mit den Fingern seitlich an, um den darunter liegenden Schädel sichtbar zu machen.
- Stabilisieren Sie den Kopf der Maus, indem Sie die Augenhöhlen mit einer Standard-Adson-Pinzette greifen.
- Machen Sie mit einer feinen Schere (dominante Hand) kleine Schnitte in den Schädel entlang der Mittellinie von der Halswirbelsäule bis zu den Riechkolben.
HINWEIS: Setzen Sie jeweils nur wenige Millimeter Scherenspitzen unter den Schädel, um eine Schädigung des darunter liegenden Gehirns zu vermeiden. - Verwenden Sie eine Adson-Pinzette mit Zähnen, um den Schädel seitlich zu reflektieren und das darunter liegende Gehirn freizulegen.
- Halten Sie den Kopf mit der nicht-dominanten Hand. Halten Sie die Schere geschlossen (dominante Hand), schöpfen Sie das Rückenmark aus der Halswirbelsäule heraus und stoßen Sie das Gehirn sanft aus dem Schädel heraus, wobei die Hirnnerven durchtrennt werden.
- Legen Sie das Gehirn in ein konisches Röhrchen, das 10 ml 10% neutrales gepuffertes Formalin enthält, das mit dem Ausweis des Tieres gekennzeichnet ist.
- Schneide das Fell entlang der Mittellinie des Rumpfes der Maus vom Hals bis zum Schwanz ein.
- Schieben Sie die Haut mit den Fingern seitlich, um die Wirbelsäule sichtbar zu machen.
- Schneiden Sie mit einer chirurgischen Schere nach unten durch die Wirbelsäule auf der Höhe, wo die Oberschenkelknochen an der Hüfte ansetzen.
- Verwende eine chirurgische Schere, um die Körperwand auf jeder Seite der Wirbelsäule von der Hüfte bis zum Hals zu durchtrennen. Schneide alle anhaftenden Organe weg.
- Legen Sie die Wirbelsäule, die das Rückenmark enthält, in dieselbe Formalinröhre, die das Gehirn enthält. Lassen Sie das Gehirn und die Wirbelsäule 5–7 Tage lang fixieren.
HINWEIS: Der Zeitpunkt der Fixierung ist wichtig. Einige Antikörper wirken nicht, wenn das Gewebe überfixiert ist. Wenn das Gewebe unterfixiert ist, ist es schwierig, das Rückenmark in Schritt 2 aus der Wirbelsäule herauszupressen.
2. Aufbereitung von Rückenmark und Gehirn
HINWEIS: Die folgenden Schritte finden in einem Abzug statt. Bevor Sie beginnen, bereiten Sie 2 x 10 cm große saubere Petrischalen, einen Erlenmeyerkolben mit einem mit Filterpapier ausgekleideten Trichter, zwei Skalpelle (eines zum Schneiden von Knochen und eines zum Schneiden von ZNS-Gewebe), Linsenpapier, einen Bleistift, Einbettkassetten und mit 10 % Formalin vorgefüllte Probengläser vor.
- Schneiden Sie mit einer Schere ein kleines Stück Linsenpapier (die gleiche Breite, aber die doppelte Länge der Kassette) ab und legen Sie es in eine Petrischale.
- Beschriften Sie eine Kunststoffkassette mit einem Bleistift mit der Proben-ID.
- Gießen Sie das Röhrchen mit dem fixierten Gehirn und der Wirbelsäule in den Trichter. Übertragen Sie die Wirbelsäule und das Gehirn in die leere Petrischale.
ANMERKUNG: Das gebrauchte Formalin sickert in den Erlenmeyerkolben und kann in Schritt 2.13 wiederverwendet werden. - Teilen Sie das Gehirn mit einem Skalpell grob in sechs koronale Teile. Machen Sie einen Schnitt kaudal zum Kleinhirn, einen in der Mitte des Kleinhirns, einen direkt rostral zum Kleinhirn und zwei Schnitte in das verbleibende rostrale Gehirn, wodurch 3 zusätzliche koronale Scheiben gleicher Dicke entstehen.
- Übertragen Sie mit einer Pinzette Gehirnproben auf eine Hälfte des Linsenpapiers in der Petrischale.
- Schneiden Sie das Rückenmark mit dem Skalpell in drei Stücke: Der erste Schnitt wird unten am Brustkorb gemacht, der zweite Schnitt direkt unter der Krümmung der Halswirbelsäule.
- Schneiden Sie mit demselben Skalpell das sakrale Wirbelsäulenstück am kaudalen Ende ab, bis das Rückenmark sichtbar ist.
- Nehmen Sie die Brustwirbelsäule (nicht-dominante Hand) an. Halten Sie die Adson-Pinzette mit fest geschlossenen Zähnen (dominante Hand) und schieben Sie das Ende der Pinzette mit einer sanften Drehbewegung vorsichtig in die kleinere Öffnung der Wirbelsäule. Die Schnur sollte am anderen Ende herauskommen.
HINWEISE: Jedes Instrument mit abgerundetem Ende, das die Größe des Rückenmarks hat, eignet sich für diesen Zweck. Wenn das Rückenmark nicht auf natürliche Weise herausspringt, erzwingen Sie es nicht. Verwenden Sie stattdessen eine feine Schere, um die Knochen an der Seite der Wirbelsäule zu befestigen und sie offen zu spiegeln, um das Rückenmark freizulegen. Alternativ können Sie das Rückenmark und das Gehirn für ein paar zusätzliche Tage in Formalin fixieren. Es sollte jedoch die gleiche Fixierungszeit auf alle Proben angewendet werden, um eine Variabilität der Antikörperfärbung zu vermeiden. - Nimm die Standard-Adson-Pinzette (dominante Hand). Halten Sie das Rückenmarksstück immer noch mit der weniger dominanten Hand fest und ziehen Sie mit einer Pinzette das herausgetretene Seil vorsichtig aus der Säule. Legen Sie das Rückenmarksstück in die Petrischale mit dem Linsenpapier.
- Wiederholen Sie diesen Vorgang für die lumbalen/sakralen und zervikalen Säulenstücke.
- Teilen Sie die drei Rückenmarksstücke (Hals-, Brust-, Lenden-/Sakralteil) mit einem Skalpell in kleinere Querschnittsstücke. Schneiden Sie mindestens 15 Segmente ab, von denen jedes weniger als 2 mm dick sein sollte.
ANMERKUNG: Stellen Sie sicher, dass die Segmente kürzer als breit sind, wodurch die Abschnitte während des Einbettungsprozesses in Schritt 3 leichter in den Querschnitt fallen. - Ordnen Sie die Rückenmarksstücke auf derselben Hälfte des Linsenpapiers an, das die Gehirnstücke enthält. Falten Sie das Linsenpapier um, um die Taschentücher zu befestigen, und legen Sie diese in die beschriftete Kassette.
HINWEIS: Das Linsenpapier verhindert, dass während der Verarbeitung kleine Gewebestücke aus der Kassette entweichen. - Füllen Sie die Kassette in ein Probenglas mit recyceltem oder frischem Formalin.
- Wiederholen Sie die Schritte 2.1 bis 2.13 für die übrigen Proben.
- Nach 5-7 Tagen Fixierung werden die Kassetten aus dem Probenbehälter in das erste Formalinbad im automatischen Gewebeprozessor überführt (siehe Materialtabelle). Lassen Sie den Gewebeprozessor über Nacht gemäß dem in der Zusatztabelle 1 beschriebenen Programm laufen. Die Proben werden bis zum Einbetten in warmem Paraffinwachs gehalten.
3. Einbetten und Schneiden von Hirn- und Rückenmarksabschnitten
- Transferkassetten vom Prozessor in die Warmhaltekammer der Paraffineinbettstation (siehe Materialtabelle).
- Betten Sie die Querschnitte des Rückenmarks und des Gehirns jeder Maus wie folgt in einen einzigen Paraffinblock ein (Abbildung 1):
- Gießen Sie zunächst Paraffinwachs ein, um den Boden der Form zu bedecken. Legen Sie mit einer feinen Pinzette Hirnkoronal- und Rückenmarkquerschnittsstücke in das Paraffin am Boden der Form.
- Übertragen Sie die Form für einige Sekunden auf die Kühloberfläche, um Gehirn- und Rückenmarksteile zu fixieren. Stellen Sie die Form zurück auf die erhitzte Oberfläche und füllen Sie sie bis zum Rand mit heißem Paraffin.
- Setzen Sie den Kassettendeckel (der mit der Proben-ID beschriftet ist) auf die Form. Gießen Sie mehr Paraffin auf den Kassettendeckel. Bringen Sie die Form in die Kühlstation, damit das Wachs aushärten kann (30–60 Minuten kühlen).
HINWEIS: Das Einbetten von Rückenmarksabschnitten erfordert Übung. Um den Erfolg zu verbessern, verwenden Sie kürzere Längen des Rückenmarks (<2 mm), da diese eher im Querschnitt fallen. Chirurgische Augenlupen können getragen werden, um zu unterscheiden, ob sich Rückenmarksstücke im Querschnitt befinden. - Paraffinblock auf rotierendes Mikrotom montieren. Trimmen Sie den Block, bis das gewünschte Gewebe im Paraffinschnitt erscheint.
- Schneiden Sie 5 μM-Bänder von Abschnitten jedes Blocks ab und geben Sie sie in ein 42 °C warmes Wasserbad.
- Sammeln Sie Abschnitte auf Objektträgern und legen Sie Objektträger in ein Glasträgerregal.
- Die Stücke bei 37 °C im Trockenofen über Nacht backen. Kühlen Sie die Objektträger ab, bevor Sie mit dem Färben fortfahren.
4. Deparaffinierung und Rehydratisierung von Schnitten zur Vorbereitung auf die Färbung
HINWEIS: Die Schritte werden in einem Abzug ausgeführt. Bevor Sie beginnen, bereiten Sie Bäder mit Lösungsmitteln vor. 5 l 1x PBS (1 L ddH2O,8 g NaCl, 0,2 g KCl, 1,44 g Na2HPO4, 0,24 g KH2PO4; pH = 7,4) mit 0,05 % Tween-20 (PBS-T) für alle Waschschritte vorbereiten.
- Entparaffinieren, indem Objektträger in zwei aufeinanderfolgende Bäder aus Xylol oder einem Lösungsmittel auf Nicht-Xylol-Basis für jeweils 5 Minuten unter leichtem Rühren auf einen Schüttler gelegt werden.
- Rehydrieren Sie das Gewebe, indem Sie Objektträger durch aufeinanderfolgende Bäder mit absteigenden Ethanolanteilen führen: 2 x 100 % Ethanol (jeweils 5 Minuten), 2 x 95 % Ethanol (jeweils 3 Minuten) und 1 x 70 % Ethanol (3 Minuten). 95 % Ethanol für die LFB-Färbung einbehalten, auf 70 % Ethanol rehydrieren und PBS-T für die Immunhistochemie (IHC) aufbewahren.
5. LFB für Myelin mit H&E
- Bereiten Sie eine Lösung von 0,1 % LFB (0,2 g LFB, siehe Materialtabelle, 200 ml 95 % Ethanol, 0,5 ml Eisessig) vor. Mischen und filtrieren Sie in einen Erlenmeyerkolben. Bis zur Verwendung in einer dunklen Flasche aufbewahren.
- Übertragen Sie Abschnitte von 95 % Ethanol in ein Glasträgergestell und stellen Sie es in eine Färbeschale, die LFB enthält. Die Schale abdecken und mit Paraffinfolie verschließen, um ein Verdunsten zu verhindern.
- Die Abschnitte werden bei 56 °C im Ofen über Nacht (maximal 16 h) inkubiert.
- Am nächsten Morgen die Objektträger in ein ddH2O-Bad überführen und halten.
- In der Zwischenzeit wird (1) frische 0,05%ige Lithiumcarbonatlösung (0,05 g Lithiumcarbonat, 100 mlddH2O) vorbereitet; (2) Eosin-Y-Lösung (2 g Eosinsalz zu 40 ml ddH20 gebenund mischen, bis es sich aufgelöst hat, und dann mit 160 ml 95%igem Ethanol mischen).
- Bereiten Sie folgende Bäder vor: 1 x Lithiumcarbonat, 3 x 70 % Ethanol, 3 x 95 % Ethanol, 2 x 100 % Ethanol, 3 x ddH20. Platzieren Sie die Bäder in der Reihenfolge ihrer Verwendung (siehe Ergänzende Tabelle 2).
- Befolgen Sie die Schritte wie in der ergänzenden Tabelle 2 beschrieben.
- Nachdem die Objektträger getrocknet sind, stellen Sie die demyelinisierenden Läsionen unter dem Mikroskop dar.
6. LFB für Myelin ohne H&E
- Führen Sie dieses Färbeverfahren für die Analyse von Myelin durch.
HINWEIS: Die Vorgehensweise ist identisch mit Schritt 5 (siehe Zusatztabelle 2), hat aber einen verkürzten Arbeitsablauf. Fahren Sie nach Schritt 4 mit Schritt 10 fort.
7. Antigengewinnung und Peroxidase-Quenching für immunhistochemische (IHC) Färbungen
HINWEIS: Bevor Sie beginnen, bereiten Sie 100 ml Wasserstoffperoxid in Methanol vor (1 Teil 30%ige Wasserstoffperoxidlösung in 9 Teilen 100%igem Methanol, in einem Abzug). Bereiten Sie 1 l 10 mM Citratpuffer mit Tween-20 (2,94 g Trinatriumcitrat, gelöst in 1 l ddH20 in einem Becherglas auf einer Rührplatte vor, bringen Sie den pH-Wert auf 6,0 und fügen Sie 500 μl Tween-20 hinzu). Bereiten Sie PBS-T vor (siehe Schritt 4). Alle Wäschen werden in Bädern von PBS-T unter sanftem Rühren (auf einem Shaker) durchgeführt, sofern nicht anders angegeben.
- Die endogene Peroxidase wird gelöscht, indem Objektträger 15 Minuten lang (in einem Abzug) in 3%iges Wasserstoffperoxid in Methanol gelegt werden. Waschen Sie die Objektträger zweimal in PBS-T (jeweils 2 Minuten).
- Objektträger auf einen Objektträgerhalter aus Metall übertragen und in 1 l Citratpuffer in einen Schnellkochtopf geben. Verschließen Sie den Deckel und setzen Sie einen Gummistopfen auf die Oberseite der Dampfentlüftung.
- Kochen Sie auf höchster Stufe in der Mikrowelle, bis die gelbe Lasche am Schnellkochtopf auftaucht, die anzeigt, dass der maximale Druck erreicht wurde. Weitere 5 Minuten bei maximalem Druck kochen lassen und dann den Schnellkochtopf mit Schutzhandschuhen aus der Mikrowelle nehmen.
- Drucklos, indem Sie den Stopfen entfernen. Nehmen Sie den Deckel ab und lassen Sie die Objektträger 20 Minuten lang im Citratpuffer abkühlen und fahren Sie dann mit der gewünschten Färbemethode fort.
VORSICHT: Treten Sie beim Ablassen des Dampfes zurück, da dies zu Verbrühungen führen kann.
8. CD45-Immunhistochemie
HINWEIS: Diese IHC-Methode wird verwendet, um infiltrierende Leukozyten sichtbar zu machen. Die Avidin/Biotin-Blockierungsschritte werden mit den Blockierungs- und Primärantikörper-Inkubationsschritten kombiniert.
- Blockierungspuffer vorbereiten (2 % BSA, 2 % Kaninchenserum in 1x PBS).
- Übertragen Sie die Objektträger in eine Glasschale und waschen Sie sie zweimal mit PBS-T (jeweils 2 Minuten). Bereiten Sie Avidin/Blockierungslösung vor (4 Tropfen/ml Avidin in 2 % BSA/2 % Kaninchenserum in 1 x PBS, siehe Materialtabelle).
- Trocknen Sie überschüssiges PBS-T um das Gewebe herum mit einem Laborpapier ab. Zeichnen Sie mit einem hydrophoben Stift einen Kreis um das Gewebe und legen Sie den Objektträger in die feuchte Kammer.
- Avidin/Blockierungslösung auf jeden Abschnitt auftragen (400 μl/Objektträger).
- Die feuchte Kammer abdecken und 30 Minuten bei Raumtemperatur inkubieren. In diesem Schritt wird der Anti-CD45-Antikörper (Ergänzende Tabelle 3) in einem biotinhaltigen Blockierungspuffer (4 Tropfen/ml Biotin, 2 % BSA/2 % Kaninchenserum in 1x PBS) hergestellt.
- Klopfen Sie die blockierende Lösung vom Objektträger auf ein fusselfreies Labortuch ab. Tupfen Sie mit einem Labortuch um das Gewebe herum, um überschüssige Flüssigkeit zu entfernen.
- Legen Sie den Objektträger zurück in eine feuchte Kammer. Geben Sie 400 μl CD45-Antikörperlösung (siehe Materialtabelle) auf den Abschnitt. Über Nacht bei 4 °C in einer abgedeckten feuchten Kammer inkubieren.
- Am nächsten Tag den Primärantikörper ablassen und die Objektträger 3 x in PBS-T (jeweils 5 min) waschen.
- Trocknen Sie den Bereich um den Abschnitt herum in einem fusselfreien Labor ab und geben Sie dann 400 μl Sekundärantikörper (1:200-Verdünnung in Blockierungspuffer) auf jeden Abschnitt. 1 Stunde bei Raumtemperatur inkubieren.
- In der Zwischenzeit bereiten Sie das ABC-Reagenz (siehe Materialtabelle) vor, indem Sie 2 Tropfen Reagenz A auf 5 ml 1x PBS geben und mischen. 2 Tropfen Reagenz B in dieselbe Lösung geben und mischen (~30 min vor Gebrauch vorbereiten).
- Waschen Sie die Objektträger in 3 Wechseln von 1x PBS-T (je 5 min) und legen Sie die Objektträger in eine feuchte Kammer.
- Geben Sie 400 μl ABC-Reagenz zu den Abschnitten. Die feuchte Kammer abdecken und 30 Minuten bei Raumtemperatur inkubieren.
- Waschen Sie die Objektträger in 3 Wechseln von 1x PBS-T (je 5 min). In der Zwischenzeit eine angemessene Menge DAB-Lösung in einem mit Folie überzogenen 15-ml-Zentrifugenröhrchen gemäß den Anweisungen des Herstellers zubereiten (siehe Materialtabelle).
- Nehmen Sie einen Objektträger und konzentrieren Sie sich auf einen Rückenmarksschnitt unter einem Mikroskop. Geben Sie 400 μl DAB in den Objektträger und starten Sie den Labor-Timer.
- Visualisieren Sie den Abschnitt, während er sich entwickelt, und stoppen Sie den Timer, wenn die Leukozyten braun sind. Den Objektträger in ein ddH20-Bad überführen, um die Reaktion zu stoppen. 5 Min. im Wasser halten. Für die restlichen Folien wird die gleiche Entwicklungszeit verwendet.
ACHTUNG: DAB ist krebserregend. DAB-Abfälle und Post-DAB-DDH2O als Sondermüll entsorgen. - Objektträger mit Mayer-Hämatoxylin für ~4-10 min gegenfärben (siehe Ergänzende Tabelle 2). Spülen Sie die Objektträger 10 Minuten lang unter fließendem Leitungswasser ab.
- In 95%igem Ethanol (1 x 3 min) dehydrieren, gefolgt von absolutem 100%igem Ethanol (jeweils 2 x 3 min).
- In einen Abzug geben Sie die Objektträger 5 Minuten lang in Xylol oder ein Xylolersatzlösungsmittel. Deckglas mit Eindeckmedium versehen und die Objektträger 1-2 Tage im Abzug trocknen lassen.
VORSICHT: Wenn Sie Xylol verwenden, verwenden Sie doppelte Handschuhe und eine Pinzette, um die Objektträger beim Abdecken zu handhaben, da es giftig ist und Handschuhe auflösen kann. - Reinigen Sie die Dias mit Xylol und scannen Sie sie mit einem Diascanner bei 20-facher Vergrößerung.
9. SMI-32 IHC bei axonaler Schädigung
HINWEIS: Dieses Protokoll verwendet einen SMI-32-Antikörper der Maus, der gegen nicht phosphorylierte Neurofilamente reagiert, die sich in verletzten Axonenanreichern können 25. Da dieser Antikörper in der Maus gezüchtet wurde und ein Mausantigen nachweist, wird empfohlen, ein Maus-auf-Maus-Kit (MOM) zu verwenden. Bei diesem Verfahren wird der Avidin/Biotin-Blockierungsschritt als separater Schritt von der primären Antikörperinkubation durchgeführt. Bevor Sie mit diesem Protokoll beginnen, deparaffinieren, rehydrieren, die endogene Peroxidaseaktivität löschen und die Antigengewinnung durchführen, wie in Schritt 4 und Schritt 7 beschrieben.
- Waschen Sie die Abschnitte zweimal mit 2 x PBS-T (je 2 min). Entfernen Sie überschüssige Flüssigkeit mit einem Labortaschentuch um die Schnitte und ziehen Sie mit einem hydrophoben Stift einen Kreis um das Gewebe.
- 400 μl Blockierungspuffer (2% (w/v) Ziegenserum in 1x PBS-T) mit Avidin (4 Tropfen/ml) zu den Abschnitten geben. 15 Minuten bei Raumtemperatur inkubieren.
- Tauchen Sie die Objektträger zweimal in 1x PBS-T. 400 μl Blockierungspuffer mit Biotin (4 Tropfen/ml) in den Objektträger geben und 15 Minuten bei Raumtemperatur inkubieren.
- Waschen Sie die Objektträger 2 Minuten lang in einem 1 x PBS-T-Bad. In der Zwischenzeit bereiten Sie das MOM-Blockierungsreagenz vor, indem Sie 2 Tropfen Stammlösung (siehe Materialtabelle) zu 2,5 ml 1x PBS hinzufügen.
- Geben Sie 400 μl MOM-Reagenz auf den Abschnitt. 1 Stunde bei Raumtemperatur inkubieren.
- Waschen Sie die Objektträger zweimal in einem 1x PBS-T Bad für 2 min. In der Zwischenzeit bereiten Sie das MOM-Verdünnungsmittel vor, indem Sie 300 μl Proteinkonzentrat-Stammlösung zu 3,75 ml 1x PBS hinzufügen.
- Geben Sie 400 μl MOM-Verdünnungsmittel hinzu und inkubieren Sie 5 Minuten lang bei Raumtemperatur. In der Zwischenzeit den SMI-32-Antikörper (siehe Materialtabelle) im MOM-Verdünnungsmittel verdünnen.
- Klopfen Sie das Verdünnungsmittel von den Objektträgern ab und geben Sie 400 μl SMI-32-Antikörperlösung auf den Abschnitt. Die feuchte Kammer abdecken und 30 Minuten bei Raumtemperatur inkubieren.
- Objektträger zweimal in einem 1x PBS-T Bad für 2 min waschen, jeweils unter leichtem Rühren. In der Zwischenzeit das MOM-Anti-Maus-IgG-Arbeitsreagenz im Verdünnungsmittel verdünnen (10 μl Stammbenzin in 2,5 ml Verdünnungsmittel).
- Fügen Sie 400 μl Anti-Maus-IgG-Arbeitsreagenz pro Objektträger hinzu. 10 Min. inkubieren.
- Die Objektträger zweimal in einem 1x PBS-T Bad für jeweils 2 min waschen. Fahren Sie mit der Färbung fort, indem Sie die im CD45-Färbeprotokoll beschriebenen Schritte (Schritt 8.11 – 8.19) befolgen.
10. LFB- und H&E-Scoring für das Vorhandensein von demyelinisierenden Läsionen
HINWEIS: Im Folgenden finden Sie einen Analyseansatz, der angewendet werden kann, um schnelle Erkenntnisse über den Schweregrad der entzündlichen Demyelinisierung zu gewinnen. Diese Analyse wird in Abschnitten der Nabelschnur durchgeführt, die auf verschiedenen Ebenen (zervikal, thorakal und lumbal, mindestens 3 Abschnitte pro Ebene) entnommen werden. Beziehen Sie sich auf den Allen Brain Atlas for Mouse Spinal Cord26 , um die anatomische Ebene des Rückenmarks zu identifizieren. Für diese Analyse sind TIFF-Dateien erforderlich. Wenn gescannte Bilder im .czi-Format vorliegen, befolgen Sie die Anweisungen in der Zusatztabelle 4 , um cci-Dateien in TIFF-Dateien zu konvertieren.
11. Berechnung des Flächenanteils der LFB-Färbung in der weißen Substanz des Rückenmarks
HINWEIS: Diese Analyse misst den prozentualen Flächenanteil der weißen Substanz des Rückenmarks, der mit LFB gefärbt ist.
- Öffnen Sie einen LFB-gefärbten Abschnitt, der als TIFF-Datei gespeichert wurde, indem Sie die Datei per Drag & Drop in ImageJ ziehen.
- Klicken Sie auf Bild > geben Sie > 8-Bit-Datei ein, um ein Graustufenbild zu erstellen. Klicken Sie auf Bild > passen Sie > Schwellenwert an. Passen Sie den unteren Schieberegler so an, dass die rote Überlagerung alle dunklen Bereiche (Myelin) erfasst, die mit bloßem Auge sichtbar sind (Abbildung 2C–E). Klicken Sie auf Übernehmen.
- Klicken Sie auf Analyze > Tools > ROI Manager, um den ROI-Manager zu öffnen.
- Wählen Sie das Polygon-Zeichenwerkzeug in der Symbolleiste ImageJ aus. Dieses Zeichenwerkzeug ermöglicht es, eine Region des Rückenmarks mit der Computermaus zu umreißen.
- Umreißen Sie den dorsalen Bereich des Rückenmarks und fügen Sie das Polygon dem ROI-Manager hinzu, indem Sie auf t auf der Tastatur klicken.
- Umreißen Sie die anterior-laterale Region der weißen Substanz des Rückenmarks und fügen Sie das Polygon dem ROI-Manager hinzu.
HINWEIS: Schließen Sie bei der Nachzeichnung große Blutgefäße, Risse im Gewebe, Artefakte und an das Hinterhorn angrenzende Bereiche aus (Pfeil 2A, B ), die normalerweise weniger myelinisiert sind. Seien Sie beim Nachzeichnen so genau wie möglich, da ein zu hoher weißer Hintergrund die Ergebnisse verzerrt. - Klicken Sie auf Analysieren > Messungen festlegen und wählen Sie Flächenanteil aus.
- Klicken Sie im ROI-Manager auf Messen . Dies ergibt den Anteil der umrissenen Fläche, der mit LFB gefärbt ist.
- Kopieren Sie aus dem neu erzeugten Ergebnisfeld die Werte in Excel und schließen Sie das Bildfenster. Berechnen Sie den durchschnittlichen prozentualen Anteil der gefärbten Fläche für die dorsalen und ventrolateralen Regionen. Bilden Sie den Mittelwert dieser Werte, um einen Wert für diesen Abschnitt zu erhalten.
- Wiederholen Sie die Schritte 11.1–11.9 für Hals-, Brust- und Lendenwirbelschnitte (N = 3/Stufe/Maus).
- Berechnen Sie den durchschnittlichen prozentualen Myelinanteil für alle Abschnitte für jede Maus. Die prozentuale Demyelinisierung wird geschätzt, indem die prozentuale Flächenfärbung von 100 subtrahiert wird.
12. Analyse der Anzahl der CD45+ -Zellen und SMI-32+ -Axon-Eizellen
- Ziehen Sie ein CD45- oder SMI-32-gefärbtes TIFF-Bild per Drag & Drop in ImageJ. Klicken Sie auf Analysieren > Skalieren > globalen > festlegen , um die Maßstabsleiste für alle Bilder festzulegen. Beachten Sie, dass dies nur für das erste Bild erfolgt.
- Wählen Sie das Polygon-Zeichenwerkzeug aus und zeichnen Sie mit der Computermaus um die graue Substanz herum. Klicken Sie auf Analysieren > Messen und halten Sie die Ergebnisse in Excel als "Graue Substanz" fest.
- Wenn sich das gezeichnete Polygon noch auf dem Bild befindet, entfernen Sie die grauen Zellen aus dem Bild, indem Sie auf die Entf-Taste (Tastatur) klicken. Bei dieser Aktion bleibt nur die weiße Substanz zu analysieren.
- Umreißen Sie den gesamten Rückenmarksabschnitt mit dem Polygon-Zeichenwerkzeug . Schließen Sie alle Geweberegionen aus, die fehlen oder beschädigt sind.
- Klicken Sie auf Analysieren > Messen und erfassen Sie die Ergebnisse als "Total Tissue Area" in der Excel-Datei.
- Klicken Sie auf Bild > Farbe > Farbentfaltung. Wählen Sie im Dropdown-Fenster "Vektoren" die Option "H DAB" aus. Es erscheinen drei neue Fenster – behalten Sie das braune Fenster (DAB-Kanal) bei und löschen Sie andere Bildfenster.
- Klicken Sie auf Bild > passen Sie > Schwellenwert an. Passen Sie den unteren Schieberegler an, um den Schwellenwert für das Bild so festzulegen, dass die rote Überlagerung die gleiche Menge an braunen Flecken erfasst, die mit bloßem Auge erkannt werden. Klicken Sie auf Übernehmen.
- Klicken Sie auf Process > Binary > Watershed. Vergleichen Sie in diesem Schritt das Originalbild und das Binärbild, um sicherzustellen, dass sie übereinstimmen.
- Klicken Sie auf Analysieren > Partikel analysieren. Wählen Sie Overlay anzeigen und ändern Sie die Einstellungen: Größe = 5 - 150 μm2, Zirkularität = 0,4 – 1. Klicken Sie auf OK.
Hinweis: Mit diesen Einstellungen können einzelne Zellen und kleine Gruppen von Zellen, die nicht mit der Funktion Wassereinzugsgebiet geteilt wurden, in die Analyse einbezogen und nicht ausgeschlossen werden. - Notieren Sie im Ergebnisfenster die letzte Zahl in der Spalte ganz links in Excel, die die Gesamtpartikelanzahl darstellt. Berechnen Sie dann die Fläche der weißen Substanz (Gesamtfläche des Gewebes – Fläche der grauen Substanz in mm2). Drücken Sie die Gesamtpartikelanzahl pro Fläche der weißen Substanz aus (Anzahl/mm2).
- Wiederholen Sie die Schritte für jedes gespeicherte RGB-Bild. Nachdem alle Rückenmarksabschnitte für eine Maus analysiert wurden, wird die Partikelzahl pro mm2 Gewebe für diese Maus gemittelt.
HINWEIS: Der Arbeitsablauf, der zur Analyse von Leukozyten des Rückenmarks verwendet wird, kann auch auf Gehirnregionen angewendet werden.
13. Messung von sNF-L mit einem SIMOA-Assay
- Entnahme von 100–200 μl Blut von lebenden Mäusen durch saphenöse Blutung mit kapillaren Microtainer-Röhrchen oder durch Herzpunktion mit einer Spritze und einer 25-G-Nadel (terminales Verfahren). Für Letzteres wird Blut in ein 1,5-ml-Mikrozentrifugenröhrchen übertragen.
- Lassen Sie das Blut 30–60 Minuten bei Raumtemperatur gerinnen.
- Proben bei 2660 x g für 5 min bei 4 °C zentrifugieren und die obere Fraktion (Serum) in ein neues Mikrozentrifugenröhrchen pipettieren. Lagern Sie das Serum bei -80 °C, bis es gebrauchsfertig ist.
- Zubereitung: Kalibratoren und Kontrollen (NF-Light-Assay-Kit, siehe Materialtabelle) vor Gebrauch 1 Stunde lang auf Raumtemperatur erwärmen lassen. Nehmen Sie das Enzymsubstrat (RGP) aus dem Kühlschrank und legen Sie es für mindestens 30 Minuten in ein 30 °C warmes Wasserbad, wobei alle 10 Minuten ein Wirbel gewirbelt wird.
- Tauen Sie die Serumproben auf Eis auf. Nach dem Auftauen die Proben vorsichtig vortexen und 5 Minuten lang bei 10000 x g zentrifugieren, um alle Rückstände zu pelletieren.
- Laden Sie die Platte: Wirbeln Sie die Kalibratoren und die Kontrollen. Laden Sie die Kalibratoren in zweifacher Ausführung, die Kontrollen in doppelter Ausführung und die Serumproben in zweifacher Ausführung auf die mit dem Kit gelieferte 96-Well-Platte. Die Serumproben werden im Verhältnis 1:3 mit dem im Kit enthaltenen Verdünnungsmittel verdünnt. Versiegeln Sie die Platte.
- Schalten Sie die SIMOA-Maschine (siehe Materialtabelle) in der Reihenfolge Computer, Programm und dann Maschine ein. Erlauben Sie der Maschine, die Wartung zu Beginn des Tages zu initialisieren und auszuführen.
- Die magnetischen Perlen 30 s lang vortexen.
- Registerkarte Reagenzien laden auf dem Bildschirm, doppelklicken Sie auf die Rackposition, an der die Reagenzflasche platziert werden soll, und scannen Sie dann den Barcode der Flasche.
- Platzieren Sie die Magnetperlen in der Schüttelposition auf dem Gestell (Positionen 1–3).
- Fahren Sie fort und laden Sie den Detektor, das SBG-Reagenz und das RGP-Reagenz in das Gerät.
- Klicken Sie in der Software auf Einstellung . Stellen Sie sicher, dass sich der Probenmodus auf der Platte befindet. Benennen Sie auf der Registerkarte "Setupausführung" das Experiment.
- Weisen Sie den Kalibratoren die Wells auf der Platte wie folgt zu: Klicken Sie auf die Well, und wählen Sie dann den Assay aus. Wählen Sie Kalibrieren A und klicken Sie dann auf aufsteigend. Markieren Sie die Wells A1-8 und klicken Sie dann auf Replikate (2), um die Koordinaten für die Kalibratoren zuzuweisen, die doppelt ausgeführt werden sollen. Führen Sie die Ausführung mit dem ordentlichen Protokoll aus.
HINWEIS: Beziehen Sie sich auf das Analysezertifikat (Website des Herstellers), um die Konzentrationen jedes Kalibrators für jede einzelne Chargennummer zu erhalten. Sobald die Wells zugewiesen sind, ist es nicht mehr möglich, von diesem Bildschirm wegzunavigieren, ohne die Arbeit zu verlieren, bis die Platte verriegelt ist. - Weisen Sie die Beispiele zu, indem Sie die folgenden Schritte ausführen:
- Klicken Sie unten rechts auf dem Bildschirm auf die Schaltfläche , um die Proben zuzuweisen. Markieren Sie die Vertiefungen, in denen sich die Proben befinden sollen.
- Markieren Sie den auszuführenden Assay aus der Liste, wählen Sie die Anzahl der Replikate und geben Sie die Onboard-Verdünnung von 4x an.
- Wenn die Wells noch hervorgehoben sind, geben Sie ein Präfix für die Proben-ID und die Startnummer ein und klicken Sie dann auf Generieren , um sequenzielle IDs für die Proben zu erzeugen. Wiederholen Sie die Schritte für Kontrollproben.
- Platte in den Plattenhalter (A1 bis A12) laden.
- Klicken Sie auf der Bildschirmoberfläche auf Fertige Programmierbeispiele und fahren Sie mit der Registerkarte Systemressourcen fort. Vergewissern Sie sich, dass alle Reagenzbehälter voll und die Abfallbehälter leer sind.
- Klicken Sie auf Ausführen.
- Wenn der Lauf abgeschlossen ist, überprüfen Sie die Kalibrierungskurve auf der Registerkarte "Datenreduzierung", indem Sie den Assay- und Plattennamen auswählen.
- Gehen Sie zu "Ausführungsverlauf" und verwenden Sie die Filter, um die letzte Ausführung zu finden. Wählen Sie "Ausführen" und dann "Alle Ergebnisse" aus. Klicken Sie auf Exportieren und speichern Sie die .csv Datei. Klicken Sie auf Bericht, wählen Sie dann Batch-Kalibrierungsbericht und wählen Sie die letzte Ausführung aus. Zeigen Sie eine Vorschau des Berichts an, und exportieren Sie ihn.
- Führen Sie die vom Hersteller empfohlene Wartung am Ende des Tages durch. Schalten Sie das Programm, den Computer und dann den Computer aus.
Ergebnisse
Abbildung 3 zeigt repräsentative IHC- und histochemische Färbungen mit Beispielen sowohl für akute (links) als auch für ältere EAE-Läsionen (rechts). Die repräsentative CD45-Färbung mit Hämatoxylin-Gegenfärbung ist in Abbildung 3A,B dargestellt. Die Abbildungen 3C–F zeigen Beispiele für die LFB-Färbung mit (Abbildung 3C,D) oder ohne (Abbildung 3E,F) der H&E-Gegenfärbung. Obwohl Hämatoxylin nicht spezifisch für Immunzellen ist, färben sich die Kerne der Immunzellen dunkler und können von ZNS-residenten Zellen unterschieden werden. Abbildung 3G,H zeigt eine repräsentative Färbung von SMI-32+-Axonen, die mit Hämatoxylin gegengefärbt wurden. Beachten Sie das vermehrte Auftreten dieser Färbung bei älteren EAE-Läsionen.
Die Schädigung myelinisierter Bahnen ist bei aktiven murinen EAE am häufigsten im Rückenmark und der Hauptgrund für Lähmungen bei dieser Erkrankung 7,9. Daher wird das Scoring für das Vorhandensein von Entzündungen und Gewebeschäden im Rückenmark in histologischen Analysen priorisiert. EAE-Läsionen treten sporadisch in verschiedenen Regionen (anterior, lateral oder dorsal) auf (Abbildung 2A,B) und auf verschiedenen Ebenen (Sakral-, Lenden-, Thorax-, Halswirbelsäule) des Rückenmarks auf. Die beschriebene Einbettungsmethode gewährleistet eine gute Probenahme von Läsionen in der gesamten Nabelschnur. Es werden mehr Abschnitte eingebettet als analysiert, da einige Abschnitte während des Bearbeitungs- oder Schnittprozesses beschädigt werden können. Um eine repräsentative Probenahme zu gewährleisten, werden für jede Maus mindestens 3 repräsentative Abschnitte auf zervikaler, thorakaler und lumbaler Ebene des Rückenmarks analysiert. Die Identität jeder Probe wird verblindet, damit die Person, die die Analyse durchführt, bei der Auswahl repräsentativer Abschnitte für die Analyse nicht voreingenommen ist.
Um schnelle Einblicke in die Unterschiede im histologischen Schweregrad der EAE zu erhalten, kann das Vorhandensein von submeningealen demyelinisierenden Läsionen in Rückenmarksquadranten in ausgewählten Abschnitten bewertet werden (Abbildung 2A,B). Dies ist eine schnelle Methode, die an gescannten Bildern oder mit einem Lichtmikroskop durchgeführt werden kann. Diese Analyse ist sensitiv genug, um Unterschiede im histologischen Schweregrad der EAE zwischen den Gruppen zu erkennen, wenn die EAE in einer Gruppe schwer und in der anderen leicht ist. Zum Beispiel wurde im Experiment in Abbildung 4 EAE bei weiblichem Wildtyp (WT) und Mäusen mit einer Deletion in OGR1 (OGR1 KO) unter Verwendung von MOG p35-55/CFA plus PTX induziert. Mäuse in der WT-Gruppe entwickelten eine schwere EAE mit vollständiger Lähmung, während die OGR1-Knockout-Gruppe eine milde Erkrankung entwickelte. Dieser Unterschied im klinischen Score entsprach einem Unterschied im Anteil der Quadranten, die submeningeale Läsionen aufwiesen (Abbildung 4C).
Es ist wichtig, das Scoring von demyelinisierenden Läsionen mit dem prozentualen Flächenanteil der Myelinfärbung zu ergänzen, um das Ausmaß des Verlusts von Myelin und/oder myelinisierten Axonen während des Autoimmunangriffs zu erfassen. Im Beispiel in Abbildung 4 unterschied sich auch der prozentuale Myelinanteil signifikant zwischen den OGR1- und WT-Mäusen (Abbildung 4D). Die prozentuale Myelinfraktion korreliert auch signifikant mit dem kumulativen EAE-Score bei Mäusen mit EAE (Abbildung 4E) und dient daher als gutes Maß für die Gesamtgewebeschädigung bei dieser Erkrankung. Beachten Sie, dass dieses Protokoll nicht zwischen der Intensität der Myelinfärbung unterscheidet. Wenn dies das gewünschte Ergebnis ist, sollte man eine Immunfluoreszenzfärbung für Myelinproteine wie das Proteolipidprotein oder das myelinbasische Protein durchführen und die Intensität dieser Färbung messen.
In dem Fall, in dem die EAE in beiden Vergleichsgruppen schwerwiegend ist, enthält ein höherer Anteil der Rückenmarksquadranten entzündliche/demyelinisierende Läsionen. In diesem Fall besteht ein empfindlicherer Ansatz zur Bewertung der Entzündung darin, die Anzahl der CD45+ -Leukozyten promm2 weißer Substanz zu zählen (siehe repräsentative Färbung in Abbildung 3A). Der hier beschriebene CD45-Antikörperklon detektiert alle infiltrierenden Leukozyten und färbt nur gelegentlich Mikroglia an, die die CD45-Expression in EAE hochregulieren (siehe Pfeil in Abbildung 3B) und ist daher nützlich, um die Infiltration peripherer Immunzellen einzufangen.
Bei längerfristigen EAE-Studien (>20 Tage) empfiehlt es sich, zusätzlich eine Analyse der Axonverletzung durchzuführen. Die SMI-32-Färbung in Rückenmarksabschnitten ist eine empfindliche Methode, um beschädigte Axone nachzuweisen. Obwohl die Entzündung im Rückenmark mit der Zeit abklingt und verschonte Axone remyelinisiert werden können, weisen überlebende Axone ein unterschiedliches Ausmaß der Restschädigung auf9 (Abbildung 3G,H). Im MOG-p35-55-induzierten EAE-Modell bei C57BL6/J-Mäusen ist beispielsweise das Ausmaß der axonalen Verletzung und des axonalen Verlusts ein Treiber der klinischen Scores nach Abklingen des Entzündungsprozesses9. Abbildung 5 zeigt ein Beispiel dafür in einem EAE-Experiment an männlichen und weiblichen Mäusen, WT-Mäusen und Mäusen, denen ein Gen namens Peroxisom-Proliferator-aktivierter Rezeptor-Delta (PPAR-delta) im myeloischen Kompartiment (LysMCre: Ppardfl/fl) fehlt. Bei den Männchen gewannen die WT-Mäuse die Funktion der Hintergliedmaßen zurück, aber die klinischen Werte blieben in der männlichen LysMCre: Ppardfl/fl-Gruppe hoch. Im Gegensatz dazu wiesen im Experiment bei den Frauen beide Versuchsgruppen durchgehend hohe Werte auf. Auf den ersten Blick deutete dieses Ergebnis darauf hin, dass PPAR-delta eine geschlechtsspezifische Wirkung bei EAE hat; Die pathologische Bewertung des Rückenmarks ergab jedoch, dass Mäuse beiderlei Geschlechts in der LysMCre: Ppardfl/fl-Gruppe im Vergleich zu WT-Pendants eine erhöhte axonale Schädigung aufwiesen (Abbildung 5B). Ein genotypischer Effekt auf die klinischen Werte wurde bei Weibchen wahrscheinlich nicht beobachtet, da weibliche WT-Mäuse tendenziell eine erhöhte axonale Schädigung aufwiesen, die sich in chronischen neurologischen Defiziten manifestierte.
Im selben Experiment wurde festgestellt, dass weibliche LysMCre: Ppardfl/fl weibliche Mäuse eine umfangreichere T-Zell-Infiltration im Kleinhirn aufweisen, was ein Beispiel dafür ist, wie die Bewertung von Gehirnentzündungen bei EAE nützlich sein kann. Bei EAE findet sich die Entzündung im Gehirn überwiegend im Kleinhirn und im Hirnstamm (Abbildung 6A,D,G), aber auch in den Hirnhäuten (unter dem Hippocampus in Abbildung 6C), in der Nähe der Ventrikel (Abbildung 6F) und anderen Bahnen der weißen Substanz einschließlich des Sehnervs und des Corpus Collosum (Abbildung 6B,E). Die Bewertung der Gehirnentzündung erfolgt in einer bestimmten Hirnregion (z. B. weiße Substanz des Kleinhirns), indem die Anzahl der CD45-Zellen promm2-Geweberegion mit der gleichen Methodik gezählt wird, die für das Rückenmarkprotokoll beschrieben ist. Bei der hier skizzierten Grössenmethode befindet sich ein Schnitt in der Mitte des Kleinhirns, der die Perspektive des Kleinhirns und des Hirnstamms bietet, wie in Abbildung 6A gezeigt.
Die Messung von sNF-L mit einem SIMOA-Assay hat sich zu einem nützlichen Biomarker für die Beurteilung einer laufenden axonalen Schädigung und des Ansprechens auf die Therapie bei schubförmig remittierender MS entwickelt 20,21,27,28. Das gleiche SIMOA-Assay-Kit, das zur Messung von sNF-L-Menschen verwendet wird, kann auch für die Messung von sNFL 22,23,24 von Mäusen verwendet werden. Um zu untersuchen, wie gut dieser Assay bei der Erkennung axonaler Verletzungen bei EAE funktioniert, wurde sNF-L in weiblichen C57BL6/J-Mäusen am Endpunkt eines EAE-Experiments gemessen und die Spiegel mit denen in geschlechtsgleichen gesunden Kontrollmäusen verglichen, die keine EAE hatten. Es wurde festgestellt, dass Mäuse mit EAE viel höhere sNF-L-Spiegel aufwiesen als gesunde Mäuse (Abbildung 7A) und diese Werte mit der Dichte von SMI-32+-Axonen im Rückenmark korrelierten (Abbildung 7B). Im Vergleich zum histologischen Scoring von axonalen Verletzungen ist der SIMOA-Assay schneller (von blutenden Mäusen bis zu Ergebnissen können in etwas mehr als einem halben Tag erreicht werden) und liefert daher eine schnelle Rückmeldung darüber, wie eine Behandlung bei lebenden Mäusen wirkt. Dieser Assay hat auch den Vorteil, dass er axonale Verletzungen sowohl im Rückenmark als auch im Gehirn widerspiegelt.

Abbildung 1: Repräsentativer Paraffinblock von Hirn- und Rückenmarksschnitten. Die 5 koronalen Hirnschnitte und Rückenmarksquerschnitte (1,5–2 mm dick) sind in denselben Block eingebettet, so dass sie in einem Abschnitt geschnitten werden können. Mindestens 15 Abschnitte des Rückenmarks sollten eingebettet sein, um eine angemessene Auswahl der Abschnitte für die Analyse zu ermöglichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
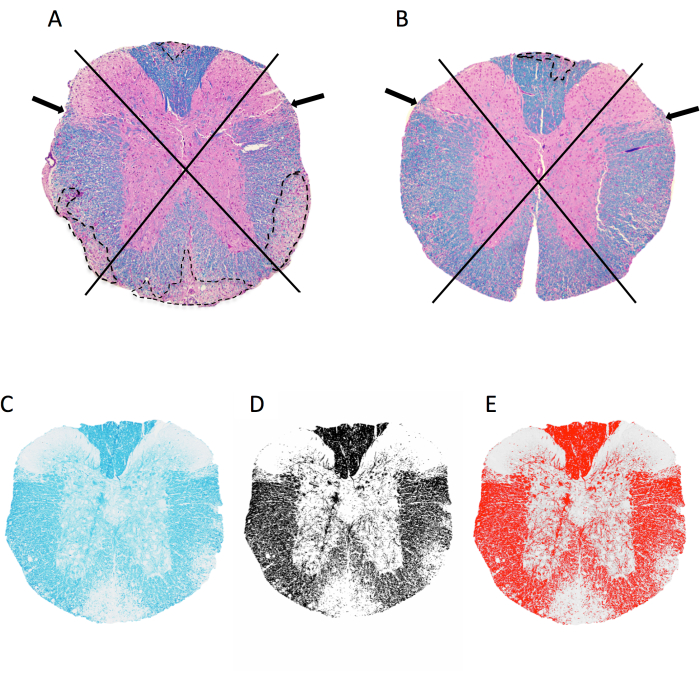
Abbildung 2: Bewertung der meningealen Entzündung und der prozentualen Myelinfläche auf der Ebene des thorakalen Rückenmarks. (A,B) zeigen Bilder des thorakalen Rückenmarks von einer weiblichen C57BL6/J-Maus mit MOG p35-55-induzierter EAE, die mit LFB/H&E gefärbt wurde. Gezeigt wird der Ansatz zur Visualisierung von Quadranten und Beispielen für demyelinisierende Läsionen (nachgezeichnet in einer gestrichelten Linie). Bei der Maus in A sind 4 von 4 Quadranten mit konfluierenden demyelinisierenden Läsionen betroffen, während bei der Maus in B 1 von 4 Quadranten betroffen sind. Die Maus in B hat eine Entzündung in anderen Quadranten, aber diese hat sich nicht in einer konfluierenden Läsion manifestiert und wird daher nicht bewertet. (C–E) Beispiel für ein LFB-Bild und das Graustufen- und Schwellenbild in imageJ. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
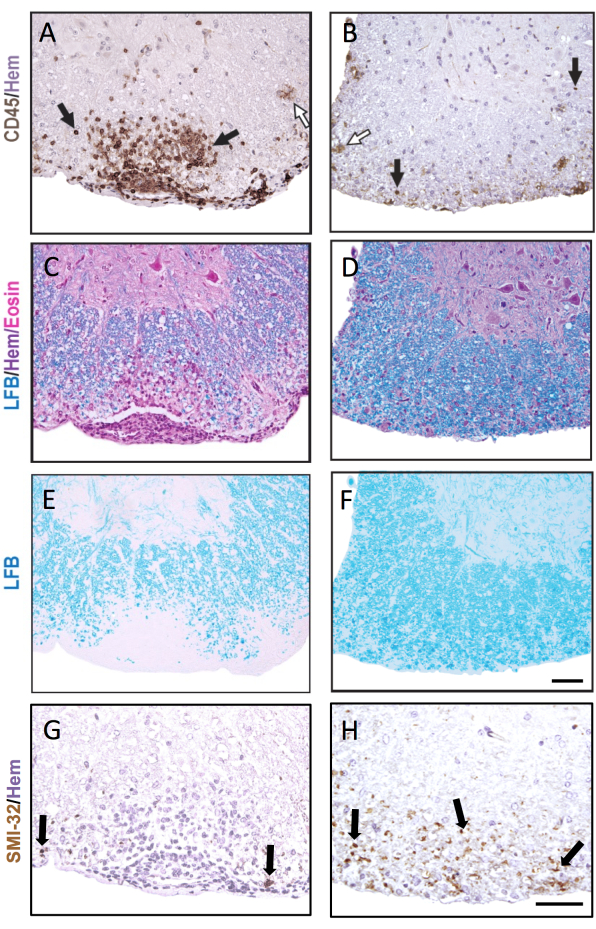
Abbildung 3: Rückenmarksschnitte, die mit CD45, LFB H&E, LFB und SMI-32 gefärbt sind. Beispiele für eine frühe (A,C,E,G) und späte (B,D,F,H) SUBMENINGEALE LÄSION IM RÜCKENMARK, GEFÄRBT FÜR CD45-Antikörper (A,B), LFB/H&E (c,D), LFB allein (E,F) und SMI-32-Antikörper (G,H). Schwarze Pfeile zeigen Beispiele für Zellen, die mit dem jeweiligen Antikörper gefärbt sind. Weiße Pfeile zeigen mutmaßliche Mikroglia, die als CD45+ gefärbt wurden. Maßstabsbalken = 50 μm. Diese Abbildung zeigt eine repräsentative Färbung von Läsionen im Rückenmark einer weiblichen C57BL6/J-Maus während der EAE und zeigt, wie unterschiedlich die Pathologie in verschiedenen Rückenmarksabschnitten sein kann. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
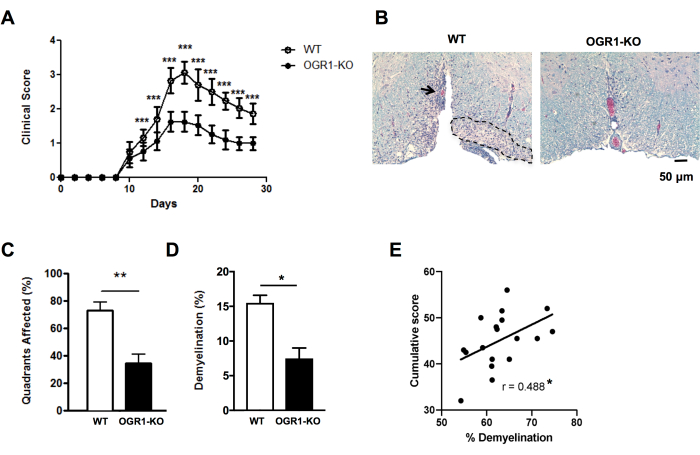
Abbildung 4: Anwendung des Scorings für Läsionen und prozentuale Demyelinisierung bei EAE. Gezeigt wird ein Beispiel für ein EAE-Experiment, bei dem weibliche Mäuse mit einem Mangel an Ovarialkarzinom-G-Protein-gekoppeltem Rezeptor 1 (OGR1)-Gen auf dem C57BL6/J-Hintergrund weniger schwere klinische EAE entwickelten als weibliche Wildtyp-Mäuse mit C57BL6/J. Die EAE wurde durch Immunisierung mit MOG p35-55/CFA plus PTX induziert und die Mäuse wurden nach der folgenden klinischen Skala bewertet: 1 = Schwanzlähmung. 2 = Schwäche der Hintergliedmaßen und des Fußes, 3 = Lähmung der Hintergliedmaßen, 4 = Schwäche der Vordergliedmaßen, 5 = Moribund. (A) Mittelwert + REM-klinische Werte von Mäusen im Zeitverlauf. (B) Abgebildet ist ein Beispiel für eine LFB/H&E-Färbung im ventralen Rückenmark. Maßstabsbalken = 50 μm. (C) Mittelwert + REM-Prozentquadranten mit demyelinisierenden Läsionen. (D) Mittelwert + SEM-prozentuale Demyelinisierung in jeder Gruppe. (E) zeigt das Ergebnis eines anderen Experiments mit MOG p35-55-induzierter EAE bei C57BL6/J-Mäusen, bei dem die EAE-Werte einzelner Mäuse über die 30 Beobachtungstage summiert und mit der prozentualen Demyelinisierung im Rückenmark korreliert wurden. Die Korrelationen wurden mit einem Spearman-Test durchgeführt. Die Panels in (A–D) sind von Souza C et al.29 adaptiert. Bei den Daten in (E) handelt es sich um Originaldaten. *P<0,05, **P<0,01, ***P<0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
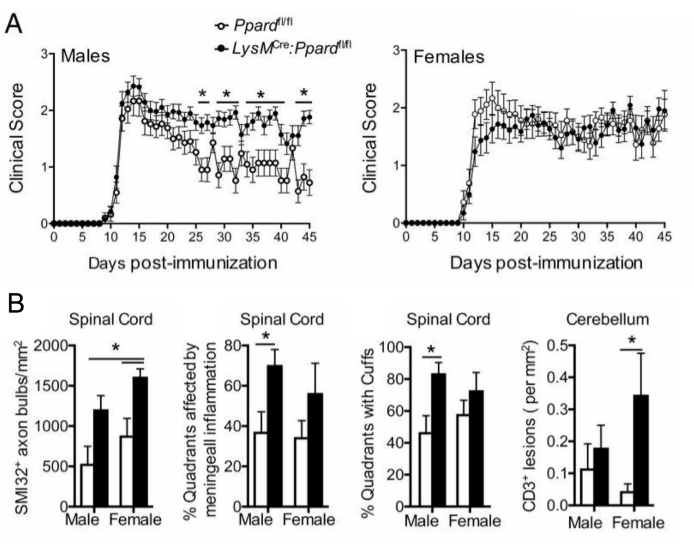
Abbildung 5: Anwendung der SMI-32-Färbung, um die Wirkung eines Genotyps auf den klinischen EAE-Phänotyp zu verstehen. Diese Abbildung zeigt ein Beispiel für ein EAE-Experiment, bei dem männliche und weibliche Wildtyp-Mäuse (tragen das gefloxte Allel von Ppard) und myeloische spezifische Ppard-mutierte Mäuse (LysMCre: Ppardfl/fl) auf dem C57BL6/J-Hintergrund mit MOG p35-55/CFA und PTX immunisiert und 45 Tage lang beobachtet wurden. (A) zeigt den Mittelwert + die klinischen REM-Werte von Mäusen. (B) zeigt mittlere + REM-Ergebnisse der histologischen Bewertung der Anzahl der SMI-32+ -Axone im Rückenmark, %Quadranten mit submeningealen Läsionen, prozentuale Quadranten mit perivaskulären Manschetten und #CD3 Läsionen im Kleinhirn pro mm2 Gewebe. Dieses Experiment zeigte einen Genotyp-Effekt auf die SMI-32-Färbung. Diese Figur ist eine Adaption von Drohomyrecky. et al.15. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
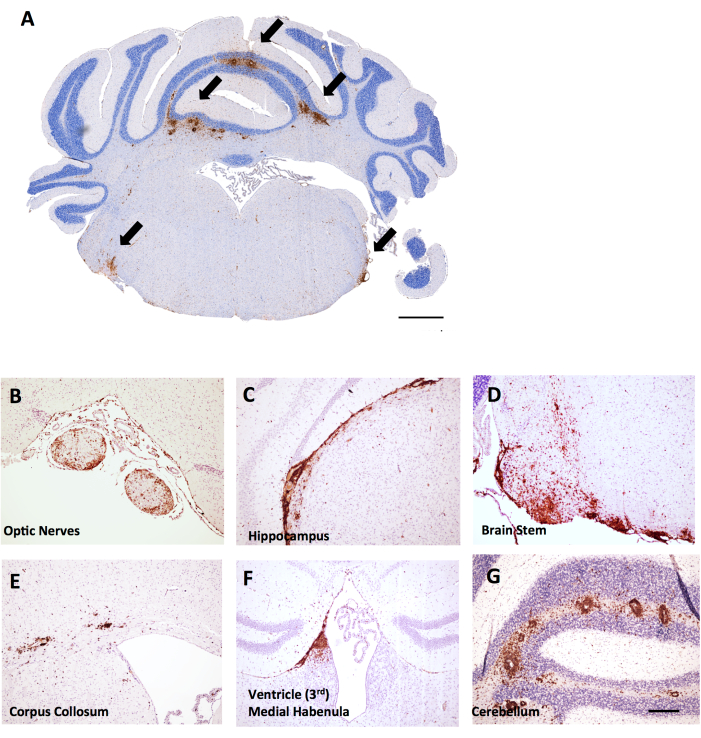
Abbildung 6: Beispiele für CD45+/Hämatoxylin-Färbung in koronalen Hirnschnitten in MOG p35-55-induzierter EAE in weiblichen C57BL6/J-Mäusen. CD45+ Läsionen sind braun dargestellt. (A) CD45+ -Läsionen im Hirnstamm von koronalen Schnitten. Maßstabsleiste = 150 μm. (B–G) Beispiele für CD45+ -Läsionen in den Sehnerven (B), meningeale Fortsätze unter dem Hippocampus (C), dem Hirnstamm (D), dem Corpus collosum (E), der medialen Habenula in der Nähe des Ventrikels (F) und dem Kleinhirn (G). Maßstab: (B–G) = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
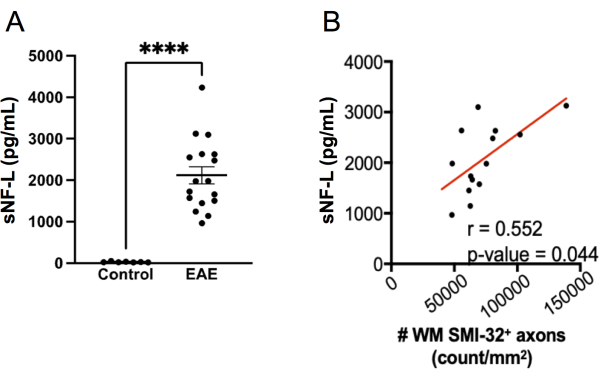
Abbildung 7: sNF-L-Spiegel im Serum in MOG p35-55-induzierter EAE. (A) Serum-NFL-Spiegel, die von weiblichen Kontroll- und EAE-Mäusen am Endpunkt eines Experiments gesammelt wurden. Die Daten wurden mit einem zweiseitigen Mann-Whitney-Test analysiert. (****p-Wert < 0,0001). (B) Rückenmarksabschnitte wurden am Endpunkt entnommen und mit SMI-32 gefärbt. Die Anzahl der positiven Zellen pro Gewebebereich der weißen Substanz wurde bestimmt und mit einem Spearman-Test mit dem Serum-NF-L am Endpunkt korreliert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Tabelle 1: Beschreibung der Bäder, die bei der Gewebeverarbeitung verwendet werden. Die Kassetten werden mit Hilfe eines automatisierten Prozessors automatisch durch diese Badreihen bewegt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 2: Schritte bei der Luxol-Fast-Blue- und Hämatoxylin- und Eosin-Färbung. Diese Tabelle zeigt die Reihenfolge der Schritte im Luxol Fast Blue und Hämatoxylin- und Eosin-Färbeprotokoll. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 3: Antikörper für die immunhistochemische Färbung. Beschrieben werden die Antikörper, die in diesem Protokoll verwendet werden, sowie diejenigen, die zur weiteren Erforschung von Entzündungen, Mikrogliose und Astrogliose verwendet werden können. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 4: So konvertieren Sie .czi in TIFF-Dateien. Beachten Sie, dass es optimal ist, ein hochauflösendes Bild zu verwenden, aber stattdessen Bilder mit mittlerer Auflösung gespeichert werden können, wenn der Arbeitsspeicher des Computers begrenzt ist. Es ist zwingend erforderlich, Bilder mit gleicher Auflösung für alle Analysen zu verwenden. Beachten Sie außerdem, dass das letzte Bild der Serie die Folienbeschriftung ist. Vermeiden Sie es, das Etikett zu lesen, um sicherzustellen, dass die Analyse verblindet ist. 30,31 Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die histologische Färbung des Rückenmarks ist ein wichtiges Instrument zur Beurteilung des Schweregrads der EAE-Erkrankung, insbesondere in Fällen, in denen es Unterschiede zwischen den Behandlungsgruppen im Ausmaß der Genesung der Erkrankung in der postakuten Phase der Erkrankung gibt. Die Färbung auf Immunzellinfiltration (CD45), Myelin (LFB) und axonale Schädigung (SMI-32) hilft dabei, die zugrunde liegende Ursache für die veränderten klinischen Werte bei Mäusen zu charakterisieren. Das hier beschriebene histologische Färbeprotokoll gibt einen Überblick über die Entzündung sowie das Ausmaß der Myelin- und axonalen Verletzung. Darüber hinaus validieren die gezeigten Ergebnisse die sNF-L-Messung als Methode zur Beurteilung des Ausmaßes der neuronalen Gesamtschädigung bei EAE.
Die kritischen Parameter für diese Analyse bestehen darin, sicherzustellen, dass die Forscher für die Identität der Abschnitte blind sind und dass es auf jeder Ebene des Rückenmarks gleichwertige Proben für die verschiedenen Mäuse gibt. Dies liegt daran, dass die Schwere der Entzündung auf niedrigeren Ebenen der Nabelschnur größer sein kann. Ein weiterer kritischer Parameter ist die Größe der Versuchsgruppen. Rückenmark und Gehirn werden in der Regel von 6-8 Mäusen pro Gruppe am Endpunkt entnommen, um signifikante Unterschiede zwischen Gruppen mit Behandlungen oder Genotypen mit bescheidenen Effektstärken zu sehen. Es ist auch wichtig sicherzustellen, dass ausgewählte Mäuse im Durchschnitt repräsentative Mittelwerte der gesamten Gruppe aufweisen. In Bezug auf die Fehlerbehebung ist ein häufiges Problem, auf das diejenigen, die mit dem Protokoll unerfahren sind, stoßen, dass das Rückenmark nicht ausreichend lange fixiert ist und nicht leicht aus der Wirbelsäule herausgepresst werden kann. Ist dies der Fall, kann das Rückenmark manuell von der Säule abgetrennt werden, indem man mit einer feinen Schere entlang der Dornfortsätze schneidet und die Säule öffnet, um das Rückenmark freizulegen. Alternativ kann das Gewebe für einige zusätzliche Tage fixiert werden, ohne den Erfolg der Antikörperfärbung zu beeinträchtigen. Die hier beschriebenen Antikörperklone wirken in Gewebe, das bis zu 2 Wochen in Formalin fixiert ist.
Das Einbetten der Rückenmarksstücke erfordert Geschick und Übung. Es wird empfohlen, Augenlupen zu tragen und eine Lampe über die Einbettstation zu richten, um besser erkennen zu können, ob die Abschnitte im Querschnitt oder im Längsschnitt fallen. Wenn Sie die Längen der Rückenmarksstücke während der Grobung auf weniger als 2 mm halten, können sie im Querschnitt fallen. Ein weiteres häufiges Problem, das bei weniger erfahrenen Anwendern auftritt, ist, dass der LFB während der nächtlichen Inkubation verdunstet, so dass die Hälfte des Objektträgers gefärbt und die andere Hälfte ungefärbt bleibt. Um Verdunstung zu vermeiden, sollte die Glasfärbeschale mit thermoplastischer Folie und anschließend mit Plastikfolie verschlossen werden. Wenn es zu Verdunstung kommt und Abschnitte ungleichmäßig gefärbt sind, empfiehlt es sich, die Objektträger mit Lithiumcarbonat vollständig zu entblauen, und über Nacht erneut in LFB zu färben. Ein weiteres häufiges Problem ist, dass Benutzer die graue Substanz nach LFB nicht vollständig entblauen. Es ist wichtig, einzelne Abschnitte unter dem Mikroskop zu untersuchen, um sicherzustellen, dass eine ausreichende Menge an Entbrühung erreicht wurde, bevor mit anderen Schritten im Protokoll fortgefahren wird. Obwohl die CD45- und SMI-32-IHC-Färbungen robust funktionieren, ist es dennoch wichtig, die Antikörperkonzentrationen in Vorexperimenten für jede neu erhaltene Antikörpercharge zu beheben. Dies kann erfolgen, indem eine Vielzahl von Konzentrationen des Antikörpers an einem positiven Kontrollabschnitt (EAE-Rückenmark) getestet wird. Die erstmalige Färbung sollte auch eine Negativkontrolle umfassen, die nur aus einem Sekundärantikörper ohne Zusatz von Primärantikörpern besteht. Schließlich ist es bei der Bildanalyse wichtig, einzelne Bilder zu begrenzen, da die Verfärbung über Objektträger oder Abschnitte hinweg ungleichmäßig sein kann.
Dieses Protokoll verwendet frei verfügbare Software. Wenn man keinen Zugang zu einem Prozessor, einem Embedder oder Mikrotom hat, können diese Schritte an einen krankenhausbasierten Pathologiekern übergeben werden, der diese Dienste anbietet. Wenn man keinen Zugang zu einem Objektträgerscanner hat, kann man auch ein Lichtmikroskop verwenden, das mit einer Videokamera ausgestattet ist, um TIFF-Bilder des Rückenmarks oder der Gehirnregionen zu speichern. Für einen mikroskopbasierten Arbeitsablauf erfassen Sie LFB- oder LFB/H&E-Schnitte bei geringer Leistung (40-fache Vergrößerung) und für CD45- und SMI-32-Färbungen mindestens vier Fenster, die in den ventralen, dorsalen und lateralen Teilen des Rückenmarks zentriert sind (200-fache Vergrößerung für CD45 und 400-fache Vergrößerung für SMI-32). An diesen Bildern kann eine Bildanalyse durchgeführt werden, um die Färbung auf ähnliche Weise wie beschrieben zu quantifizieren.
Die Entscheidung, welcher histologische Ansatz zur Bewertung der EAE gewählt werden soll, hängt davon ab, wie stark sich die klinischen Werte zwischen den Gruppen unterscheiden. Wenn es beispielsweise drastische Unterschiede im klinischen EAE-Score gibt (eine Gruppe erhielt EAE und eine Gruppe nicht), hängt dies in der Regel mit Unterschieden in der peripher vermittelten Entzündung zusammen. In diesem Fall ist ein Scoring für das Vorhandensein von demyelinisierenden Läsionen auf LFB/H&E-gefärbten Schnitten ausreichend und zeigt Unterschiede zwischen den Gruppen auf. Wenn sich die Gruppen zu Beginn des klinischen Scores ähnlicher sind und es stattdessen Unterschiede im Ausmaß der klinischen Genesung gibt (z. B. Experiment in Abbildung 5A), ist es am besten, den hier beschriebenen vollständigen histologischen Arbeitsablauf anzuwenden, einschließlich der Bewertung der Hirnentzündung im Hirnstamm und im Kleinhirn, um zu unterscheiden, ob die Unterschiede in der Krankheitschronizität mit Unterschieden in der Entzündung oder der Gewebeschädigung zusammenhängen. Wenn Unterschiede in der Entzündung festgestellt werden, die durch CD45-Zählung beurteilt werden, können weitere IHC-Studien durchgeführt werden, um T-Zellen (Anti-CD3), infiltrierende Monozyten/Makrophagen (Mac3) und Mikroglia (Iba-1/TMEM119) zu färben (empfohlene Antikörperklone sind in der Zusatztabelle 3 aufgeführt). Die Aktivierung der Mikroglia spiegelt sich in einer Erhöhung der Intensität der Iba-1-Färbung auf doppelt markierten Iba-1+TMEM-19+ -Mikroglia und einer erhöhten Retraktion der Mikrogliaprozesse wider, die durch die Sholl-Analyse in Sektionen32 beurteilt werden können. Darüber hinaus können Techniken wie Durchflusszytometrie oder Einzelzell-RNA-Sequenzierung angewendet werden, um eine tiefere Charakterisierung der Häufigkeit und des Phänotyps von Immunpopulationen im Gehirn und Rückenmark durchzuführen.
Die Zählung von SMI-32+ Axonen ist eine empfindliche Methode zum Nachweis von Axonverletzungen in EAE32,33 und in MS34. SMI-32, das die nicht-phosphorylierte Form von Neurofilamenten erkennt, die schwer oder mittel sind, reichern sich in den Endbulben der durchtrennten Neuronen an. Eine Alternative zum Nachweis verletzter Axone ist die Färbung mit Amyloid-Vorläuferprotein (APP), das sich infolge eines gestörten Axontransports in Axonen anreichern kann33. Das Färbemuster für SMI-32 und APP überlappt sich in der Regel nicht, obwohl beide eine Axonverletzung widerspiegeln, was darauf hindeutet, dass sie unterschiedliche Pathologien erkennen33. Man kann die histologischen Messungen der Axonverletzung auch durch die Messung von sNF-L ergänzen, die ein schnelles und sensitives Maß für eine laufende axonale Verletzung sowohl im Rückenmark als auch im Gehirn ist. Es bietet den Vorteil, dass es in einem halben Tag bei lebenden Mäusen durchgeführt werden kann. Ein Nachteil dieser Methode ist, dass die Kits teuer sind und die Maschine hochspezialisiert ist. Das Unternehmen, das das sNF-L-Kit verkauft, bietet eine Servicegebühr für diejenigen an, die keinen Zugang zu einer SIMOA-Maschine haben. Eine Alternative zur Beurteilung der Axonverletzung besteht darin, den Axonverlust zu bewerten, indem entweder Axone in toluidinblau gefärbten Abschnitten des Rückenmarks12 gezählt werden oder Neurofilamentbündel gezählt werden, die von SMI-31 in Bereichen der weißen Substanz des Rückenmarks nachgewiesen werden32. Beides sind aufwändigere Ansätze als die SMI-32- oder sNF-L-Messung.
Wenn sich die klinischen EAE-Scores zwischen den Gruppen unterscheiden, aber das Scoring für Entzündung, Demyelinisierung und axonale Schädigung keine Unterschiede zwischen den Gruppen zeigt, kann es sinnvoll sein, die Astrozytenaktivierung mit GFAP zu färben (siehe Ergänzende Tabelle 3 für den empfohlenen Antikörperklon). Die Aktivierung von Astrozyten ist mit einer Zunahme der GFAP-Färbung verbunden, und es wurde gezeigt, dass dies mit der EAE-Progression in einigen EAE-Modellen korreliert, einschließlich chronischer EAE bei der DA-Ratte35.
Zusammenfassend beschreibt dieses Protokoll Methoden und bietet einen Analyse-Workflow zur Durchführung eines histologischen Scorings von EAE.
Offenlegungen
Shannon Dunn berät FSD Lucid Psycheceuticals.
Danksagungen
Wir danken Dr. Raymond Sobel (Stanford University) für seine Methode, Gehirn- und Rückenmarksschnitte zu groben und zu fixieren. Wir danken Kyle Roberton und Milan Ganguly vom Toronto Centre for Phenogenomics für das Erlernen der Einbettungsmethode und dafür, dass sie so viele unserer Gehirn- und Rückenmarksabschnitte durchtrennt haben. Wir danken Dr. Matthew Cussick und Dr. Robert Fujinami (University of Utah) für die Bereitstellung ihrer Protokolle zur Bewertung submeningealer und perivaskulärer Entzündungen im Rückenmark. Wir danken Shalina Ousman für die Bereitstellung des Klons des CD45-Antikörpers. Wir danken Xiofang Lu für die Schulung am Gewebeprozessor und an der Gewebeeinbettungsstation sowie für die Wartung dieser Geräte im Keenan Research Centre of Biomedical Research am St. Michael's Hospital. Diese Arbeit wurde durch ein biomedizinisches Stipendium von MS Canada (an SED) unterstützt. Carmen Ucciferri wird durch ein Stipendium der kanadischen Regierung unterstützt. Nuria Alvarez-Sanchez wird durch ein Keenan-Postdoktorandenstipendium unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
Referenzen
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten