Method Article
Estudio de la iniciación de la muerte celular mediante un microscopio digital
* Estos autores han contribuido por igual
En este artículo
Resumen
En este trabajo se presenta un protocolo para estudiar la tasa de inicio de la muerte celular programada mediante la obtención de imágenes continuas de las hojas inoculadas después de la inducción de la muerte celular.
Resumen
La resistencia conferida por la respuesta hipersensible (HR) es una respuesta de defensa eficaz que puede ser determinada por los genes de resistencia N . La HR se manifiesta como la formación de zonas de muerte celular en las hojas inoculadas. Aquí, se presenta un protocolo para estudiar la tasa de inicio de la muerte celular mediante la obtención de imágenes de hojas inoculadas en el tiempo entre el inicio de la muerte celular y la aparición de la muerte celular utilizando un microscopio digital. El microscopio digital permite un proceso continuo de obtención de imágenes en los intervalos deseados, lo que permite una determinación precisa de la tasa de inicio de la muerte celular de hasta minutos exactos, a diferencia de las horas de los métodos tradicionales. Las imágenes con el microscopio digital también son independientes de la luz y, por lo tanto, se pueden utilizar durante el día y la noche sin perturbar el ritmo circadiano de la planta. Con este protocolo se podrían estudiar diferentes sistemas patológicos que dan lugar al desarrollo de la muerte celular programada con pequeñas modificaciones. En general, el protocolo permite una identificación simple, precisa y económica de la tasa de inicio de la muerte celular.
Introducción
La papa es uno de los cultivos alimentarios más cultivados en el mundo, ocupando el cuarto lugar detrás del arroz, el trigo y el maíz. Sin embargo, la producción de papa puede verse gravemente afectada por el virus Y de la papa (PVY), que actualmente se considera su patógeno viral más importante 1,2. En plantas de papa cv. Rywal, varias cepas de PVY (incluida la cepa de PVY N-Wilga) desencadenan una resistencia conferida por la respuesta de hipersensibilidad (HR), donde la restricción del patógeno al sitio de infección se manifiesta como lesiones necróticas en las hojas inoculadas3. En este patosistema, la HR está mediada por el gen de resistencia Ny-1, que depende de la temperatura, ya que las plantas cultivadas a temperaturas más bajas desarrollan eficientemente lesiones necróticas, mientras que en las plantas cultivadas constitutivamente a temperatura elevada (28 °C), el aborto de la resistencia se demuestra como falta de formación de lesiones y diseminación sistémica del virus 3,4. Cuando las plantas se transfieren a una temperatura más baja (22 °C), se inicia la muerte celular, que puede aprovecharse para seguir la tasa de inicio de la muerte celular mediante la obtención de imágenes de hojas inoculadas en el tiempo entre el inicio de la muerte celular y la aparición de la muerte celular.
Este protocolo demuestra un método simple para la determinación de la tasa de inicio de la muerte celular utilizando un microscopio digital. Al obtener imágenes de las hojas inoculadas después de transferir la planta de 28 °C a 22 °C, un microscopio digital permite la observación continua de la hoja en los intervalos deseados. A diferencia del uso de otros métodos (por ejemplo, microscopía confocal u observación de la formación de la lesión a simple vista), este permite determinar el momento exacto de formación de la lesión y, por lo tanto, la tasa de inicio de la muerte celular hasta minutos exactos, a diferencia de las horas de los métodos mencionados 5,6. El uso del microscopio digital también es independiente de la luz y, por lo tanto, se puede utilizar durante el día y la noche. Este protocolo también se puede utilizar para identificar los componentes involucrados en el inicio de la muerte celular o para determinar los efectos de diferentes componentes en la tasa de inicio de la muerte celular si las plantas utilizadas son transgénicas y tienen niveles alterados de componentes de interés.
Protocolo
NOTA: Las secciones 1 y 2 describen un protocolo modificado para la preparación de material vegetal basado en los métodos descritos por Lukan et al.7. Específicamente, se realizaron algunas modificaciones a las condiciones ambientales controladas y a la preparación del inóculo.
1. Cultivo de plantas de papa
- Cultive papas sanas cv. Plantas de Rywal en cultivo de tejidos de nodos de tallo8.
- Después de 6-8 semanas, corte diez explantes de 1 cm de largo que contengan nudos de plantas de papa en papel estéril en condiciones estériles con pinzas estériles y un bisturí.
- Transfiéralos a cajas de plástico con medio Murashige y Skoog (MS30) (Figura 1A) y cultívelos en condiciones ambientales controladas (22 °C a la luz y 19 °C en la oscuridad con una radiación de 250 μE o μmol/m2/s y un fotoperiodo de 16 h, a una humedad relativa del 55% ± 5%).
- Transfiéralos al suelo 2 semanas después de la micropropagación.
- Llene las macetas (r = 10 cm) con tierra. Use un dedo para crear un agujero de 3-4 cm de profundidad en la tierra en el medio de una maceta, llene el agujero con agua y espere a que se absorba.
- Coloque una planta por maceta en el hoyo, dejando las hojas por encima de la superficie. Cubra suavemente las raíces con tierra (Figura 1B).
NOTA: Es posible que algunas plantas no desarrollen raíces. Excluya esas plantas del análisis.
- Cultivar las plantas en suelo en una cámara de crecimiento en condiciones ambientales controladas (22 °C a la luz y 19 °C a la oscuridad, a una humedad relativa del 55% ± 5%, con una radiación de 250 μmol/m2/s y un fotoperiodo de 16 h).
- Después de 3-4 semanas, las plantas están listas. Utilice estas plantas para ser inoculadas.
NOTA: Las plantas deben tener al menos 3-4 hojas completamente desarrolladas con folíolos visibles (Figura 1C). Deben tener un aspecto sano, sin síntomas visibles (hojas amarillas o marrones), que podrían confundirse con lesiones causadas por PVY. Para lograr resultados comparables, las plantas deben ser inoculadas al mismo tiempo (por ejemplo, a las 9 am) en todos los experimentos para evitar posibles efectos del ritmo circadiano sobre la respuesta inmune de las plantas y la formación de lesiones 9,10,11.
2. Preparación del inóculo e inoculación de la patata
- Inocular la planta con la cepa de PVY N-Wilga (PVYN-Wi; n.º de accesión. EF558545) Inóculo como se indica a continuación.
NOTA: Se pueden inocular más plantas en paralelo si se dispone de más de un microscopio digital. Las plantas deben tener al menos tres hojas completamente desarrolladas antes de la inoculación (Figura 1C). PVYN-Wi se multiplica y se mantiene en patata cv. Pentland.- Preparar tampón fosfato, suplementado con dietilditiocarbamato de sodio (DIECA), para la inoculación: Mezclar 1,3 mL de 0,2 M de NaH 2 PO 4 0,2, 8,7 mL de0,2M deNa2HPO4 y 0,225 g de DIECA. Aumente el volumen a 100 ml con ddH20. Ajuste el pH a 7,6 añadiendo 1 M de NaOH o 1 M de solución de HCl.
- Coseche 6-8 semanas de edad de papa infectada PVYN-Wi cv. Plantas Pentland a partir del cultivo de tejidos en bolsas de extracción con red filtrante (0,5 g por 6 plantas) y añadir tampón fosfato suplementado con DIECA (4x masa de material vegetal, relación masa:volumen). Utilice un homogeneizador manual durante 1-2 minutos para obtener una solución homogénea.
- Espolvoree ligeramente las tres primeras hojas inferiores completamente desarrolladas de plantas de papa de 3-4 semanas (del paso 1.6) con polvo de carborundo.
NOTA: Ajuste la cantidad de polvo de carborundo. Demasiado puede causar daño, mientras que muy poco puede resultar en una infección ineficaz. Óptimamente, se utiliza 0,1 mg/cm de polvo de carborundo, que es aproximadamente 1,5 mg de polvo por hoja de tamaño medio (aproximadamente 15cm2). - Frote suavemente las hojas con el inóculo (~100 μL por hoja). Después de 10 minutos, lave bien las hojas con agua del grifo.
- Tenga cuidado de no dañar las hojas. No exceda el tiempo de incubación. Ajuste la cantidad de inóculo de acuerdo con el tamaño de la hoja: 6,5 μL / cm, que es aproximadamente 100 μL por hoja de tamaño promedio (aproximadamente 15 cm2).
- Transfiera las plantas a una cámara de crecimiento y cultívelas en condiciones ambientales controladas (28 °C a la luz y 28 °C en la oscuridad a una humedad relativa del 55% ± 5%, con una radiación de 250 μmol/m2/s y un fotoperiodo de 16 h) durante 3 días.
3. Preparación de la planta y uso del microscopio digital para registrar el desarrollo de la lesión
- Transferir las plantas inoculadas de la cámara de crecimiento mantenida a 28 °C a una cámara de crecimiento a 22 °C 3 días después de la inoculación, con otras condiciones como las descritas en el paso 1.5.
- Seleccione una planta para observarla. Inmovilizar la segunda hoja inoculada con cinta adhesiva (Figura 1D). Asegúrese de que la hoja deseada esté completamente inmovilizada antes de comenzar con la toma de imágenes (Figura 1D).
- Instale una aplicación de software para la captura de imágenes en la computadora portátil. Conecte el microscopio digital a la computadora. Abra el software.
NOTA: Asegúrese de que la planta, el microscopio digital y la computadora portátil estén colocados en el estante cerca del enchufe para enchufar la computadora. La decisión sobre la selección de las hojas que se van a controlar puede depender de la cuestión biológica estudiada, por ejemplo, el tipo de proceso que conduce a la formación de una muerte celular programada limitada. - Ajuste el microscopio por encima de la hoja inmovilizada. Enfoque con el dial del microscopio digital (que se muestra en la Figura 1E).
- Asegúrese de que la línea de visión sea lo más amplia posible para aumentar las posibilidades de capturar la formación de la lesión, pero que aún así se amplíe lo suficiente como para detectar la apariencia de la lesión (por lo general, se usa un aumento de 25x).
- Establezca la configuración de la cámara. Haga clic en el botón Configuración en la esquina superior derecha de la imagen (Figura 2A, parte 1 encerrada en un círculo) y ajuste la configuración de la cámara: Brillo (60-70), Contraste (10-15), Tono (0), Balance de blancos, Saturación (45-50), Nitidez (0), Gamma (5) (Figura 2B). Los ajustes utilizados en este estudio fueron los siguientes: Brillo (64), Contraste (14), Tono (0), Saturación (47), Nitidez (0), Gamma (5).
NOTA: La configuración de la cámara debe ajustarse a la luz exterior para garantizar la mejor calidad de imagen. Los ajustes se pueden adaptar de acuerdo con las condiciones del usuario en la cámara de crecimiento. - Establezca la configuración de captura de imágenes haciendo clic en el icono de Captura de imágenes (Figura 2C, parte 2 encerrada en un círculo). Haga clic en el botón Time-Lapsed Video y configure la captura de imágenes cada 15 minutos durante 24 h (Figura 2C).
NOTA: El intervalo entre las imágenes tomadas y la duración de la imagen es totalmente flexible y puede adaptarse según las necesidades del experimento. En el tiempo entre la captura de imágenes, la luz LED se apaga. La luz LED se enciende automáticamente durante la captura de imágenes. - Inicie la captura de imágenes haciendo clic en el botón INICIO (Figura 2C).
NOTA: Después de ser transferidas de 28 °C a 22 °C, las plantas deben comenzar a desarrollar lesiones dentro de las 24 h. De lo contrario, esto podría ser un signo de inoculación ineficaz. Ajuste la cantidad de polvo de carborundo, asegúrese de que el tiempo de incubación del inóculo en las hojas sea correcto y determine la abundancia del virus en el inóculo mediante qPCR. - Para guardar las imágenes, seleccione todas las imágenes y haga clic en el icono Guardar (Figura 2B, parte 3 encerrada en un círculo). Establezca las opciones de exportación. Establezca PPP en el máximo (300) (Figura 2D). Después de guardar, elimine todas las imágenes del programa.
- Para el análisis de imágenes, cualquier programa para la visualización/edición de imágenes es suficiente. A continuación se explica el uso del software gratuito para la edición de imágenes, ImageJ.
- Importe la secuencia temporal de imágenes desde un único campo de visión (en la esquina superior izquierda, haga clic en Archivo, seleccione Importar y, a continuación, Secuencia de imágenes). Pegue la ruta del directorio de imágenes guardadas y presione el botón OK para iniciar la conversión.
- Después de la conversión, el software abre automáticamente un reproductor de video interno que muestra el video final. Exporte el archivo de video haciendo clic en la opción Archivo > Guardar como y seleccionando Formato AVI. Se abre una pequeña ventana. Establezca la velocidad de fotogramas en 0.3 fps y presione OK para guardar el video como un archivo de video AVI.
NOTA: El tiempo de desarrollo de la lesión también se puede determinar revisando manualmente todas las imágenes y encontrando una imagen donde aparece la lesión.
Resultados
Este estudio demuestra un protocolo paso a paso para estudiar el inicio de la muerte celular a través de la aparición de lesiones en la papa cv. Rywal, con un microscopio digital. Esto permite determinar el momento exacto de inicio de la muerte celular programada.
Las plantas que han desarrollado raíces se colocaron en el suelo 2 semanas después de la papa cv. Micropropagación de Rywal (Figura 1A,B). Después de 3-4 semanas de crecimiento en las condiciones descritas, se utilizaron plantas con al menos 3-4 hojas completamente desarrolladas con folíolos visibles que parecían saludables, sin signos de abscisión, para un análisis posterior (Figura 1C). Utilizando un microscopio digital como se describe en este protocolo, observamos la misma área en la hoja inoculada a intervalos de 15 minutos y determinamos la aparición y expansión de la lesión en el tiempo (Figura 3). La lesión se produjo a las 15 h 30 min (Figura 3).

Figura 1: Preparación de la planta para su análisis con un microscopio digital. (A) Una caja de plástico con medio MS 30 y cv de patata. Explantes de plantas de Rywal que contienen nudos. (B) Patata cv. Planta de Rywal en el suelo (2 semanas después de la micropropagación). c) Patata cv. Planta de Rywal, lista para la inoculación (4 semanas después de ser puesta en el suelo), con al menos tres hojas completamente desarrolladas. (D) Segunda hoja inoculada (flecha) de papa cv. Planta de Rywal colocada e inmovilizada (flecha) con cinta adhesiva. (E) Planta colocada bajo el microscopio digital con la flecha apuntando al dial utilizado para enfocar. Haga clic aquí para ver una versión más grande de esta figura.
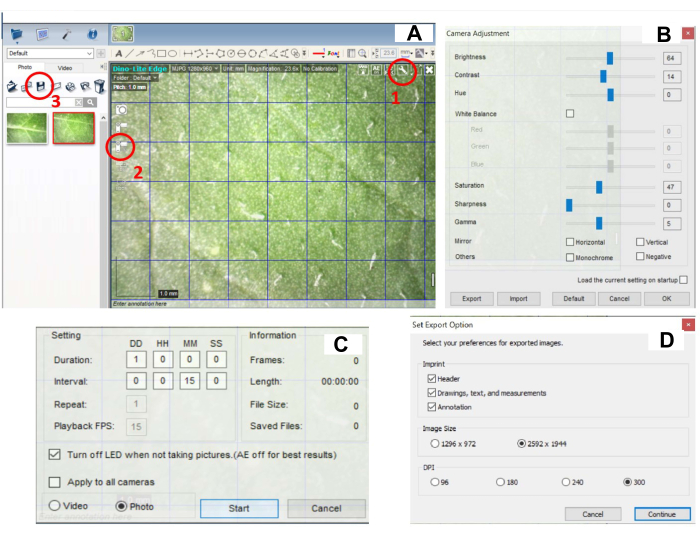
Figura 2: Configuración del software digital para registrar el desarrollo de la lesión. (A) Interfaz de software: marcadas con un círculo rojo están las opciones para el botón para (1) configuración de la cámara, (2) configuración de captura de imágenes y (3) guardado de imágenes. (B) Ventana con la configuración de la cámara, que se abre con un clic en (1) en el panel A. El brillo, el contraste, la saturación, la nitidez y la gamma deben ajustarse correctamente. (C) Ventana con la configuración de captura de imágenes, que se abre con un clic en (2) indicado en el panel A. (D) Ventana con la configuración de guardado de imágenes, que se abre con un clic en (3) indicado en el panel A. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Formación de lesiones en la hoja inoculada observada bajo el microscopio digital. Imágenes de la parte central de la hoja de patata inoculada con PVY con un aumento de 23,6x visto bajo el microscopio digital, tomadas a intervalos de 5 min. Las plantas inoculadas se colocaron a 28 °C durante 3 días, y al tercer día, la observación con microscopio digital a 22 °C comenzó a las 7:00. (A) A las 21:02, la lesión aún no es visible, (B) 90 min después, a las 22:32, la lesión es visible. (C) La expansión de la lesión se observó a las 01:02 y (D) a las 07:32 de la mañana siguiente. El experimento se repitió dos veces, y las lesiones ocurrieron 8 h 15 min y 12 h después del inicio de la muerte celular, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo demostrado permite al usuario determinar con precisión la tasa de inicio de la muerte celular mediante la obtención de imágenes continuas de las hojas inoculadas en el tiempo entre el inicio de la muerte celular y la aparición de la muerte celular utilizando un microscopio digital. A pesar de que existen numerosas formas de monitorear la aparición de lesiones y enfermedades de las plantas12,13,14,15, este protocolo presenta la ventaja de la medición independiente de la luz sin alterar el ritmo circadiano de la planta, ya que la luz se apaga entre mediciones.
Después de la inoculación, las plantas deben crecer a 28 °C durante 3 días. El gen de resistencia Ny-1 , que induce una respuesta de hipersensibilidad, depende de la temperatura y, en plantas cultivadas a temperaturas más altas, conduce al aborto de la resistencia, que se manifiesta como falta de formación de lesiones y propagación sistémica del virus3. Después de que las plantas se transfieren a 22 °C, se inicia la muerte celular, por lo que para obtener resultados precisos, la observación con un microscopio digital debe comenzar lo antes posible después de esta transferencia. Otro paso crucial en la preparación de la planta para la obtención de imágenes es la inmovilización de la hoja (Figura 1D), ya que la planta continuará creciendo durante la obtención de imágenes, lo que podría desenfocar la hoja observada, o dicha configuración no dará los resultados deseados.
Si el protocolo descrito se utiliza en plantas transgénicas con componentes alterados de interés, hipotetizados que están involucrados en la iniciación de la muerte celular, el protocolo permite al usuario determinar si la disminución del nivel de un componente estudiado afecta la tasa de iniciación de la muerte celular. De este modo, los componentes implicados en el inicio de la muerte celular pueden identificarse en los patosistemas, donde se produce la muerte celular programada, utilizando este protocolo. Otros métodos para identificar estos componentes son, por ejemplo, el análisis transcriptómico como el RNA-seq o diversas formas de microscopía, que pueden ser costosos y requerir mucho tiempo16. El método descrito en este protocolo permite identificar de manera fácil y económica los componentes involucrados en la iniciación de la muerte celular mediante la observación de diferencias en las tasas de iniciación de la muerte celular entre las plantas transgénicas y las de control. De manera óptima, en una configuración de este tipo, se deben utilizar dos cámaras digitales, ya que una planta transgénica debe analizarse en paralelo con una planta de control dentro del mismo experimento.
En este protocolo se utilizó la cepa PVY N-Wilga; sin embargo, también podrían utilizarse otras cepas de este virus, por ejemplo, PVY marcado con GFP (PVY-N605(123)-GFP)7. Además, otros patosistemas, que dan lugar al desarrollo de la muerte celular programada, podrían estudiarse utilizando este protocolo con pequeñas modificaciones.
Divulgaciones
Los autores declaran que no tienen conflictos de intereses.
Agradecimientos
Agradecemos a Barbara Jaklič por su asistencia técnica. Esta investigación contó con el apoyo financiero de la Agencia Eslovena de Investigación e Innovación (financiación básica de la investigación n.º P4-0165 y proyecto Z4-3217: Desciframiento de la interconexión de señalización relacionada con redox en la resistencia de la patata contra los virus).
Materiales
| Name | Company | Catalog Number | Comments |
| Alcohol burner | Mikro+Polo | SH-234002455 | For tweezers and scalpel sterilization |
| Autoclave A-21 CAV | Kambi | N/A | |
| Bacto Agar | Becton, Dickinson and Company | 214010 | |
| Carborundum powder | VWR Chemicals | 22505297 | |
| DinoCapture 2.0 | Dino-Lite | Version 2.0 | software for digital microscope |
| Dino-Lite Edge AM7915MZTL digital microscope | AnMo Electronics Corporation | AM7915MZTL | |
| Ethanol, 70% | Stella Tech | P94000 | For tweezers and scalpel sterilization |
| Extraction bags | Bioreba | 420100 | |
| Growth chamber FS-WI | Photon Systems Insturments | N/A | |
| Hand homogenizer | Bioreba | 400010 | |
| Hawita Special Substrate | HAWITA Gruppe | 2000000071701 | Ready to use substrate, made using peat (H4-H6 and H6-H8) |
| Hydrochloric acid (HCl) | Merck | 109057 | |
| Label tape | Sigma | L8144-5EA | |
| Laptop computer with installed DinoCapture 2.0 | HP | Z2V77EA#BED | Computer needs to be transferable as experiment takes part in a growth chamber |
| Murashige and Skoog medium | Duchefa Biochemie | M02220100 | |
| Na2HPO4 | Emsure | 1065860500 | |
| NaH2PO4 | Emsure | 1064700250 | |
| Pasteur pipette 0.5 mL | Brand | 21500209 | |
| pH-meter | Mettler Toledo | ML1601 | |
| Plastic boxes | Cvetlice Dornig | VCG10.5 | Radius = 10.5 cm |
| Plastic pots | Lab Associates | DIS40003 | Radius = 11.5 cm (top), Radius = 9.8 cm (bottom) |
| Saccharose | Kemika d.d. | 1800408 | |
| Sodium Diethyldithiocarbamate (DIECA) | Sigma-Aldeich | 228680 | Sodium diethyldithiocarbamate trihydrate, ACS reagent |
| Sodium hydroxide (NaOH) | Merck | 106462 | |
| Sterile surgical blades | Braun | 4511733633 | |
| Tweezers | Braun | BD033R |
Referencias
- Karasev, A. V., Gray, S. M. Continuous and emerging challenges of potato virus y in potato. Annual Review of Phytopathology. 51, 571-586 (2013).
- Quenouille, J., Vassilakos, N., Moury, B. Potato virus Y: A major crop pathogen that has provided major insights into the evolution of viral pathogenicity. Molecular Plant Pathology. 14 (5), 439-452 (2013).
- Szajko, K., et al. The novel gene Ny-1 on potato chromosome IX confers hypersensitive resistance to Potato virus Y and is an alternative to Ry genes in potato breeding for PVY resistance. Theoretical and Applied Genetics. 116 (2), 297-303 (2008).
- Szajko, K., Strzelczyk-Żyta, D., Marczewski, W. Ny-1 and Ny-2 genes conferring hypersensitive response to potato virus Y (PVY) in cultivated potatoes: Mapping and marker-assisted selection validation for PVY resistance in potato breeding. Molecular Breeding. 34 (1), 267-271 (2014).
- Lukan, T., et al. Cell death is not sufficient for the restriction of potato virus Y spread in hypersensitive response-conferred resistance in potato. Frontiers in Plant Science. 9, 168 (2018).
- Baebler, &. #. 3. 5. 2. ;., et al. Salicylic acid is an indispensable component of the Ny-1 resistance-gene-mediated response against Potato virus y infection in potato. Journal of Experimental Botany. 65 (4), 1095-1109 (2014).
- Lukan, T., Coll, A., Baebler, &. #. 3. 5. 2. ;., Gruden, K. Analysis of virus spread around the cell death zone at spatiotemporal resolution using confocal microscopy. Methods in Molecular Biology. 2447, 261-270 (2022).
- Vinterhalter, D., Dragiüeviü, I., Vinterhalter, B. Potato in vitro culture techniques and biotechnology. Fruit, Vegetable and Cereal Science and Biotechnology. 2, 16-45 (2008).
- Wang, W., et al. Timing of plant immune responses by a central circadian regulator). Nature. 470, 110-115 (2011).
- Roden, L. C., Ingle, R. A. Lights, rhythms, infection: The role of light and the circadian clock in determining the outcome of plant-pathogen interactions. Plant Cell. 21 (9), 2546-2552 (2009).
- Srivastava, D., et al. Role of circadian rhythm in plant system: An update from development to stress response. Environmental and Experimental Botany. 162, 256-271 (2019).
- Mulaosmanovic, E., et al. High-throughput method for detection and quantification of lesions on leaf scale based on trypan blue staining and digital image analysis. Plant Methods. 16, 62 (2020).
- Martinelli, F., et al. Advanced methods of plant disease detection. A review. Agronomy for Sustainable Development. 35, 1-25 (2015).
- Ali, M., Bachik, N., Muhadi, N. A., Tuan Yusof, T. N., Gomes, C. Non-destructive techniques of detecting plant diseases: A review. Physiological and Molecular Plant Pathology. 108, 101426 (2019).
- Sankaran, S., Mishra, A., Ehsani, R., Davis, C. A review of advanced techniques for detecting plant diseases. Computers and Electronics in Agriculture. 72 (1), 1-13 (2010).
- Rowarth, N. M., et al. RNA-Seq analysis reveals potential regulators of programmed cell death and leaf remodelling in lace plant (Aponogeton madagascariensis). BMC Plant Biology. 21 (1), 375 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados