Method Article
Изучение инициации гибели клеток с помощью цифрового микроскопа
В этой статье
Резюме
Здесь мы представляем протокол для изучения скорости инициации запрограммированной клеточной гибели путем непрерывной визуализации инокулированных листьев после индукции клеточной гибели.
Аннотация
Резистентность, вызванная гиперчувствительным ответом (ЧСС), является эффективной защитной реакцией, которая может быть определена генами устойчивости N . ЧСС проявляется в виде образования зон гибели клеток на привитых листьях. Представлен протокол исследования скорости инициации клеточной гибели путем визуализации инокулированных листьев во времени между инициацией клеточной гибели и возникновением клеточной гибели с помощью цифрового микроскопа. Цифровой микроскоп обеспечивает непрерывный процесс визуализации с заданными интервалами, что позволяет точно определять частоту начала клеточной гибели с точностью до нескольких минут, в отличие от часов в традиционных методах. Визуализация с помощью цифрового микроскопа также не зависит от света и поэтому может использоваться в дневное и ночное время, не нарушая циркадный ритм растения. Различные патосистемы, приводящие к запрограммированной гибели клеток, могут быть изучены с помощью этого протокола с незначительными изменениями. Таким образом, протокол позволяет просто, точно и недорого идентифицировать частоту инициации клеточной гибели.
Введение
Картофель является одной из наиболее широко выращиваемых продовольственных культур в мире, занимая четвертое место после риса, пшеницы и кукурузы. Тем не менее, производство картофеля может серьезно пострадать от вируса картофеля Y (PVY), который в настоящее время считается самым важным вирусным патогеном 1,2. В растениях картофеля cv. Rywal, несколько штаммов PVY (включая штамм PVY N-Wilga) вызывают резистентность, вызванную гиперчувствительным ответом (HR), при которой ограничение патогена в месте инфекции проявляется в виде некротических поражений на инокулированных листьях3. В этой патосистеме HR опосредована геном резистентности Ny-1, который зависит от температуры, так как у растений, выращенных при более низких температурах, эффективно развиваются некротические поражения, тогда как у растений, выращенных конститутивно при повышенной (28 °C) температуре, аборт резистентности проявляется в отсутствии образования поражения и системном распространении вируса 3,4. Когда растения переводят на более низкую температуру (22 °C), инициируется гибель клеток, что может быть использовано для отслеживания скорости инициации клеточной гибели путем визуализации инокулированных листьев в промежутке между началом клеточной гибели и появлением клеточной гибели.
Данный протокол демонстрирует простой метод определения скорости инициации клеточной гибели с помощью цифрового микроскопа. Визуализируя инокулированные листья после переноса растения с 28 °C на 22 °C, цифровой микроскоп позволяет непрерывно наблюдать за листом через желаемые промежутки времени. В отличие от использования других методов (например, конфокальной микроскопии или наблюдения за образованием очага невооруженным глазом), это позволяет определить точное время образования очага поражения и, следовательно, частоту начала гибели клеток с точностью до минут, в отличие от часов в вышеупомянутых методах 5,6. Использование цифрового микроскопа также не зависит от освещения и поэтому может использоваться как днем, так и ночью. Этот протокол также может быть использован для идентификации компонентов, участвующих в инициации клеточной гибели, или для определения влияния различных компонентов на частоту инициации клеточной гибели, если используемые растения являются трансгенными и имеют измененные уровни интересующих компонентов.
протокол
ПРИМЕЧАНИЕ: В разделах 1 и 2 описывается модифицированный протокол подготовки растительного материала, основанный на методах, описанных Lukan et al.7. В частности, были внесены некоторые изменения в контролируемые условия окружающей среды и подготовку инокулята.
1. Выращивание растений картофеля
- Вырастите здоровый картофель cv. Растения Ривала в культуре тканей стеблевого узла8.
- Через 6-8 недель с помощью стерильного пинцета и скальпеля вырежьте на стерильной бумаге десять эксплантов длиной 1 см, содержащих узлы от растений картофеля, в стерильных условиях.
- Переложите их в пластиковые ящики со средой Murashige and Skoog (MS30) (рис. 1A) и выращивайте в контролируемых условиях окружающей среды (22 °C на свету и 19 °C в темноте с излучением 250 мкЭ илимкмоль/м2/с и 16-часовым фотопериодом при относительной влажности 55% ± 5%).
- Перенесите их в почву через 2 недели после микроразмножения.
- Наполните горшки (r = 10 см) грунтом. Пальцем создайте отверстие в почве глубиной 3-4 см в середине горшка, заполните лунку водой и подождите, пока она впитается.
- Поместите в лунку по одному растению на горшок, оставив листья над поверхностью. Аккуратно засыпьте корни почвой (рисунок 1Б).
ПРИМЕЧАНИЕ: У некоторых растений могут не развиваться корни. Исключите эти растения из анализа.
- Выращивайте растения в почве в ростовой камере в контролируемых условиях окружающей среды (22 °C на свету и 19 °C в темноте, при относительной влажности 55% ± 5%, с излучением 250 мкмоль/м2/с и 16-часовым фотопериодом).
- Через 3-4 недели растения готовы. Используйте эти растения для прививки.
ПРИМЕЧАНИЕ: Растения должны иметь не менее 3-4 полностью развитых листьев с видимыми листочками (рисунок 1С). Они должны выглядеть здоровыми, без видимых симптомов (желтые или коричневые листья), которые могут быть ошибочно приняты за поражения, вызванные PVY. Для достижения сопоставимых результатов растения следует прививать в одно и то же время (например, в 9 часов утра) во всех экспериментах, чтобы избежать возможного влияния циркадного ритма на иммунный ответ растений и образование поражений 9,10,11.
2. Подготовка инокулята и инокуляция картофеля
- Инокуляцию растения штаммом ПВЯ N-Wilga (PVYN-Wi; регистрационный No EF558545) инокулята, как указано ниже.
ПРИМЕЧАНИЕ: При наличии более одного цифрового микроскопа можно инокулировать больше растений параллельно. Перед инокуляцией растения должны иметь не менее трех полностью развитых листьев (рис. 1С). PVYN-Wi размножается и поддерживается в картофеле cv. Pentland.- Приготовьте фосфатный буфер с добавлением диэтилдитиокарбамата натрия (DIECA) для посева: смешайте 1,3 мл 0,2 М 2 PO 4, 8,7мл 0,2 M Na2HPO4 и 0,225 г DIECA. Доведите объем до 100 мл, используя ddH20. Доведите рН до 7,6, добавив 1 М раствор NaOH или 1 М HCl.
- Урожай 6-8-недельного PVYN-Wi зараженного картофеля CV. Пентландские растения из тканевой культуры в экстракционных мешках с фильтрующей сеткой (0,5 г на 6 растений) и добавьте фосфатный буфер с добавлением DIECA (4x масса растительного материала, соотношение масса: объем). Используйте ручной гомогенизатор в течение 1-2 минут для получения однородного раствора.
- Первые три нижних полностью развитых листа 3-4-недельных растений картофеля слегка опудрить карборундовым порошком.
ПРИМЕЧАНИЕ: Отрегулируйте количество карборундового порошка. Слишком большое количество может привести к повреждению, в то время как слишком малое может привести к неэффективной инфекции. Оптимально использовать 0,1 мг/см порошка карборунда, что составляет примерно 1,5 мг порошка на лист среднего размера (примерно 15 см2 ). - Аккуратно натрите листья посевным материалом (~100 мкл на лист). Через 10 мин тщательно промойте листья водопроводной водой.
- Будьте осторожны, чтобы не повредить листьям. Не превышайте время инкубации. Отрегулируйте количество посевного материала в зависимости от размера листа - 6,5 мкл/см, что составляет примерно 100 мкл на лист среднего размера (примерно 15 см2 ).
- Перенесите растения в камеру для роста и выращивайте их в контролируемых условиях окружающей среды (28 °C на свету и 28 °C в темноте при относительной влажности 55% ± 5%, с излучением 250 мкмоль/м2/с и 16-часовым фотопериодом) в течение 3 дней.
3. Подготовка растений и использование цифрового микроскопа для регистрации развития поражения
- Перенесите инокулированные растения из камеры роста, поддерживаемой при температуре 28 °C, в камеру роста при температуре 22 °C через 3 дня после инокуляции, соблюдая другие условия, описанные в шаге 1.5.
- Выберите растение для наблюдения. Второй привитый лист иммобилизуйте с помощью скотча (рисунок 1D). Убедитесь, что желаемый лист полностью обездвижен, прежде чем приступать к визуализации (рис. 1D).
- Установите на ноутбук программное приложение для захвата изображений. Подключите цифровой микроскоп к компьютеру. Откройте программное обеспечение.
ПРИМЕЧАНИЕ: Убедитесь, что растение, цифровой микроскоп и ноутбук расположены на полке рядом с розеткой для подключения компьютера. Решение о выборе листьев для мониторинга может зависеть от изучаемого биологического вопроса, например, от типа процесса, который приводит к образованию ограниченной запрограммированной гибели клеток. - Установите микроскоп над обездвиженным листом. Сосредоточьтесь с помощью диска на цифровом микроскопе (показано на рисунке 1E).
- Убедитесь, что линия обзора как можно шире, чтобы увеличить шансы запечатлеть образование поражения, но при этом достаточно увеличена, чтобы заметить внешний вид поражения (обычно используется 25-кратное увеличение).
- Установите настройки камеры. Нажмите на кнопку «Настройки » в правом верхнем углу изображения (рис. 2A, обведена часть 1) и отрегулируйте параметры камеры: Яркость (60-70), Контрастность (10-15), Оттенок (0), Баланс белого, Насыщенность (45-50), Резкость (0), Гамма (5) (Рисунок 2B). В этом исследовании использовались следующие настройки: Яркость (64), Контрастность (14), Оттенок (0), Насыщенность (47), Резкость (0), Гамма (5).
ПРИМЕЧАНИЕ: Настройки камеры должны быть отрегулированы в соответствии с внешним освещением, чтобы обеспечить наилучшее качество изображения. Настройки могут быть адаптированы в соответствии с условиями пользователя в камере роста. - Установите настройки захвата изображения, щелкнув по значку Image Capture (Рисунок 2C, обведена часть 2). Нажмите на кнопку Time-Lapsed Video и установите Image Capture каждые 15 минут в течение 24 часов (Рисунок 2C).
ПРИМЕЧАНИЕ: Интервал между полученными изображениями и продолжительность съемки являются полностью гибкими и могут быть адаптированы в соответствии с потребностями эксперимента. В промежутке между съемкой светодиодный индикатор выключается. Светодиодная подсветка автоматически включается во время съемки изображения. - Запустите захват изображения, нажав кнопку START (рисунок 2C).
ПРИМЕЧАНИЕ: После переноса с 28 °C на 22 °C у растений должны начать развиваться поражения в течение 24 часов. В противном случае это может быть признаком неэффективной прививки. Отрегулируйте количество карборундового порошка, убедитесь, что время инкубации посева на листьях было правильным, и определите содержание вируса в посевном материале методом кПЦР. - Чтобы сохранить изображения, выберите все изображения и нажмите значок Save (Сохранить рисунок 2B, обведенная часть 3). Задайте параметры экспорта. Установите максимальное значение DPI (300) (рис. 2D). После сохранения удалите все снимки в программе.
- Для анализа изображений достаточно любой программы для просмотра/редактирования изображений. Использование бесплатного программного обеспечения для редактирования изображений, ImageJ, описано ниже.
- Импортируйте временную последовательность изображений из одного поля зрения (в левом верхнем углу нажмите «Файл», выберите «Импорт», а затем «Последовательность изображений»). Вставьте путь к каталогу сохраненных картинок и нажмите кнопку ОК, чтобы начать конвертацию.
- После конвертации программа автоматически открывает внутренний видеоплеер, показывающий итоговое видео. Экспортируйте видеофайл, нажав на опцию «Файл» > «Сохранить как» и выбрав «Формат AVI». Открывается маленькое окошко. Установите частоту кадров 0,3 кадра в секунду и нажмите OK , чтобы сохранить видео в формате AVI.
ПРИМЕЧАНИЕ: Время развития поражения также можно определить, вручную проверив все изображения и найдя изображение, на котором появляется поражение.
Результаты
В данном исследовании демонстрируется пошаговый протокол изучения инициации гибели клеток через возникновение поражения на картофеле CV. Ривал, с цифровым микроскопом. Это позволяет определить точное время начала запрограммированной клеточной гибели.
Растения, у которых развились корни, высаживали в почву через 2 недели после созревания картофеля. Микроразмножение Ривала (рис. 1А,Б). После 3-4 недель роста в описанных условиях для дальнейшего анализа использовали растения с не менее чем 3-4 полностью развитыми листьями с видимыми листочками, которые выглядели здоровыми, без признаков опадения (рис. 1С). Используя цифровой микроскоп, описанный в этом протоколе, мы наблюдали один и тот же участок на инокулированном листе с интервалом в 15 минут и определяли возникновение и распространение поражения во времени (рис. 3). Поражение произошло через 15 ч 30 мин (рис. 3).

Рисунок 1: Подготовка растения к анализу с помощью цифрового микроскопа . (A) Пластиковая коробка со средой MS 30 и картофелем CV. Растения Rywal экспланты, содержащие узлы. (Б) Картофель cv. Высаживают в почву (через 2 недели после микроразмножения). (С) Картофель cv. Растение Ривал, готовое к прививке (через 4 недели после внесения в почву), имеющее не менее трех полностью развитых листьев. (D) Второй привитый лист (стрелка) картофеля cv. Растение Рывала позиционируется и обездвиживается (стрелка) с помощью скотча. (E) Расположите растение под цифровым микроскопом так, чтобы стрелка указывала на циферблат, используемый для фокусировки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
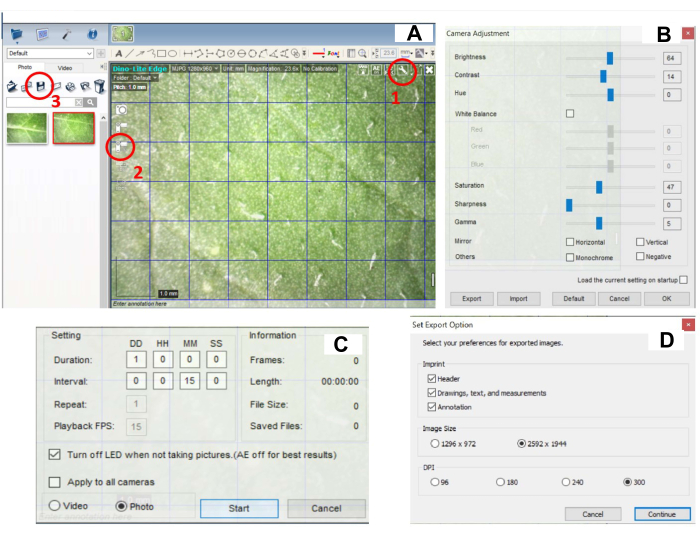
Рисунок 2: Настройка цифрового программного обеспечения для регистрации развития поражения. (A) Программный интерфейс - красным обведены параметры кнопки для (1) настроек камеры, (2) настроек захвата изображения и (3) сохранения изображений. (B) Окно с настройками камеры, которое открывается при нажатии на (1) на панели A. Яркость, контрастность, насыщенность, резкость и гамма должны быть правильно отрегулированы. (C) Окно с настройками захвата изображения, которое открывается при нажатии на (2), обозначенное на панели A. (D) Окно с настройками сохранения изображения, которое открывается при нажатии на (3), обозначенное на панели A. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Образование очагов поражения на инокулированном листе, наблюдаемое под цифровым микроскопом. Изображения центральной части листа картофеля, инокулированного PVY, при 23,6-кратном увеличении под цифровым микроскопом, сделанные с интервалом 5 мин. Привитые растения ставили при температуре 28 °С на 3 дня, а на третий день в 7:00 началось наблюдение с помощью цифрового микроскопа при 22 °С. (А) В 21:02 поражение еще не видно, (Б) 90 мин спустя, в 22:32, повреждение видно. (C) Расширение поражения наблюдалось в 01:02 и (D) в 07:32 на следующее утро. Эксперимент повторяли два раза, и поражения происходили через 8 ч 15 мин и 12 ч после начала клеточной гибели соответственно. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Продемонстрированный протокол позволяет пользователю точно определить частоту инициации клеточной гибели путем непрерывной визуализации инокулированных листьев во время между началом клеточной гибели и появлением клеточной гибели с помощью цифрового микроскопа. Несмотря на то, что существует множество способов мониторинга поражения и возникновения болезней растений12,13,14,15, этот протокол представляет собой преимущество светонезависимого измерения без нарушения циркадного ритма растения, поскольку свет выключается между измерениями.
После прививки растения должны расти при температуре 28 °C в течение 3 дней. Ген резистентности Ny-1 , индуцирующий гиперчувствительную реакцию, зависит от температуры, а у растений, выращенных при более высоких температурах, приводит к прерыванию резистентности, что проявляется отсутствием образования очагов поражения и системнымраспространением вируса. После переноса растений на 22 °С начинается гибель клеток, поэтому для получения точных результатов наблюдение с помощью цифрового микроскопа должно начинаться как можно скорее после этого переноса. Еще одним важным этапом подготовки растения к визуализации является иммобилизация листа (рис. 1D), так как растение будет продолжать расти во время визуализации, что может привести к смещению наблюдаемого листа из фокуса, или такая установка не даст желаемых результатов.
Если описанный протокол используется на трансгенных растениях с измененными компонентами, представляющими интерес, которые, как предполагается, участвуют в инициации клеточной гибели, то протокол позволяет определить, влияет ли пониженный уровень изучаемого компонента на скорость инициации клеточной гибели. Таким образом, компоненты, участвующие в инициации клеточной гибели, могут быть идентифицированы в патосистемах, где происходит запрограммированная клеточная гибель, с помощью этого протокола. Другими методами идентификации этих компонентов являются, например, транскриптомный анализ, такой как РНК-секвенирование, или различные формы микроскопии, которые могут быть дорогостоящими и трудоемкими. Метод, описанный в этом протоколе, позволяет легко и недорого идентифицировать компоненты, участвующие в инициации клеточной гибели, наблюдая различия в частоте инициации клеточной гибели между трансгенными и контрольными растениями. Оптимально, чтобы в такой обстановке использовались две цифровые камеры, так как трансгенное растение должно анализироваться параллельно с контрольным растением в рамках одного эксперимента.
В данном протоколе использовался штамм PVY N-Wilga; однако могут быть использованы и другие штаммы этого вируса, например, помеченный GFP PVY (PVY-N605(123)-GFP)7. Более того, другие патосистемы, приводящие к запрограммированной гибели клеток, могут быть изучены с помощью этого протокола с незначительной модификацией.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Благодарим Барбару Ялич за техническую помощь. Это исследование было проведено при финансовой поддержке Словенского агентства по исследованиям и инновациям (финансирование основного исследования No P4-0165 и проект Z4-3217: Расшифровка окислительно-восстановительной сигнальной взаимосвязанности в устойчивости картофеля к вирусам).
Материалы
| Name | Company | Catalog Number | Comments |
| Alcohol burner | Mikro+Polo | SH-234002455 | For tweezers and scalpel sterilization |
| Autoclave A-21 CAV | Kambi | N/A | |
| Bacto Agar | Becton, Dickinson and Company | 214010 | |
| Carborundum powder | VWR Chemicals | 22505297 | |
| DinoCapture 2.0 | Dino-Lite | Version 2.0 | software for digital microscope |
| Dino-Lite Edge AM7915MZTL digital microscope | AnMo Electronics Corporation | AM7915MZTL | |
| Ethanol, 70% | Stella Tech | P94000 | For tweezers and scalpel sterilization |
| Extraction bags | Bioreba | 420100 | |
| Growth chamber FS-WI | Photon Systems Insturments | N/A | |
| Hand homogenizer | Bioreba | 400010 | |
| Hawita Special Substrate | HAWITA Gruppe | 2000000071701 | Ready to use substrate, made using peat (H4-H6 and H6-H8) |
| Hydrochloric acid (HCl) | Merck | 109057 | |
| Label tape | Sigma | L8144-5EA | |
| Laptop computer with installed DinoCapture 2.0 | HP | Z2V77EA#BED | Computer needs to be transferable as experiment takes part in a growth chamber |
| Murashige and Skoog medium | Duchefa Biochemie | M02220100 | |
| Na2HPO4 | Emsure | 1065860500 | |
| NaH2PO4 | Emsure | 1064700250 | |
| Pasteur pipette 0.5 mL | Brand | 21500209 | |
| pH-meter | Mettler Toledo | ML1601 | |
| Plastic boxes | Cvetlice Dornig | VCG10.5 | Radius = 10.5 cm |
| Plastic pots | Lab Associates | DIS40003 | Radius = 11.5 cm (top), Radius = 9.8 cm (bottom) |
| Saccharose | Kemika d.d. | 1800408 | |
| Sodium Diethyldithiocarbamate (DIECA) | Sigma-Aldeich | 228680 | Sodium diethyldithiocarbamate trihydrate, ACS reagent |
| Sodium hydroxide (NaOH) | Merck | 106462 | |
| Sterile surgical blades | Braun | 4511733633 | |
| Tweezers | Braun | BD033R |
Ссылки
- Karasev, A. V., Gray, S. M. Continuous and emerging challenges of potato virus y in potato. Annual Review of Phytopathology. 51, 571-586 (2013).
- Quenouille, J., Vassilakos, N., Moury, B. Potato virus Y: A major crop pathogen that has provided major insights into the evolution of viral pathogenicity. Molecular Plant Pathology. 14 (5), 439-452 (2013).
- Szajko, K., et al. The novel gene Ny-1 on potato chromosome IX confers hypersensitive resistance to Potato virus Y and is an alternative to Ry genes in potato breeding for PVY resistance. Theoretical and Applied Genetics. 116 (2), 297-303 (2008).
- Szajko, K., Strzelczyk-Żyta, D., Marczewski, W. Ny-1 and Ny-2 genes conferring hypersensitive response to potato virus Y (PVY) in cultivated potatoes: Mapping and marker-assisted selection validation for PVY resistance in potato breeding. Molecular Breeding. 34 (1), 267-271 (2014).
- Lukan, T., et al. Cell death is not sufficient for the restriction of potato virus Y spread in hypersensitive response-conferred resistance in potato. Frontiers in Plant Science. 9, 168 (2018).
- Baebler, &. #. 3. 5. 2. ;., et al. Salicylic acid is an indispensable component of the Ny-1 resistance-gene-mediated response against Potato virus y infection in potato. Journal of Experimental Botany. 65 (4), 1095-1109 (2014).
- Lukan, T., Coll, A., Baebler, &. #. 3. 5. 2. ;., Gruden, K. Analysis of virus spread around the cell death zone at spatiotemporal resolution using confocal microscopy. Methods in Molecular Biology. 2447, 261-270 (2022).
- Vinterhalter, D., Dragiüeviü, I., Vinterhalter, B. Potato in vitro culture techniques and biotechnology. Fruit, Vegetable and Cereal Science and Biotechnology. 2, 16-45 (2008).
- Wang, W., et al. Timing of plant immune responses by a central circadian regulator). Nature. 470, 110-115 (2011).
- Roden, L. C., Ingle, R. A. Lights, rhythms, infection: The role of light and the circadian clock in determining the outcome of plant-pathogen interactions. Plant Cell. 21 (9), 2546-2552 (2009).
- Srivastava, D., et al. Role of circadian rhythm in plant system: An update from development to stress response. Environmental and Experimental Botany. 162, 256-271 (2019).
- Mulaosmanovic, E., et al. High-throughput method for detection and quantification of lesions on leaf scale based on trypan blue staining and digital image analysis. Plant Methods. 16, 62 (2020).
- Martinelli, F., et al. Advanced methods of plant disease detection. A review. Agronomy for Sustainable Development. 35, 1-25 (2015).
- Ali, M., Bachik, N., Muhadi, N. A., Tuan Yusof, T. N., Gomes, C. Non-destructive techniques of detecting plant diseases: A review. Physiological and Molecular Plant Pathology. 108, 101426 (2019).
- Sankaran, S., Mishra, A., Ehsani, R., Davis, C. A review of advanced techniques for detecting plant diseases. Computers and Electronics in Agriculture. 72 (1), 1-13 (2010).
- Rowarth, N. M., et al. RNA-Seq analysis reveals potential regulators of programmed cell death and leaf remodelling in lace plant (Aponogeton madagascariensis). BMC Plant Biology. 21 (1), 375 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены