Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo experimental de periimplantitis inducida por ligadura en ratones
En este artículo
Resumen
Este es un informe sobre un modelo experimental de periimplantitis inducida por ligadura en ratones. Describimos todos los pasos quirúrgicos, desde el manejo pre y postoperatorio de los animales, las extracciones, la colocación de implantes y la periimplantitis inducida por ligaduras.
Resumen
Los implantes dentales tienen una alta tasa de éxito y supervivencia. Sin embargo, las complicaciones como la periimplantitis (PI) son muy difíciles de tratar. La PI se caracteriza por la inflamación de los tejidos que rodean los implantes dentales con pérdida progresiva del hueso de soporte. Para optimizar la longevidad de los implantes dentales en términos de salud y funcionalidad, es crucial comprender la fisiopatología de la periimplantitis. En este sentido, el uso de modelos de ratón en la investigación ha demostrado claros beneficios en la recreación de circunstancias clínicas. El objetivo de este estudio fue describir un modelo experimental de periimplantitis inducida por ligaduras en ratones y determinar si existe efectividad en la inducción de esta enfermedad, dados los cambios óseos y tisulares observados. La inducción experimental de periimplantitis comprende los siguientes pasos: extracción de dientes, colocación de implantes e IP inducida por ligadura. Una muestra de dieciocho ratones machos C57BL/6J de 3 semanas de edad se dividió en dos grupos, ligadura (N = 9) y control sin ligadura (N = 9). Se realizó la evaluación de factores clínicos, radiográficos e histológicos. El grupo con ligadura mostró una pérdida ósea significativamente mayor, un aumento del edema de tejidos blandos y una migración epitelial apical que el grupo sin ligadura. Se concluyó que este modelo preclínico puede inducir con éxito periimplantitis en ratones.
Introducción
Los implantes dentales son cada vez más frecuentes como una opción deseable parareemplazar los dientes perdidos. Se prevé que la prevalencia de implantes dentales en la población adulta de EE. UU. aumente hasta un 23% para 20262. Según un informe de análisis de mercado de Grand View Research (2022), se proyectó que el tamaño del mercado global de implantes dentales alcanzaría aproximadamente US $ 4.6 mil millones en 2022. Además, se prevé que muestre una tasa de crecimiento anual constante de alrededor del 10% hasta el año 20303. Desafortunadamente, el uso de implantes dentales puede provocar complicaciones, como la periimplantitis. La periimplantitis se ha definido como una afección inducida por biofilm caracterizada por la inflamación de la mucosa periimplantaria y la consiguiente pérdida progresiva del hueso de soporte4.
Una revisión sistemática encontró que la prevalencia media de periimplantitis fue del 19,53% (intervalo de confianza [IC] del 95%, 12,87 a 26,19%) a nivel del paciente y del 12,53% (IC del 95%: 11,67 a 13,39%) a nivel del implante5. La periimplantitis representa un problema de salud pública creciente, debido al aumento del fracaso de los implantes y, en consecuencia, a los costes sustanciales del tratamiento6.
Comprender la patogénesis de la periimplantitis es crucial para desarrollar un enfoque sistemático que prevenga su aparición y progresión y maximice la longevidad de los implantes dentales en términos de estética y función 7,8. En este sentido, el uso de modelos murinos en la investigación odontológica ha demostrado ser ventajoso, dado que los ratones comparten más del 95% de sus genes con los humanos 9,10, el número de bases de datos genéticas disponibles en línea y la capacidad de reproducir escenarios clínicos11. Todas las ventajas descritas permiten la disección de los mecanismos genéticos en diferentes enfermedades12, el alojamiento y el manejo accesibles, y los anticuerpos ampliamente disponibles como paneles humanos, más allá de la disponibilidad de modificación genética (por ejemplo, knockout y sobreexpresión) para la evaluación del tejido inflamatorio y el mapeo de la enfermedad13. Aunque es ventajoso, hay pocas publicaciones que aborden la periimplantitis en ratones. Esto se debe, entre otros, a retos metodológicos, entre los que se encuentra la dificultad para obtener miniimplantes o instalarlos.
Para desarrollar periimplantitis en ratones, se han descrito muchos protocolos, como la periimplantitis inducida por ligaduras, la periimplantitis inducida por bacterias14, la periimplantitis15 inducida por lipopolisacáridos (LPS) o la combinación de LPS + periimplantitis inducida por ligaduras16. Aquí, nos centraremos en el modelo de ligadura porque es el método más aceptado para inducir periodontitis 17,18,19 y, más recientemente, periimplantitis20,21. La ligadura colocada alrededor de los implantes en posición submucosa estimula la acumulación de placa y, en consecuencia, la inflamación de los tejidos. Por lo tanto, el desarrollo de este enfoque se basa en la indicación de una técnica viable de costo-beneficio para investigaciones preclínicas en enfermedades periimplantarias. Este estudio tiene como objetivo describir un modelo experimental de periimplantitis inducida por ligaduras en ratones y determinar si existe efectividad en la inducción de esta enfermedad dados los cambios óseos y tisulares observados.
El objetivo general de este artículo es reportar el protocolo aplicado para inducir periimplantitis en ratones por ligadura y observar su efectividad a través de la evaluación de tejidos y pérdida ósea alrededor de los implantes.
Protocolo
Los procedimientos que involucran a sujetos animales han sido aprobados por el Comité de Investigación Animal del Canciller de la Universidad de California, Los Ángeles (número de protocolo ARC 2002-125), y el Animal Research: Reporting In Vivo Experiments (ARRIVE)22. Para este método, se utilizaron dieciocho ratones machos C57BL/6J de 3 semanas de edad y se sometieron a extracciones dentales, colocación de implantes e inducción de periimplantitis. Todos los procedimientos odontológicos se realizaron con un aumento microscópico del 10× y fueron realizados por operadores entrenados y calibrados (Figura 1A).
1. Pasos previos a la extracción
- Realizar el procedimiento en un quirófano cumpliendo con todas las normas de bioseguridad y protección.
- Realizar asepsia de todas las superficies con triple fricción utilizando una solución de alcohol isopropílico al 70%.
- Anestesiar ratones machos C57BL/6J de 3 semanas de edad con isoflurano al 3%. Verifique la falta de respuesta a la pata que se retira al tacto para asegurarse de que se obtenga suficiente profundidad anestésica.
- Para evitar interferir con los procedimientos en la boca, use una nariz para mantener la anestesia con isoflurano.
- Contar con un operador auxiliar para estabilizar al animal y mantener la apertura de la boca (Figura 1B).
- Aplicar lubricante oftálmico, para evitar la irritación en los ojos antes de iniciar la extracción.
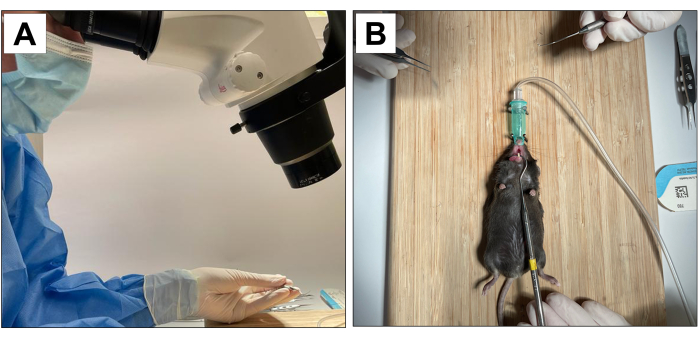
Figura 1: Adaptaciones operativas: (A) Aumento microscópico. (B) Sistema de anestesia inhalatoria adaptado y estabilización para la apertura de la boca. Haga clic aquí para ver una versión más grande de esta figura.
2. Extracción dental
- Para extracciones dentales, introduzca un explorador dental #5 entre el primer y el segundo molar para iniciar los procedimientos de elevación y luxación moviendo el instrumento en la dirección mesio-distal hasta que el diente se mueva en el alvéolo (Figuras 2A).
- A continuación, introduzca el explorador dental #5 en el sitio mesial del primer molar. Haga esto moviendo el instrumento en la dirección mesio-distal hasta que el diente se mueva en el alvéolo.
- Después de la elevación, use las pinzas de punta y las pinzas de sutura para quitar el1er molar.
- A continuación, introduzca el explorador dental entre el2º y el3º molar para elevar y luxar el2º molar (Figura 2B).
- Luego, use las pinzas de punta y/o las pinzas de sutura para extraer el diente usando los instrumentos para sostenerlo y sacarlo de la boca. (Figura 2C).
- Después de las extracciones dentales, asegúrese de lograr la hemostasia completa utilizando una punta de algodón estéril (Figura 2D) durante 1 minuto (Figura 2E, F).
- Inmediatamente después de la extracción, proporcionar a todos los animales analgésicos (Carprofeno/Rimadyl 5 mg/kg) cada 24 h. Administrar el medicamento a través de una inyección subcutánea.
- Además, sustituya la comida habitual por una dieta blanda. Administrar el antibiótico (Amoxil 0,25 mg/mL) por vía oral incorporando el medicamento en el agua de bebida. Haga esto durante cuatro semanas después de las extracciones.
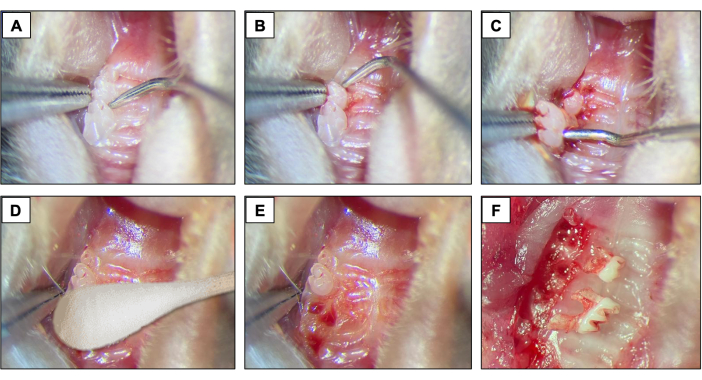
Figura 2: Secuencia inicial de extracción: (A, B) Región maxilar con 1º y 2º molar y uso de explorador dental para elevación y luxación. (C) Uso de las pinzas de punta y el explorador para la luxación y la extracción de dientes. d) Hemostasia. (E, F) Aspecto alveolar después de extracciones. Haga clic aquí para ver una versión más grande de esta figura.
3. Colocación del implante
- Con una cuchilla de 15c, cree una incisión mesiodistal a través del tejido queratinizado en el área correspondiente a los dientes previamente presentes. Utilice los molares maxilares derechos como referencia espacial (Figura 3A).
- Levante los colgajos bucales y palatinos de espesor completo utilizando un explorador dental #5, asegurando la elevación completa del colgajo (Figura 3B).
- Realice la osteotomía utilizando un micro taladro manual de carburo de 0,3 mm de diámetro unido a un Pin Vise (taladro manual) y actívelo en el sentido de las agujas del reloj. Cree sitios de osteotomía con aproximadamente 1 mm de profundidad en los alvéolos de extracción cicatrizados (Figura 3C).
- Coloque los implantes en forma de tornillo diseñados a medida con una superficie mecanizada lisa (1,0 mm de largo y 0,5 mm de diámetro) fabricados a partir de varillas de titanio 6AL4V (Figura 3D), uno por animal, autorroscantes en la región del primer y segundo molar maxilar izquierdo con un movimiento de atornillado en el sentido de las agujas del reloj (Figura 3E-I).
- Inmediatamente después de la colocación del implante, administrar analgésicos (Carprofeno/Rimadyl 5 mg/kg cada 24 h) mediante inyección subcutánea.
- Deje que los implantes cicatricen durante cuatro semanas, tiempo durante el cual administre antibióticos y aliméntelos como se describió anteriormente.
- Al final del período de curación, asegúrese de que la herida mucosa esté completamente cerrada y tenga una apariencia rosa clara.
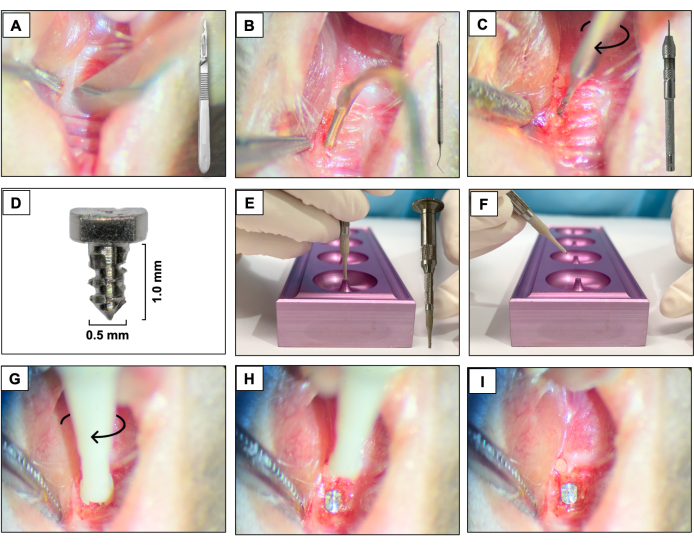
Figura 3: Secuencia de colocación del implante: (A) Incisión con una cuchilla de 15c unida al mango. (B) Colgajos de espesor completo usando el explorador dental # 5. (C) Osteotomía con un microtaladro manual de carburo de 0,3 mm unido a un tornillo de banco. (D) Implante dental de titanio. (E, F) Soporte del implante y soporte del implante. (G- I) Colocación del implante mediante un movimiento de atornillado en el sentido de las agujas del reloj. Haga clic aquí para ver una versión más grande de esta figura.
4. Inducción de periimplantitis
- Coloque una ligadura de seda (6-0) alrededor de cada accesorio inmediatamente apical a la cabeza del implante contorneando la superficie del implante y fijándolo con un nudo doble. Mantener la ligadura durante dos semanas permitiendo el desarrollo de la periimplantitis.
- Revise las ligaduras cada dos días para asegurarse de que todavía estén presentes. Si falta, coloque una nueva ligadura.
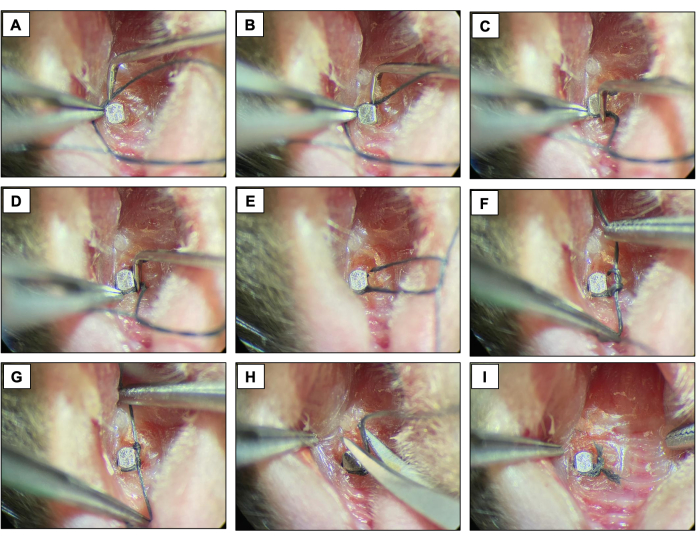
Figura 4: Secuencia de periimplantitis inducida por ligadura. (A-D) Ligadura de seda (6.0) colocada alrededor de la cabeza del implante. (E-G) Cierre de nudos. (H) Corte de ligadura. (I) Comparecencia final. Imágenes clínicas obtenidas de animales vivos bajo sedación. Haga clic aquí para ver una versión más grande de esta figura.
5. Sacrificio
- Después del período de inducción de la periimplantitis (dos semanas), sacrificar a todos los animales con una alta concentración de isoflurano inhalado, seguido de un método secundario de luxación cervical con una varilla presionada en la base del cráneo y tirando rápidamente de las extremidades posteriores, provocando la separación de las vértebras cervicales del cráneo.
- Separe los maxilares con instrumentos afilados, como tijeras quirúrgicas, que separarán toda la mandíbula del animal del resto del cuerpo.
- Fotografíe los maxilares con un microscopio óptico, fíjelo en formalina al 10% durante 24 h, luego guárdelo en etanol al 70%.
6. Microtomografía computarizada (μCT)
- Gammagrafía de los maxilares como se ha descrito anteriormente18,19 mediante microtomografía computarizada (micro-TC).
- Encienda el escáner y la computadora, luego abra el software de escaneo, haga clic en el signo de radiación y espere 15 minutos para precalentarlo.
- Abra la puerta del equipo haciendo clic en el icono de la puerta.
- Usa una mesa giratoria del tamaño de una moneda de veinticinco centavos. Coloque el maxilar en un tubo cónico de 15 ml. Fije el tubo en la base de la mesa giratoria. Coloque la mesa giratoria en el tornillo del equipo.
- Cierre la puerta del equipo haciendo clic en el icono de la puerta.
- Encienda la fuente de rayos X.
- Haga clic en el icono de captura de imagen y asegúrese de que el hueso esté en el campo.
- Ajuste una resolución de tamaño de píxel de 10 μm, energía de rayos X de 55 KVp y 181 μA, filtro de IA 0,5 mm, paso de rotación 0,4, fotograma medio 10. Esta configuración generará un tiempo de escaneo estimado de 24 minutos.
- Inicie la adquisición.
- Para la reconstrucción, abra el software de reconstrucción. Utilice un endurecimiento de viga del 20%. Usa un artefacto de anillo del 5%. Utilice un rango dinámico de 0-0,13. Anule la selección de la etiqueta ON. Haga clic en Vista previa. Elija la vista adecuada que se ve para la región de interés y guárdela como TIFF.
- Orientar las imágenes obtenidas mediante software para la visualización y análisis de datos. Hacer que el eje longitudinal de la cabeza del implante sea paralelo a los ejes sagital y coronal y perpendicular al eje axial.
- Guarde la imagen sagital como una sola imagen para el análisis óseo lineal.
- Guarde la imagen transaxial como un conjunto de datos para el análisis óseo volumétrico.
- Realice análisis óseos lineales utilizando el software de análisis de datos. Mida las distancias en milímetros entre la cabeza del implante y el hueso alveolar en los planos sagital y coronal, incluidos los sitios mesial, distal, bucal y palatino.
- Realice análisis óseos volumétricos utilizando un software de análisis de datos. Realice un seguimiento de la pérdida ósea alrededor de los implantes dibujando la región de interés en todas las diapositivas correspondientes a la pérdida ósea.
7. Análisis estadístico
- Mida la pérdida ósea microtomográfica lineal y volumétrica y normalice estos valores dividiendo cada valor por el promedio del grupo control. Presentar un promedio para todos los grupos, como media ± error estándar de la media (SEM).
- Compare la significación mediante un análisis de varianza de dos vías (ANOVA) seguido de una prueba de Tukey con un intervalo de confianza del 95%. (Prisma 5). Aplique los niveles de significación de la siguiente manera: p≤0.01**, p≤0.001****.
Resultados
Para este método, se utilizaron dieciocho ratones machos C57BL/6J de 3 semanas de edad y se sometieron a extracciones dentales, colocación de implantes e inducción de periimplantitis. Hubo nueve animales por grupo, lo cual fue estadísticamente significativo, considerando la pérdida ósea lineal alcanzando un 80% de potencia, un 15% de desviación estándar (σ) y un intervalo de confianza del 95% (α = 0,05). Los ratones fueron alimentados con una dieta blanda ad libitum durante el experimento. Nueve ratone...
Discusión
Este protocolo presenta un informe descriptivo sobre los procedimientos quirúrgicos para la inducción de periimplantitis utilizando un modelo de ligadura en ratones. Trabajar con ratones tiene ventajas, como ser costo-efectivo, la disponibilidad de un extenso conjunto genético dados los múltiples antecedentes23 entre otros aspectos24,25. A lo largo de los años, varios estudios han utilizado con éxito ratones en los campos médico y d...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el DE031431 NIH/NIDCR. Nos gustaría agradecer al Laboratorio Central de Patología Traslacional de UCLA por su ayuda en la preparación de las secciones histológicas descalcificadas.
Materiales
| Name | Company | Catalog Number | Comments |
| #5 dental explorer | Hu-Friedy, Chicago, IL | 392-0911 | Dental luxation |
| 15c blade and surgical scalpel | Henry Schein Inc., Melville, NY | 1126186 | Tissue incision |
| 6-0 silk ligatures | Fisher Scientific, Hampton, NH | NC9201232 | Ligature |
| Amoxicillin 50μg/mL | Zoetis, San Diego, CA | TS/DRUGS/57/2003 | Oral suspension |
| Bacon Soft Diet | Bio Serve®, Frenchtown, NJ | 14-726-701 | - |
| C57BL/6J male mice | The Jackson Laboratories, Bar Harbor, ME, USA | 000664 | Age: 3-week-old |
| CTAn software | V.1.16 Bruker, Billerica, MA | - | Volumetric analysis |
| Dolphin software | Navantis, Toronto, CA | - | Linear bone analysis |
| Implant carrier & Tip | D. P. Machining Inc., La Verne, CA | Unique product | Implant holder |
| Implant support | D. P. Machining Inc., La Verne, CA | Unique product | Implant capture |
| Isoflurane | Vet One, Boise, ID | NDC13985-528-60 | Inhalational anesthetic |
| Micro-CT scan 1172 | SkyScan, Kontich, Belgium | - | μCT scans |
| Nrecon Software | Bruker Corporation, Billerica, MA | - | Images reconstruction |
| Ø 0.3mm - L 2.5mm Micro Drills | Sphinx, Hoffman Estates, IL | ART. 50699 | Osteotomy |
| Ø 0.5mm - L 1.0mm Titanium implants | D. P. Machining Inc., La Verne, CA | Unique product | - |
| Ophthalmic lubricant | Apexa, Ontario, CA | NDC13985-600-03 | Artificial tears |
| Pin Vise | General Tools, Secaucus, NJ | 90 | Osteotomy |
| Rimadyl 50mg/ml | Zoetis, San Diego, CA | 4019449 | Anti-inflammatory |
| Sterile cotton tipped | Dynarex, Glendale, AZ | 4304-1 | Hemostasis |
| Tip forceps | Fine Science Tools, Foster City, CA | 11071-10 | Dental Extraction |
| Tying forceps | Fine Science Tools, Foster City, CA | 18025-10 | Ligature placement |
Referencias
- Ho, K., et al. A cross-sectional survey of patient's perception and knowledge of dental implants in japan. Int J Implant Dent. 8 (1), 14 (2022).
- Elani, H. W., Starr, J. R., Da Silva, J. D., Gallucci, G. O. Trends in dental implant use in the u.S., 1999-2016, and projections to 2026. J Dent Res. 97 (13), 1424-1430 (2018).
- Renvert, S., Persson, G. R., Pirih, F. Q., Camargo, P. M. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 45, S278-S285 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 449 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases-the efp s3 level clinical practice guideline. J Clin Periodontol. 50, 4-76 (2023).
- Graziani, F., Figuero, E., Herrera, D. Systematic review of quality of reporting, outcome measurements and methods to study efficacy of preventive and therapeutic approaches to peri-implant diseases. J Clin Periodontol. 39, 224-244 (2012).
- Schwarz, F., Derks, J., Monje, A., Wang, H. L. Peri-implantitis. J Periodontol. 89, S267-S290 (2018).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Mouse Genome Sequencing, C. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Pirih, F. Q., et al. Ligature-induced peri-implantitis in mice. J Periodontal Res. 50 (4), 519-524 (2015).
- Rau, C. D., et al. High-density genotypes of inbred mouse strains: Improved power and precision of association mapping. G3. 5 (10), 2021-2026 (2015).
- Schwarz, F., Sculean, A., Engebretson, S. P., Becker, J., Sager, M. Animal models for peri-implant mucositis and peri-implantitis. Periodontol 2000. 68 (1), 168-181 (2015).
- Varon-Shahar, E., et al. Peri-implant alveolar bone resorption in an innovative peri-implantitis murine model: Effect of implant surface and onset of infection. Clin Implant Dent Relat Res. 21 (4), 723-733 (2019).
- Pirih, F. Q., et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis. J Oral Implantol. 41 (5), e158-e164 (2015).
- Schwarz, F., et al. Influence of antiresorptive/antiangiogenic therapy on the extension of experimentally induced peri-implantitis lesions. Clin Oral Investig. 27 (6), 3009-3019 (2023).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Wong, R. L., et al. Early intervention of peri-implantitis and periodontitis using a mouse model. J Periodontol. 89 (6), 669-679 (2018).
- Hiyari, S., et al. Ligature-induced peri-implantitis and periodontitis in mice. J Clin Periodontol. 45 (1), 89-99 (2018).
- Nguyen Vo, T. N., et al. Ligature induced peri-implantitis: Tissue destruction and inflammatory progression in a murine model. Clin Oral Implants Res. 28 (2), 129-136 (2017).
- Yuan, S., et al. Comparative transcriptome analysis of gingival immune-mediated inflammation in peri-implantitis and periodontitis within the same host environment. J Inflamm Res. 15, 3119-3133 (2022).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. J Periodontol. 89, S313-S318 (2018).
- Hiyari, S., et al. Genomewide association study identifies cxcl family members as partial mediators of lps-induced periodontitis. J Bone Miner Res. 33 (8), 1450-1463 (2018).
- Kantarci, A., Hasturk, H., Van Dyke, T. E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 68 (1), 66-82 (2015).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental animal models in periodontology: A review. Open Dent J. 4, 37-47 (2010).
- Erata, E., et al. Cnksr2 loss in mice leads to increased neural activity and behavioral phenotypes of epilepsy-aphasia syndrome. J Neurosci. 41 (46), 9633-9649 (2021).
- Fakih, D., Guerrero-Moreno, A., Baudouin, C., Reaux-Le Goazigo, A., Parsadaniantz, S. M. Capsazepine decreases corneal pain syndrome in severe dry eye disease. J Neuroinflammation. 18 (1), 111 (2021).
- Douam, F., Ploss, A. The use of humanized mice for studies of viral pathogenesis and immunity. Curr Opin Virol. 29, 62-71 (2018).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), (2021).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Silva, D. N. A., et al. Probiotic lactobacillus rhamnosus em1107 prevents hyperglycemia, alveolar bone loss, and inflammation in a rat model of diabetes and periodontitis. J Periodontol. 94 (3), 376-388 (2023).
- Kim, Y. G., et al. 6-shogaol, an active ingredient of ginger, inhibits osteoclastogenesis and alveolar bone resorption in ligature-induced periodontitis in mice. J Periodontol. 91 (6), 809-818 (2020).
- Fine, N., et al. Periodontal inflammation primes the systemic innate immune response. J Dent Res. 100 (3), 318-325 (2021).
- Yu, X., et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis. J Periodontal Res. 53 (1), 98-106 (2018).
- Reinedahl, D., Chrcanovic, B., Albrektsson, T., Tengvall, P., Wennerberg, A. Ligature-induced experimental peri-implantitis-a systematic review. J Clin Med. 7 (12), (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados