Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Experimentelles Modell der Ligatur-induzierten Periimplantitis bei Mäusen
In diesem Artikel
Zusammenfassung
Dies ist ein Bericht über ein experimentelles Modell der Ligatur-induzierten Periimplantitis bei Mäusen. Wir beschreiben alle chirurgischen Schritte, von der prä- und postoperativen Behandlung der Tiere, Extraktionen, Implantatinsertion und ligaturinduzierter Periimplantitis.
Zusammenfassung
Zahnimplantate haben eine hohe Erfolgs- und Überlebensrate. Komplikationen wie Periimplantitis (PI) sind jedoch sehr schwierig zu behandeln. PI ist gekennzeichnet durch eine Entzündung im Gewebe um Zahnimplantate mit fortschreitendem Verlust des Stützknochens. Um die Langlebigkeit von Zahnimplantaten in Bezug auf Gesundheit und Funktionalität zu optimieren, ist es entscheidend, die Pathophysiologie der Periimplantitis zu verstehen. In dieser Hinsicht hat die Verwendung von Mausmodellen in der Forschung klare Vorteile bei der Nachbildung klinischer Umstände gezeigt. Ziel dieser Studie war es, ein experimentelles Modell der Ligatur-induzierten Periimplantitis bei Mäusen zu beschreiben und festzustellen, ob es angesichts der beobachteten Knochen- und Gewebeveränderungen eine Wirksamkeit bei der Induktion dieser Krankheit gibt. Die experimentelle Periimplantitis-Induktion umfasst die folgenden Schritte: Zahnextraktion, Implantatinsertion und Ligatur-induzierte PI. Eine Stichprobe von achtzehn 3 Wochen alten männlichen C57BL/6J-Mäusen wurde in zwei Gruppen eingeteilt, Ligatur (N=9) und Kontroll-Nicht-Ligatur (N=9). Die Bewertung klinischer, röntgenographischer und histologischer Faktoren wurde durchgeführt. Die Ligaturgruppe zeigte einen signifikant höheren Knochenverlust, ein erhöhtes Weichteilödem und eine apikale Epithelmigration als die Nicht-Ligaturgruppe. Es wurde der Schluss gezogen, dass dieses präklinische Modell erfolgreich eine Periimplantitis bei Mäusen induzieren kann.
Einleitung
Zahnimplantate werden immer häufiger als wünschenswerte Wahl für den Ersatz fehlender Zähneeingesetzt 1. Die Prävalenz von Zahnimplantaten in der erwachsenen US-Bevölkerung wird bis 2026 voraussichtlich um bis zu 23 % steigen2. Basierend auf einem Marktanalysebericht von Grand View Research (2022) wird die globale Marktgröße für Zahnimplantate im Jahr 2022 voraussichtlich etwa 4,6 Milliarden US-Dollar erreichen. Darüber hinaus wird bis zum Jahr 2030 eine stetige jährliche Wachstumsrate von rund 10 % erwartet3. Leider kann die Verwendung von Zahnimplantaten zu Komplikationen wie Periimplantitis führen. Periimplantitis wurde definiert als eine durch Biofilm induzierte Erkrankung, die durch eine Entzündung der periimplantären Schleimhaut und einen anschließenden fortschreitenden Verlust des Stützknochens gekennzeichnetist 4.
Eine systematische Übersichtsarbeit ergab, dass die mittlere Prävalenz der Periimplantitis 19,53 % (95 % Konfidenzintervall [KI], 12,87 bis 26,19 %) auf Patientenebene und 12,53 % (95 % KI 11,67 bis 13,39 %) auf Implantatebene5 betrug. Periimplantitis stellt aufgrund eines Anstiegs des Implantatversagens und folglich erheblicher Behandlungskosten eine wachsende öffentliche Gesundheit dar6.
Das Verständnis der Pathogenese der Periimplantitis ist entscheidend für die Entwicklung eines systematischen Ansatzes, um ihr Auftreten und Fortschreiten zu verhindern und die Langlebigkeit von Zahnimplantaten in Bezug auf Ästhetik und Funktion zu maximieren 7,8. In diesem Sinne hat sich die Verwendung von Mausmodellen in der zahnmedizinischen Forschung als vorteilhaft erwiesen, da Mäuse mehr als 95 % ihrer Gene mit dem Menschen teilen 9,10, die Anzahl der verfügbaren genetischen Online-Datenbanken und die Fähigkeit, klinische Szenarien zu reproduzieren11. Alle beschriebenen Vorteile ermöglichen die Aufschlüsselung genetischer Mechanismen bei verschiedenen Krankheiten12, die zugängliche Akkommodation und das Management sowie Antikörper, die als humane Panels weit verbreitet sind, über die Verfügbarkeit genetischer Modifikationen (z. B. Knockout und Überexpression) für die Beurteilung von Entzündungsgewebe und die Kartierung von Krankheitenhinaus 13. Obwohl dies vorteilhaft ist, gibt es nur wenige Publikationen, die sich mit Periimplantitis bei Mäusen befassen. Dies ist unter anderem auf methodische Herausforderungen zurückzuführen, darunter die Schwierigkeit, Miniimplantate zu erhalten oder zu installieren.
Um eine Periimplantitis bei Mäusen zu entwickeln, wurden viele Protokolle beschrieben, wie z. B. Ligatur-induzierte Periimplantitis, bakterieninduzierte Periimplantitis14, Lipopolysaccharid (LPS)-induzierte Periimplantitis15 oder die Kombination LPS + Ligatur-induzierte Periimplantitis16. Hier konzentrieren wir uns auf das Ligaturmodell, da es die am weitesten verbreitete Methode zur Induktion von Parodontitis 17,18,19 und in jüngerer Zeit von Periimplantitis 20,21 ist. Die Ligatur, die in submuköser Position um die Implantate gelegt wird, stimuliert die Ansammlung von Plaque und damit die Entzündung des Gewebes. Die Entwicklung dieses Ansatzes basiert daher auf der Indikation einer praktikablen Kosten-Nutzen-Technik für präklinische Untersuchungen zu periimplantären Erkrankungen. Diese Studie zielt darauf ab, ein experimentelles Modell der Ligatur-induzierten Periimplantitis bei Mäusen zu beschreiben und festzustellen, ob es angesichts der beobachteten Knochen- und Gewebeveränderungen eine Wirksamkeit bei der Induktion dieser Krankheit gibt.
Das übergeordnete Ziel dieses Artikels ist es, über das Protokoll zu berichten, das zur Induktion von Periimplantitis bei Mäusen durch Ligatur angewendet wird, und seine Wirksamkeit durch Gewebebewertung und Knochenverlust um die Implantate herum zu beobachten.
Protokoll
Verfahren mit tierischen Probanden wurden vom Chancellor's Animal Research Committee der University of California, Los Angeles (ARC-Protokollnummer 2002-125) und dem Animal Research: Reporting In Vivo Experiments (ARRIVE)22 genehmigt. Für diese Methode wurden achtzehn 3 Wochen alte männliche Mäuse des Typs C57BL/6J verwendet und zahnärztlichen Extraktionen, Implantatinsertion und Periimplantitis-Induktion unterzogen. Alle zahnärztlichen Eingriffe wurden unter 10× mikroskopischer Vergrößerung durchgeführt und von geschulten und kalibrierten Bedienern durchgeführt (Abbildung 1A).
1. Schritte vor der Extraktion
- Führen Sie den Eingriff in einem Operationssaal durch, der alle Biosicherheits- und Schutzstandards erfüllt.
- Führen Sie die Asepsis aller Oberflächen mit dreifacher Reibung mit einer 70%igen Isopropylalkohollösung durch.
- Betäuben Sie 3 Wochen alte männliche C57BL/6J-Mäuse mit 3% Isofluran. Überprüfen Sie, ob die Pfote bei Berührung nicht auf das Zurückziehen der Pfote reagiert, um sicherzustellen, dass eine ausreichende Anästhesietiefe erreicht wird.
- Um Eingriffe im Mund zu vermeiden, verwenden Sie einen Nasenkonus, um die Isofluran-Anästhesie aufrechtzuerhalten.
- Lassen Sie einen Hilfsbediener das Tier stabilisieren und die Maulöffnung aufrechterhalten (Abbildung 1B).
- Tragen Sie Augengleitmittel auf, um Augenreizungen zu vermeiden, bevor Sie mit der Extraktion beginnen.
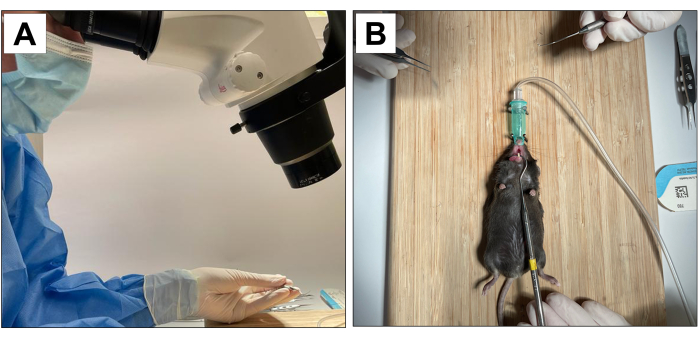
Abbildung 1: Operative Anpassungen: (A) Mikroskopische Vergrößerung. (B) Angepasstes Inhalationsanästhesiesystem und Stabilisierung für die Mundöffnung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Dentale Extraktion
- Führen Sie für dentale Extraktionen einen #5 Dental Explorer zwischen dem ersten und dem zweiten Backenzahn ein, um die Elevations- und Luxationsverfahren zu starten, indem Sie das Instrument in mesio-distaler Richtung bewegen, bis sich der Zahn in der Alveole bewegt (Abbildungen 2A).
- Als nächstes stellen Sie den #5 Dental Explorer in der mesialen Stelle des ersten Backenzahns vor. Bewegen Sie dazu das Instrument in mesio-distaler Richtung, bis sich der Zahn in der Alveole bewegt.
- Verwenden Sie nach dem Hochlagern die Spitzenzange und die Nahtbindezange, um den 1. Backenzahn zu entfernen.
- Führen Sie als Nächstes den Dental Explorer zwischen dem 2. und 3. Molaren ein, um den 2. Molaren anzuheben und zu luxieren (Abbildung 2B).
- Verwenden Sie dann die Spitzenzange und/oder die Nahtbindezange, um den Zahn mit den Instrumenten zu entfernen und aus dem Mund zu nehmen. (Abbildung 2C).
- Stellen Sie nach dentalen Extraktionen sicher, dass eine vollständige Blutstillung erreicht wird, indem Sie 1 Minute lang eine sterile Wattespitze (Abbildung 2D) verwenden (Abbildung 2E, F).
- Unmittelbar nach der Extraktion alle 24 Stunden allen Tieren Schmerzmittel (Carprofen/Rimadyl 5 mg/kg) zur Verfügung stellen. Verabreichen Sie das Medikament durch subkutane Injektion.
- Ersetzen Sie außerdem normales Essen durch eine weiche Diät. Verabreichen Sie das Antibiotikum (Amoxil 0,25 mg/ml) oral, indem Sie das Medikament in das Trinkwasser einarbeiten. Tun Sie dies vier Wochen nach der Extraktion.
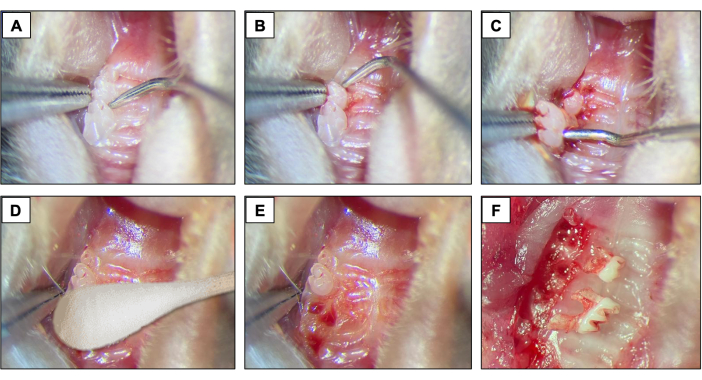
Abbildung 2: Anfängliche Extraktionssequenz: (A, B) Oberkieferregion mit 1. und 2. Backenzahn und Verwendung des Dental Explorers für Elevation und Luxation. (C) Verwendung der Spitzenzange und des Explorers zur Luxation und Zahnentfernung. (D) Hämostase. (E, F) Alveoläres Aussehen nach Extraktionen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Einsetzen des Implantats
- Erstellen Sie mit einer 15c-Klinge einen mesio-distalen Schnitt durch das keratinisierte Gewebe in dem Bereich, der den zuvor vorhandenen Zähnen entspricht. Verwenden Sie die rechten Oberkiefermolaren als Raumbezug (Abbildung 3A).
- Heben Sie die bukkalen und palatinalen Lappen in voller Dicke mit einem #5 Dental Explorer an, um eine vollständige Lappenerhöhung sicherzustellen (Abbildung 3B).
- Führen Sie die Osteotomie mit einem Hartmetall-Mikrohandbohrer mit einem Durchmesser von 0,3 mm durch, der an einem Stiftschraubstock (Handbohrmaschine) befestigt ist, und aktivieren Sie ihn im Uhrzeigersinn. Erstellen Sie Osteotomiestellen mit einer Tiefe von ca. 1 mm in den verheilten Extraktionsalveolen (Abbildung 3C).
- Platzieren Sie die kundenspezifischen schraubenförmigen Implantate mit einer glatten, bearbeiteten Oberfläche (1,0 mm lang und 0,5 mm Durchmesser), die aus 6AL4V-Titanstäben (Abbildung 3D) hergestellt wurden, eines pro Tier, indem Sie im Bereich des ersten und zweiten linken Oberkiefermolaren mit einer Schraubbewegung im Uhrzeigersinn selbstschneidend (Abbildung 3E-I).
- Unmittelbar nach dem Einsetzen des Implantats Schmerzmittel (Carprofen/Rimadyl 5 mg/kg alle 24 h) durch subkutane Injektion verabreichen.
- Lassen Sie die Implantate vier Wochen lang einheilen, während dieser Zeit verabreichen Sie Antibiotika und füttern Sie sie wie zuvor beschrieben.
- Stellen Sie am Ende der Heilungsphase sicher, dass die Schleimhautwunde vollständig geschlossen ist und ein hellrosa Aussehen hat.
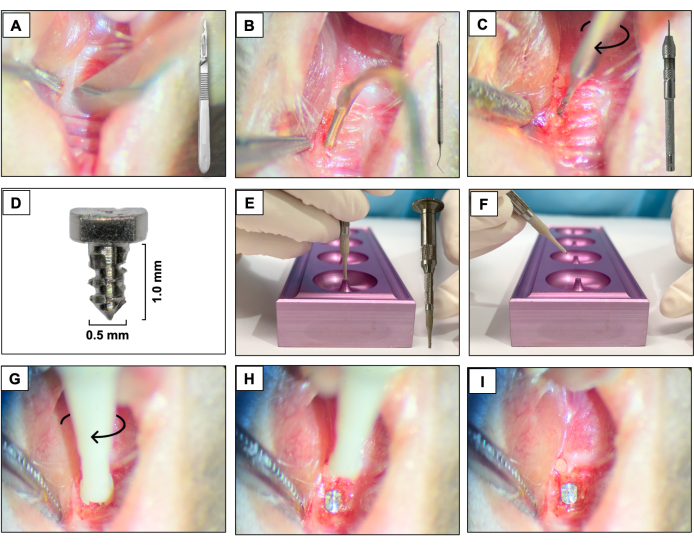
Abbildung 3: Sequenz der Implantatplatzierung: (A) Inzision mit einer 15c-Klinge, die am Griff befestigt ist. (B) Klappen in voller Dicke mit #5 Dental Explorer. (C) Osteotomie mit einem 0,3-mm-Hartmetall-Mikrohandbohrer, der an einem Schraubstock befestigt ist. (D) Titan-Zahnimplantat. (E, F) Implantatträger und Implantathalter. (G- I) Einsetzen des Implantats mit einer Schraubbewegung im Uhrzeigersinn. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Induktion der Periimplantitis
- Legen Sie eine Seidenligatur (6-0) um jede Halterung unmittelbar apikal zum Implantatkopf, indem Sie die Oberfläche des Implantats konturieren und mit einem Doppelknoten fixieren. Bewahren Sie die Ligatur zwei Wochen lang auf, damit sich eine Periimplantitis entwickeln kann.
- Überprüfen Sie die Ligaturen alle zwei Tage, um sicherzustellen, dass sie noch vorhanden sind. Wenn es fehlt, setzen Sie eine neue Ligatur ein.
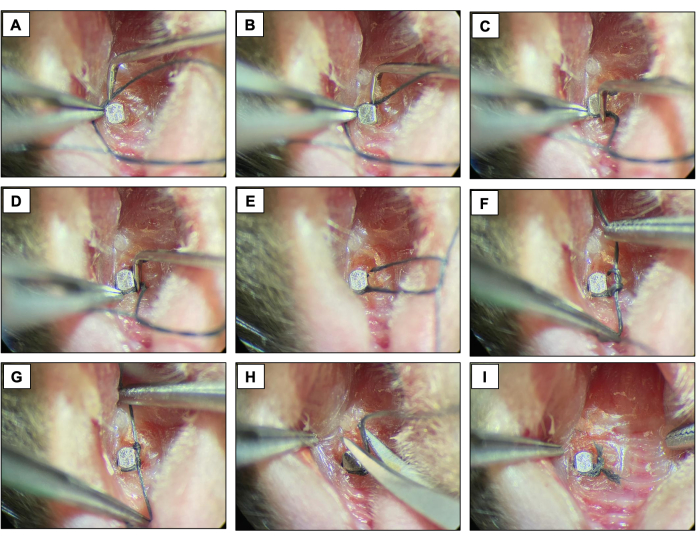
Abbildung 4: Ligatur-induzierte Periimplantitis-Sequenz. (A-D) Seidenligatur (6.0) um den Implantatkopf gelegt. (E-G) Knotenverschluss. (H) Ligaturschnitt. (I) Letztes Erscheinen. Klinische Bilder von lebenden Tieren unter Sedierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Opfer
- Nach der Periimplantitis-Induktionsphase (zwei Wochen) werden alle Tiere mit einer hohen Konzentration an inhaliertem Isofluran geopfert, gefolgt von einer sekundären Methode der Zervixluxation mit einem Stab, der in die Schädelbasis gedrückt wird und die Hinterbeine schnell zieht, wodurch die Halswirbel vom Schädel getrennt werden.
- Trennen Sie die Oberkiefer mit scharfen Instrumenten wie einer chirurgischen Schere, die den gesamten Kiefer des Tieres vom Rest des Körpers trennt.
- Fotografieren Sie die Oberkiefer mit einem Lichtmikroskop, fixieren Sie sie 24 Stunden lang in 10 % Formalin und lagern Sie sie dann in 70 % Ethanol.
6. Mikro-Computertomographie (μCT)
- Scannen Sie den Oberkiefer wie zuvor beschrieben 18,19 mit Mikro-Computertomographie (Mikro-CT).
- Schalten Sie den Scanner und den Computer ein, öffnen Sie dann die Scansoftware, klicken Sie auf das Strahlungszeichen und warten Sie 15 Minuten, um es vorzuheizen.
- Öffnen Sie die Gerätetür, indem Sie auf das Türsymbol klicken.
- Verwenden Sie einen Drehtisch in Viertelgröße. Legen Sie den Oberkiefer auf ein konisches 15-ml-Röhrchen. Befestigen Sie das Rohr in der Drehtischbasis. Setzen Sie den Drehtisch in die Geräteschraube ein.
- Schließen Sie die Gerätetür, indem Sie auf das Türsymbol klicken.
- Schalten Sie die Röntgenquelle ein.
- Klicken Sie auf das Grabbildsymbol und stellen Sie sicher, dass sich der Knochen auf dem Spielfeld befindet.
- Stellen Sie eine Auflösung von 10 μm Pixelgröße, Röntgenenergie von 55 KVp und 181 μA, Filter von AI 0,5 mm, Rotationsschritt 0,4, durchschnittliches Bild 10 ein. Diese Einstellungen generieren eine geschätzte Scanzeit von 24 Minuten.
- Starten Sie die Akquise.
- Öffnen Sie für die Rekonstruktion die Rekonstruktionssoftware. Verwenden Sie eine Strahlhärtung von 20%. Ringartefakt von 5 % verwenden. Verwenden Sie einen Dynamikbereich von 0 bis 0,13. Deaktivieren Sie die Beschriftung EIN. Klicken Sie auf Vorschau. Wählen Sie die entsprechende Ansicht aus, die für den interessierenden Bereich angezeigt wird, und speichern Sie sie als TIFF.
- Richten Sie die Bilder aus, die mit einer Software zum Anzeigen und Analysieren von Daten erhalten wurden. Machen Sie die Längsachse des Implantatkopfes parallel zur sagittalen und koronalen Achse und senkrecht zur axialen Achse.
- Speichern Sie das sagittale Bild als Einzelbild für die lineare Knochenanalyse.
- Speichern Sie das transaxiale Bild als Datensatz für die volumetrische Knochenanalyse.
- Führen Sie eine lineare Knochenanalyse mit der Analysedatensoftware durch. Messen Sie die Abstände in Millimetern zwischen dem Implantatkopf und dem Alveolarknochen in der sagittalen und koronalen Ebene, einschließlich mesialer, distaler, bukkaler und palatinaler Stellen.
- Führen Sie volumetrische Knochenanalysen mit einer Analysedatensoftware durch. Verfolgen Sie den Knochenverlust um Implantate herum, indem Sie den interessierenden Bereich in allen Objektträgern zeichnen, der dem Knochenverlust entspricht.
7. Statistische Auswertung
- Messen Sie den linearen und volumetrischen mikrotomographischen Knochenverlust und normalisieren Sie diese Werte, indem Sie jeden Wert durch den Durchschnitt der Kontrollgruppe dividieren. Präsentieren Sie einen Durchschnitt für alle Gruppen als Mittelwert ± Standardfehler des Mittelwerts (SEM).
- Vergleichen Sie die Signifikanz mit einer Zwei-Wege-Varianzanalyse (ANOVA), gefolgt von einem Tukey-Test mit einem 95%-Konfidenzintervall. (Prisma 5). Wenden Sie Signifikanzniveaus wie folgt an: p≤0,01**, p≤0,001****.
Ergebnisse
Für diese Methode wurden achtzehn 3 Wochen alte männliche Mäuse des Typs C57BL/6J verwendet und zahnärztlichen Extraktionen, Implantatinsertion und Periimplantitis-Induktion unterzogen. Es gab neun Tiere pro Gruppe, was statistisch signifikant war, wenn man den linearen Knochenverlust berücksichtigte, der 80 % Leistung, 15 % Standardabweichung (σ) und 95 % Konfidenzintervall (α = 0,05) erreichte. Mäuse wurden während des Experiments ad libitum mit einer weichen Diät gefüttert. Neun Mäuse erhielten ei...
Diskussion
Dieses Protokoll enthält einen beschreibenden Bericht über chirurgische Verfahren zur Periimplantitis-Induktion unter Verwendung eines Ligaturmodells bei Mäusen. Die Arbeit mit Mäusen hat Vorteile, wie z. B. die Kosteneffizienz, die Verfügbarkeit eines umfangreichen genetischen Arrays angesichts der vielen Hintergründe23 und andere Aspekte24,25. Im Laufe der Jahre haben mehrere Studien Mäuse erfolgreich im medizinischen und zahnärz...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde vom NIH/NIDCR DE031431 unterstützt. Wir danken dem Translational Pathology Core Laboratory an der UCLA für die Unterstützung bei der Erstellung der entkalkten histologischen Schnitte.
Materialien
| Name | Company | Catalog Number | Comments |
| #5 dental explorer | Hu-Friedy, Chicago, IL | 392-0911 | Dental luxation |
| 15c blade and surgical scalpel | Henry Schein Inc., Melville, NY | 1126186 | Tissue incision |
| 6-0 silk ligatures | Fisher Scientific, Hampton, NH | NC9201232 | Ligature |
| Amoxicillin 50μg/mL | Zoetis, San Diego, CA | TS/DRUGS/57/2003 | Oral suspension |
| Bacon Soft Diet | Bio Serve®, Frenchtown, NJ | 14-726-701 | - |
| C57BL/6J male mice | The Jackson Laboratories, Bar Harbor, ME, USA | 000664 | Age: 3-week-old |
| CTAn software | V.1.16 Bruker, Billerica, MA | - | Volumetric analysis |
| Dolphin software | Navantis, Toronto, CA | - | Linear bone analysis |
| Implant carrier & Tip | D. P. Machining Inc., La Verne, CA | Unique product | Implant holder |
| Implant support | D. P. Machining Inc., La Verne, CA | Unique product | Implant capture |
| Isoflurane | Vet One, Boise, ID | NDC13985-528-60 | Inhalational anesthetic |
| Micro-CT scan 1172 | SkyScan, Kontich, Belgium | - | μCT scans |
| Nrecon Software | Bruker Corporation, Billerica, MA | - | Images reconstruction |
| Ø 0.3mm - L 2.5mm Micro Drills | Sphinx, Hoffman Estates, IL | ART. 50699 | Osteotomy |
| Ø 0.5mm - L 1.0mm Titanium implants | D. P. Machining Inc., La Verne, CA | Unique product | - |
| Ophthalmic lubricant | Apexa, Ontario, CA | NDC13985-600-03 | Artificial tears |
| Pin Vise | General Tools, Secaucus, NJ | 90 | Osteotomy |
| Rimadyl 50mg/ml | Zoetis, San Diego, CA | 4019449 | Anti-inflammatory |
| Sterile cotton tipped | Dynarex, Glendale, AZ | 4304-1 | Hemostasis |
| Tip forceps | Fine Science Tools, Foster City, CA | 11071-10 | Dental Extraction |
| Tying forceps | Fine Science Tools, Foster City, CA | 18025-10 | Ligature placement |
Referenzen
- Ho, K., et al. A cross-sectional survey of patient's perception and knowledge of dental implants in japan. Int J Implant Dent. 8 (1), 14 (2022).
- Elani, H. W., Starr, J. R., Da Silva, J. D., Gallucci, G. O. Trends in dental implant use in the u.S., 1999-2016, and projections to 2026. J Dent Res. 97 (13), 1424-1430 (2018).
- Renvert, S., Persson, G. R., Pirih, F. Q., Camargo, P. M. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 45, S278-S285 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 449 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases-the efp s3 level clinical practice guideline. J Clin Periodontol. 50, 4-76 (2023).
- Graziani, F., Figuero, E., Herrera, D. Systematic review of quality of reporting, outcome measurements and methods to study efficacy of preventive and therapeutic approaches to peri-implant diseases. J Clin Periodontol. 39, 224-244 (2012).
- Schwarz, F., Derks, J., Monje, A., Wang, H. L. Peri-implantitis. J Periodontol. 89, S267-S290 (2018).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Mouse Genome Sequencing, C. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Pirih, F. Q., et al. Ligature-induced peri-implantitis in mice. J Periodontal Res. 50 (4), 519-524 (2015).
- Rau, C. D., et al. High-density genotypes of inbred mouse strains: Improved power and precision of association mapping. G3. 5 (10), 2021-2026 (2015).
- Schwarz, F., Sculean, A., Engebretson, S. P., Becker, J., Sager, M. Animal models for peri-implant mucositis and peri-implantitis. Periodontol 2000. 68 (1), 168-181 (2015).
- Varon-Shahar, E., et al. Peri-implant alveolar bone resorption in an innovative peri-implantitis murine model: Effect of implant surface and onset of infection. Clin Implant Dent Relat Res. 21 (4), 723-733 (2019).
- Pirih, F. Q., et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis. J Oral Implantol. 41 (5), e158-e164 (2015).
- Schwarz, F., et al. Influence of antiresorptive/antiangiogenic therapy on the extension of experimentally induced peri-implantitis lesions. Clin Oral Investig. 27 (6), 3009-3019 (2023).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Wong, R. L., et al. Early intervention of peri-implantitis and periodontitis using a mouse model. J Periodontol. 89 (6), 669-679 (2018).
- Hiyari, S., et al. Ligature-induced peri-implantitis and periodontitis in mice. J Clin Periodontol. 45 (1), 89-99 (2018).
- Nguyen Vo, T. N., et al. Ligature induced peri-implantitis: Tissue destruction and inflammatory progression in a murine model. Clin Oral Implants Res. 28 (2), 129-136 (2017).
- Yuan, S., et al. Comparative transcriptome analysis of gingival immune-mediated inflammation in peri-implantitis and periodontitis within the same host environment. J Inflamm Res. 15, 3119-3133 (2022).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. J Periodontol. 89, S313-S318 (2018).
- Hiyari, S., et al. Genomewide association study identifies cxcl family members as partial mediators of lps-induced periodontitis. J Bone Miner Res. 33 (8), 1450-1463 (2018).
- Kantarci, A., Hasturk, H., Van Dyke, T. E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 68 (1), 66-82 (2015).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental animal models in periodontology: A review. Open Dent J. 4, 37-47 (2010).
- Erata, E., et al. Cnksr2 loss in mice leads to increased neural activity and behavioral phenotypes of epilepsy-aphasia syndrome. J Neurosci. 41 (46), 9633-9649 (2021).
- Fakih, D., Guerrero-Moreno, A., Baudouin, C., Reaux-Le Goazigo, A., Parsadaniantz, S. M. Capsazepine decreases corneal pain syndrome in severe dry eye disease. J Neuroinflammation. 18 (1), 111 (2021).
- Douam, F., Ploss, A. The use of humanized mice for studies of viral pathogenesis and immunity. Curr Opin Virol. 29, 62-71 (2018).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), (2021).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Silva, D. N. A., et al. Probiotic lactobacillus rhamnosus em1107 prevents hyperglycemia, alveolar bone loss, and inflammation in a rat model of diabetes and periodontitis. J Periodontol. 94 (3), 376-388 (2023).
- Kim, Y. G., et al. 6-shogaol, an active ingredient of ginger, inhibits osteoclastogenesis and alveolar bone resorption in ligature-induced periodontitis in mice. J Periodontol. 91 (6), 809-818 (2020).
- Fine, N., et al. Periodontal inflammation primes the systemic innate immune response. J Dent Res. 100 (3), 318-325 (2021).
- Yu, X., et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis. J Periodontal Res. 53 (1), 98-106 (2018).
- Reinedahl, D., Chrcanovic, B., Albrektsson, T., Tengvall, P., Wennerberg, A. Ligature-induced experimental peri-implantitis-a systematic review. J Clin Med. 7 (12), (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten