需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠结扎诱导种植体周围炎的实验模型
摘要
这是一份关于小鼠结扎诱导的种植体周围炎实验模型的报告。我们描述了所有手术步骤,从动物的术前和术后管理、拔牙、植入物放置和结扎诱导的种植体周围炎。
摘要
种植牙的成功率和存活率都很高。然而,种植体周围炎 (PI) 等并发症的治疗非常具有挑战性。PI 的特征是种植牙周围组织发炎,支撑骨逐渐丧失。为了优化种植牙在健康和功能方面的寿命,了解种植体周围炎的病理生理学至关重要。在这方面,在研究中使用小鼠模型已被证明在重建临床环境方面有明显的好处。本研究旨在描述小鼠结扎诱导的种植体周围炎的实验模型,并确定在观察到的骨骼和组织变化的情况下是否有效诱导这种疾病。实验性种植体周围炎诱导包括以下步骤:拔牙、种植体放置和结扎诱导 PI。将18只3周龄C57BL/6J雄性小鼠的样本分为结扎组(N=9)和对照非结扎组(N=9)两组。对临床、影像学和组织学因素进行评估。与非结扎组相比,结扎组的骨质流失、软组织水肿增加和顶端上皮迁移明显更高。得出的结论是,这种临床前模型可以成功诱导小鼠种植体周围炎。
引言
种植牙作为替代缺失牙齿的理想选择越来越普遍1.到 2026 年,美国成年人口中种植牙的普及率预计将增加到 23%2。根据 Grand View Research 的市场分析报告(2022 年),预计 2022 年全球种植牙市场规模将达到约 46 亿美元。此外,预计到 2030 年,它将呈现出 10% 左右的稳定年增长率3.不幸的是,使用种植牙会导致并发症,例如种植体周围炎。种植体周围炎被定义为一种生物膜诱发的疾病,其特征是种植体周围粘膜发炎,随后支撑骨逐渐丧失4。
一项系统评价发现,患者水平种植体周围炎的平均患病率为 19.53%(95% 置信区间 [CI],12.87-26.19%),种植体水平为 12.53%(95% CI 11.67-13.39%)5。由于种植体失败的增加,以及因此产生的大量治疗费用,种植体周围炎代表了日益增长的公共卫生6.
了解种植体周围炎的发病机制对于开发一种系统的方法以防止其发生和发展以及最大限度地延长种植体的美学和功能至关重要7,8。从这个意义上说,在牙科研究中使用小鼠模型已被证明是有利的,因为小鼠与人类共享超过95%的基因9,10,可用的在线遗传数据库的数量,以及重现临床场景的能力11。所有描述的优点都允许剖析不同疾病中的遗传机制12,可获得的调节和管理,以及作为人体panel广泛使用的抗体,超出了用于炎症组织评估和疾病定位的遗传修饰可用性(例如,敲除和过表达)13。虽然有利,但很少有关于小鼠种植体周围炎的出版物。这是由于方法学上的挑战,其中包括获得或安装微型植入物的困难。
为了在小鼠中发生种植体周围炎,已经描述了许多方案,例如结扎诱导的种植体周围炎、细菌诱导的种植体周围炎14、脂多糖 (LPS) 诱导的种植体周围炎15 或联合 LPS + 结扎诱导的种植体周围炎16。在这里,我们将重点介绍结扎模型,因为它是诱发牙周炎 17,18,19 和最近的种植体周围炎20,21 的最广泛接受的方法。在植入物周围放置在粘膜下位置的结扎会刺激斑块积聚,从而刺激组织发炎。因此,这种方法的发展是基于一种可行的成本效益技术,用于种植体周围疾病的临床前研究。本研究旨在描述小鼠结扎诱导的种植体周围炎的实验模型,并确定根据观察到的骨骼和组织变化是否有效诱导这种疾病。
本文的总体目标是报告应用于通过结扎诱导小鼠种植体周围炎的方案,并通过组织评估和植入物周围的骨质流失来观察其有效性。
研究方案
涉及动物受试者的程序已获得加州大学洛杉矶分校校长动物研究委员会(ARC 协议编号 2002-125)和动物研究:报告体内实验 (ARRIVE)22 的批准。对于这种方法,使用18只3周龄的C57BL / 6J雄性小鼠并进行了拔牙,种植体放置和种植体周围炎诱导。所有牙科手术均在10×显微放大倍率下进行,并由经过培训和校准的操作员进行(图1A)。
1. 预提取步骤
- 在符合所有生物安全和保护标准的手术室中执行手术。
- 使用 70% 异丙醇溶液对所有表面进行三重摩擦的无菌。
- 用 3% 异氟烷麻醉 3 周龄 C57BL/6J 雄性小鼠。检查爪子在触摸时是否缺乏反应,以确保获得足够的麻醉深度。
- 为避免干扰口腔程序,请使用鼻锥维持异氟醚麻醉。
- 有一个辅助操作员来稳定动物并保持嘴巴张开(图1B)。
- 在开始拔牙前涂抹眼科润滑剂,以防止刺激眼睛。
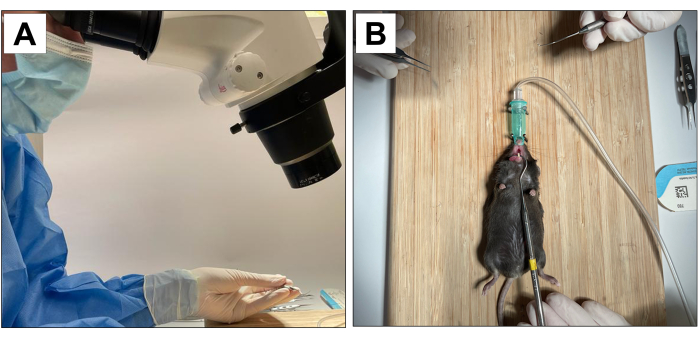
图1:手术适应: (A)显微放大倍率。(B) 适应吸入麻醉系统和张口稳定。 请点击这里查看此图的较大版本.
2. 拔牙
- 对于拔牙,在第一磨牙和第二磨牙之间引入 #5 牙科探查器,通过沿近远方向移动器械直到牙齿在牙槽中移动来开始抬高和脱位程序(图 2A)。
- 接下来,在第一磨牙的近中部位介绍#5牙科探查器。为此,请沿近远方向移动器械,直到牙齿在牙槽中移动。
- 抬高后,使用尖端镊子和缝合镊子去除第一 磨牙。
- 接下来,在第2 和第 3 磨牙之间引入牙科探查器,以抬高和脱位第2 磨牙(图 2B)。
- 然后,使用尖端镊子和/或缝合镊子将牙齿取出,使用器械将其固定并从口腔中取出。(图2C)。
- 拔牙后,使用无菌棉尖(图2D)1分钟(图2E,F)确保完全止血。
- 提取后立即每24小时向所有动物提供止痛药(卡洛芬/利马地尔5mg / kg)。通过皮下注射给药。
- 此外,用软食代替普通食物。通过将药物掺入饮用水中口服抗生素(Amoxil 0.25 mg/mL)。拔牙后持续四个星期。
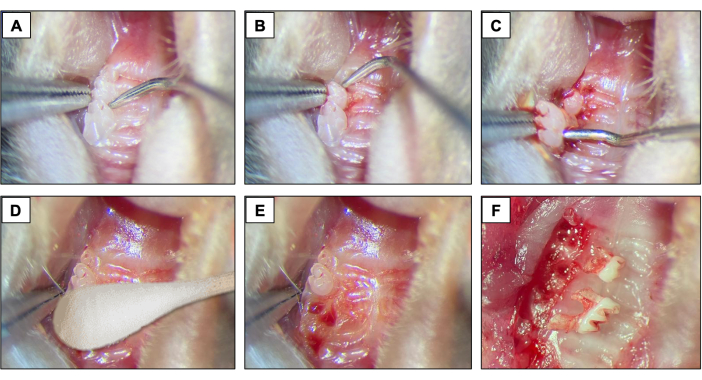
图 2:初始拔牙顺序: (A、 B) 具有第 1 和第 2 磨牙的上颌区域,并使用牙科探查器进行抬高和脱位。(C) 使用尖端镊子和探牙器进行脱位和拔牙。(d) 止血。(英、 女)拔牙后的肺泡外观。 请点击这里查看此图的较大版本.
3. 植入物放置
- 使用 15c 刀片,在与先前存在的牙齿相对应的区域的角质化组织中创建一个近远端切口。使用右上颌磨牙作为空间参考(图3A)。
- 使用 #5 牙科探测器抬起颊部和腭部全层皮瓣,确保皮瓣完全抬高(图 3B)。
- 使用连接到销钳(手钻)的直径为 0.3 毫米的硬质合金微型手钻进行截骨术,并以顺时针旋转的方式激活它。在愈合的拔牙窝中创建约1毫米深的截骨部位(图3C)。
- 将定制设计的螺旋形植入物与光滑的加工表面(1.0 mm长,0.5 mm)放置,该表面由6AL4V钛棒制成(图3D),每只动物一个,通过顺时针拧紧在第一和第二上颌左磨牙区域自攻(图3E-I)。
- 植入植入物后,立即通过皮下注射给予止痛药(卡洛芬/利马地尔 5mg/kg,每 24 小时一次)。
- 让植入物愈合四个星期,在此期间给予抗生素和如前所述的喂养。
- 在愈合期结束时,确保粘膜伤口完全闭合并具有浅粉红色的外观。
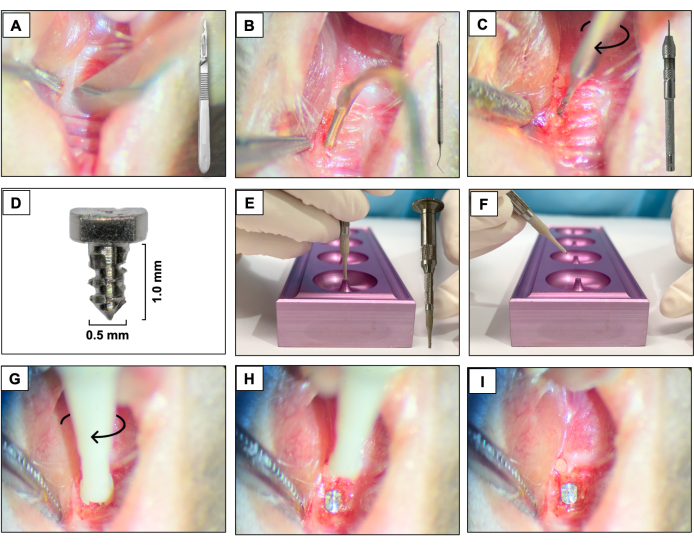
图 3:植入物放置顺序: (A) 使用连接到手柄的 15c 刀片进行切口。(B) 使用 #5 牙科探查器进行全厚度皮瓣。(C) 使用连接到销钳的 0.3 毫米硬质合金微型手钻进行截骨术。(D) 钛合金种植牙。(英、女)种植体支架和种植体支架。(G-我)使用顺时针拧紧运动放置植入物。 请点击这里查看此图的较大版本.
4. 种植体周围炎诱导
- 通过勾勒植入物表面并用双结固定,在紧邻植入物头部顶端的每个固定装置周围放置丝绸结扎 (6-0)。保持结扎两周,允许种植体周围炎的发展。
- 每两天检查一次结扎,以确保它们仍然存在。如果缺少,请放置新的连字。
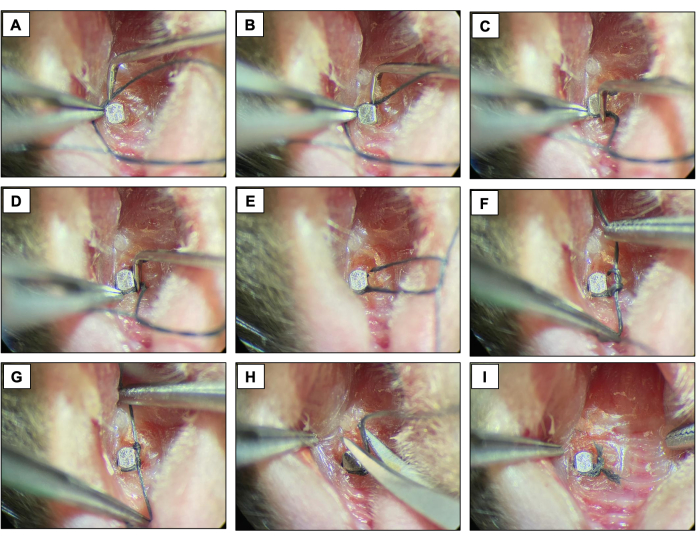
图 4:结扎诱导的种植体周围炎序列。 (A-D)将丝结扎 (6.0) 放置在植入物头周围。(E-G)打结。(H) 结扎切割。(一)最终出场。在镇静下从活体动物获得的临床图像。 请点击这里查看此图的较大版本.
5. 牺牲
- 在种植体周围炎诱导期(两周)后,用高浓度吸入的异氟烷处死所有动物,然后进行颈椎脱位的辅助方法,将一根棒压入颅底并迅速拉动后肢,导致颈椎与颅骨分离。
- 使用锋利的器械(例如手术剪刀)分离上颌骨,将动物的整个下颌与身体的其他部分分开。
- 使用光学显微镜拍摄上颌骨,将其固定在10%福尔马林中24小时,然后储存在70%乙醇中。
6. 显微计算机断层扫描(μCT)
- 如前所述,使用显微计算机断层扫描 (micro-CT) 扫描扫描上颌骨18,19。
- 打开扫描仪和电脑,然后打开扫描软件,点击辐射标志,等待15分钟预热。
- 通过单击门图标打开设备门。
- 使用四分之一尺寸的转盘。将上颌骨放在 15 毫升锥形管上。将管子固定在转盘底座中。将转台放入设备螺钉中。
- 通过单击门图标关闭设备门。
- 打开 X 射线源。
- 单击抓取图像图标并确保骨头在场上。
- 调整分辨率为10μm像素大小,X射线能量为55KVp和181μA,滤光片为AI0.5mm,旋转步长为0.4,平均帧数为10。这些设置将生成 24 分钟的估计扫描时间。
- 开始收购。
- 对于重建,请打开重建软件。使用20%的梁硬化。使用5%的环形伪影。使用 0-0.13 的动态范围。取消选择标签 ON。单击 "预览"。选择感兴趣区域所看到的适当视图,并将其另存为 TIFF。
- 使用软件对获得的图像进行定向,以查看和分析数据。使种植头的长轴平行于矢状轴和冠状轴,垂直于轴轴。
- 将矢状面图像保存为单个图像以进行线性骨分析。
- 将跨轴图像另存为体积骨分析的数据集。
- 使用分析数据软件进行线性骨骼分析。测量矢状面和冠状面(包括近中、远端、颊部和腭部)种植体头和牙槽骨之间的距离(以毫米为单位)。
- 使用分析数据软件进行体积骨分析。通过在所有载玻片中绘制与骨质流失相对应的感兴趣区域来跟踪植入物周围的骨质流失。
7. 统计分析
- 测量线性和体积显微断层扫描骨质流失,并通过将每个值除以对照组的平均值来使这些值归一化。显示所有组的平均值,作为平均值±均值的标准误差 (SEM)。
- 使用双因素方差分析 (ANOVA) 比较显著性,然后使用 95% 置信区间的 Tukey 检验。(棱镜 5)。应用显著性水平如下:p≤0.01**、p≤0.001****。
结果
对于这种方法,使用18只3周龄的C57BL / 6J雄性小鼠并进行了拔牙,种植体放置和种植体周围炎诱导。每组有9只动物,具有统计学意义,考虑到线性骨质流失达到80%的功效,15%的标准差(σ)和95%的置信区间(α = 0.05)。在实验期间,小鼠被 随意 喂食软饮食。9只小鼠接受结扎(结扎诱导的种植体周围炎实验组),9只小鼠未接受结扎(对照组)。
种植体骨整合的成?...
讨论
该协议提供了利用小鼠结扎模型诱导种植体周围炎的外科手术的描述性报告。与小鼠一起工作具有优势,例如具有成本效益,考虑到许多背景23等方面,广泛的遗传阵列的可用性24,25。多年来,一些研究成功地将小鼠用于医学和牙科领域,包括种植体周围炎26,27,28。<...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NIH/NIDCR DE031431的支持。我们要感谢加州大学洛杉矶分校转化病理学核心实验室在准备脱钙组织学切片方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| #5 dental explorer | Hu-Friedy, Chicago, IL | 392-0911 | Dental luxation |
| 15c blade and surgical scalpel | Henry Schein Inc., Melville, NY | 1126186 | Tissue incision |
| 6-0 silk ligatures | Fisher Scientific, Hampton, NH | NC9201232 | Ligature |
| Amoxicillin 50μg/mL | Zoetis, San Diego, CA | TS/DRUGS/57/2003 | Oral suspension |
| Bacon Soft Diet | Bio Serve®, Frenchtown, NJ | 14-726-701 | - |
| C57BL/6J male mice | The Jackson Laboratories, Bar Harbor, ME, USA | 000664 | Age: 3-week-old |
| CTAn software | V.1.16 Bruker, Billerica, MA | - | Volumetric analysis |
| Dolphin software | Navantis, Toronto, CA | - | Linear bone analysis |
| Implant carrier & Tip | D. P. Machining Inc., La Verne, CA | Unique product | Implant holder |
| Implant support | D. P. Machining Inc., La Verne, CA | Unique product | Implant capture |
| Isoflurane | Vet One, Boise, ID | NDC13985-528-60 | Inhalational anesthetic |
| Micro-CT scan 1172 | SkyScan, Kontich, Belgium | - | μCT scans |
| Nrecon Software | Bruker Corporation, Billerica, MA | - | Images reconstruction |
| Ø 0.3mm - L 2.5mm Micro Drills | Sphinx, Hoffman Estates, IL | ART. 50699 | Osteotomy |
| Ø 0.5mm - L 1.0mm Titanium implants | D. P. Machining Inc., La Verne, CA | Unique product | - |
| Ophthalmic lubricant | Apexa, Ontario, CA | NDC13985-600-03 | Artificial tears |
| Pin Vise | General Tools, Secaucus, NJ | 90 | Osteotomy |
| Rimadyl 50mg/ml | Zoetis, San Diego, CA | 4019449 | Anti-inflammatory |
| Sterile cotton tipped | Dynarex, Glendale, AZ | 4304-1 | Hemostasis |
| Tip forceps | Fine Science Tools, Foster City, CA | 11071-10 | Dental Extraction |
| Tying forceps | Fine Science Tools, Foster City, CA | 18025-10 | Ligature placement |
参考文献
- Ho, K., et al. A cross-sectional survey of patient's perception and knowledge of dental implants in japan. Int J Implant Dent. 8 (1), 14 (2022).
- Elani, H. W., Starr, J. R., Da Silva, J. D., Gallucci, G. O. Trends in dental implant use in the u.S., 1999-2016, and projections to 2026. J Dent Res. 97 (13), 1424-1430 (2018).
- Renvert, S., Persson, G. R., Pirih, F. Q., Camargo, P. M. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 45, S278-S285 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 449 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases-the efp s3 level clinical practice guideline. J Clin Periodontol. 50, 4-76 (2023).
- Graziani, F., Figuero, E., Herrera, D. Systematic review of quality of reporting, outcome measurements and methods to study efficacy of preventive and therapeutic approaches to peri-implant diseases. J Clin Periodontol. 39, 224-244 (2012).
- Schwarz, F., Derks, J., Monje, A., Wang, H. L. Peri-implantitis. J Periodontol. 89, S267-S290 (2018).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Mouse Genome Sequencing, C. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Pirih, F. Q., et al. Ligature-induced peri-implantitis in mice. J Periodontal Res. 50 (4), 519-524 (2015).
- Rau, C. D., et al. High-density genotypes of inbred mouse strains: Improved power and precision of association mapping. G3. 5 (10), 2021-2026 (2015).
- Schwarz, F., Sculean, A., Engebretson, S. P., Becker, J., Sager, M. Animal models for peri-implant mucositis and peri-implantitis. Periodontol 2000. 68 (1), 168-181 (2015).
- Varon-Shahar, E., et al. Peri-implant alveolar bone resorption in an innovative peri-implantitis murine model: Effect of implant surface and onset of infection. Clin Implant Dent Relat Res. 21 (4), 723-733 (2019).
- Pirih, F. Q., et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis. J Oral Implantol. 41 (5), e158-e164 (2015).
- Schwarz, F., et al. Influence of antiresorptive/antiangiogenic therapy on the extension of experimentally induced peri-implantitis lesions. Clin Oral Investig. 27 (6), 3009-3019 (2023).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Wong, R. L., et al. Early intervention of peri-implantitis and periodontitis using a mouse model. J Periodontol. 89 (6), 669-679 (2018).
- Hiyari, S., et al. Ligature-induced peri-implantitis and periodontitis in mice. J Clin Periodontol. 45 (1), 89-99 (2018).
- Nguyen Vo, T. N., et al. Ligature induced peri-implantitis: Tissue destruction and inflammatory progression in a murine model. Clin Oral Implants Res. 28 (2), 129-136 (2017).
- Yuan, S., et al. Comparative transcriptome analysis of gingival immune-mediated inflammation in peri-implantitis and periodontitis within the same host environment. J Inflamm Res. 15, 3119-3133 (2022).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. J Periodontol. 89, S313-S318 (2018).
- Hiyari, S., et al. Genomewide association study identifies cxcl family members as partial mediators of lps-induced periodontitis. J Bone Miner Res. 33 (8), 1450-1463 (2018).
- Kantarci, A., Hasturk, H., Van Dyke, T. E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 68 (1), 66-82 (2015).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental animal models in periodontology: A review. Open Dent J. 4, 37-47 (2010).
- Erata, E., et al. Cnksr2 loss in mice leads to increased neural activity and behavioral phenotypes of epilepsy-aphasia syndrome. J Neurosci. 41 (46), 9633-9649 (2021).
- Fakih, D., Guerrero-Moreno, A., Baudouin, C., Reaux-Le Goazigo, A., Parsadaniantz, S. M. Capsazepine decreases corneal pain syndrome in severe dry eye disease. J Neuroinflammation. 18 (1), 111 (2021).
- Douam, F., Ploss, A. The use of humanized mice for studies of viral pathogenesis and immunity. Curr Opin Virol. 29, 62-71 (2018).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), (2021).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Silva, D. N. A., et al. Probiotic lactobacillus rhamnosus em1107 prevents hyperglycemia, alveolar bone loss, and inflammation in a rat model of diabetes and periodontitis. J Periodontol. 94 (3), 376-388 (2023).
- Kim, Y. G., et al. 6-shogaol, an active ingredient of ginger, inhibits osteoclastogenesis and alveolar bone resorption in ligature-induced periodontitis in mice. J Periodontol. 91 (6), 809-818 (2020).
- Fine, N., et al. Periodontal inflammation primes the systemic innate immune response. J Dent Res. 100 (3), 318-325 (2021).
- Yu, X., et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis. J Periodontal Res. 53 (1), 98-106 (2018).
- Reinedahl, D., Chrcanovic, B., Albrektsson, T., Tengvall, P., Wennerberg, A. Ligature-induced experimental peri-implantitis-a systematic review. J Clin Med. 7 (12), (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。