É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo Experimental de Periimplantite Induzida por Ligadura em Camundongos
Neste Artigo
Resumo
Este é um relato de um modelo experimental de periimplantite induzida por ligadura em camundongos. Descrevemos todos os passos cirúrgicos, desde o manejo pré e pós-operatório dos animais, extrações, colocação de implantes e periimplantite induzida por ligadura.
Resumo
Os implantes dentários têm uma alta taxa de sucesso e sobrevivência. No entanto, complicações como a periimplantite (IP) são altamente desafiadoras de tratar. O IP é caracterizado por inflamação nos tecidos ao redor dos implantes dentários com perda progressiva do osso de suporte. Para otimizar a longevidade dos implantes dentários em termos de saúde e funcionalidade, é crucial compreender a fisiopatologia da peri-implantite. Nesse sentido, o uso de modelos de camundongos em pesquisas tem comprovado benefícios claros na recriação de circunstâncias clínicas. Este estudo teve como objetivo descrever um modelo experimental de periimplantite induzida por ligadura em camundongos e determinar se há efetividade na indução desta doença, dadas as alterações ósseas e teciduais observadas. A indução experimental da periimplantite compreende as seguintes etapas: extração dentária, colocação do implante e PI induzido por ligadura. Uma amostra de dezoito camundongos machos C57BL/6J com 3 semanas de idade foi dividida em dois grupos, ligadura (N=9) e controle não ligadura (N=9). Foi realizada avaliação de fatores clínicos, radiográficos e histológicos. O grupo ligadura apresentou perda óssea significativamente maior, aumento do edema de partes moles e migração epitelial apical do que o grupo sem ligadura. Concluiu-se que este modelo pré-clínico pode induzir periimplantite com sucesso em camundongos.
Introdução
Os implantes dentários são cada vez mais prevalentes como uma escolha desejável para substituir dentes perdidos1. Projeta-se que a prevalência de implantes dentários na população adulta dos EUA aumente até 23% até 20262. Com base em um relatório de análise de mercado da Grand View Research (2022), o tamanho do mercado global de implantes dentários foi projetado para atingir aproximadamente US $ 4,6 bilhões em 2022. Além disso, prevê-se que apresente uma taxa de crescimento anual constante de cerca de 10% até ao ano de 20303. Infelizmente, o uso de implantes dentários pode levar a complicações, como a periimplantite. A periimplantite tem sido definida como uma condição induzida por biofilme caracterizada por inflamação na mucosa peri-implantar e subsequente perda progressiva do osso desustentação4.
Uma revisão sistemática constatou que a prevalência média de periimplantite foi de 19,53% (intervalo de confiança [IC] 95%, 12,87 a 26,19%) no nível do paciente e 12,53% (IC 95% 11,67 a 13,39%) no nível do implante5. A periimplantite representa uma saúde pública crescente, devido ao aumento da falha do implante e, consequentemente, dos custos substanciais dotratamento6.
A compreensão da patogênese da periimplantite é crucial para o desenvolvimento de uma abordagem sistemática que previna seu aparecimento e progressão e maximize a longevidade dos implantes dentários em termos de estética efunção7,8. Nesse sentido, o uso de modelos murinos em pesquisas odontológicas tem se mostrado vantajoso, uma vez que camundongos compartilham mais de 95% de seus genes com humanos 9,10, o número de bancos de dados genéticos on-line disponíveis e a capacidade de reproduzir cenários clínicos11. Todas as vantagens descritas permitem a dissecção de mecanismos genéticos em diferentesdoenças12, acomodações e manejo acessíveis e anticorpos amplamente disponíveis na forma de painéis humanos, além da disponibilidade de modificações genéticas (por exemplo, knockout e superexpressão) para avaliação do tecido inflamatório e mapeamento dadoença13. Apesar de vantajosa, há poucas publicações abordando a periimplantite em camundongos. Isso se deve a desafios metodológicos, entre outros, incluindo a dificuldade na obtenção de mini-implantes ou sua instalação.
Para o desenvolvimento de periimplantite em camundongos, muitos protocolos têm sido descritos, como a periimplantite induzida por ligadura, a periimplantite induzida porbactérias14, a periimplantite induzida por lipopolissacarídeo (LPS)15 ou a combinação LPS + periimplantite induzida por ligadura16. Aqui, enfocaremos o modelo de ligadura por ser o método mais aceito para induzir periodontite17,18,19 e, mais recentemente, periimplantite20,21. A ligadura colocada ao redor dos implantes em posição submucosa estimula o acúmulo de placa e, consequentemente, a inflamação tecidual. Assim, o desenvolvimento dessa abordagem baseia-se na indicação de uma técnica custo-benefício viável para investigações pré-clínicas de doenças peri-implantares. Este estudo tem como objetivo descrever um modelo experimental de peri-implantite induzida por ligadura em camundongos e determinar se há eficácia na indução desta doença diante das alterações ósseas e teciduais observadas.
O objetivo geral deste artigo é relatar o protocolo aplicado para induzir peri-implantite em camundongos por ligadura e observar sua eficácia através da avaliação tecidual e perda óssea ao redor dos implantes.
Protocolo
Procedimentos envolvendo cobaias animais foram aprovados pelo Chancellor's Animal Research Committee da Universidade da Califórnia, Los Angeles (protocolo ARC número 2002-125), e pelo Animal Research: Reporting In Vivo Experiments (ARRIVE)22. Para este método, dezoito camundongos machos C57BL/6J com 3 semanas de idade foram utilizados e submetidos a extrações dentárias, colocação de implantes e indução de periimplantite. Todos os procedimentos odontológicos foram realizados sob aumento microscópico de 10× e realizados por operadores treinados e calibrados (Figura 1A).
1. Etapas de pré-extração
- Realizar o procedimento em sala cirúrgica obedecendo a todas as normas de biossegurança e proteção.
- Realizar assepsia de todas as superfícies com triplo atrito utilizando solução de álcool isopropílico a 70%.
- Anestesiar camundongos machos C57BL/6J com 3 semanas de idade com isoflurano a 3%. Verifique a ausência de resposta à retirada da pata ao toque para garantir que a profundidade anestésica suficiente seja obtida.
- Para não interferir nos procedimentos na boca, use um cone nasal para manter a anestesia com isoflurano.
- Ter um operador auxiliar para estabilizar o animal e manter a abertura bucal (Figura 1B).
- Aplique lubrificante oftálmico, para evitar irritação nos olhos antes de iniciar a extração.
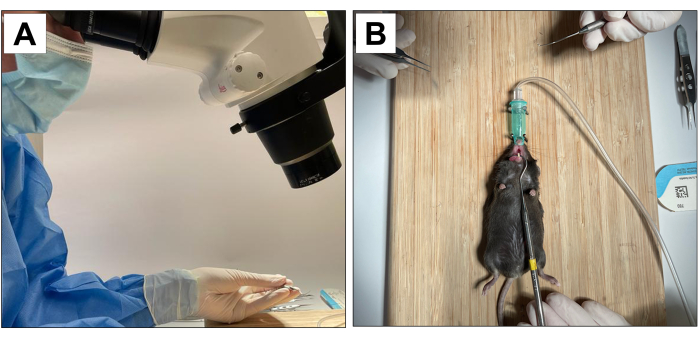
Figura 1: Adaptações operatórias: (A) Magnificação microscópica. (B) Sistema de anestesia inalatória adaptado e estabilização para abertura bucal. Clique aqui para ver uma versão maior desta figura.
2. Extração dentária
- Para as extrações dentárias, introduzir um explorador dentário #5 entre o primeiro e o segundo molar para iniciar os procedimentos de elevação e luxação, movendo o instrumento no sentido mesio-distal até que o dente se mova no alvéolo (Figuras 2A).
- Em seguida, introduza o explorador dentário #5 no sítio mesial do primeiro molar. Faça isso movendo o instrumento no sentido mesio-distal até que o dente se mova no alvéolo.
- Após a elevação, utilizar a pinça de ponta e a pinça de amarração de sutura para remover o1º molar.
- Em seguida, introduzir o explorador dentário entre o 2ºe o 3º molar para elevar e luxar o2º molar (Figura 2B).
- Em seguida, utilize a pinça de ponta e/ou a pinça de amarração de sutura para retirar o dente usando os instrumentos para segurá-lo e retirá-lo da boca. (Figura 2C).
- Após as extrações dentárias, garantir a obtenção da hemostasia completa com o uso de algodão estéril inclinado (Figura 2D) por 1 min (Figura 2E,F).
- Imediatamente após a extração, fornecer a todos os animais medicação para dor (Carprofeno/Rimadyl 5 mg/kg) a cada 24 h. Administrar a medicação através de injeção subcutânea.
- Além disso, substitua a alimentação regular por uma dieta suave. Administrar o antibiótico (Amoxil 0,25 mg/mL) por via oral, incorporando o medicamento na água potável. Faça isso por quatro semanas após as extrações.
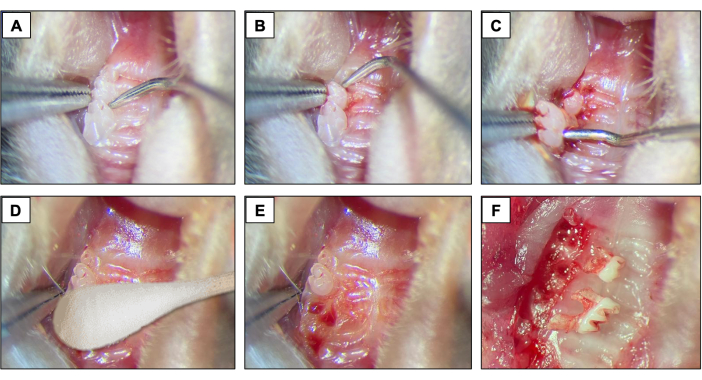
Figura 2: Sequência inicial das extrações: (A, B) Região maxilar com dentes de 1º e 2º molares e uso de explorador dentário para elevação e luxação. (C) Utilização da pinça de ponta e explorador para luxação e retirada dos dentes. (D) Hemostasia. (E, F) Aspecto alveolar após extrações. Clique aqui para ver uma versão maior desta figura.
3. Colocação de implantes
- Usando uma lâmina de 15c, crie uma incisão mesiodistal através do tecido queratinizado na área correspondente aos dentes anteriormente presentes. Utilizar os molares superiores direitos como referência espacial (Figura 3A).
- Elevar os retalhos vestibulares e palatinos de espessura total utilizando um explorador dentário #5, garantindo a elevação completa do retalho (Figura 3B).
- Realizar a osteotomia utilizando uma microbroca manual de carboneto de 0,3 mm de diâmetro acoplada a uma Pino Vise (broca manual) e ativá-la em rotação no sentido horário. Criar sítios de osteotomia com aproximadamente 1 mm de profundidade nos alvéolos de extração cicatrizados (Figura 3C).
- Colocar os implantes em forma de parafuso personalizados com superfície lisa usinada (1,0 mm de comprimento e 0,5 mm de diâmetro) fabricados com hastes de titânio 6AL4V (Figura 3D), uma por animal, auto-roscando na região do primeiro e segundo molares superiores esquerdos usando um movimento de parafusamento no sentido horário (Figura 3E-I).
- Imediatamente após a colocação do implante, administrar medicação para dor (Carprofeno/Rimadyl 5mg/kg a cada 24 h) através de injeção subcutânea.
- Permitir que os implantes cicatrizem por quatro semanas, durante as quais administrar antibióticos e se alimentar conforme descrito anteriormente.
- No final do período de cicatrização, certifique-se de que a ferida mucosa está completamente fechada e tem uma aparência rosa claro.
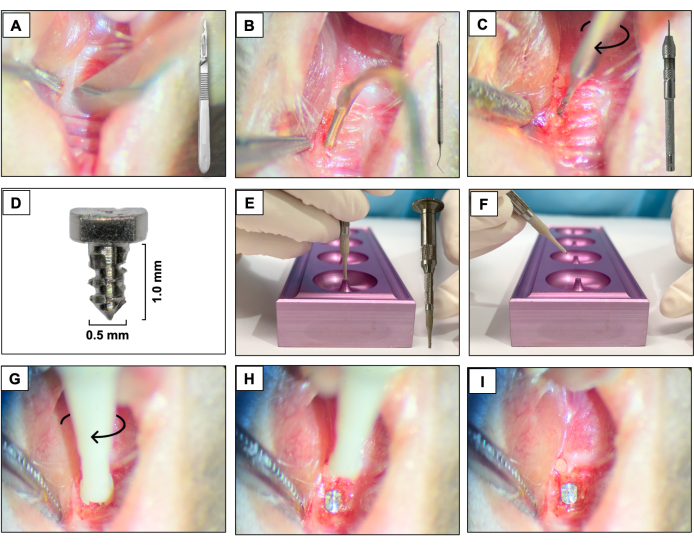
Figura 3: Sequência de colocação do implante: (A) Incisão com lâmina de 15c acoplada ao cabo. (B) Retalhos de espessura total utilizando explorador dental #5. (C) Osteotomia com microbroca manual de carboneto de 0,3 mm acoplada a Pino Vise. (D) Implante dentário de titânio. (E, F) Suporte para implante e suporte para implante. (G-I) Colocação do implante usando um movimento de parafuso no sentido horário. Clique aqui para ver uma versão maior desta figura.
4. Indução da peri-implantite
- Coloque uma ligadura de seda (6-0) ao redor de cada fixador imediatamente apical à cabeça do implante, contornando a superfície do implante e fixando-a com um nó duplo. Manter a ligadura por duas semanas permitindo o desenvolvimento da peri-implantite.
- Verifique as ligaduras a cada dois dias para se certificar de que elas ainda estão presentes. Se faltar, coloque uma nova ligadura.
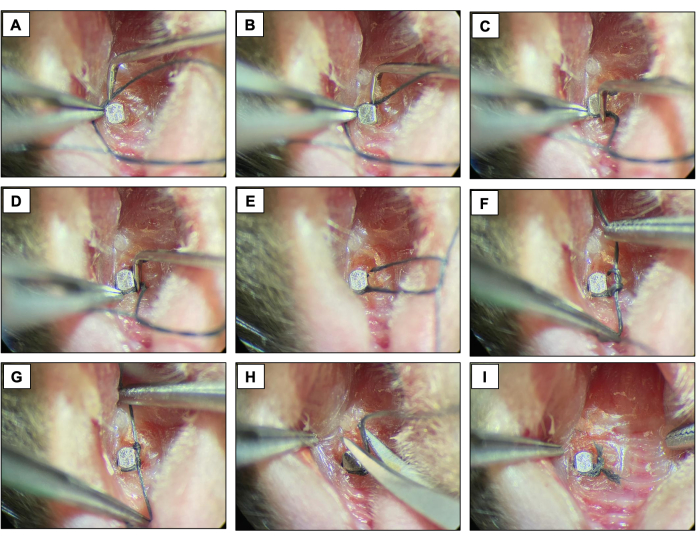
Figura 4: Sequência peri-implantite induzida por ligadura. (A-D) Ligadura de seda (6.0) colocada ao redor da cabeça do implante. (E-G) Fechamento do nó. (H) Corte da ligadura. (I) Aparição final. Imagens clínicas obtidas de animais vivos sob sedação. Clique aqui para ver uma versão maior desta figura.
5. Sacrifício
- Após o período de indução da periimplantite (duas semanas), sacrificar todos os animais com alta concentração inalatória de isoflurano, seguido de um método secundário de luxação cervical com uma haste pressionada na base do crânio e puxando rapidamente os membros posteriores, causando a separação das vértebras cervicais do crânio.
- Separe as maxilas usando instrumentos afiados, como uma tesoura cirúrgica, que separará toda a mandíbula do animal do resto do corpo.
- Fotografar as maxilas com microscópio óptico, fixá-las em formalina a 10% por 24 h e armazenar em etanol 70%.
6. Microtomografia computadorizada (μCT)
- Realizar exames de maxila conforme previamente descrito18,19 por meio de microtomografia computadorizada (micro-TC).
- Ligue o scanner e o computador, abra o software de digitalização, clique no sinal de radiação e aguarde 15 minutos para pré-aquecê-lo.
- Abra a porta do equipamento clicando no ícone da porta.
- Use uma mesa giratória de um quarto de tamanho. Coloque a maxila em um tubo cônico de 15ml. Fixe o tubo na base da mesa giratória. Coloque a mesa giratória no parafuso do equipamento.
- Feche a porta do equipamento clicando no ícone da porta.
- Ligue a fonte de Raios-X.
- Clique no ícone de imagem de captura e verifique se o osso está no campo.
- Ajuste uma resolução de tamanho de pixel de 10 μm, energia de raios-X de 55 KVp e 181 μA, filtro de AI 0,5 mm, passo de rotação 0,4, quadro médio 10. Essas configurações gerarão um tempo de varredura estimado de 24 minutos.
- Inicie a aquisição.
- Para reconstrução abra o software de reconstrução. Utilizar endurecimento de viga de 20%. Use artefato de anel de 5%. Use um intervalo dinâmico de 0-0,13. Desmarque o rótulo ATIVADO. Clique em Pré-visualizar. Escolha a visualização adequada que é vista para a região de interesse e salve-a como TIFF.
- Orientar as imagens obtidas por meio de softwares de visualização e análise de dados. Tornar o eixo longo da cabeça do implante paralelo aos eixos sagital e coronal e perpendicular ao eixo axial.
- Salve a imagem sagital como uma única imagem para análise óssea linear.
- Salve a imagem transaxial como um conjunto de dados para análise óssea volumétrica.
- Realizar análise óssea linear utilizando o software de análise de dados. Medir as distâncias em milímetros entre a cabeça do implante e o osso alveolar nos planos sagital e coronal, incluindo os sítios mesial, distal, bucal e palatino.
- Realizar análise óssea volumétrica usando software de análise de dados. Rastrear a perda óssea ao redor dos implantes desenhando a região de interesse em todas as lâminas correspondentes à perda óssea.
7. Análise estatística
- Medir a perda óssea microtomográfica linear e volumétrica e normalizar esses valores dividindo cada valor pela média do grupo controle. Apresentar média para todos os grupos, como média ± erro padrão da média (EPM).
- Comparar a significância usando uma análise de variância (ANOVA) de duas vias seguida pelo teste de Tukey com intervalo de confiança de 95%. (Prisma 5). Aplicar os níveis de significância da seguinte forma: p≤0,01**, p≤0,001****.
Resultados
Para este método, dezoito camundongos machos C57BL/6J com 3 semanas de idade foram utilizados e submetidos a extrações dentárias, colocação de implantes e indução de periimplantite. Foram nove animais por grupo, o que foi estatisticamente significante, considerando a perda óssea linear atingindo 80% de potência, 15% de desvio padrão (σ) e intervalo de confiança de 95% (α=0,05). Os camundongos foram alimentados com dieta soft ad libitum durante o experimento. Nove camundongos receberam ligadura (gru...
Discussão
Este protocolo apresenta um relatório descritivo sobre procedimentos cirúrgicos para indução de periimplantite utilizando um modelo de ligadura em camundongos. O trabalho com camundongos apresenta vantagens, como o custo-benefício, a disponibilidade de um extenso arranjo genético dadas as diversas origens23, entre outros aspectos24,25. Ao longo dos anos, vários estudos utilizaram com sucesso camundongos nas áreas médica e odontol?...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo NIH/NIDCR DE031431. Gostaríamos de agradecer ao Translational Pathology Core Laboratory da UCLA pelo auxílio no preparo dos cortes histológicos descalcificados.
Materiais
| Name | Company | Catalog Number | Comments |
| #5 dental explorer | Hu-Friedy, Chicago, IL | 392-0911 | Dental luxation |
| 15c blade and surgical scalpel | Henry Schein Inc., Melville, NY | 1126186 | Tissue incision |
| 6-0 silk ligatures | Fisher Scientific, Hampton, NH | NC9201232 | Ligature |
| Amoxicillin 50μg/mL | Zoetis, San Diego, CA | TS/DRUGS/57/2003 | Oral suspension |
| Bacon Soft Diet | Bio Serve®, Frenchtown, NJ | 14-726-701 | - |
| C57BL/6J male mice | The Jackson Laboratories, Bar Harbor, ME, USA | 000664 | Age: 3-week-old |
| CTAn software | V.1.16 Bruker, Billerica, MA | - | Volumetric analysis |
| Dolphin software | Navantis, Toronto, CA | - | Linear bone analysis |
| Implant carrier & Tip | D. P. Machining Inc., La Verne, CA | Unique product | Implant holder |
| Implant support | D. P. Machining Inc., La Verne, CA | Unique product | Implant capture |
| Isoflurane | Vet One, Boise, ID | NDC13985-528-60 | Inhalational anesthetic |
| Micro-CT scan 1172 | SkyScan, Kontich, Belgium | - | μCT scans |
| Nrecon Software | Bruker Corporation, Billerica, MA | - | Images reconstruction |
| Ø 0.3mm - L 2.5mm Micro Drills | Sphinx, Hoffman Estates, IL | ART. 50699 | Osteotomy |
| Ø 0.5mm - L 1.0mm Titanium implants | D. P. Machining Inc., La Verne, CA | Unique product | - |
| Ophthalmic lubricant | Apexa, Ontario, CA | NDC13985-600-03 | Artificial tears |
| Pin Vise | General Tools, Secaucus, NJ | 90 | Osteotomy |
| Rimadyl 50mg/ml | Zoetis, San Diego, CA | 4019449 | Anti-inflammatory |
| Sterile cotton tipped | Dynarex, Glendale, AZ | 4304-1 | Hemostasis |
| Tip forceps | Fine Science Tools, Foster City, CA | 11071-10 | Dental Extraction |
| Tying forceps | Fine Science Tools, Foster City, CA | 18025-10 | Ligature placement |
Referências
- Ho, K., et al. A cross-sectional survey of patient's perception and knowledge of dental implants in japan. Int J Implant Dent. 8 (1), 14 (2022).
- Elani, H. W., Starr, J. R., Da Silva, J. D., Gallucci, G. O. Trends in dental implant use in the u.S., 1999-2016, and projections to 2026. J Dent Res. 97 (13), 1424-1430 (2018).
- Renvert, S., Persson, G. R., Pirih, F. Q., Camargo, P. M. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 45, S278-S285 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 449 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases-the efp s3 level clinical practice guideline. J Clin Periodontol. 50, 4-76 (2023).
- Graziani, F., Figuero, E., Herrera, D. Systematic review of quality of reporting, outcome measurements and methods to study efficacy of preventive and therapeutic approaches to peri-implant diseases. J Clin Periodontol. 39, 224-244 (2012).
- Schwarz, F., Derks, J., Monje, A., Wang, H. L. Peri-implantitis. J Periodontol. 89, S267-S290 (2018).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Mouse Genome Sequencing, C. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Pirih, F. Q., et al. Ligature-induced peri-implantitis in mice. J Periodontal Res. 50 (4), 519-524 (2015).
- Rau, C. D., et al. High-density genotypes of inbred mouse strains: Improved power and precision of association mapping. G3. 5 (10), 2021-2026 (2015).
- Schwarz, F., Sculean, A., Engebretson, S. P., Becker, J., Sager, M. Animal models for peri-implant mucositis and peri-implantitis. Periodontol 2000. 68 (1), 168-181 (2015).
- Varon-Shahar, E., et al. Peri-implant alveolar bone resorption in an innovative peri-implantitis murine model: Effect of implant surface and onset of infection. Clin Implant Dent Relat Res. 21 (4), 723-733 (2019).
- Pirih, F. Q., et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis. J Oral Implantol. 41 (5), e158-e164 (2015).
- Schwarz, F., et al. Influence of antiresorptive/antiangiogenic therapy on the extension of experimentally induced peri-implantitis lesions. Clin Oral Investig. 27 (6), 3009-3019 (2023).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Wong, R. L., et al. Early intervention of peri-implantitis and periodontitis using a mouse model. J Periodontol. 89 (6), 669-679 (2018).
- Hiyari, S., et al. Ligature-induced peri-implantitis and periodontitis in mice. J Clin Periodontol. 45 (1), 89-99 (2018).
- Nguyen Vo, T. N., et al. Ligature induced peri-implantitis: Tissue destruction and inflammatory progression in a murine model. Clin Oral Implants Res. 28 (2), 129-136 (2017).
- Yuan, S., et al. Comparative transcriptome analysis of gingival immune-mediated inflammation in peri-implantitis and periodontitis within the same host environment. J Inflamm Res. 15, 3119-3133 (2022).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. J Periodontol. 89, S313-S318 (2018).
- Hiyari, S., et al. Genomewide association study identifies cxcl family members as partial mediators of lps-induced periodontitis. J Bone Miner Res. 33 (8), 1450-1463 (2018).
- Kantarci, A., Hasturk, H., Van Dyke, T. E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 68 (1), 66-82 (2015).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental animal models in periodontology: A review. Open Dent J. 4, 37-47 (2010).
- Erata, E., et al. Cnksr2 loss in mice leads to increased neural activity and behavioral phenotypes of epilepsy-aphasia syndrome. J Neurosci. 41 (46), 9633-9649 (2021).
- Fakih, D., Guerrero-Moreno, A., Baudouin, C., Reaux-Le Goazigo, A., Parsadaniantz, S. M. Capsazepine decreases corneal pain syndrome in severe dry eye disease. J Neuroinflammation. 18 (1), 111 (2021).
- Douam, F., Ploss, A. The use of humanized mice for studies of viral pathogenesis and immunity. Curr Opin Virol. 29, 62-71 (2018).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), (2021).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Silva, D. N. A., et al. Probiotic lactobacillus rhamnosus em1107 prevents hyperglycemia, alveolar bone loss, and inflammation in a rat model of diabetes and periodontitis. J Periodontol. 94 (3), 376-388 (2023).
- Kim, Y. G., et al. 6-shogaol, an active ingredient of ginger, inhibits osteoclastogenesis and alveolar bone resorption in ligature-induced periodontitis in mice. J Periodontol. 91 (6), 809-818 (2020).
- Fine, N., et al. Periodontal inflammation primes the systemic innate immune response. J Dent Res. 100 (3), 318-325 (2021).
- Yu, X., et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis. J Periodontal Res. 53 (1), 98-106 (2018).
- Reinedahl, D., Chrcanovic, B., Albrektsson, T., Tengvall, P., Wennerberg, A. Ligature-induced experimental peri-implantitis-a systematic review. J Clin Med. 7 (12), (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados