Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экспериментальная модель лигатурно-индуцированного периимплантита у мышей
В этой статье
Резюме
Это отчет об экспериментальной модели лигатур-индуцированного периимплантита у мышей. Мы описываем все хирургические этапы, начиная с пред- и послеоперационного ведения животных, удаления, установки имплантатов и лигатурно-индуцированного периимплантита.
Аннотация
Зубные имплантаты имеют высокий успех и приживаемость. Однако такие осложнения, как периимплантит (ПИ), очень сложно поддаются лечению. ПИ характеризуется воспалением в тканях вокруг зубных имплантатов с прогрессирующей потерей опорной кости. Чтобы оптимизировать долговечность зубных имплантатов с точки зрения здоровья и функциональности, крайне важно понимать патофизиологию периимплантита. В связи с этим использование мышиных моделей в исследованиях доказало явные преимущества при воссоздании клинических обстоятельств. Целью данного исследования было описание экспериментальной модели лигатурно-индуцированного периимплантита у мышей и определение эффективности индуцирования этого заболевания с учетом наблюдаемых изменений в костях и тканях. Экспериментальная индукция периимплантита включает в себя следующие этапы: удаление зубов, установка имплантата и лигатурно-индуцированная ПИ. Выборка из восемнадцати 3-недельных самцов мышей C57BL/6J была разделена на две группы: лигатурную (N=9) и контрольную (N=9). Проведена оценка клинических, рентгенологических и гистологических факторов. Лигатурная группа показала значительно более высокую потерю костной массы, повышенный отек мягких тканей и миграцию апикального эпителия, чем группа без лигатуры. Был сделан вывод о том, что данная доклиническая модель может успешно индуцировать периимплантит у мышей.
Введение
Зубные имплантаты становятся все более распространенным выбором для замены отсутствующих зубов1. По прогнозам, распространенность зубных имплантатов среди взрослого населения США увеличится до 23% к 2026году. Согласно отчету об анализе рынка Grand View Research (2022 г.), объем мирового рынка зубных имплантатов в 2022 году достигнет примерно 4,6 млрд долларов США. Кроме того, ожидается, что до 2030 г. он будет демонстрировать устойчивые ежегодные темпы роста на уровне около 10%3. К сожалению, использование зубных имплантатов может привести к осложнениям, таким как периимплантит. Периимплантит был определен как состояние, индуцированное биопленкой, характеризующееся воспалением в оболочкой вокруг имплантата и последующей прогрессирующей потерей опорной кости4.
Систематический обзор показал, что средняя распространенность периимплантита составила 19,53% (95% доверительный интервал [ДИ], от 12,87 до 26,19%) на уровне пациента и 12,53% (95% ДИ от 11,67 до 13,39%) на уровнеимплантата 5. Периимплантит представляет собой растущую проблему общественного здравоохранения в связи с увеличением числа случаев отторжения имплантатов и, как следствие, значительнымизатратами на лечение6.
Понимание патогенеза периимплантита имеет решающее значение для разработки системного подхода к предотвращению его возникновения и прогрессирования и максимизации долговечности зубных имплантатов с точки зрения эстетики и функции 7,8. В этом смысле использование мышиных моделей в стоматологических исследованиях оказалось полезным, учитывая, что мыши разделяют более 95% своих генов с людьми 9,10, количество доступных генетических онлайн-баз данных и способность воспроизводить клиническиесценарии. Все описанные преимущества позволяют расчленять генетические механизмы при различных заболеваниях12, доступное приспособление и лечение, а также антитела, широко доступные в виде панелей для человека, помимо наличия генетических модификаций (например, нокаута и гиперэкспрессии) для оценки воспалительных тканей и картирования заболевания13. Несмотря на преимущество, существует мало публикаций, посвященных периимплантиту у мышей. Это связано, в частности, с методологическими проблемами, в том числе со сложностью получения мини-имплантатов или их установки.
Для развития периимплантита у мышей было описано множество протоколов, таких как периимплантит, индуцированный лигатурой, периимплантит, индуцированный бактериями14, периимплантит, индуцированный липополисахаридами (ЛПС)15 или комбинация ЛПС + лигатурно-индуцированный периимплантит16. Здесь мы сосредоточимся на лигатурной модели, потому что она является наиболее распространенным методом индуцирования пародонтита 17,18,19 и, в последнее время, периимплантита 20,21. Лигатура, размещенная вокруг имплантатов в подслизистом положении, стимулирует накопление бляшек и, как следствие, воспаление тканей. Таким образом, разработка данного подхода основана на указании жизнеспособной методики с точки зрения затрат и выгод для доклинических исследований периимплантных заболеваний. Целью данного исследования является описание экспериментальной модели лигатурно-индуцированного периимплантита у мышей и определение эффективности индуцирования этого заболевания с учетом наблюдаемых изменений в костях и тканях.
Общая цель этой статьи состоит в том, чтобы описать протокол, применяемый для индуцирования периимплантита у мышей с помощью лигатуры, и наблюдать его эффективность путем оценки тканей и потери костной массы вокруг имплантатов.
протокол
Процедуры с участием животных были одобрены Комитетом по исследованиям на животных при канцлере Калифорнийского университета в Лос-Анджелесе (протокол ARC No 2002-125) и Animal Research: Reporting In Vivo Experiments (ARRIVE)22. Для этого метода были использованы восемнадцать 3-недельных самцов мышей C57BL/6J, которым было проведено удаление зубов, установка имплантата и индукция периимплантита. Все стоматологические процедуры выполнялись под микроскопическим увеличением 10× и выполнялись обученными и откалиброванными операторами (рис. 1А).
1. Этапы предварительной экстракции
- Проводите процедуру в операционной, соблюдая все стандарты биобезопасности и защиты.
- Проводят асептику всех поверхностей тройным трением с использованием 70% раствора изопропилового спирта.
- Обезболивайте 3-недельных самцов мышей C57BL/6J 3% изофлураном. Проверьте, нет ли реакции на отдергивание лапы при прикосновении, чтобы убедиться, что получена достаточная глубина анестезии.
- Чтобы не мешать процедурам в полости рта, используйте носовой конус для поддержания анестезии изофлураном.
- Иметь вспомогательного оператора для стабилизации животного и поддержания открытия рта (рис. 1B).
- Нанесите офтальмологическую смазку, чтобы предотвратить раздражение глаз перед началом удаления.
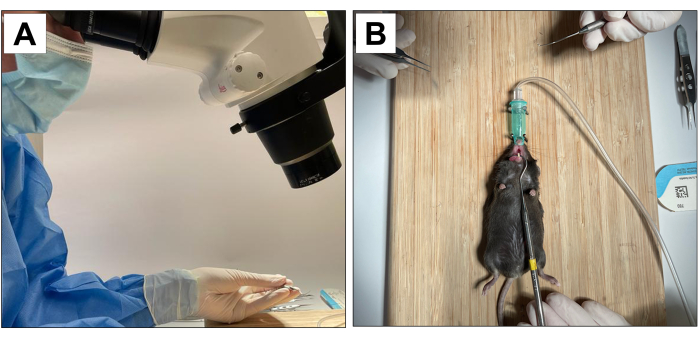
Рисунок 1: Оперативная адаптация: (А) Микроскопическое увеличение. (B) Адаптированная система ингаляционной анестезии и стабилизации для открывания рта. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Удаление зубов
- При удалении зубов введите зубной проводник #5 между первым и вторым моляром, чтобы начать процедуры подъема и вывиха, перемещая инструмент в мезио-дистальном направлении до тех пор, пока зуб не переместится в лунку (рис. 2A).
- Затем введите зубной эксплорер #5 в мезиальный участок первого моляра. Для этого перемещайте инструмент в мезио-дистальном направлении до тех пор, пока зуб не переместится в лунку.
- После подъема используйте кончиковые щипцы и щипцы для завязывания швов, чтобы удалить1-й моляр.
- Затем введите зубной проводник между2-м и3-м молярами, чтобы поднять и вывихнуть2-й моляр (рис. 2B).
- Затем используйте щипцы для завязывания кончиков и/или щипцы для завязывания швов, чтобы удалить зуб с помощью инструментов, чтобы удерживать его и извлекать изо рта. (Рисунок 2В).
- После удаления зубов обеспечьте полное достижение гемостаза с помощью стерильной ваты с наконечником (Рисунок 2D) в течение 1 минуты (Рисунок 2E, F).
- Сразу после экстракции каждые 24 ч всем животным давать обезболивающие препараты (карпрофен/римадил 5 мг/кг). Вводят лекарство через подкожную инъекцию.
- Кроме того, замените обычную пищу щадящей диетой. Антибиотик (Амоксил 0,25 мг/мл) назначают перорально, добавляя лекарство в питьевую воду. Делайте это в течение четырех недель после удаления.
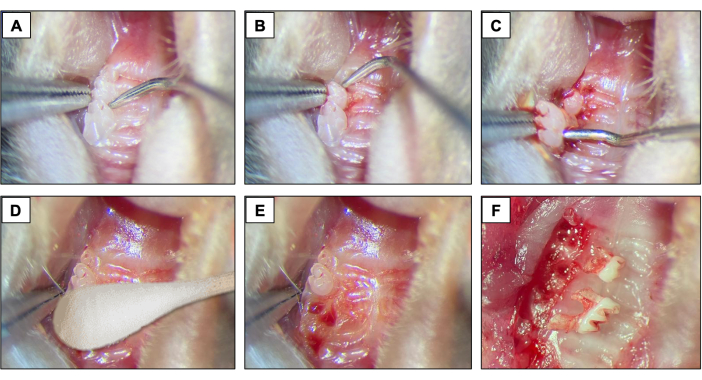
Рисунок 2: Начальная последовательность удаления: (A, B) Верхнечелюстная область с 1-м и 2-м коренными зубами и использование стоматологического эксплорера для поднятия и вывиха. (C) Использование щипцов на кончике и эксплорера для вывиха и удаления зуба. (D) Гемостаз. (Е, Ф) Альвеолярный вид после удаления. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Установка имплантата
- Используя лезвие 15c, создайте мезио-дистальный разрез через ороговевшую ткань в области, соответствующей ранее присутствующим зубам. Используйте правые верхнечелюстные моляры в качестве пространственной привязки (рис. 3А).
- Поднимите щечные и нёбные лоскуты на всю толщину с помощью стоматологического эксплорера #5, обеспечивая полное поднятие лоскута (Рисунок 3B).
- Выполните остеотомию с помощью твердосплавной ручной дрели диаметром 0,3 мм, прикрепленной к тискам (ручной дрели), и активируйте ее вращением по часовой стрелке. Создайте участки остеотомии на глубину около 1 мм в зажившие лунки для удаления зубов (Рисунок 3C).
- Установите специально разработанные винтовые имплантаты с гладкой обработанной поверхностью (длиной 1,0 мм и диаметром 0,5 мм), изготовленные из титановых стержней 6AL4V (рис. 3D), по одному на животное, путем самопостукивания в область первого и второго левых моляров верхней челюсти с помощью винтового движения по часовой стрелке (рис. 3E-I).
- Сразу после установки имплантата вводите обезболивающее лекарство (карпрофен/римадил 5 мг/кг каждые 24 ч) через подкожную инъекцию.
- Дайте имплантатам зажить в течение четырех недель, в течение которых вводите антибиотики и кормите, как описано выше.
- По окончании периода заживления следите за тем, чтобы рана слизистой полностью закрылась и имела светло-розовый вид.
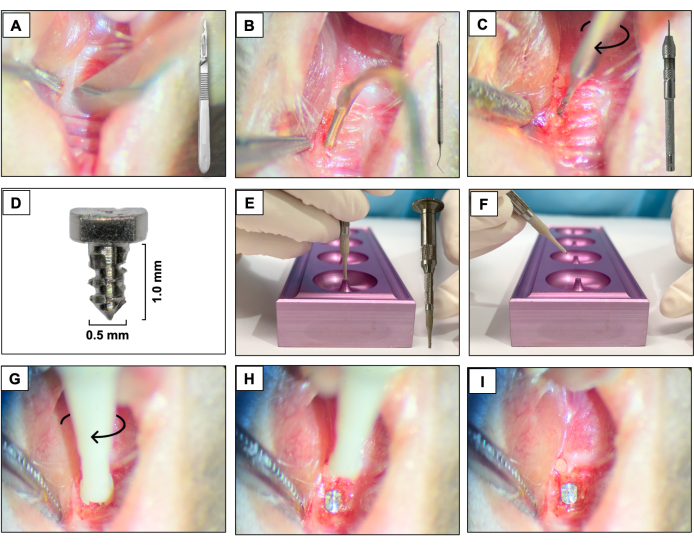
Рисунок 3: Последовательность установки имплантата: (A) Разрез с помощью лезвия 15c, прикрепленного к ручке. (B) Лоскуты полной толщины с использованием стоматологического эксплорера #5. (C) Остеотомия с использованием твердосплавного ручного сверла диаметром 0,3 мм, прикрепленного к тискам. (D) Титановый зубной имплантат. (Е, Ф) Опора для имплантата и держатель имплантата. (Г-И) Установка имплантата с помощью завинчивающих движений по часовой стрелке. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Индукция периимплантита
- Поместите шелковую лигатуру (6-0) вокруг каждого приспособления непосредственно апикально к головке имплантата, очертив контур поверхности имплантата и зафиксировав ее двойным узлом. Держать лигатуру в течение двух недель, допуская развитие периимплантита.
- Проверяйте лигатуры каждые два дня, чтобы убедиться, что они все еще присутствуют. Если его нет, установите новую лигатуру.
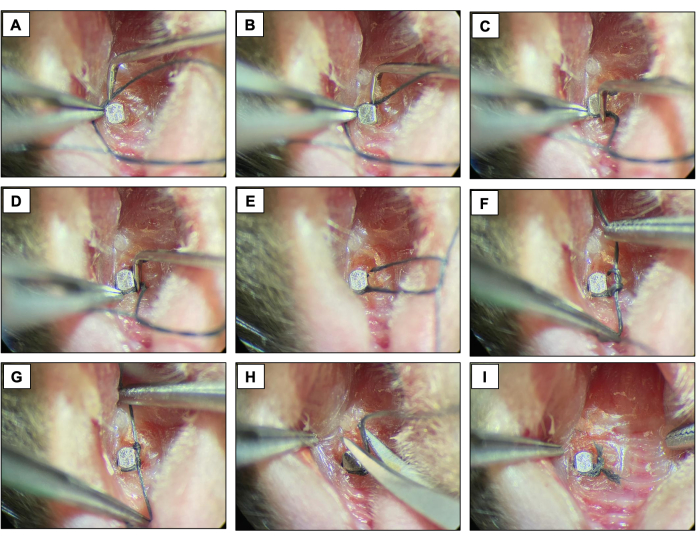
Рисунок 4: Последовательность лигатурно-индуцированного периимплантита. (А-Д) Шелковая лигатура (6.0) размещается вокруг головки имплантата. (Э-Г) Застежка узла. (H) Лигатурный разрез. (I) Окончательный внешний вид. Клинические изображения, полученные от живых животных под седацией. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
5. Жертвоприношение
- После периода индукции периимплантита (две недели) жертвуют всех животных высокой концентрацией ингаляционного изофлурана с последующим вторичным методом вывиха шейки матки с вдавливанием стержня в основание черепа и быстрым вытягиванием задних конечностей, вызывая отделение шейных позвонков от черепа.
- Отделите верхнюю челюсть с помощью острых инструментов, таких как хирургические ножницы, которые отделят всю челюсть животного от остального тела.
- Сфотографируйте верхнюю челюсть с помощью оптического микроскопа, зафиксируйте ее в 10% формалине в течение 24 ч, затем храните в 70% этаноле.
6. Микрокомпьютерная томография (мкКТ)
- Сканируйте верхнюю челюсть, как описано ранее 18,19, с помощью микрокомпьютерной томографии (микро-КТ).
- Включите сканер и компьютер, затем откройте программное обеспечение сканирования, нажмите на знак радиации и подождите 15 минут, чтобы нагреть его.
- Откройте дверцу оборудования, нажав на иконку двери.
- Используйте поворотный стол размером в четверть. Поместите верхнюю челюсть в коническую трубку объемом 15 мл. Закрепите трубку в основании поворотного стола. Поместите поворотный стол в винт оборудования.
- Закройте дверцу оборудования, нажав на значок двери.
- Включите источник рентгеновского излучения.
- Нажмите на иконку захвата изображения и убедитесь, что кость находится на поле.
- Регулировка разрешения 10 мкм, размер пикселя, энергия рентгеновского излучения 55 кВп и 181 мкА, фильтр AI 0,5 мм, шаг вращения 0,4, средний кадр 10. При таких настройках расчетное время сканирования составит 24 минуты.
- Начните сбор данных.
- Для восстановления откройте программу реконструкции. Используйте упрочнение балки 20%. Используйте кольцевой артефакт 5%. Используйте динамический диапазон 0-0,13. Снимите флажок с метки ON. Нажмите « Предварительный просмотр». Выберите подходящий вид, видимый для интересующей области, и сохраните его в формате TIFF.
- Ориентируйте полученные изображения с помощью программного обеспечения для просмотра и анализа данных. Длинная ось головки имплантата должна быть параллельна сагиттальной и корональной осям и перпендикулярна осевой оси.
- Сохраните сагиттальное изображение как единое изображение для линейного анализа костей.
- Сохранение трансаксиального изображения в виде набора данных для объемного анализа костной ткани.
- Выполняйте линейный анализ костей с помощью программного обеспечения для анализа данных. Измерьте расстояния в миллиметрах между головкой имплантата и альвеолярной костью в сагиттальной и корональной плоскостях, включая мезиальные, дистальные, щечные и нёбные участки.
- Выполняйте объемный анализ костей с помощью программного обеспечения для анализа данных. Отслеживайте потерю костной массы вокруг имплантатов, рисуя интересующую область на всех предметных стеклах, соответствующую потере костной массы.
7. Статистический анализ
- Измерьте линейную и объемную микротомографическую потерю костной массы и нормализуйте эти значения, разделив каждое значение на среднее значение контрольной группы. Представьте среднее значение по всем группам, как среднее ± стандартную ошибку среднего (SEM).
- Сравните значимость с помощью двухфакторного дисперсионного анализа (ANOVA) с последующим критерием Тьюки с 95% доверительным интервалом. (Призма 5). Примените уровни значимости следующим образом: p≤0.01**, p≤0.001****.
Результаты
Для этого метода были использованы восемнадцать 3-недельных самцов мышей C57BL/6J, которым было проведено удаление зубов, установка имплантата и индукция периимплантита. В каждой группе было девять животных, что было статистически значимым, учитывая, что линейная потеря костной массы дост...
Обсуждение
Этот протокол представляет собой описательный отчет о хирургических процедурах для индукции периимплантита с использованием лигатурной модели на мышах. Работа с мышами имеет такие преимущества, как экономическая эффективность, наличие обширного генетического массива с учетом множе...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана DE031431 NIH/NIDCR. Мы хотели бы поблагодарить Центральную лабораторию трансляционной патологии Калифорнийского университета в Лос-Анджелесе за помощь в подготовке декальцинированных гистологических срезов.
Материалы
| Name | Company | Catalog Number | Comments |
| #5 dental explorer | Hu-Friedy, Chicago, IL | 392-0911 | Dental luxation |
| 15c blade and surgical scalpel | Henry Schein Inc., Melville, NY | 1126186 | Tissue incision |
| 6-0 silk ligatures | Fisher Scientific, Hampton, NH | NC9201232 | Ligature |
| Amoxicillin 50μg/mL | Zoetis, San Diego, CA | TS/DRUGS/57/2003 | Oral suspension |
| Bacon Soft Diet | Bio Serve®, Frenchtown, NJ | 14-726-701 | - |
| C57BL/6J male mice | The Jackson Laboratories, Bar Harbor, ME, USA | 000664 | Age: 3-week-old |
| CTAn software | V.1.16 Bruker, Billerica, MA | - | Volumetric analysis |
| Dolphin software | Navantis, Toronto, CA | - | Linear bone analysis |
| Implant carrier & Tip | D. P. Machining Inc., La Verne, CA | Unique product | Implant holder |
| Implant support | D. P. Machining Inc., La Verne, CA | Unique product | Implant capture |
| Isoflurane | Vet One, Boise, ID | NDC13985-528-60 | Inhalational anesthetic |
| Micro-CT scan 1172 | SkyScan, Kontich, Belgium | - | μCT scans |
| Nrecon Software | Bruker Corporation, Billerica, MA | - | Images reconstruction |
| Ø 0.3mm - L 2.5mm Micro Drills | Sphinx, Hoffman Estates, IL | ART. 50699 | Osteotomy |
| Ø 0.5mm - L 1.0mm Titanium implants | D. P. Machining Inc., La Verne, CA | Unique product | - |
| Ophthalmic lubricant | Apexa, Ontario, CA | NDC13985-600-03 | Artificial tears |
| Pin Vise | General Tools, Secaucus, NJ | 90 | Osteotomy |
| Rimadyl 50mg/ml | Zoetis, San Diego, CA | 4019449 | Anti-inflammatory |
| Sterile cotton tipped | Dynarex, Glendale, AZ | 4304-1 | Hemostasis |
| Tip forceps | Fine Science Tools, Foster City, CA | 11071-10 | Dental Extraction |
| Tying forceps | Fine Science Tools, Foster City, CA | 18025-10 | Ligature placement |
Ссылки
- Ho, K., et al. A cross-sectional survey of patient's perception and knowledge of dental implants in japan. Int J Implant Dent. 8 (1), 14 (2022).
- Elani, H. W., Starr, J. R., Da Silva, J. D., Gallucci, G. O. Trends in dental implant use in the u.S., 1999-2016, and projections to 2026. J Dent Res. 97 (13), 1424-1430 (2018).
- Renvert, S., Persson, G. R., Pirih, F. Q., Camargo, P. M. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 45, S278-S285 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 449 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases-the efp s3 level clinical practice guideline. J Clin Periodontol. 50, 4-76 (2023).
- Graziani, F., Figuero, E., Herrera, D. Systematic review of quality of reporting, outcome measurements and methods to study efficacy of preventive and therapeutic approaches to peri-implant diseases. J Clin Periodontol. 39, 224-244 (2012).
- Schwarz, F., Derks, J., Monje, A., Wang, H. L. Peri-implantitis. J Periodontol. 89, S267-S290 (2018).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Mouse Genome Sequencing, C. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Pirih, F. Q., et al. Ligature-induced peri-implantitis in mice. J Periodontal Res. 50 (4), 519-524 (2015).
- Rau, C. D., et al. High-density genotypes of inbred mouse strains: Improved power and precision of association mapping. G3. 5 (10), 2021-2026 (2015).
- Schwarz, F., Sculean, A., Engebretson, S. P., Becker, J., Sager, M. Animal models for peri-implant mucositis and peri-implantitis. Periodontol 2000. 68 (1), 168-181 (2015).
- Varon-Shahar, E., et al. Peri-implant alveolar bone resorption in an innovative peri-implantitis murine model: Effect of implant surface and onset of infection. Clin Implant Dent Relat Res. 21 (4), 723-733 (2019).
- Pirih, F. Q., et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis. J Oral Implantol. 41 (5), e158-e164 (2015).
- Schwarz, F., et al. Influence of antiresorptive/antiangiogenic therapy on the extension of experimentally induced peri-implantitis lesions. Clin Oral Investig. 27 (6), 3009-3019 (2023).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Wong, R. L., et al. Early intervention of peri-implantitis and periodontitis using a mouse model. J Periodontol. 89 (6), 669-679 (2018).
- Hiyari, S., et al. Ligature-induced peri-implantitis and periodontitis in mice. J Clin Periodontol. 45 (1), 89-99 (2018).
- Nguyen Vo, T. N., et al. Ligature induced peri-implantitis: Tissue destruction and inflammatory progression in a murine model. Clin Oral Implants Res. 28 (2), 129-136 (2017).
- Yuan, S., et al. Comparative transcriptome analysis of gingival immune-mediated inflammation in peri-implantitis and periodontitis within the same host environment. J Inflamm Res. 15, 3119-3133 (2022).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. J Periodontol. 89, S313-S318 (2018).
- Hiyari, S., et al. Genomewide association study identifies cxcl family members as partial mediators of lps-induced periodontitis. J Bone Miner Res. 33 (8), 1450-1463 (2018).
- Kantarci, A., Hasturk, H., Van Dyke, T. E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 68 (1), 66-82 (2015).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental animal models in periodontology: A review. Open Dent J. 4, 37-47 (2010).
- Erata, E., et al. Cnksr2 loss in mice leads to increased neural activity and behavioral phenotypes of epilepsy-aphasia syndrome. J Neurosci. 41 (46), 9633-9649 (2021).
- Fakih, D., Guerrero-Moreno, A., Baudouin, C., Reaux-Le Goazigo, A., Parsadaniantz, S. M. Capsazepine decreases corneal pain syndrome in severe dry eye disease. J Neuroinflammation. 18 (1), 111 (2021).
- Douam, F., Ploss, A. The use of humanized mice for studies of viral pathogenesis and immunity. Curr Opin Virol. 29, 62-71 (2018).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), (2021).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Silva, D. N. A., et al. Probiotic lactobacillus rhamnosus em1107 prevents hyperglycemia, alveolar bone loss, and inflammation in a rat model of diabetes and periodontitis. J Periodontol. 94 (3), 376-388 (2023).
- Kim, Y. G., et al. 6-shogaol, an active ingredient of ginger, inhibits osteoclastogenesis and alveolar bone resorption in ligature-induced periodontitis in mice. J Periodontol. 91 (6), 809-818 (2020).
- Fine, N., et al. Periodontal inflammation primes the systemic innate immune response. J Dent Res. 100 (3), 318-325 (2021).
- Yu, X., et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis. J Periodontal Res. 53 (1), 98-106 (2018).
- Reinedahl, D., Chrcanovic, B., Albrektsson, T., Tengvall, P., Wennerberg, A. Ligature-induced experimental peri-implantitis-a systematic review. J Clin Med. 7 (12), (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены