È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello sperimentale di perimplantite indotta da legatura nei topi
In questo articolo
Riepilogo
Questo è un rapporto su un modello sperimentale di perimplantite indotta da legatura nei topi. Descriviamo tutte le fasi chirurgiche, dalla gestione pre e post-operatoria degli animali, alle estrazioni, al posizionamento dell'impianto e alla perimplantite indotta dalla legatura.
Abstract
Gli impianti dentali hanno un alto tasso di successo e sopravvivenza. Tuttavia, complicanze come la perimplantite (PI) sono molto difficili da trattare. La PI è caratterizzata da un'infiammazione dei tessuti intorno agli impianti dentali con progressiva perdita dell'osso di supporto. Per ottimizzare la longevità degli impianti dentali in termini di salute e funzionalità, è fondamentale comprendere la fisiopatologia della perimplantite. A questo proposito, l'utilizzo di modelli murini nella ricerca ha dimostrato chiari benefici nel ricreare le circostanze cliniche. Questo studio mirava a descrivere un modello sperimentale di perimplantite indotta da legatura nei topi e determinare se esiste un'efficacia nell'indurre questa malattia, dati i cambiamenti ossei e tissutali osservati. L'induzione sperimentale della perimplantite comprende le seguenti fasi: estrazione dei denti, posizionamento dell'impianto e PI indotta dalla legatura. Un campione di diciotto topi maschi C57BL/6J di 3 settimane è stato diviso in due gruppi, legatura (N=9) e controllo non legatura (N=9). È stata eseguita la valutazione dei fattori clinici, radiografici e istologici. Il gruppo legato ha mostrato una perdita ossea significativamente più elevata, un aumento dell'edema dei tessuti molli e una migrazione epiteliale apicale rispetto al gruppo senza legatura. Si è concluso che questo modello preclinico può indurre con successo la perimplantite nei topi.
Introduzione
Gli impianti dentali sono sempre più diffusi come scelta desiderabile per sostituire i denti mancanti1. Si prevede che la prevalenza degli impianti dentali nella popolazione adulta degli Stati Uniti aumenterà fino al 23% entro il 20262. Sulla base di un rapporto di analisi di mercato di Grand View Research (2022), si prevede che le dimensioni del mercato globale degli impianti dentali raggiungeranno circa 4.6 miliardi di dollari nel 2022. Inoltre, si prevede che mostrerà un tasso di crescita annuo costante di circa il 10% fino all'anno 20303. Sfortunatamente, l'uso di impianti dentali può portare a complicazioni, come la perimplantite. La perimplantite è stata definita come una condizione indotta da biofilm caratterizzata da infiammazione della mucosa perimplantare e conseguente perdita progressiva dell'osso di supporto4.
Una revisione sistematica ha rilevato che la prevalenza media della perimplantite era del 19,53% (intervallo di confidenza al 95% [CI], da 12,87 a 26,19%) a livello di paziente e del 12,53% (IC 95% da 11,67 a 13,39%) a livello di impianto5. La perimplantite rappresenta una salute pubblica in crescita, a causa di un aumento del fallimento implantare e, di conseguenza, di costi di trattamento sostanziali6.
Comprendere la patogenesi della perimplantite è fondamentale per sviluppare un approccio sistematico per prevenirne l'insorgenza e la progressione e massimizzare la longevità degli impianti dentali in termini di estetica e funzione 7,8. In questo senso, l'utilizzo di modelli murini nella ricerca odontoiatrica si è dimostrato vantaggioso, dato che i topi condividono oltre il 95% dei loro geni con gli esseri umani 9,10, il numero di database genetici online disponibili e la capacità di riprodurre scenari clinici11. Tutti i vantaggi descritti consentono la dissezione dei meccanismi genetici in diverse malattie12, l'accomodazione e la gestione accessibili, e gli anticorpi ampiamente disponibili come pannelli umani, oltre alla disponibilità di modificazioni genetiche (ad esempio, knockout e sovraespressione) per la valutazione dei tessuti infiammatori e la mappaturadelle malattie 13. Sebbene vantaggioso, ci sono poche pubblicazioni che affrontano la perimplantite nei topi. Ciò è dovuto, tra l'altro, a sfide metodologiche, tra cui la difficoltà di ottenere mini-impianti o di installarli.
Per sviluppare la perimplantite nei topi, sono stati descritti molti protocolli, come la perimplantite indotta dalla legatura, la perimplantite indotta da batteri14, la perimplantite indotta da lipopolisaccaridi (LPS)15 o la combinazione LPS + perimplantite indotta dalla legatura16. In questa sede ci concentreremo sul modello di legatura perché è il metodo più ampiamente accettato per indurre la parodontite 17,18,19 e, più recentemente, la perimplantite 20,21. La legatura posta intorno agli impianti in posizione sottomucosa stimola l'accumulo di placca e, di conseguenza, l'infiammazione dei tessuti. Quindi, lo sviluppo di questo approccio si basa sull'indicazione di una valida tecnica costi-benefici per indagini pre-cliniche sulle malattie perimplantari. Questo studio ha lo scopo di descrivere un modello sperimentale di perimplantite indotta dalla legatura nei topi e determinare se vi è efficacia nell'indurre questa malattia date le alterazioni ossee e tissutali osservate.
L'obiettivo generale di questo articolo è quello di riportare il protocollo applicato per indurre la perimplantite nei topi mediante legatura e di osservarne l'efficacia attraverso la valutazione dei tessuti e la perdita ossea intorno agli impianti.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Le procedure che coinvolgono soggetti animali sono state approvate dal Chancellor's Animal Research Committee dell'Università della California, Los Angeles (numero di protocollo ARC 2002-125) e dall'Animal Research: Reporting In Vivo Experiments (ARRIVE)22. Per questo metodo, sono stati utilizzati diciotto topi maschi C57BL/6J di 3 settimane che sono stati sottoposti a estrazioni dentali, posizionamento di impianti e induzione di perimplantite. Tutte le procedure odontoiatriche sono state eseguite con un ingrandimento microscopico del 10× ed eseguite da operatori addestrati e calibrati (Figura 1A).
1. Fasi di pre-estrazione
- Eseguire la procedura in una sala chirurgica conforme a tutti gli standard di biosicurezza e protezione.
- Eseguire l'asepsi di tutte le superfici con triplo attrito utilizzando una soluzione di alcol isopropilico al 70%.
- Anestetizzare topi maschi C57BL/6J di 3 settimane con isoflurano al 3%. Verificare la mancanza di risposta al ritiro della zampa al tocco per garantire una profondità di anestetico sufficiente.
- Per evitare di interferire con le procedure in bocca, utilizzare un ogiva per mantenere l'anestesia con isoflurano.
- Disporre di un operatore ausiliario per stabilizzare l'animale e mantenere l'apertura della bocca (Figura 1B).
- Applicare un lubrificante oftalmico, per prevenire l'irritazione degli occhi prima di iniziare l'estrazione.
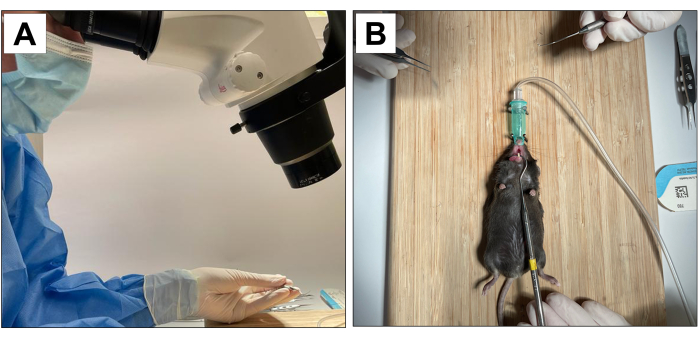
Figura 1: Adattamenti operativi: (A) Ingrandimento microscopico. (B) Sistema di anestesia per inalazione adattato e stabilizzazione per l'apertura della bocca. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Estrazione dentale
- Per le estrazioni dentali, introdurre un esploratore dentale #5 tra il primo e il secondo molare per avviare le procedure di elevazione e lussazione spostando lo strumento in direzione mesio-distale fino a quando il dente non si muove nell'alveolo (Figure 2A).
- Successivamente, introdurre l'esploratore dentale #5 nel sito mesiale del primo molare. A tale scopo, spostare lo strumento in direzione mesio-distale fino a quando il dente non si sposta nell'alveolo.
- Dopo l'elevazione, utilizzare la pinza a punta e la pinza per legare la sutura per rimuovere il 1° molare.
- Successivamente, introdurre l'esploratore dentale tra il 2° e il 3° molare per elevare e lussare il 2° molare (Figura 2B).
- Quindi, utilizzare la pinza a punta e/o la pinza per legare la sutura per rimuovere il dente utilizzando gli strumenti per tenerlo ed estrarlo dalla bocca. (Figura 2C).
- Dopo le estrazioni dentali, assicurarsi che l'emostasi sia completa utilizzando una punta di cotone sterile (Figura 2D) per 1 minuto (Figura 2E,F).
- Subito dopo l'estrazione, somministrare a tutti gli animali farmaci antidolorifici (Carprofene/Rimadyl 5 mg/kg) ogni 24 ore. Somministrare il farmaco attraverso l'iniezione sottocutanea.
- Inoltre, sostituisci il cibo normale con una dieta morbida. Somministrare l'antibiotico (Amoxil 0,25 mg/mL) per via orale incorporando il farmaco nell'acqua potabile. Fallo per quattro settimane dopo le estrazioni.
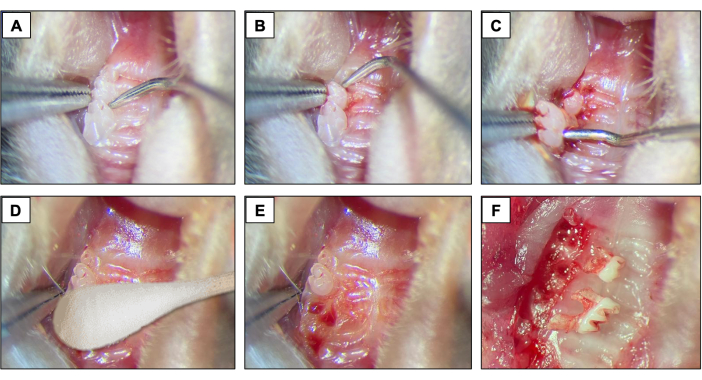
Figura 2: Sequenza di estrazione iniziale: (A, B) Regione mascellare con denti del 1° e 2° molare e uso dell'esploratore dentale per l'elevazione e la lussazione. (C) Uso della pinza a punta e dell'esploratore per la lussazione e la rimozione dei denti. (D) Emostasi. (E, F) Aspetto alveolare dopo estrazioni. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Posizionamento dell'impianto
- Utilizzando una lama da 15c, creare un'incisione mesio-distale attraverso il tessuto cheratinizzato nell'area corrispondente ai denti precedentemente presenti. Utilizzare i molari mascellari destri come riferimento spaziale (Figura 3A).
- Sollevare i lembi buccali e palatali a tutto spessore utilizzando un esploratore dentale #5, garantendo l'elevazione completa del lembo (Figura 3B).
- Eseguire l'osteotomia utilizzando un microtrapano a mano in metallo duro di 0,3 mm di diametro collegato a una morsa a perno (trapano a mano) e attivarlo in senso orario. Creare siti di osteotomia con una profondità di circa 1 mm negli alveoli di estrazione guariti (Figura 3C).
- Posizionare gli impianti a forma di vite progettati su misura con una superficie lavorata liscia (1,0 mm di lunghezza e 0,5 mm di diametro) fabbricati con aste di titanio 6AL4V (Figura 3D), uno per animale, autofilettando nella regione del primo e del secondo molare mascellare sinistro utilizzando un movimento di avvitamento in senso orario (Figura 3E-I).
- Immediatamente dopo l'inserimento dell'impianto, somministrare farmaci antidolorifici (Carprofene/Rimadyl 5 mg/kg ogni 24 ore) attraverso iniezione sottocutanea.
- Lasciare guarire gli impianti per quattro settimane, durante le quali somministrare antibiotici e nutrirsi come descritto in precedenza.
- Al termine del periodo di guarigione, assicurarsi che la ferita mucosa sia completamente chiusa e abbia un aspetto rosa chiaro.
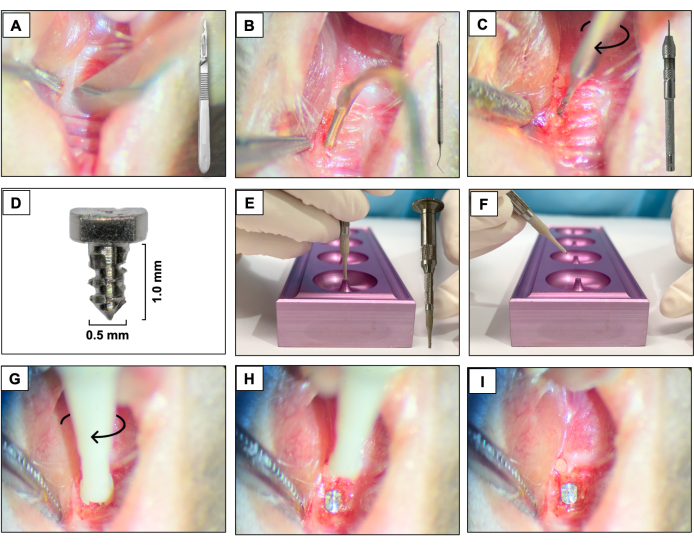
Figura 3: Sequenza di posizionamento dell'impianto: (A) Incisione utilizzando una lama da 15c attaccata all'impugnatura. (B) Lembi a tutto spessore utilizzando l'esploratore dentale #5. (C) Osteotomia con micro trapano manuale in metallo duro da 0,3 mm collegato a una morsa a spillo. (D) Impianto dentale in titanio. (E, F) Supporto implantare e supporto implantare. (G- I) Posizionamento dell'impianto con un movimento di avvitamento in senso orario. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Induzione della perimplantite
- Posizionare una legatura di seta (6-0) attorno a ciascun dispositivo immediatamente apicale alla testa dell'impianto contornando la superficie dell'impianto e fissandola con un doppio nodo. Mantenere la legatura per due settimane permettendo lo sviluppo della perimplantite.
- Controllare le legature ogni due giorni per assicurarsi che siano ancora presenti. Se mancante, posizionare una nuova legatura.
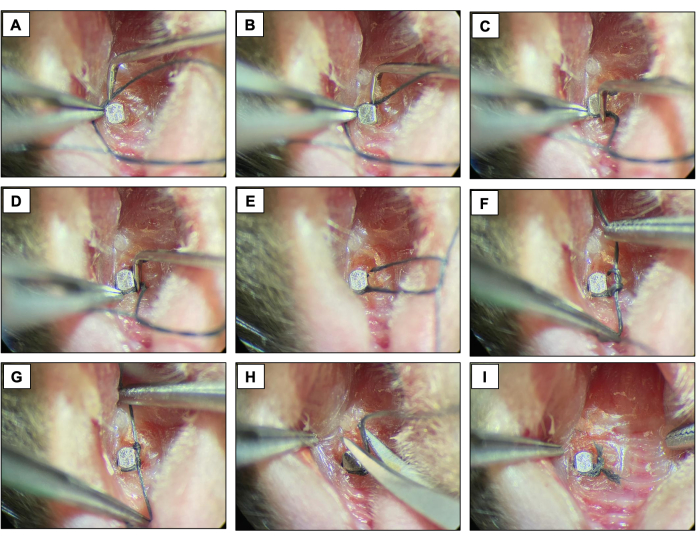
Figura 4: Sequenza di perimplantite indotta dalla legatura. (A-D) Legatura in seta (6.0) posizionata intorno alla testa dell'impianto. (E-G) Chiusura del nodo. (H) Taglio della legatura. (I) Apparizione finale. Immagini cliniche ottenute da animali vivi sotto sedazione. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Sacrificio
- Dopo il periodo di induzione della perimplantite (due settimane), sacrificare tutti gli animali con un'alta concentrazione di isoflurano inalato, seguito da un metodo secondario di lussazione cervicale con un'asta premuta alla base del cranio e tirando rapidamente gli arti posteriori, provocando la separazione delle vertebre cervicali dal cranio.
- Separa le mascelle usando strumenti affilati, come forbici chirurgiche, che separeranno l'intera mascella dell'animale dal resto del corpo.
- Fotografare le mascelle con un microscopio ottico, fissarle in formalina al 10% per 24 ore, quindi conservarle in etanolo al 70%.
6. Tomografia microcomputerizzata (μCT)
- Eseguire la scansione delle mascelle come descritto in precedenza 18,19 utilizzando la scansione con micro-tomografia computerizzata (micro-CT).
- Accendere lo scanner e il computer, quindi aprire il software di scansione, fare clic sul segno di radiazione e attendere 15 minuti per preriscaldarlo.
- Aprire lo sportello dell'apparecchiatura facendo clic sull'icona della porta.
- Utilizzare una tavola rotante di un quarto. Posizionare la mascella su un tubo conico da 15 ml. Fissare il tubo nella base della tavola rotante. Posizionare la tavola rotante nella vite dell'apparecchiatura.
- Chiudere lo sportello dell'apparecchiatura facendo clic sull'icona della porta.
- Accendere la sorgente di raggi X.
- Fai clic sull'icona dell'immagine e assicurati che l'osso sia sul campo.
- Regolare una risoluzione di 10 μm di dimensione dei pixel, un'energia dei raggi X di 55 KVp e 181 μA, un filtro di AI 0,5 mm, un passo di rotazione 0,4, un fotogramma medio di 10. Queste impostazioni genereranno un tempo di scansione stimato di 24 minuti.
- Avviare l'acquisizione.
- Per la ricostruzione, aprire il software di ricostruzione. Utilizzare una tempra del fascio del 20%. Usa l'artefatto dell'anello del 5%. Utilizzare una gamma dinamica compresa tra 0 e 0,13. Deselezionare l'etichetta ON. Fare clic su Anteprima. Scegliere la visualizzazione appropriata visualizzata per l'area di interesse e salvarla in formato TIFF.
- Orientare le immagini ottenute utilizzando il software per la visualizzazione e l'analisi dei dati. Rendere l'asse lungo della testa dell'impianto parallelo all'asse sagittale e coronale e perpendicolare all'asse assiale.
- Salvare l'immagine sagittale come immagine singola per l'analisi dell'osso lineare.
- Salvare l'immagine transassiale come set di dati per l'analisi volumetrica dell'osso.
- Eseguire l'analisi ossea lineare utilizzando il software di analisi dei dati. Misurare le distanze in millimetri tra la testa dell'impianto e l'osso alveolare nei piani sagittale e coronale, compresi i siti mesiale, distale, buccale e palatale.
- Esegui l'analisi volumetrica dell'osso utilizzando il software di analisi dei dati. Tenere traccia della perdita ossea intorno agli impianti disegnando la regione di interesse in tutti i vetrini corrispondenti alla perdita ossea.
7. Analisi statistica
- Misurare la perdita ossea microtomografica lineare e volumetrica e normalizzare questi valori dividendo ciascun valore per la media del gruppo di controllo. Presentare una media per tutti i gruppi, come media ± errore standard della media (SEM).
- Confronta la significatività utilizzando un'analisi della varianza a due vie (ANOVA) seguita da un test di Tukey con un intervallo di confidenza del 95%. (Prisma 5). Applicare i livelli di significatività come segue: p≤0.01**, p≤0.001****.
Access restricted. Please log in or start a trial to view this content.
Risultati
Per questo metodo, sono stati utilizzati diciotto topi maschi C57BL/6J di 3 settimane che sono stati sottoposti a estrazioni dentali, posizionamento di impianti e induzione di perimplantite. C'erano nove animali per gruppo, il che era statisticamente significativo, considerando la perdita ossea lineare che raggiungeva l'80% di potenza, il 15% di deviazione standard (σ) e l'intervallo di confidenza del 95% (α = 0,05). I topi sono stati nutriti con una dieta morbida ad libitum durante l'esperimento. Nove topi ha...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo protocollo presenta un rapporto descrittivo sulle procedure chirurgiche per l'induzione della perimplantite utilizzando un modello di legatura nei topi. Lavorare con i topi ha dei vantaggi, come l'economicità, la disponibilità di un ampio array genetico dato il grande background23 tra gli altri aspetti24,25. Nel corso degli anni, diversi studi hanno utilizzato con successo i topi in campo medico e odontoiatrico,<...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal NIH/NIDCR DE031431. Vorremmo ringraziare il Translational Pathology Core Laboratory dell'UCLA per l'assistenza nella preparazione delle sezioni istologiche decalcificate.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| #5 dental explorer | Hu-Friedy, Chicago, IL | 392-0911 | Dental luxation |
| 15c blade and surgical scalpel | Henry Schein Inc., Melville, NY | 1126186 | Tissue incision |
| 6-0 silk ligatures | Fisher Scientific, Hampton, NH | NC9201232 | Ligature |
| Amoxicillin 50μg/mL | Zoetis, San Diego, CA | TS/DRUGS/57/2003 | Oral suspension |
| Bacon Soft Diet | Bio Serve®, Frenchtown, NJ | 14-726-701 | - |
| C57BL/6J male mice | The Jackson Laboratories, Bar Harbor, ME, USA | 000664 | Age: 3-week-old |
| CTAn software | V.1.16 Bruker, Billerica, MA | - | Volumetric analysis |
| Dolphin software | Navantis, Toronto, CA | - | Linear bone analysis |
| Implant carrier & Tip | D. P. Machining Inc., La Verne, CA | Unique product | Implant holder |
| Implant support | D. P. Machining Inc., La Verne, CA | Unique product | Implant capture |
| Isoflurane | Vet One, Boise, ID | NDC13985-528-60 | Inhalational anesthetic |
| Micro-CT scan 1172 | SkyScan, Kontich, Belgium | - | μCT scans |
| Nrecon Software | Bruker Corporation, Billerica, MA | - | Images reconstruction |
| Ø 0.3mm - L 2.5mm Micro Drills | Sphinx, Hoffman Estates, IL | ART. 50699 | Osteotomy |
| Ø 0.5mm - L 1.0mm Titanium implants | D. P. Machining Inc., La Verne, CA | Unique product | - |
| Ophthalmic lubricant | Apexa, Ontario, CA | NDC13985-600-03 | Artificial tears |
| Pin Vise | General Tools, Secaucus, NJ | 90 | Osteotomy |
| Rimadyl 50mg/ml | Zoetis, San Diego, CA | 4019449 | Anti-inflammatory |
| Sterile cotton tipped | Dynarex, Glendale, AZ | 4304-1 | Hemostasis |
| Tip forceps | Fine Science Tools, Foster City, CA | 11071-10 | Dental Extraction |
| Tying forceps | Fine Science Tools, Foster City, CA | 18025-10 | Ligature placement |
Riferimenti
- Ho, K., et al. A cross-sectional survey of patient's perception and knowledge of dental implants in japan. Int J Implant Dent. 8 (1), 14(2022).
- Elani, H. W., Starr, J. R., Da Silva, J. D., Gallucci, G. O. Trends in dental implant use in the u.S., 1999-2016, and projections to 2026. J Dent Res. 97 (13), 1424-1430 (2018).
- Grand view research. , Available from: grandviewresearch.com/industry-analysis/dental-implants-market (2022).
- Renvert, S., Persson, G. R., Pirih, F. Q., Camargo, P. M. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 45, Suppl 20 S278-S285 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 449(2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases-the efp s3 level clinical practice guideline. J Clin Periodontol. 50, Suppl 26 4-76 (2023).
- Graziani, F., Figuero, E., Herrera, D. Systematic review of quality of reporting, outcome measurements and methods to study efficacy of preventive and therapeutic approaches to peri-implant diseases. J Clin Periodontol. 39, Suppl 12 224-244 (2012).
- Schwarz, F., Derks, J., Monje, A., Wang, H. L. Peri-implantitis. J Periodontol. 89, Suppl 1 S267-S290 (2018).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Mouse Genome Sequencing, C. Et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Pirih, F. Q., et al. Ligature-induced peri-implantitis in mice. J Periodontal Res. 50 (4), 519-524 (2015).
- Rau, C. D., et al. High-density genotypes of inbred mouse strains: Improved power and precision of association mapping. G3. 5 (10), Bethesda. 2021-2026 (2015).
- Schwarz, F., Sculean, A., Engebretson, S. P., Becker, J., Sager, M. Animal models for peri-implant mucositis and peri-implantitis. Periodontol 2000. 68 (1), 168-181 (2015).
- Varon-Shahar, E., et al. Peri-implant alveolar bone resorption in an innovative peri-implantitis murine model: Effect of implant surface and onset of infection. Clin Implant Dent Relat Res. 21 (4), 723-733 (2019).
- Pirih, F. Q., et al. A murine model of lipopolysaccharide-induced peri-implant mucositis and peri-implantitis. J Oral Implantol. 41 (5), e158-e164 (2015).
- Schwarz, F., et al. Influence of antiresorptive/antiangiogenic therapy on the extension of experimentally induced peri-implantitis lesions. Clin Oral Investig. 27 (6), 3009-3019 (2023).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Wong, R. L., et al. Early intervention of peri-implantitis and periodontitis using a mouse model. J Periodontol. 89 (6), 669-679 (2018).
- Hiyari, S., et al. Ligature-induced peri-implantitis and periodontitis in mice. J Clin Periodontol. 45 (1), 89-99 (2018).
- Nguyen Vo, T. N., et al. Ligature induced peri-implantitis: Tissue destruction and inflammatory progression in a murine model. Clin Oral Implants Res. 28 (2), 129-136 (2017).
- Yuan, S., et al. Comparative transcriptome analysis of gingival immune-mediated inflammation in peri-implantitis and periodontitis within the same host environment. J Inflamm Res. 15, 3119-3133 (2022).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions. J Periodontol. 89, Suppl 1 S313-S318 (2018).
- Hiyari, S., et al. Genomewide association study identifies cxcl family members as partial mediators of lps-induced periodontitis. J Bone Miner Res. 33 (8), 1450-1463 (2018).
- Kantarci, A., Hasturk, H., Van Dyke, T. E. Animal models for periodontal regeneration and peri-implant responses. Periodontol 2000. 68 (1), 66-82 (2015).
- Struillou, X., Boutigny, H., Soueidan, A., Layrolle, P. Experimental animal models in periodontology: A review. Open Dent J. 4, 37-47 (2010).
- Erata, E., et al. Cnksr2 loss in mice leads to increased neural activity and behavioral phenotypes of epilepsy-aphasia syndrome. J Neurosci. 41 (46), 9633-9649 (2021).
- Fakih, D., Guerrero-Moreno, A., Baudouin, C., Reaux-Le Goazigo, A., Parsadaniantz, S. M. Capsazepine decreases corneal pain syndrome in severe dry eye disease. J Neuroinflammation. 18 (1), 111(2021).
- Douam, F., Ploss, A. The use of humanized mice for studies of viral pathogenesis and immunity. Curr Opin Virol. 29, 62-71 (2018).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), (2021).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Silva, D. N. A., et al. Probiotic lactobacillus rhamnosus em1107 prevents hyperglycemia, alveolar bone loss, and inflammation in a rat model of diabetes and periodontitis. J Periodontol. 94 (3), 376-388 (2023).
- Kim, Y. G., et al. 6-shogaol, an active ingredient of ginger, inhibits osteoclastogenesis and alveolar bone resorption in ligature-induced periodontitis in mice. J Periodontol. 91 (6), 809-818 (2020).
- Fine, N., et al. Periodontal inflammation primes the systemic innate immune response. J Dent Res. 100 (3), 318-325 (2021).
- Yu, X., et al. Role of toll-like receptor 2 in inflammation and alveolar bone loss in experimental peri-implantitis versus periodontitis. J Periodontal Res. 53 (1), 98-106 (2018).
- Reinedahl, D., Chrcanovic, B., Albrektsson, T., Tengvall, P., Wennerberg, A. Ligature-induced experimental peri-implantitis-a systematic review. J Clin Med. 7 (12), (2018).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon