Case Report
Gastrectomía proximal laparoscópica de una sola incisión más un puerto con anastomosis de doble canal para el tratamiento del cáncer gástrico
En este artículo
Resumen
La gastrectomía proximal laparoscópica de una sola incisión más un puerto con anastomosis de doble canal se empleó inicialmente para la resección radical del cáncer gástrico proximal. Este estudio demostró la viabilidad del procedimiento y sentó las bases para futuras investigaciones.
Resumen
La gastrectomía proximal laparoscópica de una sola incisión más un puerto con anastomosis de doble canal (SILT-DT) es un abordaje quirúrgico mínimamente invasivo para el tratamiento del cáncer gástrico proximal. Esta técnica incluye la resección laparoscópica completa del estómago proximal, la disección de los ganglios linfáticos y la anastomosis de doble tracto. Al integrar la cirugía laparoscópica de puerto único con un orificio quirúrgico auxiliar, SILT-DT reduce la dificultad del procedimiento al tiempo que facilita la colocación de un tubo de drenaje abdominal. En comparación con la gastrectomía laparoscópica tradicional de cinco puertos, SILT-DT requiere menos puertos y da como resultado longitudes de incisión más cortas, lo que contribuye a reducir el dolor postoperatorio y a una recuperación más rápida. Se llevó a cabo una evaluación preoperatoria exhaustiva para garantizar el éxito del procedimiento, teniendo en cuenta factores como el tamaño del tumor, el estadio, la ubicación y el IMC del paciente. Esta evaluación integral permitió una selección óptima de los pacientes y la planificación quirúrgica. El seguimiento postoperatorio no mostró complicaciones significativas, lo que subraya la seguridad y eficacia de SILT-DT. Esta técnica innovadora ofrece una alternativa prometedora y mínimamente invasiva para el tratamiento del cáncer gástrico proximal, al tiempo que mantiene excelentes resultados clínicos.
Introducción
Las técnicas laparoscópicas se han convertido recientemente en una de las principales direcciones para el tratamiento quirúrgico del cáncer gástrico 1,2. La cirugía laparoscópica de rutina para el cáncer gástrico se realiza principalmente con el método de 5 orificios. Con los avances en las técnicas quirúrgicas y las mejoras continuas en los dispositivos médicos, la cirugía laparoscópica de cáncer gástrico de puerto reducido se ha desarrollado gradualmente para reducir aún más el trauma quirúrgico, minimizar la alteración de la cavidad abdominal y acelerar la recuperación postoperatoria 3,4,5,6.
Omori7 informó por primera vez de la cirugía laparoscópica de cáncer gástrico distal de puerto único en 2011. La gastrectomía radical laparoscópica pura de un solo puerto para el cáncer gástrico es más difícil que la gastrectomía laparoscópica tradicional de cinco puertos. Para hacer frente a esto, se añade un orificio auxiliar de operación al procedimiento laparoscópico de puerto único, lo que reduce la dificultad de la operación y facilita la colocación de un tubo de drenaje abdominal 8,9. La cirugía laparoscópica de incisión única más un puerto (SILS+1), una técnica mínimamente invasiva para pacientes con cáncer gástrico, ha ganado popularidad en los últimos años debido a su menor número de puertos y longitudes de incisión más cortas.
En la actualidad, la cirugía laparoscópica de cáncer gástrico de puerto único o SILS+1 es relativamente frecuente en la gastrectomía distal, mientras que su aplicación en la gastrectomía total es poco frecuente. Además, no se ha reportado el uso de anastomosis laparoscópica total de cáncer gástrico de doble tracto.
Con base en esto, primero intentamos una gastrectomía proximal laparoscópica total de un solo puerto más un puerto con anastomosis de doble tracto (SILT-DT). El puerto transumbilical se utilizó como puerto de operación principal, y el puerto de drenaje abdominal superior izquierdo sirvió como puerto de operación auxiliar. Esta técnica se empleó para realizar gastrectomía proximal, disección de ganglios linfáticos D2 y anastomosis de doble tracto para la reconstrucción del tracto digestivo.
PRESENTACIÓN DEL CASO:
El paciente, un varón de 63 años, ingresó en el hospital tras el descubrimiento de un tumor en la unión esofagogástrica durante una gastroscopia (Figura 1). Los resultados de la biopsia del gastroscopio sugirieron adenocarcinoma moderadamente diferenciado (Figura 2). Las tomografías computarizadas preoperatorias de tórax y abdomen no revelaron evidencia de metástasis a distancia (Figura 3). El paciente estaba previamente sano y no tenía antecedentes de cirugía abdominal.
Selección de pacientes
Los pacientes eran elegibles para participar si tenían adenocarcinoma de la unión gastroesofágica de Siewert tipo II o III confirmado histológicamente, con TC abdominal preoperatoria que no mostraba ganglios linfáticos agrandados alrededor del estómago ni metástasis a distancia. Se requería que el diámetro máximo del tumor fuera inferior a 3 cm, y que la distancia entre el polo inferior del tumor y el ángulo gástrico fuera superior a 5 cm. Los criterios de exclusión incluyeron pacientes previamente sometidos a cirugía abdominal, aquellos con un diámetro tumoral preoperatorio superior a 3 cm y/o que requirieron resección multivisceral, pacientes que habían sido discutidos con un equipo multidisciplinario (MDT) sobre quimiorradiación neoadyuvante, o aquellos que habían recibido quimiorradiación neoadyuvante, y pacientes con intolerancia a la cirugía laparoscópica.
Protocolo
La operación siguió los procedimientos estándar y recibió la aprobación ética. Este estudio fue autorizado por el Comité de Ética del Hospital Central de Xiangyang, afiliado a la Universidad de Artes y Ciencias de Hubei. Se obtuvo el consentimiento informado por escrito del paciente. El contenido y los métodos de investigación se adhirieron a las normas y requisitos de ética médica. Los reactivos y equipos utilizados en el estudio se enumeran en la Tabla de Materiales.
1. Pasos prequirúrgicos
- Al paciente se le indicó tomar sal de fosfato de sodio oral para la preparación intestinal un día antes de la cirugía. El paciente ayunó durante 8 h y se le permitió la ingesta de agua hasta 2 h antes de la cirugía. Se insertó una sonda gástrica superior antes de ingresar al quirófano.
- El paciente se colocó en posición supina con la cabeza elevada y ligeramente inclinada hacia la derecha.
- Se realizó intubación endotraqueal y se administró anestesia general de acuerdo con los protocolos aprobados institucionalmente.
2. Procedimiento quirúrgico
- Se realizó una incisión transversal de 3,0-3,5 cm alrededor del ombligo para insertar el puerto SILS equipado con cuatro trócares incorporados (Figura 4A). Se insertó un trocar adicional de 12 mm en el cuadrante superior izquierdo para que sirviera como puerto quirúrgico para los instrumentos quirúrgicos, incluida la cizalla ultrasónica, la grapadora lineal endoscópica y el tubo de drenaje postoperatorio.
- Se utilizó un bisturí ultrasónico para diseccionar el tejido linfoide adiposo de los grupos 1, 2, 3, 4, 7, 8a, 9 y 11p (Figura 5A,B). Se aseguró una longitud del segmento esofágico inferior de aproximadamente 5-7 cm (Figura 5C) y se mantuvo la libertad de la mayor y menor curvatura del estómago.
NOTA: El procedimiento SILT-DT se muestra en la Figura 5. La disección de estómago y ganglios linfáticos se realizó de acuerdo con las Guías de Cirugía Laparoscópica para el Cáncer Gástrico (edición 2023)10. Se realizó linfadenectomía D2 y gastrectomía proximal. - Se estableció anastomosis esófago-yeyuno (EJ). El sitio de anastomosis EJ se identificó en el yeyuno, 20 cm distal al ligamento de Treitz y cerca del esófago inferior. La anastomosis EJ se realizó a través del puerto de 12 mm en el cuadrante superior izquierdo utilizando una grapadora lineal endoscópica de 60 mm (Figura 5D).
NOTA: El diagrama esquemático que ilustra la reconstrucción del tracto digestivo se muestra en la Figura 4B. - Se utilizó una grapadora lineal endoscópica de 60 mm para resecar muestras del esófago y cerrar la abertura anastomótica entre el yeyuno y el esófago (Figura 5E).
- Se creó la anastomosis gastroyeyunal (GJ), con el sitio marcado en el yeyuno 8-15 cm distal a la anastomosis EJ y en la pared posterior de la curvatura mayor del estómago remanente (Figura 5F).
- Se estableció la anastomosis yeyoyeyunal. La anastomosis yeyoyeyuno se realizó a través de la incisión de 3,5 cm en el ombligo con una grapadora lineal endoscópica de 60 mm, marcando 5 cm distal al sitio de anastomosis GJ (Figura 5G).
- Las anastomosis individuales se cerraron y fortalecieron. Tanto las aberturas comunes de la anastomosis GJ como las de la anastomosis yeyoyeyuno se cerraron con un micro hilo Joe 3-0. El hiato mesangial se cerró con una sutura continua.
- Se colocó un tubo de drenaje detrás de la anastomosis EJ y se salió por el abdomen superior izquierdo (Figura 5H).
3. Manejo postoperatorio
- Se implementó ayuno hídrico postoperatorio y se drenó la sonda gástrica con una bolsa permanente.
- La sonda gástrica se retiró después de 48 h de observación, asegurándose de que no hubiera presencia evidente de líquido drenante sanguinolento.
- Se administró infusión de líquidos para mantener el equilibrio de agua, electrolitos y ácido-base, junto con la supresión de ácidos. La duración de los antibióticos profilácticos se limitó a un máximo de 48 h.
- La movilización precoz se promovió activamente dentro de las 6-24 horas posteriores a la cirugía. Se inició una dieta líquida durante 2-3 días durante la recuperación.
- Se evaluó la fuga anastomótica y el desarrollo del estómago residual mediante radiografía digestiva alta en día 7.
- El tubo de drenaje de la cavidad abdominal se retiró dentro de los 5 a 7 días posteriores al alta hospitalaria.
Resultados
La cirugía se completó en 150 min, con un sangrado intraoperatorio mínimo de 5 mL. No hubo complicaciones a corto plazo y la recuperación postoperatoria del paciente fue exitosa. Se recuperaron un total de 24 ganglios linfáticos y no se encontraron metástasis ganglionares. El tiempo quirúrgico fue de 150 min y la pérdida sanguínea estimada fue de 5 mL. El paciente permaneció en cama durante 2 días. El tiempo hasta el primer flato fue de 70 h, y el paciente comenzó a consumir alimentos y bebidas líquidas a los 3 días. La sonda gástrica se retiró al4º día y la sonda de drenaje a los 7 días. El agente de contraste persistió en el estómago remanente durante 30-50 min sin reflujo hacia el esófago (Figura 6). El resultado estético de las incisiones abdominales postoperatorias fue satisfactorio (Figura 4C). El dolor se evaluó mediante una escala numérica de valoración (NRS) de 11 puntos, donde 0 es ningún dolor y 10 es el peor dolor imaginable11. Los datos detallados del paciente se presentan en la Tabla 1.
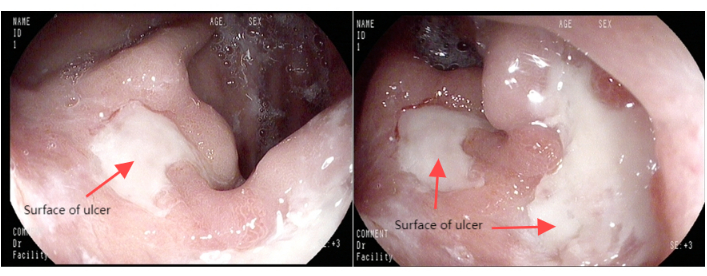
Figura 1: Imágenes gastroscópicas. Haga clic aquí para ver una versión más grande de esta figura.
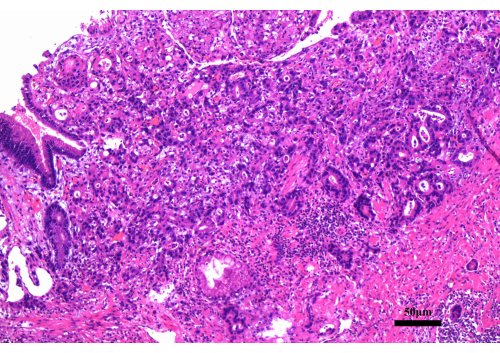
Figura 2: Hallazgos de la biopsia gastroscópica. La biopsia gastroscópica reveló un adenocarcinoma moderadamente diferenciado. Barra de escala: 50 μm; Aumento: 200x. Haga clic aquí para ver una versión más grande de esta figura.
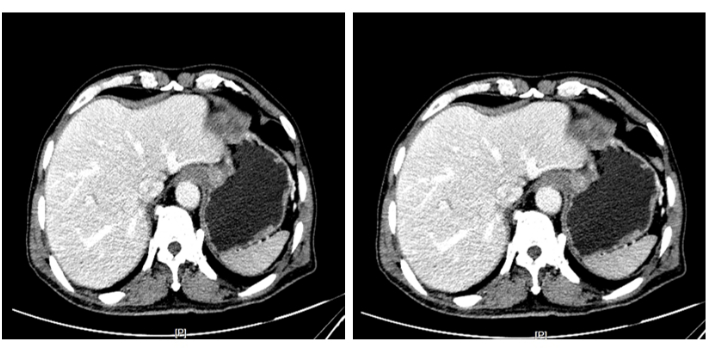
Figura 3: Tomografías computarizadas abdominales mejoradas. Se observó realce heterogéneo en el cardias, que se consideró como una lesión neoplásica, y el tumor no invadió la capa muscular. Haga clic aquí para ver una versión más grande de esta figura.
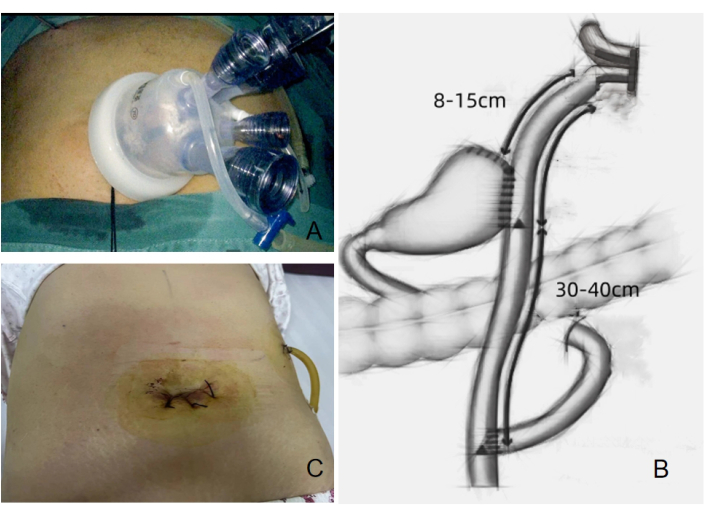
Figura 4: Configuración quirúrgica y estado postoperatorio de la herida. (A) Cuatro trócares incorporados utilizados en el procedimiento. (B) Anastomosis de doble tracto realizada durante la cirugía. (C) Condición postoperatoria de la herida mostrada después del procedimiento. Haga clic aquí para ver una versión más grande de esta figura.
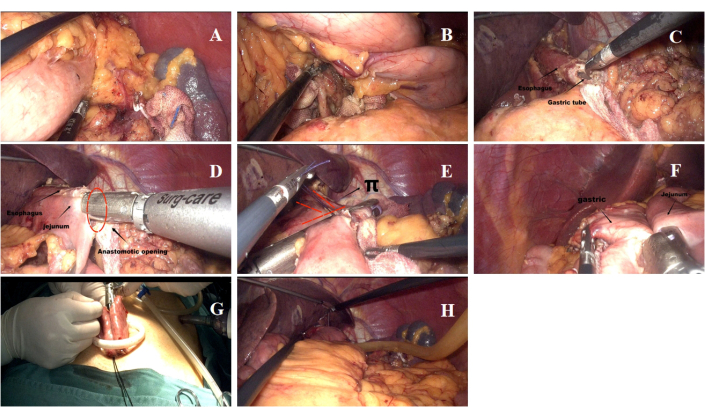
Figura 5: Detalles del procedimiento quirúrgico. (A,B) El proceso de limpieza de los ganglios linfáticos durante la cirugía. (C) Transección del esófago y apertura del extremo esofágico inferior. (D) Esofagoyuyunostomía de lado a lado realizada como parte de la anastomosis. (E) Cierre de la abertura común en el sitio de la anastomosis esofagoyeyunal. (F) Gastroyeyunostomía remanente completada. (G) Anastomosis entero-intestinal de lado a lado realizada a través de la incisión umbilical. (H) Posición del tubo de drenaje. Haga clic aquí para ver una versión más grande de esta figura.
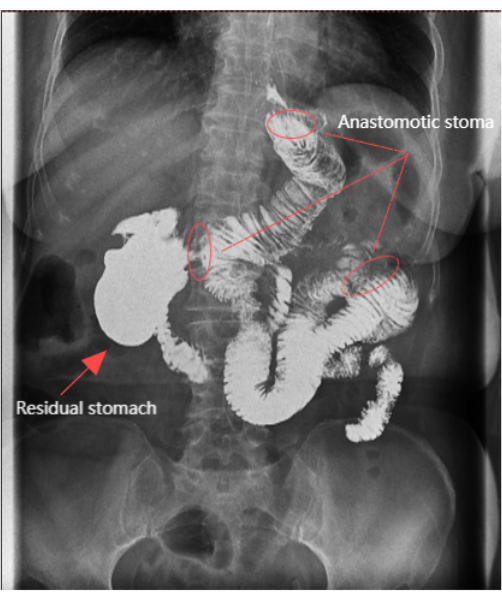
Figura 6: Radiografía digestiva alta. La radiografía digestiva alta mostró que la anastomosis estaba abierta y el resto del estómago era claramente visible. Haga clic aquí para ver una versión más grande de esta figura.
| Artículos | Resultado |
| Género | Masculino |
| Año | 63 |
| IMC (kg/m2) | 23.5 |
| Grado de anestesia | III |
| Estadificación preoperatoria de TNM | cT1N0M0 |
| Tiempo de funcionamiento (min) | 150 |
| Longitud de la incisión (cm) | 2.8 |
| Volumen de sangrado intraoperatorio (mL) | 5 |
| Patología | adenocarcinoma moderadamente diferenciado |
| La distancia del margen proximal (cm) | 3.4 |
| La distancia del margen distal (cm) | 5.5 |
| Tamaño del tumor (cm) | 1.5*2*1.2 |
| El número de ganglios linfáticos recuperados | 24 |
| Estadificación TNM | pT2N0M0 |
| La duración de la extracción de la sonda gástrica después de la cirugía (d) | 4 |
| La duración hasta la comida inicial | 3 |
| La duración de la actividad en la cama | 2 |
| La duración del flato (h) | 70 |
| El momento de la defecación (d) | 6 |
| La duración del tubo de drenaje (d) | 7 |
| Puntuación de dolor el primer día después de la cirugía | 2 |
| Estancia hospitalaria postoperatoria (día) | 8 |
| Complicaciones | Ninguno |
Tabla 1: Datos perioperatorios del paciente. Detalles sobre los datos perioperatorios del paciente, incluidas las mediciones clave y los resultados.
Discusión
La gastrectomía radical laparoscópica de puerto único y de puerto reducido se han convertido en enfoques innovadores para el tratamiento del cáncer gástrico y están ganando aceptación de manera constante. Estas técnicas están recibiendo cada vez más atención por sus ventajas, que incluyen mejores resultados cosméticos, reducción del dolor postoperatorio, menor riesgo de infecciones del sitio quirúrgico y tiempos de recuperación más rápidos.
Los resultados de 12 estudios con 343 casos mostraron que la cirugía laparoscópica de puerto único y de puerto reducido fue eficaz en el tratamiento del cáncer gástrico distal, representando la mayoría de los casos 3,4,12,13,14,15,16,17,18,19,20,21 . Sin embargo, solo cuatro estudios se centraron en la resección gástrica total 22,23,24,25. Estos hallazgos indican que la investigación clínica y la aplicación de la cirugía del cáncer gástrico de puerto único, en particular la gastrectomía total, son limitadas debido a la alta dificultad quirúrgica, la disección extensa y la extirpación de los ganglios linfáticos requeridas, y la compleja técnica de reconstrucción endoscópica del tracto digestivo.
Realizamos con éxito la primera gastrectomía proximal laparoscópica con anastomosis de doble tracto mediante una sola incisión más un puerto para el tratamiento del cáncer gástrico proximal. En comparación con los métodos quirúrgicos tradicionales, la cirugía de una sola incisión más un puerto es menos invasiva. En relación con la técnica de puerto único, la adición del puerto abdominal superior izquierdo mejora la comodidad durante la operación y permite la colocación racional de un tubo de drenaje a través de una incisión en la parte superior izquierda del abdomen.
Lee et al.26 reportaron el primer caso de gastrectomía proximal laparoscópica de puerto único con reconstrucción de doble tracto para cáncer gástrico temprano en 2016. En comparación con la SILS, la cirugía de una sola incisión más un puerto incluye un puerto abdominal superior izquierdo adicional, creando una estructura triangular compuesta por la región umbilical, la parte superior izquierda del abdomen y el área quirúrgica. Este enfoque innovador aborda eficazmente las limitaciones de la cirugía pura de una sola incisión, como la antitracción inadecuada y la visualización lineal. Además, mejora la flexibilidad del instrumento de la mano derecha del cirujano, lo que se traduce en mejoras significativas en la eficiencia operativa y una reducción de la complejidad durante cada anastomosis bajo laparoscopia total.
Además, varias estrategias pueden mejorar la eficiencia operativa y reducir la duración del procedimiento. El cirujano puede considerar modificar su posición durante la disección de los ganglios linfáticos y la reconstrucción del tracto digestivo, como colocarse en el lado izquierdo del paciente o entre las piernas del paciente, para optimizar la exposición del área quirúrgica. Para procedimientos como la esofagoyunostomía y la gastroyeyunostomía, se recomienda que un asistente o el cirujano jefe mantenga una posición estable mientras otro realiza el acoplamiento, mejorando así la eficiencia de la anastomosis y minimizando el riesgo de avulsión del tejido. Además, se recomienda emplear instrumentos laparoscópicos integrados para minimizar la interferencia entre las fibras ópticas y otros instrumentos.
En resumen, la gastrectomía proximal laparoscópica de una sola incisión más un puerto con anastomosis de doble canal es factible para el tratamiento del cáncer gástrico proximal. En este caso, el paciente experimentó una recuperación exitosa. La operación es mínimamente invasiva y la recuperación es más rápida. Sin embargo, las limitaciones de este protocolo incluyen la necesidad de cáncer gástrico en estadio temprano o tumores gástricos benignos, sin que el IMC del paciente sea excesivamente alto. No se recomienda la aplicación de este protocolo en pacientes con enfermedad localmente avanzada o IMC alto debido al riesgo potencial de márgenes tumorales positivos y aumento de la complejidad quirúrgica. Este protocolo aún se encuentra en fase de exploración técnica, sin guías establecidas y con datos clínicos insuficientes para validar plenamente su eficacia a largo plazo. El desarrollo de este protocolo requiere la aprobación ética de las instituciones médicas y el estricto cumplimiento de las indicaciones quirúrgicas. Es necesario realizar más investigaciones y exploraciones clínicas para determinar la aplicabilidad clínica de la técnica SILT-DT.
Divulgaciones
Los autores no tienen conflictos de intereses ni vínculos financieros que revelar.
Agradecimientos
Este trabajo contó con el apoyo de subvenciones del Proyecto de Investigación Científica de la Comisión de Salud de la Provincia de Hubei y el Proyecto Clave de Ciencia y Tecnología de Xiangyang en el campo médico y de la salud (2021YL15).
Materiales
| Name | Company | Catalog Number | Comments |
| 3D laparoscope | KARL STORZ SE & Co. KG | 26605BA | |
| Absorbability surgical sutures | Johnson & Johnson | TLBJXZ | |
| Absorbable ligature clip | Hangzhou KANGJI Medical Instrument co., LTD | KJ-JZJ02ML | |
| Disposable puncture device | Hangzhou KANGJI Medical Instrument co., LTD | Type IV sets F | |
| Disposable step type endoscopic cutting stapler and nail bin | Nanjing Maidixin Medical Device Co.,Ltd | MLCR-Mb,MLCNC-60b-purple, MLCNC-45b-white | |
| laparoscopic instruments | Hangzhou KANGJI Medical Instrument co., LTD | ||
| Ultrasound knife | INNOLCON, Medical Science and Technology (suzhou) co., LTD |
Referencias
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Chevallay, M., et al. Cancer of the gastroesophageal junction: A diagnosis, classification, and management review. Ann N Y Acad Sci. 1434 (1), 132-138 (2018).
- Omori, T., et al. A randomized controlled trial of single-port versus multi-port laparoscopic distal gastrectomy for gastric cancer. Surg Endosc. 35 (8), 4485-4493 (2021).
- Kang, S. H., et al. Postoperative pain and quality of life after single-incision distal gastrectomy versus multiport laparoscopic distal gastrectomy for early gastric cancer - a randomized controlled trial. Surg Endosc. 37 (3), 2095-2103 (2023).
- Teng, W., et al. Short-term outcomes of reduced-port laparoscopic surgery versus conventional laparoscopic surgery for total gastrectomy: A single-institute experience. BMC Surg. 23 (1), 75 (2023).
- Podda, M., Saba, A., Porru, F., Pisanu, A. Systematic review with meta-analysis of studies comparing single-incision laparoscopic colectomy and multiport laparoscopic colectomy. Surg Endosc. 30 (11), 4697-4720 (2016).
- Omori, T., et al. Transumbilical single-incision laparoscopic distal gastrectomy for early gastric cancer. Surg Endosc. 25 (7), 2400-2404 (2011).
- Teng, W., et al. Comparison of short-term outcomes between single-incision plus one-port laparoscopic surgery and conventional laparoscopic surgery for distal gastric cancer: A randomized controlled trial. Transl Cancer Res. 11 (2), 358-366 (2022).
- Du, G. S., et al. Single-incision plus one-port laparoscopic gastrectomy versus conventional multi-port laparoscopy-assisted gastrectomy for gastric cancer: A retrospective study. Surg Endosc. 36 (5), 3298-3307 (2022).
- Chinese Society of Laparoscopic and Endoscopic Surgery, C. S. S., Chinese Medical Association, Association, R. a. L. S. C. O. C. R. H., Endoscopic and Robotic Surgical Society, C. a.-C. A., Endoscopy and Minimally Invasive Technology Society, C. a. O. M. E. Guideline for laparoscopic gastrectomy for gastric cancer (2023 edition). Chinese J Digest Surg. 22 (4), 425-436 (2023).
- Hjermstad, M. J., et al. Studies comparing numerical rating scales, verbal rating scales, and visual analogue scales for assessment of pain intensity in adults: A systematic literature review. J Pain Symptom Manage. 41 (6), 1073-1093 (2011).
- Park, D. J., Lee, J. H., Ahn, S. H., Eng, A. K., Kim, H. H. Single-port laparoscopic distal gastrectomy with d1+β lymph node dissection for gastric cancers: Report of 2 cases. Surg Laparosc Endosc Percutan Tech. 22 (4), e214-e216 (2012).
- Ahn, S. H., Jung, D. H., Son, S. Y., Park, D. J., Kim, H. H. Pure single-incision laparoscopic d2 lymphadenectomy for gastric cancer: A novel approach to 11p lymph node dissection (midpancreas mobilization). Ann Surg Treat Res. 87 (5), 279-283 (2014).
- Ahn, S. H., Son, S. Y., Jung, D. H., Park, D. J., Kim, H. H. Pure single-port laparoscopic distal gastrectomy for early gastric cancer: Comparative study with multi-port laparoscopic distal gastrectomy. J Am Coll Surg. 219 (5), 933-943 (2014).
- Kim, S. M., et al. Techniques of the single-port totally laparoscopic distal gastrectomy. Ann Surg Oncol. 22 (Suppl 3), S341 (2015).
- Jeong, O., Park, Y. K., Ryu, S. Y. Early experience of duet laparoscopic distal gastrectomy (duet-ldg) using three abdominal ports for gastric carcinoma: Surgical technique and comparison with conventional laparoscopic distal gastrectomy. Surg Endosc. 30 (8), 3559-3566 (2016).
- Kim, S. M., et al. Comparison of single-port and reduced-port totally laparoscopic distal gastrectomy for patients with early gastric cancer. Surg Endosc. 30 (9), 3950-3957 (2016).
- Lee, B., et al. Learning curve of pure single-port laparoscopic distal gastrectomy for gastric cancer. J Gastric Cancer. 18 (2), 182-188 (2018).
- Omori, T., et al. The safety and feasibility of single-port laparoscopic gastrectomy for advanced gastric cancer. J Gastrointest Surg. 23 (7), 1329-1339 (2019).
- Kang, S. H., et al. Long-term outcomes of single-incision distal gastrectomy compared with conventional laparoscopic distal gastrectomy: A propensity score-matched analysis. J Am Coll Surg. 234 (3), 340-351 (2022).
- Lee, S., et al. Intracorporeal modified delta-shaped gastroduodenostomy during 2-port distal gastrectomy: Technical aspects and short-term outcomes. Ann Surg Treat Res. 105 (3), 172-177 (2023).
- Ahn, S. H., Park, D. J., Son, S. Y., Lee, C. M., Kim, H. H. Single-incision laparoscopic total gastrectomy with d1+beta lymph node dissection for proximal early gastric cancer. Gastric Cancer. 17 (2), 392-396 (2014).
- Ertem, M., Ozveri, E., Gok, H., Ozben, V. Single incision laparoscopic total gastrectomy and d2 lymph node dissection for gastric cancer using a four-access single port: The first experience. Case Rep Surg. 2013, 504549 (2013).
- Lee, I. Y., Lee, D., Lee, C. M. Case report: Single-port laparoscopic total gastrectomy for gastric cancer in patient with situs inversus totalis. Front Oncol. 13, 1094053 (2023).
- Luo, Y., et al. A novel single-port robot for total gastrectomy to treat gastric cancer: A case report (with video). Asian J Endosc Surg. 17 (2), e13292 (2024).
- Lee, C. M., et al. Single-port laparoscopic proximal gastrectomy with double tract reconstruction for early gastric cancer: Report of a case. J Gastric Cancer. 16 (3), 200-206 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados