Case Report
Incisão única mais uma gastrectomia proximal laparoscópica de uma porta com anastomose de canal duplo para tratamento de câncer gástrico
Neste Artigo
Resumo
A gastrectomia proximal laparoscópica de incisão única mais um portal com anastomose de canal duplo foi inicialmente empregada para a ressecção radical do câncer gástrico proximal. Este estudo demonstrou a viabilidade do procedimento e lançou as bases para pesquisas futuras.
Resumo
A gastrectomia proximal laparoscópica de incisão única mais uma via com anastomose de canal duplo (SILT-DT) é uma abordagem cirúrgica minimamente invasiva para o tratamento do câncer gástrico proximal. Essa técnica inclui ressecção laparoscópica abrangente do estômago proximal, dissecção de linfonodos e anastomose de trato duplo. Ao integrar a cirurgia laparoscópica de portal único com um orifício cirúrgico auxiliar, o SILT-DT reduz a dificuldade do procedimento e facilita a colocação de um tubo de drenagem abdominal. Em comparação com a gastrectomia laparoscópica tradicional de cinco portas, a SILT-DT requer menos portas e resulta em comprimentos de incisão mais curtos, contribuindo para reduzir a dor pós-operatória e acelerar a recuperação. Uma avaliação pré-operatória completa foi realizada para garantir o sucesso do procedimento, com fatores como tamanho do tumor, estágio, localização e IMC do paciente cuidadosamente considerados. Essa avaliação abrangente permitiu a seleção ideal de pacientes e o planejamento cirúrgico. O acompanhamento pós-operatório não demonstrou complicações significativas, ressaltando a segurança e eficácia da SILT-DT. Esta técnica inovadora oferece uma alternativa minimamente invasiva promissora para o tratamento do câncer gástrico proximal, mantendo excelentes resultados clínicos.
Introdução
As técnicas laparoscópicas tornaram-se recentemente uma das principais direções para o tratamento cirúrgico do câncer gástrico 1,2. A cirurgia laparoscópica de rotina para câncer gástrico é realizada principalmente usando o método de 5 orifícios. Com os avanços nas técnicas cirúrgicas e melhorias contínuas nos dispositivos médicos, a cirurgia laparoscópica de câncer gástrico de porta reduzida desenvolveu-se gradualmente para reduzir ainda mais o trauma cirúrgico, minimizar o distúrbio da cavidade abdominal e acelerar a recuperação pós-operatória 3,4,5,6.
Omori7 relatou pela primeira vez a cirurgia laparoscópica de câncer gástrico distal de portal único em 2011. A gastrectomia radical laparoscópica pura de portal único para câncer gástrico é mais difícil do que a gastrectomia laparoscópica tradicional de cinco portas. Para resolver isso, um orifício de operação auxiliar é adicionado ao procedimento laparoscópico de portal único, o que reduz a dificuldade da operação e facilita a colocação de um tubo de drenagem abdominal 8,9. A cirurgia laparoscópica de incisão única mais uma porta (SILS+1), uma técnica minimamente invasiva para pacientes com câncer gástrico, ganhou popularidade nos últimos anos devido ao seu número reduzido de portas e comprimentos de incisão mais curtos.
Atualmente, a cirurgia laparoscópica de câncer gástrico de portal único ou SILS+1 é relativamente comum na gastrectomia distal, enquanto sua aplicação na gastrectomia total é rara. Além disso, o uso de anastomose laparoscópica total de câncer gástrico de trato duplo não foi relatado.
Com base nisso, primeiro tentamos gastrectomia proximal laparoscópica total de portal único mais um portal com anastomose de trato duplo (SILT-DT). A porta transumbilical foi usada como a principal porta de operação, e a porta de drenagem abdominal superior esquerda serviu como porta auxiliar de operação. Essa técnica foi empregada para realizar gastrectomia proximal, dissecção linfonodal D2 e anastomose dupla para reconstrução do trato digestivo.
APRESENTAÇÃO DO CASO:
O paciente, um homem de 63 anos, foi internado após a descoberta de um tumor na junção esofagogástrica durante uma gastroscopia (Figura 1). Os resultados da biópsia do gastroscópio sugeriram adenocarcinoma moderadamente diferenciado (Figura 2). As tomografias computadorizadas pré-operatórias de tórax e abdome não revelaram evidências de metástase à distância (Figura 3). O paciente era previamente saudável e não tinha história de cirurgia abdominal.
Seleção de pacientes
Os pacientes eram elegíveis para participar se tivessem adenocarcinoma da junção gastroesofágica de Siewert tipo II ou III confirmado histologicamente, com TC abdominal pré-operatória sem linfonodos aumentados ao redor do estômago ou metástase à distância. O diâmetro máximo do tumor deveria ser inferior a 3 cm, e a distância entre o polo inferior do tumor e o ângulo gástrico deveria exceder 5 cm. Os critérios de exclusão incluíram pacientes previamente submetidos a cirurgia abdominal, aqueles com diâmetro tumoral pré-operatório superior a 3 cm e/ou que necessitavam de ressecção multivisceral, pacientes submetidos a discussões em equipe multidisciplinar (MDT) sobre quimiorradiação neoadjuvante ou aqueles que receberam quimiorradiação neoadjuvante e pacientes com intolerância à cirurgia laparoscópica.
Protocolo
A operação seguiu os procedimentos padrão e recebeu aprovação ética. Este estudo foi permitido pelo Comitê de Ética do Hospital Central de Xiangyang, afiliado à Universidade de Artes e Ciências de Hubei. O consentimento informado por escrito foi obtido do paciente. O conteúdo e os métodos de pesquisa aderiram às normas e requisitos da ética médica. Os reagentes e equipamentos utilizados no estudo estão listados na Tabela de Materiais.
1. Etapas pré-cirúrgicas
- O paciente foi instruído a tomar sal oral de fosfato de sódio para preparo intestinal um dia antes da cirurgia. O paciente ficou em jejum de 8 h e foi permitida a ingestão de água até 2 h antes da cirurgia. Uma sonda gástrica superior foi inserida antes de entrar na sala de cirurgia.
- O paciente foi posicionado em decúbito dorsal com a cabeça elevada e levemente inclinada para a direita.
- A intubação endotraqueal foi realizada e a anestesia geral foi administrada de acordo com protocolos aprovados institucionalmente.
2. Procedimento cirúrgico
- Uma incisão transversal medindo 3,0-3,5 cm foi criada ao redor do umbigo para inserir a porta SILS equipada com quatro trocartes embutidos (Figura 4A). Um trocarte adicional de 12 mm foi inserido no quadrante superior esquerdo para servir como porta operatória para instrumentos cirúrgicos, incluindo cisalhamento ultrassônico, grampeador linear endoscópico e tubo de drenagem pós-operatória.
- Uma faca ultrassônica foi usada para dissecar o tecido linfóide adiposo dos grupos 1, 2, 3, 4, 7, 8a, 9 e 11p (Figura 5A, B). Um comprimento de segmento esofágico inferior de aproximadamente 5-7 cm foi garantido (Figura 5C), e a liberdade da curvatura maior e menor curvatura do estômago foi mantida.
NOTA: O procedimento SILT-DT é mostrado na Figura 5. A dissecção do estômago e dos linfonodos foi realizada de acordo com as Diretrizes para Cirurgia Laparoscópica para Câncer Gástrico (edição 2023)10. Uma linfadenectomia D2 e gastrectomia proximal foram concluídas. - A anastomose esôfago-jejuno (EJ) foi estabelecida. O local da anastomose EJ foi identificado no jejuno, 20 cm distal ao ligamento de Treitz e próximo ao esôfago inferior. A anastomose EJ foi realizada através do portal de 12 mm no quadrante superior esquerdo usando um grampeador linear endoscópico de 60 mm (Figura 5D).
NOTA: O diagrama esquemático que ilustra a reconstrução do trato digestivo é mostrado na Figura 4B. - Um grampeador linear endoscópico de 60 mm foi usado para ressecar espécimes do esôfago e fechar a abertura da anastomose entre o jejuno e o esôfago (Figura 5E).
- Foi criada a anastomose gastrojejunal (GJ), com o local marcado no jejuno 8-15 cm distal à anastomose EJ e na parede posterior da maior curvatura do estômago remanescente (Figura 5F).
- A anastomose jejunojejunal foi estabelecida. A anastomose jejunojejunal foi feita através da incisão de 3,5 cm no umbigo com grampeador linear endoscópico de 60 mm, marcando 5 cm distal ao local da anastomose GJ (Figura 5G).
- As anastomoses individuais foram fechadas e reforçadas. Tanto as aberturas comuns da anastomose GJ quanto a anastomose jejunojejunal foram fechadas com um fio micro Joe 3-0. O hiato mesangial foi fechado com sutura contínua.
- Um tubo de drenagem foi colocado atrás da anastomose do EJ e saiu do abdome superior esquerdo (Figura 5H).
3. Manejo pós-operatório
- O jejum de água pós-operatório foi implementado e a sonda gástrica foi drenada com uma bolsa de demora.
- A sonda gástrica foi removida após 48 h de observação, garantindo a ausência de presença evidente de líquido drenante sanguinolento.
- A infusão de fluidos foi administrada para manter o equilíbrio hídrico, eletrolítico e ácido-básico, juntamente com a supressão ácida. A duração dos antibióticos profiláticos foi limitada a um máximo de 48 h.
- A mobilização precoce foi ativamente promovida dentro de 6 a 24 horas após a cirurgia. Uma dieta líquida foi iniciada por 2-3 dias durante a recuperação.
- O vazamento anastomótico foi avaliado e o desenvolvimento do estômago residual foi avaliado por meio de radiografia do trato gastrointestinal superior no 7º dia.
- O tubo de drenagem da cavidade abdominal foi removido dentro de 5 a 7 dias após a alta hospitalar.
Resultados
A cirurgia foi concluída em 150 min, com sangramento intraoperatório mínimo de 5 mL. Não houve complicações em curto prazo e a recuperação pós-operatória do paciente foi bem-sucedida. Um total de 24 linfonodos foram recuperados e nenhuma metástase linfonodal foi encontrada. O tempo cirúrgico foi de 150 min e a perda sanguínea estimada foi de 5 mL. O paciente permaneceu no leito por 2 dias. O tempo para o primeiro flatulência foi de 70 h, e o paciente começou a consumir alimentos e bebidas líquidas após 3 dias. A sonda gástrica foi removida no4º dia, e a sonda de drenagem foi removida em 7 dias. O contraste persistiu no estômago remanescente por 30-50 min sem refluxo para o esôfago (Figura 6). O resultado estético das incisões abdominais pós-operatórias foi satisfatório (Figura 4C). A dor foi avaliada por uma escala numérica de 11 pontos (NRS), onde 0 é nenhuma dor e 10 é a pior dor imaginável11. Os dados detalhados para o paciente são apresentados na T able 1.
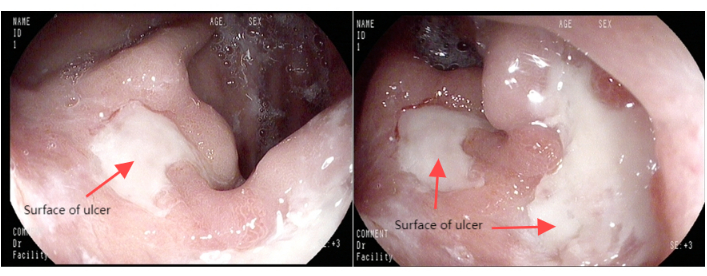
Figura 1: Imagens gastroscópicas. Clique aqui para ver uma versão maior desta figura.
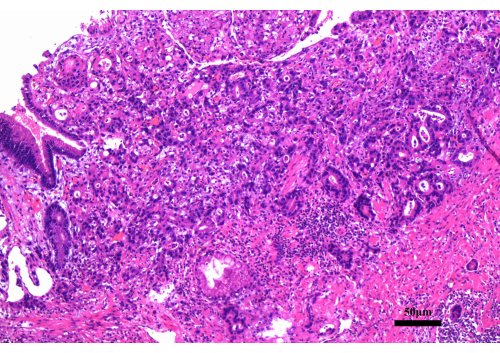
Figura 2: Os achados da biópsia gastroscópica. A biópsia gastroscópica revelou adenocarcinoma moderadamente diferenciado. Barra de escala: 50 μm; Ampliação: 200x. Clique aqui para ver uma versão maior desta figura.
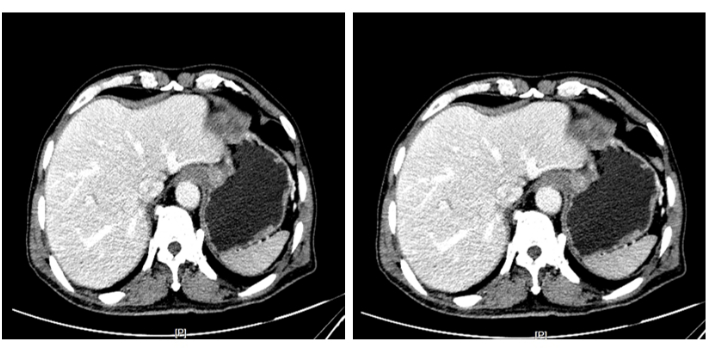
Figura 3: Tomografia computadorizada com realce abdominal. Realce heterogêneo foi observado na cárdia, que foi considerada uma lesão neoplásica, e o tumor não invadiu a camada muscular. Clique aqui para ver uma versão maior desta figura.
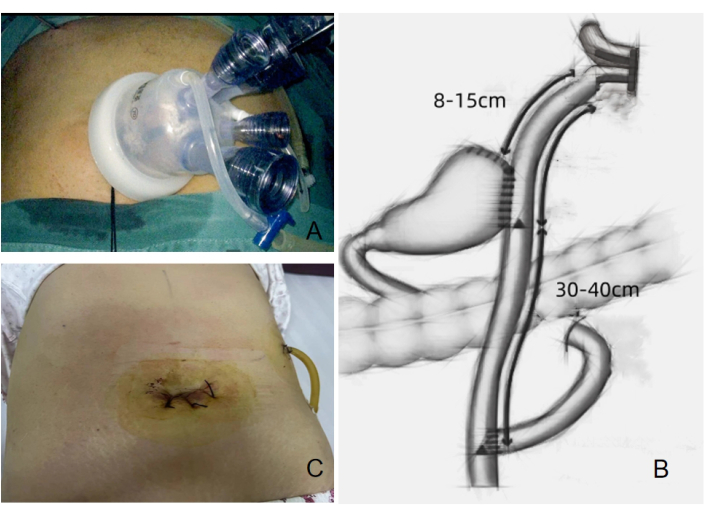
Figura 4: Configuração cirúrgica e condição da ferida pós-operatória. (A) Quatro trocartes embutidos usados no procedimento. (B) Anastomose de trato duplo realizada durante a cirurgia. (C) Condição da ferida pós-operatória mostrada após o procedimento. Clique aqui para ver uma versão maior desta figura.
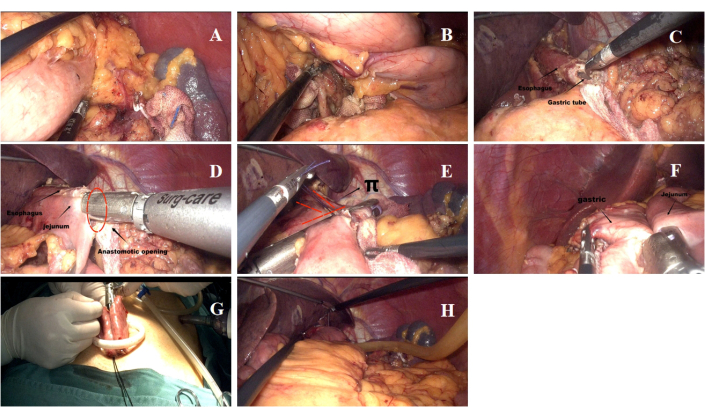
Figura 5: Detalhes do procedimento cirúrgico. (A,B) O processo de limpeza dos gânglios linfáticos durante a cirurgia. (C) Transsecção do esôfago e abertura da extremidade inferior do esôfago. (D) Esofagojejunostomia lado a lado realizada como parte da anastomose. (E) Fechamento da abertura comum no local da anastomose esofagojejunal. (F) Gastrojejunostomia remanescente concluída. (G) Anastomose entero-intestinal látero-lateral realizada através da incisão umbilical. (H) Posição do tubo de drenagem. Clique aqui para ver uma versão maior desta figura.
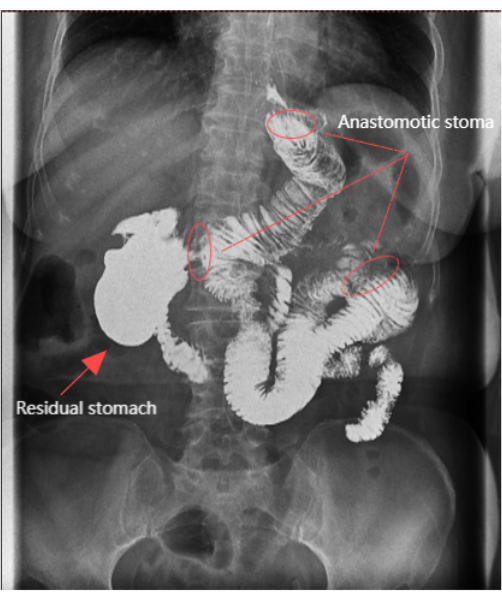
Figura 6: Radiografia do trato gastrointestinal superior. A radiografia do trato gastrointestinal superior mostrou que a anastomose estava aberta e o estômago remanescente era claramente visível. Clique aqui para ver uma versão maior desta figura.
| Itens | Resultado |
| Gênero | Macho |
| Ano | 63 |
| IMC (kg/m2) | 23.5 |
| Grau de anestesia | III |
| Estadiamento TNM pré-operatório | cT1N0M0 |
| Tempo de operação (min) | 150 |
| Comprimento da incisão (cm) | 2.8 |
| Volume de sangramento intraoperatório (mL) | 5 |
| Patologia | adenocarcinoma moderadamente diferenciado |
| A distância da margem proximal (cm) | 3.4 |
| A distância da margem distal (cm) | 5.5 |
| Tamanho do tumor (cm) | 1.5*2*1.2 |
| O número de linfonodos recuperados | 24 |
| Estadiamento TNM | pT2N0M0 |
| A duração da remoção da sonda gástrica após a cirurgia (d) | 4 |
| A duração até a refeição inicial | 3 |
| A duração da atividade na cama | 2 |
| A duração do flatulência (h) | 70 |
| O tempo para evacuar (d) | 6 |
| A duração do tubo de drenagem (d) | 7 |
| Escore de dor no primeiro dia após a cirurgia | 2 |
| Internação pós-operatória (dia) | 8 |
| Complicações | Nenhum |
Tabela 1: Dados perioperatórios do paciente. Detalhes sobre os dados perioperatórios do paciente, incluindo as principais medições e resultados.
Discussão
A gastrectomia radical laparoscópica de portal único e de portal reduzido tornou-se uma abordagem inovadora para o tratamento do câncer gástrico e está ganhando aceitação constante. Essas técnicas estão recebendo maior atenção por suas vantagens, incluindo melhores resultados cosméticos, redução da dor pós-operatória, menor risco de infecções do sítio cirúrgico e tempos de recuperação mais rápidos.
Os resultados de 12 estudos envolvendo 343 casos mostraram que a cirurgia laparoscópica de portal único e de portal reduzido foi eficaz no tratamento do câncer gástrico distal, sendo responsável pela maioria dos casos 3,4,12,13,14,15,16,17,18,19,20,21 . No entanto, apenas quatro estudos enfocaram a ressecção gástrica total 22,23,24,25. Esses achados sugerem que a pesquisa clínica e a aplicação da cirurgia de câncer gástrico de portal único, particularmente a gastrectomia total, são limitadas devido à alta dificuldade cirúrgica, à extensa dissecção e remoção de linfonodos necessária e à complexa técnica de reconstrução endoscópica do trato digestivo.
Realizamos com sucesso a primeira gastrectomia proximal laparoscópica com anastomose de trato duplo usando uma única incisão mais uma porta para o tratamento do câncer gástrico proximal. Em comparação com os métodos cirúrgicos tradicionais, a cirurgia de incisão única mais de um portal é mais minimamente invasiva. Em relação à técnica de portal único, a adição do portal abdominal superior esquerdo aumenta a conveniência durante a operação e permite a colocação racional de um tubo de drenagem através de uma incisão no abdome superior esquerdo.
Lee et al.26 relataram o primeiro caso de gastrectomia proximal laparoscópica de portal único com reconstrução de trato duplo para câncer gástrico precoce em 2016. Em comparação com o SILS, a cirurgia de incisão única mais um portal inclui um portal abdominal superior esquerdo adicional, criando uma estrutura triangular composta pela região umbilical, abdome superior esquerdo e área cirúrgica. Essa abordagem inovadora aborda efetivamente as limitações da cirurgia pura de incisão única, como antitração inadequada e visualização linear. Além disso, aumenta a flexibilidade do instrumento da mão direita do cirurgião, levando a melhorias significativas na eficiência operatória e redução da complexidade durante cada anastomose sob laparoscopia total.
Além disso, várias estratégias podem aumentar a eficiência operacional e reduzir a duração do procedimento. O cirurgião pode considerar alterar seu posicionamento durante a dissecção dos linfonodos e a reconstrução do trato digestivo, como posicionar-se no lado esquerdo do paciente ou entre as pernas do paciente, para otimizar a exposição da área cirúrgica. Para procedimentos como esofagojejunostomia e gastrojejunostomia, recomenda-se que um assistente ou o cirurgião-chefe mantenha uma posição estável enquanto outro realiza o encaixe, melhorando assim a eficiência da anastomose e minimizando o risco de avulsão tecidual. Além disso, o emprego de instrumentos laparoscópicos integrados é recomendado para minimizar a interferência entre as fibras ópticas e outros instrumentos.
Em resumo, a gastrectomia proximal laparoscópica de incisão única mais uma porta com anastomose de canal duplo é viável para o tratamento do câncer gástrico proximal. Nesse caso, o paciente teve uma recuperação bem-sucedida. A operação é minimamente invasiva e a recuperação é mais rápida. No entanto, as limitações desse protocolo incluem a necessidade de câncer gástrico em estágio inicial ou tumores gástricos benignos, com o IMC do paciente não sendo excessivamente alto. A aplicação desse protocolo não é recomendada para pacientes com doença localmente avançada ou IMC elevado devido ao risco potencial de margens tumorais positivas e aumento da complexidade cirúrgica. Este protocolo ainda está em fase de exploração técnica, sem diretrizes estabelecidas e dados clínicos insuficientes para validar totalmente sua eficácia a longo prazo. O desenvolvimento deste protocolo requer aprovação ética das instituições médicas e adesão estrita às indicações cirúrgicas. Mais pesquisas e explorações clínicas são necessárias para determinar a aplicabilidade clínica da técnica SILT-DT.
Divulgações
Os autores não têm conflitos de interesse ou vínculos financeiros a divulgar.
Agradecimentos
Este trabalho foi apoiado por bolsas do Projeto de Pesquisa Científica da Comissão de Saúde da Província de Hubei e do Projeto-Chave de Ciência e Tecnologia de Xiangyang na área médica e de saúde (2021YL15).
Materiais
| Name | Company | Catalog Number | Comments |
| 3D laparoscope | KARL STORZ SE & Co. KG | 26605BA | |
| Absorbability surgical sutures | Johnson & Johnson | TLBJXZ | |
| Absorbable ligature clip | Hangzhou KANGJI Medical Instrument co., LTD | KJ-JZJ02ML | |
| Disposable puncture device | Hangzhou KANGJI Medical Instrument co., LTD | Type IV sets F | |
| Disposable step type endoscopic cutting stapler and nail bin | Nanjing Maidixin Medical Device Co.,Ltd | MLCR-Mb,MLCNC-60b-purple, MLCNC-45b-white | |
| laparoscopic instruments | Hangzhou KANGJI Medical Instrument co., LTD | ||
| Ultrasound knife | INNOLCON, Medical Science and Technology (suzhou) co., LTD |
Referências
- Bray, F., et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 68 (6), 394-424 (2018).
- Chevallay, M., et al. Cancer of the gastroesophageal junction: A diagnosis, classification, and management review. Ann N Y Acad Sci. 1434 (1), 132-138 (2018).
- Omori, T., et al. A randomized controlled trial of single-port versus multi-port laparoscopic distal gastrectomy for gastric cancer. Surg Endosc. 35 (8), 4485-4493 (2021).
- Kang, S. H., et al. Postoperative pain and quality of life after single-incision distal gastrectomy versus multiport laparoscopic distal gastrectomy for early gastric cancer - a randomized controlled trial. Surg Endosc. 37 (3), 2095-2103 (2023).
- Teng, W., et al. Short-term outcomes of reduced-port laparoscopic surgery versus conventional laparoscopic surgery for total gastrectomy: A single-institute experience. BMC Surg. 23 (1), 75 (2023).
- Podda, M., Saba, A., Porru, F., Pisanu, A. Systematic review with meta-analysis of studies comparing single-incision laparoscopic colectomy and multiport laparoscopic colectomy. Surg Endosc. 30 (11), 4697-4720 (2016).
- Omori, T., et al. Transumbilical single-incision laparoscopic distal gastrectomy for early gastric cancer. Surg Endosc. 25 (7), 2400-2404 (2011).
- Teng, W., et al. Comparison of short-term outcomes between single-incision plus one-port laparoscopic surgery and conventional laparoscopic surgery for distal gastric cancer: A randomized controlled trial. Transl Cancer Res. 11 (2), 358-366 (2022).
- Du, G. S., et al. Single-incision plus one-port laparoscopic gastrectomy versus conventional multi-port laparoscopy-assisted gastrectomy for gastric cancer: A retrospective study. Surg Endosc. 36 (5), 3298-3307 (2022).
- Chinese Society of Laparoscopic and Endoscopic Surgery, C. S. S., Chinese Medical Association, Association, R. a. L. S. C. O. C. R. H., Endoscopic and Robotic Surgical Society, C. a.-C. A., Endoscopy and Minimally Invasive Technology Society, C. a. O. M. E. Guideline for laparoscopic gastrectomy for gastric cancer (2023 edition). Chinese J Digest Surg. 22 (4), 425-436 (2023).
- Hjermstad, M. J., et al. Studies comparing numerical rating scales, verbal rating scales, and visual analogue scales for assessment of pain intensity in adults: A systematic literature review. J Pain Symptom Manage. 41 (6), 1073-1093 (2011).
- Park, D. J., Lee, J. H., Ahn, S. H., Eng, A. K., Kim, H. H. Single-port laparoscopic distal gastrectomy with d1+β lymph node dissection for gastric cancers: Report of 2 cases. Surg Laparosc Endosc Percutan Tech. 22 (4), e214-e216 (2012).
- Ahn, S. H., Jung, D. H., Son, S. Y., Park, D. J., Kim, H. H. Pure single-incision laparoscopic d2 lymphadenectomy for gastric cancer: A novel approach to 11p lymph node dissection (midpancreas mobilization). Ann Surg Treat Res. 87 (5), 279-283 (2014).
- Ahn, S. H., Son, S. Y., Jung, D. H., Park, D. J., Kim, H. H. Pure single-port laparoscopic distal gastrectomy for early gastric cancer: Comparative study with multi-port laparoscopic distal gastrectomy. J Am Coll Surg. 219 (5), 933-943 (2014).
- Kim, S. M., et al. Techniques of the single-port totally laparoscopic distal gastrectomy. Ann Surg Oncol. 22 (Suppl 3), S341 (2015).
- Jeong, O., Park, Y. K., Ryu, S. Y. Early experience of duet laparoscopic distal gastrectomy (duet-ldg) using three abdominal ports for gastric carcinoma: Surgical technique and comparison with conventional laparoscopic distal gastrectomy. Surg Endosc. 30 (8), 3559-3566 (2016).
- Kim, S. M., et al. Comparison of single-port and reduced-port totally laparoscopic distal gastrectomy for patients with early gastric cancer. Surg Endosc. 30 (9), 3950-3957 (2016).
- Lee, B., et al. Learning curve of pure single-port laparoscopic distal gastrectomy for gastric cancer. J Gastric Cancer. 18 (2), 182-188 (2018).
- Omori, T., et al. The safety and feasibility of single-port laparoscopic gastrectomy for advanced gastric cancer. J Gastrointest Surg. 23 (7), 1329-1339 (2019).
- Kang, S. H., et al. Long-term outcomes of single-incision distal gastrectomy compared with conventional laparoscopic distal gastrectomy: A propensity score-matched analysis. J Am Coll Surg. 234 (3), 340-351 (2022).
- Lee, S., et al. Intracorporeal modified delta-shaped gastroduodenostomy during 2-port distal gastrectomy: Technical aspects and short-term outcomes. Ann Surg Treat Res. 105 (3), 172-177 (2023).
- Ahn, S. H., Park, D. J., Son, S. Y., Lee, C. M., Kim, H. H. Single-incision laparoscopic total gastrectomy with d1+beta lymph node dissection for proximal early gastric cancer. Gastric Cancer. 17 (2), 392-396 (2014).
- Ertem, M., Ozveri, E., Gok, H., Ozben, V. Single incision laparoscopic total gastrectomy and d2 lymph node dissection for gastric cancer using a four-access single port: The first experience. Case Rep Surg. 2013, 504549 (2013).
- Lee, I. Y., Lee, D., Lee, C. M. Case report: Single-port laparoscopic total gastrectomy for gastric cancer in patient with situs inversus totalis. Front Oncol. 13, 1094053 (2023).
- Luo, Y., et al. A novel single-port robot for total gastrectomy to treat gastric cancer: A case report (with video). Asian J Endosc Surg. 17 (2), e13292 (2024).
- Lee, C. M., et al. Single-port laparoscopic proximal gastrectomy with double tract reconstruction for early gastric cancer: Report of a case. J Gastric Cancer. 16 (3), 200-206 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados