Method Article
Desarrollo de un modelo de rata para el trastorno bipolar
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo presenta un protocolo para la inducción de un modelo único de trastorno bipolar en ratas que captura tanto el comportamiento maníaco como el depresivo.
Resumen
El trastorno bipolar es una afección de salud mental caracterizada por cambios de humor extremos, incluidos períodos de altibajos emocionales (manía) y bajos (depresión). Si bien la neurobiología subyacente exacta aún no se comprende completamente, los desequilibrios en los sistemas de neurotransmisores, particularmente la dopamina, parecen desempeñar un papel central. Por esta razón, las manipulaciones de las vías dopaminérgicas se han utilizado para modelar la manía o la depresión en roedores. Sin embargo, los modelos que representan con precisión el cambio típico entre estos dos episodios son raros, lo que limita la validez aparente. En un modelo único, se utilizan técnicas modernas para aumentar temporalmente la expresión del receptor de dopamina D1, que se ha implicado en la patología del trastorno bipolar. Un constructo lentiviral inducible por tetraciclina que expresa el receptor de dopamina D1 bajo el control del promotor alfa de la calmodulina quinasa II se inyecta estereotácticamente en la corteza prefrontal medial de ratas adultas. La sobreexpresión del receptor de dopamina D1 se logra mediante la adición del análogo de tetraciclina doxiciclina al agua potable de los animales, lo que conduce a un aumento en los comportamientos relacionados con la recompensa, impulsivos y de riesgo y una disminución de la ansiedad. Estos comportamientos se asemejan a un fenotipo similar a la manía. Al eliminar la doxiciclina del agua potable, se puede inducir un fenotipo similar a la depresión, caracterizado por un aumento de la indefensión y la anhedonia, dentro del mismo animal. Este artículo proporciona un protocolo paso a paso para realizar la cirugía, así como procedimientos para inducir el fenotipo similar al trastorno bipolar. Además, se describen las consideraciones para evaluar los cambios conductuales asociados con el comportamiento maníaco y depresivo. Este prometedor modelo, que demuestra una buena validez de constructo y apariencia, ofrece una valiosa herramienta para investigar más a fondo los mecanismos fisiopatológicos del trastorno bipolar.
Introducción
El trastorno bipolar (BD) es un trastorno grave del estado de ánimo que afecta a alrededor del 1% de la población mundial1. Se caracteriza por episodios de estado de ánimo extremo, depresión y manía, junto con estados eutímicos. Los síntomas de los episodios depresivos en la EB se asemejan a los de la depresión unipolar. Los pacientes muestran un menor interés y placer en las actividades y sentimientos de tristeza, desesperanza e inutilidad. Además, a menudo se pueden observar cambios en el apetito, el comportamiento del sueño, así como deficiencias cognitivas2. Los episodios maníacos se caracterizan por un estado de ánimo anormalmente elevado, una disminución de la necesidad de dormir, desinhibición social, un aumento de la autoestima y sentimientos de grandiosidad, así como una mayor toma de riesgos e irritabilidad2.
La etiología de la enfermedad de la EB parece ser una compleja interacción de factores genéticos y de desarrollo3, pero los mecanismos exactos implicados en su fisiopatología aún no se conocen completamente. Se cree que los síntomas surgen de desequilibrios en los sistemas de neurotransmisores4 y, en particular, los estudios centrados en el sistema de dopamina han sido influyentes5. Por ejemplo, Berk et al.6 postularon la hipótesis de la dopamina, asumiendo que un estado hiperdopaminérgico subyace a la manía, mientras que la depresión surge de la hipodopaminergia. Desde entonces, la evidencia de modelos animales, así como los estudios farmacológicos y de imagen, han reunido un fuerte apoyo para una asociación entre los síntomas maníacos y la hiperdopaminergia. Además, se pudo encontrar una conexión entre la disminución de la señalización dopaminérgica y los episodios depresivos, aunque en menor medida7. Además, los resultados de las investigaciones genéticas han reforzado la idea de una hipótesis de dopamina de BD8.
Para arrojar más luz sobre el papel del sistema de dopamina en la EB, se pueden utilizar modelos animales para investigar los mecanismos neurobiológicos que subyacen a los síntomas. Las aplicaciones y limitaciones de los modelos de enfermedad a menudo se evalúan en base a tres criterios de validación, propuestos originalmente por Willner9. Estos incluyen validez facial, de constructo y predictiva. La validez aparente describe la capacidad del modelo para imitar las características conductuales del trastorno. La validez de constructo se alcanza cuando la fisiopatología y la etiología del trastorno son la base del modelo, mientras que la validez predictiva implica que el tratamiento farmacológico del trastorno puede reproducirse dentro del modelo.
Hasta ahora, varios modelos de roedores han contribuido a la comprensión de BD10 e incluyen una amplia gama de modificaciones genéticas, intervenciones farmacéuticas, así como manipulaciones ambientales11.
Se ha demostrado que las manipulaciones experimentales del gen del reloj , por ejemplo, inducen un fenotipo similar a la manía en ratones. El factor de transcripción CLOCK desempeña un papel importante en la regulación de los ritmos circadianos, y los ratones genéticamente alterados, que expresan una proteína que no puede activar la transcripción Clock, se caracterizan por hiperactividad y aumento de las respuestas de recompensa12. El fenotipo resultante parece estar mediado por genes regulados diferencialmente para la señalización dopaminérgica en el área tegmental ventral del cerebro13.
Se ha demostrado que influir directamente en la señalización de la dopamina a través de la administración de fármacos que aumentan la dopamina, como el psicoestimulante anfetamina, induce hiperlocomoción, y la posterior retirada se ha relacionado con síntomas similares a los depresivos, incluida la anhedonia14. También se ha demostrado que los desafíos farmacológicos con ketamina o el agonista del receptor de dopamina D2/D3 quinpirol inducen un comportamiento relevante para la BD15,16.
Además de la intervención farmacológica, se pueden emplear manipulaciones del entorno, como la privación del sueño, para inducir fenotipos conductuales relevantes para la BD17. Los animales privados de sueño muestran un fenotipo similar a la manía caracterizado por un aumento de la locomoción y la emisión de vocalizaciones ultrasónicas que se asocian con cambios en la señalización de la dopamina18.
Existen muchos otros modelos de roedores para estudiar el comportamiento depresivo19 o maníaco20 . Sin embargo, aunque todos estos modelos han contribuido en gran medida a la comprensión de la patología de la BD, están limitados por el estudio de un solo episodio a la vez o los efectos a corto plazo. Por el contrario, ha sido difícil modelar el cambio característico entre estados afectivos.
Aquí, se presenta un protocolo para un modelo de rata único para BD. Demuestra una mayor validez facial al inducir ambos episodios en un animal utilizando una sola manipulación dirigida del sistema de dopamina, es decir, sobreexpresión condicional del receptor de dopamina D1 (DRD1) en la corteza prefrontal medial (mPFC) a partir de una construcción lentiviral inducible por tetraciclina. Al conducir la transcripción génica bajo el control del promotor de la calmodulina quinasa II alfa (CamKIIa), DRD1 se expresa principalmente en neuronas glutamatérgicas, aumentando así la especificidad de la manipulación genética.
La columna vertebral original del lentivirus pRRL.cPPT.WPRE.Sin fue proporcionada por el Dr. Didier Trono (Ecole Polytechnique Fédérale de Lausanne, Suiza)21 y modificada reemplazando el minigen GFP por un sitio polienlazador (vector de lentivirus PL13). A continuación, PL13 se utilizó para producir PL13.pTRE2.DRD1.CamKIIa.rtTA3 o PL13.pTRE2.dsRedExpress.CamKIIa.rtTA3. El ADNc de la rata DRD1 se obtuvo del Dr. David Sibley (NINDS/NIH)22, y el ADNc del activador controlado por tetraciclina inversa 3 (rtTA3) de los Dres. Atze Das y Ben Berkhout (Centro Médico Académico, Universidad de Ámsterdam)23. El ADN del promotor de CamKIIa fue proporcionado por el Dr. Karl Deisseroth (Universidad de Stanford, CA), y las secuencias de dsRedExpress y del elemento de respuesta de tetraciclina 2 (pTRE2) se subclonaron de los plásmidos internos pcDNA3.1-dsRedExpress y pcDNA3.1-pTRE2, respectivamente. Los vectores virales se generaron mediante la subclonación de secuencias de ADN amplificadas por PCR flanqueadas por sitios de restricción.
El modelo que utiliza este vector viral ha demostrado que la sobreexpresión de DRD1 en neuronas mPFC CamKIIa-positivas conduce a un fenotipo similar a la manía24,25, mientras que la posterior regulación negativa de la expresión génica induce un comportamiento depresivo26. Dado que el fenotipo similar a la enfermedad puede ser inducido repetidamente en un animal27, el modelo refleja un alto nivel de validez facial. Además, las manipulaciones del sistema de dopamina tienen una fuerte validez de constructo para modelos animales de BD7, ya que los cambios en los niveles de DRD128,29 o los polimorfismos de DRD1 se han asociado con la patología de BD 30,31,32.
Otros estudios en animales también han llevado a una mayor comprensión de las funciones de la DRD1 prefrontal. Por ejemplo, una disminución de DRD1 ha sido un hallazgo consistente en modelos de depresión 33,34, mientras que la estimulación optogenética de DRD1 en neuronas glutamatérgicas mPFC reduce la ansiedad e induce efectos antidepresivos35. En una reciente publicación de Wu et al.36 se ha demostrado el papel de mPFC DRD1 en las transiciones de estados afectivos. Este estudio destaca que estos receptores son cruciales para los cambios subyacentes en la plasticidad de la sinapsis excitatoria.
En conjunto, el empleo de un modelo de rata de BD que consiste en la manipulación dirigida y condicional de DRD1 en neuronas CamKIIa-positivas de la mPFC constituye un sistema modelo con alta validez de constructo y facial y, por lo tanto, exhibe un gran potencial para la investigación traslacional sobre BD.
A continuación, se describen los procedimientos quirúrgicos para la generación de modelos. Además, se presentarán consideraciones metodológicas para la inducción del modelo y las evaluaciones conductuales junto con los resultados representativos del fenotipo similar a la enfermedad resultante. Se discuten los posibles obstáculos y factores que influyen en la generación de modelos y la evaluación del comportamiento, y se ofrece una perspectiva sobre las direcciones futuras.
Protocolo
El protocolo para la inyección estereotáctica descrito aquí ha sido aprobado por la LANUV (Landesamt für Natur, Umwelt und Verbraucherschutz, Renania del Norte-Westfalia, Alemania). Se utilizaron ratas Sprague Dawley macho adulto (350-650 g de peso corporal). Los reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Los constructos lentivirales
NOTA: Se utiliza un sistema lentiviral de tercera generación para la expresión condicional de DRD1 o proteína fluorescente roja (dsRed) como condición de control25,27.
- Producir el lentivirus basado en el protocolo de Stewart et al.37 con los plásmidos de empaquetamiento 8454 y 8455 del repositorio Addgene.
NOTA: Si la producción de virus no se planifica de forma independiente, muchas instalaciones centrales proporcionan lentivirus de alto título, como Charité Berlin, Alemania. - Titule los virus concentrados y guárdelos a -80 °C.
- Prepare 2 × 107 unidades de transducción (UT) por μL para las inyecciones.
- Transportar los virus al quirófano en hielo seco.
2. Animales
NOTA: El modelo de rata para BD se ha establecido en ratas Sprague Dawley macho adultas (350-650 g de peso corporal). Para la investigación de ratas hembras o de momentos de desarrollo más tempranos, es crucial considerar que la expresión de DRD1 en la mPFC cambia durante el desarrollo y puede ser influenciada por el ciclo estral 38,39,40.
- Emparejar ratas con animales de la misma condición con alimento y agua ad libitum en condiciones constantes de temperatura y humedad (45%-65% de humedad relativa, temperatura 22 °C ± 2 °C).
- Mantenga a las ratas bajo un ciclo inverso de luz-oscuridad de 12 h (las luces se apagan a las 11 a.m.), ya que la investigación del comportamiento debe realizarse durante la fase activa de los animales en la oscuridad.
- Dé a los animales al menos siete días para que se aclimaten a las instalaciones y a la manipulación por parte de los experimentadores antes del inicio de cualquier experimento.
3. Inyección estereotáctica del constructo viral
NOTA: Realice la cirugía bajo una capucha de seguridad (precaución para trabajar con lentivirus) y en condiciones asépticas.
- Preparación
- Asegúrese de que todos los materiales necesarios estén disponibles y funcionen (Tabla de materiales).
- Coloque el marco estereotáctico con el soporte de la jeringa conectado al brazo estereotáctico. Conecte el soporte de la jeringa a la bomba de jeringa.
- Coloque el taladro dental y monte una fresa de 0,9 mm.
- Coloque la almohadilla térmica y ajústela a 37 °C. Eleve la almohadilla térmica a una altura adecuada para facilitar el posicionamiento de la rata.
- Cubra la almohadilla térmica con una cortina absorbente.
- Prepare los instrumentos quirúrgicos esterilizados en autoclave sobre una superficie estéril.
- Monte una jeringa de inyección estereotáxica de 10 μL con una aguja de inyección de 33 G en el soporte de la jeringa.
- Extraer 2,3 μL de suspensión viral para inyecciones bilaterales de 1 μl cada una. Confirme visualmente el retiro exitoso. Asegúrese de realizar este paso como último paso preparatorio para minimizar el tiempo que tarda el lentivirus en estar a temperatura ambiente.
- Analgesia e inducción de la anestesia
- En la mañana de la cirugía, administre meloxicam (1 mg/kg de peso corporal, p.o.).
- Veinte minutos antes del inicio de los procedimientos quirúrgicos para la analgesia, inyecte a la rata buprenorfina (0,5 mg/kg de peso corporal, s.c.).
- Encienda la máquina de anestesia con un flujo de oxígeno de 0,8-1 L/min.
- Inundar la cámara de inducción con un 4 % de isoflurano y colocar la rata en la cámara de inducción.
- Después de una inducción exitosa de la anestesia, visible por la respiración lenta y la pérdida del conocimiento, retire la rata de la cámara de inducción y muévala al marco estereotáctico.
- Posicionamiento de la rata
- Asegúrese de que el flujo de anestesia se cambie a la mascarilla nasal.
- Transfiera la rata de la cámara de inducción al marco estereotáctico, colocando sus dientes frontales en el soporte.
- Coloque correctamente la máscara de anestesia sobre la nariz y gire el isoflurano a 1.5-2.3% para su mantenimiento.
- Proteja los ojos con una crema ocular estéril.
- Al menos 10 minutos antes de realizar cualquier incisión, inyecte localmente a la rata lidocaína (10 mg/kg de peso corporal, s.c.) directamente debajo del sitio de la incisión planificada.
- Asegure a la rata en el marco estereotáctico con barras para los oídos. Asegúrese de que las barras de los oídos estén uniformes y en una posición nivelada de la cabeza.
- Recorta el pelo alrededor del sitio de la incisión con unas tijeras. Retire los trozos de piel con una almohadilla de celulosa humedecida con un antiséptico para la piel.
- Desinfecte el campo quirúrgico con un antiséptico cutáneo.
- Craneotomía e inyección de construcción viral
- Asegúrese de que la anestesia sea adecuada comprobando la ausencia de reflejo en los dedos del pie.
- Desinfecte las manos y cambie a guantes estériles antes de tocar cualquier equipo.
- Haga una pequeña incisión medial (~1,5 cm) con una hoja de bisturí.
- Asegure el acceso al campo quirúrgico empujando la piel hacia los lados con pinzas de bulldog.
- Limpie el campo quirúrgico de sangre y tejido restante con permutas estériles. Asegure una visión adecuada del bregma y suficiente espacio anterior.
- Establezca la coordenada A/P y M/L en cero en función de bregma.
- Mueva el brazo estereotáctico a las coordenadas A/P + 2.7 y M/L ± 0.4 y visualice con un lápiz desinfectado.
- Taladre un orificio de ~ 1 mm de diámetro, cubriendo los lados de inyección para ambos hemisferios.
- Extrae la sangre con un intercambiador estéril.
- Establezca las coordenadas D/V a cero en la superficie del cerebro y baje lentamente la aguja de inyección a -2,8 para inyectar en el área prelímbica de la CPFm.
- Espere 5 minutos para permitir la relajación del tejido.
- Inyecte 1 μL de suspensión viral con una tasa de 0,1 μL/min.
- Espere 5 minutos para que se absorba antes de retirar lentamente la aguja.
- Repita la inyección en el otro hemisferio.
- Cierre y cuidados postoperatorios
- Retire la aguja y cierre la abertura en el cráneo con cera para huesos.
- Retire las pinzas de bulldog y suture la piel (sutura quirúrgica 3-0).
- Inyectar a la rata meloxicam (1 mg/kg, s.c.) para la analgesia postoperatoria.
- Apague la anestesia, retire al animal del marco estereotáctico y colóquelo en su jaula de origen. Asegúrate de que la rata se despierte por completo.
- Enjuague la jeringa con etanol al 100% para desactivar el lentivirus restante, seguido de H2O destilado en preparación para la próxima inyección.
- Realizar analgesia postoperatoria con meloxicam (1 mg/kg, p.o.) cada 24 h durante 3 días y puntuar el estado de salud de los animales durante 1 semana.
- Animales de una sola casa durante las primeras 24 horas después de la cirugía para evitar que otros manipulen las suturas. Colócalos de nuevo con sus compañeros de jaula después.
4. Tratamiento con doxiciclina para la inducción del modelo
NOTA: Inicie la inducción del modelo tan pronto como 24 horas después de la inyección. También se pueden esperar períodos de tiempo más largos entre la inyección y la inducción de hasta varios meses, por ejemplo, para probar cohortes más grandes de animales al mismo tiempo. Se ha demostrado que esto no influye en la funcionalidad del constructo viral.
- Inducción de un episodio similar a una manía
- Para inducir un fenotipo similar a la manía, dé a los animales 0,5 g/L de hicalato de doxiciclina agregándolo al agua potable. Esto induce la transcripción viral y la sobreexpresión de DRD1 adicional.
- Prepare el agua que contiene doxiciclina frescamente cada 48 h a 72 h, un período de tiempo en el que la estabilidad de la doxiciclina no se vea afectada, incluso en botellas de agua no opacas41.
NOTA: Después del tratamiento con doxiciclina durante siete días, la sobreexpresión mediada por el virus habrá alcanzado su máximo, y se puede realizar una investigación conductual durante el episodio similar a la manía.
- Inducción de un episodio depresivo
- Cambie a los animales a agua potable normal, para inducir un episodio depresivo.
- Espere 4 días hasta que se haya detenido la transcripción viral, luego realice una evaluación conductual del episodio depresivo.
- Realizar inducciones de episodios posteriores siguiendo el mismo patrón.
5. Evaluación conductual
NOTA: Siguiendo la inducción del modelo, se puede evaluar el comportamiento similar al bipolar. Se han propuesto diferentes marcos de traslación de los síntomas clínicos a los patrones de comportamiento observables en roedores. Uno de los más influyentes es el criterio de dominio de investigación42, donde se examinan los cambios en los dominios de funcionamiento y comportamiento, posiblemente afectados en los trastornos psiquiátricos. Sin embargo, es importante tener en cuenta que, debido a la barrera de especies, algunos síntomas, por ejemplo, el suicidio, no pueden investigarse en roedores43. Debido a sus capacidades cognitivas y emocionales avanzadas, los modelos de ratas tienen un potencial especialmente fuerte para la evaluación traslacional de los síntomas44, lo que permite procedimientos de prueba más elaborados. Las consideraciones para la evaluación conductual se describen en la Tabla 1.
- Planifique la investigación conductual como una batería de pruebas conductuales45, para proporcionar una imagen completa del fenotipo resultante.
- Preste atención a realizar pruebas más invasivas al final.
- Considere los cambios en el comportamiento que podrían resultar de la experiencia previa con pruebas al tratar de evaluar a un animal en ambos episodios similares a la enfermedad.
NOTA: Dependiendo de la pregunta en cuestión, puede ser beneficioso evaluar diferentes grupos de ratas durante el episodio maníaco o depresivo, lo que también permitiría la recolección de tejido durante el episodio respectivo. La experiencia ha demostrado que las pruebas con animales ingenuos en cuanto al comportamiento pueden dar lugar a un fenotipo más prominente en ciertas pruebas conductuales. - Además, hay que tener en cuenta otros factores como las condiciones de vivienda46 o el sexo del experimentador47.
- Adoptar todas las medidas posibles para reducir el estrés no intencionado de los animales, no sólo para el bienestar animal, sino también para excluir posibles interacciones de los fenotipos psiquiátricos con el estrés48.
- Preste especial atención al ritmo circadiano, ya que las interrupciones del ritmo circadiano son un síntoma de BD17. Dado que las ratas son más activas durante el anochecer y el amanecer, se deben realizar pruebas bajo una luz roja tenue con animales alojados bajo un ciclo inverso de luz-oscuridad49.
NOTA: La mayoría de los resultados representativos presentados aquí se han recopilado siguiendo este enfoque. Sin embargo, un fenotipo similar a la enfermedad sigue siendo observable si se realiza una evaluación del comportamiento sin cambiar el ciclo día-noche de los animales27. - Siempre preregistre el experimento y realice y describa siguiendo las pautas de PREPARE50 y ARRIVE51 .
Resultados
Cuando se agrega doxiciclina al agua potable de los animales, se expresará DRD1 adicional y, después de 7 días, habrá suficiente sobreexpresión para probar el comportamiento maníaco del animal. Hasta ahora, se ha demostrado un aumento en los comportamientos relacionados con la recompensa. Los animales maníacos beben más solución de sacarosa en relación con el agua en una prueba de elección de dos botellas en comparación con los controles25. Cuando se colocan en una caja de observación con una hembra receptiva y se observan durante 25 minutos, los animales maníacos muestran más monturas sexuales en comparación con los controles27 (Figura 1A). En un paradigma de autoadministración de cocaína, administran más cocaína bajo un programa de proporción fija y muestran un punto de ruptura más alto en un programa de proporción progresiva. Su curva dosis-respuesta se desplaza hacia una mayor sensibilidad a dosis bajas25. Este cambio en la sensibilidad también se observa en un aumento de la prominencia motivacional en varios paradigmas de condicionamiento de lugares. Los animales maníacos pasaron más tiempo en los lados condicionados para la nicotina, el alcohol y la cocaína en comparación con los controles25. También se encontró un aumento en la búsqueda de novedades y elecciones más impulsivas en una prueba basada en un laberinto en T sobre el descuento diferido25. En una versión de rata operante de la Tarea de Juego de Iowa, los animales maníacos deciden con más frecuencia por las opciones desventajosas (alto riesgo, alta ganancia) en comparación con los controles24 (Figura 1B). La ansiedad en los animales maníacos se reduce, como lo indica el mayor tiempo que se pasa con los brazos abiertos en el laberinto elevado plus25.
Se puede inducir un fenotipo similar al depresivo mediante la terminación de la sobreexpresión de DRD1. En el episodio depresivo, se pudo observar un aumento de la impotencia. En un paradigma triádico de indefensión, el grupo al que se le presentó por primera vez una descarga eléctrica (Figura 1C), así como el grupo que había aprendido a controlar la descarga, estaban más indefensos con mayores latencias de escape en comparación con sus respectivos controles27. Los grupos en los que se indujo la indefensión, no mostraron diferencias entre el animal de experimentación y el de control. Se encontró anhedonia en la prueba de elección de dos botellas para sacarosa27 y en el comportamiento sexual (datos no publicados). En la prueba de enterramiento de mármol, los animales depresivos también estaban más ansiosos26 (Figura 1D).
El modelo animal descrito no solo ofrece la posibilidad de investigar el comportamiento maníaco o depresivo, sino que también proporciona una oportunidad única para observar un cambio en el comportamiento al terminar la sobreexpresión de DRD1, que se asemeja al cambio de manía a depresión en los pacientes. Aquí, es importante tener en cuenta la habituación a ciertos comportamientos y elegir pruebas con una habituación mínima. Por ejemplo, se mostró un aumento del comportamiento sexual en el episodio maníaco y en el episodio depresivo, una reducción de dicho comportamiento a niveles similares a los observados en los animales de control. En este experimento, se indujeron tres ciclos maníacos/depresivos dentro del mismo animal27. Para el consumo de sacarosa, la preferencia por la solución de sacarosa en el estado de manía no solo se redujo a niveles de control cuando se cambió al estado depresivo, sino que disminuyó27. En la versión con ratas de la tarea de juego de Iowa, el número de opciones desventajosas aumentó en los animales con manía, pero no fue significativamente diferente de los controles cuando los animales estaban en el estado depresivo. En este último estado, el número total de pellets ganados se redujo en comparación con los animales control24.
En general, los animales muestran un fenotipo bipolar robusto, observable en diferentes dominios de comportamiento durante ambos episodios. El cambio entre episodios en este modelo contribuye a mejorar la validez facial. En la Figura 2 se ofrece una descripción general de los dominios de comportamiento afectados.
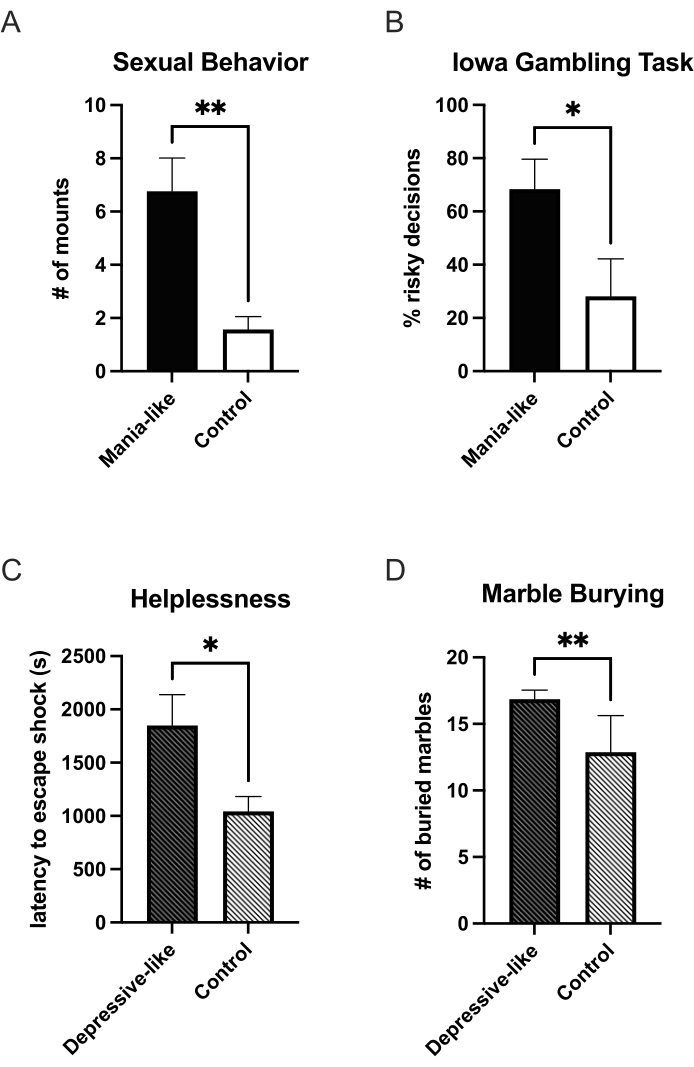
Figura 1: Cambios de comportamiento en estados similares a la manía y la depresión después de la sobreexpresión viral de DRD1. Durante la sobreexpresión viral de DRD1, en el estado de manía, los animales muestran más monturas sexuales (A) y un aumento en las elecciones arriesgadas en la Tarea de Juego de Iowa (B) en comparación con los controles. Después de la terminación de la sobreexpresión, los animales pasan a un estado similar al depresivo. Muestran un aumento de la impotencia (C) y la ansiedad (D). *p < 0,05; **p < 0,01; Las barras de error indican el error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
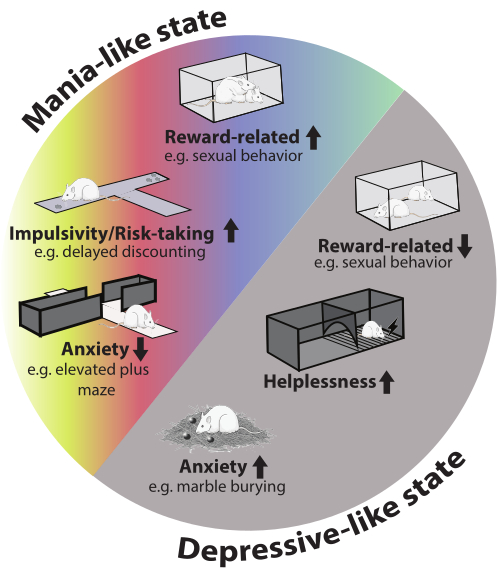
Figura 2: Fenotipo conductual del modelo. En el episodio similar a la manía, hay un aumento en los comportamientos relacionados con la recompensa (por ejemplo, el comportamiento sexual), la impulsividad y la toma de riesgos. La ansiedad se redujo en la prueba del laberinto elevado plus. Durante el episodio depresivo, la ansiedad aumentó en la prueba de entierro de canicas, el comportamiento sexual se redujo y los animales mostraron más indefensión. La imagen de la rata en la figura fue tomada de Servier Medical Art y está licenciada bajo CC BY 4.0. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Consideraciones para la evaluación conductual. La tabla destaca consideraciones importantes para los principales pasos experimentales durante la evaluación conductual. Haga clic aquí para descargar esta tabla.
Discusión
Aquí, se presenta un nuevo modelo de rata para BD con mayor validez facial. Una manipulación dirigida de DRD1 en el mPFC permite la inducción de un fenotipo similar a la manía y la depresión en el mismo animal. Los resultados representativos destacan un fenotipo similar a la enfermedad observable en ambos episodios. El modelo es relativamente fácil de aplicar. Se necesitan dos vectores lentivirales inducibles que expresen DRD1 o dsRed como control. Para la producción y el uso de sistemas lentivirales en animales, se requieren ciertos niveles de seguridad, que deben estar establecidos. Si no se dispone de los equipos necesarios para la producción del virus, la experiencia de trabajo con las instalaciones principales ha sido positiva.
El paso más crucial para generar el modelo es la inyección estereotáctica del sistema lentiviral. Las cirugías estereotácticas son procedimientos bien establecidos en neurociencia, y las tasas de éxito entre los investigadores capacitados son altas. Hay dos posibles fuentes principales de error. Los problemas con la anestesia pueden provocar la muerte durante el procedimiento quirúrgico. En este caso, el uso de la anestesia inhalada con isoflurano, tal como se describe en el protocolo, ha demostrado ser el mejor enfoque, ya que los niveles fácilmente ajustables del fármaco constituyen un claro beneficio en comparación con la anestesia inyectable. Dado que el isoflurano no proporciona ningún efecto analgésico y los nociceptores meníngeos son sensibles a la estimulación52, se recomienda el uso de un opioide para la analgesia intraoperatoria. En combinación con la medicación postoperatoria adecuada, como se describe en el protocolo, no hay signos observables de dolor postoperatorio. Sin embargo, siempre se deben considerar las posibles influencias en las preguntas de investigación, por ejemplo, con respecto a las interacciones de la dopamina con el sistema opioide, y se debe elegir un régimen de medicación adecuado en consecuencia53. Si la cirugía se realiza en condiciones asépticas, es raro que se produzcan infecciones o que se deteriore la cicatrización de las heridas. Si se producen problemas durante la cirugía o la recuperación, la resolución de problemas debe centrarse en la correcta ejecución del protocolo descrito. Es esencial garantizar unas condiciones de trabajo asépticas y una dosificación precisa de la medicación. La administración de líquidos o soluciones de glucosa también puede ayudar a la recuperación. Si se producen infecciones, el tratamiento no debe incluir tetraciclinas, ya que estas interactuarán con la transcripción de los sistemas virales. El tratamiento de primera línea para las infecciones postoperatorias de la herida sería enrofloxacino, posiblemente combinado con carprofeno.
Otra posible fuente de error durante la cirugía es la colocación de la inyección fuera del área objetivo. Esto, sin embargo, rara vez ocurre cuando se sigue correctamente el protocolo y se asegura la correcta colocación de la cabeza del animal. Siempre se debe verificar la colocación exitosa. Si bien la ubicación del virus que expresa dsRed es fácilmente detectable en animales de control, la verificación de la ubicación de los virus que expresan DRD1 requiere pasos adicionales. La tinción de anticuerpos contra diferentes partes de la construcción viral no produjo resultados satisfactorios. Se recomienda verificar la ubicación del virus mediante la disección de la mPFC y la realización de una PCR para detectar las transcripciones de rtTA3 como se describe en Beyer et al.24. También es importante tener en cuenta que la inyección del virus debe ser bilateral con cantidades iguales de virus. Se ha demostrado que la lateralización cerebral y conductual difiere en pacientes con trastorno bipolar 54,55, y las inyecciones virales unilaterales podrían no inducir el fenotipo conductual deseado.
La inducción de la expresión viral de DRD1 y el episodio similar a la manía mediante la adición de doxiciclina al agua potable funciona muy bien. Se ha demostrado que sustituir el agua potable normal por doxiciclina no causa cambios marcados en el comportamiento de bebida. Sin embargo, se debe controlar el consumo de líquidos. Las modulaciones son posibles, si otras sustancias, por ejemplo, medicamentos, están destinadas a ser administradas a través del agua potable. La administración de doxiciclina también se puede realizar a través de gránulos de alimentos. Pero esto aún no ha sido validado.
Para la investigación del comportamiento, en la Tabla 1 se enumeran varias consideraciones. Especialmente los requisitos específicos del modelo deben evaluarse al planificar un experimento. Por ejemplo, se debe decidir si se realizarán pruebas a dos grupos de animales, o si un animal se someterá a una evaluación de comportamiento durante ambos episodios, lo que puede requerir una nueva prueba. Si el fenotipo bipolar no es detectable durante la investigación conductual, aunque se pudo verificar la ubicación, la solución de problemas puede centrarse en varios factores que posiblemente influyan en el resultado conductual. Los cambios en los experimentadores o en el ritmo circadiano deben evaluarse críticamente durante el proceso, ya que las condiciones estresantes del entorno pueden influir en los resultados conductuales.
Si bien el modelo demuestra una buena validez de constructo y aparente, aún es necesario evaluar la validez predictiva. La administración crónica de litio, como tratamiento de primera línea de BD56, debería tener éxito en la prevención de cambios en el comportamiento inducidos por el modelo. Las respuestas a otros fármacos utilizados en la BD, como los fármacos antipsicóticos o anticonvulsivos, podrían investigarse para probar completamente la validez predictiva del modelo.
Además, una limitación actual es que la validez del modelo en animales hembra aún debe evaluarse en estudios futuros. Si bien existe una tendencia a incluir animales hembra en la investigación preclínica, a menudo se descuida. Para el modelo presentado, se esperan interacciones del sistema dopaminérgico con el ciclo estral. Sin embargo, no está claro hasta qué punto ocurrirán. También es importante tener en cuenta las limitaciones generales de los modelos animales psiquiátricos. Si bien la posibilidad de inducir ambos episodios similares a la enfermedad en una rata proporciona una mayor validez facial, los cambios inducidos externamente aún difieren de la aparición espontánea y el ciclo de los episodios de enfermedad en pacientes con BD. Dado que el modelo se basa únicamente en la manipulación dirigida del sistema de dopamina, los efectos principales serán causados por alteraciones en la transmisión de dopamina y efectos secundarios relacionados. Por lo tanto, no se tienen en cuenta las contribuciones de otros sistemas a la sintomatología de la BD.
En conclusión, el modelo presentado tiene un gran potencial para la investigación de la EB, ya que ambos episodios de la enfermedad pueden estudiarse en un solo animal. Esto presenta posibilidades únicas para la investigación de transiciones entre episodios en comparación con la mayoría de los modelos establecidos. El protocolo presentado requiere equipo y habilidades técnicas que están disponibles en la mayoría de los laboratorios de investigación preclínica, lo que lo hace ampliamente aplicable. Hasta ahora, el fenotipo conductual resultante ha sido robusto en diferentes comportamientos. Otros dominios como el comportamiento social57 o las funciones cognitivas aún no se han explorado. Si bien el protocolo presentado se centró en los resultados conductuales, existen varias posibilidades de aplicaciones futuras para investigar más a fondo los mecanismos moleculares. La ampliación de las investigaciones para comprender los mecanismos subyacentes en la patogénesis de la BD, especialmente en lo que respecta a la transición entre episodios, puede conducir a la identificación de dianas terapéuticas que eventualmente podrían traducirse en futuras aplicaciones clínicas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la Fundación Alemana de Investigación (Deutsche Forschungsgemeinschaft, DFG): proyecto número 552842155 y GRK2862/1, proyecto no: 492434978. JA recibió financiación del Fondo de Investigación FoRUM de la Facultad de Medicina de la Ruhr-Universität Bochum (subvención n.º P109-24). La imagen de la rata en la Figura 2 fue tomada de Servier Medical Art y está licenciada bajo CC BY 4.0.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9 mm burr | FST | 19007-09 | Burr for craniotomy |
| 10 µl Neuros Syringe | Hamilton | 65460-06 | Mounted to syringe pump for injection |
| 1ml single use Syringes | Braum | 9166017V | Administration of medication |
| 33 G Needles | Hamilton | 65461-02 | Replacement needles for neuros syringe |
| 4-way valve | UNO | 180000259 | For simultaneous connection of induction chamber and face mask |
| Absorbent Drape | Sabanindas | 1834014 | Covering equipment before placing the animal |
| Anaesthetic Gas Filter | UNO | 180000140 | Anesthesia fume collection |
| Anasthesia mask for stereotactic | Hugo Sachs Electronic | 73-4922 | Administering anesthesia during surgery |
| Anesthesia vaporiser | UNO | 180000002 | Provide and adjust levels of vaporised isoflurane |
| Bone wax | SMI | Z046 | Closing the hole in the skull |
| Bulldog clamps | FST | 18038-45 | To retain skin and allow access to the surgical field |
| Buprenorphine | Elanco | 18760711 | Interoperative analgesia |
| Cannula | Tegler | T138339 | Administration of medication |
| Cellulose swabs | Meditrade | 1177 | Cleaning Skin |
| Connector | UNO | 180000005 | Connecting anesthesia tubing to face mask |
| Control Unit for heating pad | UNO | 180000122 | Controlling heating pad |
| Dental Dril | Saeyang | SMT K-38 | Dental drill for craniotomy; equipable with fine dental burrs |
| Desktop digital stereotaxic instrument | RWD | E03135-002 | Fully equipped stereotactic frame with digital manipulator |
| Destilled H2O | - | - | Rinsing the syringe |
| Doxycycline hyclate | Sigma aldrich | D9891 | For model induction |
| Dry ice | - | - | Transporting viral suspension |
| Earbars | RWD | 68302 | Head fixation in the stereotactic frame |
| Ethanol | - | - | Rinsing the syringe and deactivating virus |
| Flowmeter | UNO | CM2 | Verify and adjust flow rate |
| Forceps - anatomical | FST | 11000-12 | Holding skin |
| Forceps - surgical | FST | 11027-12 | Holding skin |
| Heating pad | UNO | 180000028 | Heating pad for keeping the animal warm during surgery |
| Induction chamber | UNO | 180000233 | Chamber for initial induction of anesthesia |
| Isoflurane | CP Pharma | V7005232.00.00 | Anesthesia |
| Lentiviral suspension | - | - | Lentiviral construct coding for DRD1 or dsRed for model induction |
| Lidocaine | Combustin | 8780701 | Local analgesia |
| Meloxicam | Boehringer Ingelheim | 7578423 | Pre- and postoperative analgesia |
| Needle holder | FST | 91201-13 | Sutering |
| Oxygen concentrator | UNO | 180000399 | Providing oxygen for anesthesia |
| PE Tubing | - | - | Connecting components of the anesthesia machine to induction chamber & face mask |
| Pencil | - | - | Marking the correct side for craniotomy |
| Scalpel blade holder | FST | 10003-12 | To hold scalpel blade |
| Scapel blades | FST | 10011-00 | Fine surgical blade for incision |
| Scavenger Unit | UNO | 180000260 | Controlling capacity of fume collector |
| Skin disinfectant | Bode | 975042 | Disinfacting skin before incision |
| Sterile cotton swabs | Boettger | 1102241 | Cleaning surgical field |
| Sterile eye cream | Bayer | 1578675 | Protect eyes during surgery |
| Surgical Scissors | FST | 14000-12 | Trimming fur and cutting suture material |
| Suture 3-0 polyglycolic acid | SMI | 11201519 | Suturing skin |
| Syringe pump | KdScientific | 788130 | Syring pump with connectable holder |
Referencias
- Müller-Oerlinghausen, B., Berghöfer, A., Bauer, M. Bipolar disorder. Lancet. 359 (9302), 241-247 (2002).
- Grande, I., Berk, M., Birmaher, B., Vieta, E. Bipolar disorder. Lancet. 387 (10027), 1561-1572 (2016).
- Vieta, E., et al. Bipolar Disorders. Nat Rev Dis Primers. 4 (1), 1-16 (2018).
- Lee, J. G., et al. Neuromolecular etiology of bipolar disorder: Possible therapeutic targets of mood stabilizers. Clin Psychopharmacol Neurosci. 20 (2), 228-239 (2022).
- Mohamadian, M., et al. Mood and behavior regulation: Interaction of lithium and dopaminergic system. Naunyn Schmiedebergs Arch Pharmacol. 396 (7), 1339-1359 (2023).
- Berk, M., et al. Dopamine dysregulation syndrome: implications for a dopamine hypothesis of bipolar disorder. Acta Psychiatr Scand. 116 (s434), 41-49 (2007).
- Ashok, A. H., et al. The dopamine hypothesis of bipolar affective disorder: the state of the art and implications for treatment. Mol Psychiatry. 22 (5), 666-679 (2017).
- Zhang, C. -. Y., et al. Genetic evidence for the "dopamine hypothesis of bipolar disorder.". Mol Psychiatry. 28 (2), 532-535 (2023).
- Willner, P. The validity of animal models of depression. Psychopharmacology. 83 (1), 1-16 (1984).
- Beyer, D. K. E., Freund, N. Animal models for bipolar disorder: From bedside to the cage. Int J Bipolar Disord. 5 (1), 35 (2017).
- Valvassori, S. S., Gava, F. F., Cararo, J. H., Quevedo, J. Chapter 9 - The evolution of animal models for bipolar disorder. Neurobiol Bipol Dis. , 109-115 (2021).
- McClung, C. A., et al. Regulation of dopaminergic transmission and cocaine reward by the Clock gene. Proc Natl Acad Sci U S A. 102 (26), 9377-9381 (2005).
- Roybal, K., et al. Mania-like behavior induced by disruption of CLOCK. Proc Natl Acad Sci U S A. 104 (15), 6406-6411 (2007).
- Pathak, G., Ibrahim, B. A., McCarthy, S. A., Baker, K., Kelly, M. P. Amphetamine sensitization in mice is sufficient to produce both manic- and depressive-related behaviors as well as changes in the functional connectivity of corticolimbic structures. Neuropharmacol. 95, 434-447 (2015).
- Krug, J. T., et al. Effects of chronic lithium exposure in a modified rodent ketamine-induced hyperactivity model of mania. Pharmacol Biochem Behav. 179, 150-155 (2019).
- Shaldubina, A., Einat, H., Szechtman, H., Shimon, H., Belmaker, R. H. Preliminary evaluation of oral anticonvulsant treatment in the quinpirole model of bipolar disorder. J Neural Transm. 109 (3), 433-440 (2002).
- Freund, N., Haussleiter, I. Bipolar chronobiology in men and mice: A Narrative review. Brain Sci. 13 (5), 738 (2023).
- Wendler, E., et al. Mania-like elevated mood in rats: Enhanced 50-kHz ultrasonic vocalizations after sleep deprivation. Prog Neuropsychopharmacol Biol Psychiatry. 88, 142-150 (2019).
- Krishnan, V., Nestler, E. J. Animal models of depression: molecular perspectives. Curr Top Behav Neurosci. 7, 121-147 (2011).
- Schmerder, K., Freund, N. Animal models for mania. Psychiatr Vulnerab Mood Anxiety Disord. 190, 233-277 (2023).
- Zufferey, R., et al. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72 (12), 9873-9880 (1998).
- Gardner, B., Liu, Z. F., Jiang, D., Sibley, D. R. The role of phosphorylation/dephosphorylation in agonist-induced desensitization of D1 dopamine receptor function: Evidence for a novel pathway for receptor dephosphorylation. Mol Pharmacol. 59 (2), 310-321 (2001).
- Das, A. T., et al. Viral evolution as a tool to improve the tetracycline-regulated gene expression system. J Biol Chem. 279 (18), 18776-18782 (2004).
- Beyer, D. K. E., Horn, L., Klinker, N., Freund, N. Risky decision-making following prefrontal D1 receptor manipulation. Transl Neurosci. 12 (1), 432-443 (2021).
- Sonntag, K. C., et al. Viral over-expression of D1 dopamine receptors in the prefrontal cortex increase high-risk behaviors in adults: Comparison with adolescents. Psychopharmacology. 231 (8), 1615-1626 (2014).
- Beyer, D. K. E., Mattukat, A., Freund, N. Prefrontal dopamine D1 receptor manipulation influences anxiety behavior and induces neuroinflammation within the hippocampus. Int J Bipolar Disord. 9 (1), 9 (2021).
- Freund, N., Thompson, B. S., Sonntag, K., Meda, S., Andersen, S. L. When the party is over: Depressive-like states in rats following termination of cortical D1 receptor overexpression. Psychopharmacology. 233 (7), 1191-1201 (2016).
- Pantazopoulos, H., Stone, D., Walsh, J., Benes, F. M. Differences in the cellular distribution of D1 receptor mRNA in the hippocampus of bipolars and schizophrenics. Synapse. 54 (3), 147-155 (2004).
- Suhara, T., et al. D1 dopamine receptor binding in mood disorders measured by positron emission tomography. Psychopharmacology. 106 (1), 14-18 (1992).
- Dmitrzak-Weglarz, M., et al. Dopamine receptor D1 Gene -48A/G polymorphism is associated with bipolar illness but not with schizophrenia in a polish population. Neuropsychobiology. 53 (1), 46-50 (2006).
- Rybakowski, J., Dmitrzak-Weglarz, M., Suwalska, A., Leszczynska-Rodziewicz, A., Hauser, J. Dopamine D1 receptor gene polymorphism is associated with prophylactic lithium response in bipolar disorder. Pharmacopsychiatry. 42 (01), 20-22 (2009).
- Severino, G., et al. A48G polymorphism in the D 1 receptor genes associated with bipolar I disorder. Am J Med Genet B Neuropsychiatr Genet. 134B (1), 37-38 (2005).
- Shinohara, R., et al. Dopamine D1 receptor subtype mediates acute stress-induced dendritic growth in excitatory neurons of the medial prefrontal cortex and contributes to suppression of stress susceptibility in mice. Mol Psychiatry. 23 (8), 1717-1730 (2018).
- Yang, Y., Zhong, Z., Wang, B., Wang, Y., Ding, W. Activation of D1R signaling in the medial prefrontal cortex rescues maternal separation-induced behavioral deficits through restoration of excitatory neurotransmission. Behav Brain Res. 441, 114287 (2023).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nat Commun. 10 (1), 223 (2019).
- Wu, M., et al. Dopamine pathways mediating affective state transitions after sleep loss. Neuron. 112 (1), 141-154 (2024).
- Stewart, S. A., et al. Lentivirus-delivered stable gene silencing by RNAi in primary cells. RNA. 9 (4), 493-501 (2003).
- Andersen, S. L., Thompson, A. T., Rutstein, M., Hostetter, J. C., Teicher, M. H. Dopamine receptor pruning in prefrontal cortex during the periadolescent period in rats. Synapse. 37 (2), 167-169 (2000).
- Brenhouse, H. C., Sonntag, K. C., Andersen, S. L. Transient D1 dopamine receptor expression on prefrontal cortex projection neurons: Relationship to enhanced motivational salience of drug cues in adolescence. J Neurosci. 28 (10), 2375-2382 (2008).
- Thompson, T. L., Moss, R. L. Modulation of mesolimbic dopaminergic activity over the rat estrous cycle. Neurosci Lett. 229 (3), 145-148 (1997).
- Redelsperger, I. M., et al. Stability of doxycycline in feed and water and minimal effective doses in tetracycline-inducible systems. J Am Assoc Lab Anim Sci. 55 (4), 467-474 (2016).
- Insel, T., et al. Research domain criteria (RDoC): Toward a new classification framework for research on mental disorders. Am J Psychiatry. 167 (7), 748-751 (2010).
- von Mücke-Heim, I. -. A., et al. Introducing a depression-like syndrome for translational neuropsychiatry: a plea for taxonomical validity and improved comparability between humans and mice. Mol Psychiatry. 28 (1), 329-340 (2023).
- Ben-Ami Bartal, I. The complex affective and cognitive capacities of rats. Science. 385 (6715), 1298-1305 (2024).
- Jaehne, E. J., Corrone, M., van den Buuse, M. Administering a behavioral test battery in rodents. Neurobiol Methods Protoc. , 87-100 (2024).
- Prager, E. M., Bergstrom, H. C., Grunberg, N. E., Johnson, L. R. The Importance of reporting housing and husbandry in rat research. Front Behav Neurosci. 5, 38 (2011).
- Sorge, R. E., et al. Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nat Methods. 11 (6), 629-632 (2014).
- Du Preez, A., et al. Do different types of stress differentially alter behavioral and neurobiological outcomes associated with depression in rodent models? A systematic review. Front Neuroendocrinol. 61, 100896 (2021).
- Burn, C. C. What is it like to be a rat? Rat sensory perception and its implications for experimental design and rat welfare. Appl Anim Behav Sci. 112 (1), 1-32 (2008).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. PREPARE: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), e1000412 (2010).
- Messlinger, K., Ellrich, J. Meningeal nociception: Electrophysiological studies related to headache and referred pain. Microsc Res Tech. 53 (2), 129-137 (2001).
- Jirkof, P. Side effects of pain and analgesia in animal experimentation. Lab Anim. 46 (4), 123-128 (2017).
- Moebus, L., Quirin, M., Ehrlenspiel, F. Cerebral asymmetry in bipolar disorders: A scoping review. Biol Psychol. 179, 108551 (2023).
- Mundorf, A., Borawski, J., Ocklenburg, S. Behavioral lateralization in bipolar disorders: A systematic review. Int J Bipolar Disord. 11 (1), 37 (2023).
- Alda, M. Lithium in the treatment of bipolar disorder: Pharmacology and pharmacogenetics. Mol Psychiatry. 20 (6), 661-670 (2015).
- Reinhardt, P. R., Theis, C. D. C., Juckel, G., Freund, N. Rodent models for mood disorders - understanding molecular changes by investigating social behavior. Biol Chem. 404 (10), 939-950 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados