Method Article
Sviluppo di un modello di ratto per il disturbo bipolare
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo presenta un protocollo per l'induzione di un modello unico di disturbo bipolare nel ratto che cattura sia il comportamento maniacale che quello depressivo.
Abstract
Il disturbo bipolare è una condizione di salute mentale caratterizzata da sbalzi d'umore estremi, inclusi periodi di alti (mania) e bassi emotivi (depressione). Sebbene l'esatta neurobiologia sottostante non sia ancora del tutto compresa, gli squilibri nei sistemi di neurotrasmettitori, in particolare la dopamina, sembrano svolgere un ruolo centrale. Per questo motivo, le manipolazioni delle vie dopaminergiche sono state utilizzate per modellare la mania o la depressione nei roditori. Tuttavia, i modelli che rappresentano accuratamente il tipico passaggio tra questi due episodi sono rari, limitando la validità facciale. In un modello unico, le tecniche moderne vengono utilizzate per aumentare temporaneamente l'espressione del recettore D1 della dopamina, che è stata implicata nella patologia del disturbo bipolare. Un costrutto lentivirale inducibile dalla tetraciclina che esprime il recettore D1 della dopamina sotto il controllo del promotore della calmodulina chinasi II alfa viene iniettato stereotassicamente nella corteccia prefrontale mediale di ratti adulti. La sovraespressione del recettore D1 della dopamina si ottiene aggiungendo l'analogo della tetraciclina doxiciclina all'acqua potabile degli animali, portando ad un aumento dei comportamenti legati alla ricompensa, impulsivi e a rischio e ad una diminuzione dell'ansia. Questi comportamenti assomigliano a un fenotipo simile alla mania. Rimuovendo la doxiciclina dall'acqua potabile, un fenotipo simile alla depressione, caratterizzato da aumento dell'impotenza e dell'anedonia, può essere indotto all'interno dello stesso animale. Questo articolo fornisce un protocollo passo dopo passo per l'esecuzione dell'intervento chirurgico, nonché le procedure per indurre il fenotipo simile al disturbo bipolare. Inoltre, vengono descritte le considerazioni per valutare i cambiamenti comportamentali associati a comportamenti maniaci e depressivi. Questo modello promettente, che dimostra un buon costrutto e validità facciale, offre uno strumento prezioso per indagare ulteriormente i meccanismi fisiopatologici del disturbo bipolare.
Introduzione
Il disturbo bipolare (BD) è un grave disturbo dell'umore che colpisce circa l'1% della popolazione mondiale1. È caratterizzata da episodi di umore estremo, depressione e mania, oltre a stati eutimici. I sintomi degli episodi depressivi nella BD assomigliano a quelli della depressione unipolare. I pazienti mostrano un ridotto interesse e piacere per le attività e sentimenti di tristezza, disperazione e inutilità. Inoltre, spesso si possono osservare cambiamenti nell'appetito, nel comportamento durante il sonno e disturbi cognitivi2. Gli episodi maniacali sono caratterizzati da umore anormalmente accentuato, diminuzione del bisogno di sonno, disinibizione sociale, aumento dell'autostima e sentimenti di grandiosità, nonché aumento dell'assunzione di rischi e dell'irritabilità2.
L'eziologia della malattia della BD sembra essere una complessa interazione di fattori genetici e di sviluppo3, ma gli esatti meccanismi coinvolti nella sua fisiopatologia non sono ancora completamente compresi. Si ritiene che i sintomi derivino da squilibri nei sistemi di neurotrasmettitori4 e, in particolare, gli studi incentrati sul sistema della dopamina sono stati influenti5. Ad esempio, Berk et al.6 hanno postulato l'ipotesi della dopamina, assumendo che uno stato iperdopaminergico sia alla base della mania, mentre la depressione derivi dall'ipodopaminergia. Da allora, le prove provenienti da modelli animali, così come gli studi farmacologici e di imaging, hanno raccolto un forte sostegno per un'associazione tra sintomi maniacali e iperdopaminergia. Inoltre, è stata trovata una connessione tra la diminuzione della segnalazione dopaminergica e gli episodi di depressione, anche se in misura minore7. Inoltre, i risultati delle indagini genetiche hanno rafforzato l'idea di un'ipotesi di dopamina di BD8.
Per far luce sul ruolo del sistema della dopamina nella BD, i modelli animali possono essere utilizzati per studiare i meccanismi neurobiologici che sono alla base dei sintomi. Le applicazioni e i limiti dei modelli di malattia sono spesso valutati sulla base di tre criteri di convalida, originariamente proposti da Willner9. Questi includono la validità facciale, costruttiva e predittiva. La validità apparente descrive la capacità del modello di imitare le caratteristiche comportamentali del disturbo. La validità del costrutto è raggiunta quando la fisiopatologia e l'eziologia del disturbo sono alla base del modello, mentre la validità predittiva implica che il trattamento farmacologico del disturbo possa essere riprodotto all'interno del modello.
Finora, vari modelli di roditori hanno contribuito alla comprensione di BD10 e includono un'ampia gamma di modificazioni genetiche, interventi farmaceutici e manipolazioni ambientali11.
È stato dimostrato che le manipolazioni sperimentali del gene Clock , ad esempio, inducono un fenotipo simile alla mania nei topi. Il fattore di trascrizione CLOCK svolge un ruolo importante nella regolazione dei ritmi circadiani e i topi geneticamente modificati, che esprimono una proteina che non può attivare la trascrizione di Clock, sono caratterizzati da iperattività e aumento delle risposte di ricompensa12. Il fenotipo risultante sembra essere mediato da geni regolati in modo differenziale per la segnalazione dopaminergica nell'area tegmentale ventrale13 del cervello.
È stato dimostrato che l'influenza diretta della segnalazione della dopamina attraverso la somministrazione di farmaci che aumentano la dopamina, come lo psicostimolante anfetamina, induce iperlocomozione e la successiva sospensione è stata collegata a sintomi simili alla depressione, tra cui l'anedonia14. È stato anche dimostrato che le sfide farmacologiche con la ketamina o l'agonista del recettore D2/D3 della dopamina quinpirolo inducono un comportamento rilevante per BD15,16.
Oltre all'intervento farmacologico, le manipolazioni dell'ambiente, come la privazione del sonno, possono essere impiegate per indurre fenotipi comportamentali rilevanti per BD17. Gli animali privati del sonno mostrano un fenotipo maniacale caratterizzato da un aumento della locomozione e dell'emissione di vocalizzazioni ultrasoniche che sono associate a cambiamenti nella segnalazione della dopamina18.
Ci sono numerosi altri modelli di roditori per studiare il comportamento depressivo19 o maniaca-simile20 . Tuttavia, mentre tutti questi modelli hanno fortemente contribuito alla comprensione della patologia BD, sono limitati dallo studio di un solo episodio alla volta o degli effetti a breve termine. Al contrario, è stato difficile ottenere la modellazione del caratteristico passaggio tra gli stati affettivi.
Qui viene presentato un protocollo per un modello di ratto unico per BD. Dimostra una maggiore validità facciale inducendo entrambi gli episodi in un animale utilizzando una singola manipolazione mirata del sistema della dopamina, cioè sovraesprimendo condizionatamente il recettore della dopamina D1 (DRD1) nella corteccia prefrontale mediale (mPFC) da un costrutto lentivirale inducibile da tetraciclina. Guidando la trascrizione genica sotto il controllo del promotore della calmodulina chinasi II alfa (CamKIIa), DRD1 è espresso principalmente nei neuroni glutammatergici, aumentando così la specificità della manipolazione genetica.
La spina dorsale originale del lentivirus pRRL.cPPT.WPRE.Sin è stata fornita dal Dr. Didier Trono (Ecole Polytechnique Fédérale de Lausanne, Svizzera)21 e modificata sostituendo il minigene GFP con un sito di polilinker (vettore del lentivirus PL13). Il PL13 è stato poi utilizzato per produrre PL13.pTRE2.DRD1.CamKIIa.rtTA3 o PL13.pTRE2.dsRedExpress.CamKIIa.rtTA3. Il cDNA di DRD1 di ratto è stato ottenuto dal Dr. David Sibley (NINDS/NIH)22 e il cDNA dell'attivatore controllato con tetraciclina inversa 3 (rtTA3) dai dottori Atze Das e Ben Berkhout (Academic Medical Center, Università di Amsterdam)23. Il DNA promotore di CamKIIa è stato fornito dal Dr. Karl Deisseroth (Stanford University, CA), e le sequenze dsRedExpress e l'elemento di risposta alla tetraciclina 2 (pTRE2) sono state subclonate rispettivamente dai plasmidi interni pcDNA3.1-dsRedExpress e pcDNA3.1-pTRE2. I vettori virali sono stati generati mediante subclonaggio di sequenze di DNA amplificate con PCR affiancate da siti di restrizione.
Il modello che utilizza questo vettore virale ha dimostrato che la sovraespressione di DRD1 nei neuroni mPFC CamKIIa-positivi porta a un fenotipo mania-like24,25, mentre la successiva downregulation dell'espressione genica induce un comportamento depressivo-like26. Poiché il fenotipo simile alla malattia può essere indotto ripetutamente in un animale27, il modello riflette un alto livello di validità facciale. Inoltre, le manipolazioni del sistema della dopamina hanno una forte validità di costrutto per i modelli animali di BD7, poiché i cambiamenti nei livelli di DRD128,29 o nei polimorfismi DRD1 sono stati associati alla patologia BD 30,31,32.
Altri studi sugli animali hanno anche portato a una maggiore comprensione delle funzioni della DRD1 prefrontale. Ad esempio, una diminuzione di DRD1 è stata un risultato costante nei modelli di depressione33,34, mentre la stimolazione optogenetica di DRD1 nei neuroni glutammatergici mPFC riduce l'ansia e induce effetti antidepressivi35. In una recente pubblicazione di Wu et al.36, è stato dimostrato il ruolo di mPFC DRD1 nelle transizioni di stato affettivo. Questo studio evidenzia che questi recettori sono cruciali per i cambiamenti sottostanti nella plasticità delle sinapsi eccitatorie.
Nel complesso, l'impiego di un modello di BD su ratto che consiste nella manipolazione mirata e condizionale di DRD1 nei neuroni CamKIIa-positivi della mPFC costituisce un sistema modello con un'elevata validità di costrutto e di facciata e, quindi, mostra un forte potenziale per la ricerca traslazionale sulla BD.
Di seguito vengono descritte le procedure chirurgiche per la generazione del modello. Inoltre, verranno presentate considerazioni metodologiche per l'induzione del modello e le valutazioni comportamentali insieme ai risultati rappresentativi del fenotipo simile alla malattia risultante. Vengono discussi i possibili ostacoli e i fattori che influenzano la generazione di modelli e la valutazione comportamentale e viene fornita una prospettiva sulle direzioni future.
Protocollo
Il protocollo per l'iniezione stereotassica qui descritto è stato approvato dal LANUV (Landesamt für Natur, Umwelt und Verbraucherschutz, Renania Settentrionale-Vestfalia, Germania). Sono stati utilizzati ratti Sprague Dawley maschi adulti (350-650 g di peso corporeo). I reagenti e le attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. I costrutti lentivirali
NOTA: Un sistema lentivirale di terza generazione viene utilizzato per l'espressione condizionale di DRD1 o proteina fluorescente rossa (dsRed) come condizione di controllo25,27.
- Produrre il lentivirus basato sul protocollo di Stewart et al.37 con i plasmidi 8454 e 8455 dal repository Addgene.
NOTA: Se la produzione di virus non è pianificata in modo indipendente, molte strutture principali forniscono lentivirus ad alto titolo, come la Charité Berlin, in Germania. - Titolare i virus concentrati e conservarli a -80 °C.
- Preparare 2 × 107 unità di trasduzione (TU) per μL per le iniezioni.
- Trasporta i virus nella sala operatoria su ghiaccio secco.
2. Animali
NOTA: Il modello di ratto per BD è stato stabilito in ratti Sprague Dawley maschi adulti (350-650 g di peso corporeo). Per lo studio delle femmine di ratto o dei primi punti temporali dello sviluppo, è fondamentale considerare che l'espressione di DRD1 nella mPFC cambia durante lo sviluppo e può essere influenzata dal ciclo estrale 38,39,40.
- Accoppiare i ratti con animali della stessa condizione con cibo e acqua ad libitum in condizioni di temperatura e umidità costanti (45%-65% di umidità relativa, temperatura 22 °C ± 2 °C).
- Tenere i ratti sotto un ciclo inverso di luce-buio di 12 ore (luci spente alle 11 del mattino), poiché l'indagine comportamentale dovrebbe essere eseguita durante la fase attiva degli animali al buio.
- Concedere agli animali almeno sette giorni per acclimatarsi alla struttura e alla manipolazione da parte degli sperimentatori prima dell'inizio di qualsiasi esperimento.
3. Iniezione stereotassica del costrutto virale
NOTA: Eseguire l'intervento chirurgico sotto una cappa di sicurezza (precauzione per lavorare con lentivirus) e condizioni asettiche.
- Preparazione
- Assicurarsi che tutti i materiali necessari siano disponibili e funzionanti (Tabella dei materiali).
- Impostare il telaio stereotassico con il supporto della siringa fissato al braccio stereotassico. Collegare il supporto della siringa alla pompa a siringa.
- Installa il trapano dentale e monta una fresa da 0,9 mm.
- Appoggiare il termoforo e impostarlo a 37 °C. Sollevare il termoforo a un'altezza appropriata per facilitare il posizionamento del topo.
- Coprire il termoforo con un telo assorbente.
- Preparare gli strumenti chirurgici autoclavati su una superficie sterile.
- Montare una siringa per iniezione stereotassica da 10 μL con un ago per iniezione da 33 G sul supporto della siringa.
- Prelevare 2,3 μl di sospensione virale per iniezioni bilaterali da 1 μl ciascuna. Conferma visivamente l'avvenuto prelievo. Assicurati di eseguire questo passaggio come ultimo passaggio preparatorio per ridurre al minimo il tempo necessario affinché il lentivirus sia a temperatura ambiente.
- Analgesia e induzione dell'anestesia
- La mattina dell'intervento, somministrare meloxicam (1 mg/kg di peso corporeo, p.o.).
- Venti minuti prima dell'inizio delle procedure chirurgiche per l'analgesia, iniettare nel ratto buprenorfina (0,5 mg/kg di peso corporeo, s.c.).
- Accendere l'anestesista con un flusso di ossigeno di 0,8-1 L/min.
- Inondare la camera di induzione con il 4% di isoflurano e posizionare il ratto nella camera di induzione.
- Dopo aver eseguito con successo l'induzione dell'anestesia, visibile da una respirazione rallentata e dalla perdita di coscienza, rimuovere il ratto dalla camera di induzione e spostarlo nel telaio stereotassico.
- Posizionamento del ratto
- Assicurarsi che il flusso dell'anestesia sia commutato sulla maschera nasale.
- Trasferire il ratto dalla camera di induzione al telaio stereotassico, posizionando i denti anteriori nel supporto.
- Posizionare correttamente la maschera per anestesia sul naso e ruotare l'isoflurano all'1,5-2,3% per il mantenimento.
- Proteggi gli occhi con una crema contorno occhi sterile.
- Almeno 10 minuti prima di eseguire qualsiasi incisione, iniettare localmente nel ratto lidocaina (10 mg/kg di peso corporeo, s.c.) direttamente sotto il sito di incisione previsto.
- Fissare il ratto nel telaio stereotassico utilizzando le barre auricolari. Assicurarsi che le barre auricolari siano uniformi e in una posizione livellata della testa.
- Taglia il pelo intorno al sito di incisione usando le forbici. Rimuovere i pezzi di pelo utilizzando un tampone di cellulosa inumidito con un antisettico per la pelle.
- Disinfettare il campo chirurgico utilizzando un antisettico cutaneo.
- Craniotomia e iniezione di costrutto virale
- Garantire un'anestesia adeguata verificando l'assenza di riflesso delle dita dei piedi.
- Disinfettare le mani e passare a guanti sterili prima di toccare qualsiasi attrezzatura.
- Praticare una piccola incisione mediale (~1,5 cm) utilizzando la lama di un bisturi.
- Accesso sicuro al campo chirurgico spingendo la pelle ai lati con morsetti per bulldog.
- Pulire il campo chirurgico dal sangue e dai tessuti rimanenti utilizzando sostituzioni sterili. Garantire una corretta visione del bregma e uno spazio anteriore sufficiente.
- Impostare le coordinate A/P e M/L su zero in base alla bregma.
- Spostare il braccio stereotassico sulle coordinate A/P + 2,7 e M/L ± 0,4 e visualizzare utilizzando una matita disinfettata.
- Praticare un foro di ~1 mm di diametro, coprendo i lati di iniezione per entrambi gli emisferi.
- Rimuovere il sangue utilizzando uno swap sterile.
- Impostare le coordinate D/V su zero sulla superficie del cervello e abbassare lentamente l'ago per iniezione a -2,8 per iniettare nell'area prelimbica della mPFC.
- Attendere 5 minuti per consentire il rilassamento del tessuto.
- Iniettare 1 μL di sospensione virale con una velocità di 0,1 μL/min.
- Attendere 5 minuti per l'assorbimento prima di rimuovere lentamente l'ago.
- Ripetere l'iniezione nell'altro emisfero.
- Chiusura e cure post-operatorie
- Rimuovere l'ago e chiudere l'apertura nel cranio usando cera per ossa.
- Rimuovere le pinze del bulldog e suturare la pelle (sutura chirurgica 3-0).
- Iniettare nel ratto meloxicam (1 mg/kg, s.c.) per l'analgesia postoperatoria.
- Spegnere l'anestesia, rimuovere l'animale dal telaio stereotassico e metterlo nella sua gabbia domestica. Assicurati che il topo si svegli completamente.
- Sciacquare la siringa con etanolo al 100% per disattivare il lentivirus rimanente, seguito da H2O distillato in preparazione per l'iniezione successiva.
- Eseguire l'analgesia postoperatoria con meloxicam (1 mg/kg, p.o.) ogni 24 ore per 3 giorni e valutare lo stato di salute degli animali per 1 settimana.
- Animali da casa singola per le prime 24 ore dopo l'intervento chirurgico per evitare che altri manomettano le suture. Rimettili con i loro compagni di gabbia in seguito.
4. Trattamento con doxiciclina per l'induzione del modello
NOTA: Avviare l'induzione del modello non appena 24 ore dopo l'iniezione. Si possono anche attendere periodi di tempo più lunghi tra l'iniezione e l'induzione, fino a diversi mesi, ad esempio per testare coorti più grandi di animali contemporaneamente. È stato dimostrato che questo non influenza la funzionalità del costrutto virale.
- Induzione di un episodio simile alla mania
- Per indurre un fenotipo mania-simile, somministrare agli animali 0,5 g/L di doxiciclina iclato aggiungendolo all'acqua potabile. Ciò induce la trascrizione virale e la sovraespressione di DRD1 aggiuntiva.
- Preparare l'acqua contenente doxiciclina fresca ogni 48-72 ore, un periodo di tempo in cui la stabilità della doxiciclina non è influenzata, anche in bottiglie d'acqua non opache41.
NOTA: Dopo il trattamento con doxiciclina per sette giorni, la sovraespressione mediata dal virus avrà raggiunto il suo massimo e si potrà eseguire un'indagine comportamentale durante l'episodio maniaca-simile.
- Induzione di un episodio depressivo-simile
- Riportare gli animali all'acqua potabile normale, per indurre un episodio depressivo.
- Attendere 4 giorni fino all'interruzione della trascrizione virale, quindi eseguire una valutazione comportamentale dell'episodio depressivo-simile.
- Esegui le induzioni degli episodi successivi seguendo lo stesso schema.
5. Valutazione comportamentale
NOTA: Dopo l'induzione del modello, è possibile valutare il comportamento bipolare. Sono stati proposti diversi quadri di traduzione dai sintomi clinici ai modelli comportamentali osservabili nei roditori. Uno dei più influenti è il criterio42 del dominio di ricerca, in cui vengono esaminati i cambiamenti nei domini del funzionamento e del comportamento, possibilmente influenzati nei disturbi psichiatrici. È, tuttavia, importante notare che a causa della barriera di specie, alcuni sintomi, ad esempio la suicidalità, non possono essere studiati nei roditori43. A causa delle loro avanzate capacità cognitive ed emotive, i modelli di ratto hanno un potenziale particolarmente forte per la valutazione traslazionaledei sintomi 44, consentendo procedure di test più elaborate. Le considerazioni per la valutazione comportamentale sono descritte nella Tabella 1.
- Pianificare l'indagine comportamentale come una batteria di test comportamentali45, per fornire un quadro completo del fenotipo risultante.
- Prestare attenzione all'esecuzione di test più invasivi per ultimi.
- Considerare i cambiamenti nel comportamento potenzialmente derivanti da precedenti esperienze di test quando si cerca di testare un animale in entrambi gli episodi di malattia.
NOTA: A seconda della domanda in questione, può essere utile testare diversi gruppi di ratti durante l'episodio maniacale o depressivo, il che consentirebbe anche la raccolta di tessuti durante il rispettivo episodio. L'esperienza ha dimostrato che testare animali naïve al comportamento può portare a un fenotipo più prominente in alcuni test comportamentali. - Inoltre, prendi in considerazione altri fattori come le condizioni abitative46 o il sesso dello sperimentatore47.
- Adottare tutte le misure possibili per ridurre lo stress non intenzionale per gli animali, non solo per il benessere degli animali, ma anche per escludere possibili interazioni di fenotipi psichiatrici con lo stress48.
- Presta particolare attenzione al ritmo circadiano, poiché le interruzioni del ritmo circadiano sono un sintomo di BD17. Poiché i ratti sono più attivi durante il tramonto e l'alba, si dovrebbe eseguire il test sotto una luce rossa fioca con animali alloggiati in un ciclo inverso luce-buio49.
NOTA: La maggior parte dei risultati rappresentativi qui presentati sono stati raccolti seguendo questo approccio. Un fenotipo simile alla malattia è, tuttavia, ancora osservabile se la valutazione comportamentale viene eseguita senza cambiare il ciclo giorno-notte degli animali27. - Registrare sempre in anticipo l'esperimento e condurlo e descriverlo seguendo le linee guida PREPARE50 e ARRIVE51 .
Risultati
Quando la doxiciclina viene aggiunta all'acqua potabile degli animali, verrà espressa un'ulteriore DRD1 e, dopo 7 giorni, ci sarà una sovraespressione sufficiente per testare l'animale per un comportamento simile alla mania. Finora è stato dimostrato un aumento dei comportamenti legati alla ricompensa. Gli animali simili alla mania bevono più soluzione di saccarosio rispetto all'acqua in un test di scelta di due bottiglie rispetto ai controlli25. Quando vengono messi in una scatola di osservazione con una femmina ricettiva e osservati per 25 minuti, gli animali mania-like mostrano più montature sessuali rispetto ai controlli27 (Figura 1A). In un paradigma di autosomministrazione di cocaina, somministrano più cocaina in un programma a rapporto fisso e mostrano un punto di rottura più alto in un programma a rapporto progressivo. La loro curva dose-risposta è spostata verso una maggiore sensibilità a basse dosi25. Questo cambiamento di sensibilità si osserva anche nell'aumento della salienza motivazionale in diversi paradigmi di condizionamento del luogo. Gli animali maniaci hanno trascorso più tempo nei lati condizionati per nicotina, alcol e cocaina rispetto ai controlli25. Sono stati riscontrati anche un aumento della ricerca di novità e scelte più impulsive in un test basato su labirinto a T sullo sconto ritardato25. In una versione operante del ratto dell'Iowa Gambling Task, gli animali maniaci decidono più spesso per le scelte svantaggiose (alto rischio, alto guadagno) rispetto ai controlli24 (Figura 1B). L'ansia negli animali maniaci è ridotta, come indicato da più tempo trascorso sulle braccia aperte nel labirinto plus25 sopraelevato.
Un fenotipo depressivo può essere indotto terminando la sovraespressione di DRD1. Nell'episodio depressivo, si potrebbe osservare un aumento dell'impotenza. In un paradigma triadico di impotenza, il gruppo che si è presentato per la prima volta con una scossa elettrica (Figura 1C), così come il gruppo che aveva imparato a controllare la scossa, erano più indifesi con latenze di fuga aumentate rispetto ai rispettivi controlli27. I gruppi in cui è stata indotta l'impotenza, non hanno mostrato alcuna differenza tra l'animale sperimentale e quello di controllo. L'anedonia è stata riscontrata nel test di scelta di due flaconi per il saccarosio27 e nel comportamento sessuale (dati non pubblicati). Nel test di seppellimento delle biglie, gli animali simili alla depressione erano anche più ansiosi26 (Figura 1D).
Il modello animale descritto non solo offre la possibilità di studiare il comportamento maniacale o depressivo, ma fornisce anche un'opportunità unica di osservare un cambiamento nel comportamento quando si termina la sovraespressione di DRD1, simile al passaggio dalla mania alla depressione nei pazienti. In questo caso, è importante tenere a mente l'abitudine a determinati comportamenti e scegliere test con un'assuefazione minima. Ad esempio, è stato dimostrato un aumento del comportamento sessuale nell'episodio maniacale e nell'episodio depressivo, una riduzione di tale comportamento a livelli simili a quelli osservati negli animali di controllo. In questo esperimento, sono stati indotti tre cicli maniaco-depressivi all'interno dello stesso animale27. Per il consumo di saccarosio, la preferenza per la soluzione di saccarosio nello stato maniacale non solo è stata ridotta ai livelli di controllo quando si è passati allo stato depressivo, ma è diminuita27. Nella versione ratto del compito di gioco d'azzardo dell'Iowa, il numero di scelte svantaggiose era aumentato negli animali mania-like, ma non significativamente diverso dai controlli quando gli animali erano in stato depressivo-like. In quest'ultimo stato, il numero complessivo di pellet guadagnati è stato ridotto rispetto agli animali di controllo24.
Nel complesso, gli animali mostrano un robusto fenotipo bipolare, osservabile in diversi domini comportamentali durante entrambi gli episodi. Il passaggio da un episodio all'altro in questo modello contribuisce a migliorare la validità del volto. Una panoramica dei domini comportamentali interessati è fornita nella Figura 2.
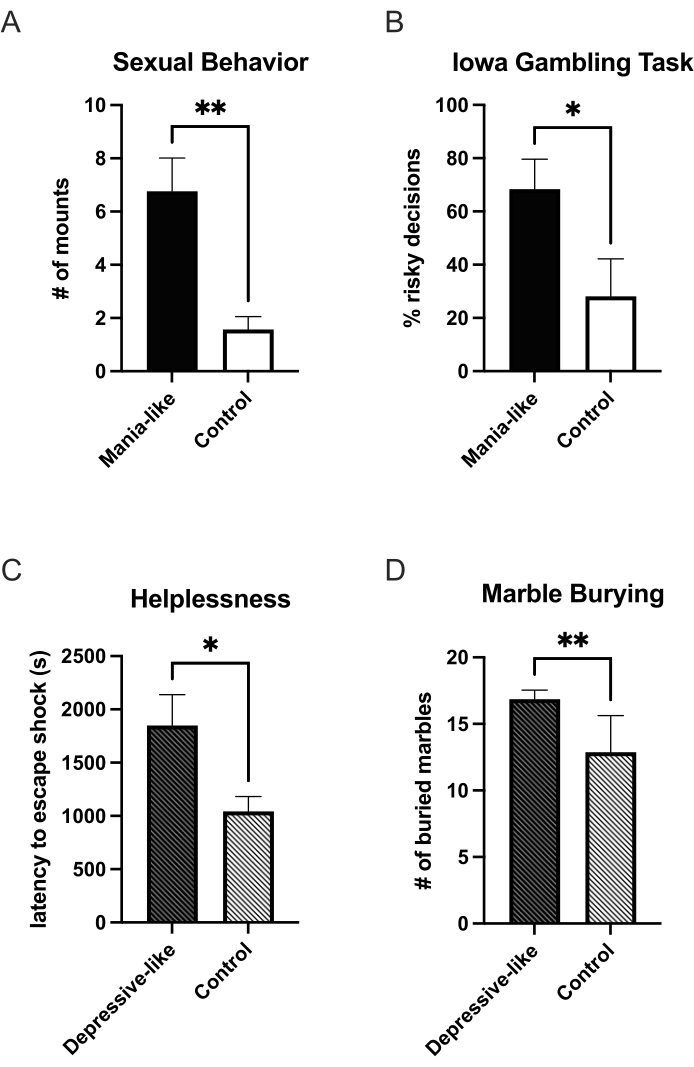
Figura 1: Cambiamenti comportamentali in stati maniaci e depressivi a seguito di sovraespressione virale di DRD1. Durante la sovraespressione virale di DRD1, nello stato mania-like, gli animali mostrano più aumenti sessuali (A) e un aumento delle scelte rischiose nell'Iowa Gambling Task (B) rispetto ai controlli. Dopo la fine della sovraespressione, gli animali passano a uno stato depressivo. Mostrano un aumento dell'impotenza (C) e dell'ansia (D). *p < 0,05; **p < 0,01; Le barre di errore indicano l'errore standard della media. Clicca qui per visualizzare una versione più grande di questa figura.
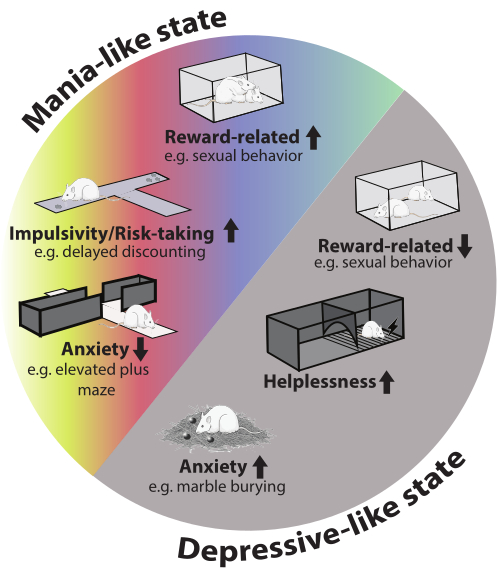
Figura 2: Fenotipo comportamentale del modello. Nell'episodio maniaca-simile, c'è un aumento dei comportamenti legati alla ricompensa (ad esempio, il comportamento sessuale), l'impulsività e l'assunzione di rischi. L'ansia è stata ridotta nel test del labirinto elevato plus. Durante l'episodio depressivo, l'ansia è aumentata nel test di sepoltura del marmo, il comportamento sessuale è stato ridotto e gli animali hanno mostrato più impotenza. L'immagine del ratto nella figura è stata presa da Servier Medical Art ed è sotto licenza CC BY 4.0. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Considerazioni per la valutazione comportamentale. La tabella evidenzia importanti considerazioni per le principali fasi sperimentali durante la valutazione comportamentale. Clicca qui per scaricare questa tabella.
Discussione
Qui viene presentato un nuovo modello di ratto per BD con una maggiore validità facciale. Una manipolazione mirata di DRD1 nella mPFC consente l'induzione di un fenotipo maniale e depressivo nello stesso animale. Risultati rappresentativi evidenziano un fenotipo simile alla malattia osservabile in entrambi gli episodi. Il modello è relativamente facile da applicare. Sono necessari due vettori lentivirali inducibili che esprimano DRD1 o dsRed come controllo. Per la produzione e l'uso di sistemi lentivirali negli animali, sono necessari determinati livelli di sicurezza, che devono essere in atto. Se non sono disponibili le attrezzature necessarie per la produzione di virus, l'esperienza di lavoro con le strutture principali è stata positiva.
Il passaggio più cruciale per la generazione del modello è l'iniezione stereotassica del sistema lentivirale. Gli interventi chirurgici stereotassici sono procedure ben consolidate nelle neuroscienze e le percentuali di successo tra i ricercatori qualificati sono elevate. Ci sono due principali possibili fonti di errore. I problemi con l'anestesia possono portare a decessi durante la procedura chirurgica. In questo caso, l'uso dell'anestesia per inalazione di isoflurano, come descritto nel protocollo, si è dimostrato l'approccio migliore, poiché i livelli di farmaco facilmente regolabili costituiscono un chiaro vantaggio rispetto all'anestesia per iniezione. Poiché l'isoflurano non fornisce alcun effetto analgesico e i nocicettori meningei sono sensibili alla stimolazione52, si raccomanda di utilizzare un oppioide per l'analgesia intraoperatoria. In combinazione con appropriati farmaci postoperatori, come descritto nel protocollo, non ci sono segni osservabili di dolore postoperatorio. Tuttavia, le possibili influenze sulle domande di ricerca, ad esempio per quanto riguarda le interazioni della dopamina con il sistema oppioide, dovrebbero sempre essere prese in considerazione e di conseguenza dovrebbe essere scelto un regime terapeutico appropriato53. Se l'intervento chirurgico viene eseguito in condizioni asettiche, l'insorgenza di infezioni o la compromissione della guarigione delle ferite è rara. Se si verificano problemi durante l'intervento chirurgico o il recupero, la risoluzione dei problemi deve concentrarsi sulla corretta esecuzione del protocollo descritto. Garantire condizioni di lavoro asettiche e un dosaggio preciso dei farmaci è essenziale. La somministrazione di liquidi o soluzioni di glucosio può inoltre favorire il recupero. Se si verificano infezioni, il trattamento non deve includere tetracicline in quanto queste interagiranno con la trascrizione dei sistemi virali. Il trattamento di prima linea per le infezioni postoperatorie della ferita sarebbe l'enrofloxacina, possibilmente combinata con il carprofene.
Un'altra possibile fonte di errore durante l'intervento chirurgico è il posizionamento dell'iniezione al di fuori dell'area target. Questo, tuttavia, si verifica raramente quando il protocollo viene seguito correttamente e viene garantito il corretto posizionamento della testa dell'animale. Il successo del posizionamento dovrebbe sempre essere verificato. Mentre il posizionamento del virus che esprime dsRed è facilmente rilevabile negli animali di controllo, la verifica del posizionamento dei virus che esprimono DRD1 richiede ulteriori passaggi. L'esecuzione della colorazione degli anticorpi contro diverse parti del costrutto virale non ha prodotto risultati soddisfacenti. Si raccomanda di verificare il posizionamento del virus sezionando l'mPFC ed eseguendo una PCR per rilevare i trascritti di rtTA3 come descritto in Beyer et al.24. È anche importante notare che l'iniezione del virus dovrebbe essere bilaterale con quantità uguali di virus. È stato dimostrato che la lateralizzazione cerebrale e comportamentale differisce nei pazienti con disturbo bipolare54,55 e le iniezioni virali unilaterali potrebbero non indurre il fenotipo comportamentale desiderato.
L'induzione dell'espressione virale di DRD1 e l'episodio maniacale con l'aggiunta di doxiciclina all'acqua potabile funziona molto bene. È stato dimostrato che la sostituzione dell'acqua potabile normale con la doxiciclina non provoca cambiamenti marcati nel comportamento di consumo. Tuttavia, il consumo di liquidi deve essere monitorato. Le modulazioni sono possibili se altre sostanze, ad esempio i farmaci, devono essere somministrate attraverso l'acqua potabile. La somministrazione di doxiciclina può essere effettuata anche tramite pellet alimentari. Ma questo non è stato ancora convalidato.
Per l'indagine comportamentale, nella Tabella 1 sono elencate diverse considerazioni. In particolare, quando si pianifica un esperimento, è necessario valutare i requisiti specifici del modello. Ad esempio, si dovrebbe decidere se due gruppi di animali saranno testati o se un animale sarà sottoposto a valutazione comportamentale durante entrambi gli episodi, il che potrebbe richiedere un nuovo test. Se il fenotipo bipolare non è rilevabile durante l'indagine comportamentale, sebbene il posizionamento possa essere verificato, la risoluzione dei problemi può concentrarsi su vari fattori che possono influenzare l'esito comportamentale. I cambiamenti negli sperimentatori o nel ritmo circadiano dovrebbero essere valutati criticamente durante il processo, poiché le condizioni di stress nell'ambiente possono influenzare i risultati comportamentali.
Sebbene il modello dimostri un buon costrutto e una validità apparente, la validità predittiva deve ancora essere valutata. La somministrazione cronica di litio, come trattamento di prima linea di BD56, dovrebbe essere efficace nel prevenire i cambiamenti comportamentali indotti dal modello. Le risposte ad altri farmaci utilizzati nella BD, come i farmaci antipsicotici o anticonvulsivi, potrebbero essere studiate per testare completamente la validità predittiva del modello.
Inoltre, una limitazione attuale è che la validità del modello nelle femmine deve ancora essere valutata in studi futuri. Sebbene vi sia una tendenza a includere le femmine nella ricerca preclinica, questa tendenza è spesso ancora trascurata. Per il modello presentato, ci si deve aspettare interazioni del sistema della dopamina con il ciclo estrale. Tuttavia, non è chiaro fino a che punto si verificheranno. È anche importante tenere a mente i limiti generali dei modelli animali psichiatrici. Mentre la possibilità di indurre entrambi gli episodi di malattia in un ratto fornisce una maggiore validità facciale, i cambiamenti indotti esternamente differiscono ancora dall'insorgenza spontanea e dal ciclo degli episodi di malattia nei pazienti con BD. Poiché il modello si basa esclusivamente sulla manipolazione mirata del sistema della dopamina, gli effetti principali saranno causati da alterazioni nella trasmissione della dopamina e dagli effetti secondari correlati. I contributi di altri sistemi alla sintomatologia della BD non sono quindi presi in considerazione.
In conclusione, il modello presentato ha un forte potenziale per lo studio della BD, poiché entrambi gli episodi di malattia possono essere studiati in un singolo animale. Ciò presenta possibilità uniche per l'indagine delle transizioni tra gli episodi rispetto ai modelli più consolidati. Il protocollo presentato richiede attrezzature e competenze tecniche che sono disponibili nella maggior parte dei laboratori di ricerca preclinica, rendendolo ampiamente applicabile. Finora, il fenotipo comportamentale risultante è stato robusto in diversi comportamenti. Altri domini come il comportamento sociale57 o le funzioni cognitive devono ancora essere esplorati. Sebbene il protocollo presentato si concentri sui risultati comportamentali, ci sono varie possibilità per applicazioni future per indagare ulteriormente i meccanismi molecolari. L'espansione delle indagini per comprendere i meccanismi alla base della patogenesi della BD, in particolare per quanto riguarda la transizione tra gli episodi, può portare all'identificazione di bersagli terapeutici che potrebbero eventualmente essere tradotti in future applicazioni cliniche.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni della Fondazione tedesca per la ricerca (Deutsche Forschungsgemeinschaft, DFG): progetto numero 552842155 e GRK2862/1, progetto n.: 492434978. JA ha ricevuto finanziamenti dal Fondo di ricerca FoRUM della Facoltà di Medicina della Ruhr-Universität Bochum (sovvenzione n. P109-24). L'immagine del ratto nella Figura 2 è stata presa da Servier Medical Art ed è sotto licenza CC BY 4.0.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9 mm burr | FST | 19007-09 | Burr for craniotomy |
| 10 µl Neuros Syringe | Hamilton | 65460-06 | Mounted to syringe pump for injection |
| 1ml single use Syringes | Braum | 9166017V | Administration of medication |
| 33 G Needles | Hamilton | 65461-02 | Replacement needles for neuros syringe |
| 4-way valve | UNO | 180000259 | For simultaneous connection of induction chamber and face mask |
| Absorbent Drape | Sabanindas | 1834014 | Covering equipment before placing the animal |
| Anaesthetic Gas Filter | UNO | 180000140 | Anesthesia fume collection |
| Anasthesia mask for stereotactic | Hugo Sachs Electronic | 73-4922 | Administering anesthesia during surgery |
| Anesthesia vaporiser | UNO | 180000002 | Provide and adjust levels of vaporised isoflurane |
| Bone wax | SMI | Z046 | Closing the hole in the skull |
| Bulldog clamps | FST | 18038-45 | To retain skin and allow access to the surgical field |
| Buprenorphine | Elanco | 18760711 | Interoperative analgesia |
| Cannula | Tegler | T138339 | Administration of medication |
| Cellulose swabs | Meditrade | 1177 | Cleaning Skin |
| Connector | UNO | 180000005 | Connecting anesthesia tubing to face mask |
| Control Unit for heating pad | UNO | 180000122 | Controlling heating pad |
| Dental Dril | Saeyang | SMT K-38 | Dental drill for craniotomy; equipable with fine dental burrs |
| Desktop digital stereotaxic instrument | RWD | E03135-002 | Fully equipped stereotactic frame with digital manipulator |
| Destilled H2O | - | - | Rinsing the syringe |
| Doxycycline hyclate | Sigma aldrich | D9891 | For model induction |
| Dry ice | - | - | Transporting viral suspension |
| Earbars | RWD | 68302 | Head fixation in the stereotactic frame |
| Ethanol | - | - | Rinsing the syringe and deactivating virus |
| Flowmeter | UNO | CM2 | Verify and adjust flow rate |
| Forceps - anatomical | FST | 11000-12 | Holding skin |
| Forceps - surgical | FST | 11027-12 | Holding skin |
| Heating pad | UNO | 180000028 | Heating pad for keeping the animal warm during surgery |
| Induction chamber | UNO | 180000233 | Chamber for initial induction of anesthesia |
| Isoflurane | CP Pharma | V7005232.00.00 | Anesthesia |
| Lentiviral suspension | - | - | Lentiviral construct coding for DRD1 or dsRed for model induction |
| Lidocaine | Combustin | 8780701 | Local analgesia |
| Meloxicam | Boehringer Ingelheim | 7578423 | Pre- and postoperative analgesia |
| Needle holder | FST | 91201-13 | Sutering |
| Oxygen concentrator | UNO | 180000399 | Providing oxygen for anesthesia |
| PE Tubing | - | - | Connecting components of the anesthesia machine to induction chamber & face mask |
| Pencil | - | - | Marking the correct side for craniotomy |
| Scalpel blade holder | FST | 10003-12 | To hold scalpel blade |
| Scapel blades | FST | 10011-00 | Fine surgical blade for incision |
| Scavenger Unit | UNO | 180000260 | Controlling capacity of fume collector |
| Skin disinfectant | Bode | 975042 | Disinfacting skin before incision |
| Sterile cotton swabs | Boettger | 1102241 | Cleaning surgical field |
| Sterile eye cream | Bayer | 1578675 | Protect eyes during surgery |
| Surgical Scissors | FST | 14000-12 | Trimming fur and cutting suture material |
| Suture 3-0 polyglycolic acid | SMI | 11201519 | Suturing skin |
| Syringe pump | KdScientific | 788130 | Syring pump with connectable holder |
Riferimenti
- Müller-Oerlinghausen, B., Berghöfer, A., Bauer, M. Bipolar disorder. Lancet. 359 (9302), 241-247 (2002).
- Grande, I., Berk, M., Birmaher, B., Vieta, E. Bipolar disorder. Lancet. 387 (10027), 1561-1572 (2016).
- Vieta, E., et al. Bipolar Disorders. Nat Rev Dis Primers. 4 (1), 1-16 (2018).
- Lee, J. G., et al. Neuromolecular etiology of bipolar disorder: Possible therapeutic targets of mood stabilizers. Clin Psychopharmacol Neurosci. 20 (2), 228-239 (2022).
- Mohamadian, M., et al. Mood and behavior regulation: Interaction of lithium and dopaminergic system. Naunyn Schmiedebergs Arch Pharmacol. 396 (7), 1339-1359 (2023).
- Berk, M., et al. Dopamine dysregulation syndrome: implications for a dopamine hypothesis of bipolar disorder. Acta Psychiatr Scand. 116 (s434), 41-49 (2007).
- Ashok, A. H., et al. The dopamine hypothesis of bipolar affective disorder: the state of the art and implications for treatment. Mol Psychiatry. 22 (5), 666-679 (2017).
- Zhang, C. -. Y., et al. Genetic evidence for the "dopamine hypothesis of bipolar disorder.". Mol Psychiatry. 28 (2), 532-535 (2023).
- Willner, P. The validity of animal models of depression. Psychopharmacology. 83 (1), 1-16 (1984).
- Beyer, D. K. E., Freund, N. Animal models for bipolar disorder: From bedside to the cage. Int J Bipolar Disord. 5 (1), 35 (2017).
- Valvassori, S. S., Gava, F. F., Cararo, J. H., Quevedo, J. Chapter 9 - The evolution of animal models for bipolar disorder. Neurobiol Bipol Dis. , 109-115 (2021).
- McClung, C. A., et al. Regulation of dopaminergic transmission and cocaine reward by the Clock gene. Proc Natl Acad Sci U S A. 102 (26), 9377-9381 (2005).
- Roybal, K., et al. Mania-like behavior induced by disruption of CLOCK. Proc Natl Acad Sci U S A. 104 (15), 6406-6411 (2007).
- Pathak, G., Ibrahim, B. A., McCarthy, S. A., Baker, K., Kelly, M. P. Amphetamine sensitization in mice is sufficient to produce both manic- and depressive-related behaviors as well as changes in the functional connectivity of corticolimbic structures. Neuropharmacol. 95, 434-447 (2015).
- Krug, J. T., et al. Effects of chronic lithium exposure in a modified rodent ketamine-induced hyperactivity model of mania. Pharmacol Biochem Behav. 179, 150-155 (2019).
- Shaldubina, A., Einat, H., Szechtman, H., Shimon, H., Belmaker, R. H. Preliminary evaluation of oral anticonvulsant treatment in the quinpirole model of bipolar disorder. J Neural Transm. 109 (3), 433-440 (2002).
- Freund, N., Haussleiter, I. Bipolar chronobiology in men and mice: A Narrative review. Brain Sci. 13 (5), 738 (2023).
- Wendler, E., et al. Mania-like elevated mood in rats: Enhanced 50-kHz ultrasonic vocalizations after sleep deprivation. Prog Neuropsychopharmacol Biol Psychiatry. 88, 142-150 (2019).
- Krishnan, V., Nestler, E. J. Animal models of depression: molecular perspectives. Curr Top Behav Neurosci. 7, 121-147 (2011).
- Schmerder, K., Freund, N. Animal models for mania. Psychiatr Vulnerab Mood Anxiety Disord. 190, 233-277 (2023).
- Zufferey, R., et al. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72 (12), 9873-9880 (1998).
- Gardner, B., Liu, Z. F., Jiang, D., Sibley, D. R. The role of phosphorylation/dephosphorylation in agonist-induced desensitization of D1 dopamine receptor function: Evidence for a novel pathway for receptor dephosphorylation. Mol Pharmacol. 59 (2), 310-321 (2001).
- Das, A. T., et al. Viral evolution as a tool to improve the tetracycline-regulated gene expression system. J Biol Chem. 279 (18), 18776-18782 (2004).
- Beyer, D. K. E., Horn, L., Klinker, N., Freund, N. Risky decision-making following prefrontal D1 receptor manipulation. Transl Neurosci. 12 (1), 432-443 (2021).
- Sonntag, K. C., et al. Viral over-expression of D1 dopamine receptors in the prefrontal cortex increase high-risk behaviors in adults: Comparison with adolescents. Psychopharmacology. 231 (8), 1615-1626 (2014).
- Beyer, D. K. E., Mattukat, A., Freund, N. Prefrontal dopamine D1 receptor manipulation influences anxiety behavior and induces neuroinflammation within the hippocampus. Int J Bipolar Disord. 9 (1), 9 (2021).
- Freund, N., Thompson, B. S., Sonntag, K., Meda, S., Andersen, S. L. When the party is over: Depressive-like states in rats following termination of cortical D1 receptor overexpression. Psychopharmacology. 233 (7), 1191-1201 (2016).
- Pantazopoulos, H., Stone, D., Walsh, J., Benes, F. M. Differences in the cellular distribution of D1 receptor mRNA in the hippocampus of bipolars and schizophrenics. Synapse. 54 (3), 147-155 (2004).
- Suhara, T., et al. D1 dopamine receptor binding in mood disorders measured by positron emission tomography. Psychopharmacology. 106 (1), 14-18 (1992).
- Dmitrzak-Weglarz, M., et al. Dopamine receptor D1 Gene -48A/G polymorphism is associated with bipolar illness but not with schizophrenia in a polish population. Neuropsychobiology. 53 (1), 46-50 (2006).
- Rybakowski, J., Dmitrzak-Weglarz, M., Suwalska, A., Leszczynska-Rodziewicz, A., Hauser, J. Dopamine D1 receptor gene polymorphism is associated with prophylactic lithium response in bipolar disorder. Pharmacopsychiatry. 42 (01), 20-22 (2009).
- Severino, G., et al. A48G polymorphism in the D 1 receptor genes associated with bipolar I disorder. Am J Med Genet B Neuropsychiatr Genet. 134B (1), 37-38 (2005).
- Shinohara, R., et al. Dopamine D1 receptor subtype mediates acute stress-induced dendritic growth in excitatory neurons of the medial prefrontal cortex and contributes to suppression of stress susceptibility in mice. Mol Psychiatry. 23 (8), 1717-1730 (2018).
- Yang, Y., Zhong, Z., Wang, B., Wang, Y., Ding, W. Activation of D1R signaling in the medial prefrontal cortex rescues maternal separation-induced behavioral deficits through restoration of excitatory neurotransmission. Behav Brain Res. 441, 114287 (2023).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nat Commun. 10 (1), 223 (2019).
- Wu, M., et al. Dopamine pathways mediating affective state transitions after sleep loss. Neuron. 112 (1), 141-154 (2024).
- Stewart, S. A., et al. Lentivirus-delivered stable gene silencing by RNAi in primary cells. RNA. 9 (4), 493-501 (2003).
- Andersen, S. L., Thompson, A. T., Rutstein, M., Hostetter, J. C., Teicher, M. H. Dopamine receptor pruning in prefrontal cortex during the periadolescent period in rats. Synapse. 37 (2), 167-169 (2000).
- Brenhouse, H. C., Sonntag, K. C., Andersen, S. L. Transient D1 dopamine receptor expression on prefrontal cortex projection neurons: Relationship to enhanced motivational salience of drug cues in adolescence. J Neurosci. 28 (10), 2375-2382 (2008).
- Thompson, T. L., Moss, R. L. Modulation of mesolimbic dopaminergic activity over the rat estrous cycle. Neurosci Lett. 229 (3), 145-148 (1997).
- Redelsperger, I. M., et al. Stability of doxycycline in feed and water and minimal effective doses in tetracycline-inducible systems. J Am Assoc Lab Anim Sci. 55 (4), 467-474 (2016).
- Insel, T., et al. Research domain criteria (RDoC): Toward a new classification framework for research on mental disorders. Am J Psychiatry. 167 (7), 748-751 (2010).
- von Mücke-Heim, I. -. A., et al. Introducing a depression-like syndrome for translational neuropsychiatry: a plea for taxonomical validity and improved comparability between humans and mice. Mol Psychiatry. 28 (1), 329-340 (2023).
- Ben-Ami Bartal, I. The complex affective and cognitive capacities of rats. Science. 385 (6715), 1298-1305 (2024).
- Jaehne, E. J., Corrone, M., van den Buuse, M. Administering a behavioral test battery in rodents. Neurobiol Methods Protoc. , 87-100 (2024).
- Prager, E. M., Bergstrom, H. C., Grunberg, N. E., Johnson, L. R. The Importance of reporting housing and husbandry in rat research. Front Behav Neurosci. 5, 38 (2011).
- Sorge, R. E., et al. Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nat Methods. 11 (6), 629-632 (2014).
- Du Preez, A., et al. Do different types of stress differentially alter behavioral and neurobiological outcomes associated with depression in rodent models? A systematic review. Front Neuroendocrinol. 61, 100896 (2021).
- Burn, C. C. What is it like to be a rat? Rat sensory perception and its implications for experimental design and rat welfare. Appl Anim Behav Sci. 112 (1), 1-32 (2008).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. PREPARE: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), e1000412 (2010).
- Messlinger, K., Ellrich, J. Meningeal nociception: Electrophysiological studies related to headache and referred pain. Microsc Res Tech. 53 (2), 129-137 (2001).
- Jirkof, P. Side effects of pain and analgesia in animal experimentation. Lab Anim. 46 (4), 123-128 (2017).
- Moebus, L., Quirin, M., Ehrlenspiel, F. Cerebral asymmetry in bipolar disorders: A scoping review. Biol Psychol. 179, 108551 (2023).
- Mundorf, A., Borawski, J., Ocklenburg, S. Behavioral lateralization in bipolar disorders: A systematic review. Int J Bipolar Disord. 11 (1), 37 (2023).
- Alda, M. Lithium in the treatment of bipolar disorder: Pharmacology and pharmacogenetics. Mol Psychiatry. 20 (6), 661-670 (2015).
- Reinhardt, P. R., Theis, C. D. C., Juckel, G., Freund, N. Rodent models for mood disorders - understanding molecular changes by investigating social behavior. Biol Chem. 404 (10), 939-950 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon