Method Article
Desenvolvendo um modelo de rato para transtorno bipolar
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo apresenta um protocolo para a indução de um modelo único de transtorno bipolar em ratos que captura tanto o comportamento semelhante à mania quanto o depressivo.
Resumo
O transtorno bipolar é uma condição de saúde mental caracterizada por mudanças extremas de humor, incluindo períodos de altos e baixos emocionais (mania) e baixos (depressão). Embora a neurobiologia subjacente exata ainda não seja totalmente compreendida, os desequilíbrios nos sistemas de neurotransmissores, particularmente a dopamina, parecem desempenhar um papel central. Por esse motivo, manipulações de vias dopaminérgicas têm sido usadas para modelar mania ou depressão em roedores. No entanto, modelos que representam com precisão a troca típica entre esses dois episódios são raros, limitando a validade da face. Em um modelo único, técnicas modernas são usadas para aumentar temporariamente a expressão do receptor D1 da dopamina, que tem sido implicado na patologia do transtorno bipolar. Uma construção lentiviral induzível por tetraciclina que expressa o receptor de dopamina D1 sob o controle do promotor alfa da calmodulina quinase II é injetada estereotaxialmente no córtex pré-frontal medial de ratos adultos. A superexpressão do receptor de dopamina D1 é alcançada pela adição do análogo da tetraciclina doxiciclina à água potável dos animais, levando a um aumento nos comportamentos relacionados à recompensa, impulsivos e de risco e uma diminuição da ansiedade. Esses comportamentos se assemelham a um fenótipo semelhante à mania. Ao remover a doxiciclina da água potável, um fenótipo semelhante ao depressivo, caracterizado por aumento do desamparo e anedonia, pode ser induzido no mesmo animal. Este artigo fornece um protocolo passo a passo para a realização da cirurgia, bem como procedimentos para induzir o fenótipo semelhante ao transtorno bipolar. Além disso, são descritas considerações para avaliar as mudanças comportamentais associadas ao comportamento semelhante à mania e ao comportamento depressivo. Este modelo promissor, que demonstra boa validade de construto e face, oferece uma ferramenta valiosa para investigar mais detalhadamente os mecanismos fisiopatológicos do transtorno bipolar.
Introdução
O transtorno bipolar (TB) é um transtorno de humor grave que afeta cerca de 1% da população mundial1. É caracterizada por episódios de humor extremo, depressão e mania, juntamente com estados eutímicos. Os sintomas de episódios depressivos no TB se assemelham aos da depressão unipolar. Os pacientes mostram interesse e prazer reduzidos em atividades e sentimentos de tristeza, desesperança e inutilidade. Além disso, mudanças no apetite, comportamento de sono, bem como deficiências cognitivas podem ser observadas com frequência2. Os episódios maníacos são caracterizados por humor anormalmente elevado, diminuição da necessidade de sono, desinibição social, aumento da autoestima e sentimentos de grandiosidade, bem como aumento da assunção de riscos e irritabilidade2.
A etiologia da doença do TB parece ser uma interação complexa de fatores genéticos e de desenvolvimento3, mas os mecanismos exatos envolvidos em sua fisiopatologia ainda não são totalmente compreendidos. Acredita-se que os sintomas surjam de desequilíbrios nos sistemas de neurotransmissores4 e, particularmente, estudos com foco no sistema de dopamina têm sido influentes5. Por exemplo, Berk et al.6 postularam a hipótese da dopamina, assumindo que um estado hiperdopaminérgico está subjacente à mania, enquanto a depressão surge da hipodopaminergia. Desde então, evidências de modelos animais, bem como estudos farmacológicos e de imagem, reuniram forte apoio para uma associação entre sintomas maníacos e hiperdopaminergia. Além disso, uma conexão entre diminuição da sinalização dopaminérgica e episódios depressivos pode ser encontrada, embora em menor grau7. Além disso, os resultados das investigações genéticas fortaleceram a ideia de uma hipótese de dopamina do TB8.
Para esclarecer ainda mais o papel do sistema de dopamina no TB, modelos animais podem ser usados para investigar os mecanismos neurobiológicos subjacentes aos sintomas. As aplicações e limitações dos modelos de doenças são frequentemente avaliadas com base em três critérios de validação, originalmente propostos por Willner9. Isso inclui validade de face, construto e preditiva. A validade de face descreve a capacidade do modelo de imitar as características comportamentais do transtorno. A validade de construto é alcançada quando a fisiopatologia e a etiologia do transtorno são a base do modelo, enquanto a validade preditiva implica que o tratamento farmacológico do transtorno pode ser reproduzido dentro do modelo.
Até agora, vários modelos de roedores contribuíram para a compreensão do TB10 e incluem uma ampla gama de modificações genéticas, intervenções farmacêuticas, bem como manipulações ambientais11.
Manipulações experimentais do gene Clock , por exemplo, demonstraram induzir um fenótipo semelhante à mania em camundongos. O fator de transcrição CLOCK desempenha um papel importante na regulação dos ritmos circadianos, e camundongos geneticamente alterados, expressando uma proteína que não pode ativar a transcrição do Clock, são caracterizados por hiperatividade e aumento das respostas de recompensa12. O fenótipo resultante parece ser mediado por genes regulados diferencialmente para sinalização dopaminérgica na área tegmental ventral do cérebro13.
Influenciando diretamente a sinalização da dopamina por meio da administração de drogas que aumentam a dopamina, como o psicoestimulante anfetamina, demonstrou induzir hiperlocomoção, e a abstinência subsequente tem sido associada a sintomas depressivos, incluindo anedonia14. Desafios farmacológicos com cetamina ou o agonista do receptor D2/D3 da dopamina quinpirole também demonstraram induzir comportamento relevante para TB15,16.
Além da intervenção farmacológica, manipulações do ambiente, como a privação do sono, podem ser empregadas para induzir fenótipos comportamentais relevantes para o TB17. Animais privados de sono apresentam um fenótipo semelhante à mania caracterizado por aumento da locomoção e emissão de vocalizações ultrassônicas que estão associadas a alterações na sinalização da dopamina18.
Existem vários outros modelos de roedores para estudar o comportamento depressivo19 ou mania20 . No entanto, embora todos esses modelos tenham contribuído fortemente para a compreensão da patologia do TB, eles são limitados pelo estudo de apenas um episódio de cada vez ou efeitos de curto prazo. Em contraste, modelar a troca característica entre estados afetivos tem sido difícil de alcançar.
Aqui, um protocolo para um modelo de rato único para TB é apresentado. Ele demonstra maior validade de face induzindo ambos os episódios em um animal usando uma única manipulação direcionada do sistema de dopamina, ou seja, superexpressando condicionalmente o receptor de dopamina D1 (DRD1) no córtex pré-frontal medial (mPFC) de uma construção lentiviral induzível por tetraciclina. Ao conduzir a transcrição gênica sob o controle do promotor da calmodulina quinase II alfa (CamKIIa), o DRD1 é expresso principalmente em neurônios glutamatérgicos, aumentando assim a especificidade da manipulação genética.
O esqueleto original do lentivírus pRRL.cPPT.WPRE.Sin foi fornecido pelo Dr. Didier Trono (Ecole Polytechnique Fédérale de Lausanne, Suíça)21 e modificado substituindo o minigene GFP por um local poliligante (vetor lentivírus PL13). PL13 foi então usado para produzir PL13.pTRE2.DRD1.CamKIIa.rtTA3 ou PL13.pTRE2.dsRedExpress.CamKIIa.rtTA3. O cDNA do rato DRD1 foi obtido do Dr. David Sibley (NINDS / NIH) 22, e o cDNA do ativador 3 controlado por tetraciclina reversa (rtTA3) dos Drs. Atze Das e Ben Berkhout (Centro Médico Acadêmico, Universidade de Amsterdã) 23 . O DNA promotor CamKIIa foi fornecido pelo Dr. Karl Deisseroth (Stanford University, CA), e as sequências dsRedExpress e do elemento de resposta à tetraciclina 2 (pTRE2) foram subclonadas a partir dos plasmídeos internos pcDNA3.1-dsRedExpress e pcDNA3.1-pTRE2, respectivamente. Os vetores virais foram gerados por subclonagem de sequências de DNA amplificadas por PCR ladeadas por locais de restrição.
O modelo usando este vetor viral demonstrou que a superexpressão de DRD1 em neurônios positivos para mPFC CamKIIa leva a um fenótipo semelhante à mania24 , 25 , enquanto a subsequente regulação negativa da expressão gênica induz um comportamento semelhante ao depressivo26. Como o fenótipo semelhante à doença pode ser induzido repetidamente em um animal27, o modelo reflete um alto nível de validade de face. Além disso, as manipulações do sistema de dopamina têm forte validade de construto para modelos animais de TB7, pois alterações nos níveis de DRD128,29 ou polimorfismos DRD1 foram associadas à patologia do TB 30,31,32.
Outros estudos em animais também levaram a uma maior compreensão das funções do DRD pré-frontal1. Por exemplo, uma diminuição no DRD1 tem sido um achado consistente em modelos de depressão33,34, enquanto a estimulação optogenética do DRD1 em neurônios glutamatérgicos mPFC reduz a ansiedade e induz efeitos antidepressivos35. Em uma publicação recente de Wu et al.36, o papel do mPFC DRD1 nas transições de estado afetivo foi demonstrado. Este estudo destaca que esses receptores são cruciais para mudanças subjacentes na plasticidade das sinapses excitatórias.
Ao todo, o emprego de um modelo de TB em ratos que consiste na manipulação direcionada e condicional de DRD1 em neurônios positivos para CamKIIa do mPFC constitui um sistema modelo com alta validade de construção e face e, portanto, exibe forte potencial para pesquisa translacional sobre TB.
A seguir, são descritos procedimentos cirúrgicos para geração de modelos. Além disso, considerações metodológicas para indução de modelos e avaliações comportamentais serão apresentadas juntamente com resultados representativos do fenótipo semelhante a uma doença resultante. Possíveis obstáculos e fatores de influência na geração de modelos e avaliação comportamental são discutidos, e uma perspectiva sobre as direções futuras é dada.
Protocolo
O protocolo para injeção estereotáxica aqui descrito foi aprovado pelo LANUV (Landesamt für Natur, Umwelt und Verbraucherschutz, Renânia do Norte-Vestfália, Alemanha). Foram utilizados ratos Sprague Dawley machos adultos (350-650 g de peso corporal). Os reagentes e equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. As construções lentivirais
NOTA: Um sistema lentiviral de terceira geração é usado para a expressão condicional de DRD1 ou proteína fluorescente vermelha (dsRed) como condição de controle 25,27.
- Produza o lentivírus com base no protocolo de Stewart et al.37 com plasmídeos de empacotamento 8454 e 8455 do repositório Addgene.
NOTA: Se a produção do vírus não for planejada de forma independente, muitas instalações centrais fornecem lentivírus de alto título, como Charité Berlin, Alemanha. - Titule os vírus concentrados e armazene-os a -80 °C.
- Prepare 2 × 107 unidades de transdução (TU) por μL para injeções.
- Transportar vírus para a sala cirúrgica em gelo seco.
2. Animais
NOTA: O modelo de rato para TB foi estabelecido em ratos Sprague Dawley machos adultos (350-650 g de peso corporal). Para investigação de ratas ou pontos de tempo de desenvolvimento anteriores, é crucial considerar que a expressão de DRD1 no mPFC muda durante o desenvolvimento e pode ser influenciada pelo ciclo estral 38,39,40.
- Pares de ratos domésticos com animais da mesma condição com comida e água ad libitum sob condições constantes de temperatura e umidade (45%-65% de umidade relativa, temperatura 22 °C ± 2 °C).
- Mantenha os ratos em um ciclo claro-escuro inverso de 12 h (luzes apagadas às 11h), pois a investigação comportamental deve ser realizada durante a fase ativa dos animais no escuro.
- Dê aos animais pelo menos sete dias para se aclimatarem às instalações e ao manuseamento pelos experimentadores antes do início de quaisquer experiências.
3. Injeção estereotáxica do construto viral
NOTA: Realize a cirurgia sob uma capa de segurança (precaução para trabalhar com lentivírus) e condições assépticas.
- Preparação
- Certifique-se de que todos os materiais necessários estejam disponíveis e funcionais (Tabela de Materiais).
- Configure a armação estereotáxica com o suporte da seringa preso ao braço estereotáxico. Conecte o suporte da seringa à bomba da seringa.
- Configure a broca odontológica e monte uma broca de 0,9 mm.
- Coloque a almofada de aquecimento e ajuste-a para 37 °C. Eleve a almofada de aquecimento a uma altura apropriada para facilitar o posicionamento do rato.
- Cubra a almofada de aquecimento com uma cortina absorvente.
- Prepare instrumentos cirúrgicos autoclavados em uma superfície estéril.
- Montar uma seringa de injeção estereotáxica de 10 μL com uma agulha de injeção de 33 G no suporte da seringa.
- Retirar 2,3 μL de suspensão viral para injeções bilaterais de 1 μl cada. Confirme visualmente a retirada bem-sucedida. Certifique-se de executar esta etapa como a última etapa preparatória para minimizar o tempo que leva para o lentivírus estar em temperatura ambiente.
- Analgesia e indução anestésica
- Na manhã da cirurgia, administrar meloxicam (1 mg/kg de peso corporal, v.o.).
- Vinte minutos antes do início dos procedimentos cirúrgicos para analgesia, injetar buprenorfina no rato (0,5 mg/kg de peso corporal, s.c.).
- Ligue a máquina de anestesia com um fluxo de oxigênio de 0,8-1 L/min.
- Inundar a câmara de indução com isoflurano a 4 % e colocar o rato na câmara de indução.
- Após a indução bem-sucedida da anestesia, visível por respiração lenta e perda de consciência, remova o rato da câmara de indução e mova-o para o quadro estereotáxico.
- Posicionamento do rato
- Certifique-se de que o fluxo da anestesia seja alterado para a máscara nasal.
- Transfira o rato da câmara de indução para a estrutura estereotáxica, colocando os dentes da frente no suporte.
- Coloque corretamente a máscara de anestesia sobre o nariz e gire o isoflurano para 1,5-2,3% para manutenção.
- Proteja os olhos usando creme para os olhos estéril.
- Pelo menos 10 minutos antes de fazer qualquer incisão, injete localmente lidocaína no rato (10 mg/kg de peso corporal, s.c.) diretamente abaixo do local da incisão planejada.
- Prenda o rato na estrutura estereotáxica usando barras auriculares. Certifique-se de que as barras auriculares estejam uniformes e na posição nivelada da cabeça.
- Apare o pelo ao redor do local da incisão usando uma tesoura. Remova os pedaços de pele usando uma almofada de celulose umedecida com um anti-séptico para a pele.
- Desinfete o campo cirúrgico usando um anti-séptico de pele.
- Craniotomia e injeção de construção viral
- Garanta a anestesia adequada, verificando a ausência de reflexo do dedo do pé.
- Desinfete as mãos e mude para luvas estéreis antes de tocar em qualquer equipamento.
- Faça uma pequena incisão medial (~1,5 cm) usando uma lâmina de bisturi.
- Garanta o acesso ao campo cirúrgico empurrando a pele para os lados com grampos de buldogue.
- Limpe o campo cirúrgico do sangue e do tecido restante usando trocas estéreis. Garanta a visão adequada do bregma e espaço anterior suficiente.
- Defina as coordenadas A/P e M/L como zero com base em bregma.
- Mova o braço estereotáxico para as coordenadas A/P + 2.7 e M/L ± 0.4 e visualize usando um lápis desinfetado.
- Faça um furo de ~ 1 mm de diâmetro, cobrindo os lados da injeção para ambos os hemisférios.
- Remova qualquer sangue usando uma troca estéril.
- Defina as coordenadas D/V como zero na superfície do cérebro e abaixe lentamente a agulha de injeção para -2,8 para injetar na área pré-límbica do mPFC.
- Aguarde 5 min para permitir o relaxamento do tecido.
- Injete 1 μL de suspensão viral com uma taxa de 0,1 μL / min.
- Aguarde 5 minutos para absorção antes de remover lentamente a agulha.
- Repita a injeção no outro hemisfério.
- Fechamento e cuidados pós-operatórios
- Remova a agulha e feche a abertura no crânio usando cera óssea.
- Remova os grampos de buldogue e suture a pele (sutura cirúrgica 3-0).
- Injetar no rato meloxicam (1 mg/kg, s.c.) para analgesia pós-operatória.
- Desligue a anestesia, remova o animal da estrutura estereotáxica e coloque-o em sua gaiola de origem. Certifique-se de que o rato acorde completamente.
- Enxágue a seringa com etanol 100% para desativar o lentivírus restante, seguido de H2O destilado em preparação para a próxima injeção.
- Realize analgesia pós-operatória com meloxicam (1 mg/kg, v.o.) a cada 24 h durante 3 dias e pontue o estado de saúde dos animais durante 1 semana.
- Animais domésticos solteiros nas primeiras 24 horas após a cirurgia para evitar que outras pessoas adulterem as suturas. Coloque-os de volta com seus companheiros de gaiola depois.
4. Tratamento com doxiciclina para indução de modelos
NOTA: Inicie a indução do modelo assim que 24 h após a injeção. Pode-se também esperar períodos de tempo mais longos entre a injeção e a indução de até vários meses, por exemplo, para testar coortes maiores de animais ao mesmo tempo. Isso demonstrou não influenciar a funcionalidade da construção viral.
- Indução de um episódio de mania
- Para induzir um fenótipo semelhante à mania, dê aos animais 0,5 g / L de hiclato de doxiciclina adicionando-o à água potável. Isso induz a transcrição viral e a superexpressão de DRD1 adicional.
- Prepare a água contendo doxiciclina fresca a cada 48 h a 72 h, um período de tempo em que a estabilidade da doxiciclina não é influenciada, mesmo em garrafas de água não opacas41.
NOTA: Após o tratamento com doxiciclina por sete dias, a superexpressão mediada pelo vírus terá atingido seu máximo, e pode-se realizar uma investigação comportamental durante o episódio de mania.
- Indução de um episódio de tipo depressivo
- Mude os animais de volta à água potável normal, para induzir um episódio depressivo.
- Aguarde 4 dias até que a transcrição viral seja interrompida e, em seguida, faça uma avaliação comportamental do episódio depressivo.
- Realize induções de episódios subsequentes seguindo o mesmo padrão.
5. Avaliação comportamental
NOTA: Após a indução do modelo, pode-se avaliar o comportamento bipolar. Diferentes estruturas de tradução de sintomas clínicos para padrões comportamentais observáveis em roedores foram propostas. Um dos mais influentes é o critério de domínio de pesquisa42, onde são examinadas as mudanças nos domínios de funcionamento e comportamento, possivelmente afetados em transtornos psiquiátricos. É, no entanto, importante notar que, devido à barreira das espécies, alguns sintomas, por exemplo, suicídio, não podem ser investigados em roedores43. Devido às suas capacidades cognitivas e emocionais avançadas, os modelos de ratos têm um potencial especialmente forte para avaliação translacionalde sintomas 44, permitindo procedimentos de teste mais elaborados. As considerações para avaliação comportamental estão descritas na Tabela 1.
- Planeje a investigação comportamental como uma bateria de testes comportamentais45, para fornecer uma imagem abrangente do fenótipo resultante.
- Preste atenção em realizar testes mais invasivos por último.
- Considere mudanças no comportamento potencialmente resultantes de experiências anteriores de testes ao tentar testar um animal em ambos os episódios semelhantes a doenças.
NOTA: Dependendo da questão em questão, pode ser benéfico testar diferentes grupos de ratos durante o episódio de mania ou depressão, o que também permitiria a coleta de tecido durante o respectivo episódio. A experiência mostrou que testar animais ingênuos comportamentalmente pode resultar em um fenótipo mais proeminente em certos testes comportamentais. - Além disso, leve em consideração outros fatores, como condições de moradia46 ou sexo do experimentador47.
- Adotar todas as medidas possíveis para reduzir o estresse não intencional aos animais, não apenas para o bem-estar animal, mas também para excluir possíveis interações de fenótipos psiquiátricos com o estresse48.
- Preste atenção especial ao ritmo circadiano, pois as interrupções do ritmo circadiano são um sintoma do TB17. Como os ratos são mais ativos durante o anoitecer e o amanhecer, deve-se testar sob luz vermelha fraca com animais alojados em um ciclo inverso de luz-escuridão49.
NOTA: A maioria dos resultados representativos apresentados aqui foi coletada seguindo essa abordagem. Um fenótipo semelhante à doença, no entanto, ainda é observável se a avaliação comportamental for realizada sem mudar o ciclo dia-noite dos animais27. - Sempre pré-registre o experimento e conduza e descreva as diretrizes PREPARE50 e ARRIVE51 de seguida.
Resultados
Quando a doxiciclina é adicionada à água potável dos animais, DRD1 adicional será expresso e, após 7 dias, haverá superexpressão suficiente para testar o animal quanto a um comportamento semelhante à mania. Até agora, foi demonstrado um aumento nos comportamentos relacionados à recompensa. Animais do tipo mania bebem mais solução de sacarose em relação à água em um teste de escolha de duas garrafas quando comparados aos controles25. Quando colocados em uma caixa de observação com uma fêmea receptiva e observados por 25 min, os animais do tipo mania apresentam mais montas sexuais em comparação com os controles27 (Figura 1A). Em um paradigma de autoadministração de cocaína, eles administram mais cocaína sob um esquema de proporção fixa e mostram um ponto de interrupção mais alto em um esquema de proporção progressiva. Sua curva dose-resposta é deslocada para maior sensibilidade a baixas doses25. Essa mudança na sensibilidade também é observada no aumento da saliência motivacional em vários paradigmas de condicionamento do lugar. Animais do tipo mania passaram mais tempo nos lados condicionados para nicotina, álcool e cocaína em comparação com os controles25. Aumento da busca de novidades e escolhas mais impulsivas em um teste baseado em labirinto em T sobre desconto atrasado também foram encontrados25. Em uma versão de rato operante da Iowa Gambling Task, animais semelhantes a mania decidem com mais frequência pelas escolhas desvantajosas (alto risco, alto ganho) em comparação com os controles24 (Figura 1B). A ansiedade em animais do tipo mania é reduzida, como indicado por mais tempo gasto nos braços abertos no labirinto em cruz elevado25.
Um fenótipo semelhante ao depressivo pode ser induzido pela terminação da superexpressão de DRD1. No episódio depressivo, observou-se um aumento do desamparo. Em um paradigma triádico de desamparo, o grupo que foi apresentado pela primeira vez a um choque elétrico (Figura 1C), assim como o grupo que aprendeu a controlar o choque, mostraram-se mais desamparados com latências de escape aumentadas quando comparados aos seus respectivos controles27. Os grupos em que o desamparo foi induzido não apresentaram diferenças entre o animal experimental e o controle. A anedonia foi encontrada no teste de escolha de duas garrafas parasacarose 27 e no comportamento sexual (dados não publicados). No teste de enterramento de bolinhas de gude, os animais depressivos também estavam mais ansiosos26 (Figura 1D).
O modelo animal descrito não apenas oferece a possibilidade de investigar o comportamento semelhante à mania ou depressão, mas também oferece uma oportunidade única de observar uma mudança no comportamento ao encerrar a superexpressão de DRD1, assemelhando-se à mudança de mania para depressão em pacientes. Aqui, é importante manter a habituação a certos comportamentos em mente e escolher testes com habituação mínima. Por exemplo, o aumento do comportamento sexual no episódio de mania e no episódio de depressão foi mostrada uma redução desse comportamento a níveis semelhantes aos observados em animais de controle. Neste experimento, três ciclos semelhantes à mania / depressão foram induzidos no mesmo animal27. Para beber sacarose, a preferência pela solução de sacarose no estado mania-like não foi apenas reduzida aos níveis de controle quando mudada para o estado depressivo, mas diminuiu27. Na versão de rato da tarefa de jogo de Iowa, o número de escolhas desvantajosas foi aumentado em animais semelhantes à mania, mas não significativamente diferente dos controles quando os animais estavam no estado depressivo. Neste último estado, o número total de pellets ganhos foi reduzido em comparação com os animais de controle24.
No geral, os animais mostram um fenótipo robusto semelhante ao bipolar, observável em diferentes domínios comportamentais durante ambos os episódios. A troca entre episódios neste modelo contribui para melhorar a validade da face. Uma visão geral dos domínios comportamentais afetados é fornecida na Figura 2.
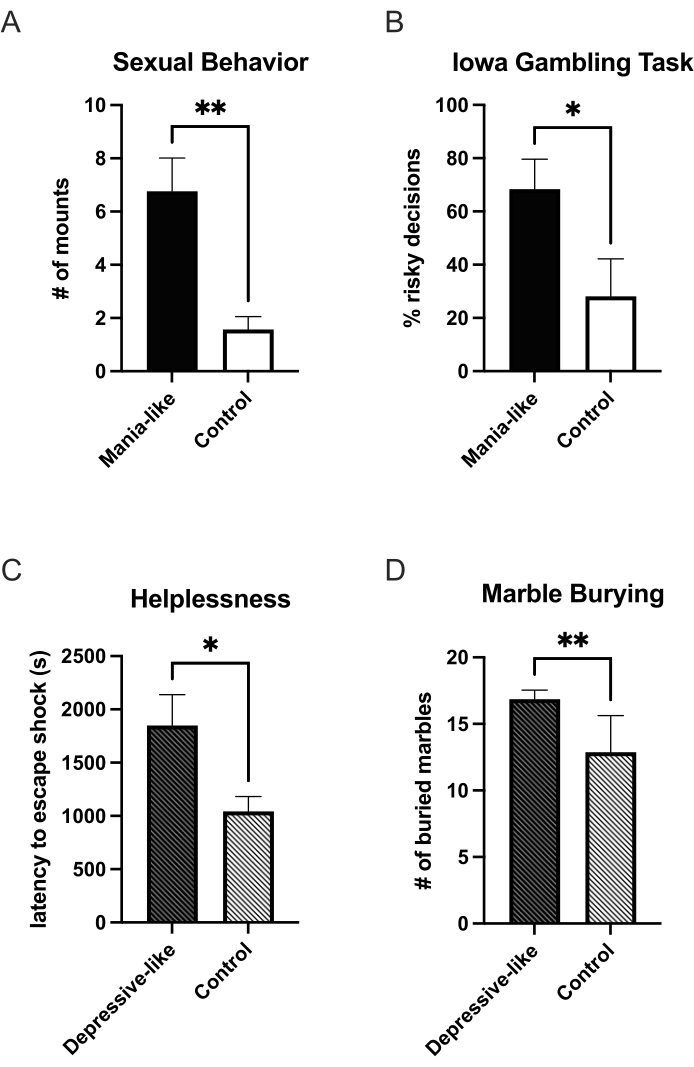
Figura 1: Mudanças comportamentais em estados semelhantes a mania e depressão após a superexpressão viral de DRD1. Durante a superexpressão viral do DRD1, no estado de mania, os animais mostram mais montarias sexuais (A) e um aumento nas escolhas arriscadas na Iowa Gambling Task (B) em comparação com os controles. Após o término da superexpressão, os animais mudam para um estado depressivo. Eles mostram um aumento no desamparo (C) e ansiedade (D). *p < 0,05; **p < 0,01; As barras de erro indicam o erro padrão da média. Clique aqui para ver uma versão maior desta figura.
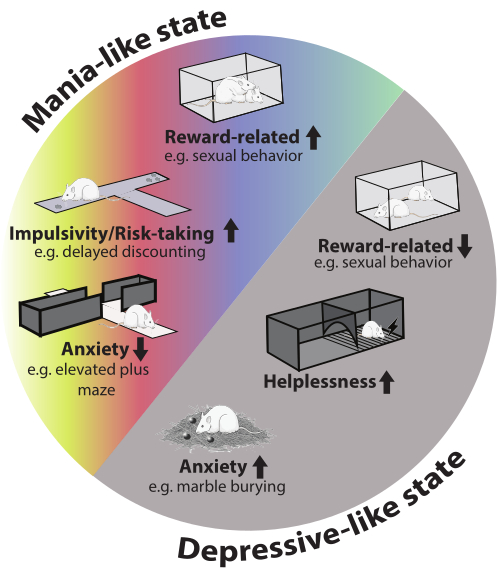
Figura 2: Fenótipo comportamental do modelo. No episódio de mania, há um aumento nos comportamentos relacionados à recompensa (por exemplo, comportamento sexual), impulsividade e tomada de risco. A ansiedade foi reduzida no teste do labirinto em cruz elevado. Durante o episódio depressivo, a ansiedade aumentou no teste de enterrar bolinhas de gude, o comportamento sexual foi reduzido e os animais mostraram mais desamparo. A imagem do rato na figura foi retirada da Servier Medical Art e está licenciada sob CC BY 4.0. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Considerações para avaliação comportamental. A tabela destaca considerações importantes para as principais etapas experimentais durante a avaliação comportamental. Clique aqui para baixar esta tabela.
Discussão
Aqui, um novo modelo de rato para TB com maior validade de face é apresentado. Uma manipulação direcionada de DRD1 no mPFC permite a indução de um fenótipo semelhante à mania e depressão no mesmo animal. Os resultados representativos destacam um fenótipo semelhante à doença observável em ambos os episódios. O modelo é relativamente fácil de aplicar. São necessários dois vetores lentivirais induzíveis que expressam DRD1 ou dsRed como controle. Para a produção e o uso de sistemas lentivirais em animais, são necessários certos níveis de segurança, que precisam estar em vigor. Se o equipamento necessário para a produção de vírus não estiver disponível, a experiência de trabalho com instalações centrais tem sido positiva.
A etapa mais crucial para gerar o modelo é a injeção estereotáxica do sistema lentiviral. As cirurgias estereotáxicas são procedimentos bem estabelecidos na neurociência, e as taxas de sucesso entre os investigadores treinados são altas. Existem duas fontes principais possíveis de erro. Problemas com a anestesia podem levar a fatalidades durante o procedimento cirúrgico. Aqui, o uso de anestesia inalatória com isoflurano, conforme descrito no protocolo, provou ser a melhor abordagem, pois os níveis de drogas facilmente ajustáveis constituem um benefício claro em comparação com a anestesia por injeção. Como o isoflurano não fornece efeitos analgésicos e os nociceptores meníngeos são sensíveis à estimulação52, recomenda-se o uso de um opioide para analgesia intraoperatória. Combinado com medicação pós-operatória apropriada, conforme descrito no protocolo, não há sinais observáveis de dor pós-operatória. No entanto, possíveis influências em questões de pesquisa, por exemplo, no que diz respeito às interações da dopamina com o sistema opioide, devem sempre ser consideradas, e um regime de medicação apropriado deve ser escolhido de acordo53. Se a cirurgia for realizada em condições assépticas, a ocorrência de infecções ou comprometimento da cicatrização da ferida é rara. Se ocorrerem problemas durante a cirurgia ou recuperação, a solução de problemas deve se concentrar na execução correta do protocolo descrito. Garantir condições de trabalho assépticas e dosagem precisa de medicamentos é essencial. A administração de soluções de fluido ou glicose também pode ajudar na recuperação. Se ocorrerem infecções, o tratamento não deve incluir tetraciclinas, pois elas interagirão com a transcrição dos sistemas virais. O tratamento de primeira linha para infecções pós-operatórias da ferida seria enrofloxacina, possivelmente combinada com carprofeno.
Outra possível fonte de erro durante a cirurgia é a colocação da injeção fora da área-alvo. Isso, no entanto, raramente ocorre quando o protocolo é seguido corretamente e o posicionamento adequado da cabeça do animal é garantido. A colocação bem-sucedida deve sempre ser verificada. Embora a colocação do vírus que expressa dsRed seja facilmente detectável em animais de controle, a verificação da colocação de vírus que expressam DRD1 requer etapas extras. A realização de coloração de anticorpos contra diferentes partes da construção viral não produziu resultados satisfatórios. Recomenda-se verificar a colocação do vírus dissecando o CPFm e realizando uma PCR para detectar transcritos de rtTA3, conforme descrito em Beyer et al.24. Também é importante notar que a injeção do vírus deve ser bilateral com quantidades iguais de vírus. A lateralização cerebral e comportamental demonstrou diferir em pacientes com transtorno bipolar54,55, e injeções virais unilaterais podem não induzir o fenótipo comportamental desejado.
A indução da expressão viral de DRD1 e o episódio de mania pela adição de doxiciclina à água potável funciona muito bem. Foi comprovado que a substituição da água potável normal por doxiciclina não causa mudanças acentuadas no comportamento de beber. No entanto, o consumo de líquidos deve ser monitorado. Modulações são possíveis, se outras substâncias, por exemplo, medicamentos, forem administradas através da água potável. A administração de doxiciclina também pode ser realizada por meio de pellets de alimentos. Mas isso ainda não foi validado.
Para investigação comportamental, várias considerações estão listadas na Tabela 1. Especialmente os requisitos específicos do modelo precisam ser avaliados ao planejar um experimento. Por exemplo, deve-se decidir se dois grupos de animais serão testados ou se um animal será submetido a avaliação comportamental durante os dois episódios, o que pode exigir um novo teste. Se o fenótipo bipolar não for detectável durante a investigação comportamental, embora a colocação possa ser verificada, a solução de problemas pode se concentrar em vários fatores que possivelmente influenciam o resultado comportamental. Mudanças nos experimentadores ou no ritmo circadiano devem ser avaliadas criticamente durante o processo, pois condições estressantes no ambiente podem influenciar os resultados comportamentais.
Embora o modelo demonstre boa validade de construto e face, a validade preditiva ainda precisa ser avaliada. A administração crônica de lítio, como tratamento de primeira linha do TB56, deve ser bem-sucedida na prevenção de mudanças de comportamento induzidas pelo modelo. As respostas a outros medicamentos usados no TB, como antipsicóticos ou anticonvulsivantes, podem ser investigadas para testar completamente a validade preditiva do modelo.
Além disso, uma limitação atual é que a validade do modelo em animais fêmeas ainda precisa ser avaliada em estudos futuros. Embora haja uma tendência de incluir animais fêmeas na pesquisa pré-clínica, isso ainda é frequentemente negligenciado. Para o modelo apresentado, as interações do sistema de dopamina com o ciclo estral são esperadas. No entanto, não está claro até que ponto eles ocorrerão. Também é importante ter em mente as limitações gerais dos modelos animais psiquiátricos. Embora a possibilidade de induzir ambos os episódios semelhantes à doença em um rato proporcione maior validade facial, as alterações induzidas externamente ainda diferem da ocorrência espontânea e do ciclo de episódios da doença em pacientes com TB. Como o modelo é baseado exclusivamente na manipulação direcionada do sistema de dopamina, os principais efeitos serão causados por alterações na transmissão de dopamina e efeitos secundários relacionados. Contribuições de outros sistemas para a sintomatologia do TB não são, portanto, contabilizadas.
Em conclusão, o modelo apresentado tem forte potencial para investigar o TB, pois ambos os episódios da doença podem ser estudados em um único animal. Isso apresenta possibilidades únicas para a investigação de transições entre episódios em comparação com a maioria dos modelos estabelecidos. O protocolo apresentado requer equipamentos e habilidades técnicas que estão disponíveis na maioria dos laboratórios de pesquisa pré-clínica, tornando-o amplamente aplicável. Até agora, o fenótipo comportamental resultante tem sido robusto em diferentes comportamentos. Outros domínios, como comportamento social57 ou funções cognitivas, ainda precisam ser explorados. Embora o protocolo apresentado tenha se concentrado em resultados comportamentais, existem várias possibilidades de aplicações futuras para investigar mais os mecanismos moleculares. A expansão das investigações para entender os mecanismos subjacentes na patogênese do TB, especialmente no que diz respeito à transição entre os episódios, pode levar à identificação de alvos terapêuticos que podem eventualmente ser traduzidos em futuras aplicações clínicas.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado por bolsas da Fundação Alemã de Pesquisa (Deutsche Forschungsgemeinschaft, DFG): número do projeto 552842155 e GRK2862/1, projeto nº: 492434978. JA recebeu financiamento do Fundo de Pesquisa FoRUM da Faculdade de Medicina da Ruhr-Universität Bochum (Grant no. P109-24). A imagem do rato na Figura 2 foi retirada da Servier Medical Art e está licenciada sob CC BY 4.0.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9 mm burr | FST | 19007-09 | Burr for craniotomy |
| 10 µl Neuros Syringe | Hamilton | 65460-06 | Mounted to syringe pump for injection |
| 1ml single use Syringes | Braum | 9166017V | Administration of medication |
| 33 G Needles | Hamilton | 65461-02 | Replacement needles for neuros syringe |
| 4-way valve | UNO | 180000259 | For simultaneous connection of induction chamber and face mask |
| Absorbent Drape | Sabanindas | 1834014 | Covering equipment before placing the animal |
| Anaesthetic Gas Filter | UNO | 180000140 | Anesthesia fume collection |
| Anasthesia mask for stereotactic | Hugo Sachs Electronic | 73-4922 | Administering anesthesia during surgery |
| Anesthesia vaporiser | UNO | 180000002 | Provide and adjust levels of vaporised isoflurane |
| Bone wax | SMI | Z046 | Closing the hole in the skull |
| Bulldog clamps | FST | 18038-45 | To retain skin and allow access to the surgical field |
| Buprenorphine | Elanco | 18760711 | Interoperative analgesia |
| Cannula | Tegler | T138339 | Administration of medication |
| Cellulose swabs | Meditrade | 1177 | Cleaning Skin |
| Connector | UNO | 180000005 | Connecting anesthesia tubing to face mask |
| Control Unit for heating pad | UNO | 180000122 | Controlling heating pad |
| Dental Dril | Saeyang | SMT K-38 | Dental drill for craniotomy; equipable with fine dental burrs |
| Desktop digital stereotaxic instrument | RWD | E03135-002 | Fully equipped stereotactic frame with digital manipulator |
| Destilled H2O | - | - | Rinsing the syringe |
| Doxycycline hyclate | Sigma aldrich | D9891 | For model induction |
| Dry ice | - | - | Transporting viral suspension |
| Earbars | RWD | 68302 | Head fixation in the stereotactic frame |
| Ethanol | - | - | Rinsing the syringe and deactivating virus |
| Flowmeter | UNO | CM2 | Verify and adjust flow rate |
| Forceps - anatomical | FST | 11000-12 | Holding skin |
| Forceps - surgical | FST | 11027-12 | Holding skin |
| Heating pad | UNO | 180000028 | Heating pad for keeping the animal warm during surgery |
| Induction chamber | UNO | 180000233 | Chamber for initial induction of anesthesia |
| Isoflurane | CP Pharma | V7005232.00.00 | Anesthesia |
| Lentiviral suspension | - | - | Lentiviral construct coding for DRD1 or dsRed for model induction |
| Lidocaine | Combustin | 8780701 | Local analgesia |
| Meloxicam | Boehringer Ingelheim | 7578423 | Pre- and postoperative analgesia |
| Needle holder | FST | 91201-13 | Sutering |
| Oxygen concentrator | UNO | 180000399 | Providing oxygen for anesthesia |
| PE Tubing | - | - | Connecting components of the anesthesia machine to induction chamber & face mask |
| Pencil | - | - | Marking the correct side for craniotomy |
| Scalpel blade holder | FST | 10003-12 | To hold scalpel blade |
| Scapel blades | FST | 10011-00 | Fine surgical blade for incision |
| Scavenger Unit | UNO | 180000260 | Controlling capacity of fume collector |
| Skin disinfectant | Bode | 975042 | Disinfacting skin before incision |
| Sterile cotton swabs | Boettger | 1102241 | Cleaning surgical field |
| Sterile eye cream | Bayer | 1578675 | Protect eyes during surgery |
| Surgical Scissors | FST | 14000-12 | Trimming fur and cutting suture material |
| Suture 3-0 polyglycolic acid | SMI | 11201519 | Suturing skin |
| Syringe pump | KdScientific | 788130 | Syring pump with connectable holder |
Referências
- Müller-Oerlinghausen, B., Berghöfer, A., Bauer, M. Bipolar disorder. Lancet. 359 (9302), 241-247 (2002).
- Grande, I., Berk, M., Birmaher, B., Vieta, E. Bipolar disorder. Lancet. 387 (10027), 1561-1572 (2016).
- Vieta, E., et al. Bipolar Disorders. Nat Rev Dis Primers. 4 (1), 1-16 (2018).
- Lee, J. G., et al. Neuromolecular etiology of bipolar disorder: Possible therapeutic targets of mood stabilizers. Clin Psychopharmacol Neurosci. 20 (2), 228-239 (2022).
- Mohamadian, M., et al. Mood and behavior regulation: Interaction of lithium and dopaminergic system. Naunyn Schmiedebergs Arch Pharmacol. 396 (7), 1339-1359 (2023).
- Berk, M., et al. Dopamine dysregulation syndrome: implications for a dopamine hypothesis of bipolar disorder. Acta Psychiatr Scand. 116 (s434), 41-49 (2007).
- Ashok, A. H., et al. The dopamine hypothesis of bipolar affective disorder: the state of the art and implications for treatment. Mol Psychiatry. 22 (5), 666-679 (2017).
- Zhang, C. -. Y., et al. Genetic evidence for the "dopamine hypothesis of bipolar disorder.". Mol Psychiatry. 28 (2), 532-535 (2023).
- Willner, P. The validity of animal models of depression. Psychopharmacology. 83 (1), 1-16 (1984).
- Beyer, D. K. E., Freund, N. Animal models for bipolar disorder: From bedside to the cage. Int J Bipolar Disord. 5 (1), 35 (2017).
- Valvassori, S. S., Gava, F. F., Cararo, J. H., Quevedo, J. Chapter 9 - The evolution of animal models for bipolar disorder. Neurobiol Bipol Dis. , 109-115 (2021).
- McClung, C. A., et al. Regulation of dopaminergic transmission and cocaine reward by the Clock gene. Proc Natl Acad Sci U S A. 102 (26), 9377-9381 (2005).
- Roybal, K., et al. Mania-like behavior induced by disruption of CLOCK. Proc Natl Acad Sci U S A. 104 (15), 6406-6411 (2007).
- Pathak, G., Ibrahim, B. A., McCarthy, S. A., Baker, K., Kelly, M. P. Amphetamine sensitization in mice is sufficient to produce both manic- and depressive-related behaviors as well as changes in the functional connectivity of corticolimbic structures. Neuropharmacol. 95, 434-447 (2015).
- Krug, J. T., et al. Effects of chronic lithium exposure in a modified rodent ketamine-induced hyperactivity model of mania. Pharmacol Biochem Behav. 179, 150-155 (2019).
- Shaldubina, A., Einat, H., Szechtman, H., Shimon, H., Belmaker, R. H. Preliminary evaluation of oral anticonvulsant treatment in the quinpirole model of bipolar disorder. J Neural Transm. 109 (3), 433-440 (2002).
- Freund, N., Haussleiter, I. Bipolar chronobiology in men and mice: A Narrative review. Brain Sci. 13 (5), 738 (2023).
- Wendler, E., et al. Mania-like elevated mood in rats: Enhanced 50-kHz ultrasonic vocalizations after sleep deprivation. Prog Neuropsychopharmacol Biol Psychiatry. 88, 142-150 (2019).
- Krishnan, V., Nestler, E. J. Animal models of depression: molecular perspectives. Curr Top Behav Neurosci. 7, 121-147 (2011).
- Schmerder, K., Freund, N. Animal models for mania. Psychiatr Vulnerab Mood Anxiety Disord. 190, 233-277 (2023).
- Zufferey, R., et al. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72 (12), 9873-9880 (1998).
- Gardner, B., Liu, Z. F., Jiang, D., Sibley, D. R. The role of phosphorylation/dephosphorylation in agonist-induced desensitization of D1 dopamine receptor function: Evidence for a novel pathway for receptor dephosphorylation. Mol Pharmacol. 59 (2), 310-321 (2001).
- Das, A. T., et al. Viral evolution as a tool to improve the tetracycline-regulated gene expression system. J Biol Chem. 279 (18), 18776-18782 (2004).
- Beyer, D. K. E., Horn, L., Klinker, N., Freund, N. Risky decision-making following prefrontal D1 receptor manipulation. Transl Neurosci. 12 (1), 432-443 (2021).
- Sonntag, K. C., et al. Viral over-expression of D1 dopamine receptors in the prefrontal cortex increase high-risk behaviors in adults: Comparison with adolescents. Psychopharmacology. 231 (8), 1615-1626 (2014).
- Beyer, D. K. E., Mattukat, A., Freund, N. Prefrontal dopamine D1 receptor manipulation influences anxiety behavior and induces neuroinflammation within the hippocampus. Int J Bipolar Disord. 9 (1), 9 (2021).
- Freund, N., Thompson, B. S., Sonntag, K., Meda, S., Andersen, S. L. When the party is over: Depressive-like states in rats following termination of cortical D1 receptor overexpression. Psychopharmacology. 233 (7), 1191-1201 (2016).
- Pantazopoulos, H., Stone, D., Walsh, J., Benes, F. M. Differences in the cellular distribution of D1 receptor mRNA in the hippocampus of bipolars and schizophrenics. Synapse. 54 (3), 147-155 (2004).
- Suhara, T., et al. D1 dopamine receptor binding in mood disorders measured by positron emission tomography. Psychopharmacology. 106 (1), 14-18 (1992).
- Dmitrzak-Weglarz, M., et al. Dopamine receptor D1 Gene -48A/G polymorphism is associated with bipolar illness but not with schizophrenia in a polish population. Neuropsychobiology. 53 (1), 46-50 (2006).
- Rybakowski, J., Dmitrzak-Weglarz, M., Suwalska, A., Leszczynska-Rodziewicz, A., Hauser, J. Dopamine D1 receptor gene polymorphism is associated with prophylactic lithium response in bipolar disorder. Pharmacopsychiatry. 42 (01), 20-22 (2009).
- Severino, G., et al. A48G polymorphism in the D 1 receptor genes associated with bipolar I disorder. Am J Med Genet B Neuropsychiatr Genet. 134B (1), 37-38 (2005).
- Shinohara, R., et al. Dopamine D1 receptor subtype mediates acute stress-induced dendritic growth in excitatory neurons of the medial prefrontal cortex and contributes to suppression of stress susceptibility in mice. Mol Psychiatry. 23 (8), 1717-1730 (2018).
- Yang, Y., Zhong, Z., Wang, B., Wang, Y., Ding, W. Activation of D1R signaling in the medial prefrontal cortex rescues maternal separation-induced behavioral deficits through restoration of excitatory neurotransmission. Behav Brain Res. 441, 114287 (2023).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nat Commun. 10 (1), 223 (2019).
- Wu, M., et al. Dopamine pathways mediating affective state transitions after sleep loss. Neuron. 112 (1), 141-154 (2024).
- Stewart, S. A., et al. Lentivirus-delivered stable gene silencing by RNAi in primary cells. RNA. 9 (4), 493-501 (2003).
- Andersen, S. L., Thompson, A. T., Rutstein, M., Hostetter, J. C., Teicher, M. H. Dopamine receptor pruning in prefrontal cortex during the periadolescent period in rats. Synapse. 37 (2), 167-169 (2000).
- Brenhouse, H. C., Sonntag, K. C., Andersen, S. L. Transient D1 dopamine receptor expression on prefrontal cortex projection neurons: Relationship to enhanced motivational salience of drug cues in adolescence. J Neurosci. 28 (10), 2375-2382 (2008).
- Thompson, T. L., Moss, R. L. Modulation of mesolimbic dopaminergic activity over the rat estrous cycle. Neurosci Lett. 229 (3), 145-148 (1997).
- Redelsperger, I. M., et al. Stability of doxycycline in feed and water and minimal effective doses in tetracycline-inducible systems. J Am Assoc Lab Anim Sci. 55 (4), 467-474 (2016).
- Insel, T., et al. Research domain criteria (RDoC): Toward a new classification framework for research on mental disorders. Am J Psychiatry. 167 (7), 748-751 (2010).
- von Mücke-Heim, I. -. A., et al. Introducing a depression-like syndrome for translational neuropsychiatry: a plea for taxonomical validity and improved comparability between humans and mice. Mol Psychiatry. 28 (1), 329-340 (2023).
- Ben-Ami Bartal, I. The complex affective and cognitive capacities of rats. Science. 385 (6715), 1298-1305 (2024).
- Jaehne, E. J., Corrone, M., van den Buuse, M. Administering a behavioral test battery in rodents. Neurobiol Methods Protoc. , 87-100 (2024).
- Prager, E. M., Bergstrom, H. C., Grunberg, N. E., Johnson, L. R. The Importance of reporting housing and husbandry in rat research. Front Behav Neurosci. 5, 38 (2011).
- Sorge, R. E., et al. Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nat Methods. 11 (6), 629-632 (2014).
- Du Preez, A., et al. Do different types of stress differentially alter behavioral and neurobiological outcomes associated with depression in rodent models? A systematic review. Front Neuroendocrinol. 61, 100896 (2021).
- Burn, C. C. What is it like to be a rat? Rat sensory perception and its implications for experimental design and rat welfare. Appl Anim Behav Sci. 112 (1), 1-32 (2008).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. PREPARE: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), e1000412 (2010).
- Messlinger, K., Ellrich, J. Meningeal nociception: Electrophysiological studies related to headache and referred pain. Microsc Res Tech. 53 (2), 129-137 (2001).
- Jirkof, P. Side effects of pain and analgesia in animal experimentation. Lab Anim. 46 (4), 123-128 (2017).
- Moebus, L., Quirin, M., Ehrlenspiel, F. Cerebral asymmetry in bipolar disorders: A scoping review. Biol Psychol. 179, 108551 (2023).
- Mundorf, A., Borawski, J., Ocklenburg, S. Behavioral lateralization in bipolar disorders: A systematic review. Int J Bipolar Disord. 11 (1), 37 (2023).
- Alda, M. Lithium in the treatment of bipolar disorder: Pharmacology and pharmacogenetics. Mol Psychiatry. 20 (6), 661-670 (2015).
- Reinhardt, P. R., Theis, C. D. C., Juckel, G., Freund, N. Rodent models for mood disorders - understanding molecular changes by investigating social behavior. Biol Chem. 404 (10), 939-950 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados