Creación de la columna de Winogradsky: Un método que sirve para enriquecer las especies microbianas en una muestra de sedimento
Visión general
Fuente: Elizabeth Suter1, Christopher Corbo1, Jonathan Blaize1
1 Departamento de Ciencias Biológicas, Wagner College, 1 Campus Road, Staten Island NY, 10301
La columna Winogradsky es un ecosistema en miniatura y cerrado utilizado para enriquecer las comunidades microbianas de sedimentos, especialmente las que participan en el ciclismo de azufre. La columna fue utilizada por primera vez por Sergei Winogradsky en la década de 1880 y desde entonces se ha aplicado en el estudio de muchos microorganismos diversos involucrados en la biogeoquímica, tales como fotocontautorátesis, oxidantes de azufre, reductores de sulfato, metanogenos, oxidantes de hierro, nitrógeno ciclistas, y más (1,2).
La mayoría de los microorganismos en la Tierra se consideran inculturables,lo que significa que no pueden aislarse en un tubo de ensayo o en una placa de petri (3). Esto es debido a muchos factores, incluyendo que los microorganismos dependen de otros para ciertos productos metabólicos. Las condiciones en una columna de Winogradsky imitan de cerca el hábitat natural de un microorganismo, incluyendo sus interacciones con otros organismos, y permite que se cultivan en un laboratorio. Por lo cual, esta técnica permite a los científicos estudiar estos organismos y entender cómo son importantes para los ciclos biogeoquímicos de la Tierra sin tener que cultivarlos de forma aislada.
Los ambientes de la Tierra están llenos de microorganismos que prosperan en todo tipo de hábitats, como suelos,agua oceánica, nubes y sedimentos de aguas profundas. En todos los hábitats, los microorganismos dependen unos de otros. A medida que un microorganismo crece, consume sustratos particulares,incluyendo combustibles ricos en carbono como azúcares, así como nutrientes, vitaminas y gases respiratorios como el oxígeno. Cuando estos recursos importantes se agotan, diferentes microorganismos con diferentes necesidades metabólicas pueden entonces florecer y prosperar. Por ejemplo, en la columna Winogradsky, los microbios consumen primero el material orgánico añadido mientras agotan el oxígeno en las capas inferiores de la columna. Una vez que se agota el oxígeno, los organismos anaeróbicos pueden tomar el control y consumir diferentes materiales orgánicos. Este desarrollo consecutivo de diferentes comunidades microbianas a lo largo del tiempo se denomina sucesión (4). La sucesión microbiana es importante en una columna de Winogradsky, donde la actividad microbiana cambia la química del sedimento, que luego afecta la actividad de otros microbios y así sucesivamente. Muchos microorganismos en suelos y sedimentos también viven a lo largo de gradientes,que son zonas de transición entre dos tipos diferentes de hábitats basados en las concentraciones de sustratos (5). En el punto correcto en el gradiente, un microbio puede recibir cantidades óptimas de diferentes sustratos. A medida que se desarrolla una columna Winogradsky, comienza a imitar estos gradientes naturales, particularmente en oxígeno y sulfuro (Fig. 1).
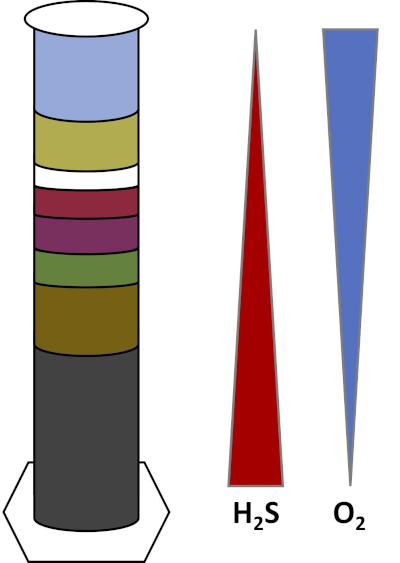
Figura 1: Representación de los gradientes de oxígeno (O2)y sulfuro (H2S) que se desarrollan en una columna Winogradsky.
En una columna de Winogradsky, el barro y el agua de un estanque o humedal se mezclan en una columna transparente y se les permite incubar, normalmente en la luz. Se añaden sustratos adicionales a la columna para dar a la comunidad fuentes de carbono, generalmente en forma de celulosa, y azufre. Los fotosintetizadores suelen comenzar a crecer en las capas superiores del sedimento. Estos microorganismos fotosintéticos se componen en gran medida de cianobacterias,que producen oxígeno y aparecen como una capa verde o marrón-marrón (Fig. 2, Tabla 1). Mientras que la fotosíntesis produce oxígeno, el oxígeno no es muy soluble en agua y disminuye por debajo de esta capa (Fig. 1). Esto crea un gradiente de oxígeno, que va desde altas concentraciones de oxígeno en las capas superiores hasta cero oxígeno en las capas inferiores. La capa oxigenada se llama la capa aeróbica y la capa sin oxígeno se llama la capa anaeróbica.
En la capa anaeróbica, muchas comunidades microbianas diferentes pueden proliferar dependiendo del tipo y la cantidad de sustratos disponibles, la fuente de los microbios iniciales y la porosidad del sedimento. En la parte inferior de la columna, los organismos que descomponen anaeróbicamente la materia orgánica pueden prosperar. La fermentación microbiana produce ácidos orgánicos a partir de la descomposición de la celulosa. Estos ácidos orgánicos pueden ser utilizados por reductoresde sulfato, que oxidan esos orgánicos usando sulfato, y producen sulfuro como subproducto. La actividad de los reductores de sulfato se indica si el sedimento se vuelve negro, porque el hierro y el sulfuro reaccionan para formar minerales de sulfuro de hierro negro (Fig. 2, Tabla 1). El sulfuro también se difunde hacia arriba, creando otro gradiente en el que las concentraciones de sulfuro son altas en la parte inferior de la columna y bajas en la parte superior de la columna (Fig. 1).
Cerca del centro de la columna, los oxidantes de azufre aprovechan el suministro de oxígeno desde arriba y sulfuro desde abajo. Con la cantidad correcta de luz, los oxidantes fotosintéticos de azufre pueden desarrollarse en estas capas. Estos organismos se conocen como bacterias de azufre verde y púrpura,y a menudo aparecen como filamentos y manchas verdes, púrpuras o púrpura-rojos (Fig. 2, Tabla 1). Las bacterias de azufre verde tienen una mayor tolerancia al sulfuro y generalmente se desarrollan en la capa directamente debajo de las bacterias de azufre púrpura. Por encima de las bacterias de azufre púrpura, también se pueden desarrollar bacterias de nonsulfurpúrpura. Estos organismos fotosintetizan utilizando ácidos orgánicos como donantes de electrones en lugar de sulfuro y a menudo aparecen como una capa roja, púrpura, naranja o marrón. Los oxidantes de azufre no fotosintéticos pueden desarrollarse por encima de las bacterias púrpuras nonsulfur, y estos generalmente aparecen como filamentos blancos (Fig. 2, Tabla 1). Además, también se pueden formar burbujas en la columna Winogradsky. Las burbujas en las capas aeróbicas indican la producción de oxígeno por las cianobacterias. Las burbujas en las capas anaeróbicas son probablemente debido a la actividad de los metanogenos, organismosque descomponen anaeróbicamente la materia orgánica y forman metano como subproducto.
| Posición en la columna | Grupo funcional | Ejemplos de organismos | Indicador visual |
| Arriba | Fotosíntesis | Cianobacterias | Capa verde o marrón rojizo. A veces burbujas de oxígeno. |
| Oxidantes de azufre no fotosintéticos | Beggiatoa, Thiobacilus | Capa blanca. | |
| Bacterias púrpuras sin azufre | Rhodomicrobium, Rhodospirilum, Rhodopseuodmonas | Capa roja, púrpura, naranja o marrón. | |
| Bacterias de azufre púrpura | Chromatium | Capa púrpura, o púrpura-roja. | |
| Bacterias de azufre verde | Clorobio | Capa verde. | |
| Bacterias reductoras de sulfato | Desulfovibrio, Desulfotomaculum, Desulfobacter, Desulfuromonas | Capa negra. | |
| Parte inferior | Metanógenos | Methanococcus, Methanosarcina | A veces burbujas de metano. |
Tabla 1: Los principales grupos de bacterias que pueden aparecer en una columna clásica de Winogradsky, de arriba abajo. Se dan ejemplos de organismos de cada grupo, y se enumeran los indicadores visuales de cada capa de organismos. (2002) y Rogan et al. (2005).
Procedimiento
1. Configuración
- Para configurar una columna Winogradsky, necesitará algunos suministros básicos:
- Una pala, un cubo y una botella para recoger las muestras en el campo
- Un recipiente vertical y transparente, como un cilindro graduado o una botella de agua de plástico de aproximadamente 1L
- Envoltura de plástico y bandas de goma
- cuencos grandes y cuchara grande para remover
- Una fuente de azufre (yema de huevo o sulfato de calcio)
- Una fuente de carbono orgánico (celulosa, en forma de periódico rallado)
- Una fuente de luz (ventana soleada o lámpara de escritorio)
- Suelo o barro recogido de un pantano, humedal, estanque o arroyo
- Agua del mismo hábitat
- OPCIONAL Lo siguiente será necesario para algunos de los experimentos opcionales descritos en este protocolo:
- Sal de mesa
- Celofán de color diferente
- Una fuente de hierro (como una uña o lana de acero)
- Un refrigerador con fuente de luz
- Un radiador cerca de una fuente de luz
- Si utiliza una botella de agua de plástico, corte el área del cuello para que la columna tenga forma cilíndrica. Retire los envoltorios para que la luz pueda penetrar a través del plástico.
- Los huevos crudos pueden contener Salmonella y deben manipularse con cuidado. Se deben seguir las técnicas adecuadas de lavado de manos. Alternativamente, se puede utilizar huevo hervido. Además, no hay manera de saber con certeza si el barro o el sedimento están contaminados con aguas residuales u otra sustancia dañina. Se deben usar guantes al mezclar el barro y configurar la columna.
2. Montaje de una columna Winogradsky
- Con la pala, desenterrar y recoger barro en el cubo. Los sedimentos deben estar cerca del borde del agua y completamente saturados de agua. Necesitará suficiente barro para llenar cada columna de Winogradsky. Recoger un poco de agua de la misma fuente en la botella de muestra (se necesitan aproximadamente 3000 ml por columna).
- En el laboratorio, transfiera suficiente barro al primer tazón de mezcla para llenar el 75% de su columna de volumen de 1 litro. A continuación, tamquée a través para eliminar grandes rocas, ramas u hojas mientras usa la cuchara para romper los grumos.
- Agregue un poco de agua que recogió al tazón de mezcla mientras revolvía. Añadir hasta que la consistencia de la mezcla de agua y lodo sea como un batido. Continúe asegurándose de que no haya grumos.
- Transfiera alrededor de 1/3 del batido de lodo de agua al segundo tazón. Agregue la yema de huevo y un puñado de periódicos rallados y mezcle.
- Agregue la mezcla de barro, yema de huevo y periódico a la columna hasta que la columna esté llena de 1/4.
- Agregue la mezcla regular de agua y lodo en la columna hasta que la columna esté llena de 3 a 4.
- Agregue el agua adicional a la columna, dejando sólo un pequeño espacio (1/2 pulgada) de aire en la parte superior.
- Cubra la columna con una envoltura de plástico y asegúrela con una banda de goma.
- Incubar la columna en la luz a temperatura ambiente.
- Durante las próximas 4 a 8 semanas, monitoree los cambios en la columna Winogradsky para el desarrollo de diferentes capas de colores y la formación de burbujas, como se describe en la Tabla 1. Además, debe registrar el tiempo que tardan en desarrollarse las diferentes capas.
3. Modificaciones opcionales a la columna clásica de Winogradsky
- Añadir 25-50g de sal por columna Winogradsky a la columna de barro recogido antes de añadir agua y agitar (paso 2.3). La adición de sal selecciona para las bacterias halófilas (amantes de la sal).
- Sustratos alternativos, como el hierro, en forma de una uña o lana de acero, se pueden añadir a la columna junto con la yema de huevo y el periódico rallado (paso 2.4). Esto enriquecerá las bacterias oxidantes del hierro, como Gallionella,y aparecerá como una capa de color óxido.
- En lugar de la temperatura ambiente (paso 2.9), la columna se puede incubar cerca de un radiador para seleccionar para las bacterias termofílicas (amantes del calor) o en un refrigerador con una fuente de luz para seleccionar para las bacterias psicófilas (amantes del frío).
- La cantidad de luz que recibe una columna a medida que incuba (paso 2.9) también se puede variar colocando diferentes columnas en luz alta, poca luz u oscuridad.
- La longitud de onda de la luz entrante se puede limitar cubriendo la columna con celofán sombreadas de manera diferente a medida que se incuba (paso 2.9) para determinar qué colores seleccionan para diferentes grupos bacterianos.
4. Análisis de datos
- Después de 1-3 semanas, un poco de color verde en la parte superior de la capa de barro de la columna clásica Denogradsky debe ser visible (Fig. 2A). Estos son los primeros signos de crecimiento de la capa cianobacteriana.
- Con el tiempo, seguir monitoreando la apariencia y evolución de las diferentes capas, cada una indicativa de los diferentes tipos de bacterias. SUGERENCIA: Consulte los Conceptos y la Tabla 1 para entender qué bacterias contribuyen a las diferentes capas.

Figura 2A: Una foto de una columna clásica de Winogradsky que ha incubado a temperatura ambiente durante 21 días. Observe el sedimento verde, indicativo de cianobacterias, en la parte superior de la columna.
- Si también se prepararon modificaciones en la columna clásica de Winogradsky, compare los resultados de cada columna.
- Observe las capas de cada una de las columnas Winogradsky modificadas. Tome nota de lo siguiente:
- ¿Las columnas muestran el mismo número de capas?
- ¿Las capas tienen el mismo color y grosor?
- ¿Las capas se producen a las mismas profundidades?
- ¿Cuánto tiempo tarda se desarrolló cada columna?
- ¿Una columna se desarrolló más lentamente que las otras?
- Observe las capas de cada una de las columnas Winogradsky modificadas. Tome nota de lo siguiente:
Resultados
En este experimento, el agua y los sedimentos fueron recogidos de un hábitat de agua dulce. Dos columnas Winogradsky fueron construidas y autorizadas para desarrollar: una columna clásica de Winogradsky incubada en la luz a temperatura ambiente (Fig. 2A) y una columna Winogradsky incubada en la oscuridad a temperatura ambiente (Fig. 2B).

Figura 2B: Una foto de la columna clásica de Winogradsky (izquierda), incubada a temperatura ambiente a temperatura ambiente a la luz durante 68 días y una columna Winogradsky incubada a temperatura ambiente en la oscuridad durante 68 días (derecha).
Después de permitir que las columnas se desarrollen durante 7-9 semanas, las capas de la columna clásica se pueden comparar con la columna incubada en la oscuridad (Fig. 2B). En la columna clásica de Winogradsky, se puede observar una capa cianobacteriana verde cerca de la parte superior del tubo. Cerca del centro del tubo, se puede observar una capa de color rojo-púrpura, indicativo de bacterias púrpuras nonsulfur. Bajo esta capa, se observa una capa púrpura-roja, indicativa de las bacterias del azufre púrpura. Directamente debajo de esta capa, se pueden observar sedimentos negros en la región anaeróbica de la columna, indicativo de bacterias que reducen el sulfato.
La columna cultivada en la oscuridad (Fig. 2B) se desarrolló de manera diferente a la columna clásica de Winogradsky. Al igual que la columna clásica, la columna oscura produjo sedimentos negros cerca de la parte inferior de la columna, indicativo de bacterias que reducen el sulfato. La columna oscura no produjo la capa cianobacteriana verde, ni las capas rojas, púrpuras o verdes indicativas de nonsulfuro púrpura, azufre púrpura y bacterias de azufre verde, respectivamente. Estos grupos dependen de la luz para el crecimiento, y por lo tanto no pueden crecer en la oscuridad.
Los resultados precisos de cada columna de Winogradsky variarán ampliamente con sus condiciones de incubación y sus hábitats de origen.
Las comunidades microbianas originarias de hábitats de agua dulce no estarán acostumbradas a altas concentraciones de sal y la adición de sal puede ralentizar o inhibir el crecimiento. Por el contrario, puede haber suficientes bacterias halofílicas en hábitats salobres y de agua salada para que la adición de sales no haga ninguna diferencia o incluso mejore el crecimiento de capas particulares en comparación con una columna sin sales añadidas.
Los sedimentos arenosos son más porosos que los sedimentos fangosos. Si se produce suficiente sulfuro en estos sedimentos porosos, los sulfuros pueden difundirse hasta la parte superior de la columna e inhibir el crecimiento de organismos aeróbicos. En este caso, la columna solo puede contener capas indicativas de anaerobios y no puede contener ningún aerobios, como las cianobacterias.
El agua dulce generalmente contiene menos sulfato que el agua salada. El sulfato es importante para el crecimiento de bacterias reductoras de sulfato. Los reductores de sulfato crean sulfuro como subproducto y se indican mediante el desarrollo de una capa negra en la parte inferior de la columna. Si el sulfato no se complementa a comunidades de agua dulce, los reductores de sulfato pueden no producir suficiente sulfuro. La creación del subproducto de sulfuro es importante para el crecimiento de bacterias de azufre verde y púrpura y los oxidantes de azufre no fotosintéticos. En estos casos, los oxidantes de azufre todavía pueden crecer usando la yema de huevo como fuente de azufre, incluso si los reductores de sulfato (capa negra) nunca se desarrollan.
Diferentes longitudes de onda de luz deben seleccionarse para organismos con diferentes pigmentos de absorción. Una columna mantenida en la oscuridad sólo permitirá que los organismos no fotosintéticos crezcan, incluyendo reductores de sulfato, oxidantes de hierro y metanogenos. Los fotosintetizadores tienen pigmentos que absorben la luz a diferentes longitudes de onda dentro del rango visible (400-700 nm). Al cubrir una columna con, por ejemplo, celofán azul, se bloquea la entrada de luz azul (450-490 nm) para que no entre en la columna. Todos los fotosintetizadores de la columna tienen pigmentos que requieren las longitudes de onda azules (6) y su crecimiento debe ser inhibido. Por otro lado, el celofán rojo bloqueará la luz de 635-700 nm. Estas longitudes de onda son importantes para los pigmentos utilizados por las cianobacterias (6), mientras que el azufre púrpura, el azufre verde y las bacterias púrpuras nonsulfuro todavía pueden ser capaces de crecer.
Diferentes comunidades microbianas pueden tener capacidades adaptativas muy diferentes para hacer frente a los cambios en las temperaturas. Las altas temperaturas pueden mejorar las tasas de actividad microbiana cuando hay suficientes termofílicos. Por otro lado, en ausencia de termófilos, las altas temperaturas pueden disminuir la actividad microbiana general. Del mismo modo, las bajas temperaturas pueden disminuir la actividad microbiana general a menos que la comunidad microbiana contenga suficientes psicofilis.
Aplicación y resumen
La columna Winogradsky es un ejemplo de un ecosistema microbiano interdependiente. Después de mezclar el barro, el agua y los sustratos adicionales de carbono y azufre en una columna vertical, el ecosistema estratificado debe estabilizarse en zonas separadas y estables durante varias semanas. Estas zonas están ocupadas por diferentes microorganismos que florecen en un lugar particular a lo largo del gradiente entre el sedimento rico en sulfuro en el fondo y el sedimento rico en oxígeno en la parte superior. Mediante la manipulación de las condiciones y sustratos dentro de la columna Winogradsky, la presencia y actividad de diferentes microorganismos como halófilos, termófilos, psicófilos, oxidantes de azufre, reductores de azufre, oxidantes de hierro y fotosintetizadores se puede observar.
Saltar a...
Vídeos de esta colección:

Now Playing
Creación de la columna de Winogradsky: Un método que sirve para enriquecer las especies microbianas en una muestra de sedimento
Microbiology
130.4K Vistas

Diluciones en serie y enchapado: enumeración microbiana
Microbiology
317.8K Vistas

Cultivos de enriquecimiento: Cultivo de bacterias aerobias y anaerobias en medios selectivos y diferenciales
Microbiology
132.5K Vistas

Cultivos puros y siembra por estrías: aislamiento de colonias bacterianas únicas de una muestra mixta
Microbiology
166.8K Vistas

Secuenciación del ARNr 16s: Una técnica basada en PCR para identificar especies bacterianas
Microbiology
190.3K Vistas

Curvas de crecimiento: Generación de curvas de crecimiento utilizando unidades formadoras de colonias y mediciones de densidad óptica
Microbiology
299.0K Vistas

Pruebas de susceptibilidad a los antibióticos: Pruebas con epsilometro para determinar los valores de la CMI de dos antibióticos y evaluar la sinergismos
Microbiology
94.3K Vistas

Microscopía y tinción: Tinción de Gram, cápsula y endosporas
Microbiology
364.6K Vistas

Ensayo de placa: Un método para determinar los títulos virales como unidades formadoras de placas (UFP)
Microbiology
186.9K Vistas

Transformación de células E. coli mediante un procedimiento con cloruro de calcio
Microbiology
87.3K Vistas

Conjugación: Un método para transferir resistencia a ampicilina de un donante a una E. Coli receptora
Microbiology
38.5K Vistas

Transducción de fagos: Un método para transferir resistencia a ampicilina de un donante una E. coli receptora
Microbiology
29.3K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados