Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Purification par affinité des complexes virus de la grippe ribonucléoprotéiques de la chromatine des cellules infectées
Dans cet article
Résumé
Les virus grippaux répliquer leur génome à ARN en association avec la cellule hôte chromatine. Ici, nous présentons une méthode pour purifier intactes complexes ribonucléoprotéiques virales de la chromatine des cellules infectées. Purifiée des complexes viraux peuvent être analysés à la fois par Western blot et par extension d'amorce de la teneur en protéines et d'ARN, respectivement.
Résumé
Comme tous les virus à ARN à brin négatif, le génome de virus de la grippe est conditionnée sous forme de complexes ribonucléoprotéiques virales (vRNP), dans lequel le génome simple brin est encapsidé par la nucléoprotéine (NP), et associé avec le complexe polymérase trimère constitué de la PA, PB1, PB2 et sous-unités. Cependant, contrairement à la plupart des virus à ARN, virus de la grippe virale effectuer la synthèse d'ARN dans le noyau des cellules infectées. Fait intéressant, la synthèse d'ARNm viral utilise cellulaires pré-ARNm comme amorces, et il a été proposé que ce processus se déroule sur la chromatine 1. Interactions entre la polymérase virale et l'hôte l'ARN polymérase II, ainsi qu'entre le NP et les nucléosomes d'accueil ont également été caractérisées 1,2.
Récemment, la génération de virus grippaux recombinants codant pour une seule Strep-Tag génétiquement fusionnée à l'extrémité C-terminale de la sous-unité PB2 de la polymérase virale (RWSN-PB2-streptococcique 3) a êtrefr décrit. Ces virus recombinants permettre la purification de complexes contenant PB2, y compris, à partir de vRNPs cellules infectées. Pour obtenir purifié vRNPs, des cultures de cellules sont infectées, et vRNPs sont purifiés par affinité à partir de lysats dérivés de ces cellules. Toutefois, les procédures de lyse utilisées à ce jour ont été basées sur une seule étape de lyse détergent, qui, malgré la présence d'une nucléase générale, souvent d'extraire la chromatine liée seul matériau inefficace.
Notre travail préliminaire suggère qu'une grande partie de vRNPs nucléaires n'ont pas été extraites lors de la lyse cellulaire traditionnel, et ne pouvait donc pas être purifié par affinité. Pour augmenter cette efficacité de l'extraction, et de séparer la chromatine liée de la non-chromatine assortis vRNPs nucléaires, nous avons adapté un protocole étape par étape d'extraction subcellulaire à la grippe les cellules infectées. En bref, cette procédure sépare tout d'abord les noyaux de la cellule, puis extraits solubles des protéines nucléaires (appelée ici "nucléoplasmique" fraction).Le reste insoluble nucléaire est ensuite digéré par Benzonase, un ADN non spécifique / ARN nucléase, suivie de deux étapes d'extraction de sel: la première utilisation de NaCl 150 mM (appelé "CH150"), puis 500 mM de NaCl ("ch500") (Fig. 1 ). Ces étapes d'extraction de sel ont été choisis en fonction de notre observation selon laquelle 500 mM de NaCl était suffisante pour solubiliser plus de 85% de vRNPs nucléaires tout en permettant la liaison de vRNPs marqués à la matrice d'affinité.
Après fractionnement subcellulaire des cellules infectées, il est possible de purifier par affinité vRNPs PB2-étiqueté à partir de chaque fraction individuelle et d'analyser leurs protéines et d'ARN en utilisant des composants Western Blot et par extension d'amorce, respectivement. Récemment, nous avons utilisé cette méthode pour découvrir que l'exportation vRNP forme des complexes au cours de points de retard après l'infection sur la fraction la chromatine extraite avec 500 mM de NaCl (ch500) 3.
Protocole
Un organigramme schématique du protocole est indiqué dans la Fig. 1 et une table de réactifs est présenté ci-dessous.
1. Infection (16 - 24 h)
- Semences sur des cellules HeLa en 5 150 mm en plastique des boîtes de culture de cellules dans un milieu de Eagle modifié par Dulbecco (DMEM)-moyen-élevé de glucose, de telle sorte qu'ils atteindront environ 80% de confluence le jour suivant (environ 5 x 10 8 cellules). Il est important que les cellules ne parviennent pas à 100% de confluence.
- Le lendemain, diluer le Strep-étiqueté stock de virus de la grippe dans un tampon phosphate salin (PBS) contenant 0,3% de sérumalbumine bovine (BSA) à une multiplicité d'infection de 3.
- Retirez le milieu de croissance à partir des cellules, laver une fois avec du PBS, et ajouter 10 ml de PBS contenant le virus à des cellules. Incuber pendant 1 h à température ambiante.
- Remplacez le milieu d'infection avec du DMEM-hyperglycémie, et poursuivre l'incubation à 37 ° C.
2. Fractionnement subcellulaire (3 h)
- Laver les cellules une fois avec du PBS froid et de suspendre les cellules dans du PBS froid avec une raclette en caoutchouc et le transfert d'un tube conique de 50 ml.
- Sédimenter les cellules dans une centrifugeuse de table pendant 5 min à 1000 tours par minute et puis aspirer PBS.
- Resuspendre culot cellulaire dans 10 ml de tampon de saccharose à froid (10 mM HEPES pH 7,9, KCl 10 mM, 2 mg d'acétate de mM (MgOAc), 3 mM CaCl 2, 340 mM de saccharose, 1 mM de dithiothréitol (DTT), 1% mélange inhibiteur de la protéase) . Après la suspension, passer des cellules à travers un embout de pipette 200 pi attaché à une pipette en plastique de 10 ml de sérum de perturber amas de cellules.
- Incuber 10 min sur la glace. Inverser doucement périodiquement pour remettre en suspension les cellules.
- Ajouter de Nonidet P-40 (NP-40) à une concentration finale de 0,5% et à vortex à grande vitesse pendant 15 secondes. Immédiatement centrifuger pendant 10 min à 3500 xg à 4 ° C dans un centrifuge de tablege.
- Enlever le surnageant et conserver à 4 ° C. Il s'agit de la fraction cytoplasmique. Le culot doit être plus petite et plus blanche que la cellule d'origine culot. Toutes les fractions peuvent être conservés pendant au moins 4 h à 4 ° C.
- Laver le culot dans 5 ml de tampon de saccharose à froid, re-centrifugation à l'étape 2.5 et jeter le surnageant.
- Reprendre le culot (contenant des noyaux) dans 1,5 ml tampon d'extraction à froid nucléoplasmique (HEPES 50 mM pH 7,9, 150 mM, 1,5 mM KOAc MgCl 2, 0,1% de NP-40, DTT 1 mM, 1% mélange inhibiteur de la protéase).
- Transférer dans un réfrigérés, tout en verre de 4 ml homogénéisateur Dounce avec un pilon hermétique et homogénéiser les noyaux avec 20 coups.
Éviter de faire mousser pendant l'homogénéisation. La résistance devrait augmenter après environ 10 coups. Homogénéisation efficace peut être confirmé sous un microscope à contraste de phase. - Transfert des noyaux homogénéisé dans un tube de 1,5 ml et incuber 20 min sur une roue tournant à 4 °C.
- Centrifuger à 16000 x g dans une microcentrifugeuse à 4 ° C pendant 10 min.
- Enlever le surnageant et conserver à 4 ° C. Il s'agit de la fraction nucléoplasmique.
- Resuspendre le culot dans 1,5 ml de tampon de digestion (50 mM HEPES pH 7,9, NaCl 10 mM, 1,5 mM MgCl 2, 1 mM DTT, 1% de mélange inhibiteur de la protéase, 100 U / ml Benzonase (pour l'analyse d'ARN, substitut avec 20 U / ml de RNase sans DNase I)) de pré-chauffé à 37 ° C, et incuber 10 min à 37 ° C.
- Ajouter 42 ul de NaCl 5 M (pour une concentration finale de 150 mM de NaCl) et incuber 20 min encore à 4 ° C.
- Centrifuger à 16000 x g dans une microcentrifugeuse à 4 ° C pendant 10 min.
- Enlever le surnageant et conserver à 4 ° C. Il s'agit de la fraction CH150.
- Resuspendre le culot dans 1,5 ml à froid de haute-sel tampon (50 mM HEPES pH 7,9, NaCl 500 mM, 1,5 mM MgCl 2, 0,1% de NP-40, DTT 1 mM, 1% mélange inhibiteur de la protéase) et incuber 20 min sur la glace.
- Centrifuger à 16000 x g </ Em> dans une microcentrifugeuse à 4 ° C pendant 10 min.
- Enlever le surnageant et conserver à 4 ° C. Il s'agit de la fraction ch500.
3. Strep-tag de purification (2 h)
- Ajouter 300 pi de 5 M de NaCl à la fraction cytoplasmique (pour une concentration finale de 150 mM de NaCl).
- Aliquote de 100 ul de billes de Sépharose emballés Strep-Tactin par fraction dans un tube de 15 ml conique.
- Ajouter 10 volumes de tampon de lavage (Strep 20 mM HEPES pH 7,9, NaCl 150 mM (500 mM de NaCl pour ch500 échantillons), EDTA 1 mM) à des billes, inverser le tube pour mélanger, et centrifuger 5 min à 1000 x g dans une table centrifuger.
- Jeter le surnageant, répétez l'étape 3.3 deux fois, puis reprendre le culot perle dans un volume égal de tampon de lavage Strep.
- Ajouter 200 ul de Strep-lavé Tactin suspension talon à chaque fraction (en 1,5 ml microtubes pour nuceloplasmic, des CH150, et ch500 fractions et un tube de 15 ml conique pour la fraction cytoplasmique).
- Tournertubes 1h à 4 ° C sur une roue en rotation.
- Centrifuger les tubes 1 min à 1000 x g à 4 ° C. Rejeter le surnageant.
- Ajouter 1 ml de tampon de lavage à froid Strep dans chaque tube. Transfert perles de tube de 15 ml (fraction cytoplasmique) pour tube de 1,5 ml. Laver tout 1 min tubes à 4 ° C, centrifugation, après que l'étape 3.7. Répétez cette étape de lavage à deux reprises.
- Après la dernière étape de lavage, enlever toutes les traces de tampon de lavage en utilisant un embout de pipette à plat. Ajouter 100 ul de tampon d'élution (tampon de lavage contenant 2,5 Strep desthiobiotine mM) et mélanger délicatement.
- Incuber 15 min sur la glace. Mélanger délicatement de temps en temps des perles en tapant sur le fond des tubes.
- Tubes à centrifuger 1 min à 1000 x g à 4 ° C dans microcentrifugeuse. Recueillir le surnageant contenant éluées Strep-tag vRNPs.
4. Les résultats représentatifs
L'efficacité du fractionnement est mieux jugée par analyse par Western blot des lysats de fractionnement à l'aide ANTIBodies spécifiques pour les marqueurs subcellulaires (Fig. 2). En particulier, réussie fractionnement subnucléaire doit afficher peu ou pas de l'ARN polymérase II cellulaire (Pol II) dans le nucléoplasmique, ou soluble fraction nucléaire 4, et le plus doit être extrait avec NaCl 150 mM 5. Une dégradation de Pol II est également reproductible observée dans les cellules infectées par le virus de la grippe par rapport aux cellules non infectées, conformément à la littérature 6.
Purification de vRNPs est mieux jugée par l'argent ou la coloration au bleu de Coomassie, comme indiqué pour un éluat cytoplasmique dans la Fig. 3. Dans notre expérience, la plupart Strep-PB2 est purifié dans le cadre d'un vRNP complètement formé, c.-à-polymérase peu soluble est capturé. Cela se reflète dans la grande NP: PA/PB1/PB2 ratio observé par l'argent ou la coloration au bleu de Coomassie. Un ratio plus faible indique une contamination par des ARNases tampon, que plusieurs ARNases ubiquitaires (tels que la RNase A) sont connus pour cliver l'ARN viral, de telle façon que de dissociermangé la polymérase du NP multimères 7. Fait intéressant, le traitement avec Benzonase seul, tandis que suffisante pour digérer l'ARN viral, semble avoir aucun effet sur les ratios stoechiométriques de protéines vRNP. Bien que nous ne pouvons pas expliquer ce phénomène, nous avons observé des perturbations de la vRNPs après digestion avec d'autres RNases (données non présentées), suggérant que Benzonase peut laisser certaines régions structurellement importantes d'ARN intact. Après purification de vRNPs à partir du cytoplasme et nucléoplasme (effectuée sans digestion à la nucléase), 8 bandes faibles, mais discrète à poids moléculaire élevé peut être observé par coloration à l'argent, qui correspondent aux poids moléculaire prédit des 8 segments génomiques de la grippe (voir réf. 3 ).
Les quantités relatives de vRNPs purifiés à partir de chaque fraction à 9 heures après l'infection sont présentés dans la figure. 4. La répartition des vRNPs varie au cours de l'infection, avec la plus forte accumulation dans la fraction CH150 à des moments au début, etune accumulation accrue dans le nucléoplasme et le cytoplasme à des moments tardifs.
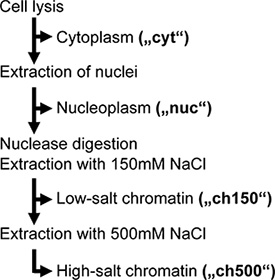
Diagramme Figure 1. Du fractionnement subcellulaire. Adapté de la réf. 3.
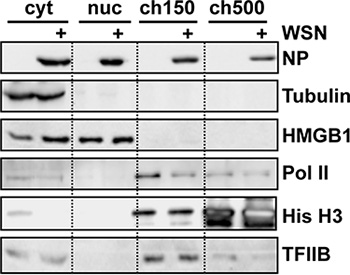
Figure 2. Analyse par Western blot des fractions subcellulaires de la grippe les cellules infectées. 10 9 cellules HeLa ont été infectées par la grippe WSN souche du virus pour 9 h avant le fractionnement subcellulaire. Des quantités égales de protéines totales ont été chargés dans chaque couloir et analysées en utilisant les anticorps indiqués. L'ARN polymérase II (Pol II) a été détecté en utilisant clone 8WG16, qui reconnaît toutes les formes du domaine C-terminal (la bande hypophosphorylé est le plus important). Adapté de la réf. 3.

Figure 3.Argent analyse tache de purifier vRNPs. Des cellules HeLa sont infectées par le RWSN (comme un contrôle négatif) ou RWSN-PB2-Strep pour 9 h, suivie d'une purification de la fraction Strep cytoplasmique. Astérisque indique les bandes qui ne sont pas visibles après digestion par la RNase. Adapté de la réf. 3.

Figure 4. Argent analyse tache de vRNPs purifiés à partir de différentes fractions cellulaires. 10 9 cellules HeLa ont été infectées par le RWSN-PB2-Strep ou RWSN pour 9 h suivie d'un fractionnement subcellulaire et la purification Strep. Des quantités égales d'éluat de chaque fraction ont été chargés. Adapté de la réf. 3.
Discussion
Alors que de nombreuses études ont récemment identifié des protéines individuelles ou des réseaux cellulaires impliqués dans l'infection du virus de la grippe 8, la signification fonctionnelle de la majorité de ces interactions demeure incertaine. Compte tenu de la dépendance absolue de la chromatine à base de fonctions pour la grippe virus à ARN de synthèse et de la nature complexe biophysique et biochimique du noyau 9, de nouvelles techniques seront nécessaires pour élucider ces ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier Nada Naffakh et Marie-Anne Rameix-Welti (Institut Pasteur) pour le virus de RWSN-PB2-Strep.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| DMEM-hyperglycémie | Gibco | 11965-092 | |
| BSA | Sigma | A9418 | |
| Inhibiteur de la protéase Mix G | Serva | 39101 | |
| Benzonase nucléase | Novagen | 71206 | 25 U / pl |
| DNase I, sans RNase | ThermoScientific | EN0523 | 50 U / pl |
| Dounce homogénéisateur | Wheaton | 432-1271 | Usage de type "B" pilon |
| Strep-Tactin Sepharose | IBA GmbH | 2-1201-025 | 50% en format de colonne de suspension peut également être utilisé |
| Desthiobiotine | IBAGmbH | 2-1000-002 |
Références
- Engelhardt, O. G., Smith, M., Fodor, E. Association of the influenza A virus RNA-dependent RNA polymerase with cellular RNA polymerase II. J. Virol. 79, 5812-5812 (2005).
- Garcia-Robles, I., Akarsu, H., Müller, C. W., Ruigrok, R., Baudin, F. Interaction of influenza virus proteins with nucleosomes. Virology. 332, 329 (2005).
- Chase, G. P., Rameix-Welti, M. A., Zvirbilene, A., Zvirblis, G., Götz, V., Wolff, T., Naffakh, N., Schwemmle, M. Influenza virus ribonucleoprotein complexes gain preferential access to cellular export machinery through chromatin targeting. PLoS Pathogens. 7, e1002187 (2011).
- Kimura, H., Tao, Y., Roeder, R. G., Cook, P. R. Quantitation of RNA polymerase II and its transcription factors in an HeLa cell: little soluble holoenzyme but significant amounts of polymerases attached to the nuclear substructure. Mol. Cell. Biol. 19, 5383-5383 (1999).
- Henikoff, S., Henikoff, J. G., Sakai, A., Loeb, G. B., Ahmad, K. Genome-wide profiling of salt fractions maps physical properties of chromatin. Genome Res. 19, 460 (2009).
- Rodriguez, A., Perez-Gonzalez, A., Nieto, A. Influenza virus infection causes specific degradation of the largest subunit of cellular RNA polymerase II. J. Virol. 81, 5315-5315 (2007).
- Ye, Z., Liu, T., Offringa, D. P., McInnis, J., Levandowski, R. A. Association of influenza virus matrix protein with ribonucleoproteins. J. Virol. 73, 7467-7467 (1999).
- Watanabe, T., Watanabe, S., Kawaoka, T., Y, . Cellular networks involved in the influenza virus life cycle. Cell Host Microbe. 7, 427 (2010).
- Engelhardt, O. G., Fodor, E. Functional association between viral and cellular transcription during influenza virus infection. Rev. Med. Virol. 16, 329-345 (2006).
- Schwartz, L. B., Sklar, V. E., Jaehning, J. A., Weinmann, R., Roeder, R. G. Isolation and partial characterization of the multiple forms of deoxyribonucleic acid-dependent ribonucleic acid polymerase in the mouse myeloma, MOPC 315. J. Biol. Chem. 249, 5889 (1974).
- Lambert, J. P., Baetz, K., Figeys, D. Of proteins and DNA--proteomic role in the field of chromatin research. Mol. Biosyst. 6, 30 (2010).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J. Virol. 85, 6618 (2011).
- Liao, T. L., Wu, C. Y., Su, W. C., Jeng, K. S., Lai, M. M. Ubiquitination and deubiquitination of NP protein regulates influenza A virus RNA replication. EMBO J. 29, 3879 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon