Method Article
Time-lapse d'imagerie par fluorescence de la croissance racinaire d'Arabidopsis avec la manipulation rapide de l'environnement root en utilisant le RootChip
Dans cet article
Résumé
Cet article fournit un protocole pour la culture de jeunes plants d'Arabidopsis dans le RootChip, une plate-forme d'imagerie qui combine microfluidique de contrôle automatisé des conditions de croissance avec un suivi racine microscopique et FRET basée sur la mesure de niveaux intracellulaires de métabolites.
Résumé
Les fonctions des racines que l'ancre physique de l'usine et est l'organe responsable de l'absorption d'eau et les nutriments minéraux tels que des éléments d'azote, de phosphore, de sulfate et de trace que les plantes acquièrent à partir du sol. Si nous voulons développer des approches durables pour la production de rendement des cultures à haute, nous avons besoin de mieux comprendre comment se développe la racine, prend place un large éventail de nutriments, et interagit avec des organismes symbiotiques et pathogènes. Pour atteindre ces objectifs, nous devons être en mesure d'explorer les racines dans le détail microscopique sur des périodes allant de quelques minutes à plusieurs jours.
Nous avons développé le RootChip, un polydiméthylsiloxane (PDMS) - basé dispositif microfluidique, qui nous permet de grandir et de racines d'image à partir de plants d'Arabidopsis en évitant tout stress physique aux racines lors de la préparation pour l'imagerie 1 (figure 1). Le dispositif contient une structure de canal bifurqué avec vannes micromécaniques pour guider l'écoulement du fluideà partir des entrées de solution à chacun des huit chambres d'observation 2. Ce système de perfusion permet le microenvironnement root pour être contrôlé et modifié avec précision et rapidité. Le volume des chambres est d'environ 400 nl, ce qui nécessite que des quantités minimes de la solution d'essai.
Ici nous fournissons un protocole détaillé pour étudier la biologie racine sur le RootChip en utilisant l'imagerie des approches fondées sur la résolution en temps réel. Les racines peuvent être analysés sur plusieurs jours en utilisant la microscopie laps de temps. Les racines peuvent être perfusés avec des solutions nutritives ou des inhibiteurs, et jusqu'à huit plants peuvent être analysés en parallèle. Ce système a le potentiel pour une large gamme d'applications, y compris l'analyse de la croissance des racines dans la présence ou l'absence de produits chimiques, basé sur la fluorescence d'analyse de l'expression génique et l'analyse des biocapteurs, par exemple FRET nanocapteurs 3.
Protocole
Remarque: Effectuez toutes les étapes étapes préparatoires dans des conditions stériles.
1. Préparation de cônes en plastique pour la germination des graines
- Remplir une boîte de Pétri 10 cm avec le milieu de croissance contenant de la gélose 1% à une épaisseur de 5 mm. Nous utilisons une force moitié modifiée Hoagland moyenne 4, mais la composition du milieu devrait être choisie en fonction de différents besoins expérimentaux.
- Alors que le milieu est encore liquide, utiliser une pipette multi-canaux pour remplir 10 embouts de pipette ul avec 5 pi de milieu de la boîte de Pétri.
- Conserver les conseils remplis dans la boîte de pointe de la pipette jusqu'à ce que le support est solide, puis coupé à 4 cônes en plastique mm de long et à la verticale dans une boîte de Petri contenant un milieu de croissance solide.
2. Germination et croissance des semis
- Surface stériliser les graines dans NaOCl 5% pendant 5 min, laver trois fois avec de l'eau stérile, puis placez une seule graine sur le dessus de chaque du cône moyen remplies.
- Sceller le plat avec du ruban adhésif Micropore (3M) et conserver à 4 ° C pour synchroniser la germination.
- Après trois jours, transférer les plaques à une chambre de croissance pour démarrer la germination. Nos conditions de croissance sont de 23 ° C à un cycle de 16h light/8h haute sombre (intensité de la lumière: 100 uE m -2 s -1).
- Entre 5 et 7 jours après la germination, les semis devraient être prêts pour le transfert à l'RootChip. A cette époque, des racines doivent être à proximité des points de fond des cônes en plastique. Vérifiez la santé des semis, la longueur des racines et, le cas échéant, l'expression d'un marqueur fluorescent sous une loupe binoculaire.
- Marquez plants individuels pour le transfert sur la puce. Sélectionnez une dizaine de plants dans un cas est endommagé pendant le transfert.
3. Transfert de semis sur le RootChip
- Pour stériliser le RootChip à long terme des expériences, enveloppezl'appareil dans du papier de soie, dans un plat en verre de Petri, et autoclave.
- Une fois que le RootChip a refroidi, le couvrir avec un milieu de croissance liquide. Le RootChip doit être complètement immergé, mais le niveau du liquide ne doit pas être supérieure à 3 mm au-dessus de la surface RootChip.
- Avec une pipette 20 ul, tirez moyenne à travers l'entrée des racines et la chambre de sortie pour remplir la chambre d'observation avec le milieu.
- Cônes en plastique plug sélectionné à l'étape 2.5 dans les entrées RootChip. Les cônes doit être bien ajusté dans les entrées. Depuis le RootChip est monté sur une fine couche de verre optique, ne s'appliquent pas trop de pression à la puce.
- Incuber la nuit RootChip en milieu liquide. Pour l'empêcher de flotter, placez deux lames de verre sur la puce. Ajouter un barreau magnétique et fermer le plat.
- Transférer l'Assemblée à un agitateur magnétique et agiter doucement le milieu.
- Le RootChip entrées se croisent les voies à un angle de 30 ° à l'appareil normal de FACIlitate la croissance des racines dans les canaux (figure 1A). À soutenir la croissance en outre dans la direction souhaitée, basculer l'ensemble légèrement en plaçant une lame de verre sous la boîte de Pétri sur le côté de la face puce des sorties.
- Pour maintenir le cycle lumière / obscurité, la lumière sur les plants avec une lampe anneau (intensité de la lumière: 100 m uE -2 s -1) relié à une minuterie.
4. Raccordement de la RootChip au Transporteur
- Le lendemain, remplir un refermable, flacon sous pression avec le milieu de croissance liquide (figure 1B).
- Inverser le support de puce et le placer sur une surface stable. Retirer l'RootChip du milieu liquide et pour l'insérer côté PDMS vers le bas dans l'ouverture inférieure du support de puce. Orienter la puce de telle sorte que le côté contenant les entrées de commande de couche est tournée vers le côté de connecteurs de pression des tubes de ligne dans la paroi latérale de support.
- Sécher le couvercle en verre sur lebas de la puce en tamponnant délicatement avec du papier absorbant. Fixez le RootChip au transporteur avec du ruban adhésif et le droit toute l'assemblée.
- Raccords pour tuyaux sont fabriqués en coupant souple tube en plastique microbore (TYGON, 0,20 "x 0,060 ID" OD) en morceaux de 5 cm de long et en les reliant à des tubes en acier inoxydable microbore (la Nouvelle-Angleterre petit tube, 0.025 "OD x 0,013" ID x 0,75 " longue). remplissage des connecteurs de tubes avec de l'eau en utilisant une seringue et le bouchon chaque raccord de tubulure d'admission dans la couche de commande correspondant sur la puce. l'eau sera ultérieurement remplir les canaux de couche de contrôle et peuvent être utilisées pour transmettre la pression aux vannes micromécaniques.
- Brancher les extrémités opposées des lignes dans le support ou le flacon de solution (s). Appliquer une pression sur le flacon de solution avec une seringue d'air. La pression de l'air a augmenté dans le flacon de solution va forcer le liquide dans les lignes.
5. Montage de la RootChip au microscope
- Placez le support sur le Microscstade de l'OPE. Pour réduire la possibilité de déplacer l'assemblée au cours de l'expérience à cause des vibrations dans la salle, le transporteur doit correspondre exactement dans les encoches de l'insert scène.
- Les soupapes à puce et l'écoulement de milieu à travers la puce sont commandés par la pression d'air. Deux lignes avec les régulateurs sont bifurqué d'une ligne de pression principale - un est utilisé pour contrôler l'écoulement de fluide à travers les canaux, et l'autre est reliée à soupapes à air électrovannes qui actionnent les soupapes de poussée jusqu'à la couche de contrôle. Les électrovannes sont exploités à partir de l'ordinateur via le contrôleur USB de soupape (développé par Rafael Gómez-Sjöberg, Lawrence Berkeley National Lab). Fermez les deux régulateurs de pression avant de connecter la puce.
- Ajouter quelques ml d'eau dans les réservoirs du transporteur pour maintenir l'humidité élevée dans l'assemblée. Cette étape doit être répétée sur le parcours de plus d'expériences pour conserver les plantes de se dessécher. Maintenez le volume faible pour minimiser til quantité de liquide pouvant être versé sur le microscope. Pour expériences à long terme, la sortie des points de vente de puces peut être guidé dans les réservoirs du transporteur en reliant les points de vente de puces pour les réservoirs avec un tube microbore (voir l'étape 4.4). Sinon, la sortie qui s'accumule sur la surface de la puce peuvent être collectées par pipetage.
- Préparer les feuilles de carrés de plastique transparent à partir de feuilles protectrices (C-Line). Fixer le plastique transparent au transporteur par un adhésif double face pour maintenir une humidité élevée dans l'assemblée.
- Placez la lumière anneau sur la puce et de maintenir le cycle lumière / obscurité. La lampe circulaire doit être éteint avant le début de toute expérience qui utilise des marqueurs fluorescents, que l'éclairage direct d'interférer avec la collection d'images.
6. Fonctionnement de la RootChip aide de l'interface LabView
Le contrôleur d'interface RootChip pour la plate-forme logiciel LabView peutêtre téléchargé depuis notre site http://dpb.carnegiescience.edu/technology/rootchip .
- Les soupapes sur la puce sont fermées par application d'une pression à la couche de contrôle, dans ce cas par l'ouverture des vannes d'air électrovannes. Le contrôleur d'interface permet l'activation des soupapes en cliquant sur le bouton ci-dessous le numéro de la vanne. Le vert vif indique application d'une pression et la fermeture d'une vanne de puce (figure 2B). Activer tous les trois solutions d'entrée vannes dans l'interface du contrôleur avant d'ouvrir les régulateurs de pression. Note: Le contrôleur d'interface dispose d'une boucle de rétroaction, qui permet de suivre l'état du système. Cette fonctionnalité peut être activée en cliquant sur le "relecture" bouton dans l'interface du contrôleur.
- Ouvrez le régulateur de pression pour la couche de contrôle et initialement fixé à 15 psi, puis ouvrez le régulateur pour le débit de la couche et initialement fixé à 5 psi. Dépendancesding sur le débit souhaité, les pressions peut être ajusté ultérieurement.
- Ouvrir la soupape d'admission pour le milieu de croissance de choix pour rincer les chambres avec du milieu.
- Vérifiez les chemins d'écoulement sous le microscope. En règle générale, l'air est emprisonné dans les canaux d'écoulement et doit être retiré. En outre, les canaux de la couche de contrôle encore contenir de l'air qui doit être chassé et remplacé par l'eau des raccords de tubes (dead-end de remplissage). Deux tâches sont réalisés par jet de liquide de chacun des huit chambres à plusieurs reprises (5 psi) jusqu'à ce que tout l'air est forcé à partir des canaux dans le PDMS ("dégazage"). Remarque: L'interface du contrôleur peut être programmé pour automatiser des expériences. Ces routines peuvent également être utilisés pour dégazer la puce.
7. Les résultats représentatifs
Le but premier de l'RootChip est de combiner une plate-forme d'imagerie et un système de perfusion dans un seul appareil avec un haut niveau d'intégration. Pour démontrer la manipulationdu microenvironnement des racines on tirait les chambres avec du colorant alimentaire noir (dilution 1:4 dans un milieu de culture hydroponique) et mesuré l'échange de fluide à l'intérieur des chambres. A la pression recommandée de 5 psi, nous avons mesuré un échange complet dans les 10 secondes à un débit calculé d'environ 1,5 l / min (Figure 3).
Nous avons également observé la croissance des racines des jeunes plants, dans ce cas augmenté dans l'obscurité et fourni avec 10 mM de glucose comme source d'énergie externe (Figure 4). Selon les conditions de croissance tels que la lumière et la composition du milieu, les plantes peuvent être observées dans le RootChip pour un maximum de trois jours.
Le RootChip a été utilisé pour surveiller les niveaux de glucose intracellulaire et galactose dans les racines exprimant nanocapteurs génétiquement codés, sur la base de Förster Resonance Energy Transfer (FRET) 5-7. Roots dans la puce ont été perfusés avec des impulsions carrées de glucose ou de solution de galactose ( Figure 5). Les concentrations intracellulaires de sucres ont été surveillés et sont présentés ici exprimée comme un rapport de l'intensité de la Citrine fluorophore accepteur de l'intensité de l'ECFP donateurs. La hausse du ratio indique l'accumulation de sucre.
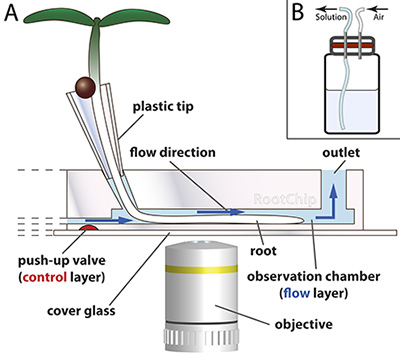
Figure 1. Principe RootChip.
- Le RootChip dispose de huit chambres d'observation pour la croissance et l'imagerie des racines. Les premières graines germent dans des cônes en plastique - fabriqués à partir de pointes de pipette en plastique - qui sont remplis d'un milieu solide. L'extrémité de la racine se développe à travers le milieu et parvient dans la chambre où un flux continu de milieu liquide maintient les conditions dans la chambre de constante. Vannes micromécanique (rouge) de contrôler le flux. La puce est montée sur une vitre de protection optique.
Le dessin n'est pas à l'échelle. (Adapté avec la permission de Grossmann et al., 2011 Plant Cell.) - Scheme d'un flacon de solution sous pression à membrane (rouge).
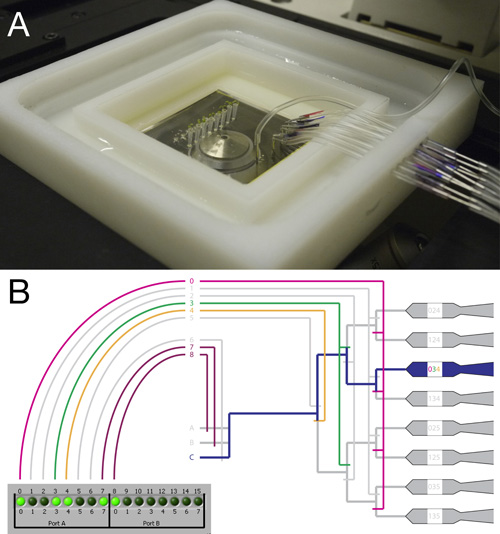
Figure 2. Raccordement et montage de la RootChip.
- Vue du haut de la RootChip entièrement connecté et le transporteur monté sur un microscope inversé.
- Schéma illustrant le système de vannes et de l'interface du contrôleur. Un exemple pour une soupape de réglage pour guider l'écoulement de fluide à une chambre unique est représenté. Alors que les vannes 4 à 8 soupapes agissent comme simples, les vannes de 0 à 3 acte en groupes. Avec ce système, une chambre individuelle peut être adressée par l'activation d'une combinaison de vannes.
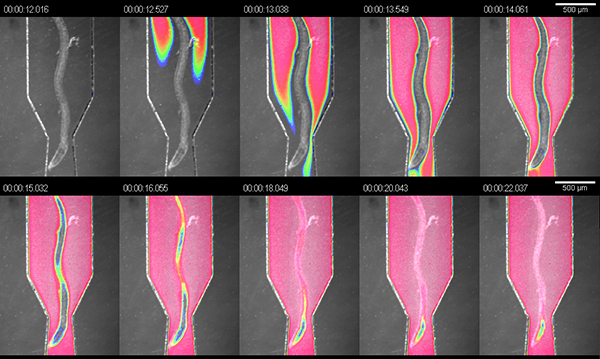
Figure 3. Échange de solutions dans le ch observationambres. visualisation de l'échange de fluide dans une chambre d'observation en utilisant une solution de colorant. L'image est une superposition de champ lumineux et fausses couleurs intensité du signal de colorant.
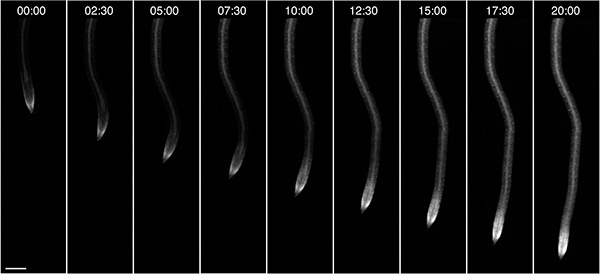
Figure 4. La croissance des racines sur puce. Observation d'une racine unique de plus en plus l'expression d'un fluorescent FRET nanocapteur pour le glucose / galactose au cours de 20h. Format de l'heure: hh: mm; barre d'échelle: 100 um.
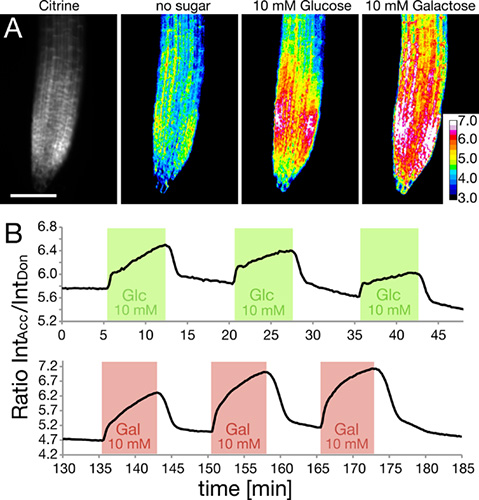
Figure 5. Mesurer le taux de sucre intracellulaires à l'aide FRET nanocapteurs.
- Le montant de la sonde est indiqué que l'intensité de citrine dans le bout de la racine (à gauche). La réponse de l'intracellulaire FRET nanocapteur à l'application de glucose ou une solution de galactose est représenté sous forme d'images ratiométriques. (Adapté avec la permission de Grossmann et al., 2011 PlaCellule nt) La barre d'échelle:. 100 um.
- Tracing FRET changements de rapport en réponse à trois répétées des impulsions carrées de glucose (vert) et le galactose (rouge).
Discussion
Les principaux avantages de la croissance par rapport aux méthodes RootChip classiques sont la préparation peu invasive pour la microscopie, la capacité de façon réversible et à plusieurs reprises de modifier l'environnement root, et la capacité d'observation continue du tissu développemental compétent et physiologiquement sain sur une période de plusieurs jours. Auparavant, les plants ont été cultivés à la verticale sur des supports gélifiés et transféré à un système de perfusion immédiatement avant l'expérience, ce qui a permis que la mesure de racines simples à un moment 8. Outils microfluidiques ont été utilisés pour Arabidopsis, mais à un niveau faible intégration 9 ou sans contrôle 10 perfusion. Le RootChip combine un niveau d'intégration élevé avec la possibilité d'automatiser des expériences par le biais des conseils précis du débit. Un autre avantage de cette plate-forme, caractéristique de tous les dispositifs microfluidiques 11, est que seules des quantités minimes de liquide sont tenus de fournir à la racine avec l'écrou nécessaireRients, même pour les expériences de plusieurs jours. Le RootChip est actuellement conçu comme un dispositif à usage unique, mais puisque les coûts de production de puces sont faibles, les faibles quantités de réactifs consommés rend la puce reste très rentable.
Il ya quelques étapes essentielles qui doivent être prises pour garantir la santé des plants:
Le volume dans les cônes en plastique n'est pl 3-4, qui va commencer à sécher lorsqu'elle est exposée à l'air. Par conséquent, il est essentiel que les cônes sont transférés sur la puce rapidement et l'humidité est maintenue élevée jusqu'à ce que les racines ont atteint les chambres d'observation, qui leur fournissent suffisamment d'eau. Étapes 4.2 à 4.5 doit être effectuée rapidement et sans interruption pour éviter le dessèchement des plants.
Étapes 3.5 - 3.8 décrire l'incubation de la puce dans des milieux liquides au cours de laquelle les racines se développent dans les chambres d'observation. Cette étape peut être ignorée par le montage de la puce dans le carrier immédiatement et de départ de perfusion constante avec un milieu de croissance. Toutefois, nous recommandons le trempage dans un milieu de croissance pendant une nuit, comme il a quelques avantages: 1) il crée un environnement humide de sorte que les plants sont moins susceptibles de se dessécher à mesure qu'ils grandissent dans la chambre d'observation; 2) la puce est trempé dans un liquide, de sorte dégazage (étape 6.4) est plus rapide.
Il est important d'utiliser les médias avec de faibles concentrations de soluté. Des solutions plus concentrées peuvent précipiter et de boucher les canaux, surtout si la puce est utilisée sur plusieurs jours.
Une fois que le terminal est connecté à la conduite de pression d'air, le flux de milieu est contrôlée en changeant la pression hydraulique dans les vannes. Afin de garantir une bonne fermeture des vannes micromécaniques, il est important de choisir une pression de commande qui est environ trois fois plus élevé que la pression d'écoulement. La pression d'écoulement ne doit pas dépasser 15 psi que le fluide sera poussé sur les entrées de racines. Des pressions plus élevées may aussi causer la délamination de la puce, ce qui rend inutilisable le chip.
Une limitation de la RootChip est que le PDMS est poreuse et hydrophobe. Alors que le matériau est pratiquement inerte à des solutions aqueuses, il peut absorber les composés organiques 12. Cela peut interférer avec un échange rapide de solutions que les composés organiques peuvent couler de la matière même lorsque l'alimentation de ce composé a été arrêté à l'entrée. En raison de la porosité, l'utilisation de solvants organiques peut provoquer un gonflement du PDMS 12.
On continuer à optimiser la RootChip et s'étendent son utilité, par exemple avec des racines de plantes cultivées. Nous croyons que par l'amélioration de l'accès à la racine pour les traitements et d'observation, les outils microfluidiques comme le RootChip va ouvrir de nouvelles dimensions de la recherche des racines.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions Philipp Denninger de l'aide pour la préparation et vidéo Bhavna Chaudhuri pour fournir des lignes de plantes exprimant FRET capteurs. Ce travail a été soutenu par des subventions de la National Science Foundation (MCB 1021677), le ministère de l'Énergie (DE-FG02-04ER15542) à WBF, le National Institutes of Health, et le Howard Hughes Medical Institute à SRQGG a été soutenu par une longue EMBO terme de bourses. MM a été soutenu par la Fondation Alexander von Humboldt.
matériels
| Name | Company | Catalog Number | Comments |
| Articles | Source | Informations | |
| Support de puce, de logiciels et d'autres informations. | Carnegie Institution - DPB | Des fichiers de CAO et CNC pour la fabrication de support, logiciel de commande et de plus amples informations sont disponibles pour téléchargement sur le site http://dpb.carnegiescience.edu/technology/rootchip~~HEAD=NNS transporteurs peuvent également être commandés à partir de ce site. | |
| RootChip | Stanford Fonderie | Dessins de masques et de protocoles de fabrication sont disponibles sur demande. Prêt-à-utiliser RootChips peut être commandé auprès http://www.stanford.edu/group/foundry/ | |
| Contrôleur de carte à puce | -Maison construite- | Le système de vanne automatique de contrôleur a été initialement développé par Rafael Gómez-Sjöberg, Lawrence Berkeley National Lab. Une instruction détaillée comment construire votre propre contrôleur de vanne actionné peut être trouvé à https://sites.google.com/a/lbl.gov/microfluidics-lab/valve-controllers |
Références
- Grossmann, G. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23, 4234-4240 (2011).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288, 113-116 (2000).
- Okumoto, S., Jones, A., Frommer, W. B. Quantitative Imaging with Fluorescent Biosensors: Advanced Tools for Spatiotemporal Analysis of Biodynamics in Cells. Annu. Rev. Plant Biol. , (2012).
- Loqué, D., Lalonde, S., Looger, L. L., von Wirén, N., Frommer, W. B. A cytosolic trans-activation domain essential for ammonium uptake. Nature. 446, 195-198 (2007).
- Okumoto, S. Imaging approach for monitoring cellular metabolites and ions using genetically encoded biosensors. Curr. Opin. Biotechnol. 21, 45-54 (2010).
- Fehr, M., Frommer, W. B., Lalonde, S. Visualization of maltose uptake in living yeast cells by fluorescent nanosensors. Proc. Natl. Acad. Sci. USA. 99, 9846-9851 (2002).
- Takanaga, H., Chaudhuri, B., Frommer, W. B. GLUT1 and GLUT9 as major contributors to glucose influx in HepG2 cells identified by a high sensitivity intramolecular FRET glucose sensor. Biochim. Biophys. Acta. 1778, 1091-1099 (2008).
- Chaudhuri, B., Hörmann, F., Frommer, W. B. Dynamic imaging of glucose flux impedance using FRET sensors in wild-type Arabidopsis plants. J. Exp. Bot. 62, 2411-2417 (2011).
- Meier, M., Lucchetta, E. M., Ismagilov, R. F. Chemical stimulation of the Arabidopsis thaliana root using multi-laminar flow on a microfluidic chip. Lab Chip. 10, 2147-2153 (2010).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98, 263703-26 (2011).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Lee, J. N., Park, C., Whitesides, G. M. Solvent Compatibility of Poly(dimethylsiloxane)-Based Microfluidic Devices. Anal. Chem. 75, 6544-6554 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon