Method Article
Time-lapse imaging di fluorescenza della crescita Root Arabidopsis con manipolazione accelerato dell'ambiente root usando il RootChip
In questo articolo
Riepilogo
Questo articolo fornisce un protocollo per la coltivazione di piantine di Arabidopsis in RootChip, una piattaforma di imaging microfluidico che combina controllo automatizzato delle condizioni di crescita con il monitoraggio radice al microscopio e FRET-based misura i livelli di metaboliti intracellulari.
Abstract
Le funzioni principali come l'ancoraggio fisico della pianta ed è l'organo responsabile per l'assorbimento delle sostanze nutritive e di acqua minerale, quali elementi azoto, fosforo, solfato e la traccia che acquisiscono le piante dal terreno. Se vogliamo sviluppare approcci sostenibili alla produzione di colture ad alto rendimento, abbiamo bisogno di capire meglio come la radice si sviluppa, occupa un ampio spettro di nutrienti, e interagisce con gli organismi simbiotici e patogeni. Per raggiungere questi obiettivi, dobbiamo essere in grado di esplorare le radici in dettaglio microscopico su periodi di tempo che vanno da minuti a giorni.
Abbiamo sviluppato il RootChip, un polidimetilsilossano (PDMS) - dispositivo basato su microfluidica, che ci permette di crescere e radici immagini da piantine di Arabidopsis evitando qualsiasi stress fisico alle radici durante la preparazione per l'imaging 1 (figura 1). Il dispositivo contiene una struttura biforcata canale dotato di valvole micromeccanici per guidare il flusso del fluidoda insenature soluzione a ciascuno degli otto camere di osservazione 2. Questo sistema permette la perfusione microambiente radice da controllare e modificato con precisione e rapidità. Il volume delle camere è di circa 400 nl, richiedendo così soltanto quantità minime di soluzione campione.
Qui forniamo un protocollo dettagliato per studiare la biologia root sul RootChip utilizzando l'imaging basate su approcci con la risoluzione in tempo reale. Le radici possono essere analizzati più giorni utilizzando la microscopia lasso di tempo. Roots può essere perfuso con soluzioni nutritive o inibitori, e fino a otto giovani pianta possono essere analizzati in parallelo. Questo sistema ha il potenziale per una vasta gamma di applicazioni, compresa l'analisi della crescita delle radici in presenza o assenza di sostanze chimiche, basato sulla fluorescenza analisi di espressione genica, e l'analisi dei biosensori, ad esempio FRET nanosensori 3.
Protocollo
Nota: eseguire tutte le fasi fasi preparatorie in condizioni sterili.
1. Preparazione del Coni in plastica per germinazione dei semi
- Riempire a 10 centimetri capsula Petri con terreno di coltura contenente 1% di agar a uno spessore di 5 mm. Usiamo un punto di forza un mezzo modificato Hoagland media 4, ma la composizione media dovrebbe essere scelto in base alle singole esigenze sperimentali.
- Mentre il mezzo è ancora liquido, utilizzare una pipetta multicanale per riempire puntali 10 microlitri con 5 microlitri di terreno dalla piastra di Petri.
- Conservare le punte piene nella casella di punta della pipetta fino a quando il terreno è solido, quindi tagliare a 4 coni di plastica mm di lunghezza e mettere in piedi in una capsula di Petri contenente terreno solido di crescita.
2. Germinazione dei semi e la crescita delle piantine
- Surface sterilizzare semi in 5% NaOCl per 5 min, lavare tre volte con acqua sterile, quindi inserire un singolo seme sopra l'del mezzo-riempita conos.
- Sigillare il piatto con del nastro Micropore (3M) e conservare a 4 ° C per sincronizzare la germinazione.
- Dopo tre giorni, trasferire i piatti per un armadio di crescita per iniziare la germinazione. Le nostre condizioni di crescita sono 23 ° C ad una 16h ciclo di alta light/8h scuro (intensità luminosa: 100 μE m -2 s -1).
- Tra il 5 e 7 giorni dopo la germinazione, le piantine devono essere pronti per il trasferimento al RootChip. A questo punto, punte delle radici dovrebbe essere vicino ai scarichi di fondo dei coni di plastica. Controllare la salute piantina, lunghezza radice e, se del caso, espressione di un marcatore fluorescente sotto un microscopio da dissezione.
- Segna singole piantine per il trasferimento sul chip. Selezionare una decina di piantine nel caso in cui uno è danneggiato durante il trasferimento.
3. Trasferimento di piantine sul RootChip
- Per sterilizzare il RootChip per esperimenti a lungo termine, avvolgereil dispositivo in carta velina, posto in un piatto di vetro Petri, e autoclave.
- Una volta che il RootChip si è raffreddato, coprire con terreno di coltura liquido. Il RootChip dovrebbe essere completamente immerso, ma il livello del liquido dovrebbe essere non più di 3 mm dalla superficie RootChip.
- Con una pipetta 20 microlitri, tirare mezzo attraverso l'ingresso e uscita della camera principale per riempire la camera di osservazione con il terreno.
- Coni di plastica Plug selezionato al punto 2.5 in RootChip le insenature. I coni devono adattarsi comodamente alle bocche di porto. Poiché il RootChip è montato su uno strato sottile di vetro ottico, non applicare una pressione eccessiva al chip.
- Incubare la RootChip notte in mezzo liquido. Per evitare galleggiante, posizionare due lastre di vetro sul chip. Aggiungere una barra di agitazione magnetica e chiudere il piatto.
- Trasferire l'assemblea a un agitatore magnetico e agitare delicatamente il mezzo.
- Il insenature RootChip si incrociano i canali in un angolo di 30 ° al dispositivo normale FACIlitate crescita delle radici nei canali (Figura 1A). Per supportare ulteriormente la crescita nella direzione desiderata, inclinare leggermente il gruppo inserendo un vetrino sotto la capsula di Petri sul lato opposto del circuito delle uscite.
- Per mantenere il ciclo luce / buio, illuminare le piante con una lampada anello (intensità luminosa: 100 μE m -2 s -1) collegato a un timer.
4. Collegamento del RootChip al Vettore
- Il giorno seguente, riempire un sigillabile, fiala pressurizzabile con terreno di coltura liquido (Figura 1B).
- Capovolgere il chip carrier e posizionarlo su una superficie stabile. Rimuovere il RootChip dal mezzo liquido e inserirla lato PDMS basso nell'apertura inferiore del chip carrier. Orient il chip in modo che il lato che contiene le bocche di controllo di livello è di fronte al lato dei connettori pressione tubi linea nella parete laterale vettore.
- Essiccare il vetro di copertura sulfondo del chip delicatamente blotting con carta velina. Fissare il RootChip al vettore con nastro ea destra tutta l'assemblea.
- Connettori tubi sono ottenuti tagliando tubo flessibile in plastica microbore (TYGON, 0.20 "ID x 0.060" OD) in pezzi lunghi 5 cm e il collegamento a tubi in acciaio inox microbore (New England piccolo tubo, 0.025 "OD x 0,013" ID x 0,75 " lungo). Riempire i connettori tubi con acqua utilizzando una siringa e spina ciascun connettore tubo nell'ingresso corrispondente livello di controllo sul chip. L'acqua poi riempire i canali di controllo di livello e possono essere usate per trasmettere la pressione alle valvole micromeccanica.
- Inserire le estremità opposte delle linee nei supporti / flacone soluzione (s). Applicare pressione sul flacone della soluzione con una siringa d'aria. L'incremento della pressione dell'aria all'interno della fiala soluzione forzerà liquida nelle linee.
5. Montaggio del RootChip al microscopio
- Posizionare il vettore sul microscfase di Ope. Per ridurre la possibilità del Gruppo di cambio nel corso dell'esperimento a causa delle vibrazioni nella camera, il vettore deve adattarsi esattamente nelle tacche dell'inserto stadio.
- Le valvole di chip e il flusso del fluido attraverso il chip sono controllati dalla pressione dell'aria. Due linee con regolatori sono ramificati fuori di una linea di pressione principale - uno viene utilizzato per controllare il flusso medio attraverso i canali, e l'altro è collegato ad sfiati elettrovalvole che azionano le valvole push-up del livello di controllo. Le elettrovalvole sono azionate dal computer attraverso la valvola USB controller (sviluppato da Rafael Gómez-Sjöberg, Lawrence Berkeley National Lab). Chiudere entrambi i regolatori di pressione prima di collegare il chip.
- Aggiungere alcuni ml di acqua ai serbatoi del vettore per mantenere l'alto tasso di umidità all'interno del gruppo. Questa operazione deve essere ripetuta nel corso di lunghi esperimenti per mantenere le piante si secchino. Mantenere il volume basso per ridurre al minimo tegli quantità di liquido che potrebbe essere versato sul microscopio. Per esperimenti a lungo termine, il deflusso dai punti vendita di chip possono essere guidati nei serbatoi del vettore collegando i punti vendita di chip per i serbatoi con tubi microbore (vedi punto 4.4). In alternativa, il deflusso che si accumula sulla superficie del chip possono essere raccolti per pipettamento.
- Preparare fogli a quadretti di plastica trasparente da protezioni in lamiera (C-Line). Fissare la plastica trasparente per il vettore da nastro biadesivo per mantenere l'umidità elevata nel gruppo.
- Posizionare la luce ad anello sopra il chip e mantenere il ciclo luce / buio. La luce 'anello deve essere spento prima dell'inizio di ogni esperimento che utilizza marcatori fluorescenti, come l'illuminazione diretta interferisce con collezione di immagini.
6. Funzionamento del RootChip utilizzando l'interfaccia LabView
L'interfaccia di controllo RootChip per la piattaforma software LabVIEW è in gradoessere scaricato dal nostro sito http://dpb.carnegiescience.edu/technology/rootchip .
- Le valvole sul chip sono chiusi applicando pressione al livello di controllo, in questo caso aprendo le elettrovalvole aria. L'interfaccia di controllo consente l'attivazione delle valvole facendo clic sul pulsante qui sotto il numero della valvola. Verde brillante indica applicazione di pressione e la chiusura di una valvola di chip (Figura 2B). Attivare tutte e tre le soluzioni, le valvole di aspirazione a l'interfaccia di controllo prima di aprire i regolatori di pressione. Nota: L'interfaccia di controllo dispone di un anello di retroazione, che consente il monitoraggio dello stato del sistema. Questa funzione può essere attivata facendo clic sul pulsante "rilettura" nell'interfaccia controller.
- Aprire il regolatore di pressione per il livello di controllo ed inizialmente è impostato a 15 psi, quindi aprire il regolatore per il livello di flusso e inizialmente impostata a 5 psi. DipendenzaDing sulla portata desiderata, le pressioni possono essere regolato in seguito.
- Aprire la valvola di aspirazione per mezzo di crescita di scelta per lavare le camere con il terreno.
- Controllare percorsi di flusso sotto il microscopio. Tipicamente, aria viene intrappolata nei canali di flusso e deve essere rimosso. Inoltre, i canali del livello di controllo contengono ancora aria che deve essere forzata e sostituito dal l'acqua dai connettori di tubi (morto-end riempimento). Entrambi i compiti vengono raggiunti da lavaggio ciascuno degli otto volte più camere (5 psi) fino a quando tutta l'aria viene forzata dai canali nel PDMS ("degasaggio"). Nota: L'interfaccia di controllo può essere programmato per automatizzare esperimenti. Routine può anche essere utilizzato per degassare il chip.
7. Risultati rappresentativi
Lo scopo principale del RootChip è di combinare una piattaforma di imaging e un sistema di perfusione in un unico dispositivo con un elevato livello di integrazione. Per dimostrare la manipolazioneil microambiente di radici arrossimmo le camere con colorante alimentare scuro (diluizione 1:4 in ambiente idroponico) e misurato lo scambio di fluido all'interno delle camere. Alla pressione raccomandata di 5 psi abbiamo misurato uno scambio completo entro 10 secondi ad una portata calcolata di circa 1,5 microlitri / min (Figura 3).
Abbiamo osservato inoltre la crescita delle radici di piante, in questo caso coltivati al buio e fornito con 10 mM di glucosio come fonte di energia esterna (Figura 4). A seconda delle condizioni di crescita quali la luce e la composizione del mezzo, le piante possono essere osservato nel RootChip per un massimo di tre giorni.
La RootChip è stato usato per monitorare i livelli di glucosio e galattosio intracellulare in radici esprimono nanosensori geneticamente codificati, basato sul trasferimento di Förster Resonance Energy (FRET) 5-7. Radici nel chip sono stati perfusi con impulsi quadrati o soluzione di glucosio galattosio ( Figura 5). I livelli intracellulari di zuccheri sono stati monitorati e sono mostrati qui espresso come rapporto dell'intensità della Citrine fluoroforo accettore all'intensità del ECFP donatore. L'aumento nel rapporto indica accumulo di zucchero.
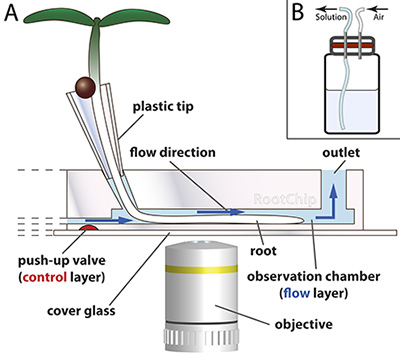
Figura 1. RootChip principio.
- Il RootChip dispone di otto camere di osservazione per la crescita e l'imaging di radici. I semi germinano prima in coni di plastica - fabbricato da puntali di plastica - che sono pieni di terreno solido. La punta radice cresce attraverso il mezzo e raggiunge la camera in cui un flusso continuo di liquido mantiene le condizioni nella camera costante. Valvole di micromeccanica (rosso) controllare il flusso. Il chip è montato su un vetro di copertura ottico.
Disegno non in scala. (Adattato con il permesso di Grossmann et al., 2011 Plant Cell). - Scheme di una fiala di soluzione pressurizzabile con membrana (rosso).
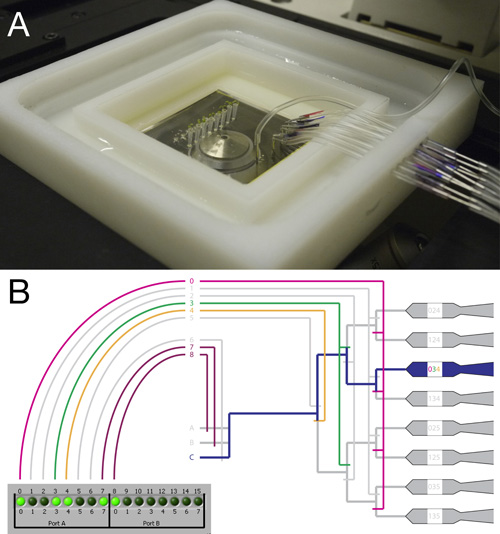
Figura 2. Collegamento e montaggio del RootChip.
- Vista dall'alto del RootChip completamente connessa e il supporto montato su un microscopio invertito.
- Schema illustrante il sistema di otturatore e l'interfaccia di controllo. Un esempio di una valvola di taratura per guidare il flusso di fluido ad una singola camera è mostrato. Mentre valvole 4 a 8 funge da valvola singole, valvole da 0 a 3 atto a gruppi. Con questo sistema una camera singola possono essere affrontate attivando una combinazione di valvole.
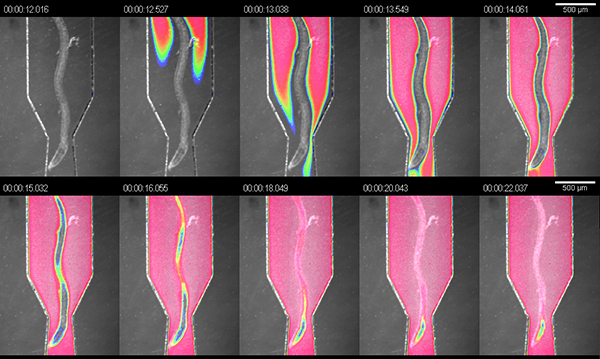
Figura 3. Scambio di soluzioni nel ch osservazioneambre. visualizzazione dello scambio di fluido in una camera di osservazione usando soluzione colorante. L'immagine è una sovrapposizione di campo chiaro e falsi colori intensità del segnale colorante.
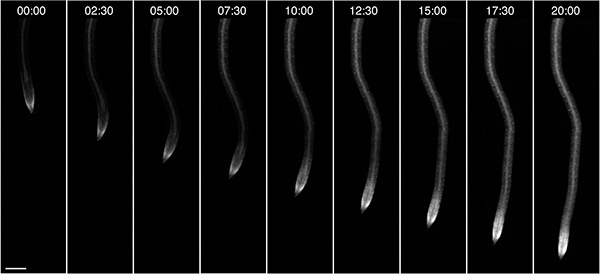
Figura 4. On-Chip crescita delle radici. Osservazione di una singola radice crescente esprimere una fluorescente FRET nanosensori di glucosio / galattosio nel corso di 20h. Formato ora: hh: mm, barra di scala: 100 micron.
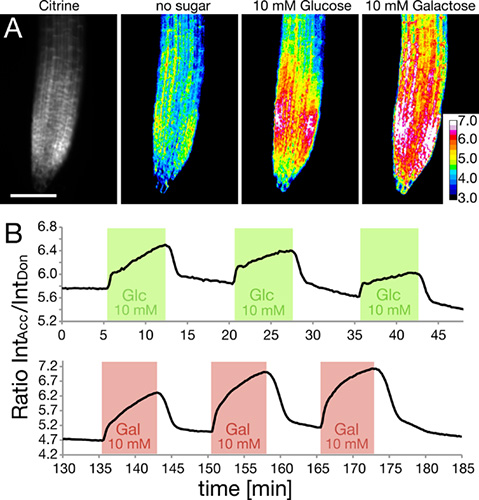
Figura 5. Misura i livelli di zucchero intracellulari mediante FRET nanosensori.
- La quantità di sensore viene indicato come intensità citrino all'interno della punta della radice (a sinistra). La risposta del intracellulare FRET nanosensori all'applicazione di glucosio o galattosio soluzione è mostrata come immagini raziometrici. (Adattato con il permesso di Grossmann et al., 2011 Plant Cell) bar Scala:. 100 um.
- Analisi FRET rapporto cambia in risposta a tre impulsi ripetuti quadrati di glucosio (verde) e galattosio (rosso).
Discussione
I vantaggi principali del RootChip rispetto ai metodi convenzionali di crescita sono la preparazione minimamente invasivo per la microscopia, la capacità di alterare reversibilmente e ripetutamente l'ambiente radice, e la capacità di osservazione continua di tessuto evolutivamente competente e fisiologicamente sano per un periodo di diversi giorni. In precedenza, piantine sono state cresciute verticalmente su supporti gelificati e trasferiti ad un sistema di perfusione immediatamente prima dell'esperimento, che ha consentito solo misurando radici uno alla volta 8. Strumenti microfluidici sono stati utilizzati per Arabidopsis, ma su un livello di integrazione basso 9 o senza controllo perfusione 10. Il RootChip combina un elevato livello di integrazione con la possibilità di automatizzare gli esperimenti attraverso l'orientamento del flusso preciso. Un altro vantaggio di questa piattaforma, caratteristica di tutti i dispositivi microfluidici 11, è che solo quantità minime di liquido sono tenuti a fornire alla radice con il dado necessariaRients, anche per gli esperimenti che coprono diversi giorni. Il RootChip è attualmente concepito come un dispositivo monouso, ma dal momento che i costi di produzione di chip sono bassi, le piccole quantità di reagenti consumati rende il chip ancora molto conveniente.
Ci sono alcuni punti critici che devono essere adottate per garantire la salute delle piantine:
Il volume dei coni di plastica è solo ul 3-4, che inizierà ad asciugare se esposto all'aria. Quindi è importante che i coni vengono trasferiti sul chip rapidamente e l'umidità è mantenuta alta fino a quando le radici hanno raggiunto le camere di osservazione, che li alimentano con acqua sufficiente. Passi 4.2 a 4.5 devono essere eseguite in modo rapido e senza interruzioni per evitare l'essiccazione delle piantine.
Passi 3.5 - 3.8 descrivono l'incubazione del chip in mezzi liquidi durante il quale le radici crescono nelle camere di osservazione. Questo passaggio può essere saltato montando il chip nel carrier immediatamente e partendo perfusione costante con terreno di crescita. Tuttavia, si consiglia ammollo nel mezzo di crescita per tutta la notte, in quanto ha alcuni vantaggi: 1) crea un ambiente umido in modo che le piantine sono meno probabilità di diventare essiccata man mano che crescono nella camera di osservazione; 2) il chip è imbevuta di liquido, in modo degassamento (step 6.4) sarà più veloce.
E 'importante utilizzare supporti con basse concentrazioni di soluto. Le soluzioni più concentrate possono precipitare e intasare i canali, specialmente se il chip viene utilizzato per diversi giorni.
Una volta che il dispositivo è collegato alla linea di pressione dell'aria, il flusso del fluido è controllata regolando la pressione idraulica nelle valvole. Per garantire la corretta chiusura delle valvole micromeccanici, è importante scegliere una pressione di comando che è circa tre volte superiore alla pressione del flusso. La pressione del flusso non deve superare i 15 psi come il fluido verrà spinto fuori delle bocche di radice. Pressioni più elevate ragazzoy anche causare delaminazione del chip, il che rende inutilizzabile chip.
Una limitazione è che RootChip PDMS è poroso e idrofobo. Mentre il materiale è praticamente inerti di soluzioni acquose, può assorbire composti organici 12. Questo può interferire con un rapido scambio di soluzioni di composti organici potrebbe fuoriuscire dal materiale, anche quando la fornitura di questo composto è stato fermato all'ingresso. A causa della porosità, che utilizza solventi organici può causare gonfiore del PDMS 12.
Si continua a ottimizzare il RootChip ed estendere la sua utilità, ad esempio con radici delle piante coltivate. Siamo convinti che migliorando l'accesso alla radice per i trattamenti e di osservazione, strumenti come la microfluidica RootChip aprirà nuove dimensioni della ricerca root.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Ringraziamo Philipp Denninger aiuto con video di preparazione e Bhavna Chaudhuri per la fornitura di linee di piante che esprimono FRET sensori. Questo lavoro è stato supportato anche da finanziamenti della National Science Foundation (MCB 1.021.677), il Dipartimento dell'Energia (DE-FG02-04ER15542) al WBF, il National Institutes of Health, e la Howard Hughes Medical Institute a SRQGG è stato sostenuto da un lungo EMBO termine borsa di studio. MM è stato sostenuto dalla Alexander von Humboldt Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Articoli | Fonte | Informazioni | |
| Chip carrier, software e altre informazioni. | Carnegie Institution - DPB | File CAD e CNC per la fabbricazione del vettore, il software di controllo e ulteriori informazioni sono disponibili per il download dal sito http://dpb.carnegiescience.edu/technology/rootchip~~HEAD=NNS portatori possono essere ordinati anche da questo sito. | |
| RootChip | Stanford Foundry | Disegni Maschera e protocolli di fabbricazione sono disponibili su richiesta. Ready-to-use RootChips può essere ordinato presso http://www.stanford.edu/group/foundry/ | |
| Chip di controllo | -Casa costruita- | Il sistema automatico di controllo della valvola è stato originariamente sviluppato da Rafael Gómez-Sjöberg, Lawrence Berkeley National Lab. Un istruzioni dettagliate su come costruire il vostro proprio controllore valvola di azionamento può essere trovato alla https://sites.google.com/a/lbl.gov/microfluidics-lab/valve-controllers |
Riferimenti
- Grossmann, G. The RootChip: An Integrated Microfluidic Chip for Plant Science. Plant Cell. 23, 4234-4240 (2011).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288, 113-116 (2000).
- Okumoto, S., Jones, A., Frommer, W. B. Quantitative Imaging with Fluorescent Biosensors: Advanced Tools for Spatiotemporal Analysis of Biodynamics in Cells. Annu. Rev. Plant Biol. , (2012).
- Loqué, D., Lalonde, S., Looger, L. L., von Wirén, N., Frommer, W. B. A cytosolic trans-activation domain essential for ammonium uptake. Nature. 446, 195-198 (2007).
- Okumoto, S. Imaging approach for monitoring cellular metabolites and ions using genetically encoded biosensors. Curr. Opin. Biotechnol. 21, 45-54 (2010).
- Fehr, M., Frommer, W. B., Lalonde, S. Visualization of maltose uptake in living yeast cells by fluorescent nanosensors. Proc. Natl. Acad. Sci. USA. 99, 9846-9851 (2002).
- Takanaga, H., Chaudhuri, B., Frommer, W. B. GLUT1 and GLUT9 as major contributors to glucose influx in HepG2 cells identified by a high sensitivity intramolecular FRET glucose sensor. Biochim. Biophys. Acta. 1778, 1091-1099 (2008).
- Chaudhuri, B., Hörmann, F., Frommer, W. B. Dynamic imaging of glucose flux impedance using FRET sensors in wild-type Arabidopsis plants. J. Exp. Bot. 62, 2411-2417 (2011).
- Meier, M., Lucchetta, E. M., Ismagilov, R. F. Chemical stimulation of the Arabidopsis thaliana root using multi-laminar flow on a microfluidic chip. Lab Chip. 10, 2147-2153 (2010).
- Parashar, A., Pandey, S. Plant-in-chip: Microfluidic system for studying root growth and pathogenic interactions in Arabidopsis. Appl. Phys. Lett. 98, 263703-26 (2011).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Lee, J. N., Park, C., Whitesides, G. M. Solvent Compatibility of Poly(dimethylsiloxane)-Based Microfluidic Devices. Anal. Chem. 75, 6544-6554 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon