Method Article
Implantation du coeur artificiel total SynCardia
Dans cet article
Résumé
Le but de cette revue est de passer brièvement en revue les indications, la gestion et les résultats pour le cœur artificiel total. techniques opératoires de la vidéo pour l'implantation du dispositif sont présentées.
Résumé
Avec les progrès technologiques, l'utilisation de dispositifs d'assistance circulatoire mécanique de l'insuffisance cardiaque en phase terminale a augmenté rapidement. La grande majorité de ces patients sont généralement bien desservi par les dispositifs d'assistance ventriculaire gauche (DAVG). Cependant, un sous-ensemble de patients atteints d'insuffisance biventriculaire à un stade avancé ou d'autres lésions anatomiques importantes ne sont pas traitées adéquatement par un support mécanique ventriculaire gauche isolée. Des exemples de pathologie cardiaque concomitante qui peuvent être mieux traités par résection et TAH remplacement comprend: après infarctus ventriculaire défaut septal, anévrysme aortique racine / dissection, l'échec d'allogreffe cardiaque, massif thrombus ventriculaire, arythmies malignes réfractaires (indépendants de pressions de remplissage), hypertrophique / restrictive cardiomyopathie, et une cardiopathie congénitale complexe. Les patients présentent souvent avec choc cardiogénique et le dysfonctionnement de plusieurs organes du système. Excision des deux ventricules et le remplacement orthotopique avec un artifici totalecoeur ial (TAH) est un moyen efficace, quoique extrême, la thérapie pour la restauration rapide de la circulation sanguine et la réanimation. Prise en charge périopératoire est axé sur la réanimation des organes cibles et la réadaptation physique. Outre les préoccupations habituelles de l'infection, saignements, et la thromboembolie commun à tous les patients pris en charge mécaniquement, les patients TAH face à des risques uniques à l'égard de l'insuffisance rénale et l'anémie. La supplémentation de la baisse brutale de peptide natriurétique cérébral suivante ventriculectomy semble avoir des effets rénaux de protection. Anémie suivante TAH implantation peut être profond et persistant. Néanmoins, l'anémie est généralement bien toléré et la transfusion sont limitées pour éviter HLA sensibilisation. Jusqu'à récemment, les patients TAH ont été confinés hospitalisés attachés à un pilote de la console £ 500 de pneumatique. L'introduction récente d'un sac à dos de taille pilote portable (actuellement en essai clinique) a permis aux patients d'être renvoyé à la maison et même retourner au travail. Malgré la profonde présenteation de ces malades, il existe un succès de 79 à 87% en pont à la transplantation.
Introduction
La première implantation humaine d'un cœur artificiel total (TAH) en 1969 a été réalisée par Denton Cooley chez un homme de 47 ans qui a été incapable de détacher de la circulation extracorporelle suivante ventriculaire gauche anévrisme. Le dispositif expérimental fourni un soutien hémodynamique pendant 64 heures jusqu'à un cœur de donneur n'a pu être trouvée. Bien que techniquement réussie, le soutien de l'appareil a été compliquée par l'hémolyse et l'insuffisance rénale. Le patient irait à mourir de submerger la septicémie 32 heures après la transplantation 1. Une seconde tentative de Cooley en 1981 a eu des résultats malheureux similaires 2. En 1982, William DeVries réalisé le premier implant permanent largement médiatisée du Jarvik-7 TAH dans un dentiste de 61 ans. Le patient avait un cours post-opératoire difficile marqué par une insuffisance respiratoire récurrente, fracture de la jambe de prothèse valvulaire mitrale nécessitant un remplacement d'appareil, la septicémie, accident vasculaire cérébral, insuffisance rénale intermittente, et des saignements liés à l'anticoagulationlation. Il a finalement succombé au bout de 112 jours pour la colite pseudomembraneuse 3.
Malgré ces résultats décevants initiales, raffinement progressif dans la conception de l'appareil, la sélection des patients, et la gestion des patients ont conduit à une amélioration sensible des résultats. Le Jarvik-7 a depuis évolué dans le SynCardia TAH, qui reste le seul approuvé par la FDA TAH dans l'utilisation clinique aujourd'hui. À ce jour, plus de 1000 implants ont été réalisées dans le monde entier 4.
Nous présentons nos techniques opératoires institutionnels dans le cadre d'un rapport de cas de vidéo.
Protocole
Présentation de cas:
Le patient est un homme de 60 ans atteint de cardiomyopathie hypertrophique. Il a développé des symptômes d'insuffisance cardiaque progressive au cours des 10 dernières années avec les récentes multiples réadmissions pour insuffisance cardiaque décompensée. Il a commencé le IV milrinone chronique et a été cotée pour la transplantation cardiaque. Son PMH est remarquable pour arythmies auriculaires s / p ablation, embolie pulmonaire récurrente, l'hypertension pulmonaire, thrombus auriculaire gauche, et la course avant. Épreuve d'effort cardiorespiratoire a démontré une faible consommation maximale d'oxygène (VO 2 max 10,6 ml / kg min). Imaging a été marquée par de graves hypertrophie ventriculaire gauche modérée à grave altération de la fonction systolique, et aucune obstruction LV sorties de voies (FEVG 25-30%, LVIDd 5,0 cm, 1,5 cm IVSd, LVPWd 1,5 cm). Il avait un gros thrombus auriculaire gauche dans l'appendice et une possible thrombus LV ainsi. Hémodynamique (sur milrinone 0,5 mcg / kg / min) étaient remarquables pour: RA 17 mmHg, PCWP 37 mmHg, PA 74/35 mmHg, et Fick CI 1.4 L/min/m2. En raison de sa myopathie restrictive et petite cavité de LV, il a été considéré comme un bon candidat pour ventriculaire gauche isolée dispositif d'assistance.
1. L'appareil
- Le cœur artificiel total SynCardia est le seul approuvé par la FDA TAH dans l'utilisation clinique. Il a été introduit en 1982 comme le coeur Jarvik-7.
- Le dispositif est constitué de deux chambres de ventricule de polyuréthane. Chaque chambre a un volume de course maximale de ~ 70 ml. Chaque chambre dispose de 2 soupapes à disque basculant (Medtronic Hall, 27 mm afflux, 25 mm écoulement) pour diriger afflux de sang et de sortie. Chaque chambre est entraîné pneumatiquement par une chaîne cinématique séparée reliée à un conducteur extérieur (figure 1).
2. Indications
- Le dispositif déplace un volume total de 400 ml ~. General taille minimum de destinataire comprennent une recommandation BSA> 1,7 m 2 et un diamètre thoracique (AP dimension colonne vertébrale à sternum au niveau de l'une0 ème vertèbre thoracique)> 10 cm (Figure 2). Placement dans les petites patients est possible en déplaçant l'appareil dans la poitrine gauche, bien que cela augmente le risque de veine pulmonaire face gauche et la compression des bronches. Un appareil de la taille plus petite pour une utilisation dans les petits patients est en cours d'élaboration et devrait dans un proche avenir.
- TAH support est indiqué chez les patients présentant un stade avancé de l'insuffisance biventriculaire sévère ou autre anomalie anatomique qui n'est pas optimale traité avec ventriculaire gauche support mécanique isolé. Ces patients présentent souvent in extremis à des complications liées à leur malperfusion. Généralement les patients sont classés comme INTERMACS (Registre interagences pour mécanique assistée assistance circulatoire) profil 1 (choc cardiogénique critique) ou 2 (diminution progressive du soutien inotrope).
- Les patients atteints de la pathologie cardiaque concomitante significative. Les patients gravement malades atteints d'insuffisance cardiaque au stade terminal nécessitant Suppo mécaniquert peut pas être traitée de manière optimale par l'addition d'autres procédures réparatrices étendus. Cela peut augmenter le risque de défaillance du ventricule droit implantation poste de LVAD, ce qui augmente le risque de morbidité et de mortalité péri-opératoire. Cela comprend: l'infarctus du myocarde aigu avec communication interventriculaire; anévrisme de la racine aortique / dissection, insuffisance cardiaque d'allogreffe, massif thrombus ventriculaire, arythmies malignes réfractaires (indépendants de pressions de remplissage), la cardiomyopathie hypertrophique / restrictive, et la maladie cardiaque congénitale complexe.
3. Préparation de l'appareil
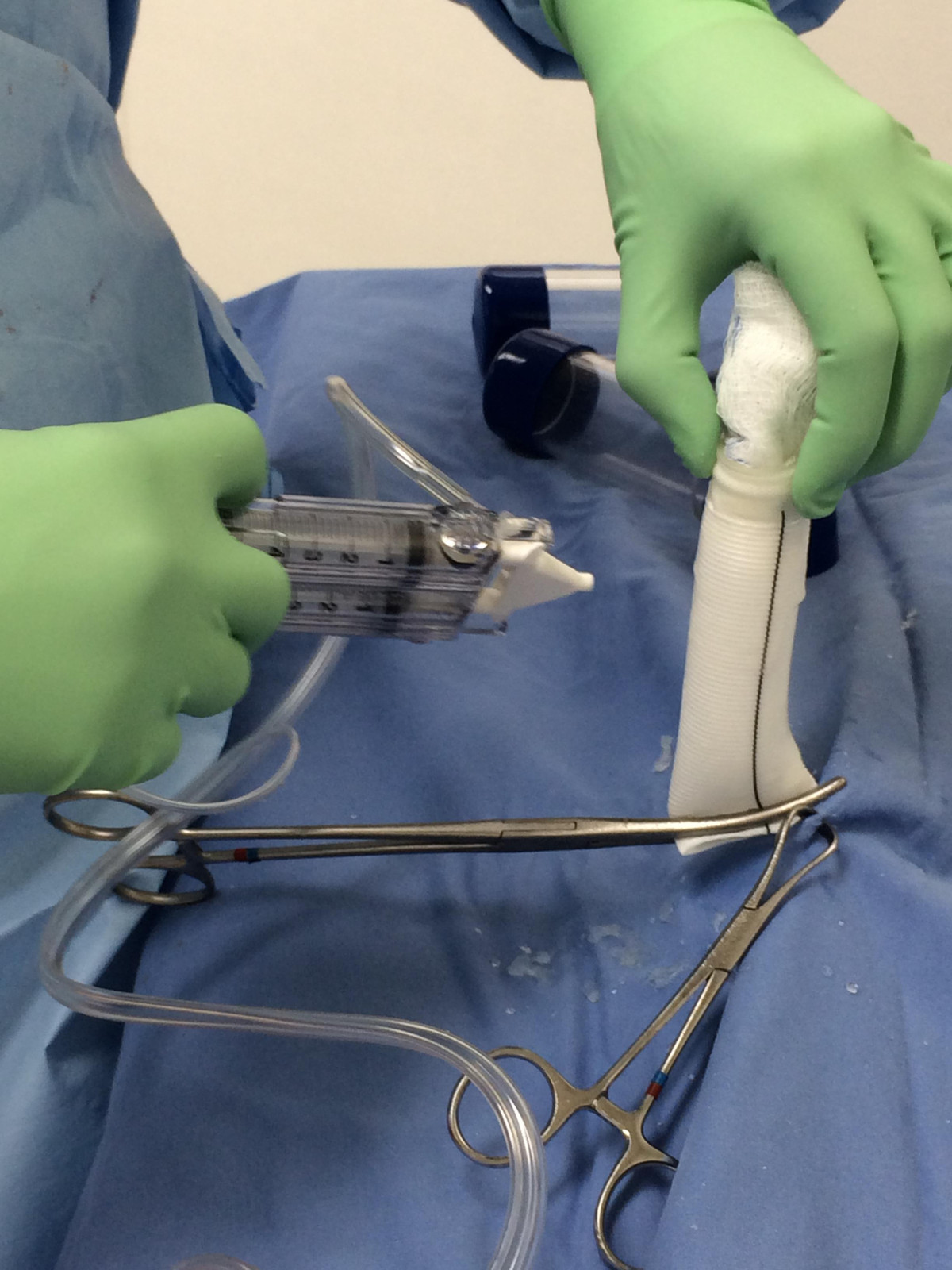
- Le aortique Dacron et greffes pulmonaires sont scellés avec CoSeal colle chirurgicale (figure 3).
- Les greffes et les appareils sont trempées dans la rifampicine.
4. Implantation
- Préparation de routine et sternotomie médiane. La poitrine et l'abdomen sont prepped dans le mode routine pour la chirurgie cardiaque et un sternot médianenomie est effectuée.
- Division de la membrane de gauche et la création d'une poche prépéritonéal abdominale supérieure gauche. Similaire à l'implant d'une assistance ventriculaire gauche, le diaphragme gauche est divisée en dedans et une poche prépéritonéal abdominale supérieure gauche est créé pour les transmissions pneumatiques. Deux incisions ~ 5-10 cm en dessous du rebord costal gauche sont prises et exécutées par l'aponévrose du grand droit. Tunnels intramusculaires pour les transmissions pneumatiques sont créés et entretenus avec deux drains Penrose 1 ".
- Canulation et l'initiation de la circulation extracorporelle. L'aorte, SVC, et IVC sont canule. Cathétérisme bicave est effectuée dans les oreillettes (vs canulation directe du SVC / IVC) à préserver les sites pour une utilisation lors de la transplantation ultérieure. Dissection inutile dans le péricarde est réduite au minimum pour préserver les tissus.
- L'aorte est serrée croix. La racine de l'aorte et l'artère pulmonaire sont divisés au niveau des commissures valvulaires. Excision du ventricule droit esta commencé le long de la marge aiguë, 1-2 cm distale et parallèle à la rainure auriculo-ventriculaire droite. Le septum interventriculaire est incisé ouverture du ventricule gauche. L'incision du ventricule droit se poursuit supérieurement dans le tractus RV de sortie. De même, l'incision du ventricule gauche est prolongé latéralement parallèlement à la rainure auriculo-ventriculaire gauche. Les sorties des voies LV est ouvert latéralement. Le septum interventriculaire restante est divisée et l'échantillon est enlevé (figure 4).
- Le sinus coronaire est suturée. Si un FOP est identifié, il est de la même suturée. L'appendice auriculaire gauche est ligaturée avec une agrafeuse endoscopique non de coupe afin d'éliminer une source potentielle de thrombus (Figures 5 et 6).
- Les feuillets de valvule mitrale et tricuspide sont excisés en laissant une manchette de plusieurs millimètres à l'espace annulaire. Les poignets sont garnis ventriculaires laissant 1 cm bord du tissu. Les poignets sont ensuite suturée avec 2-0 Prolene (MH) pour hémostasesis et de réduire la taille de l'orifice de la taille des raccords rapides auriculaires TAH. Certains centres choisissent d'utiliser une bande de renfort de feutre.
- Les poignets des raccords rapides auriculaires TAH sont garnis de 0,5-1 cm. Les poignets sont alors inversés et cousues à leurs poignets ventriculaires gauche et droit respectifs.
- De la même façon, les raccords rapides greffés de l'artère aorte et pulmonaire sont coupés. La greffe pulmonaire est laissé plusieurs centimètres de plus que la greffe aortique pour laisser place à la greffe aortique à passer en dessous. Les greffons sont cousus à leurs orifices respectifs (figure 7).
- Au moment de la ré-entrée pour une transplantation subséquente, une réponse inflammatoire intense du péricarde est souvent considérée. Dissection à travers ce tissu, au moment de la greffe peut être associée à une importante perte de sang. Cela semble être supérieure à ce qui est généralement vu pendant refaire sternotomie. Membrane péricardique s'opposent est utilisé pour aligner le péricarde et maintenirdes plans de tissu avasculaire. Ceci est commencé sur le péricarde inférolatérale gauche que l'accès à cet espace sera entravée fois que le dispositif est en place. Bandes de Prélude sont également placés autour des anastomoses aortiques et pulmonic. Certains centres utilisent tourniquets en caoutchouc stérilisés pour envelopper les anastomoses.
- Les transmissions sont passés à travers les tunnels créés précédemment. A 13-15 mm Hegar dilatateur est utilisé pour guider la transmission à travers le drain Penrose précédemment placé. Une feuille de membrane Prélude est enroulé autour des transmissions ainsi. Les connecteurs métalliques d'origine de la transmission de la console externe sont remplacés par des connecteurs en plastique qui sera également se connecter avec le conducteur de décharge portable.
- Mamelons de-sèche sur le TAH ventricules gauche et droit sont liées. La gauche, puis à droite ventricules artificiels sont vidées et ensuite connectés à leurs orifices respectifs. Les raccords rapides souples sont saisis avec 2 pilotes d'aiguilles lourds et tendus sur le plastique dur connectors des ventricules artificiels assurant une liaison étanche (figure 8).
- Un évent de la racine aortique est placé. Taux faible, faible pompage de pression est déclenchée (Gauche pression d'entraînement 40, la pression d'entraînement droit 0,% systole 40, taux 40, vide 0) et les poumons sont ventilés pour de-diffusion. L'écoulement à travers le côté droit est initialement passive.
- La pince est enlevée transversale. Une fois de-diffusion adéquate est confirmée par T, la circulation extracorporelle peut être arrêté assez rapidement. TAH support est augmentée. Les paramètres typiques de TAH immédiats initiaux sont: la pression d'entraînement Gauche 180-200 mmHg, pression d'entraînement droit 30-60 mmHg, HR 100-120 bpm, et 50% systole vide est généralement laissé à 0 jusqu'à ce que la poitrine est fermée (ou scellé) à. empêcher l'entraînement d'air. Une fois scellé, les augmentations dans le vide (généralement à 15 mmHg) se traduira par une augmentation du volume de remplissage et augmentation du débit cardiaque. Paramètres sont ensuite titrés pour remplissage ventriculaire partiel et l'éjection complète.
- Protamine est donnée et les canules CPB sont supprimés. Les patients nécessitant une TAH souvent présent à un dysfonctionnement organique de fin significative, y compris la congestion hépatique chronique et peuvent avoir coagulopathie sous-jacente associée significative. La complication la plus fréquente après TAH implantation saigne. Nous recommandons un seuil bas pour l'emballage médiastinale et fermeture du sternum retardé.
- Une fois que le coffre est prêt à être fermé, le reste du péricarde le long de la droite et en haut est bordée de Prélude. La configuration de la TAH ne conserve pas la forme oblongue normale. Contraction du péricarde sur le dispositif permettra de limiter l'espace disponible pour une transplantation ultérieure. Un implant mammaire saline est utilisé pour maintenir l'espace péricardique apical pour la transplantation ultérieure. Un implant mammaire saline lisse est placée au sommet et rempli avec 200 à 250 ml d'une solution saline (figure 9).
- Le coffre est fermé à la mode routine. Bien imgagin par peropératoire TEE est limité, il reste un outil utile à la fin de la chirurgie à évaluer pour la compression de la droite et à gauche le retour veineux auriculaire par le dispositif lors de la fermeture. Ceci est plus fréquent sur la droite (à la fois la veine et veines pulmonaires face droite) et peut généralement être traitée avec le déplacement de l'appareil en bas et à gauche. Cela peut être fixé avec une suture lourde placée autour du rebord costal et liée au ventricule droit artificiel. Une bande de silastic est laissée sous le sternum pour protéger la pompe lors de la rentrée pour la transplantation.
Résultats
De Avril 2006 à Juillet 2012, 66 patients ont été implantés avec une TAH au Centre médical de l'Université du Commonwealth de Virginie. Les patients étaient gravement malades: 18% sur un autre support mécanique (ECMO, LVAD, ou BiVAD), 58% ont été sur une pompe à ballonnet intra-aortique, 58% étaient des médicaments inotropes, 17% ont été ventilés mécaniquement, et 17% étaient à l' hémodialyse. Les patients ont été pris en charge pour un total de 7863 jours. La durée médiane de soutien était 87,5 jours (intervalle de 1 à 602 jours). 10 patients ont obtenu leur congé d'un pilote de décharge portable (dans le cadre d'un essai clinique, pas approuvé par la FDA). 50 (76%) patients ont été comblées avec succès à la transplantation, 7 (11%) est resté sur la transplantation de l'appareil en attente, et 9 (14%) sont décédés tandis que sur l'appareil (figure 10). 3 des décès sont survenus dans la semaine du 1 er après l'implantation et étaient liés à une insuffisance polyviscérale progressive. Les 6 autres décès ont eu lieu de 32 à 169 jours après l'implant (3 sEPSIS / MSOF, une hémorragie médiastinale, une hémorragie intracrânienne, et une crise hypertensive). L'effet indésirable le plus fréquent périopératoire saignait nécessitant une nouvelle exploration médiastinale dans 30%.
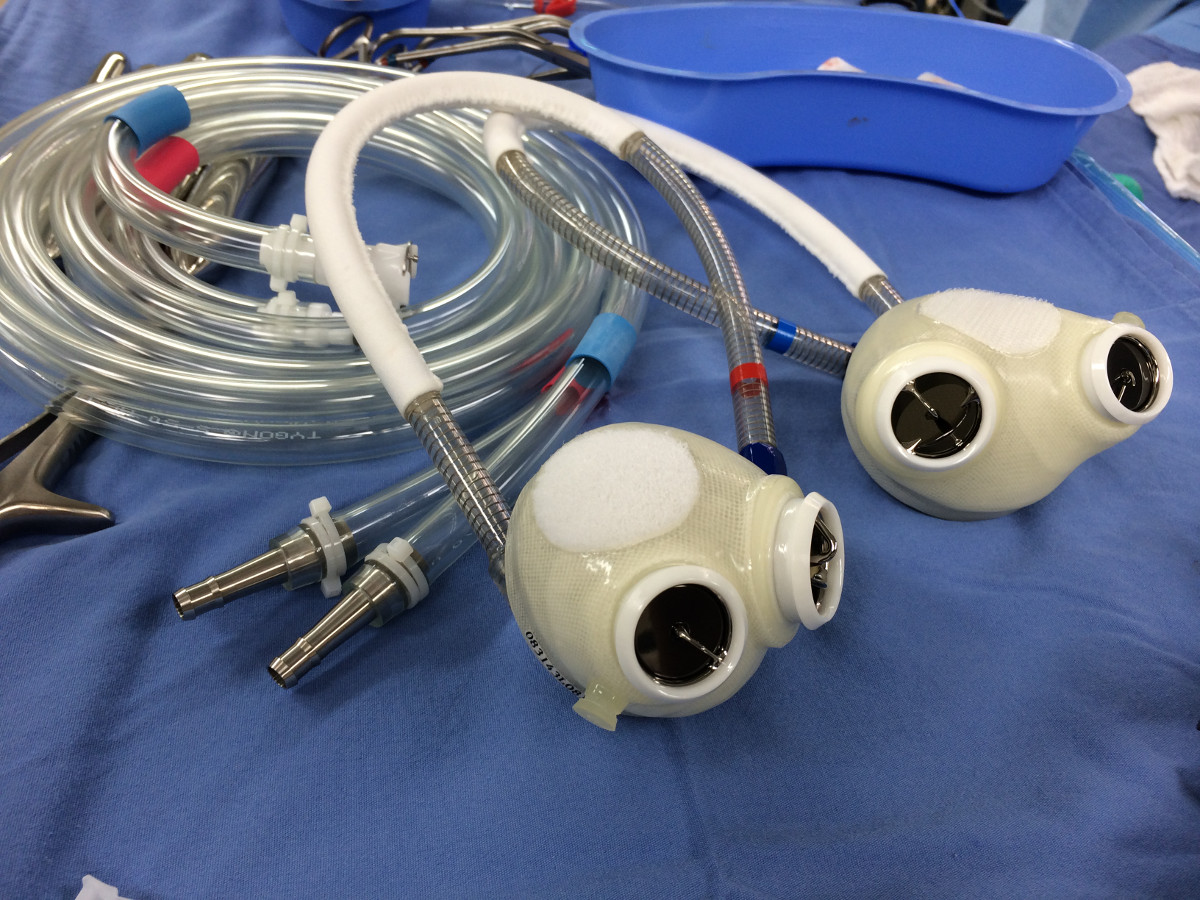
Figure 1. Le cœur artificiel SynCardia total.
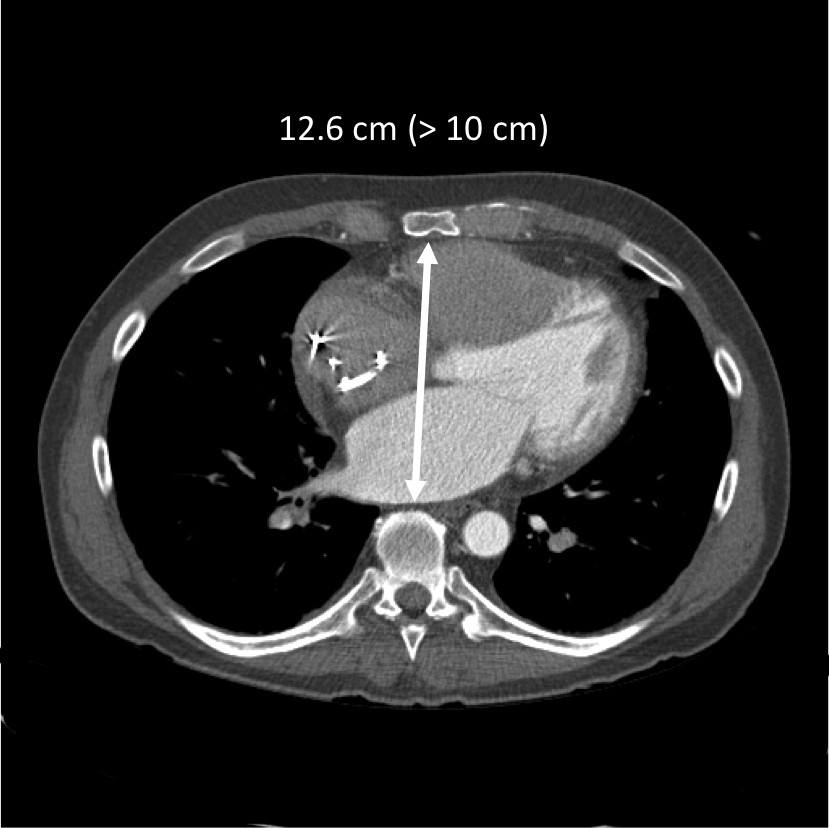
Figure 2. Mesure AP dimension par CT. A l'espace> 10 cm entre le sternum et le bord antérieur de la 10 e corps vertébral est généralement requis pour l'appareil pour s'adapter.
 />
/>
Figure 3. Prétraitement des greffes d'écoulement des artères. Les greffons de l'artère aorte et pulmonaire sont Pré-scellées avec du mastic chirurgical Coseal, un hydrogel synthétique utilisé comme un mastic d'appoint pour des greffes vasculaires. Auparavant, les greffes ont été preclotted avec le propre sang du patient avant héparinisation.
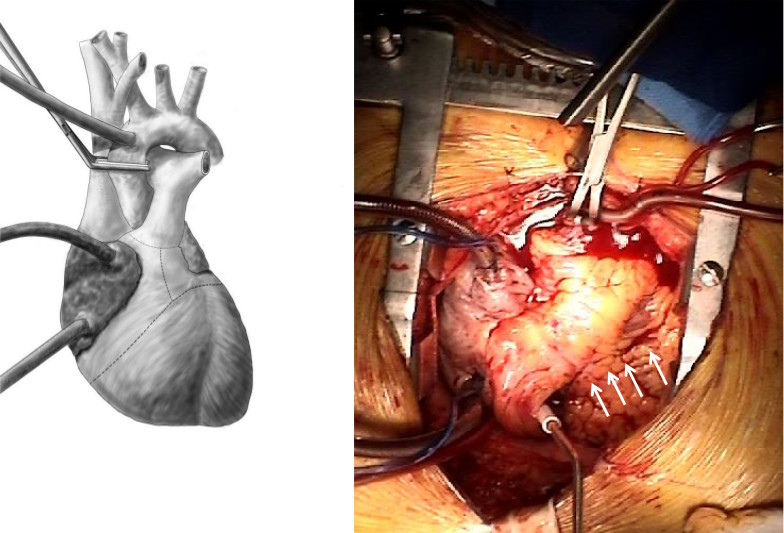
Figure 4. Excision du droit et le ventricule gauche. L'RV et LV sont excisées laissant 1 cm ventriculaire brassard au-delà de la mitrale et tricuspide anneau. Les flèches indiquent l'incision le long de la paroi antérieure de la RV. Les incisions sont étendues à travers les secteurs de chasse ventriculaire gauche et à droite et à travers les valves aortiques et pulmonic.
oad/50377/50377fig5highres.jpg "width =" 500 "/>
Figure 5. Bourdon le sinus coronaire. L'sinus coronaire (flèche) est suturée par le brassard de RV (les feuillets tricuspide ont été excisées) pour l'hémostase.
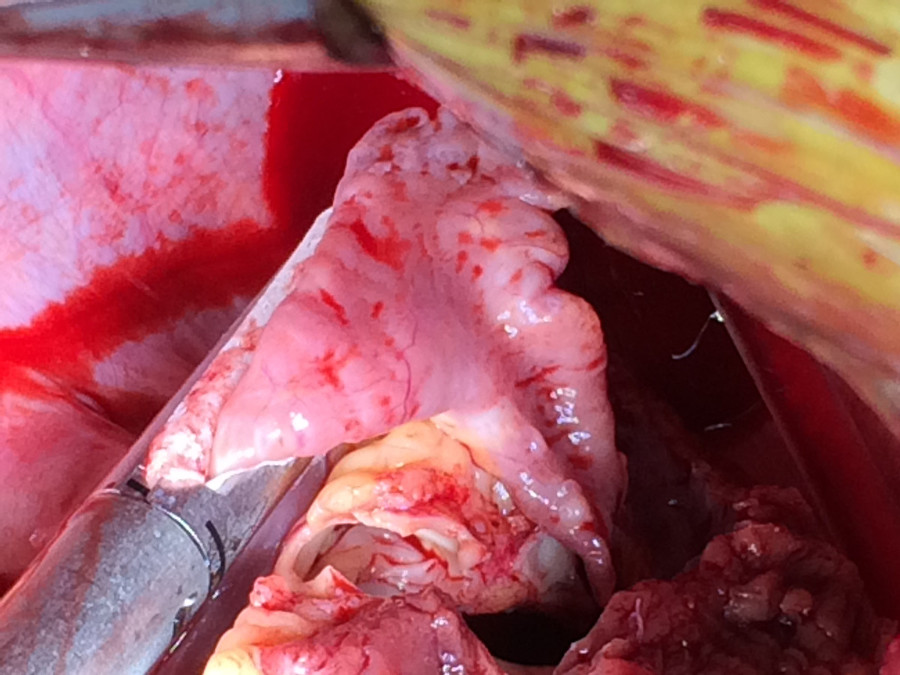
Figure 6. Ligaturer appendice auriculaire. L'appendice auriculaire gauche est ligaturée avec une agrafeuse endo GIA Seamguard renforcée pour minimiser une source potentielle d'emboles systémique.
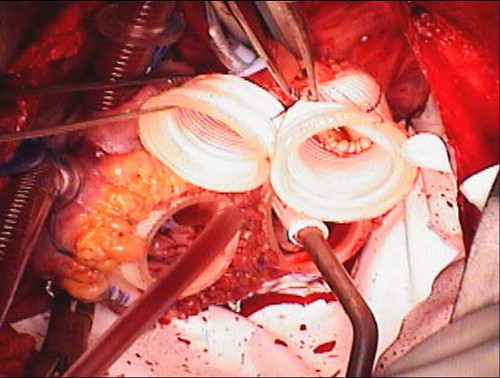
Figure 7. Des raccords rapides et Goretex OBSTACLE implanté. Les raccords rapides auriculaires et des greffes vasculaires sont cousues à leurs orifices respectifs. Le péricarde est tapissé par une membrane Goretex pour faciliter la rentrée suivante pour la transplantation.
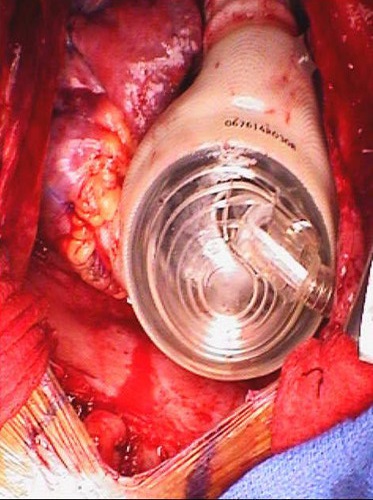
Figure 8. Dispositif implanté. Du dispositif implanté juste avant la fermeture du thorax.
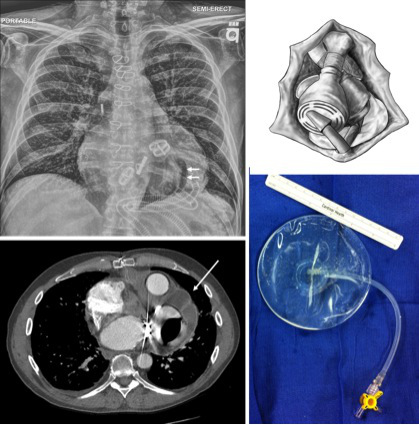
Figure 9. D'implant de solution saline apicale péricardique comme démontré sur l'imagerie CT et radiographie pulmonaire. Un implant salin (flèches simples) est utilisé pour maintenir l'espace péricardique apicale pour la transplantation. Dans le CXR, le bord de la TAH (où le péricarde serait autrement contrat) est délimitée par la bulle d'air central (double flèche).
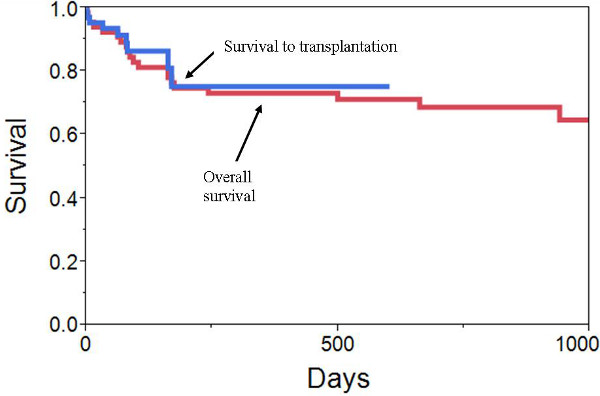
Figure 10 courbes. Résultats VCU. De survie de Kaplan-Meier montrant sursurvie à la greffe et la survie globale après l'implantation TAH.
Discussion
Remplacement artificiel du cœur humain a longtemps capturé l'imagination du public. Les premières expériences avec le cœur artificiel total a été marquée par des résultats optimaux 1-3. La conception et les techniques d'implantation pour le TAH utilisé aujourd'hui n'ont pas changé de façon significative depuis la description originale Dr DeVries de 6. Cependant, des améliorations dans la sélection des patients (comme un pont à la transplantation) et la compréhension de la gestion périopératoire ont conduit à une amélioration significative dans les résultats. En 2004, une étude de référence de 81 implants TAH a été publié. Le procès a établi l'efficacité du TAH comme un pont vers la transplantation et a conduit à l'approbation de la FDA de la SynCardia TAH. Dans cette étude non randomisée, 79% ont été comblé avec succès à la transplantation. La survie globale à 1 an était de 70%. Dans une cohorte appariée de 35 patients qui répondaient aux critères de l'étude mais n'ont pas subi TAH implantation, 46% ont survécu à la transplantation et la survie à 1 an était de 31% 7.
La sélection des patients est essentiel à la bonne résultats 8,9. Il est important d'identifier les patients qui n'ont pas encore développé défaillance d'un organe de fin irréversible ou d'autres complications qui limiterait leurs chances pour la réanimation ou la candidature de transplantation. Dans notre institution, les résultats de la cirrhose par biopsie du foie, la dépendance de dialyse chronique, ou d'autres facteurs psychosociaux qui empêcheraient candidature de greffe seraient également empêcher candidature pour une TAH. Inversement, les patients présentant une décompensation aiguë ou d'autres preuves de récupération potentiel d'organe de fin sont considérés.Il est tout aussi important d'identifier les patients atteints d'insuffisance biventriculaire dont le droit ventriculaire (RV) dysfonctionnement devrait s'améliorer avec isolé LV déchargement et n'ont donc pas besoin d'un soutien circulatoire biventriculaire. défaillance ventriculaire suivante LVAD implantation est associée à une morbidité et une mortalité accrue 10. L'utilisation précoce du soutien biventriculaire rapport à la rescousse retardél'échec de RV suivante LVAD est également associée à de meilleurs résultats 11. Un certain nombre de facteurs de risque d'insuffisance de RV ont été identifiés et plusieurs systèmes de notation du risque ont été développés. La nécessité d'inotropes / intra-aortique support de pompe de ballon, des signes de dysfonction rénale et hépatique (taux élevé de créatinine, aspartate aminotransférase, bilirubine), la preuve hémodynamique de dysfonction VD (diminution RV indice du travail en temps, l'augmentation de l'oreillette droite / pressions de coin), et échocardiographique des signes de dysfonctionnement RV (RV de dilatation, diminué RV fraction d'éjection / tricuspide mouvement annulaire, augmenté insuffisance tricuspide) ont tous été identifiés comme des facteurs risque 12-15. Néanmoins, la détermination du risque de défaillance ventriculaire droite après le placement LVAD reste difficile. Une récente petite série démontré aucune valeur prédictive de plusieurs des systèmes de notation dans la prédiction de la nécessité d'un soutien de RV 16.
Moment de la chirurgie est une consi importantetion. Une fois que la décision a été prise que le soutien mécanique biventriculaire est nécessaire, l'implantation précoce offre le moyen le plus efficace pour rétablir la circulation sanguine et ressusciter un patient. Cependant, les patients peuvent présenter brusquement avec un profond choc cardiogénique aigu, malperfusion grave, et l'évaluation préalable minimal. Utilisation libéral d'options de soutien temporaires (telles que l'ECMO / CPIA) pendant 24-48 heures peut commencer le processus de réanimation alors que les questions concernant le statut neurologique ou d'autres questions de la candidature de la transplantation sont exaucées. L'utilisation prolongée de fortes doses de soutien inotrope peut augmenter le risque de défaillance d'un organe de fin irréversible ou d'autres complications.
Les techniques générales d'implantation n'ont pas changé de façon spectaculaire depuis le dispositif a été introduit 6,17. Cependant, les avantages de prendre le temps de protéger et de maintenir l'espace péricardique doivent être soulignés 18. Le dispositif semble inciter une intense épaisseur inflammatoireforcement du péricarde. Doublure Goretex avec le péricarde et le maintien de l'espace apicale avec une solution saline implant facilite considérablement la ré-entrée pour une transplantation. Saignement périopératoire reste la complication la plus fréquente périopératoire. Emballage de la poitrine avec fermeture sternale différée est une stratégie efficace pour limiter la quantité de produits sanguins périopératoires nécessaires pour renverser la coagulopathie sous-jacente et de minimiser le risque de tamponnade. En dépit de la coque relativement rigide des ventricules artificiels, il est possible de suffisamment de liquide pour accumuler médiastinale et empêcher flux veineux entraînant une tamponnade. échocardiographie de surface après l'implantation de TAH a une utilité limitée. imagerie CT si souvent limitée par un dysfonctionnement rénal sous-jacent et la nécessité d'éviter IV contraste. Nous vous recommandons début médiastinale ré-exploration dans n'importe quel patient HAT qui est par ailleurs en train de faire mal pour des raisons inconnues.
Après l'implantation, le dispositif est réglé pour maximiser le débit cardiaque.Il est capable de générer un signal de sortie> 9 lpm. Pour minimiser la stase, paramètres de l'appareil sont ajustés pour "remplissage partiel et éjection complète." Début des paramètres de TAH postopératoires typiques sont: la pression Gauche d'entraînement 180-200 mmHg, pression d'entraînement droit 30-60 mmHg, HR 100-120 bpm,% systole 50 et 15 mmHg vide. Chez les patients présentant une hypertension artérielle pulmonaire longue date, les pressions plus élevées d'entraînement de RV nécessaires à la complète éjection droite face peuvent être nuisibles. Il est possible de "overdrive" la sortie coté droit. Chez 2 patients, ce qui a entraîné un œdème pulmonaire profonde nécessitant le soutien d'ECMO veino-veineuse temporaire. Un patient avait une insuffisance polyviscérale progressive et expira. L'autre a été pris en charge jusqu'à ce que l'œdème calmée et a été sevré avec succès hors de l'ECMO.
Anticoagulation est généralement lancé 24 heures après la fermeture de la poitrine. Les patients sont démarrés sur la bivalirudine (0,005 mg / kg / h), l'aspirine (81 mg par jour), et dipyridamole (50 mg trois fois par jour). En dehors de l'opSalle de exploitation, du héparine est évitée pour minimiser le risque de thrombocytopénie induite par l'héparine. Bivalirudine n'est généralement pas titré et une fois la transition stable à la warfarine orale. Objectifs de la thérapie sont un INR 2-3 et la fonction plaquettaire normale 20-40% par agrégométrie optique. Les patients présentant des signes d'hémolyse accrue (LDH> 1000) peuvent bénéficier de l'ajout de la pentoxifylline (400 mg TID) 19,20.
L'insuffisance rénale chez les patients gravement malades est clairement multifactorielle. Cependant, nous avons remarqué une tendance disproportionnée vers l'insuffisance rénale suivante TAH implantation. Nous émettons l'hypothèse que c'est en partie liée à la diminution brutale de la production de peptide natriurétique native associée à ventriculaire excision. Supplémentation périopératoire avec une perfusion de nésiritide à faible dose (0,005 mcg / kg / min) semble réduire l'incidence de l'insuffisance rénale 21. En outre, la perfusion de nésiritide a un effet profond pour augmenter la production d'urine après impl TAHantation 22. Une fois les patients ont récupéré, nous avons été en mesure d'arrêter la perfusion dans la plupart des patients. Cependant, nous avons eu quelques patients qui ne pouvaient pas être sevrés de la perfusion jusqu'à ce qu'ils ont été transplantés.
patients TAH font souvent preuve d'une anémie chronique importante. Les causes incluent bas d'hémolyse et erthryopoesis inefficace. Malgré l'anémie, les patients TAH montrent une bonne tolérance à l'effort et peu de symptômes, même avec des taux d'hémoglobine de 5-6 g / dL. Afin d'éviter une sensibilisation HLA et d'autres complications associées, les transfusions sont évités à moins que le patient est symptomatique ou il existe d'autres côtés de malperfusion d'organes d'extrémité 23.
Au-delà de la période postopératoire précoce, les soins se concentre sur la réadaptation physique agressif. Malgré la présentation grave, la majorité des patients étaient capables d'initier la thérapie physique dans la première semaine post-opératoire et la plupart étaient en mesure de commencer treadmill exercice par la deuxième semaine. Cependant, nous avons trouvé que les patients atteints de TAH démontrent un émoussement anormale de la réponse de la pression sanguine à l'exercice. Ceci est en partie lié à l'utilisation de vasodilatateurs à limiter la post-24. Alors que cela pourrait limiter la quantité de réadaptation physique, la plupart des patients vont sur la transplantation avant cette limite est atteinte.
Jusqu'à récemment, les patients étaient TAH hôpital lié et attaché à une console de 418 lb. Comme les temps d'attente pour les dons d'organes continuent à augmenter, cela a été accompagné par considérablement réduit la qualité de vie ainsi que les coûts financiers accrus. L'introduction d'un pilote permettant l'évacuation portable à la maison et même le retour au travail a été une avancée majeure dans l'utilité pratique de la TAH. Le pilote SynCardia liberté (à l'essai clinique et non approuvé par la FDA) est un £ 14, conducteur de taille sac à dos avec un piston pneumatique à commande électrique 25. Les premières expériences avec le pilote a démontré qu'il est sensitive à la post-conditions et un anti hypertenseur schéma thérapeutique agressive est nécessaire 26.
En résumé, les résultats actuels ont établi le TAH comme un dispositif efficace pour la réanimation et le pont après la transplantation. Cette cohorte de patients représente une extrémité du spectre de patients atteints d'insuffisance cardiaque de phase terminale. Souvent, il n'ya pas d'autre option thérapeutique durable approprié.
Déclarations de divulgation
La production de cette vidéo-article a été parrainé par SynCardia. MH et VK ont servi de consultants pour SynCardia Systems Inc. Les autres auteurs n'ont rien à révéler.
matériels
| Name | Company | Catalog Number | Comments |
| Total artificial heart (implant kit) |  Syncardia Syncardia | 500101 | |
| PRECLUDE pericardial membrane |  Gore Medical Gore Medical | 1PCM101 | |
| Smooth Round Saline Implant |  Mentor Mentor | 350-1645 | |
| CoSeal Surgical Sealant |  Baxter Baxter | 93407 |
Références
- Cooley, D. A., Liotta, D., Hallman, G. L., Bloodwell, R. D., Leachman, R. D., Milam, J. D. Orthotopic cardiac prosthesis for two-staged cardiac replacement. American Journal of Cardiology. 24 (5), 723-730 (1969).
- Cooley, D. A. The total artificial heart. Nat. Med. 9 (1), 108-111 (2003).
- DeVries, W. C., Anderson, J. L., Joyce, L. D., Anderson, F. L., Hammond, E. H., Jarvik, R. K., Kolff, W. J. . Clinical use of the total artificial. 310 (5), 273-278 (1984).
- . Syncardia Systems. 1000th Implant of the World's Only Approved Total Artificial Heart Performed. [Press release]. , (2012).
- Joyce, L. D., et al. Nine year experience with the clinical use of total artificial hearts as cardiac support devices. ASAIO Transactions. 34, 703-707 (1988).
- DeVries, W. C. Surgical Technique for Implantation of the Jarvik-7-100. Total Artificial Heart. JAMA. 259 (6), 875-880 (1988).
- Copeland, J. G., et al. Cardiac replacement with a total artificial heart as a bridge to transplantation. N. Engl. J. Med. 351, 859-867 (2004).
- Kasirajan, V., Tang, D. G., Katlaps, G. J., Shah, K. B. The total artificial heart for biventricular failure and beyond. Curr Opin Cardiol. 27, (2012).
- Copeland, J. G., et al. Risk factor analysis for bridge to transplantation with the CardioWest total artificial heart. Ann Thorac Surg. 85, 1639-1644 (2008).
- Kormos, R. L., et al. Right ventricular failure in patients with the HeartMate II continuous-flow left ventricular assist device: incidence, risk factors, and effect on outcomes. J Thorac Cardiovasc Surg. 139, 1316-1324 (2010).
- Fitzpatrick, J. R., et al. Early planned institution of biventricular mechanical circulatory support results in improved outcomes compared with delayed conversion of a left ventricular assist device to a biventricular assist device. J Thorac Cardiovasc Surg. 137, 971-977 (2009).
- Matthews, J. C., Koelling, T. M., Pagani, F. D., Aaronson, K. D. The right ventricular failure risk score a pre-operative tool for assessing the risk of right ventricular failure in left ventricular assist device candidates. J Am Coll Cardiol. 51, 2163-2172 (2008).
- Ochiai, Y., et al. Predictors of Severe Right Ventricular Failure After Implantable Left Ventricular Assist Device Insertion: Analysis of 245 Patients. Circulation. 106 (suppl I), (2002).
- Drakos, S. G., et al. Risk factors predictive of right ventricular failure after left ventricular assist device implantation. Am J Cardiol. 105, 1030-1035 (2010).
- Fitzpatrick, J. R., et al. Risk score derived from pre-operative data analysis predicts the need for biventricular mechanical circulatory support. J Heart Lung Transplant. 27, 1286-1292 (2008).
- Pettinari, M., et al. Are right ventricular risk scores useful. Eur J Cardiothorac Surg. 42 (4), 1-6 (2012).
- Arabia, F. A., Copeland, J. G., Pavie, A., Smith, R. G. Implantation Technique for the CardioWest Total Artificial Heart. Ann Thorac Surg. 68, 698-704 (1999).
- Copeland, J. G., Arabia, F. A., Smith, R. G., Covington, D. Synthetic membrane neopericardium facilitates total artificial heart explantation. J Heart Lung Transplant. 20, 654-656 (2001).
- Crouch, M. A., et al. Successful use and dosing of bivalirudin after temporary total artificial heart implantation: a case series. Pharmacotherapy. 28, 1413-1420 (2008).
- Ensor, C. R., et al. Antithrombotic therapy for the CardioWest temporary total artificial heart. Tex Heart Inst J. 37, 149-158 (2010).
- Stribling, W. K., et al. Use of nesiritide and renal function following total artificial heart implantation. J Heart Lung Transplant. 30, 96 (2011).
- Shah, K. B., et al. Impact of low dose B-type natriuretic peptide infusion on urine output after total artificial heart implantation. J Heart Lung Transplant. 31 (6), 670-672 (2012).
- Mankad, A. K., et al. Persistent anemia in patients supported with the total artificial heart: hemolysis and ineffective erythropoiesis. J Card Fail. 17, 42-42 (2011).
- Kohli, H. S., et al. Exercise blood pressure response during assisted circulatory support: comparison of the total artificial heart with a leftventricular assist device during rehabilitation. J Heart Lung Transplant. 30, 1207-1213 (2011).
- Jaroszewski, D. E., Anderson, E. M., Pierce, C. N., Arabia, F. A. The SynCardia freedom driver: a portable driver for discharge home with the total artificial heart. J Heart Lung Transplant. 30, 844-845 (2011).
- Yankah, L., Shah, K. B., Hess, M. L., Kasirajan, V., Tang, D. G. Response of the Syncardia TAH Pneumatic Drivers to Afterload Challenge on a Mock Loop. ASAIO Journal. 58 (7), (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon