Method Article
Visualiser les effets d'une expérience précoce positive, tactile stimulation, sur dendritiques Morphologie et Synaptic connectivité avec Golgi-Cox coloration
Dans cet article
Résumé
Ce document décrit les procédures de stimulation tactile de ratons et après coloration de Golgi-Cox de la morphologie neuronale. La stimulation tactile est une expérience positive qui est administré dans la période périnatale par caresser les petits avec un chiffon de ménage. Golgi-cox coloration est une procédure fiable permettant la visualisation des neurones entiers.
Résumé
Pour générer des changements à long terme dans le comportement, les expériences doivent produire des changements stables dans la morphologie neuronale et la connectivité synaptique. La stimulation tactile est une première expérience positive qui imite maternels lécher et toilettage chez le rat. Exposer ratons à cette expérience positive peut être complété facilement et à moindre coût en utilisant des matériaux très accessibles, comme un chiffon de ménage. L'utilisation d'un dessin de la croix-portée, les chiots sont soit caressé ou laissés au repos, pendant 15 minutes, trois fois par jour pendant la période périnatale. Pour mesurer les changements neuroplastiques liés à cette première expérience positive Golgi-Cox coloration des tissus du cerveau est utilisée. En raison du fait que l'appareil de Golgi-Cox imprégnation colore un nombre discret de neurones et non la totalité des cellules, la coloration du cerveau de rongeurs avec une solution Golgi-Cox permet la visualisation d'éléments neuronaux entiers, y compris le corps de la cellule, des dendrites, les axones, et épines dendritiques. Le protocole de coloration is effectuée sur plusieurs jours et exige que le chercheur accorder une attention particulière aux détails. Cependant, une fois que la coloration est terminée, l'ensemble du cerveau a été imprégnée et peut être conservé indéfiniment à l'analyse en cours. Par conséquent, l'appareil de Golgi-Cox coloration est une ressource précieuse pour l'étude de l'expérience la plasticité.
Introduction
Bien qu'il existe de nombreuses techniques rapportés et utilisés pour l'examen des premières expériences négatives sur la maturation du cerveau, comme le stress périnatal 1,2, la privation sensorielle 3, et 4 drogue toxicité, il existe très peu de méthodes employées pour examiner les effets des expériences positives dans cette période de temps. Mis à part l'enrichissement de l'environnement, la stimulation tactile est l'un des rares cerveau amélioration des traitements avec des effets démontrés 5. La stimulation tactile est une méthode de stimulation sensorielle à la peau qui imite le comportement de rat maternelle, léchage et toilettage. Son acceptation générale comme une manipulation positif découle des études indiquant que la stimulation tactile amélioré la maturation des prématurés et des rats nouveau-nés 6. En outre, la recherche dans le laboratoire Meaney 7 a démontré que des niveaux plus élevés de léchage et toilettage maternelle sont liés à des résultats positifs dans la progéniture. En raison de tinfluences positives es, stimulation tactile évolué rapidement dans une stratégie de redressement visant à réduire l'anxiété 8, l'amélioration des résultats liés à une lésion cérébrale 9-11, et atténuer médicament sensibilisation 12. En tant que tel, la stimulation tactile est une technique utile pour la promotion de premières expériences positives, avec une capacité éprouvée à réorganiser radicalement la morphologie neuronale et la connectivité synaptique du cerveau en développement.
Afin d'étudier et de quantifier les modifications de la morphologie neuronale, il est nécessaire pour visualiser les neurones intacts. La procédure de coloration de Golgi-Cox est une modification de la technique de Camillo Golgi publié dans les années 1800 qui fournit la coloration discrète d'un petit nombre de neurones complètes 13. Bien que la procédure semble tacher neurones au hasard et la reproductibilité est souvent cité comme défaut majeur, le permis de taux d'imprégnation petite visualisation de l'ensemble de l'élément neuronal, y compris CEorganes ll, dendrites, épines dendritiques, et des axones. De même, le temps nécessaire pour imprégner un cerveau donné avec une solution de Golgi a également été citée comme une chute. Toutefois, étant donné qu'une fois que la coloration est un tissu complet peut être conservée indéfiniment, et le temps entre la perfusion du cerveau et de la visualisation de neurones avec un microscope peut être achevée en moins de 21 jours, la période de temps n'est pas déraisonnable. En outre, avec des modifications mineures au protocole, Golgi-Cox coloration peut être efficacement utilisée pour imprégner le cerveau de rongeurs de toutes les tranches d'âge. Comme les changements au niveau de la structure ont été liés à des modifications persistantes de fonctionnement comportemental et psychologique, la technique de coloration de Golgi-Cox offre aux chercheurs un outil précieux pour mesurer la neuroplasticité.
Protocole
Toutes les expériences ont été effectuées en conformité avec le Conseil canadien de protection des animaux et approuvées par l'Université de Lethbridge, Comité de protection des animaux.
Une. Elevage et tactile Stimulation
- Commandez rats enceintes des fournisseurs d'animaux communs ou reproduire des chiots en interne en utilisant des procédures de sélection standard de laboratoire.
- Maison tous les animaux dans une pièce à température contrôlée de l'élevage (21 ° C), maintenu sur une lumière 12:12 h: cycle d'obscurité et de fournir l'accès à la nourriture et de l'eau ad libitum.
- Lorsque les chiots sont nés, maison rates individuellement avec leur progéniture.
- Pour éviter le stress supplémentaire lié à la manipulation immédiatement après la naissance, commencer la stimulation tactile de chiots à P3.
- La stimulation tactile doit être effectuée trois fois par jour (09h00, 13h00 et 16h00) à partir de P3-P21 et les chiots doivent être sevrés de leur mère à la P21.
- Lors de l'utilisation d'une conception de la litière en coupe, la moitié des chiots Liste from chaque portée subira stimulation tactile avec l'autre moitié servant de témoins. Affecter aléatoirement un nombre égal de chiots mâles et femelles de chaque groupe. Pour différencier chiots traitement de stimulation et de contrôle tactile, marquer un groupe de chiots avec un marqueur permanent sur leurs pattes de derrière et la queue. Le marquage doit être appliqué de nouveau tous les jours.
Stimulation tactile
- Retirer les barrages de leur cage et les placer dans une cage temporaire avec de la nourriture et de l'eau. Gardez le barrage et la cage temporaire dans la salle d'élevage / de logement.
- Peser les ratons comme un groupe avant le matin séance de stimulation tactile (09:00 AM). Pour chaque session, le transport rat chiots leurs cages dans une chambre de test séparé pour la stimulation tactile. Placez la cage de la maison sur un coussin chauffant qui est fixé à 24 ° C.
- Utilisez une planche rigide pour diviser la cage de la maison en deux moitiés. Placez les ratons dans les tactiles stimulation groupe demie et de contrôle chiots dans l'autre moitié.Réglez une minuterie pour 15 min.
- L'utilisation d'un plumeau comme doux, brosser tous les petits dans le groupe stimulation tactile en même temps pendant 15 minutes d'affilée. Les jeunes ratons (~ P3-P12) se blottissent ususally ensemble et semblent entrer dans un cycle de sommeil profond qui le rend très facile à stimuler tous les petits à la fois. Comme l'âge des chiots, ils deviennent plus actifs, avec quelques petits marche et l'enquête lors de la session. L'expérimentateur doit en permanence déplacer chiots errants dans le groupe pour s'assurer que chaque chiot reçoit la stimulation égale.
- Une fois la session de 15 min est complète, le transport des chiots à la salle de reproduction et de retourner à la mère de la cage.
- Répétez ce processus trois fois par jour pendant les 19 jours de stimulation tactile. Après la dernière séance de stimulation tactile à P21, les chiots doivent être sevrés de leur mère. Les chiots doivent ensuite être logés dans des cages avec 5 ou 6 autres animaux sevrés de même sexe.
- Si les rats subissent pas de tests supplémentaires, ils devraient être laissés nondérangé, la lumière normale: cycle d'obscurité avec accès à la nourriture et de l'eau libitm (en dehors de la cage de nettoyage et de manutention ordinaire) jusqu'à ce qu'ils atteignent environ 100 jours d'âge. Si l'objet d'autres manipulations expérimentales, les animaux doivent être traités ou testés conformément à ces protocoles de laboratoire.
2. Sacrifice et Golgi-Cox coloration
- À environ P100, administrer une surdose de pentobarbital de sodium par injection IP aux rats et perfusent intracardiaque avec environ 100 ml de solution saline 0,9%.
- Extrait le cerveau lorsque la perfusion est terminée. Retirer le cerveau du crâne, couper le nerf optique sous un effort pour garder intact le cervelet; chercheurs peuvent choisir de conserver ou de supprimer les bulbes olfactifs. Placer cerveaux extraits dans une bouteille de Nalgene opaque avec 20 ml d'une solution 14 Golgi-Cox.
- Gardez le cerveau en solution Golgi-Cox pendant 14 jours. Après 14 jours, remplacer le Golgi-Csolution de boeuf avec une solution de saccharose à 30%. Gardez le cerveau dans la solution de saccharose pendant 2-5 jours avant la coupe.
Remarque: Si les cerveaux ne peuvent pas être sectionnés dans les 14 jours suivant le transfert de la solution de saccharose, le chercheur doit remplacer le saccharose avec un nouveau stock de 30% de saccharose. Le chercheur peut remplacer le saccharose toutes les deux semaines pendant 4 mois, sans effets néfastes sur la coloration.
- Pour la section du cerveau, le cerveau doit être effacé sec et fixé à l'étape de découpe avec de la colle cyanocacrylic. Pour éviter de le déchirer ou le sectionnement inégale, le chercheur doit faire preuve de prudence et veiller à ce que l'ensemble du cerveau est solidement fixé à la scène.
- Le réservoir de vibratome doit être rempli d'une solution de saccharose à 6% à un niveau qui recouvre la lame de sectionnement. Définissez les paramètres de vibratome à une vitesse et une amplitude de 5, (le milieu sur les deux échelles). Trancher le cerveau en 200 sections um et placer les sections sur un micro gélifié de 2%lame de portée. Soyez sûr de garder les sections humide au cours de la coupe.
- Lorsque toutes les sections d'intérêts ont été recueillis, appuyez sur les sections sur les lames en appliquant une pression sur les lames avec du papier absorbant humide. Conserver les diapositives d'une grille coulissante dans la chambre de l'humidité jusqu'à ce qu'ils soient prêts à être souillé. Ils doivent rester dans la chambre humide pendant au moins 12 heures, mais pas plus de 4 jours. Les diapositives doivent être humide et ne devraient pas être autorisés à sécher.
- Préparer le régiment de coloration avant de commencer le processus de coloration. Étiquette douze plats de coloration du verre (10,7 x 8,5 x 6,8 cm) et processus de la manière suivante:
- Eau distillée - 1 min
- Hydroxyde d'ammonium - 30 min (dans le noir)
- Eau distillée - 1 min
- Kodak Fix pour Film - 30 min (dans l'obscurité)
- Eau distillée - 1 min
- 50% d'alcool - 1 min
- 70% d'alcool - 1 min
- 95% d'alcool - 1 min
- 100% Alcohol - 5 min
- 100% d'alcool - 5 min
- La solution (1/3 de chloroforme, 1/3 HemoDe, 1/3 d'alcool à 100%) - 15 min
- HemoDe - 15 min
* Le xylène peut être utilisé en remplacement de la HemoDe. Afin d'assurer la qualité de la coloration uniforme, de nouvelles solutions doivent être utilisés pour chaque grille coulissante traitées.
- Suite à la dernière 15 min émersion dans HemoDe, lamelle les diapositives avec Permount.
- Laisser les lames sécher à l'air avant d'examiner au microscope.
Résultats
Lorsque cette procédure de coloration a été suivie de façon appropriée, la coloration homogène et uniforme des dendrites et des épines est généré. Voir la figure 1 pour une représentation de Golgi-Cox coloration neuronale. Cette procédure produit une coloration qui est comparable à la visualisation de champs dendritiques qui sont sans coupure incorporation de tissu nouvellement développé suivant les méthodes in vitro et peut permettre. La technique basée vibratome de Golgi-Cox coloration a été trouvée pour produire une coloration plus répandue des branches terminales et des neurones pyramidaux, de coloration avec collodionné soit incorporé et le tissu de section de cryostat, 15. En outre, parce que cette méthode de coloration imprègne l'ensemble du cerveau, toutes les sections peuvent être analysés immédiatement ou dans l'avenir. Comme l'emplacement du changement morphologique est qu'il n'est pas toujours évident lors de la génération d'une hypothèse de départ, ce processus permet l'exploration de régions du cerveau supplémentaires uned empêche l'élimination des tissus qui peuvent être utiles à l'avenir.
Cette méthode de coloration peut être utilisée pour la coloration fiable de toute cerveaux de rats âgés (P0-vieillesse). Toutefois, lorsque la coloration jeunes cerveaux (<1 gramme), le cerveau ne doit rester dans la solution de Golgi-Cox pour 6 jours, plutôt que les 14 jours recommandés pour le cerveau adulte, toutes les autres procédures sont maintenus constants. La principale difficulté que l'on peut rencontrer au cours de ce processus de coloration de Golgi-Cox est l'incapacité à produire une coloration de qualité des régions centrales du cerveau, y compris le thalamus. Comme l'ensemble du cerveau est imprégné en même temps, les régions centrales ne peuvent pas recevoir les concentrations idéales de tache. Malgré cette constatation, la technique de Golgi-Cox produit une coloration exceptionnelle des régions sous-corticales comme l'hippocampe et le striatum. Une limite finale de la procédure résulte de l'élimination incomplète de sang du cerveau au cours du processus de perfusion. Le sang peut produire des artefacts dans le tissu cérébralqui le rend difficile à photographier et tracer les neurones.
Techniques de coloration de Golgi-Cox fournissent une mesure fiable de la morphologie dendritique et neuroanatomie qui est utile pour une vaste gamme d'études destinées à examiner les changements au niveau des neurones. Lors de l'examen la structure neuronale dans le cortex préfrontal suite à une stimulation tactile dans la période postnatale précoce, Golgi-Cox coloration a révélé une augmentation spectaculaire de la complexité dendritique. Les changements anatomiques liés à une stimulation tactile précoce peut être démontrée en comparant visuellement la densité de la colonne vertébrale de neurones pyramidaux à partir d'un rat témoin de neurones pyramidaux à partir d'un rat ayant subi une stimulation tactile (voir la figure 1). En outre, des paramètres tels que l'arborisation dendritique, longueur dendritique, et la densité de la colonne vertébrale peuvent être calculées et analysées statistiquement pour générer des données en continu qui peut être comparé à travers les animaux. Pour générer des résultats fiables, l'analyse doit être effectuée sur hinimum de trois animaux par groupe de traitement et environ cinq neurones par l'hémisphère doit être choisi au hasard pour chaque région du cerveau en cours d'analyse. Figure 2 montre la complexité dendritique (épines / um x um de dendrites) des animaux qui ont reçu la stimulation et les animaux qui n'ont pas tactile . Dans les deux domaines apical et basilaires des neurones analysées à partir de la mPFC (CG3), stimulation tactile a entraîné la prolifération des paramètres neuronaux.
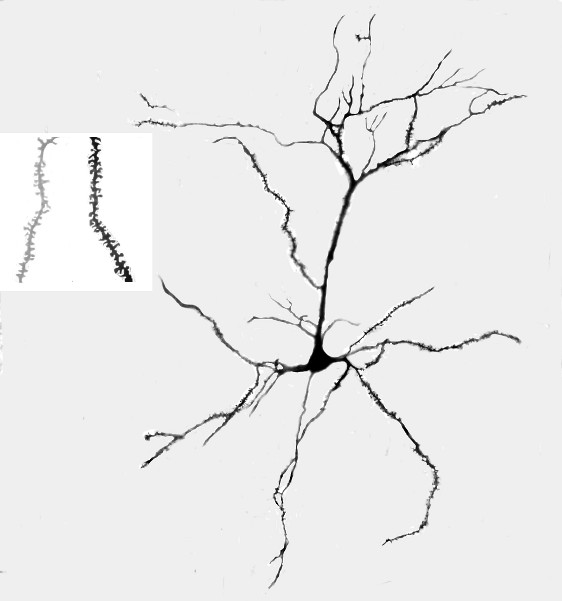
Figure 1. Photo A. Représentant d'un appareil de Golgi-Cox taché neurone pyramidal de la couche III de la zone CG3 dans un rat qui a reçu une stimulation tactile au cours du développement. B. Représentant agrandie (1000 X) photographie des épines dendritiques sur les dendrites terminaux dans le domaine basilaire de CG3 ; l'image la plus claire sur la gauche est un rat dans le groupe de contrôle et l'image plus sombre sur la right provient d'un rat ayant reçu une stimulation tactile.
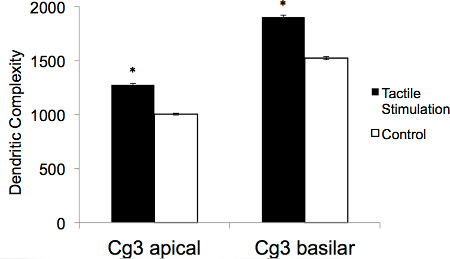
Figure 2. Représentation illustrative de la complexité dendritique apicale et basilaire moyenne (épines / um um x) pour les neurones dans la région CG3 de rats adultes qui ont reçu soit une stimulation tactile au cours du développement ou n'ont pas (* p <0,01).
Discussion
En raison de la plasticité manifeste du cerveau en développement, il est important que les procédures expérimentales portant sur les premières expériences sont soigneusement examinés et des tentatives sont faites pour contrôler toutes les variables qui interviennent. Pour cette raison, une conception de la litière croix est utilisé lors de la procédure de stimulation tactile de veiller à ce que les chiots reçoivent des expériences similaires dans tous les autres domaines du développement. En outre, il est également important que de multiples petits de plusieurs portées sont sélectionnées pour analyse afin d'éviter la possibilité que les effets résultent d'une polarisation dans un seul petit ou litière.
La stimulation tactile est censé imiter le comportement de la mère naturelle, léchage et toilettage, qui est considéré comme bénéfique pour le développement de la progéniture. Bien que des études antérieures ont mis l'accent sur la première semaine de vie (P0-P7) est une période critique pour lécher et toilettage 16, l'ampleur du changement identifié suite à 18 jours de tactile stimulation peut signifier que, bien que les périodes sensibles existent, plus l'exposition est supérieure. Il est également important de noter que les chiots reçoivent une stimulation tactile dans ce paradigme expérimental connaissent aussi lécher et le toilettage de leur mère, d'où la stimulation tactile est en plus à la stimulation normale administré par la mère. Enfin, il faut aussi être conscient des changements de région dépendant. Bien que la stimulation tactile au cours du développement a augmenté la complexité dendritique dans le cortex préfrontal, cela ne garantit pas que les changements structurels de cette nature seront évidents dans toutes les régions du cerveau. Il est possible que la morphologie neuronale dans d'autres régions du cerveau telles que le cortex pariétal, réagirait de façon remarquablement différentes de la même expérience. Cependant, parce que la procédure de stimulation tactile est facile à administrer et ne pose aucun risque pour la descendance ou des barrages, il a le potentiel de servir comme un outil précieux pour de nombreuses études de recherche visant à améliorer le développementrésultats al.
En ce qui concerne l'appareil de Golgi-Cox coloration du tissu cérébral, les étapes critiques pour la réussite de la visualisation des cellules neuronales sont les suivantes: 1) il doit y avoir une perfusion adéquate du cerveau avec une solution saline. Perfusion inadéquate ou insuffisante des résultats de tissu cérébral dans les artefacts des vaisseaux sanguins qui font qu'il est difficile de réellement visualiser les cellules neuronales dans le dédale des vaisseaux sanguins, tout en compliquant la possibilité de photographier les neurones colorés. 2) cerveaux perfusés doivent être stockés dans une solution de Golgi-Cox et solution de saccharose dans l'obscurité. Stocker le tissu cérébral dans l'obscurité réduit la coloration du tissu de fond, augmentant encore le risque de visualisation avec succès des cellules neuronales de qualité. 3) Le tissu cérébral est stocké dans une solution de saccharose suivant l'entreposage de 14 jours dans une solution de Golgi-Cox. Lorsque le tissu est immergé dans la solution de saccharose à 30% pendant 2-5 jours, les cerveaux sont plus souples qui empêche éclatement et la déchirure des sections oùcoupe. Il est important d'empêcher le tissu cérébral de rester dans la solution de saccharose pour des périodes de temps accrues (à moins que la solution de saccharose est continuellement remplacée par une solution fraîche) en raison d'un stockage prolongé en saccharose réduit la qualité de la coloration. 4) Enfin, une fois les lames ont été colorées et couvercle glissé, ils devraient être suffisamment de temps pour sécher avant de visualisation au microscope. Si les lames ne sont pas autorisés à diffuser suffisamment sec, le tissu peut s'assombrir, réduisant visualisation succès de neurones corticaux.
Des changements stables dans le fonctionnement psychologique et des réponses comportementales qui se produisent en réponse à des expériences sont soupçonnés d'être facilitée par la réorganisation de la morphologie neuronale et la connectivité synaptique 17. Comme ces changements structurels constituent une ressource mesurable pour l'expérience la plasticité, l'utilisation d'une procédure de coloration fiable est important. Cette base vibratome Golgi-Cox procédure de coloration fournit tache fiabletion de fines branches et les épines dendritiques qui peuvent ne pas être évident avec d'autres protocoles tels que celloïdine-encastrement. La particularité de la procédure de Golgi-Cox vient de sa capacité à colorer seulement une petite fraction d'éléments neuronaux (1-10%), de ce qui permet le traçage des neurones individuels pour les longues distances. En dépit du fait que seule une petite fraction des neurones sont imprégnés avec le colorant, les cellules qui sont rendues visibles, à maintenir toutes les fonctions, y compris le corps de la cellule, des dendrites, épines dendritiques et des axones. En outre, lorsque la procédure de coloration est effectuée correctement, les cellules colorées se distinguent clairement et distinctement sur un fond transparent parce que d'autres structures corticales restent non colorées et transparent. En raison de la prise de conscience que les modifications persistantes dans le fonctionnement vers l'extérieur doit être lié à la plasticité du système nerveux, à savoir la capacité des neurones à modifier leur structure et leur connectivité, la procédure de coloration de Golgi-Cox donne aux chercheurs untechnique fiable de visualiser et de quantifier cette plasticité.
Déclarations de divulgation
Les auteurs déclarent que nous n'avons pas d'intérêts financiers concurrents.
Remerciements
Ce travail est financé par des subventions du CRSNG à BK et RG. Les auteurs tiennent aussi à remercier Kehe Xie et Russell Hosain pour leur expertise en matière de coloration de Golgi-Cox.
matériels
| Name | Company | Catalog Number | Comments |
| Potassium Dichromate | Fisher | P188 | |
| Mercuric Chloride | Fisher | M1561 | |
| Potassium Chromate | Fisher | P220 | |
| Ammonium Hydroxide | Fisher | A669-500 | |
| Kodak Rapid Fix | Vistek | Kodak 146 4016 | |
| EtOH-95 & Anhydrous | Commercial Alcohols | No Cat Numbers | All other Et-OH are dilutions |
| Swiffers- Soft Feather-Like dusters | Safeway | Can be found at most grocery stores | |
| Sucrose | Sigma-Aldrich | S-9378 | |
| HemoDe | Electron Microscopy Sciences | 23410 | |
| Permount | Fisher | Sp15 | |
| Slides | VWR | 160004-365 | |
| Coverslips | VWR | 062011-9 |
Références
- Mychasiuk, R., Ilnystkyy, S., Kovalchuk, O., Kolb, B., Gibb, R. Intensity matters: Brain, behaviour, and the epigenome of prenatally stressed rats. Neuroscience. 180, 105-110 (2011).
- Muhammad, A., Carroll, C., Kolb, B. Stress during development alters dendritic morphology in the nucleus accumbens and prefrontal cortex. Neuroscience. 216, 103-109 (2012).
- Wiesel, T., Hubel, D. Effects of visual deprivation on morphology and physiology of cells in the cat's lateral geniculate body. Journal of Neurophysiology. 26 (978), 6 (1963).
- Dwyer, J., McQuown, S., Leslie, F. The dynamic effects of nicotine on the developing brain. Pharmacology & Therapeutics. 122, 125-139 (2009).
- Richards, S., Mychasiuk, R., Kolb, B., Gibb, R. Tactile stimulation during development alters behaviour and neuroanatomical organization of normal rats. Behavioural Brain Research. 231, 86-91 (2012).
- Schanberg, S., Field, T. Sensory deprivation stress and supplemental stimulation in the rat pup and preterm neonate. Child Development. 58 (6), 1431-1447 (1987).
- Caldji, C., Tannenbaum, J., Sharma, S., Francis, D., Plotsky, P., Meaney, M. Maternal care during infancy regulates the development of neural systems mediating the expression of fearfulness in the rat. Proceedings of the National Academy of Sciences. 95 (9), 5335-5340 (1998).
- Imanaka, A., Morinobu, S., Toki, S., Yamamoto, S., Matsuki, A., Kozuru, T., et al. Neonatal tactile stimulation reverses the effect of neonatal isolation on open-field and anxiety-like behavior, and pain sensitivity in male and female adult Sprague-Dawley rats. Behavioural Brain Research. 186, 91-97 (2008).
- Gibb, R., Gonzalez, C., Wegenast, W., Kolb, B. Tactile stimulation promotes motor recovery following cortical injury in adult rats. Behavioural Brain Research. 214 (1), 102-107 (2010).
- Rodrigues, A., Artneni, N., Abel, C., Zylbersztejn, D., Chazan, R., Viola, G., et al. Tactile stimulation and maternal separation prevent hippocampal damage in rats submitted to neonatal hypoxia-ischemia. Brain Research. 1002, 94-99 (2004).
- Kolb, B., Gibb, R. Tactile stimulation after frontal or parietal cortical injury in infant rats facilitates functional recovery and produces synaptic changes in adjacent cortex. Behavioural Brain Research. 214, 115-120 (2010).
- Muhammad, A., Hossain, S., Pellis, S., Kolb, B. Tactile stimulation during development attenuates amphetamine sensitization and structurally reorganizes prefrontal cortex and striatum in a sex-dependent manner. Behavioral Neuroscience. 125 (2), 161-174 (2011).
- Golgi, C. Sulla struttura della sostanza grigia dell cervello. Gaz Med Lomb. 33, 244-246 .
- Glaser, E. M., van der Loos, H. Analysis of thick brain sections by obverse-reverse computer microscopy: Application of a new, high clarity Golgi-Nissl stain. Journal of Neuroscience Methods. 4, 117-125 (1981).
- Gibb, R., Kolb, B. A method for vibratome sectioning of Golgi-Cox stained whole rat brain. Journal of Neuroscience Methods. 79, 1-4 (1998).
- Meaney, M. Maternal care, gene expression, and the transmission of individual differences in stress reactivity across generations. Annual Review of Neuroscience. 24, 1161-1192 (2001).
- Robinson, T. E., Kolb, B. Structural plasticity associated with exposure to drugs of abuse. Neuropharmacology. 47, 33-46 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon