Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle de la peau de souris fœtale de Scarless Wound Repair
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
During mammalian development, early gestational skin wounds heal without a scar. Here we detail a reliable and reproducible model of fetal scarless wound healing in the cutaneous dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
Résumé
Early in utero, but not in postnatal life, cutaneous wounds undergo regeneration and heal without formation of a scar. Scarless fetal wound healing occurs across species but is age dependent. The transition from a scarless to scarring phenotype occurs in the third trimester of pregnancy in humans and around embryonic day 18 (E18) in mice. However, this varies with the size of the wound with larger defects generating a scar at an earlier gestational age. The emergence of lineage tracing and other genetic tools in the mouse has opened promising new avenues for investigation of fetal scarless wound healing. However, given the inherently high rates of morbidity and premature uterine contraction associated with fetal surgery, investigations of fetal scarless wound healing in vivo require a precise and reproducible surgical model. Here we detail a reliable model of fetal scarless wound healing in the dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
Introduction
Blessures fœtales de peau guérissent rapidement et scarlessly jusqu'à la fin de la gestation 1. Fœtale cicatrice réparation de la plaie est caractérisé par la régénération de l'architecture des tissus normaux et la fonction. Le passage d'une cicatrice à la cicatrisation phénotype se produit dans le troisième trimestre de la grossesse chez les humains et autour de jour embryonnaire 18 (E18) chez la souris 2,3. En comparaison à des adultes, fœtales réparation de plaie est caractérisée par une épithélialisation rapide, le dépôt de tissu conjonctif, et la migration des fibroblastes.
De nombreuses études ont offert des explications possibles pour le phénomène de cicatrisation sans cicatrice au cours du développement précoce du fœtus. L'inflammation est une composante fondamentale de la réparation des adultes de la plaie; Cependant, les blessures fœtales sont caractérisées par un manque d'inflammation aiguë 4. Si ce est une conséquence de l'immaturité fonctionnelle du système immunitaire au cours des étapes du fœtus demeure incertain. Une étude récente suggère que les différences dans l'abondance, maturity, et la fonction des mastocytes dans la peau fœtale E15 vs E18 peuvent être responsables de la transition d'un phénotype cicatrice, au moins chez la souris 3. D'autres études avancent que les différences dans les propriétés et l'abondance des macrophages de plaies foetales et adultes sont responsables de la réforme de la matrice extracellulaire normale (ECM) pendant la blessure fœtale réparation 5.
Les différences dans les facteurs environnementaux au cours du développement fœtal et adultes peuvent également affecter la cicatrisation des plaies. Longaker et ses collègues ont montré que la plaie fluide du fœtus possède des niveaux élevés d'activité de l'acide hyaluronique stimulant comparativement à aucun dans la plaie fluide 6 adultes. Par conséquent, des niveaux plus élevés de l'acide hyaluronique, un glycosaminoglycane qui favorise un micro-environnement favorable à la motilité cellulaire et de la prolifération, dans l'environnement de la plaie fœtal peuvent être responsables du phénotype cicatrice vu pendant le développement fœtal précoce. Autres lignes de point de preuves à l'effet que la fetal 'environnement de la plaie est relativement hypoxémique et immergée dans le liquide amniotique stérile riche en facteurs de croissance 7. Toutefois, aucune réponse définitive n'a été fournie pour un événement ou facteur critique durant l'embryogenèse qui déclenche la transition de la régénération cicatrice à la réparation fibrotique.
Comprendre les mécanismes responsables de la guérison sans cicatrice chez le fœtus nécessite un modèle précis et reproductible. Ici nous détaillons un modèle reproductible de fœtus la cicatrisation sans cicatrice dans le dos de E16,5 (cicatrice) et embryons a 18,5 (cicatrisation) de souris. En outre, des variations mineures de ce modèle peuvent être utilisés pour effectuer un certain nombre d'autres études, telles que l'analyse de l'expression des gènes des plaies fœtales et 8,9 de la peau. Étant donné que les grossesses chronométrés précisément sont essentielles pour la récapitulation succès de ce modèle de guérison de plaies sans cicatrice fœtale, nous avons également en détail notre protocole pour superovulation chronométré grossesses.
Protocole
NOTE: Toutes les procédures décrites dans ce document sont effectuées conformément aux directives établies par la commission administrative de Stanford sur le soin des animaux de laboratoire (APLAC).
1. Timed grossesses - Technique Superovulation (Figure 1)
NOTA: Le calendrier est précisément l'âge gestationnel des embryons de souris pour la chirurgie fœtale à E16,5 et a 18,5 est d'une importance critique. Dans cette section, nous détaillons notre protocole pour chronométrer grossesses de souris à l'aide de sérum juments enceintes (PMS) et la gonadotrophine chorionique humaine (hCG) pour induire une superovulation injections.
- Injecter souris femelles (<5 par cage) par voie intrapéritonéale (IP) avec 3,0 à 5,0 unités internationales (UI) de PMS dans un volume de 100 pi de PBS 1:00-15:00 pour le jour 1.
- Entre 12h00 et 14h00 du jour 3 (quarante-cinq à 47 h après l'injection PMS), injecter des souris femelles IP avec 3,0 à 5,0 UI de HCG dans un volume de 100 pi de PBS.
REMARQUE: Les induit d'injection de HCG ovulation environ 12 heures après l'injection. - Immédiatement après injections de HCG, se accoupler avec les femelles hommes âgés de 8 à 16 semaines.
NOTE: Nous plaçons généralement deux femelles dans une cage des hommes individuels. - Séparez les femelles des mâles dans la matinée du 4 jours (6h00-10:00 AM) et enregistrer en tant fœtale E0.5 d'âge.
REMARQUE: bouchons vaginaux peuvent être vérifiés à ce moment; Cependant, l'observation d'un bouchon vaginal ne garantit pas la grossesse et les femmes peut devenir enceinte quand aucune prise est observée. Étant donné que la grossesse est généralement observable par l'inspection et / ou à la palpation visuelle à un âge gestationnel E16,5 et a 18,5, la vérification des bouchons vaginaux le matin du jour 4 ne est pas strictement nécessaire. Dans notre expérience, et selon la souche, environ 30-50% des femmes super-ovulé devenir enceinte en utilisant la technique décrite ici.
pg "/>
Figure 1. Schéma de Superovulation Technique. De procédure de représentation schématique pour superovulation chronométré grossesses chez les souris. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
2. murin fœtale chirurgie (Dorsale Blessant) sur E16,5 et a 18,5 embryons (Figure 2)
- Avant l'intervention, nettoyer toutes les surfaces de la salle d'opération et de l'équipement avec 70% d'alcool isopropylique. En outre, stériliser toutes les fournitures chirurgicales et des instruments qui seront utilisés dans la procédure en leur autoclavage. Certaines institutions peuvent permettre l'utilisation ultérieure de la stérilisation de perles chaud. Par opération, utiliser des packs stériles qui comprennent la gaze et des instruments chirurgicaux.
- Induire une anesthésie chez les femmes enceintes (fœtale E16,5 d'âge ou a 18,5) sous mélange isoflurane / oxygène de 2,5% à 2 L par minute suivie d'entretien de l'anesthésie à 1 L par minute.
- Pour conanesthésie bonne société, se assurer que les réflexes de pédale profondes de la souris sont supprimées et placez la souris en position couchée.
- Appliquer une pommade ophtalmique vétérinaire tels que Puralube pour éviter l'irritation ou la sécheresse des yeux lors de la procédure.
- Préparer l'abdomen par administration d'une légère application de crème dépilatoire pour pas plus de 30 secondes (figure 2A).
- Préparer l'abdomen pour la chirurgie aseptique povidone-iode et l'alcool (figure 2B et 2C).
- Effectuer laparotomie médiane sous microscope avec des ciseaux de microchirurgie (Figure 2D et 2E).
- Exposez délicatement l'utérus et le fœtus sélectionné pour la chirurgie (figure 2F).
- Irriguer champ opératoire avec chaud (38 ° C) une solution saline tamponnée au phosphate (PBS) en utilisant une aiguille émoussée pointe
NOTE: On peut être faite avec précaution en courbant la pointe d'une aiguille de gros calibre. (Figure 2G et 2H). - Positionner le foetus de manière à permettres accès complet à dos.
- Passez un point de cordons de la bourse en utilisant 7-0 suture de nylon dans l'utérus recouvrant le site d'destiné dorsale blessure (Figure 2I). Position sac chaîne sur une région de dos à gauche ou à droite de la moelle épinière, et dans une région de la paroi utérine dépourvue de gros vaisseaux sanguins.
- Faire une incision de 3 mm à travers la paroi de l'utérus et le sac amniotique dans le centre de la chaîne de sac (Figure 2J).
- Irriguer site d'incision avec chaud (38 ° C) PBS.
- Avec des ciseaux de microchirurgie, couper une seule blessure excision de pleine épaisseur, environ 1 mm de longueur, dans le dos du fœtus.
- Doucement blot site d'incision sécher avec du coton-applicateur à bout.
- Injecter 3 microlitres le volume d'encre de Chine sous-cutanée dans le site de la plaie pour marquer l'emplacement de la plaie (Figure 2K).
- Rincer avec une chaude (38 ° C) pour assurer PBS encre a été retenu dans le site de la plaie.
- Avoir chirurgicale assistant inject chaude (38 ° C) par PBS émoussée pointe 10 G seringue dans le sac amniotique que le cordon de bourse est fermée (Figure 2L). Rentrer seringue fermeture chaîne de sac à main est presque terminée (Figure 2M).
- Revenir doucement l'utérus dans la cavité abdominale (Figure 2N).
- Evert la peau et du péritoine.
- Ont assistante en chirurgie irriguer cavité abdominale avec chaud (38 ° C) PBS.
- Fermer l'abdomen rapidement en agrafant la peau et du péritoine fermé (Figure 2O). La fermeture standard est réalisée en deux couches; péritoine et de muscle abdominal dans une couche, le tissu sous-cutané et la peau dans la seconde couche. Pour sacrifice immédiat et la récolte du fœtus, notre démonstration montre la fermeture en une seule couche.
- Placez l'animal sous observation dans un incubateur chaud réglé à 37 ° C pendant 30 min ou jusqu'à ce que l'animal ne reprenne conscience suffisante pour maintenir décubitus sternal.
- Ne pas returne à l'animal de compagnie d'autres animaux jusqu'à ce qu'il ait complètement récupéré de la procédure.
- En me éveillant de l'anesthésie et pendant la suite 48 h, administrer l'injection sous-cutanée de la buprénorphine (0,05 mg / kg) toutes les 12 h pour l'analgésie au besoin en fonction de l'évaluation de la douleur. Administrer carprofène (5 mg / kg) par injection sous-cutanée pour un allégement supplémentaire de la douleur post-opératoire si nécessaire.
- Animaux Retour à la cage et leur fournir des vivres et de l'eau ad libitum.
- Surveiller de près les manifestations de douleur.
- 48 heures après la chirurgie, sacrifiez mère enceinte avec une overdose d'isoflurane et la récolte blessés fœtus. Afin de faire cela, ajuster la concentration d'isoflurane à 5% ou plus et de maintenir l'exposition pendant 1 min après l'arrêt de la respiration. Confirmez l'euthanasie à la dislocation cervicale. Prélever un embryon non blessé pour le contrôle d'âge appariés. Embryons tardives devraient avoir une méthode distincte de l'euthanasie conformément aux recommandations du IACUC, comme decapitation, dislocation cervicale ou injection de produits chimiques.
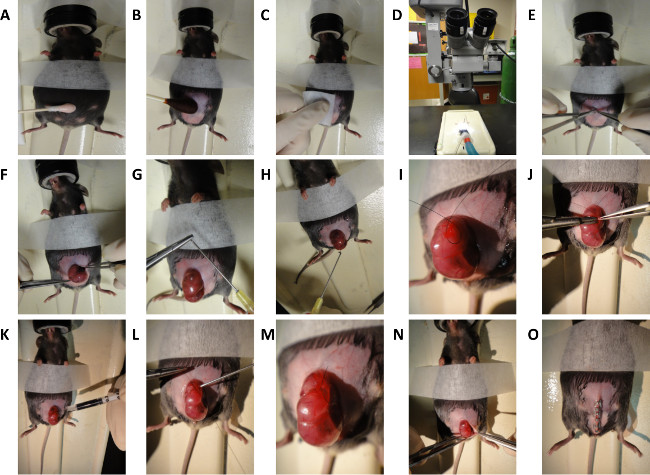
Figure 2. Schéma pour la chirurgie fœtale murin. Étapes générales pour dorsale blessant à E16,5 et d'embryons de souris a 18,5. (A) Epilation de l'abdomen de la souris. (B et C) Préparation de l'abdomen de la souris. (D) Microscope utilisé pour chirurgicale procédure. (E) laparotomie médiane. (F) Exposition de l'utérus. (G) Création d'aiguille émoussée pointe. (H) Irrigation de l'utérus avec une solution saline chaude. (i) la création d'une chaîne de sac suture. (J) incision dans l'utérus murales et 1 mm complète de génération de la plaie d'excision épaisseur. (K) de l'injection sous-cutanée de l'encre de Chine. (L et M) Clôture de cordons de la bourse. suture (N et O)Clôture de l'abdomen. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Résultats
Pour l'analyse histologique, les plaies cutanées dans la peau dorsale de E16,5 et a 18,5 embryons de souris doivent être récoltées 48 h après la blessure, fixé à 4% PFA, et inclus en paraffine. Dans les modèles transgéniques fluorescents, cryoconservation OCT peut être approprié. Il existe plusieurs taches qui peuvent être utilisés pour visualiser l'architecture tissulaire et cellulaire conjonctif. Hématoxyline et l'éosine est une tache deux couleurs qui colore les noyaux bleus et structures ?...
Discussion
Le protocole chirurgical présenté ici décrit un modèle excision des fœtus guérison sans cicatrice murin d'abord publié en 2006 par notre laboratoire 10. En plus d'autres modèles établis de blessure excision 11, modèles incision de fœtus guérison sans cicatrice murin existent ainsi 12,13. Enquêtes de fœtus cicatrisation sans cicatrice chez le singe, l'agneau, le lapin, l'opossum, et le rat ont été signalés 14-17. Cependant, les souris représent...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Ce travail a été financé en partie par une subvention du NIH subvention R01 GM087609 (à HPL), un cadeau d'Ingrid Lai et le projet de loi en l'honneur de Shu Shu Anthony (à HPL), subvention du NIH U01 HL099776 (MTL), le Laboratoire pour Hagey pédiatrique médecine régénérative et la Fondation Oak (MTL et HPL). GMV a été soutenu par l'École de médecine de Stanford, le Programme de formation scientifique médicale de Stanford, et l'octroi de formation NIGMS GM07365. MSH a été soutenu par CIRM clinique Fellow Subvention de formation TG2-01159. WXH a été soutenu par un financement de la Fondation Sarnoff cardiovasculaire.
matériels
| Name | Company | Catalog Number | Comments |
| 7-O MONOSOF Suture | eSuture | SN-1647G | |
| Surgical Forceps | Kent Scientific | INS650916 | |
| Micro-scissors | Kent Scientific | INS600127 | |
| Autoclip 9 mm | Texas Scientific Instruments | 205060 | |
| Insulin Syringe | Thermo Fisher Scientific | 22-272-382 | |
| Black Pigment | AIMS | 242 | |
| BD Safety-Lok 3 ml Syringe | BD Biosciences | 309596 | |
| Phosphate Buffered Saline | Life Technologies | 10010-049 | |
| OPMI-MD Surgical Microscope | Carl Zeiss Surgical Inc | ||
| Pregnant Mares Serum (PMS) | Millipore | 367222 | |
| Human Chorionic Gonadotropin (HCG) | Sigma-Aldrich | CG10 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| Nair (depilatory cream) | Church and Dwight Co. | 22600267058 |
Références
- Larson, B. J., Longaker, M. T., Lorenz, H. P. Scarless fetal wound healing: a basic science review. Plastic and reconstructive surgery. 126, 1172-1180 (2010).
- Wilgus, T. A. Regenerative healing in fetal skin: a review of the literature. Ostomy/wound management. 53, 16-31 (2007).
- Wulff, B. C., et al. Mast cells contribute to scar formation during fetal wound healing. The Journal of investigative dermatology. 132, 458-465 (2012).
- Lorenz, H. P., Adzick, N. S. Scarless skin wound repair in the fetus. The Western journal of medicine. 159, 350-355 (1993).
- Longaker, M. T., et al. Wound healing in the fetus. Possible role for inflammatory macrophages and transforming growth factor-beta isoforms. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 2, 104-112 (1994).
- Longaker, M. T., et al. Studies in fetal wound healing. IV. Hyaluronic acid-stimulating activity distinguishes fetal wound fluid from adult wound fluid. Annals of surgery. 210, 667-672 (1989).
- Colombo, J. A., Napp, M., Depaoli, J. R., Puissant, V. Trophic influences of human and rat amniotic fluid on neural tube-derived rat fetal cells. International journal of developmental neuroscience : the official journal of the International Society for Developmental Neuroscience. 11, 347-355 (1993).
- Colwell, A. S., Longaker, M. T., Peter Lorenz, H. Identification of differentially regulated genes in fetal wounds during regenerative repair. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 16, 450-459 (2008).
- Hu, M. S., et al. Gene expression in fetal murine keratinocytes and fibroblasts. The Journal of surgical research. , (2014).
- Colwell, A. S., Krummel, T. M., Longaker, M. T., Lorenz, H. P. An in vivo mouse excisional wound model of scarless healing. Plastic and reconstructive surgery. 117, 2292-2296 (2006).
- Wilgus, T. A., et al. The impact of cyclooxygenase-2 mediated inflammation on scarless fetal wound healing. The American journal of pathology. 165, 753-761 (2004).
- Iocono, J. A., Ehrlich, H. P., Keefer, K. A., Krummel, T. M. Hyaluronan induces scarless repair in mouse limb organ culture. Journal of pediatric surgery. 33, 564-567 (1998).
- Chopra, V., Blewett, C. J., Krummel, T. M. Transition from fetal to adult repair occurring in mouse forelimbs maintained in organ culture. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 5, 47-51 (1997).
- Adzick, N. S., Longaker, M. T. Animal models for the study of fetal tissue repair. The Journal of surgical research. 5, 47-51 (1991).
- Block, M. Wound healing in the new-born opossum (Didelphis virginianam). Nature. 187, 340-341 (1960).
- Longaker, M. T., Dodson, T. B., Kaban, L. B. A rabbit model for fetal cleft lip repair. Journal of oral and maxillofacial surgery : official journal of the American Association of Oral and Maxillofacial Surgeons. 48, 714-719 (1990).
- Longaker, M. T., et al. A model for fetal cleft lip repair in lambs. Plastic and reconstructive surgery. 90, 750-756 (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon