JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
흉터 상처 수리의 마우스 태아의 피부 모델
* 이 저자들은 동등하게 기여했습니다
요약
During mammalian development, early gestational skin wounds heal without a scar. Here we detail a reliable and reproducible model of fetal scarless wound healing in the cutaneous dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
초록
Early in utero, but not in postnatal life, cutaneous wounds undergo regeneration and heal without formation of a scar. Scarless fetal wound healing occurs across species but is age dependent. The transition from a scarless to scarring phenotype occurs in the third trimester of pregnancy in humans and around embryonic day 18 (E18) in mice. However, this varies with the size of the wound with larger defects generating a scar at an earlier gestational age. The emergence of lineage tracing and other genetic tools in the mouse has opened promising new avenues for investigation of fetal scarless wound healing. However, given the inherently high rates of morbidity and premature uterine contraction associated with fetal surgery, investigations of fetal scarless wound healing in vivo require a precise and reproducible surgical model. Here we detail a reliable model of fetal scarless wound healing in the dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
서문
태아 피부 상처 임신 1 늦게까지 신속하고 scarlessly 치유. 태아 흉터 상처 수리는 정상 조직의 구조와 기능의 재생이 특징입니다. 흉터 표현형에 흉터에서의 전환은 인간 및 마우스 2,3에 배아 일 18 (E18)의 주위에 임신의 세 번째 임신에서 발생합니다. 성인에 비해, 상처 복구 태아 급속한 상피화, 결합 조직의 증착, 및 섬유 아세포 이동을 특징으로한다.
많은 연구 초기 태아의 개발 기간 동안 흉터 상처 치유의 현상에 대한 가능한 설명을 제안했다. 염증은 성인 상처 수리의 기본 구성 요소입니다; 그러나, 태아의 상처는 급성 염증 (4)의 부족을 특징으로한다. 이 단계 동안 여부 태아 면역계의 작용 미성숙 결과는 불분명하다. 최근 연구 제안이 풍부, 매트의 차이urity 및 E18 태아의 피부 대 E15에서 비만 세포의 기능 이상 마우스 3 흉터 표현형으로의 전환에 대한 책임이 있습니다. 다른 연구는 속성과 태아와 성인 상처 대 식세포의 풍요 로움의 차이가 태아의 상처 수리 (5) 동안 정상 세포 외 기질 (ECM)의 개혁에 대한 책임이 있음을 가정하는.
태아 및 성인 개발시 환경 요인의 차이도 상처 복구에 영향을 미칠 수 있습니다. Longaker와 동료들은 태아의 상처 액이 6 유체 상처 성인 없음에 비해 히알루 론산 자극 활동의 높은 수준을 보유하고 있음을 보여 주었다. 따라서, 태아 상처 환경에서 히알루 론산, 세포 운동성 및 확산에 도움이 미세 환경을 촉진하는 글리코 사 미노 글리 칸, 높은 수준의 초기 태아의 개발 과정에서 볼 수있는 흉터의 표현형에 대한 책임을 할 수있다. 태아는 사실에 근거 포인트의 다른 라인L 상처 환경은 상대적으로 저산소증과 성장 인자 7 풍부한 무균 양수에 잠겨있다. 그러나, 확실한 대답은 섬유 성 수리에 흉터 재생으로의 전환을 트리거 배아 중 중요한 사건이나 요인에 제공 없습니다.
태아의 흉터 치유 메커니즘 책임을 이해하는 것은 정확하고 재현성 모델을 필요로한다. 여기 세부 E16.5 (흉터) 및 E18.5 (흉터) 마우스 배아의 배부 태아 흉터 상처 치유의 재현 모델. 또한,이 모델의 경미한 변화는 이러한 태아 피부 및 상처 8,9의 유전자 발현 분석과 같은 추가의 연구들을 수행하는데 이용 될 수있다. 정확하게 시간이 초과 임신이 태아의 흉터 상처 치유 모델의 성공적인 반복 설에 중요한 점을 감안, 우리 과배란 초과 임신에 대해서도 상세하게 우리의 프로토콜입니다.
프로토콜
참고 :이 문서에 설명 된 모든 절차는 실험 동물 관리에 스탠포드 행정 패널 (APLAC)에 의해 설립 지침에 따라 수행된다.
1. 시간 제한 임신 - 과배란 기술 (그림 1)
참고 : 정확하게 E16.5 및 E18.5에서 태아 수술을 위해 마우스 배아의 임신 기간 타이밍은 매우 중요합니다. 과배란을 유도하기 위해 임신 한 암컷 혈청 (PMS) 및 인간 융모 성 성선 자극 호르몬 (HCG) 주사를 사용하여 마우스 임신 타이밍에 대한 우리의 프로토콜이 절 우리의 세부 사항.
- 1:00 하루 1 3:00 PM 사이에 100 μl의 PBS의 볼륨 PMS의 3.0-5.0 국제 단위 (IU)와 여성 마우스 (케이지 당 <5) 복강 내 (IP)를 주입한다.
- 12:00 3 일 (사십 오 PMS 주입 후 시간 47) 2:00시 사이에, 100 μl의 PBS의 볼륨 HCG의 3.0-5.0 IU와 여성 쥐 IP를 주입.
참고 : HCG 주입 유도한다 배란 약 12 시간 후 분사. - 즉시 HCG 주사 다음 8-16 주령의 수컷과 암컷을 짝짓기.
참고 : 우리는 일반적으로 개별 남성의 케이지에 두 여성을 배치합니다. - 태아 연령 E0.5으로 - (10:00 AM 6:00) 기록 4 일의 아침에 남성에서 분리 된 여성.
참고 : 질 플러그가이 시간에 확인할 수 있습니다; 그러나, 질 플러그의 관찰은 임신을 보장하지 않으며 어떠한 플러그가 관찰되지 않을 때 여성은 임신이 될 수 있습니다. 임신 4 일의 아침에 질 플러그 검사, 임신 나이 E16.5 및 E18.5에서 육안 검사 및 / 또는 촉진에 의해 일반적으로 관찰 할 수 있음을 감안할 때 꼭 필요한 것은. 경험상, 상기 균주에 따라 슈퍼 배란 여성의 약 30 % ~ 50 %가 여기에 설명 된 기술을 사용하여 임신.
PG "/>
그림 과배란 기법에 대한 도식. 마우스에서 과배란 초과 임신에 대한 회로도를 보여주는 절차. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 쥐과 태아 수술 E16.5 및 E18.5 배아에 (등쪽 부상) (그림 2)
- 절차 전에, 70 % 이소 프로필 알코올 수술실 및 장비의 모든 표면을 청소합니다. 또한,이를 오토 클레이브에 의해 절차에서 사용될 모든 수술 용품 및기구 소독. 일부 기관들은 뜨거운 비드 살균 이후의 사용을 허용 할 수 있습니다. 작업 당, 거즈 및 수술 도구를 포함 무균 팩을 사용합니다.
- 분당 1 L에 유지 보수 마취 다음에 분당 2 L에서 2.5 % 이소 플루 란 / 산소 혼합물에서 임신 한 어머니의 마취 (태아 연령 E16.5 또는 E18.5)를 유도한다.
- 사기하려면회사 적절한 마취, 마우스의 깊은 페달 반사가 억제되어 있는지 확인하고 발생하기 쉬운 위치에 마우스를 놓습니다.
- Puralube이 절차를 수행하는 동안 눈에 자극이나 건조 함을 방지하기 위해 같은 수의사 안과 연고를 적용합니다.
- 더 이상 30 초 (그림 2A)을 위해 제모 크림의 빛 응용 프로그램을 투여하여 복부를 준비합니다.
- 포비돈 - 요오드 알코올 (그림 2B 및 2C) 무균 수술을 위해 복부를 준비합니다.
- 미세 수술 가위 (그림 2D 및 2E)를 사용하여 현미경으로 중간 선 개복술을 수행합니다.
- 조심스럽게 수술 (그림 2 층)으로 선택 자궁과 태아를 노출합니다.
- 뭉툭한 팁 바늘을 사용하여 따뜻한 (38 ° C) 인산염 완충 식염수 (PBS)와 수술 필드를 관개
참고 : 하나는 조심스럽게 큰 구멍 바늘의 끝 부분을 구부려서 할 수있다. (그림 2G 및 2H). - 허용하는 방식으로 태아의 위치를배부에 대한 전체 액세스 권한을에요.
- 의도 지느러미 상처 (그림 2I)의 사이트를 덮는 자궁을 통해 7-0 나일론 봉합사를 사용하여 지갑 문자열 스티치를 전달합니다. 위치 지갑 왼쪽 또는 척수의 오른쪽에 배부의 영역을 통해 문자열, 큰 혈관이없는 자궁 벽의 영역에서.
- 지갑 문자열 (그림 2J)의 중심에 자궁 벽과 양막을 통해 3mm의 절개를합니다.
- 따뜻한 (38 ° C) PBS와 절개 사이트를 관개.
- 미세 수술 가위를 사용하여 태아의 등쪽에서, 하나의 전층 상처 절제 길이 약 1mm 잘라.
- 부드럽게 얼룩 절개 사이트는면 팁 어플리케이터를 건조.
- 상처의 위치 (그림 2K)를 표시하기 위해 상처 부위에 3 μL 볼륨 인도 잉크 피하 주입한다.
- 잉크가 상처 사이트 내에서 유지 된 보장하기 위해 따뜻한 (38 ° C) PBS로 세척하십시오.
- 수술 보조 난 되세요nject 지갑 문자열로 양막에 무딘 팁 10 G 주사기를 통해 따뜻한 (38 ° C) PBS (그림 2L)를 폐쇄한다. 지갑 문자열 폐쇄 완료 (그림 2M)에 가까워지면서 주사기를 집어 넣으십시오.
- 조심스럽게 복강 (그림 2N)로 자궁을 반환합니다.
- 에버트 피부와 복막.
- 따뜻한 (38 ° C) PBS로 복강 수술 보조 관개했다.
- 피부와 복막을 스테이플 링으로 빠르게 닫기 복부 (그림 2O)을 마감했다. 표준 클로저는 두 층에서 수행된다; 복막과 제 2 층에서의 하나의 층, 피하 조직 및 피부 복근. 즉시 희생과 태아의 수확을 위해, 우리의 시위는 한 층에 폐쇄를 보여줍니다.
- 30 분 동안이나 동물이 흉골 드러 누움을 유지하기에 충분한 의식을 회복 할 때까지 37 ° C로 설정 따뜻한 인큐베이터에서 관찰에서 동물을 놓습니다.
- 마지막 ret하지 마십시오완전히 절차에서 회복 될 때까지 다른 동물의 회사에 동물을 항아리.
- 마취에서 그 이후 48 시간 동안 각성시, 부 프레 노르 핀의 피하 주사 (0.05 ㎎ / ㎏) 통증 평가에 따라 필요에 따라 진통제마다 12 시간을 관리 할 수 있습니다. 필요에 따라 추가 수술 후 통증 완화를 위해 피하 주사를 통해 카프로 펜 (5 ㎎ / ㎏)을 관리합니다.
- 케이지에 동물을 반환하고 물과식이로 제공합니다.
- 통증의 양상 면밀히 모니터링합니다.
- 48 시간의 수술 후는, 이소 플루 란과 수확 부상 태아의 과다 복용으로 임신 한 어머니를 희생. 이를 위해, 5 % 이상으로 이소 플루 란 농도를 조정하고 호흡의 중단 후 1 분 동안 노출을 유지한다. 자궁 경부 전위와 안락사를 확인합니다. 연령대 제어를위한 unwounded 배아를 수확. 늦은 배아는 같은 IACUC의 권고와 일치 안락사의 별도의 방법이 있어야 드인두세, 자궁 전위, 또는 화학 물질 주입.
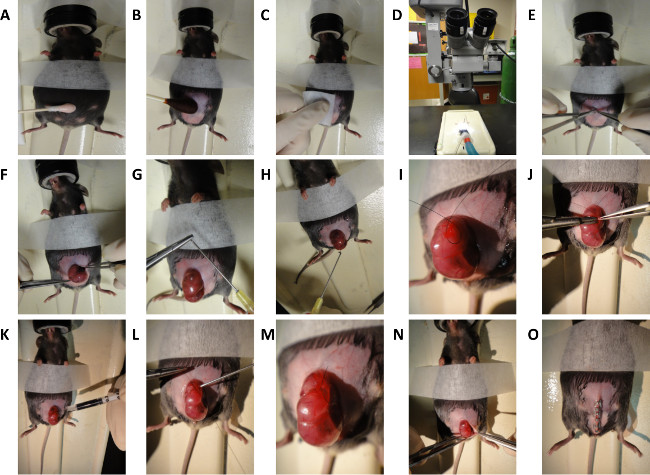
그림 2. 회로도 쥐과 태아 외과. E16.5 및 E18.5 마우스 배아에 상처를 입는 등의 일반 단계를 반복합니다. (A) 마우스 복부의 탈모. (B 및 C) 마우스 복부의 준비. (D) 현미경 수술에 사용 자궁을 통해 지갑 문자열 봉합의 과정. (E) 중간 선 개복술. (F) 자궁의 노출. 뭉툭한 팁 바늘 (G) 작성. 따뜻한 식염수와 자궁의 (H) 관개. (I) 작성. (J) 절개 벽과 1mm 전체 두께 절제 상처 발생. (K) 인도 잉크의 피하 주사. (L과 M) 지갑 문자열 봉합의 폐쇄. (N과 O)복부의 폐쇄. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
조직 학적 분석을 위해, E16.5 및 E18.5 마우스 배아의 등 피부에 피부의 상처는 48 시간의 PFA 4 %에 고정 후 상처, 및 파라핀을 수확해야합니다. 형광 형질 전환 모델에서, 빛 간섭 단층 냉동 보존이 적합 할 수 있습니다. 세포 및 결합 조직 구조를 시각화하는데 이용 될 수있는 몇 가지 얼룩이있다. 헤 마톡 실린 및 에오신 파란색 핵 및 산성 구조 (즉., 세포질과 세포 외 콜라겐) 레드, 핑크, 오렌?...
토론
여기에 제시된 수술 프로토콜은 먼저 우리의 실험실 (10)에 의해 2006 년에 출판 된 태아 쥐의 흉터 치유 절제 모델에 대해 설명합니다. 절제 상처 (11)의 다른 모델의 확립 외에, 뮤린 태아 흉터, 창상 치유의 모델 (12, 13)뿐만 아니라 존재한다. 원숭이, 양, 토끼, 쥐, 쥐 태아 흉터 상처 치유의 조사는 14 ~ 17보고되었다. 그러나 마우스는 그들의 비교적 낮은 당 일일 케이...
공개
The authors have nothing to disclose.
감사의 말
이 작품은 (HPL에) NIH 보조금 R01 GM087609, (MTL에) (HPL에) 안토니 슈, NIH 보조금 U01의 HL099776의 명예에 잉그리드 라이 빌 슈에서 선물, Hagey 연구소에 대한로부터 연구비 일부 지원 소아 재생 의학 및 (MTL과 HPL에) 오크 재단. GGW 의학의 스탠포드 대학, 스탠포드 의료 과학자 훈련 프로그램에 의해 지원되며, NIGMS 훈련 보조금 GM07365했다. MSH는 CIRM 임상 연구원 교육 그랜트 TG2-01159에 의해 지원되었다. WXH가 노프 심장 혈관 재단 기금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 7-O MONOSOF Suture | eSuture | SN-1647G | |
| Surgical Forceps | Kent Scientific | INS650916 | |
| Micro-scissors | Kent Scientific | INS600127 | |
| Autoclip 9 mm | Texas Scientific Instruments | 205060 | |
| Insulin Syringe | Thermo Fisher Scientific | 22-272-382 | |
| Black Pigment | AIMS | 242 | |
| BD Safety-Lok 3 ml Syringe | BD Biosciences | 309596 | |
| Phosphate Buffered Saline | Life Technologies | 10010-049 | |
| OPMI-MD Surgical Microscope | Carl Zeiss Surgical Inc | ||
| Pregnant Mares Serum (PMS) | Millipore | 367222 | |
| Human Chorionic Gonadotropin (HCG) | Sigma-Aldrich | CG10 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| Nair (depilatory cream) | Church and Dwight Co. | 22600267058 |
참고문헌
- Larson, B. J., Longaker, M. T., Lorenz, H. P. Scarless fetal wound healing: a basic science review. Plastic and reconstructive surgery. 126, 1172-1180 (2010).
- Wilgus, T. A. Regenerative healing in fetal skin: a review of the literature. Ostomy/wound management. 53, 16-31 (2007).
- Wulff, B. C., et al. Mast cells contribute to scar formation during fetal wound healing. The Journal of investigative dermatology. 132, 458-465 (2012).
- Lorenz, H. P., Adzick, N. S. Scarless skin wound repair in the fetus. The Western journal of medicine. 159, 350-355 (1993).
- Longaker, M. T., et al. Wound healing in the fetus. Possible role for inflammatory macrophages and transforming growth factor-beta isoforms. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 2, 104-112 (1994).
- Longaker, M. T., et al. Studies in fetal wound healing. IV. Hyaluronic acid-stimulating activity distinguishes fetal wound fluid from adult wound fluid. Annals of surgery. 210, 667-672 (1989).
- Colombo, J. A., Napp, M., Depaoli, J. R., Puissant, V. Trophic influences of human and rat amniotic fluid on neural tube-derived rat fetal cells. International journal of developmental neuroscience : the official journal of the International Society for Developmental Neuroscience. 11, 347-355 (1993).
- Colwell, A. S., Longaker, M. T., Peter Lorenz, H. Identification of differentially regulated genes in fetal wounds during regenerative repair. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 16, 450-459 (2008).
- Hu, M. S., et al. Gene expression in fetal murine keratinocytes and fibroblasts. The Journal of surgical research. , (2014).
- Colwell, A. S., Krummel, T. M., Longaker, M. T., Lorenz, H. P. An in vivo mouse excisional wound model of scarless healing. Plastic and reconstructive surgery. 117, 2292-2296 (2006).
- Wilgus, T. A., et al. The impact of cyclooxygenase-2 mediated inflammation on scarless fetal wound healing. The American journal of pathology. 165, 753-761 (2004).
- Iocono, J. A., Ehrlich, H. P., Keefer, K. A., Krummel, T. M. Hyaluronan induces scarless repair in mouse limb organ culture. Journal of pediatric surgery. 33, 564-567 (1998).
- Chopra, V., Blewett, C. J., Krummel, T. M. Transition from fetal to adult repair occurring in mouse forelimbs maintained in organ culture. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 5, 47-51 (1997).
- Adzick, N. S., Longaker, M. T. Animal models for the study of fetal tissue repair. The Journal of surgical research. 5, 47-51 (1991).
- Block, M. Wound healing in the new-born opossum (Didelphis virginianam). Nature. 187, 340-341 (1960).
- Longaker, M. T., Dodson, T. B., Kaban, L. B. A rabbit model for fetal cleft lip repair. Journal of oral and maxillofacial surgery : official journal of the American Association of Oral and Maxillofacial Surgeons. 48, 714-719 (1990).
- Longaker, M. T., et al. A model for fetal cleft lip repair in lambs. Plastic and reconstructive surgery. 90, 750-756 (1992).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유