É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo de pele Rato Fetal de reparação de feridas Scarless
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
During mammalian development, early gestational skin wounds heal without a scar. Here we detail a reliable and reproducible model of fetal scarless wound healing in the cutaneous dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
Resumo
Early in utero, but not in postnatal life, cutaneous wounds undergo regeneration and heal without formation of a scar. Scarless fetal wound healing occurs across species but is age dependent. The transition from a scarless to scarring phenotype occurs in the third trimester of pregnancy in humans and around embryonic day 18 (E18) in mice. However, this varies with the size of the wound with larger defects generating a scar at an earlier gestational age. The emergence of lineage tracing and other genetic tools in the mouse has opened promising new avenues for investigation of fetal scarless wound healing. However, given the inherently high rates of morbidity and premature uterine contraction associated with fetal surgery, investigations of fetal scarless wound healing in vivo require a precise and reproducible surgical model. Here we detail a reliable model of fetal scarless wound healing in the dorsum of E16.5 (scarless) and E18.5 (scarring) mouse embryos.
Introdução
Feridas cutâneas fetais curar rapidamente e scarlessly até o final da gestação 1. Fetal reparação ferida scarless é caracterizada pela regeneração da arquitetura do tecido normal e função. A transição de uma scarless a cicatrizes fenótipo ocorre no terceiro trimestre da gravidez em seres humanos e por volta do dia embrionário 18 (E18) em ratos 2,3. Em comparação com a de adultos, a reparação de feridas fetal é caracterizada pela rápida epitelização, a deposição de tecido conjuntivo, e a migração de fibroblasto.
Muitos estudos têm oferecido possíveis explicações para o fenômeno da cicatrização de feridas scarless durante o desenvolvimento fetal precoce. A inflamação é um componente fundamental de reparação de feridas de adultos; No entanto, as feridas do feto são caracterizadas por uma ausência de inflamação aguda 4. Se isto é uma conseqüência da imaturidade funcional do sistema imunológico durante os estágios fetais permanece obscuro. Um estudo recente sugere que as diferenças na abundância, maturity, e a função de mastócitos em E15 vs pele fetal E18 podem ser responsáveis para a transição de um fenótipo sem cicatrizes, pelo menos no rato 3. Outros estudos sustentam que as diferenças nas propriedades e abundância de macrófagos feridas fetais e adultos são responsáveis pela reforma da matriz extracelular normal (ECM) durante a reparação de feridas fetal 5.
Diferenças em fatores ambientais durante o desenvolvimento fetal e adulto também pode afetar a reparação de feridas. Longaker e seus colegas mostraram que o líquido da ferida de o feto possui altos níveis de atividade estimulante ácido hialurônico comparado a nenhum adulto na ferida fluido 6. Consequentemente, os níveis mais elevados de ácido hialurónico, um glicosaminoglicano que promove um microambiente propício à motilidade e proliferação celular, no ambiente da ferida fetal pode ser responsável pelo fenótipo scarless visto durante o desenvolvimento fetal precoce. Outras linhas de evidência apontam para o fato de que o fetaambiente l ferida é relativamente hipoxêmica e submerso no líquido amniótico estéril rico em fatores de crescimento 7. No entanto, nenhuma resposta definitiva foi fornecido para um evento crítico ou fator durante a embriogênese que dispara a transição de regeneração scarless para reparação fibrótica.
A compreensão dos mecanismos responsáveis pela cura scarless no feto necessita de um modelo preciso e reprodutível. Aqui nós detalhe um modelo reprodutível de scarless cicatrização de feridas fetal no dorso de E16.5 (scarless) e embriões E18.5 (cicatrização) do mouse. Além disso, pequenas variações deste modelo pode ser utilizado para executar uma série de outros estudos, como a análise de feridas fetais e 8,9 pele expressão gênica. Dado que as gravidezes precisamente cronometradas são críticos para recapitulação sucesso deste modelo de cicatrização fetal scarless ferida, nós também detalhe nosso protocolo para gestações de superovulação cronometrado.
Protocolo
NOTA: Todos os procedimentos descritos neste trabalho são realizados de acordo com as diretrizes estabelecidas pelo Painel Administrativo Stanford em Laboratory Animal Care (APLAC).
1. Temporário Gestações - Técnica superovulação (Figura 1)
NOTA: Precisamente cronometrar a idade gestacional de embriões de camundongos para a cirurgia fetal em E16.5 e E18.5 é de importância crítica. Nesta seção, detalhe nosso protocolo para cronometrar gestações rato usando grávida éguas soro (PMS) e gonadotrofina coriônica humana (HCG) injeções para induzir superovulação.
- Injectar camundongos fêmeas (<5 por gaiola) por via intraperitoneal (IP) com 3,0-5,0 unidades internacionais (UI) de PMS em um volume de 100 l PBS 01:00 - 15:00 para o dia 1.
- Entre as 12:00 e as 14:00 do dia 3 (quarenta e cinco a 47 horas após a injecção de PMS), injectar ratinhos fêmea IP com 3,0-5,0 UI de HCG em um volume de 100 ul de PBS.
NOTA: Os induz injeção de HCG ovulação, aproximadamente, 12 h pós-injecção. - Imediatamente após injeções de HCG, companheiro fêmeas com machos com idade entre 8-16 semanas.
ATENÇÃO: Nós normalmente colocar duas fêmeas em uma gaiola de machos individuais. - Fêmeas separados de homens na manhã do dia 4 (06:00 - 10:00) e registro como E0.5 idade fetal.
NOTA: plugs vaginais pode ser verificado neste momento; No entanto, a observação de um plug vaginal não garante a gravidez e as fêmeas podem engravidar quando nenhum plug é observado. Tendo em conta que a gravidez é normalmente observada por inspeção e / ou palpação visual em idades gestacionais E16.5 e E18.5, verificação de fichas vaginais na manhã do dia 4 não é estritamente necessário. Na nossa experiência, e, dependendo da estirpe, aproximadamente 30-50% das mulheres super-ovulado engravidar utilizando a técnica aqui descrita.
pg "/>
Figura 1. Esquema de Técnica superovulação. Procedimento exibição Esquema de superovulação cronometrado gestações em camundongos. Por favor, clique aqui para ver uma versão maior desta figura.
2. Cirurgia Fetal Murino (Dorsal o ferimento) em E16.5 e E18.5 embriões (Figura 2)
- Antes do procedimento, limpe todas as superfícies da sala de cirurgia e equipamentos com 70% de álcool isopropílico. Além disso, todos os fornecimentos esterilizar instrumentos cirúrgicos e que serão utilizados no processo de autoclavagem por eles. Algumas instituições podem permitir o uso posterior de esterilização quente talão. Por operação, use embalagens esterilizadas que incluem gaze e instrumentos cirúrgicos.
- Induzir a anestesia em mães grávidas (E16.5 idade fetal ou E18.5) sob 2,5% de mistura de isoflurano / oxigênio a 2 L por min seguido de manutenção da anestesia em 1 L por min.
- Para conempresa anesthetization adequado, garantir os reflexos profundos pedal do mouse são suprimidas e coloque o mouse na posição prona.
- Aplique uma pomada oftálmica vet como Puralube para evitar irritação nos olhos ou secura durante o procedimento.
- Prepare abdômen pela administração de uma leve aplicação de creme depilatório para não mais do que 30 segundos (Figura 2A).
- Prepare abdômen para a cirurgia asséptica com iodopovidona e álcool (Figura 2B e 2C).
- Execute linha média laparotomia sob o microscópio com tesoura microcirúrgica (Figura 2D e 2E).
- Gentilmente expor útero e feto selecionados para a cirurgia (Figura 2F).
- Lavar campo cirúrgico com água morna (38 ° C) solução salina tamponada com fosfato (PBS) utilizando uma agulha de ponta romba
NOTA: Pode ser feita dobrando cuidadosamente a ponta de uma agulha de grande calibre. (Figura 2G e 2H). - Posicionar o feto de uma maneira que permitas acesso total ao dorso.
- Passe um ponto cordão da bolsa utilizando sutura 7-0 nylon através do útero que cobre o local do ferimento dorsal pretendido (Figura 2I). Posição de fio de bolsa ao longo de uma região dorso para a esquerda ou direita da espinal medula, e em uma região da parede uterina desprovida de vasos sanguíneos grandes.
- Faça uma incisão três milímetros através da parede uterina e saco amniótico, no centro do cordão da bolsa (Figura 2J).
- Irrigar local da incisão com água morna (38 ° C) PBS.
- Com uma tesoura de microcirurgia, cortar uma única ferida excisional de espessura total, aproximadamente 1 mm de comprimento, no dorso do feto.
- Delicadamente, local da incisão secar com algodão-ponta do aplicador.
- Injectar 3 ul volume de nanquim subcutaneamente no local da ferida para marcar o local da ferida (Figura 2K).
- Lavar com água morna (38 ° C) para assegurar PBS tinta foi retido no interior do sítio da ferida.
- Já cirúrgico assistente inject quente (38 ° C) PBS através de ponta romba 10 G seringa no saco amniótico como o cordão da bolsa é fechada (Figura 2L). Retrair seringa como cadeia de fecho da bolsa se aproxima da conclusão (Figura 2 M).
- Suavemente útero voltar para dentro da cavidade abdominal (Figura 2N).
- Evert pele e peritônio.
- Já assistente cirúrgico irrigar cavidade abdominal com água morna (38 ° C) PBS.
- Fechar abdômen rapidamente por grampeamento pele e peritônio fechado (Figura 2O). O fecho de padrão é executada em duas camadas; peritoneu e da musculatura abdominal numa camada, tecido subcutâneo e pele na segunda camada. Para sacrifício imediato e colheita do feto, a nossa demonstração mostra o encerramento, em uma camada.
- Colocar o animal sob observação numa incubadora quente regulado a 37 ° C durante 30 minutos ou até que o animal recupera a consciência suficiente para manter decúbito esternal.
- Não return o animal para a companhia de outros animais até que ele está totalmente recuperado do procedimento.
- Quando acordarmos da anestesia e durante a subsequente 48 horas, administrar a injecção subcutânea de buprenorfina (0,05 mg / kg) a cada 12 horas, para a analgesia conforme necessário, com base na avaliação da dor. Administrar carprofeno (5 mg / kg) via injecção subcutânea para o alívio da dor adicional de pós-operatório, conforme necessário.
- Retorno animais na gaiola e dar-lhes comida e água ad libitum.
- Acompanhar de perto para manifestações de dor.
- 48 horas após a cirurgia, sacrificar mãe grávida com uma overdose de isoflurano e colheita feridos feto. A fim de fazer isso, ajustar a concentração de isoflurano a 5% ou superior e manter a exposição durante 1 min após a cessação da respiração. Confirme a eutanásia com luxação cervical. Colher um embrião sem ferimentos para o controle pareados por idade. Embriões tardias devem ter um método separado da eutanásia consistente com as recomendações IACUC, como decapitação, luxação cervical, ou injeção de produtos químicos.
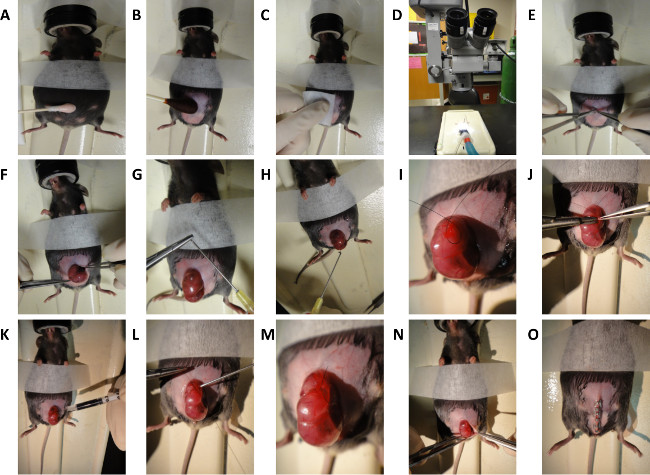
Figura 2. Esquema de Cirurgia Murino Fetal. Etapas gerais para dorsal ferindo em E16.5 e E18.5 embriões de rato. (A) Depilação de rato abdômen. (B e C) Preparação de rato abdômen. (D) Microscópio usado para cirúrgico procedimento. (E) Midline laparotomia. (F) A exposição de útero. (G) Criação de agulha de ponta romba. (H) Irrigação do útero com soro fisiológico morno. (I) Criação de cordão da bolsa de sutura. (J) incisão através uterino de parede e 1 mm de geração ferida excisional espessura total. (K) A injecção subcutânea de nanquim. (L e M) Encerramento do cordão da bolsa de sutura. (N e O)Encerramento do abdômen. Por favor, clique aqui para ver uma versão maior desta figura.
Resultados
Para a análise histológica, feridas cutâneas na pele dorsal de embriões de camundongos E16.5 e E18.5 devem ser colhidas 48 horas após o ferimento, fixadas em 4% PFA, e embebidos em parafina. Em modelos transgênicos fluorescentes, a criopreservação com outubro pode ser apropriado. Existem várias manchas que podem ser utilizados para visualizar arquitectura do tecido conjuntivo e celular. HE é uma mancha de duas cores que mancha núcleos azuis e estruturas eosinofílica (ie., Citoplasma e colágeno extr...
Discussão
O protocolo cirúrgico aqui apresentado descreve um modelo excisional de fetal cura scarless murino publicado pela primeira vez em 2006 por nosso laboratório 10. Em adição a outros modelos estabelecidos da ferida excisional 11, modelos incisionais de cicatrização sem cicatrizes murino fetal existir como bem 12,13. As investigações sobre a cicatrização de feridas scarless fetal no macaco, cordeiro, coelho, gambá, e rato têm sido relatados 14-17. No entanto, os ratos ...
Divulgações
The authors have nothing to disclose.
Agradecimentos
Este trabalho foi financiado em parte por uma concessão do NIH concessão R01 GM087609 (para HPL), um presente de Ingrid Lai e Bill Shu em honra de Anthony Shu (para HPL), NIH concessão U01 HL099776 (para MTL), o Laboratório Hagey para Pediatric Regenerative Medicine e The Oak Foundation (para MTL e HPL). GGW foi apoiado pela Escola de Medicina de Stanford, o Programa de Formação de Stanford Medical Scientist, e uma bolsa de formação NIGMS GM07365. MSH foi apoiada por CIRM Clinical Fellow Training Grant TG2-01159. WXH foi apoiado pelo financiamento da Fundação Sarnoff Cardiovascular.
Materiais
| Name | Company | Catalog Number | Comments |
| 7-O MONOSOF Suture | eSuture | SN-1647G | |
| Surgical Forceps | Kent Scientific | INS650916 | |
| Micro-scissors | Kent Scientific | INS600127 | |
| Autoclip 9 mm | Texas Scientific Instruments | 205060 | |
| Insulin Syringe | Thermo Fisher Scientific | 22-272-382 | |
| Black Pigment | AIMS | 242 | |
| BD Safety-Lok 3 ml Syringe | BD Biosciences | 309596 | |
| Phosphate Buffered Saline | Life Technologies | 10010-049 | |
| OPMI-MD Surgical Microscope | Carl Zeiss Surgical Inc | ||
| Pregnant Mares Serum (PMS) | Millipore | 367222 | |
| Human Chorionic Gonadotropin (HCG) | Sigma-Aldrich | CG10 | |
| Povidone Iodine Prep Solution | Dynarex | 1415 | |
| Nair (depilatory cream) | Church and Dwight Co. | 22600267058 |
Referências
- Larson, B. J., Longaker, M. T., Lorenz, H. P. Scarless fetal wound healing: a basic science review. Plastic and reconstructive surgery. 126, 1172-1180 (2010).
- Wilgus, T. A. Regenerative healing in fetal skin: a review of the literature. Ostomy/wound management. 53, 16-31 (2007).
- Wulff, B. C., et al. Mast cells contribute to scar formation during fetal wound healing. The Journal of investigative dermatology. 132, 458-465 (2012).
- Lorenz, H. P., Adzick, N. S. Scarless skin wound repair in the fetus. The Western journal of medicine. 159, 350-355 (1993).
- Longaker, M. T., et al. Wound healing in the fetus. Possible role for inflammatory macrophages and transforming growth factor-beta isoforms. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 2, 104-112 (1994).
- Longaker, M. T., et al. Studies in fetal wound healing. IV. Hyaluronic acid-stimulating activity distinguishes fetal wound fluid from adult wound fluid. Annals of surgery. 210, 667-672 (1989).
- Colombo, J. A., Napp, M., Depaoli, J. R., Puissant, V. Trophic influences of human and rat amniotic fluid on neural tube-derived rat fetal cells. International journal of developmental neuroscience : the official journal of the International Society for Developmental Neuroscience. 11, 347-355 (1993).
- Colwell, A. S., Longaker, M. T., Peter Lorenz, H. Identification of differentially regulated genes in fetal wounds during regenerative repair. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 16, 450-459 (2008).
- Hu, M. S., et al. Gene expression in fetal murine keratinocytes and fibroblasts. The Journal of surgical research. , (2014).
- Colwell, A. S., Krummel, T. M., Longaker, M. T., Lorenz, H. P. An in vivo mouse excisional wound model of scarless healing. Plastic and reconstructive surgery. 117, 2292-2296 (2006).
- Wilgus, T. A., et al. The impact of cyclooxygenase-2 mediated inflammation on scarless fetal wound healing. The American journal of pathology. 165, 753-761 (2004).
- Iocono, J. A., Ehrlich, H. P., Keefer, K. A., Krummel, T. M. Hyaluronan induces scarless repair in mouse limb organ culture. Journal of pediatric surgery. 33, 564-567 (1998).
- Chopra, V., Blewett, C. J., Krummel, T. M. Transition from fetal to adult repair occurring in mouse forelimbs maintained in organ culture. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society. 5, 47-51 (1997).
- Adzick, N. S., Longaker, M. T. Animal models for the study of fetal tissue repair. The Journal of surgical research. 5, 47-51 (1991).
- Block, M. Wound healing in the new-born opossum (Didelphis virginianam). Nature. 187, 340-341 (1960).
- Longaker, M. T., Dodson, T. B., Kaban, L. B. A rabbit model for fetal cleft lip repair. Journal of oral and maxillofacial surgery : official journal of the American Association of Oral and Maxillofacial Surgeons. 48, 714-719 (1990).
- Longaker, M. T., et al. A model for fetal cleft lip repair in lambs. Plastic and reconstructive surgery. 90, 750-756 (1992).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados