Method Article
Mesure de la force maximale isométrique généré par perméabilisées fibres du muscle squelettique
Dans cet article
Résumé
L'analyse des propriétés contractiles des fibres musculaires squelettiques chimiquement peau, ou perméabilisées offre un puissant moyen permettant d'évaluer la fonction musculaire au niveau de la cellule musculaire unique. Dans cet article, nous présentons une technique valide et fiable pour préparer et tester perméabilisées fibres musculaires squelettiques in vitro.
Résumé
Analysis of the contractile properties of chemically skinned, or permeabilized, skeletal muscle fibers offers a powerful means by which to assess muscle function at the level of the single muscle cell. Single muscle fiber studies are useful in both basic science and clinical studies. For basic studies, single muscle fiber contractility measurements allow investigation of fundamental mechanisms of force production, and analysis of muscle function in the context of genetic manipulations. Clinically, single muscle fiber studies provide useful insight into the impact of injury and disease on muscle function, and may be used to guide the understanding of muscular pathologies. In this video article we outline the steps required to prepare and isolate an individual skeletal muscle fiber segment, attach it to force-measuring apparatus, activate it to produce maximum isometric force, and estimate its cross-sectional area for the purpose of normalizing the force produced.
Introduction
La principale fonction du muscle squelettique est de générer de la force. la force musculaire est provoquée in vivo par une séquence complexe d'événements qui comprend potentiels nerveuses motrices d'action, la transmission neuromusculaire, fibres musculaires des potentiels d'action, la libération de calcium intracellulaire, et l'activation du système de protéines régulatrices et contractiles. Parce que la génération de force est le résultat final de cette séquence, un déficit en vigueur pourrait être causée par la défaillance d'un ou plusieurs des étapes individuelles. Un attribut clé de la préparation de fibres perméabilisées est qu'il élimine la plupart des étapes nécessaires à la génération de force in vivo, avec seulement les fonctions de réglementation et contractiles associés à l'appareil myofibrillaire restant. L'enquêteur assume le contrôle de la livraison de l'activation de calcium et de l'énergie (ATP), et est récompensé par un système simplifié qui permet l'évaluation des structures de réglementation et contractiles isolés dans leur co natifnfiguration. Mesures de force utilisant des fibres musculaires squelettiques perméabilisées sont donc précieux lors de l'évaluation des modifications de la fonction musculaire observée in vivo. Par exemple, nous avons utilisé cette technique pour caractériser la capacité de génération de force de fibres de myostatine souris déficientes 1 et d'évaluer la cause de la faiblesse musculaire persistante exposé suivant rotateurs chronique rotateurs 2,3.
Méthodologie de fibres perméabilisées moderne peut être attribuée à des études influentes début des 4,5 et est actuellement utilisé par un certain nombre de groupes de recherche. Bien que les techniques ont été décrites dans la littérature, il n'a pas encore été présenté dans le format vidéo. Le but de cet article est d'illustrer, une technique valide et fiable mise à jour pour mesurer la capacité maximale de production de force de fibres simples à partir d'échantillons de muscles squelettiques perméabilisées chimiquement. Pour ce faire, un segment de fibre individuelle (désigné ici en tant que ̶0; fibre ") est extraite à partir d'un paquet pré-perméabilisées et de fibres placées dans une chambre contenant une solution expérimentale au repos, le trait caractéristique de ce qui est une concentration en calcium qui est <10 nM. La fibre est ensuite fixé à une extrémité à un transducteur de force et à l'autre extrémité à un dispositif de commande de longueur. Avec la fibre maintenu à une longueur de sarcomère optimale, il est transféré à une solution d'activation qui a une concentration en calcium suffisante pour provoquer l'activation maximale et la force de contraction isométrique ainsi maximale. Force données sont acquises, stockées et analysées à l'aide d'un ordinateur personnel.
Protocole
Toutes les procédures impliquant des sujets animaux ou humains doivent être effectuées conformément aux directives et règlements pertinents, et les organismes de réglementation. L'Université du Michigan Comité sur l'utilisation et aux soins des animaux (UCUCA) et l'Université de Conseil d'examen du Michigan Medical Center institutionnel approuvé l'ensemble des animaux et des procédures humaines décrites dans cet article.
1. Assurez-dissection et stockage Stock Solution
Remarque: Les volumes finales spécifiées dans les instructions suivantes peuvent être agrandies ou réduites comme souhaité.
- Dans un bécher de 1000 ml, ajouter 800 ml d'eau déminéralisée (ASTM Type 1). Le maintien d'un bruit doux, ajouter tous les composés énumérés dans le tableau 1 à l'eau déminéralisée et leur permettre de se dissolvent.
Composé Désiré Conc. (M) Formule Poids (g / mol) Ajouter à 1 L (g) K-propionate 0,250 112.17 28,040 Imidazole 0,040 68.08 2.720 EGTA 0,010 380,40 3.800 MgCl 2 • 6H 2 O 0,004 203,31 0,813
Tableau 1: Dissection et stockage solution stock composants.
- Porter à un volume final de 1000 ml avec de l'eau désionisée. A noter qu'il n'y a pas lieu à un pH de la solution à ce stade. Conserver la solution d'achat d'actions à 4 ° C.
2. Assurez solution de stockage
- Pour faire 200 ml de solution de stockage, de commencer avec 100 ml de disséquer et de la solution de stockage de valeurs d'un bécher de 250 ml. Ajouter suffisante Na 2 H 2 ATP pour apporter adénosine finaletriphosphate (ATP) à la concentration de 2 mM. Porter à un volume final de 200 ml avec du glycérol. Ajuster le pH à 7,00 avec de l'hydroxyde de potassium (KOH). Conserver la solution de stockage à -20 ° C.
Remarque: En raison de la nature visqueuse de glycérol il peut être difficile de se passer précisément en volume. Pour cette raison, on ajoute typiquement le glycerol en poids (par 100 ml de glycérol pèse environ 126 g).
3. Assurez-dissection Solution
- Pour faire 200 ml de solution de dissection, de commencer avec 100 ml de la solution de dissection et le stockage dans un bécher de 250 ml.
- Ajouter suffisamment de Na 2 H 2 ATP pour amener la concentration finale d'ATP à 2 mM. Ajuster le pH à 7,00 avec du KOH. Amener le volume final à 200 ml avec de l'eau désionisée. Aliquote dans des volumes de 2,5 ml et conserver à -80 ° C.
4. Faire dissection Solution avec Brij 58
Remarque: Brij 58 est un détergent non-ionique qui perturbe (perméabilise) bicouches lipidiques.
- Pour faire 200 ml de solution avec Brij 58 dissection, commencer avec 200 ml de la solution de dissection dans un bécher de 250 ml. Le maintien d'un bruit doux, ajouter 1 g de Brij 58 (0,5% p / v) à la solution de dissection et de le laisser se dissoudre. Aliquote dans des volumes de 2,5 ml et conserver à -80 ° C.
5. Assurez-Testing Solutions
Remarque: Ce qui suit est une adaptation de Moisescu et Thieleczek 1978 (6). Voir Discussion pour des commentaires supplémentaires sur la préparation de solutions de test.
- Préparer trois béchers séparés 1.000 ml étiquetés "relaxant", "pré-activation" et "Activer". Ajouter 400 ml d'eau déminéralisée dans chaque bêcher.
- Ajouter les composés indiqués dans le Tableau 2 dans le bêcher approprié, puis à chauffer la solution entre 70 ° C et 80 ° C. Maintenir une température de solution de 70-80 ° C pendant 30 min en remuant sans cesse.
Note: Une température de 70-80 ° C passes dans le elimination de l'acide carbonique formé par la réaction de carbonate de calcium avec EGTA dans la solution d'activation. Les solutions de détente et de la solution de pré-activation sont traités de la même manière que la solution d'activation pour maintenir la cohérence.
| SOLUTION DE DÉTENTE | PRE-ACTIVATING SOLUTION | Solution d'activation | |||||
| Composé | Formule Poids (g / mol) | Concentration désiré (mM) | Mass requis (g) | Concentration désiré (mM) | Mass requis (g) | Concentration désiré (mM) | Mass requis (g) |
| HEPES (acide) | 238.30 | 90,0 | 10,724 | 90,0 | 10,724 | 90.00 | 10,724 |
| MgO | 40.31 | 10.3 | 0,208 | 8.5 | 0,171 | 8.12 | 0,164 |
| EGTA (acide) | 380,40 | 52,0 | 9.890 | 52.00 | 9.890 | ||
| HDTA (acide) | 348,36 | 50,0 | 8,709 | ||||
| CaCO 3 | 100.10 | 50.00 | 2.503 | ||||
Tableau 2: Rele relâchement, la pré-activation et activation composants de la solution.
- Refroidir la solution jusqu'à la température ambiante et ajouter suffisamment de NaN 3 / KOH pour amener la concentration finale de NaN3 à 1 mM.
ATTENTION: NaN 3 (azoture de sodium) est toxique. Reportez-vous à la fiche signalétique chimiques avant de manipuler ce produit chimique.- Pour 100 ml de solution d'azide de sodium 100 mM, ajouter 0,65 g de NaN 3 à 10 ml de KOH 1 N. Ajuster à un volume final de 100 ml avec de l'eau désionisée.
- Ajuster le pH à environ 7,10 en utilisant KOH.
- Suite à l'étape 5.4 ajouter suffisamment de Na 2 H 2 ATP pour amener la concentration finale d'ATP à 8 mM et Na 2 CrP suffisante pour amener le phosophate finale de la créatine (CRP) de concentration de 10 mM.
- Amener chaque solution au volume final de 500 ml avec de l'eau désionisée. Réfrigérer ou chauffer les solutions à la température à laquelle expériences seront réalisées, puis utilisez KOH d'apporterle pH à 7,10, tout en maintenant cette température.
- Ajouter la solution dans le bécher contenant la solution de pré-activation de détente telles que la solution finale de pré-activation est une partie de solution dans 500 solution de pré-activation de détente. Aliquote dans des volumes de 2,5 ml et conserver à -80 ° C.
6. Assurez-suture Loops
- Commencez avec un brin de non stérile USP 10-0 monofilament en nylon suture.
- Utilisez la pince pour créer une boucle avec le brin en utilisant la technique de nœud double. Réduire le nœud en taille à environ 750 um de diamètre. diamètre de la boucle peut être évaluée sous le microscope utilisant des marquages oculaire du réticule.
- Utilisez microdissecting ciseaux pour enlever l'excès de suture ne laissant que la boucle et de petite taille (500 um) queues de chaque côté. Un exemple d'une boucle finie est représentée sur la figure 1.
- Répétez les étapes 6.2-6.3 jusqu'à 4 boucles utilisables ont été faites. Magasin boucles dans un élastomère de silicone plaqué petri plat pour une utilisation future.
Remarque: Quatre boucles de suture sont requises pour chaque fibre testée.
7. Bundle échantillon
Remarque: Les étapes suivantes décrivent la procédure pour disséquer l'échantillon original en petits «paquets» expérimentaux à partir de laquelle des fibres individuelles seront finalement extraits et testés. En tout temps, l'échantillon doit être traité avec soin. Aux fins de cette description, des instructions seront données comme si l'enquêteur est droitier.
- Obtenir l'échantillon d'intérêt et de le transférer à l'établissement où aura lieu la dissection.
Remarque: Les méthodes de biopsie tissulaire varieront selon le modèle expérimental et conception de l'étude. Lorsque cela est possible, la perfusion du muscle devrait être maintenue jusqu'au moment de la biopsie. - Si l'échantillon doit être transféré entre le site de la récolte et le site de dissection, le transporter dans un flacon contenant une solution de dissection froide tout en étant maintenu sur de la glace.
- Préparer une boîte de Pétri de 5 cm élastomère de silicone plaqué avec une solution glacée de dissection et deux à trois broches de montage d'insectes (100 um de diamètre, en acier inoxydable).
- Transférer l'échantillon à l'antenne. Assurez-vous que l'échantillon reste immergé en ajoutant plus de solution de dissection si nécessaire.
- Inspecter l'échantillon sous le microscope et le manipuler à aligner les axes longitudinaux des fibres vers l'épaule droite de l'enquêteur (Figure 2). Ensuite, l'échantillon à ancrer la capsule par goupillage dans les coins.
Remarque: Assurez-utilisation de tout tissu conjonctif restant comme des points d'ancrage à ce moment puisque ce sera de maximiser l'utilisation de l'échantillon et de conserver l'intégrité de la fibre. Le faisceau peut être épinglé dans une légère tension pour aider à définir les marges inter-fibres. - Avec la pince à la main gauche et les ciseaux microdissecting dans le droit, commencer à disséquer délicatement un faisceau le long des marges longitudinales entre les fibres
Note: En fonction de sonlongueur totale, disséquer davantage le paquet en plusieurs petits paquets. - Assurez-vous que les dimensions des faisceaux mesurent environ 0,5-1 mm de largeur et ≥3 mm de longueur. Évaluer les dimensions à l'aide d'un microscope avec des marques de réticule dans l'oculaire, ou en plaçant une règle sous la parabole.
- Enlever et jeter tout tissu qui a été endommagé par des pinces ou des épingles à la suite du processus de dissection.
- Répétez le processus jusqu'à ce qu'un nombre suffisant de paquets ont été disséqués ou jusqu'à ce que l'échantillon a été épuisé.
Note: Le nombre de faisceaux que l'on peut obtenir dépend de nombreux facteurs, notamment la taille et l'état de l'échantillon initial, la morphologie du muscle, et l'homme de l'investigateur.
8. Fibres perméabilisent
- Transférez les faisceaux de la solution de dissection dans un flacon contenant 2,5 ml de fraîches, réfrigérées, solution, disséquant avec le détergent non-ionique "Brij 58 'ajoutée(0,5%, p / v). Incuber sur de la glace pendant 30 min avec de temps en temps, une agitation douce. Veiller à ce que les faisceaux restent immergés dans toute incubation.
- À la fin de l'incubation de 30 min, transférer les paquets dans un flacon contenant une solution de dissection frais (pas de Brij 58) et agiter doucement et brièvement pour enlever tout résidu de détergent.
9. Préparer Bundles pour le stockage
- Transférer les paquets à un flacon contenant une solution de stockage réfrigéré et incuber une nuit à 4 ° C.
10. Magasin Bundles
- Le lendemain, préparer une boîte de stockage, capable de résister à -80 ° C, avec suffisamment individuels 0,5 ml à vis des tubes coniques de capitalisation pour accueillir tous les faisceaux obtenus au cours du processus de dissection (un paquet par tube). Chaque tube conique doit être rempli avec 200-400 pi de solution de stockage frais.
- Transférer les paquets dans les tubes coniques étiquetés individuellement. Assurez-vous que le faisceau ne soit pas collée àle côté du tube ou flottant à la surface de la solution conique. Boucher les tubes coniques et conserver les échantillons à -80 ° C jusqu'au jour de l'essai.
11. Préparer appareil expérimental
Remarque: L'appareil personnalisé est composé d'un étage qui abrite un dispositif de commande de capteur de longueur et de force, un système de déplacement et une chambre dissection microscope 10X. installations d'entraînement micrométrique permettent une manipulation précise des surfaces de fixation de la fibre. Motifs de diffraction laser sont utilisés pour estimer la longueur de sarcomère. Les données générées lors de l'expérimentation sont enregistrées sur un ordinateur personnel. Reportez-vous à la figure 3 pour les images annotées de l'expérimental.
- Décongelez un flacon chacun des pré-activation de détente et de solutions d'activation et de maintenir sur la glace. Notez que l'ATP et la CRP sont des composés labiles qui devraient être maintenus à des températures froides.
- Préparer le microscope, appareil de test et l'ordinateur associé à l'emploi.
- Remplissez la première chambre expérimentale avec une solution de détente. Dans notre appareil, la première chambre contient des prismes qui permettent à l'investigateur de photographier la fibre par le côté. Remplir la deuxième chambre avec la solution expérimentale de pré-activation et le troisième avec une solution d'activation.
- Réglez la température de sorte que l'affichage en chambre thermomètre indique 15 ° C. Discussion deux boucles de suture préparés sur les surfaces de fixation en acier inoxydable étendant à la fois du transducteur de force et de durée de commande (figure 5A).
12. Extrait perméabilisées fibre unique
- Décongeler un faisceau de fibres d'intérêt, et de les transférer à une boîte de Pétri élastomère de silicone plaqué avec des produits frais, réfrigérés solution de détente. Fixer le faisceau avec des broches à chaque extrémité et assurez-vous qu'il est submergé.
- Utilisation de la pince, saisir une fibre à une extrémité, et commencer à extraire en douceur le long de son axe longitudinal.
Remarque: les dommages à la compression à laextrémité de la fibre provoquée par la pince est pas un problème à l'heure actuelle puisque les propriétés contractiles dans ce domaine ne seront pas testées. Des précautions doivent toutefois être prises lors de l'extraction des fibres du faisceau depuis adhérences entre les fibres et la matrice extracellulaire peuvent entraîner une tension excessive, conduisant finalement dommages à étirer-induite. Notez que il existe une variabilité considérable entre les muscles de la mesure dans laquelle les fibres adhèrent à la matrice extracellulaire avoisinante. Fibres qui sont soupçonnés d'avoir été endommagé par un tel tronçon devraient être jetés. - Utilisez une lame de rasoir ou un scalpel pour modifier une pipette comme le montre la (figure 4). Introduire la fibre dans l'embout avec une petite quantité de solution de détente. Transférer la fibre unique à partir de la boîte de Pétri élastomère de silicone plaqué à la chambre expérimentale qui contient la solution de détente.
13. Monter fibre unique
Remarque: Un depicti étape par étapepeut être consulté sur la figure 5.
- Guider délicatement avec une pince, retirer la fibre de la pointe de la pipette et l'ancrer à la longueur-contrôleur (gauche) en utilisant la première boucle de suture.
- Utilisez un seul mouvement en douceur lors du serrage de la boucle avec la pince. Assurez-vous que une tension égale et opposée est appliquée à chaque extrémité de la suture.
- La première boucle doit être attachée autour de 1 mm à 2 mm de l'extrémité de la surface de fixation de longueur de commande.
- Manipuler l'autre extrémité de la fibre vers le transducteur de force (à droite) et de sécuriser la fibre en utilisant la même procédure. Enlever l'excès de suture à l'aide des ciseaux de microdissecting (Figure 5C).
- Placer la fibre sous une faible quantité de tension en augmentant la distance entre les bras de longueur et de contrôleur de transducteur de force à l'aide de la coordonnée x d'entraînement micrométrique (figure 3A).
- Enfiler la deuxième boucle sur le premier et ancrer la fibreà un point en moins de 0,2 mm de l'extrémité de la surface de fixation de force de transducteur (Figure 5D).
- Enlever l'excès de suture à l'aide des ciseaux de microdissecting.
- Le procédé de fixation de fibre peut entraîner la perte de solution de la chambre. Si nécessaire, ajouter la solution de plus relaxant pour assurer la surface de la solution est plat (ni concave ni convexe). Une surface plane est important lors de l'évaluation longueur de sarcomère par diffraction laser.
- Aligner la fibre parallèlement aux parois latérales de la chambre expérimentale en ajustant la position de la longueur-contrôleur dans la direction de l'axe des y.
- Enquête sur la fibre en utilisant la vue prisme de côté et ajuster la position de la longueur-contrôleur dans la direction de l'axe z jusqu'à ce que la fibre est parallèle au sol de la chambre.
Note: positionnement de la fibre parallèlement à l'étage de la chambre peut être réalisé sans prismes de la chambre en se focalisant sur une première extrémité de la fibre et tpoule, sans réglage de la mise au point du microscope, ce qui porte l'autre extrémité de la fibre dans le foyer à l'aide de son entraînement micromètre axe z. - Si la fibre est de toute façon tordu, tordu ou endommagé à la suite du processus de montage, la fibre doit être jeté et fixé une nouvelle fibre.
14. Set Optimal Sarcomère Longueur
- Lorsque la fibre a été correctement aligné dans la chambre, insérez l'écran cible calibré sur la face antérieure du microscope et de l'aligner sur la première chambre expérimentale.
Remarque: L'écran cible est calibré en utilisant l'équation de type standard, λ = SL sin, où SL est la longueur de sarcomère, θ est l'angle de diffraction entre 0 ° et 1 ° faisceaux diffractés et λ est la longueur d'onde du laser. - Allumer le laser et ajuster la position de la platine de telle sorte que le laser passe par le centre de la fibre.
ATTENTION: concentré de lumière laser peut être endommager to vue. Ne jamais tenter de visualiser la fibre à travers le microscope lorsque le laser est allumé. - Placez la fibre par rapport au faisceau laser pour diffracter la lumière laser et d'observer un bagout d'interférence sur l'écran cible calibré (figure 6). Éteignez les lumières de visualiser ce modèle plus clairement.
Remarque: Si, avec le positionnement correct du faisceau laser, aucun motif d'interférence est considérée, ce qui suggère que les composants de la fibre myofibrillaires sont anormaux / endommagé et que la fibre doit être remplacée par une nouvelle. - Pour définir le sarcomère longueur, augmenter ou diminuer la tension sur la fibre en utilisant l'axe-x micromètre entraînement longueur du contrôleur jusqu'à ce que l'espacement souhaité de la lumière diffractée est observé sur l'écran cible.
Remarque: La longueur de sarcomère optimale de la fibre dépendra de l'espèce animale à partir de laquelle on a obtenu l'échantillon. Une longueur de sarcomère de 2,7 um est communément supposé être optimale lorsque âneschanter fibres de 7,8 de tissus humains. - Après optimale longueur de sarcomère a été défini, mesurer la distance entre les deux points de suture plus intimes. Ceci est le plus facilement accompli en utilisant la lecture numérique sur le disque micrométrique qui contrôle le mouvement de l'axe des x de la chambre. Positionner la chambre de telle sorte que les cheveux transversale verticale de l'oculaire est alignée sur la bordure la plus interne de la suture la plus interne et la lecture numérique zéro sur l'unité de micromètre.
- Traduire la scène le long de l'axe des x par rapport au microscope jusqu'à ce qu'il atteigne l'autre plus à l'intérieur suture. L'affichage numérique indique la longueur de la fibre. Cette valeur doit être enregistrée comme la longueur des fibres, L f.
Remarque: Il doit être entendu que la distance entre les deux sutures les plus internes déterminera la longueur fonctionnelle du tissu contractile en cours d'évaluation. L'enquêteur devrait viser la cohérence dans cette dimension (c.-L f) dans unsérie d'expériences.
15. estimation transversale Area (CSA)
- Maintenir la fibre à L f et utiliser l'appareil photo de microscope monté pour capturer une image à fort grossissement de la partie centrale de la fibre à la fois le haut et de côté. Vue latérale images peuvent être capturées en utilisant le prisme intégré dans le côté de la chambre.
Remarque: Lors du passage entre le haut et des vues de côté, il est important de se déplacer seulement le microscope dans la direction y pour que les deux images sont "dans le registre" et par conséquent montrent deux vues différentes de la même section de la fibre. - Obtenir des mesures en ce moment à normaliser force absolue plus tard dans l'étude. Les techniques d'obtention de ces mesures sont décrites plus loin et illustrés sur les figures 7A et 7B.
16. Susciter isométrique Contraction
Remarque: Bien que les données générées lors de ces expériencess peuvent être collectées et interprétées sans l'utilisation d'un ordinateur, un logiciel qui permet l'acquisition, affichage, le stockage et l'analyse des réponses de force est avantageux. Le logiciel LabVIEW personnalisé créé par notre laboratoire permet à ces fonctions ainsi que la capacité de concevoir des «trains de mouvement 'qui régissent l'action de la longueur contrôleur pendant une expérience.
- Vérifiez que la température de la détente, de pré-activation et solutions d'activation sont stables à 15 ° C.
- Utilisez le logiciel de contrôle de la chambre pour déplacer la fibre à la chambre contenant la solution de pré-activation et incuber là pour 3 min.
Remarque: La solution de pré-activation est faiblement tamponnée de Ca2 +, ce qui entraîne une activation et la force du développement très rapide lors de l'introduction de la fibre de la solution d'activation. - Avec 10 sec restant dans la solution de pré-activation et la longueur de fibre maintenu à L f, établir un zéro foniveau de rce dans l'enregistrement expérimental.
Remarque: Le mouvement «Trouver Zero Force 'de la longueur contrôleur révèle le niveau transducteur de force qui correspond à la force de zéro (c.-à-la fibre devient brièvement mou à la suite du mouvement). Force passive est la différence entre zéro et que le niveau de force juste avant le mouvement du transducteur à zéro. - A la fin de la 3 min, déplacer la fibre à la chambre contenant la solution d'activation et force isométrique maximale permet de développer en évidence par un plateau de force qui est précédée d'une montée rapide.
- Après avoir atteint la force isométrique maximale, en utilisant la longueur contrôleur pour identifier la sortie transducteur de force qui correspond à une force nulle dans la chambre contenant la solution d'activation.
Note: Ceci est nécessaire parce que la sortie transducteur de force qui correspond à une force nulle est en général différente pour chaque chambre de solution-remplie. - Après avoir atteint une deuxième force plateau, retourner la fibre à la chambre contenant la solution de détente. Le test est maintenant terminée. Pour tester plusieurs fibres au cours de toute aspiration d'une séance toutes les solutions et ajouter de nouvelles solutions, réfrigérés.
Remarque: les protocoles de cyclisme Brenner devraient être pris en considération lors susciter contractions maximales sur une période de temps prolongée. Ce protocole a été établi pour conserver les propriétés structurelles et mécaniques dans la fibre au maximum neuf activé.
Résultats
Fibres simples sains, perméabilisées chimiquement devraient apparaître uniforme en forme et avoir l'espacement des stries cohérente lorsqu'on les examine sous un fort grossissement. Les fibres qui sont inflexibles lorsqu'il est manipulé avec les forceps ou avoir des dommages structurels évidents doivent être jetés.
Des images numériques à fort grossissement prises au cours de l'étape 15 sont analysées pour cinq mesures de diamètre par paires le long de la section médiane de la fibre. Fibre CSA est estimée en supposant une section transversale elliptique et une moyenne de 5 mesures de la CSA individuels comme représenté sur la figure 7A. Figure 7B sert également à illustrer comment les dimensions des fibres dans une vue peuvent être significativement différents par rapport aux dimensions appariés dans l'autre vue (c.-à-cross les sections ne sont pas, en général, année).
Traces de forces représentatifs de fibres lentes et rapides humains sont présentés sur les figures 8A et 8B, respectivement. Voltagsortie e du transducteur de force est acquise lors d'un test et convertie de force (mN) à l'aide d'acquisition de données et des logiciels d'analyse (LabVIEW). Figure 9 illustre l'approche utilisée pour évaluer la force active maximale (F o), qui est calculé en soustrayant la force nécessaire pour maintenir la fibre à longueur optimale de sarcomère tandis que dans un état de relaxation (force passive, F P), de la plus grande force isométrique développé lors de l'activation de la fibre maximale (de la force totale, F T). Depuis la sortie du transducteur de force qui correspond à une force nulle est, en général, différente pour chacune des différentes chambres de bain, on desserrer brièvement la fibre à la fois dans la pré-activation et l'activation de solutions pour capter le niveau du zéro de la force fiche expérimentale. Normalisation de la force active maximale par le CSA de fibre est utilisée pour générer le plus de valeur informative de la force spécifique (SF o). Parce qu'elle prend en considération le CSA de la fibre, SF o fournit une mesure de la capacité de génération de force intrinsèque de l'appareil contractile de la fibre, ce qui permet des comparaisons fonctionnelles entre les fibres de dimensions disparates. Il convient toutefois de noter que les mesures de la CSA sont pas en mesure de distinguer la proportion de la fibre de filaments contractiles occupé par rapport à la proportion occupée par d'autres structures sous-cellulaires.
Les caractéristiques typiques de santé, des fibres adultes de Claflin et al., 2011 10 pour l'homme, Mendias et al. 2011 1 pour la souris et Gumucio et al. 2012 2 pour rat sont détaillés dans le tableau 3. Toutes les données présentées dans le tableau 3 ont été générés en utilisant la techniques décrites dans cet article.
| Humain (Vaste externe) | Souris (EDL) | Rat (Infra) | ||||
| Mâle | Femme | Mâle | Mâle | |||
| Type 1 | Type 2a | Type 1 | Type 2a | (Pas tapé) | (Pas tapé) | |
| CSA (pm 2) | 4880 - 6900 | 5270 - 8380 | 3870 - 5470 | 4010 - 5610 | 1850 - 3080 | 5290 - 8010 |
| F o (mN) | 0,79 à 1,17 | De 1,02 à 1,54 | 0,64 à 0,97 | 0,71 à 1,07 | 0,14 à 0,25 | 0,55 au 0,97 |
| SF o (kPa) | 142-182 | 165-210 | 156-193 | 172-214 | 67-94 | 102-131 |
| n | 129 | 160 | 149 | 207 | 37 | 94 |
Tableau 3. Les caractéristiques typiques de la santé, des fibres adultes de vastus lateralis humaine 10, extenseur des orteils de la souris et le rat épineux 1 2 muscles. Longueurs de sarcomériques optimales ont été fixés à 2,7 um pour les fibres humaines 7,8 et 2,5 um à la fois pour la souris (36, 37) et des fibres de rat (38). Gammes expérimentale L f (25 e et 75 e quartiles) étaient de 1,39 à 1,73 mm, de 1,17 à 1,53 mm et de 1,32 à 1,59 mm pour l'homme, la souris et le rat, respectivement. Plages indiquées indiquent les 25 ème et 75 ème quartiles et n est le nombre de fibres testées.
Les problèmes les plus courants rencontrés lors des tests comprennent un bordereau de boucle de suture, ce qui en résulte une force responsabe avec un "catch", telle que celle illustrée sur la figure 10A, et une déchirure d'épaisseur partielle ou totale de la fibre, ce qui entraîne une réaction de force qui retourne brusquement vers ou à (pause) zéro tandis que la fibre est toujours immergée dans la solution d'activation (Figure 10B). Si un lapsus, déchirure ou de bris lors d'une expérience, la fibre doit être jeté et les données exclue, même si le maintien d'un enregistrement sur les défaillances de la fibre peut aussi être informative 11. Un autre résultat négatif qui peuvent être rencontrées est l'activation prématurée de la fibre tandis que dans la solution (Figure 10C) pré-activation. Activation partielle dans la solution pré-activation suggère une contamination entre puits significative (soit une augmentation involontaire de la concentration de calcium dans le pré-activation bien). Dans ce cas, tous les bains devraient être aspirés et bien rincés à l'eau déminéralisée. Séchage des surfaces de séparation entre les chambres est également recomded que l'humidité ou de la condensation dans ces domaines peuvent conduire à l'évacuation de solution entre les bains. La décision d'inclure ou d'exclure des données dépendra en définitive la mise au point expérimentale et devraient donc être considérées lors de la conception de l'étude.

Figure 1: boucle de suture (10-0 monofilament en nylon de suture).

Figure 2:. Dissection Bundle Forceps sont dans la main gauche, des ciseaux de microdissection sont dans la main droite. La ligne rouge indique l'orientation favorable du poignet et des ciseaux avec les axes longitudinaux des fibres.

Figure 3: (A) Appareil de test avec des composants marqués. (A) des chambres expérimentales avec des fonds transparents. (B) Longueur-contrôleur. (C) transducteur de force. (D) de la source lumineuse. (E) Longueur-contrôleur xyz micromètre entraînement avec affichage numérique. (F) Stade micromètre entraînement avec affichage numérique. (G) transducteur de force xyz micromètre entraînement. (H) Programme d'calibré écran cible diffraction laser. Table de l'isolement (i) de vibration. (B) Gros plan des chambres expérimentales. Surface (j) de fixation en acier inoxydable étendant à partir de la longueur-contrôleur. Surface (k) de fixation en acier inoxydable étendant à partir du transducteur de force. (L) Side-view prisme. (M) de logement pour les modules de refroidissement thermoélectrique. (N) thermocouple pour signaler chambre température.

Figure 4: modification 100 pipette ul utilisé pour transférer des fibres de plat de dissection à la chambre expérimentale.
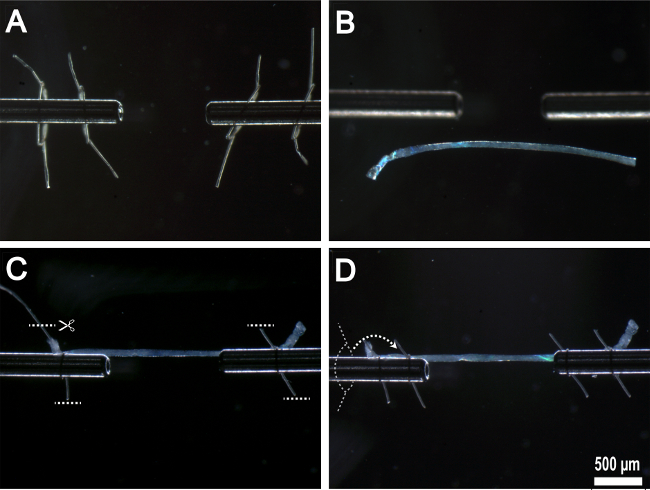
Figure 5:. Montage fibre unique sur appareil expérimental (A) des boucles de suture préparés enfilés sur des surfaces de fixation en acier inoxydable. (B) Fibre transféré à la chambre expérimentale. (C) Fibre ancrée sur les surfaces de fixation en acier inoxydable selon la première paire de boucles de suture avec un excès de suture enlevés. (D) Deuxième paire de boucles de suture filetés sur le dessus de premières boucles de suture et attachés en place.

Figure 6: Sarcomère longueur est déterminée par la projection d'un motif d'interférence laser sur un écran cible calibré (a) la source de laser.. (B) Mirror. (C) l'écran cible. Motif d'interférence (d) au laser.
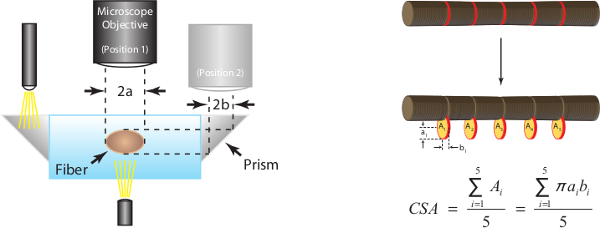
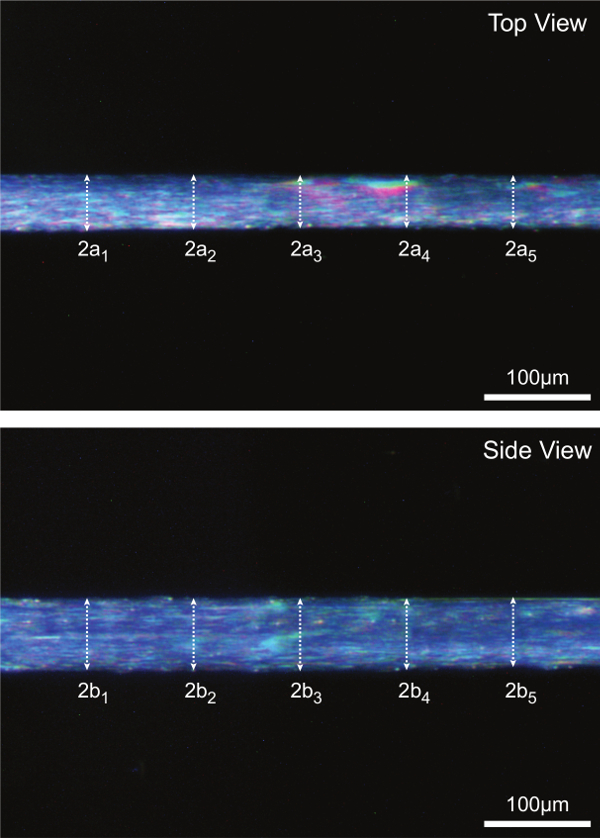
Figure 7: (A) Détermination de la zone fibre coupe à longueur optimale de sarcomère (humaine = 2,7 um). En supposant une section transversale elliptique, l'ASC est calculé pour chacun des cinq emplacements le long de la section médiane de la fibre et la moyenne des cinq mesures individuelles est rapporté comme CSA de la fibre. 2a représente le diamètre supérieur de la vue et est un axe de l'ellipse, 2b représente diamètre vue latérale et l'autre est l'axe de l'ellipse. (B) images de fibres représentatives illustrant chacune des cinq mesures de diamètre correspondantes prises à la fois dans la vue de dessus et de côté.
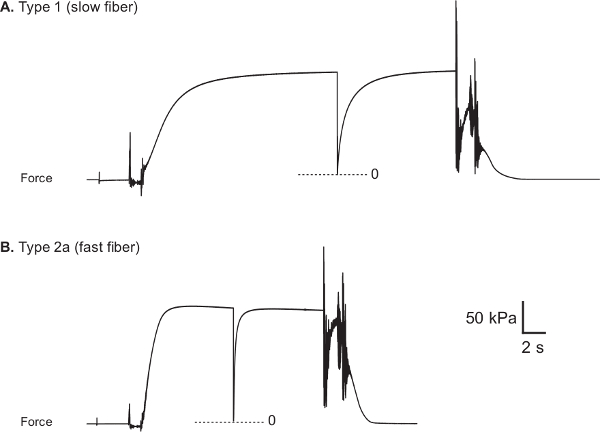
Figure 8: traces de force représentatifs de vastus lateralis humain sain fibres musculaires (A) de type 1 fibres (CSA: 5710 um 2, F o: 0,89 mN et SF o: 156 kPa).. (B) le type de fibre 2a (CSA: 9510 um, 2 F o: 1,66 mN et SF o: 174 kPa). Fibre myosine type de chaîne lourde a été déterminée par l'utilisation de séparation électrophorétique et l'argent-coloration techniques 22.
ADO / 52695 / 52695fig9.jpg "/>
Figure 9: Calcul de la force active maximale (F o) (a) vue élargi de la réponse de la force de la fibre pendant le mouvement de mou induisant de la longueur contrôleur initié en solution de pré-activation.. F P est la force nécessaire pour maintenir une longueur de sarcomère de 2,7 um avec la fibre au repos. (B) de vue élargi de longueur contrôleur mouvement de slack-induisant. Notez que F o = F T - F P.
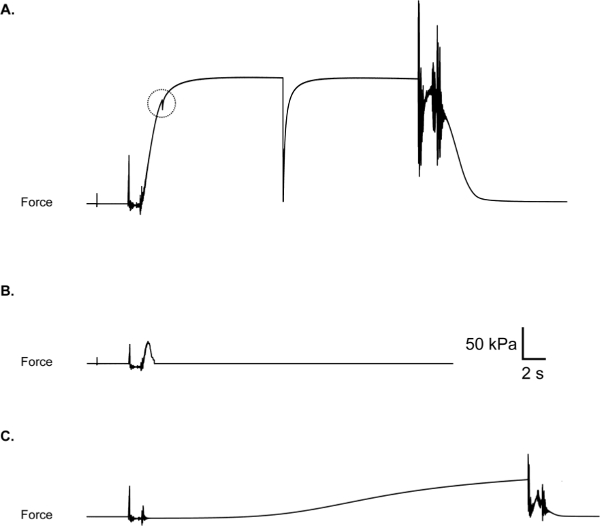
Figure 10: (A) boucle de suture glissement, comme en témoigne une "capture" en vigueur trace lors de la montée de la force. Vérifiez que les boucles sont sécurisées avant d'activer la fibre. (B) la rupture de la fibre lors de l'activation. Peut-être en raison de l'intégrité des fibres pauvres ou traitement de fibres agressif pendant suture boucle lieument. (C) l'activation des fibres partielle prématurée due à la contamination de la chambre de pré-activation avec Ca 2+.
Discussion
L'évaluation des propriétés contractiles des fibres musculaires squelettiques simples perméabilisées sont utilisées pour étudier la fonction musculaire dans une grande variété de contextes. Les exemples incluent les études qui ont évalué les effets du vieillissement, 12 exercer 10,13,14, 15 vols spatiaux, des blessures 2,3,16, traitements médicamenteux 17,18, 19 maladies et les manipulations génétiques 20,21 sur la structure et la fonction des fibres. En raison de la capacité d'évaluer directement la performance contractile des myofibrilles dans leur configuration native, cette technique fournit une plate-forme attrayante pour partir à former une compréhension de la fonction myofibrillaire absent des effets potentiellement confondants qui sont présents lorsque la transmission du signal neuromusculaire et la libération de calcium induite par l'excitation- sont inclus dans le système étudié. En outre, les tests fonctionnels de fibres simples peut être utilisé pour compléter les résultats de l'identification de protéines contractiles telles que cellesobtenu par immunohistochimie ou électrophorèse sur gel + western blot 22.
Une des principales fonctions du muscle squelettique est de générer de la force. Par conséquent sF o, une mesure de la capacité de génération de force intrinsèque d'un système contractile, est d'un grand intérêt pour les physiologistes musculaires. Des estimations fiables de la SF o exigent des mesures précises des deux ASC de la fibre et F o. Depuis fibres sont, en général, ni circulaire en coupe, ni uniforme dans la norme CSA sur toute leur longueur, un grand soin doivent être prises lors de l'estimation CSA. A cet effet, les mesures sont effectuées à plusieurs endroits le long de la longueur de la fibre et, à chaque emplacement, à partir de deux points de vue séparés par 90 °. Des mesures fiables de F o nécessitent une attention à plusieurs détails, y compris la comptabilisation des force passive, ajuster la longueur des sarcomères de maximiser le chevauchement des filaments épais et minces, en utilisant une solution d'activation avec une concentration de calcium tRésultats sur le chapeau de l'activation maximale, en maintenant la température expérimentale désirée, et le maintien de conditions optimales de stockage (température et durée) des fibres avant le jour de l'expérience.
Bien que les étapes décrites ci-dessous décrivent la procédure pour évaluer la force isométrique maximale, il est souvent souhaitable d'évaluer d'autres qualités fonctionnelles importantes de fibres musculaires squelettiques. Ceci peut être obtenu en étendant le protocole expérimental afin d'inclure d'autres manipulations mécaniques de la fibre. Par exemple, la mesure de la vitesse à laquelle la fibre raccourcit contre une série de différentes charges permet la détermination de la relation force-vitesse, à partir de laquelle les relations de force de puissance et vitesse puissance peuvent être calculées 10,23,24. En outre, la vitesse de raccourcissement sans charge peut être déterminée en utilisant le «test mou" 25, qui consiste à appliquer une série de mesures et DE MESURE raccourcissement creuses induisantng le temps requis par la fibre pour enlever le mou. Un autre paramètre cinétique qui est fréquemment rapporté est tr k, la constante de vitesse pour la force réaménagement suivant une perturbation mécanique qui détache temporairement tous les ponts transversaux 26. Enfin, la relation entre la concentration de calcium et la génération de la force active (la "relation force-PCA») est souvent un intérêt 18 et peut être déterminée en exposant la fibre à une série de solutions avec des concentrations en calcium allant de en dessous du seuil d'activation de l'contractile système à ceux suffisante pour déclencher l'activation maximale et donc la force maximale (F o).
Bien que la majeure partie de l'équipement mentionné est nécessaire pour évaluer la contractilité seule fibre, d'autres équipements est pas absolument nécessaire. Le régulateur de longueur, par exemple, est essentiel pour tout protocole expérimental qui nécessite un allongement ou raccourcissement rapide et précise de la fibre,mais ne sont pas absolument nécessaires pour évaluer la force isométrique maximale (si un niveau dans le dossier de force zéro force doit toujours être identifié par des moyens). Les prismes qui permettent l'observation de la fibre par le côté, tout en étant utile pour l'évaluation de surface de section transversale, ne sont pas absolument nécessaire lors du positionnement de la fibre à l'intérieur de la chambre expérimentale. En outre, des moyens de remplacement pour exposer la fibre à des différentes solutions expérimentales peuvent être employés, y compris la conception d'un système à commande manuelle de chambres ou une chambre unique qui permet le remplissage et la vidange rapide de solutions. Enfin, alors que les températures expérimentales sous-physiologiques telles que 15 ° C sont habituellement utilisés pour améliorer la reproductibilité des mesures mécaniques 1,2,3,5,8,12,17,27, il est possible de générer des données valides à d'autres températures 23 , 28 aussi longtemps que les effets de la température sur les propriétés de la solution (concentration de calcium, le pH, etc.) sont pris en considération.
Les compositions des solutions de test sont parmi les aspects les plus critiques des techniques de fibres perméabilisées décrites ici. Considérations concernant la composition de la solution est complexe et dépasse la portée de cet article. Les solutions décrites dans l'étape 5 de la section de protocole sont conçus en mettant l'accent sur une activation rapide de la fibre perméabilisées lors de leur transfert à partir de pré-activation pour l'activation de solutions tout en maintenant une force ionique constante, la composition cationique, et l'osmolarité 6,29. D'autres approches de composition de la solution ont été utilisées avec un succès notable par d'autres groupes de recherche et généralement faire usage de constantes de liaison publiés et des outils informatiques 27,30,31. Les concentrations d'ions calcium dans les différentes solutions d'activation est particulièrement important dans les études impliquant une activation submaximale telles que les évaluations de force PCA. Pour les expériences dans lesquelles les fibres sont entièrement activés, tels que ceux décrired ici, la concentration de calcium dans la solution d'activation dépasse généralement avec une marge confortable que nécessaire pour obtenir la force maximale, ce qui rend sa connaissance précise moins critique. L'addition de phosphate de créatine est important pour tamponner les fluctuations intramyofibrillar ATP et ADP qui seraient autrement associés à l'activité contractile. La créatine kinase est nécessaire pour catalyser le transfert de phosphate de créatine phosphate à l'ADP. Dans des conditions expérimentales qui se traduisent par des taux de rotation élevés, y compris l'ATP à travailler à des températures élevées ou raccourcissement de mesure à grande vitesse en 32 fibres rapides, la créatine kinase doit être ajouté à la solution pour compléter la créatine kinase endogène qui reste lié à la fibre. Pour des conditions expérimentales moins exigeantes, le système de régénération d'ATP 27 est moins critique.
Limites de la technique perméabilisée de fibre unique sont les suivants. Les données générées par ces tests définissent lapropriétés contractiles myofibrillaires de l'unité spécifique qui a été attaché à l'appareil expérimental. Par conséquent, cette capture seulement une petite fraction de l'ensemble de fibres à partir de multinucléées laquelle le segment a été obtenu qui, à son tour, représente une petite fraction du nombre total de fibres dans le muscle. Les enquêteurs doivent donc examiner attentivement l'échantillonnage requis pour appuyer des conclusions tirées des expériences. En outre, l'évaluation de l'impact d'une intervention de l'entraînement physique sur la fonction de la fibre présume que les fibres évalués ont en effet été recrutés au cours de la formation. Bien que le protocole tente d'imiter le milieu intracellulaire naturel de la fibre, le procédé de perméabilisation de sarcolemme est non spécifique et permet nécessairement constituants intracellulaires solubles diffusent librement dans les solutions de bain. Une autre conséquence de la perméabilité de la membrane est un changement dans l'équilibre osmotique mis en évidence par un gonflement en volume de fibres 33. Legonflement de la fibre augmente la distance entre l'actine et la myosine résultant de la sensibilité réduite de calcium du système de myofilaments 34,35, mais peut être inversée par l'introduction de grandes composés osmotiquement actifs 34. Une dernière limite à considérer est la conséquence de la technique utilisée pour fixer les fibres de l'appareil expérimental. Cela exige invariablement fausser la relation spatiale au sein du système de filament à et à proximité des points d'attache, à la participation à des déficits fonctionnels. Plus précisément, les régions de la fibre à et adjacente aux points de fixation sont fonctionnellement compromise et contribuent ainsi artéfactuelle série élasticité au système de mesure.
En résumé, nous avons décrit un moyen permettant d'évaluer la capacité de génération de force de fibres musculaires squelettiques perméabilisées chimiquement in vitro. Bien que l'objet de cet article a été mis sur l'évaluation des generatin maximale de force isométriqueg capacité des fibres musculaires squelettiques humaines, l'approche expérimentale peut être modifiée et étendue afin de déterminer une variété de paramètres cinétiques et les relations à travers une gamme d'espèces de mammifères, ou autrement.
Déclarations de divulgation
Production and free access to this article is sponsored by Aurora Scientific
Remerciements
This work was supported by the following funding sources: R01-AR063649, AG-020591, F31-AR035931.
matériels
| Name | Company | Catalog Number | Comments |
| Polystyrene culture test tube with cap | Fisher Scientific | 14-956-3D | |
| 0.5 ml screw cap microcentrifuge | Fisher Scientific | 02-681-334 | |
| 0.5 ml microcentrifuge caps with o-ring | Fisher Scientific | 02-681-358 | |
| Microcentrifuge cryobox | Fisher Scientific | 5055-5005 | |
| pH meter | Mettler-Toledo | FE20 | |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Nonsterile-suture 10-0 monofilament | Ashaway Line Twine | S30002 | |
| Insect pins | Fine Science Tools | 26002-10 | |
| Forceps - Dumont #5 | Fine Science Tools | 11251-20 | |
| Microdissecting scissors | Fine Science Tools | 15000-08 | |
| Stereo microscope | Leica Microsystems | MZ8 | |
| Micrometer drives | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Aplha Omega Instruments | Series 800 | |
| LabVIEW software | National Instruments | - | |
| Computer | Varied | - | |
| Chamber system | Aurora Scientific | 802D | |
| Length-controller | Aurora Scientific | 312C | |
| Force-transducer | Aurora Scientific | 403A | |
| Reagents | |||
| K-proprionate | TCI America | P0510 | |
| Imadizole | Sigma-Aldrich | I0125 | |
| MgCl2•6H20 | Sigma-Aldrich | M2670 | |
| Brij 58 | Sigma-Aldrich | P5884 | |
| EGTA (acid) | Sigma-Aldrich | E0396 | |
| Na2H2ATP•0.56H2O | Sigma-Aldrich | A7699 | |
| Glycerol | Sigma-Aldrich | G6279 | |
| HEPES (acid) | Sigma-Aldrich | H7523 | |
| MgO | Sigma-Aldrich | 529699 | |
| HDTA (acid) | TCI America | D2019 | |
| CaCO3 | Sigma-Aldrich | C4830 | |
| NaN3 | Sigma-Aldrich | S8032 | |
| KOH (1 N) | Sigma-Aldrich | 35113 | |
| HCL (1 N) | Sigma-Aldrich | 318949 | |
| Na2CrP•4H2O | Sigma-Aldrich | P7936 | |
| pH 10 standard | Fisher Scientific | SB115 | |
| pH 7 standard | Fisher Scientific | SB107 | |
Références
- Mendias, C. L., Kayupov, E., Bradley, J. R., Brooks, S. V., Claflin, D. R. Decreased specific force and power production of muscle fibers from myostatin-deficient mice are associated with a suppression of protein degradation. J Appl Physiol. 111 (1), 185-191 (2011).
- Gumucio, J. P., Davis, M. E., Bradley, J. R., Stafford, P. L., Schiffman, C. J., Lynch, E. B., Claflin, D. R., Bedi, A., Mendias, C. L. Rotator cuff tear reduces muscle fiber specific force production and induces macrophage accumulation and autophagy. J Orthop Res. 30 (12), 1963-1970 (2012).
- Mendias, C. L., Roche, S. M., Harning, J. A., Davis, M. E., Lynch, E. B., Sibilsky Enselman, E. r., Jacobson, J. A., Claflin, D. R., Calve, S., Bedi, A. Reduced muscle fiber force production and disrupted myofibril architecture in patients with chronic rotator cuff tears. J Shoulder Elbow Surg. 1 (4), 111-119 (2015).
- Moss, R. L. Sarcomere length-tension relations of frog skinned muscle fibres during calcium activation at short lengths. J Physiol. 292, 177-192 (1979).
- Chase, P. B., Kushmerick, M. J. Effects of pH on contraction of rabbit fast and slow skeletal muscle fibers. Biophys J. 53, 935-946 (1988).
- Moisescu, D. G., Thieleczek, R. Calcium and strontium concentration changes within skinned muscle preparations following a change in the external bathing solution. J Physiol. 275, 241-262 (1978).
- Walker, S. M., Schrodt, G. R. I Segment lengths and thin filament periods in skeletal muscle fibers of the Rhesus monkey and the human. Anat Rec. 178, 63-81 (1974).
- Gollapudi, S. K., Lin, D. C. Experimental determination of sarcomere force-length relationship in type-1 human skeletal muscle fibers. J Biomech. 42, 2011-2016 (2009).
- Brenner, B. Technique for stabilizing the striation pattern in maximally calcium-activated skinned rabbit psoas fibers. Biophys J. 41 (1), 99-102 (1983).
- Claflin, D. R., et al. Effects of high and low-velocity resistance training on the contractile properties of skeletal muscle fibers from young and older humans. J Appl Physiol. 111, 1021-1030 (2011).
- Lynch, G. S., Faulkner, J. A., Brooks, S. V. Force deficits and breakage rates after single lengthening contractions of single fast fibers from unconditioned and conditioned muscles of young and old rats. Am J Physiol Cell Physiol. 295, C249-C256 (2008).
- Frontera, W. R., Rodriguez Zayas, A., Rodriguez, N. Aging of human muscle: understanding sarcopenia at the single muscle cell level. Phys Med Rehabil Clin N Am. 23, 201-207 (2012).
- Malisoux, L., Francaux, M., Theisen, D. What do single-fiber studies tell us about exercise training. Med Sci Sports Exerc. 39 (7), 1051-1060 (2007).
- Widrick, J. L., Stelzer, J. E., Shoepe, T. C., Garner, D. P. Functional properties of human muscle fibers after short-term resistance exercise training. Am J Physiol Regulatory Integrative Comp Physiol. 238, 408-416 (2002).
- Trappe, S. Effects of spaceflight, simulated spaceflight and countermeasures on single muscle fiber physiology. J Gravit Physiol. 9 (1), 323-326 (2002).
- Malisoux, L., Jamart, C., Delplace, K., Nielens, H., Francaux, M., Thiesen, D. Effect of long-term muscle paralysis on human single fiber mechanics. J Appl Physiol. 102, 340-449 (2006).
- Krivickas, L. S., Walsh, R., Amato, A. Single muscle fiber contractile properties in adults with muscular dystrophy treated with MYO-029. Muscle Nerve. 39, 3-9 (2009).
- Russell, A. J., et al. Activation of fast skeletal muscle troponin as a potential therapeutic approach for treating neuromuscular diseases. Nature Medicine. 18 (3), 352-356 (2012).
- Krivickas, L. S., Yang, J. I., Kim, S. K., Frontera, W. R. Skeletal muscle fiber function and rate of disease progression in amyotrophic lateral sclerosis. Muscle Nerve. 26, 636-643 (2002).
- Mendias, C. L., Marcin, J. E., Calerdon, D. R., Faulkner, J. A. Contractile properties of EDL and soleus muscles of myostatin-deficient mice. J Appl Physiol. 101, 898-905 (2006).
- Lynch, G. S., Rafael, J. A., Chamberlain, J. S., Faulkner, J. A. Contraction-induced injury to single permeabilized muscle fibers from mdx, transgenic mdx and control mice. Am J Physiol Cell Physiol. 279, 1290-1294 (2000).
- Mizunoya, Q., Wakamatsu, J., Tatsumi, R., Ikeuchi, Y. Protocol for high-resolution separation of rodent myosin heavy chain isoforms in a mini-gel electrophoresis system. Anal Biochem. 377, 111-113 (2008).
- Hill, A. V. The heat of shortening and the dynamic constants of muscle. Proc R Soc Lond B Biol Sci. 126, 136-195 (1938).
- Bottinelli, R., Canepari, M., Pellegrino, M. A., Reggiani, C. Force-velocity properties of human skeletal muscle fibres: myosin heavy chain isoform and temperature dependence. J Physiol. 495, 573-586 (1996).
- Edman, K. A. The velocity of unloaded shortening and its relation to sarcomere length and isometric force in vertebrate muscle fibres. J Physiol. 291, 143-159 (1979).
- Brenner, B., Eisenberg, E. Rate of force generation in muscle: Correlation with actomyosin ATPase activity in solution. PNAS. 83, 3542-3546 (1986).
- Moss, R. L. The effect of calcium on the maximum velocity of shortening in skinned skeletal muscle fibres of the rabbit. J. Muscle Res. Cell Motil. 3, 295-311 (1982).
- Pate, E., Wilson, G. J., Bhimani, M., Cooke, R. Temperature dependence of the inhibitory effects of orthovanadate on shortening velocity in fast skeletal muscle. Biophys J. 66, 1554-1562 (1994).
- Ashley, C. C., Moisescu, D. G. Effect of changing the composition of the bathing solutions upon the isometric tension-pCa relationship in bundles of crustacean myofibrils. J Physiol. 270, 627-652 (1977).
- Godt, R. E. Calcium-activated tension of skinned muscle fibers of the frog. Dependence on magnesium adenosine triphosphate concentration. J Gen Physiol. 63, 722-739 (1974).
- Fabiato, A., Fabiato, F. Calculator programs for computing the composition of the solutions containing multiple metals and ligands used for experiments in skinned skeletal muscle cells. Journal de Physiologie (Paris). 75, 463-505 (1979).
- Chase, P. B., Kushmerick, M. J. Effect of physiological ADP concentrations on contraction of single skinned fibers from rabbit fast and slow muscles). Am J Physiol. 268, C480-C489 (1995).
- Godt, R. E., Maughan, D. W. Swelling of skinned muscle fibers of the frog. Biophysical Journal. 19, 103-116 (1977).
- Kawai, M., Wray, J. S., Zhao, Y. The effect of lattice spacing change on cross-bridge kinetics in chemically skinned rabbit psoas muscle fibers. Biophys J. 64, 187-196 (1993).
- Millman, B. M. The filament lattice of striated muscle. Physiol Rev. 78 (2), 359-391 (1998).
- Edman, K. A. Contractile properties of mouse single muscle fibers, a comparison with amphibian muscle fibers. J Exp Biol. 208, 1905-1913 (2005).
- Phillips, S. K., Woledge, R. C. A comparison of isometric force, maximum power and isometric heat rate as a function of sarcomere length in mouse skeletal muscle. Pflügers Archiv. 420, 578-583 (1992).
- Stephenson, D. G., Williams, D. A. Effects of sarcomere length on the force-pCa relation in fast and slow-twitch skinned muscle fibres from the rat. J Physiol. 333, 637-653 (1982).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon