Method Article
Die Messung der isometrischen Maximalkraft von permeabilisierten Skelettmuskelfasern generiert
In diesem Artikel
Zusammenfassung
Die Analyse der Kontraktionseigenschaften von chemisch gehäutet oder durchlässig gemacht, Skelettmuskelfasern bietet ein leistungsfähiges Mittel, um die Muskelfunktion auf der Ebene der einzelnen Muskelzelle zu bewerten. In diesem Artikel beschreiben wir eine valide und zuverlässige Technik für die Vorbereitung und Prüfung durchlässig gemacht Skelettmuskelfasern in vitro.
Zusammenfassung
Analysis of the contractile properties of chemically skinned, or permeabilized, skeletal muscle fibers offers a powerful means by which to assess muscle function at the level of the single muscle cell. Single muscle fiber studies are useful in both basic science and clinical studies. For basic studies, single muscle fiber contractility measurements allow investigation of fundamental mechanisms of force production, and analysis of muscle function in the context of genetic manipulations. Clinically, single muscle fiber studies provide useful insight into the impact of injury and disease on muscle function, and may be used to guide the understanding of muscular pathologies. In this video article we outline the steps required to prepare and isolate an individual skeletal muscle fiber segment, attach it to force-measuring apparatus, activate it to produce maximum isometric force, and estimate its cross-sectional area for the purpose of normalizing the force produced.
Einleitung
Die primäre Funktion der Skelettmuskel ist, um eine Kraft zu erzeugen. Muskelkraft wird in vivo durch eine komplexe Abfolge von Ereignissen, die motorischen Nervenaktionspotentiale, die neuromuskuläre Übertragung, Muskelfaseraktionspotentiale, die Freisetzung von intrazellulärem Calcium, und die Aktivierung des Systems der Regulierung und kontraktilen Proteine enthält ausgelöst. Da Krafterzeugung ist das ultimative Ergebnis dieser Sequenz könnte ein Defizit in Kraft, die durch Ausfall eines oder mehrerer der einzelnen Stufen verursacht werden. Ein Schlüsselattribut der permeabilisierten Faservorbereitung ist, dass es beseitigt die meisten der für die Krafterzeugung in vivo erforderlichen Schritte, mit nur den regulatorischen und kontraktilen Funktionen mit der myofibrillären Gerät restlichen verbunden. Der Prüfer übernimmt die Kontrolle über die Lieferung der Aktivierung Calcium und Energie (ATP), und ist mit einem vereinfachten System, die Beurteilung der isolierten regulatorischen und kontraktilen Strukturen können in ihrer Mutter co belohntnfiguration. Messungen der Stärke mit permeabilisierten Skelettmuskelfasern sind somit wertvolle bei der Beurteilung Veränderungen in vivo beobachtet Muskelfunktion. Zum Beispiel haben wir diese Technik verwendet, um die Krafterzeugungskapazität von Fasern von Myostatin-defizienten Mäusen 1 zu charakterisieren und um die Ursache der anhaltenden Muskelschwäche folgende chronische Rotatorenmanschette 2,3 ausgestellt zu bewerten.
Moderne permeabilisiert Faser Methodik kann früh einflussStudien 4,5 verfolgt werden und ist derzeit in Gebrauch von einer Reihe von Forschungsgruppen. Obwohl die Techniken in der Literatur beschrieben worden sind, haben sie noch nicht im Videoformat präsentiert. Das Ziel dieses Artikels ist es, um eine aktualisierte, gültige und zuverlässige Technik für die Messung der maximalen Krafterzeugungskapazität von einzelnen Fasern aus chemisch permeabilisiert Skelettmuskel-Proben zu veranschaulichen. Dazu ist eine individuelle Fasersegment (nachfolgend als ein voll ̶0; Faser ") aus einem vorge permeabilisiert Faserbündel herausgezogen und in einer Versuchskammer, die eine entspannende Lösung eingebracht, von denen das bestimmende Merkmal eine Calciumkonzentration, <10 nM. Die Faser wird dann an einem Ende mit einer Kraft-Wandler und mit dem anderen Ende an einem längen Controller angeschlossen sind. Mit der Faser in einer optimalen Sarkomerlänge gehalten wird, wird es einer aktivierenden Lösung, die eine Calcium-Konzentration, die ausreicht, um eine maximale Aktivierung und damit eine maximale isometrische Kontraktionskraft hervorrufen übertragen hat. Kraftdaten werden erfasst, gespeichert und mit einem Computer analysiert.
Protokoll
Alle Verfahren, die tierischen oder menschlichen Probanden sollten in Übereinstimmung mit den einschlägigen Richtlinien, Vorschriften und Aufsichtsbehörden durchgeführt werden. Die University of Michigan Ausschuss für die Benutzung und Pflege der Tiere (UCUCA) und der University of Michigan Medical Center Institutional Review Board genehmigt alle tierischen und in diesem Artikel beschriebenen menschlichen Verfahren.
1. Stellen Sie Dissecting und Lagerstammlösung
Hinweis: Die in den folgenden Anweisungen festgelegten letzten Bände kann nach oben oder nach unten skaliert werden, wie gewünscht.
- In einem 1000-ml-Becher 800 ml entionisiertem Wasser (ASTM Typ 1). Die Aufrechterhaltung eines sanften rühren, fügen Sie alle in Tabelle 1 aufgeführten Verbindungen zu dem VE-Wasser und lassen Sie sie lösen.
Verbindung Wunsch Conc. (M) Formelgewicht (g / mol) In den 1 L (g) K-propionat 0,250 112,17 28,040 Imidazol 0,040 68,08 2,720 EGTA 0,010 380,40 3.800 MgCl 2 • 6H 2 O 0,004 203,31 0,813
Tabelle 1: Zergliedern und Lagerung Lager Lösungskomponenten.
- Zu bringen, um ein Endvolumen von 1000 ml mit entionisiertem Wasser. Man beachte, dass es nicht notwendig ist, um die Lösung zu diesem Zeitpunkt Ph. Bewahren Sie die Stammlösung bei 4 ° C.
2. Stellen Sie Storage Solution
- Zu 200 ml Aufbewahrungslösung zu machen, beginnen mit 100 ml sezieren und Lagerstammlösung in ein 250-ml-Becherglas. In ausreichend Na 2 H 2 ATP zur endgültigen Adenosin bringenTriphosphat (ATP) Konzentration auf 2 mM. Zu bringen, um ein Endvolumen von 200 ml mit Glycerin. Auf pH 7,00 mit Kaliumhydroxid (KOH). Bewahren Sie die Speicherlösung bei -20 ° C.
Anmerkung: Wegen der viskosen Natur des Glycerins kann es schwierig sein, genau zu Volumen verzichten. Aus diesem Grund haben wir in der Regel fügen Sie die Glycerin nach Gewicht (100 ml Glycerin wiegt ca. 126 g).
3. Stellen Sie Dissecting Lösung
- Zu 200 ml Sezieren Lösung zu machen, beginnen mit 100 ml Seziersaal und Lagerstammlösung in ein 250-ml-Becherglas.
- Gebe ausreichend Na 2 H 2 ATP endgültigen ATP-Konzentration auf 2 mM zu bringen. PH-Wert auf 7,00 mit KOH. Bringen Sie das Endvolumen auf 200 ml mit VE-Wasser. Aliquot in Mengen von 2,5 ml und bei -80 ° C.
4. Stellen Sezieren Lösung mit Brij 58
Hinweis: Brij 58 ist ein nicht-ionisches Detergens, die (permeabel) Lipid-Doppelschichten stört.
- Zu 200 ml Sezieren Lösung mit Brij 58 zu machen, beginnen mit 200 ml Seziersaal Lösung in einem 250 ml Becherglas. Die Aufrechterhaltung eines sanften rühren, fügen Sie 1 g Brij 58 (0,5% w / v) zum Seziersaal Lösung und lassen Sie es zu lösen. Aliquot in Mengen von 2,5 ml und bei -80 ° C.
5. Stellen Sie Prüflösungen
Hinweis: Das folgende ist aus Moisescu und Thieleczek 1978 angepasst (6). Siehe Diskussion für zusätzliche Kommentare zur Vorbereitung Testlösungen.
- Bereiten Sie drei separate 1.000 ml-Becher mit "Relaxing", "Pre-Aktivierung" und "Aktivieren". In 400 ml VE-Wasser in jedes Becherglas.
- Hinzufügen der in Tabelle 2 angegebenen Verbindungen in den entsprechenden Becher und dann Erhitzen der Lösungen auf 70 ° C und 80 ° C. Achten Sie auf eine Lösungstemperatur von 70-80 ° C für 30 Minuten unter ständigem Rühren.
Hinweis: Eine Temperatur von 70-80 ° C hilft bei der elimination der Kohlensäure durch die Reaktion von Kalziumcarbonat mit EGTA in der Aktivierungslösung gebildet. Die entspannende Lösung und Pre-Aktivierungslösungen werden in der gleichen Weise wie der Aktivierungslösung behandelt wird, um die Konsistenz zu gewährleisten.
| RELAXING SOLUTION | PRE-Aktivierungslösung | Aktivierungslösung | |||||
| Verbindung | Formelgewicht (g / mol) | Gewünschte Konzentration (mM) | Erforderliche Gewicht (g) | Gewünschte Konzentration (mM) | Erforderliche Gewicht (g) | Gewünschte Konzentration (mM) | Erforderliche Gewicht (g) |
| HEPES (Säure) | 238,30 | 90,0 | 10,724 | 90,0 | 10,724 | 90.00 | 10,724 |
| MgO | 40.31 | 10.3 | 0,208 | 8.5 | 0,171 | 8.12 | 0,164 |
| EGTA (Säure) | 380,40 | 52,0 | 9,890 | 52.00 | 9,890 | ||
| HDTA (Säure) | 348,36 | 50,0 | 8,709 | ||||
| CaCO 3 | 100,10 | 50.00 | 2,503 | ||||
Tabelle 2: Relaxing, pre-aktivierenden und Aktivierungslösung Komponenten.
- Die Lösung wird auf Raumtemperatur und gebe ausreichend NaN 3 / KOH, um den endgültigen NaN 3 Konzentration auf 1 mM zu bringen.
ACHTUNG: NaN 3 (Natriumazid) ist giftig. Beziehen sich auf die chemische Sicherheitsdatenblätter vor dem Umgang mit dieser Chemikalie.- Zu 100 ml 100 mM Natriumazid-Lösung zu machen, fügen 0,65 g NaN 3 bis 10 ml 1 N KOH. Einzustellen, um ein Endvolumen von 100 ml mit entionisiertem Wasser.
- Den pH-Wert auf etwa 7,10 unter Verwendung von KOH.
- Nach dem Schritt 5.4 setze ausreichend Na 2 H 2 ATP, um die endgültige ATP-Konzentration auf 8 mM und ausreichend Na 2 CrP zu bringen, um die endgültige Kreatin phosophate (CRP) Konzentration auf 10 mM zu bringen.
- Bringen jeder Lösung auf das Endvolumen von 500 ml mit entionisiertem Wasser. Chill oder erhitzen Sie die Lösungen auf die Temperatur, bei der Experimente durchgeführt werden, dann verwenden KOH zu bringender pH-Wert auf 7,10, während diese Temperatur beibehalten wurde.
- Hinzuzufügen entspannt Lösung in das Becherglas, das die pre-Aktivierungslösung, so dass das endgültige Prä-aktivierende Lösung 1 Teil entspannt Lösung in 500 pre-aktivierende Lösung. Aliquot in Mengen von 2,5 ml und bei -80 ° C.
6. Stellen Sie Suture Loops
- Beginnen mit einem Strang aus nicht-sterilen USP 10-0 Monofilament-Nylonnaht.
- Verwenden Sie die Pinzette, um eine Schleife mit dem Strang unter Verwendung des Doppelüberhandknoten-Technik erstellen. Reduzieren Sie die Knoten in der Größe auf etwa 750 & mgr; m Durchmesser. Schleifendurchmesser unter dem Mikroskop mit Okular-Strichplatte Markierungen zu beurteilen.
- Verwenden microdissecting Schere, um überschüssige Naht so dass nur die Schleife und kleinen (500 um) tails auf beiden Seiten zu entfernen. Ein Beispiel eines fertigen Schleife ist in Abbildung 1 dargestellt.
- Wiederholen Sie die Schritte wurden 6,2 bis 6,3 bis 4 verwendbar Schleifen gemacht. Speicher Schleifen in einem Silikonelastomer überzogenen Petri Gericht für die zukünftige Verwendung.
Hinweis: Für jede Faser getestet Vier Nahtschleifen erforderlich.
7. Bundle Probe
Hinweis: Die folgenden Schritte beschreiben das Verfahren zur Zerlegung der ursprünglichen Probe in kleinere experimentelle "Bündel" von dem aus einzelnen Fasern werden schließlich extrahiert und untersucht werden. Jederzeit die Probe sollte mit Sorgfalt behandelt werden. Für die Zwecke dieser Beschreibung wird Anweisungen, als ob der Prüfer ist Rechtshänder gegeben.
- Besorgen Sie sich die Probe von Interesse und überträgt es auf der Anlage, in der Präparation stattfinden wird.
Hinweis: Methoden der Gewebebiopsie wird in Abhängigkeit von experimentellen Modell und Studiendesign variieren. Wenn möglich, sollte Muskeldurchblutung bis zum Zeitpunkt der Biopsie erhalten werden. - Wenn die Probe zwischen der Entnahmestelle und Seziersaal Website übertragen werden soll, transportiert sie in ein Gefäß gekühlt Sezieren Lösung, während auf Eis gehalten.
- Eine 5 cm Siliconelastomerbeschichtete Petrischale mit gekühltem Präpariermikroskop Lösung und zwei vor drei Insektenmontagestifte (100 um Durchmesser, Edelstahl).
- Übertragung der Probe auf die Schale. Stellen Sie sicher, dass die Probe bleibt, indem mehr Sezieren Lösung gegebenenfalls unter Wasser.
- Überprüfen Sie die Probe unter dem Mikroskop und zu manipulieren, um die Längsachsen der Fasern in Richtung der rechten Schulter des Forschers (Abbildung 2) ausrichten. Dann verankern die Probe in die Schale durch Verstiften an den Ecken.
Hinweis: Nutzen Sie das verbleibende Bindegewebe als Verankerungspunkte zu dieser Zeit, da dies Probe zu maximieren und zu erhalten Faserintegrität. Das Bündel können in leichte Spannung an der Festlegung zwischen den Fasern Margen helfen festgesteckt werden. - Mit der Zange auf der linken Seite und den microdissecting Schere im rechten beginnen vorsichtig seziert ein Bündel entlang der Längsränder zwischen den Fasern
Hinweis: Je nach ihrerGesamtlänge, weiter das Bündel sezieren in zahlreiche kleinere Bundles. - Stellen Sie sicher, dass Bündel Abmessungen sind etwa 0,5-1 mm in der Breite und ≥3 mm in der Länge. Beurteilen Sie die Abmessungen mit einem Mikroskop mit Fadenkreuz Markierungen in das Okular oder indem man ein Lineal unter der Schale.
- Entfernen Sie alle Gewebe, das mit der Zange oder Stifte als Folge der Seziersaal beschädigt wird.
- Den Vorgang wiederholen, bis eine ausreichende Anzahl von Bündeln haben seziert wurden oder bis die Probe erschöpft ist.
Anmerkung: Die Anzahl der Bündel, die erhalten werden kann, hängt von zahlreichen Faktoren, einschließlich der Größe und dem Zustand der Ausgangsprobe, die Morphologie des Muskels und dem Geschick des Untersuchers abhängig gemacht werden.
8. permeabilisieren Fibers
- Übertragen Sie die Pakete aus dem Sezieren Lösung in ein Fläschchen mit 2,5 ml frisch, gekühlt, Sezieren Lösung mit dem nicht-ionischen Detergens "Brij 58 'hinzugefügt(0,5%, w / v). Inkubieren auf Eis für 30 min unter gelegentlichem, leichtem Schütteln. Stellen Sie sicher, dass die Bündel bleiben während der Inkubation unter Wasser.
- Am Ende der 30-minütigen Inkubation, übertragen Sie die Bündel in ein Gefäß frischen Sezieren Lösung (kein Brij 58) und leicht bewegen und kurz, um alle verbleibenden Reinigungsmittel zu entfernen.
9. Bereiten Bundles für Storage
- Übertragen Sie die Bündel in ein Gefäß gekühlt Speicherlösung und Inkubation über Nacht bei 4 ° C.
10. Bewahren Sie Bundles
- Am folgenden Tag, bereiten eine Aufbewahrungsbox, in der Lage ist Festigkeit -80 ° C, mit genügend individuelle 0,5 ml Schraubkappe konische Röhrchen, um alle während des Sektionsprozess (ein Bündel pro Röhrchen) erhalten Bündel unterzubringen. Jeder konische Röhrchen sollten mit 200-400 ml frisches Speicherlösung gefüllt werden.
- Übertragen Sie die Bündel in die individuell beschriftet konische Röhrchen. Sicherzustellen, daß das Bündel nicht steckendie Seite der konischen Röhre oder schwimmt auf der Oberfläche der Lösung. Verschließen Sie die konische Röhrchen und die Proben bei -80 ° C zu lagern, bis der Tag der Prüfung.
11. Bereiten Versuchsapparatur
Hinweis: Die benutzerdefinierte Vorrichtung besteht aus einer Bühne, die eine Länge Controller und Kraftaufnehmer, einen beweglichen Kammersystem und ein 10X Dissektionsmikroskop Häuser. Mikrometerschraube Installationen ermöglichen eine präzise Manipulation von Faserbefestigungsflächen. Laserbeugungsmuster werden verwendet, um Sarkomerlänge schätzen. Während der Experimente erzeugten Daten auf einem Personalcomputer aufgezeichnet. Siehe für kommentierten Bilder der Versuchsaufbau Abbildung 3.
- Auftauen jeder der entspannenden, pre-aktivierenden und Aktivierungslösungen ein Fläschchen und halten auf dem Eis. Man beachte, dass ATP und CrP labile Verbindungen, die bei niedrigen Temperaturen gehalten werden sollten.
- Bereiten Sie das Mikroskop, Testgerät und die zugehörigen Computer für den Einsatz.
- Füllen Sie den ersten Versuchskammer mit entspannenden Lösung. In unserer Vorrichtung enthält die erste Kammer Prismen, dass der Prüfer, um die Faser von der Seite zu fotografieren kann. Füllen Sie den zweiten Versuchskammer mit Pre-Aktivierungslösung und das dritte mit Aktivierungslösung.
- Stellen Sie die Temperatur, so dass die in Kammer Thermometer Display 15 ° C. Thread zwei vorbereitete Fadenschlaufen auf die sich von beiden dem Kraftwandler und längen Steuerung (5A) aus Edelstahl Befestigungsflächen.
12. Extract permeabilisiert Single Fiber
- Tauwetter ein Faserbündel von Interesse, und übertragen Sie zu einem Siliconelastomer vernickelt Petrischale mit frisch, gekühlt entspannenden Lösung. Sichern Sie das Bündel mit Stiften an beiden Enden und sicherzustellen, dass er eingetaucht ist.
- Mit der Pinzette, greifen eine Faser an einem Ende und beginnt sanft Extraktion entlang seiner Längsachse.
Hinweis: Druck Beschädigung derEnde der Faser mit der Zange verursacht kein Problem ist zu diesem Zeitpunkt, da die kontraktilen Eigenschaften in diesem Bereich wird nicht getestet werden. Sorgfalt sollte jedoch bei der Extraktion von Fasern aus dem Bündel da Adhäsionen zwischen den Fasern und der extrazellulären Matrix kann bei übermäßiger Spannung führen, was letztendlich zu strecken induzierte Schäden getroffen werden. Beachten Sie, dass eine beträchtliche Variabilität zwischen Muskeln in dem Maße, in dem die Fasern haften an der umgebenden extrazellulären Matrix vorliegt. Fasern, die im Verdacht stehen, durch eine solche Strecke beschädigt worden sein sollte verworfen werden. - Verwenden einer Rasierklinge oder einem Skalpell, eine Pipettenspitze zu modifizieren, wie in (4) gezeigt. Einführung der Faser in der Spitze zusammen mit einer kleinen Menge an Lösung entspannt. Übertragen Sie die einzelne Faser von der Siliconelastomerbeschichtete Petrischale auf die Versuchskammer, die die entspannende Lösung enthält.
13. Berg Single Fiber
Hinweis: Ein Schritt-für-Schritt depiction in 5 zu sehen.
- Führungs vorsichtig mit der Pinzette, entfernen Sie die Faser aus der Pipettenspitze und verankern, um die Länge-Controller (links) mit dem ersten Fadenschleife.
- Verwenden Sie eine einzige, gleichmäßige Bewegung beim Anziehen der Schleife mit der Zange. Sicherzustellen, dass eine gleiche und entgegengesetzte Spannung an den beiden Enden des Nahtmaterials aufgebracht wird.
- Die erste Schlaufe sollte etwa 1 mm bis 2 mm von dem Ende der Länge Kontroller Befestigungsfläche verbunden werden.
- Manipulieren das andere Ende der Faser in Richtung der Kraftwandler (rechts) und sichern die Faser unter Verwendung des gleichen Verfahrens. Entfernen Sie überschüssiges Naht mit den microdissecting Schere (5C).
- Legen Sie die Faser unter einer geringen Menge an Spannung, indem der Abstand zwischen der Länge-Controller und Kraft-Wandler Arme mit der x-Koordinate Mikrometerschraube (3A).
- Schrauben Sie die zweite Schleife über den ersten und verankern die Faseran einem Punkt innerhalb von 0,2 mm vom Ende des Kraftwandlers Befestigungsfläche (5D).
- Entfernen Sie überschüssiges Naht mit den microdissecting Schere.
- Die Faserbefestigungsverfahren kann zum Verlust der Lösung aus der Kammer zu führen. Falls erforderlich, fügen Sie mehr Entspannung Lösung, um die Oberfläche der Lösung zu gewährleisten ist flach (weder konkav noch konvex). Eine flache Oberfläche ist wichtig, bei der Bewertung der Sarkomerlänge mit Laserbeugung.
- Ausrichten der Faser parallel zu den Seitenwänden der Experimentierkammer durch Einstellen der Position des Längensteuerung in der Richtung der y-Achse.
- Umfrage der Faser mit der Prismenseitenansicht und die Position der Länge-Steuerung in Richtung der z-Achse, bis die Faser parallel zum Boden der Kammer.
Anmerkung: Die Positionierung der Faser parallel zum Boden der Kammer kann ohne Kammer Prismen durch Fokussieren erste an einem Ende der Faser und t durchgeführt werdenhen, ohne Anpassung des Mikroskops Fokus, bringen Sie das andere Ende der Faser in den Fokus mit seiner z-Achse Mikrometerschraube. - Wenn die Faser in irgendeiner Weise verdreht, verdreht oder als Folge des Montagevorgangs beschädigt wird, sollte die Faser zu entsorgen und eine neue Faser angebracht.
14. Set Optimal Sarkomerlänge
- Wenn die Faser wurde korrekt in der Kammer ausgerichtet ist, legen Sie die kalibrierte Zielbild auf die Vorderseite des Mikroskops und richten Sie sie auf den ersten Versuchskammer.
Hinweis: Das Zielbild wird unter Verwendung der Standardgittergleichung kalibriert, λ = SL sin, wobei SL Sarkomerlänge ist θ der Beugungswinkel zwischen den 0 ° und 1 ° gebeugten Strahlen und λ die Wellenlänge des Lasers. - Schalten Sie den Laser und die Position der Stufe, so daß der Laser durch die Mitte der Faser verläuft.
ACHTUNG: Konzentrierte Laserlicht kann eine Beschädigung to Augenlicht. Versuchen Sie niemals, die Faser durch das Mikroskop sichtbar zu machen, wenn der Laser eingeschaltet ist. - Positionieren Sie die Faser in Bezug auf den Laserstrahl, um das Laserlicht zu beugen und beobachten ein Interferenz prasseln auf die kalibrierte Zielbild (Abbildung 6). Schalten Sie das Licht, dieses Muster deutlicher sichtbar zu machen.
Anmerkung: Wenn bei der korrekten Positionierung des Laserstrahls, wird kein Interferenzmuster zu sehen ist, bedeutet dies, dass die myofibrillaren Komponenten der Faser anomale / beschädigt sind und der Faser sollte durch eine neue ersetzt werden. - Um die Sarkomerlänge, Erhöhung gesetzt oder die Spannung auf der Faser mit der Länge-Controller X-Achse Mikrometerschraube, bis der gewünschte Abstand des gebeugten Lichts auf dem Zielbildschirm beobachtet verringern.
Anmerkung: Die optimale Sarkomerlänge der Faser von der Spezies des Tieres, von dem die Probe erhalten wurde, abhängen. A Sarkomerlänge von 2,7 & mgr; m wird allgemein angenommen, optimal zu sein, als Eselsingen Fasern aus menschlichem Gewebe 7,8. - Nach optimaler Sarkomerlänge eingestellt wurde, messen Sie den Abstand zwischen den beiden innersten Fäden. Dies geschieht am einfachsten mit Hilfe der Digitalanzeige auf der Mikrometerschraube, die die x-Achsen-Bewegung der Kammer kontrolliert durchgeführt. Positionieren der Kammer derart, dass die vertikalen Linie des Okulars an der innersten Grenze des innersten Fadens ausgerichtet und die Nullen der Digitalanzeige auf der Mikrometerschraube.
- Übersetzen die Bühne entlang der x-Achse relativ zu dem Mikroskop bis zum Erreichen des anderen innersten Naht. Das digitale Display zeigt die Länge der Faser. Dieser Wert sollte wie Faserlänge, L f aufgezeichnet werden.
Anmerkung: Es ist zu verstehen, dass der Abstand zwischen den beiden innersten Fäden bestimmen die Funktionslänge des kontraktilen Gewebes ausgewertet werden. Der Prüfer sollte für Konsistenz in dieser Dimension (dh L f) innerhalb einer bemühenVersuchsreihe.
15. Estimate Querschnittsfläche (CSA)
- Aufrechterhaltung der Faser bei L f verwenden, auf dem Mikroskop montierte Kamera, um ein Bild hoher Vergrßerung des mittleren Teils der Faser von oben und Seitenansichten einzufangen. Seitenansicht die Bilder unter Verwendung des Prismas in der Seite der Kammer eingebettet erfasst werden.
Hinweis: Beim Wechsel zwischen Auf- und Seitenansichten ist es wichtig, das Mikroskop nur in der y-Richtung zu bewegen, um sicherzustellen, dass die zwei Bilder "im Register" und damit zwei verschiedene Ansichten der gleichen Schnitt der Faser. - Erhalten Sie Messungen in dieser Zeit zur absoluten Kraft später in der Studie zu normalisieren. Die Techniken zur Gewinnung dieser Messungen sind unten beschrieben und in den 7A und 7B dargestellt.
16. Elicit isometrische Kontraktion
Hinweis: Während die Daten während dieser Versuch erzeugts gesammelt und ausgewertet, ohne die Verwendung eines Computers, der Software, die für die Erfassung, Anzeige, Speicherung und Auswertung der Antworten Kraft ist vorteilhaft ermöglicht werden. Die benutzerdefinierte LabVIEW-Software von unserem Labor können diese Funktionen als auch die Fähigkeit, 'motion Züge, die bei einem Experiment die Wirkung von der Länge-Controller regeln zu entwerfen.
- Bestätigen Sie, dass die Temperatur des entspannten, pre-aktivierenden und Aktivierungslösungen bei 15 ° C stabil sind.
- Verwenden Sie die Kammer Steuerungssoftware, um die Faser in die Kammer mit der pre-Aktivierungslösung bewegen und Inkubation für 3 min.
Hinweis: Das pre-aktivierende Lösung schwach für Ca 2+ gepuffert, was zu einer sehr schnellen Aktivierung und Kraftentwicklung bei Einführung der Faser zur Aktivierungslösung. - Mit 10 sec in der Pre-Aktivierungslösung und der Faserlänge bei L f aufrechterhalten bleibt, stellen Sie eine Null-force Ebene in der experimentellen Datensatz.
Hinweis: Die 'Finden Kraft Null' Bewegung des Länge-Controller zeigt die Kraft-Wandlerstufe, die auf Null Kraft entspricht (dh die Faser kurz schlaff wird als Ergebnis der Bewegung). Passivkraft ist der Unterschied zwischen dieser Null und dem Kraftniveau unmittelbar vor dem Wandler-Nullstellen-Bewegung. - Am Ende der 3 min, bewegen Sie die Faser auf die Kammer mit der Aktivierungslösung und ermöglichen maximale isometrische Kraft zu entwickeln, wie durch eine Hochebene in Kraft, die durch einen schnellen Anstieg vorangestellt ist belegt.
- Nach Erreichen der maximalen isometrischen Kraft, verwenden Sie die Länge-Controller, um die Kraft-Wandler Ausgang, der auf Null Kraft in der Kammer mit der Aktivierungslösung entspricht identifizieren.
Anmerkung: Dies ist notwendig, da die Kraft-Wandler-Ausgang, der mit Kraft Null entspricht, ist im allgemeinen für jede Lösung gefüllte Kammer. - Nach Erreichen eines zweiten Kraft plateau, Rückkehr der Faser zu der Kammer, die die entspannende Lösung. Test ist abgeschlossen. Um mehrere Fasern während einer Sitzung absaugen testen alle Lösungen und neue, gekühlte Lösungen.
Hinweis: Brenner Radsport Protokolle sollten bei der Auslösung maximale Kontraktionen über einen längeren Zeitraum werden. Dieses Protokoll wurde gezeigt, strukturellen und mechanischen Eigenschaften in der maximal aktivierten Faser 9 zu erhalten.
Ergebnisse
Gesund, chemisch permeabilisiert Einzelfasern sollten einheitlich in der Form erscheinen und konsistente Streifenabstand unter hoher Vergrößerung betrachtet. Fasern, die unflexibel sind, wenn sie mit der Zange oder manipuliert haben offensichtliche strukturelle Schäden zu verwerfen.
Hohe Vergrößerung digitaler Bilder im Schritt 15 aufgenommen werden 5 gepaart Durchmessermessungen entlang der Mittelteil der Faser analysiert. Faser CSA wird unter Annahme eines elliptischen Querschnitt aufweist und durchschnittlich 5 einzelnen CSA-Messungen, wie in 7A dargestellt. 7B dient auch dazu, zu veranschaulichen, wie Faserabmessungen in einer Ansicht kann signifikant verschieden im Vergleich zu Partner Abmessungen in der anderen Ansicht (dh grenz Abschnitte nicht im allgemeinen rund).
Vergleichskraft Spuren aus menschlichen langsamen und schnellen Fasern werden in den 8A und 8B gezeigt. Voltage Ausgabe der Kraft-Wandler während eines Tests erfasst und umgewandelt zu zwingen (MN) mit Datenerfassungs- und Analysesoftware (LabVIEW). 9 veranschaulicht die Vorgehensweise verwendet, um maximale Wirkkraft (F o) zu bewerten, die durch Subtraktion berechnet wird die erforderlich ist, um die Faser zu optimalen Sarkomerlänge pflegen Kraft, während in einem entspannten Zustand (passive Kraft F P), von der größten isometrische Kraft während maximal Faseraktivierung entwickelt (Gesamtkraft F T). Da der Ausgang der Kraftwandler, der auf Null Kraft entspricht, ist in der Regel für jede der verschiedenen Badekammern wir kurz zu entspannen die Faser sowohl in der Pre-aktivierenden und Aktivierungslösungen, um die Null-Kraftniveau in der Capture- experimentellen Datensatz. Normalisierung der maximalen Wirkkraft, die durch Faser CSA dient dazu, die mehr Aussagekraft bestimmten Kraft (SF o) zu erzeugen. Denn es berücksichtigt die CSA der Faser, SF o liefert ein Maß für die intrinsische Krafterzeugungskapazität des kontraktilen Apparates der Faser, wodurch eine funktionale Vergleiche zwischen Fasern von unterschiedlichen Größen. Es sollte jedoch angemerkt werden, dass CSA-Messungen sind nicht möglich, den Anteil der Faser durch kontraktile Filamente gegenüber dem Anteil von anderen subzellulären Strukturen besetzte unterscheiden.
Typische Eigenschaften von gesunden, erwachsenen Fasern von Claflin et al. 2011 10 Menschen, Mendias et al. 2011 1 für Maus und Gumucio et al. 2012 2 für Ratten sind in Tabelle 3 aufgeführt. Die Daten in Tabelle 3 wurden unter Verwendung der erzeugten Techniken, die in diesem Artikel beschrieben.
| Mensch (Vastus lateralis) | Maus (EDS) | Ratte (Infraspinatus) | ||||
| Männlich | Weiblich | Männlich | Männlich | |||
| Typ-1- | Typ 2a | Typ-1- | Typ 2a | (Nicht eingegeben) | (Nicht eingegeben) | |
| CSA (& mgr; m 2) | 4880 - 6900 | 5270 - 8380 | 3870 - 5470 | 4010 - 5610 | 1850 - 3080 | 5290 - 8010 |
| F o (MN) | 0,79-1,17 | 1,02-1,54 | 0,64-0,97 | 0,71-1,07 | 0,14-0,25 | 0,55-0,97 |
| sF o (kPa) | 142-182 | 165-210 | 156-193 | 172-214 | 67-94 | 102-131 |
| n | 129 | 160 | 149 | 207 | 37 | 94 |
Tabelle 3. Typische Merkmale von gesunden, erwachsenen Fasern aus menschlichem vastus lateralis 10, Maus extensor digitorum longus 1 und Ratte infraspinatus 2 Muskeln. Optimal Sarkomer Längen wurden mit 2,7 & mgr; m für die menschliche Fasern 7,8 und 2,5 & mgr; m sowohl für Maus (36 gesetzt, 37) und Ratten-Fasern (38). Experimental L f Bereiche (25. und 75. Quartile) waren 1,39 bis 1,73 mm, 1,17 bis 1,53 mm und 1,32 bis 1,59 mm für Mensch, Maus und Ratte sind. Bereiche gezeigt zeigen die 25. und 75. Quartile und n die Anzahl der getesteten Fasern.
Die häufigsten Probleme während der Prüfung umfassen eine Fadenschleife Schlupf, der in einem Kraft respons Ergebnissee mit einem "fangen", wie es in 10A dargestellt ist, und eine teilweise oder vollständige Dicke Reiß der Faser, die in einer Reaktion, die Kraft schlagartig in Richtung oder, um (Pause) gibt Ergebnisse Null, während die Faser noch im Aktivierungslösung eingetaucht (10B). Wenn während eines Experiments ein Schlupf, Riss oder Bruch auftritt, sollte die Faser verworfen werden und die Daten ausgeschlossen, obwohl die Aufrechterhaltung einer Aufzeichnung der Faserausfälle können auch informative 11 sein. Ein weiteres negatives Ergebnis, die angetroffen werden kann, ist die vorzeitige Aktivierung der Faser, während in der Pre-aktivierende Lösung (Abbildung 10C). Teilaktivierung in der Pre-Aktivierungslösung schlägt erhebliche grenzüber gut Kontamination (dh eine unbeabsichtigte Erhöhung der Kalziumkonzentration in der Pre-Aktivierung auch). In diesem Fall sollten alle Bäder abgesaugt und gut mit deionisiertem Wasser gespült werden. Trocknen der Teilungsoberflächen zwischen den Kammern ist auch Empded wie Feuchtigkeit oder Kondensation in diesen Bereichen können zu Feuchtigkeitsregulierung der Lösung zwischen den Bädern führen. Die Entscheidung über die ein- oder ausgeschlossen werden Daten hängt letztlich von der experimentellen Fokus und sollte daher bei der Auslegung der Studie werden.

Abbildung 1: Nähfadenschlaufe (10-0 Monofilament-Nylonnaht).

Abb. 2: Bundle Dissektion Zange sind in der linken Hand, sind Mikrodissektion Schere in die rechte Hand. Rote Linie gibt die günstige Orientierung des Handgelenks und der Schere, wobei die Längsachsen der Fasern.

Abbildung 3: (A) Prüfgerät mit markierten Komponenten. (A) Versuchskammern mit transparenten Böden. (B) Length-Controller. (C) Kraft-Wandler. (D) Lichtquelle. (E) Length-Controller xyz Mikrometerschraube mit digitaler Anzeige. (F) Bühnenmikrometerschraube mit digitaler Anzeige. (G) Kraft-Wandler xyz Mikrometerschraube. (H) Plattform für kalibrierten Laserbeugungszielbildschirm. (I) Schwingungsisolierung Tisch. (B) Close-up Blick auf die Versuchskammern. (J) Edelstahl-Befestigungsfläche, die sich von der Länge-Controller. (K) Edelstahl-Befestigungsfläche, die sich von dem Kraftwandler. (L) Side-View-Prisma. (M) Gehäuse für thermoelektrische Kühlmodulen. (N) Thermoelement für die Berichterstattung Kammer temperatur.

Abbildung 4: Modifizierte 100 ul Pipettenspitze verwendet werden, um Fasern aus Dissektion Gericht zu Versuchskammer übertragen.
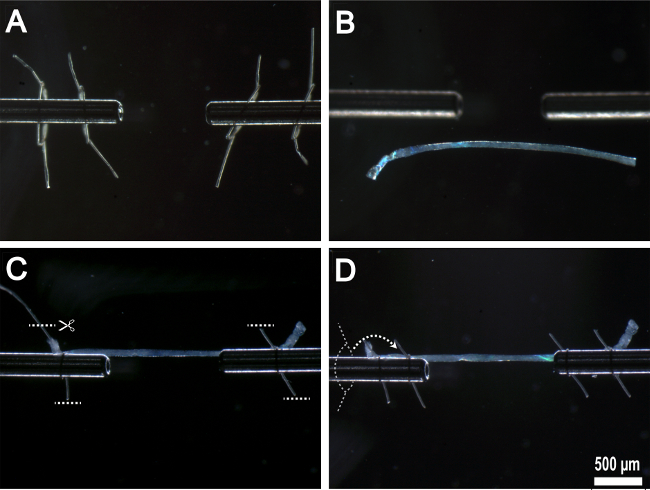
Abb. 5: Montage einzelnen Faser auf Versuchsvorrichtung (A) Nahtschlaufen auf Edelstahl-Befestigungsflächen eingefädelt. (B) Fiber übertragen Experimentierkammer. (C) Fiber to Edelstahlbefestigungsflächen durch das erste Paar von Nahtschleifen mit überschüssigen Faden entfernt verankert. (D) zweites Paar Nahtschlaufen über die Oberseite des ersten Nahtschleifen Gewinde und gebunden an Ort und Stelle.

Abbildung 6: Sarkomerlänge wird durch die Projektion eines Laserinterferenzmuster auf einer kalibrierten Zielbild beurteilt (a) Laser-Quelle.. (B) Spiegel. (C) Zielbild. (D) Laserinterferenzmuster.
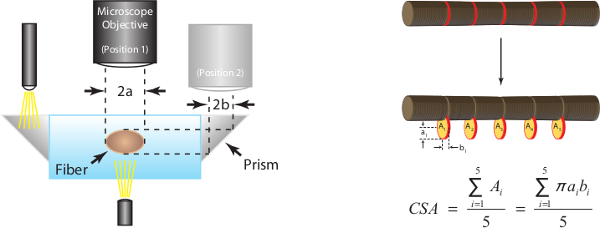
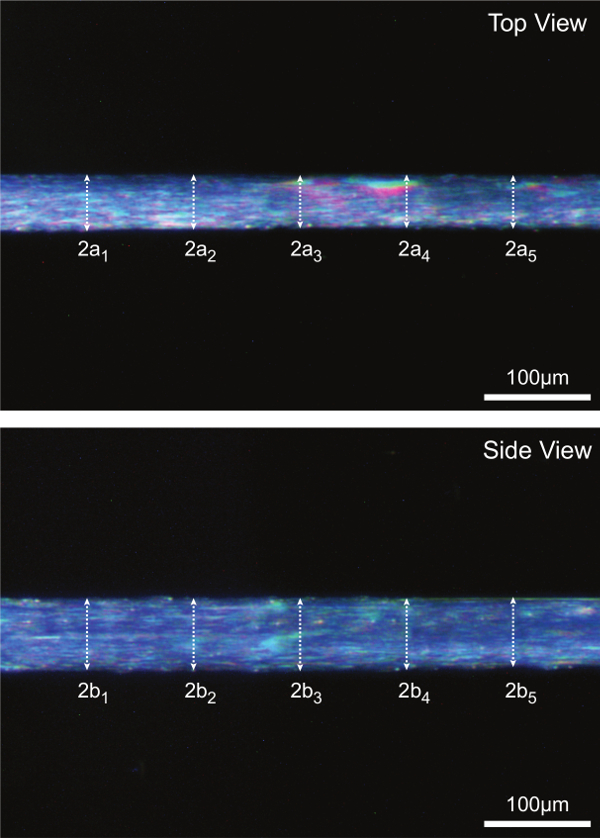
Abbildung 7: (A) Bestimmung der Faserquerschnittsfläche zu optimalen Sarkomerlänge (human = 2,7 um). Unter der Annahme eines elliptischen Querschnitts wird CSA für jede der fünf Positionen entlang der Fasermittelteil und dem Mittelwert der fünf Einzelmessungen als Faser CSA berichtet berechnet. 2a für Aufsicht und Durchmesser ist einer Achse der Ellipse, 2b darstellt Seitenansicht Durchmesser und die andere Achse der Ellipse. (B) Repräsentative Faserabbildungen zur Darstellung jeder der fünf entsprechenden Durchmessermessungen sowohl in der Aufsicht und Seitenansicht genommen.
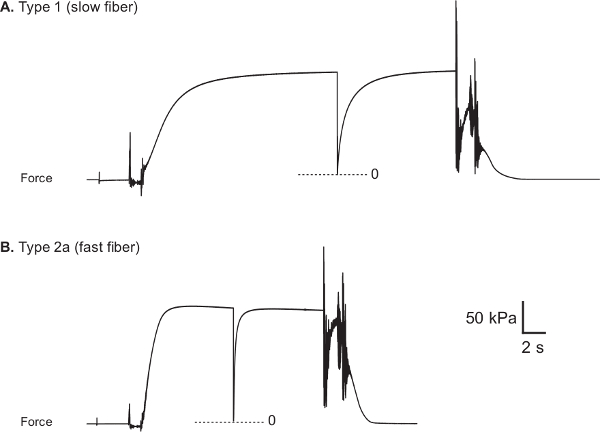
Abbildung 8: Repräsentative Kraft Spuren von gesunden menschlichen M. vastus lateralis Fasern (A) Typ 1 Faser (CSA: 5710 & mgr; m 2, F o: 0,89 mN und SF o: 156 kPa).. (B) Typ 2a Faser (CSA: 9510 & mgr; m 2, F o: 1,66 mN und SF o: 174 kPa). Faser-Myosin schwere Kette-Typ wurde durch die Verwendung von elektrophoretischen Trennung und Silber-Färbetechniken 22 bestimmt.
oad / 52695 / 52695fig9.jpg "/>
Abbildung 9: Berechnung der maximalen Wirkkraft (F o) (a) erweiterte Ansicht des Faserkraftantwort bei slack-induzierende Bewegung des Länge-Controller in der Vor-Aktivierungslösung eingeleitet.. F P die erforderlich ist, um eine Sarkomerlänge von 2,7 um mit der Faser in Ruhe zu halten Kraft. (B) vergrößerte Ansicht Länge-Controller slack-induzierende Bewegung. Beachten Sie, dass F o = F T - F P.
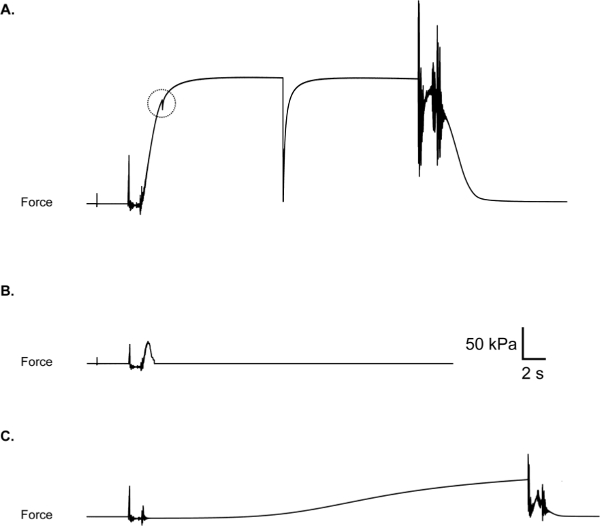
Abbildung 10: (A) Fadenschleife Schlupf, durch ein "Fang" in Kraft Spur während des Anstiegs von Gewalt zeigt. Überprüfen Sie, ob Schleifen sind vor der Aktivierung der Faser sicher. (B) Faserbruch während der Aktivierung. Kann während der Fadenschleife Ort aufgrund der schlechten Faserintegrität oder aggressive Faserbehandlung seinment. (C) Eine vorzeitige Teilfaseraktivierung durch Verschmutzung von Pre-Aktivierungskammer mit Ca 2+.
Diskussion
Beurteilungen der kontraktilen Eigenschaften permeabilisierter einzelnen Skelettmuskelfasern werden verwendet, um die Muskelfunktion in einer Vielzahl von Kontexten zu untersuchen. Beispiele hierfür sind Studien, die die Auswirkungen der Alterung 12 ausgewertet haben, ausüben 10,13,14, Raumfahrt 15, Verletzungen 2,3,16, medikamentöse Behandlungen 17,18, 19 und Krankheit genetische Manipulation 20,21 auf Faserstruktur und Funktion. Aufgrund der Fähigkeit, direkt die kontraktilen Leistung Myofibrillen in ihrer Mutter Konfiguration, bietet diese Technik eine attraktive Plattform, um ein Verständnis der Funktion myofibrillären abwesend potenziell verwirrende Effekte, die vorhanden sind zu bilden, wenn die neuromuskuläre Signalübertragung und Anregung induzierte Calciumfreisetzung sind in der untersuchten Systems enthalten. Weiterhin kann die Funktionsprüfung der Einzelfasern verwendet werden, um kontraktilen Proteinidentifikationsergebnisse wie jene ergänzendurch Immunhistochemie oder Gelelektrophorese + Western-Blot-22 erhalten.
Eine der primären Funktionen der Skelettmuskel ist, um eine Kraft zu erzeugen. Folglich sF o, ein Maß für die intrinsischen Krafterzeugungsfähigkeit eines kontraktilen Systems ist von großem Interesse, um die Muskel Physiologen. Zuverlässige Schätzungen der sF o erfordern genaue Maßnahmen beider Faser CSA und F o. Da Fasern sind in der Regel weder einen kreisförmigen Querschnitt, noch gleichmäßiger in CSA entlang ihrer Länge, große Sorgfalt sollte bei der Schätzung CSA genommen werden. Zu diesem Zweck werden die Messungen an mehreren Stellen entlang der Länge der Faser hergestellt und an jedem Ort, von zwei Seiten um 90 ° getrennt sind. Zuverlässige Maßnahmen der F o erfordern Aufmerksamkeit auf einige Details, einschließlich Buchhaltung für passive Kraft, die Anpassung Sarkomerlänge Überschneidungen von dicken und dünnen Fäden zu maximieren, unter Verwendung einer Aktivierungslösung mit einem Calciumkonzentration tKappe ergibt maximalen Aktivierung, die Aufrechterhaltung der gewünschten Versuchstemperatur und Aufrechterhaltung einer optimalen Lagerbedingungen (Temperatur und Dauer) der Fasern vor dem Tag des Experiments.
Während die hier beschriebenen Schritte beschreiben das Verfahren zur Bewertung maximale isometrische Kraft, ist es häufig wünschenswert, andere wichtige funktionelle Eigenschaften der Skelettmuskelfasern bewerten. Dies kann durch Verstrecken des experimentellen Protokolls, um zusätzliche mechanische Manipulationen der Faser schließen erreicht werden. Zum Beispiel ermöglicht die Messung der Geschwindigkeit, mit der die Faser verkürzt gegen eine Reihe von unterschiedlichen Lasten Bestimmung des Kraft-Geschwindigkeits-Beziehung, aus der Kraft-Kraft und Geschwindigkeitsleistungsverhältnisse berechnet 10,23,24 werden. Zusätzlich kann die Geschwindigkeit der entladenen Verkürzung durch Verwendung des "slack-Test" 25, die der Anwendung einer Reihe von Durchhang-induzierende Verkürzung Schritte und measuri bestehen bestimmt werdenng die Zeit von der Faser erforderlich den Durchhang zu entfernen. Eine weitere kinetische Parameter, die häufig berichtet wird, ist k tr, die Geschwindigkeitskonstante für Kraft Sanierung nach einer mechanischen Störung, die vorübergehend löst alle Querbrücken 26. Schließlich ist die Beziehung zwischen der Calciumkonzentration und der aktiven Krafterzeugung (der "Kraft-PCA relationship") oft von Interesse 18 und kann durch Aussetzen der Faser einer Reihe von Lösungen mit Calciumkonzentrationen im Bereich von unterhalb der Schwelle für die Aktivierung des kontraktilen bestimmt werden System, um solche ausreichende maximale Aktivierung und damit maximale Kraft (F o) zu entlocken.
Obwohl ein Großteil der genannten Gerätes ist für die Bewertung der einzelnen Faser Kontraktilität benötigt wird, ist anderen Geräten nicht unbedingt erforderlich. Das Längen-Controller, beispielsweise ist für jede experimentelle Protokoll, das eine schnelle und genaue Verlängerung oder Verkürzung der Faser erfordert,aber nicht für die Bewertung maximalen isometrischen Kraft (wenn auch ein Nullkraftniveau in der Kraft-Eintrag muss immer noch auf irgendeine Weise identifiziert werden kann) unbedingt erforderlich. Die Prismen, die Beobachtung der Faser von der Seite zu erlauben, während die für die Beurteilung Querschnittsfläche, sind nicht unbedingt notwendig, wenn die Positionierung der Faser in der Experimentierkammer. Weiterhin sind Mittel zum alternativen Freilegen der Fasern zu den verschiedenen Versuchslösungen verwendet werden könnten, einschließlich der Konzipierung einer manuell betriebenen System von Kammern oder einer Kammer, die für ein schnelles Füllen gestattet und Entleeren von Lösungen. Schließlich, während subphysiologischen experimentellen Temperaturen wie 15 ° C werden häufig verwendet, um die Reproduzierbarkeit der mechanischen Messungen 1,2,3,5,8,12,17,27 verbessern, ist es möglich, gültige Daten bei anderen Temperaturen 23 erzeugen , 28, solange die Wirkungen der Temperatur auf die Lösungseigenschaften (Calciumkonzentration, pH, etc.) berücksichtigt werden.
Die Zusammensetzung der Testlösungen zu den kritischsten Aspekte der hier beschriebenen Techniken permeabilisierten Faser. Überlegungen zu Lösungszusammensetzung sind komplex und würde den Rahmen dieses Artikels sprengen. Das in Schritt 5 des Protokolls beschrieben Lösungen werden mit Betonung auf eine schnelle Aktivierung des permeabilisierten Faser bei der Übertragung vom voraktiviert, um Aktivierungslösungen, während eine konstante Ionenstärke, kationische Zusammensetzung und Osmolarität 6,29 ausgelegt. Andere Ansätze zur Lösungszusammensetzung wurden mit großem Erfolg von anderen Forschungsgruppen tätig und nutzen veröffentlicht Bindungskonstanten und Computational Tools 27,30,31 Regel. Die Konzentrationen von Calciumionen in den verschiedenen Aktivierungslösungen ist insbesondere in Studien mit submaximale Aktivierung wie Kraft-PCA Auswertungen. Für Experimente, in denen die Fasern vollständig aktiviert werden, wie jene, beschriebend hier die Calciumkonzentration in der Aktivierungslösung übersteigt typischerweise mit einem komfortablen Vorsprung, die maximale Kraft zu erzielen, was seine genaue Kenntnis weniger kritisch notwendig. Zusatz von Kreatinphosphat ist für die Pufferung der intramyofibrillar ATP und ADP Schwankungen, die sonst mit kontraktile Aktivität verbunden wäre. Kreatinkinase erforderlich ist, um den Phosphattransfer von Kreatinphosphat zu ADP katalysieren. Unter Versuchsbedingungen, die in hoher ATP Umsatzraten, einschließlich der Arbeit bei hohen Temperaturen oder Messen von Hochgeschwindigkeits-Backfett in die schnellen Fasern 32 führen kann, müssen Kreatinkinase zu der Lösung gegeben werden, um die endogenen Creatin-Kinase, die gebunden an die Faser bleibt zu ergänzen. Für weniger anspruchsvolle experimentellen Bedingungen ist der ATP-Regenerationssystem 27 weniger kritisch.
Einschränkungen der permeabilisierten Einzelfaser-Technik sind die folgenden. Die von diesen Tests generierten Daten bestimmen diekontraktilen Eigenschaften des spezifischen myofibrillaren Einheit, die mit der experimentellen Vorrichtung befestigt war. Folglich fängt diese nur einen kleinen Teil des gesamten mehrkernige Faser aus dem das Segment wurde erhalten, der wiederum nur einen kleinen Teil der Gesamtzahl von Fasern in den Muskel. Die Ermittler sollten daher sorgfältig überlegen, die erforderlich ist, um irgendwelche Schlüsse aus den Versuchen ausge unterstützt Sampling. Zusätzlich Bewertung der Auswirkungen der Übung Trainingsintervention auf Faser-Funktion setzt voraus, dass die ausgewerteten Fasern wurden in der Tat während der Ausbildung rekrutiert. Obwohl das Protokoll versucht, den natürlichen intrazellulären Milieu der Faser imitieren, ist die sarcolemma Permeabilisierung Verfahren unspezifisch und notwendigerweise ermöglicht lösliche intrazelluläre Bestandteile frei in den Badelösungen diffundieren. Eine weitere Folge der Membranpermeabilität einer Änderung des osmotischen Gleichgewichts durch eine Schwellung des Faservolumens 33 sichtbar. DieFaserquellung erhöht den Abstand zwischen Aktin und Myosin-Filamente was zu einer verringerten Calciumempfindlichkeit des myofilament System 34,35, kann aber durch die Einführung von großen, osmotisch wirksame Verbindungen 34 umgekehrt werden. Eine letzte Einschränkung zu betrachten ist die Folge der Technik verwendet, um Fasern zu der experimentellen Vorrichtung zu befestigen. Dies erfordert unweigerlich eine Verzerrung der räumlichen Beziehung innerhalb des Fadensystem an und nahe den Befestigungspunkten, mit Teilnahme an Funktionsdefizite. Insbesondere werden die Bereiche der Faser an und benachbart zu den Befestigungspunkten funktional beeinträchtigt und dadurch artifactual Serie Elastizität mit dem Messsystem bei.
Zusammenfassend haben wir ein Mittel, mit dem die Krafterzeugungskapazität des chemisch permeabilisiert Skelettmuskelfasern in vitro zu beurteilen, beschrieben. Obwohl der Schwerpunkt dieses Artikels hat sich auf die Bewertung der maximalen isometrischen Kraft generatin geweseng Kapazität des menschlichen Skelettmuskelfasern kann der experimentelle Ansatz modifiziert und erweitert, um eine Vielzahl von kinetischen Parameter und Beziehungen in einer Reihe von Arten, von Säugetieren oder anderweitig zu bestimmen.
Offenlegungen
Production and free access to this article is sponsored by Aurora Scientific
Danksagungen
This work was supported by the following funding sources: R01-AR063649, AG-020591, F31-AR035931.
Materialien
| Name | Company | Catalog Number | Comments |
| Polystyrene culture test tube with cap | Fisher Scientific | 14-956-3D | |
| 0.5 ml screw cap microcentrifuge | Fisher Scientific | 02-681-334 | |
| 0.5 ml microcentrifuge caps with o-ring | Fisher Scientific | 02-681-358 | |
| Microcentrifuge cryobox | Fisher Scientific | 5055-5005 | |
| pH meter | Mettler-Toledo | FE20 | |
| Petri dish | Fisher Scientific | 08-757-11YZ | |
| Nonsterile-suture 10-0 monofilament | Ashaway Line Twine | S30002 | |
| Insect pins | Fine Science Tools | 26002-10 | |
| Forceps - Dumont #5 | Fine Science Tools | 11251-20 | |
| Microdissecting scissors | Fine Science Tools | 15000-08 | |
| Stereo microscope | Leica Microsystems | MZ8 | |
| Micrometer drives | Parker Hannifin | 3936M | |
| Thermometer | Physitemp | BAT-12 | |
| Water bath circulator | Neslab Instruments | RTE-111 | |
| Temperature controller | Aplha Omega Instruments | Series 800 | |
| LabVIEW software | National Instruments | - | |
| Computer | Varied | - | |
| Chamber system | Aurora Scientific | 802D | |
| Length-controller | Aurora Scientific | 312C | |
| Force-transducer | Aurora Scientific | 403A | |
| Reagents | |||
| K-proprionate | TCI America | P0510 | |
| Imadizole | Sigma-Aldrich | I0125 | |
| MgCl2•6H20 | Sigma-Aldrich | M2670 | |
| Brij 58 | Sigma-Aldrich | P5884 | |
| EGTA (acid) | Sigma-Aldrich | E0396 | |
| Na2H2ATP•0.56H2O | Sigma-Aldrich | A7699 | |
| Glycerol | Sigma-Aldrich | G6279 | |
| HEPES (acid) | Sigma-Aldrich | H7523 | |
| MgO | Sigma-Aldrich | 529699 | |
| HDTA (acid) | TCI America | D2019 | |
| CaCO3 | Sigma-Aldrich | C4830 | |
| NaN3 | Sigma-Aldrich | S8032 | |
| KOH (1 N) | Sigma-Aldrich | 35113 | |
| HCL (1 N) | Sigma-Aldrich | 318949 | |
| Na2CrP•4H2O | Sigma-Aldrich | P7936 | |
| pH 10 standard | Fisher Scientific | SB115 | |
| pH 7 standard | Fisher Scientific | SB107 | |
Referenzen
- Mendias, C. L., Kayupov, E., Bradley, J. R., Brooks, S. V., Claflin, D. R. Decreased specific force and power production of muscle fibers from myostatin-deficient mice are associated with a suppression of protein degradation. J Appl Physiol. 111 (1), 185-191 (2011).
- Gumucio, J. P., Davis, M. E., Bradley, J. R., Stafford, P. L., Schiffman, C. J., Lynch, E. B., Claflin, D. R., Bedi, A., Mendias, C. L. Rotator cuff tear reduces muscle fiber specific force production and induces macrophage accumulation and autophagy. J Orthop Res. 30 (12), 1963-1970 (2012).
- Mendias, C. L., Roche, S. M., Harning, J. A., Davis, M. E., Lynch, E. B., Sibilsky Enselman, E. r., Jacobson, J. A., Claflin, D. R., Calve, S., Bedi, A. Reduced muscle fiber force production and disrupted myofibril architecture in patients with chronic rotator cuff tears. J Shoulder Elbow Surg. 1 (4), 111-119 (2015).
- Moss, R. L. Sarcomere length-tension relations of frog skinned muscle fibres during calcium activation at short lengths. J Physiol. 292, 177-192 (1979).
- Chase, P. B., Kushmerick, M. J. Effects of pH on contraction of rabbit fast and slow skeletal muscle fibers. Biophys J. 53, 935-946 (1988).
- Moisescu, D. G., Thieleczek, R. Calcium and strontium concentration changes within skinned muscle preparations following a change in the external bathing solution. J Physiol. 275, 241-262 (1978).
- Walker, S. M., Schrodt, G. R. I Segment lengths and thin filament periods in skeletal muscle fibers of the Rhesus monkey and the human. Anat Rec. 178, 63-81 (1974).
- Gollapudi, S. K., Lin, D. C. Experimental determination of sarcomere force-length relationship in type-1 human skeletal muscle fibers. J Biomech. 42, 2011-2016 (2009).
- Brenner, B. Technique for stabilizing the striation pattern in maximally calcium-activated skinned rabbit psoas fibers. Biophys J. 41 (1), 99-102 (1983).
- Claflin, D. R., et al. Effects of high and low-velocity resistance training on the contractile properties of skeletal muscle fibers from young and older humans. J Appl Physiol. 111, 1021-1030 (2011).
- Lynch, G. S., Faulkner, J. A., Brooks, S. V. Force deficits and breakage rates after single lengthening contractions of single fast fibers from unconditioned and conditioned muscles of young and old rats. Am J Physiol Cell Physiol. 295, C249-C256 (2008).
- Frontera, W. R., Rodriguez Zayas, A., Rodriguez, N. Aging of human muscle: understanding sarcopenia at the single muscle cell level. Phys Med Rehabil Clin N Am. 23, 201-207 (2012).
- Malisoux, L., Francaux, M., Theisen, D. What do single-fiber studies tell us about exercise training. Med Sci Sports Exerc. 39 (7), 1051-1060 (2007).
- Widrick, J. L., Stelzer, J. E., Shoepe, T. C., Garner, D. P. Functional properties of human muscle fibers after short-term resistance exercise training. Am J Physiol Regulatory Integrative Comp Physiol. 238, 408-416 (2002).
- Trappe, S. Effects of spaceflight, simulated spaceflight and countermeasures on single muscle fiber physiology. J Gravit Physiol. 9 (1), 323-326 (2002).
- Malisoux, L., Jamart, C., Delplace, K., Nielens, H., Francaux, M., Thiesen, D. Effect of long-term muscle paralysis on human single fiber mechanics. J Appl Physiol. 102, 340-449 (2006).
- Krivickas, L. S., Walsh, R., Amato, A. Single muscle fiber contractile properties in adults with muscular dystrophy treated with MYO-029. Muscle Nerve. 39, 3-9 (2009).
- Russell, A. J., et al. Activation of fast skeletal muscle troponin as a potential therapeutic approach for treating neuromuscular diseases. Nature Medicine. 18 (3), 352-356 (2012).
- Krivickas, L. S., Yang, J. I., Kim, S. K., Frontera, W. R. Skeletal muscle fiber function and rate of disease progression in amyotrophic lateral sclerosis. Muscle Nerve. 26, 636-643 (2002).
- Mendias, C. L., Marcin, J. E., Calerdon, D. R., Faulkner, J. A. Contractile properties of EDL and soleus muscles of myostatin-deficient mice. J Appl Physiol. 101, 898-905 (2006).
- Lynch, G. S., Rafael, J. A., Chamberlain, J. S., Faulkner, J. A. Contraction-induced injury to single permeabilized muscle fibers from mdx, transgenic mdx and control mice. Am J Physiol Cell Physiol. 279, 1290-1294 (2000).
- Mizunoya, Q., Wakamatsu, J., Tatsumi, R., Ikeuchi, Y. Protocol for high-resolution separation of rodent myosin heavy chain isoforms in a mini-gel electrophoresis system. Anal Biochem. 377, 111-113 (2008).
- Hill, A. V. The heat of shortening and the dynamic constants of muscle. Proc R Soc Lond B Biol Sci. 126, 136-195 (1938).
- Bottinelli, R., Canepari, M., Pellegrino, M. A., Reggiani, C. Force-velocity properties of human skeletal muscle fibres: myosin heavy chain isoform and temperature dependence. J Physiol. 495, 573-586 (1996).
- Edman, K. A. The velocity of unloaded shortening and its relation to sarcomere length and isometric force in vertebrate muscle fibres. J Physiol. 291, 143-159 (1979).
- Brenner, B., Eisenberg, E. Rate of force generation in muscle: Correlation with actomyosin ATPase activity in solution. PNAS. 83, 3542-3546 (1986).
- Moss, R. L. The effect of calcium on the maximum velocity of shortening in skinned skeletal muscle fibres of the rabbit. J. Muscle Res. Cell Motil. 3, 295-311 (1982).
- Pate, E., Wilson, G. J., Bhimani, M., Cooke, R. Temperature dependence of the inhibitory effects of orthovanadate on shortening velocity in fast skeletal muscle. Biophys J. 66, 1554-1562 (1994).
- Ashley, C. C., Moisescu, D. G. Effect of changing the composition of the bathing solutions upon the isometric tension-pCa relationship in bundles of crustacean myofibrils. J Physiol. 270, 627-652 (1977).
- Godt, R. E. Calcium-activated tension of skinned muscle fibers of the frog. Dependence on magnesium adenosine triphosphate concentration. J Gen Physiol. 63, 722-739 (1974).
- Fabiato, A., Fabiato, F. Calculator programs for computing the composition of the solutions containing multiple metals and ligands used for experiments in skinned skeletal muscle cells. Journal de Physiologie (Paris). 75, 463-505 (1979).
- Chase, P. B., Kushmerick, M. J. Effect of physiological ADP concentrations on contraction of single skinned fibers from rabbit fast and slow muscles). Am J Physiol. 268, C480-C489 (1995).
- Godt, R. E., Maughan, D. W. Swelling of skinned muscle fibers of the frog. Biophysical Journal. 19, 103-116 (1977).
- Kawai, M., Wray, J. S., Zhao, Y. The effect of lattice spacing change on cross-bridge kinetics in chemically skinned rabbit psoas muscle fibers. Biophys J. 64, 187-196 (1993).
- Millman, B. M. The filament lattice of striated muscle. Physiol Rev. 78 (2), 359-391 (1998).
- Edman, K. A. Contractile properties of mouse single muscle fibers, a comparison with amphibian muscle fibers. J Exp Biol. 208, 1905-1913 (2005).
- Phillips, S. K., Woledge, R. C. A comparison of isometric force, maximum power and isometric heat rate as a function of sarcomere length in mouse skeletal muscle. Pflügers Archiv. 420, 578-583 (1992).
- Stephenson, D. G., Williams, D. A. Effects of sarcomere length on the force-pCa relation in fast and slow-twitch skinned muscle fibres from the rat. J Physiol. 333, 637-653 (1982).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten