Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Production de synthétique fondre le verre nucléaire
Dans cet article
Résumé
A protocol for the production of synthetic nuclear melt glass, similar to trinitite, is presented.
Résumé
Realistic surrogate nuclear debris is needed within the nuclear forensics community to test and validate post-detonation analysis techniques. Here we outline a novel process for producing bulk surface debris using a high temperature furnace. The material developed in this study is physically and chemically similar to trinitite (the melt glass produced by the first nuclear test). This synthetic nuclear melt glass is assumed to be similar to the vitrified material produced near the epicenter (ground zero) of any surface nuclear detonation in a desert environment. The process outlined here can be applied to produce other types of nuclear melt glass including that likely to be formed in an urban environment. This can be accomplished by simply modifying the precursor matrix to which this production process is applied. The melt glass produced in this study has been analyzed and compared to trinitite, revealing a comparable crystalline morphology, physical structure, void fraction, and chemical composition.
Introduction
Concerns over the potential malicious use of nuclear weapons by terrorists or rogue nations have highlighted the importance of nuclear forensics analysis for the purpose of attribution.1 Rapid post-detonation analysis techniques are desirable to shorten the attribution timeline as much as possible. The development and validation of such techniques requires realistic nuclear debris samples for testing. Nuclear testing no longer occurs in the United States and nuclear surface debris from the testing era is not readily available (with the exception of trinitite - the melt glass produced by the first nuclear test at the trinity site) and therefore realistic surrogate debris is needed.
The primary goal of the method described here is the production of realistic surrogate nuclear debris similar to trinitite. Synthetic nuclear melt glass samples which are readily available to the academic community can be used to test existing analysis techniques and to develop new methods such as thermo-chromatography for rapid post-detonation analysis.2 With this goal in mind the current study is focused on producing samples which mimic trinitite but do not contain any sensitive weapon design information. The fuel and tamper components within these samples are completely generic and the comparison to trinitite is based on chemistry, morphology, and physical characteristics. The similarities between trinitite and the synthetic nuclear melt glass produced in this study have been previously discussed.3
The purpose of this article is to outline the details of the production process used at the University of Tennessee (UT). This production process was developed with two key parameters in mind: 1) the composition of material incorporated into nuclear melt glass, and 2) the melting temperature of the material. Methods exist for estimating the melting temperature of glass forming networks4 and these techniques have been employed here, along with additional experimentation to determine the optimal processing temperature for the trinitite matrix.5
Alternative methods for surrogate debris production have been published recently. The use of high power lasers has the advantage of creating sufficiently high temperatures to cause elemental fractionation within the target matrix.6 Porous chromatographic substrates have been used to produce small particles similar to fallout particles using condensed phase methods7. The latter method is most useful for producing particulate debris (nuclear fallout) and has been demonstrated with natural metals. The advantages of the method presented here are 1) simplicity, 2) reproducibility, and 3) scalability (sample sizes can range from tiny beads to large chunks of melt glass). Also, this method is expandable both in terms of production output and variety of explosive scenarios covered, and it has already been demonstrated using radioactive materials. A sample has been successfully activated at the High Flux Isotope Reactor (HFIR) at Oak Ridge National Laboratory (ORNL). Natural uranium compounds were added to the matrix prior to melting and fission products were produced in situ by neutron irradiation.
Methods within the glass making industry and those employed for the purpose of radioactive waste immobilization8 have been consulted in the development of the method presented here. The unique effects of radiation in glasses are of inherent interest9 and will constitute an important area of study as this method is further developed.
The method described below is appropriate for any application where a bulk melt glass sample is desired. These samples most closely resemble the material found near the epicenter of a nuclear explosion. Samples of various sizes can be produced, however, methods employing plasma torches or lasers will be more useful for simulating fine particulate debris. Also, commercial HTFs do not reach temperatures high enough to cause elemental fractionation for a wide range of elements. This method should be employed when physical and morphological characteristics are of primary importance.
Protocole
Attention: Le processus décrit ici comprend l'utilisation de matières radioactives (par exemple, l'hexahydrate de nitrate d'uranium) et de plusieurs substances corrosives. Les vêtements et les équipements de protection appropriés devraient être utilisés (y compris une blouse de laboratoire, des gants, des lunettes de protection, et une hotte) lors de la préparation de l'échantillon. En outre, les zones de laboratoire utilisées pour ces travaux doivent être surveillés régulièrement pour contamination radioactive.
Note:. Les composés chimiques nécessaires sont énumérés dans le tableau 1 Cette formulation a été développée par l'examen de données déclarées précédemment composition pour trinitite 10 Les fractions de masse rapportés ici ont été déterminées par la moyenne des fractions de masse pour plusieurs échantillons de trinitite différents 10 La masse "disparus".. (les fractions de ne pas correspondre à l'unité) existe pour permettre une certaine souplesse lors de l'ajout de carburant, de sabotage, et d'autres constituants. Notre analyse indépendante de plusieurs échantillons trinitite suggère que le quartz est la seule phase minéralesurvivre dans trinitite. 5 Par conséquent, le quartz est le seul minéral inclus dans notre trinitite formulation standard (STF). Bien que les grains reliques d'autres minéraux ont été signalés dans trinitite, 11 ceux-ci ont tendance à être l'exception plutôt que la règle. En général, le quartz est le seul minéral présent dans le verre fondu. 10,12 Aussi, sable de quartz est un composant commun d'asphalte et de béton qui sera important dans la formation du verre urbaine de fusion nucléaire.
-4| Données moyennées trinitite | Norme trinitite Formulation (STF) | ||
| Composé | Fraction de masse | Composé | Fraction de masse |
| SiO 2 | 6.42x10 -1 | SiO 2 | 6.42x10 -1 |
| Al 2 O 3 | 1.43x10 -1 | Al 2 O 3 | 1.43x10 -1 |
| CaO | 9.64x10 -2 | CaO | 9.64x10 -2 |
| FeO | 1.97x10 -2 | 1.97x10 -2 | |
| MgO | 1.15x10 -2 | MgO | 1.15x10 -2 |
| Na 2 O | 1.25x10 -2 | Na 2 O | 1.25x10 -2 |
| K 2 O | 5.13x10 -2 | KOH | 6.12x10 -2 |
| MnO | 5.05x10 -4 | MnO | |
| TiO 2 | 4.27x10 -3 | TiO 2 | 4.27x10 -3 |
| Le total | 9.81x10 -1 | Le total | 9.91x10 -1 |
Tableau 1. Liste des composés chimiques.
1. Préparation de la STF
Remarque: L'équipement nécessaire comprend une microbalance, spatules en métal, un mortier et un pilon en céramique, une hotte chimique, gants en latex, une blouse de laboratoire et des lunettes de protection.
- Le mélange des composants non radioactifs
- Acquérir au moins 65 g de sable de quartz (SiO 2), 15 g de Al 2 O 3 </ sub> poudre, 10 g de poudre de CaO, 2 g de poudre de FeO, 2 g de poudre de MgO, 2 g de Na 2 O en poudre, 7 g de pastilles de KOH, 1 g de poudre de MnO et 1 g de poudre de TiO 2 ( composés énumérés dans le Tableau 1).
- Utilisez une microbalance et petite spatule de mesurer précisément les fractions de la masse de chaque composé comme indiqué dans le tableau 1. Pour de meilleurs résultats préparer 100 g de la matrice de précurseur non radioactif à un moment donné.
- Utilisation d'un mortier et d'un pilon à pulvériser (à ~ 10-20 granules de taille um) et bien mélanger les composés, en formant un mélange de poudre homogène contenant 64,2 g de SiO 2, 14,2 g de Al 2 O 3, 9,64 g de CaO, 1,97 g de FeO, 1,15 g de MgO, 1,25 g de Na 2 O. 6,12 g de KOH, 0,0505 g de MnO, et 0,427 g de TiO 2.
- Agiter le mélange, en utilisant un mélangeur à billes, peu de temps avant l'étape suivante est prise.
- Le mélange des STF avec Uranium hexahydrate de nitrate (UNH)
- Acquire au moins 1 g de UNH.
- L'intérieur d'une hotte, pulvériser quelques cristaux UNH (en utilisant un mortier et un pilon) pour former une poudre fine de 1-2 um granulés.
- Ajouter 33,75 pg de UNH par gramme de la matrice de précurseur non radioactif (ce rapport est approprié pour simuler une arme simple avec un rendement de 1 kilotonnes). 13
- Bien mélanger le mélange de poudre, y compris l'UNH, en utilisant un mortier et un pilon. Remplissez mélange final peu de temps avant l'étape de fusion.
2. Production de 1 gramme échantillon fondre le verre
Remarque: L'équipement nécessaire comprend une HTF évalué à 1 600 ° C ou plus, creusets de haute pureté de graphite, longs en acier inoxydable pince à creuset, des gants résistant à la chaleur, et des lunettes de protection. Des gants résistants à la chaleur et une protection oculaire doivent être portés lors de l'introduction ou du retrait des échantillons du four. Lunettes de sécurité teintées (ou des lunettes de soleil) sont utiles, car ils réduisent la lueur de la fournaise.
- Production d'un échantillon non radioactif
- Remplir un plat en céramique d'épaisseur (par exemple un pignon) avec ~ 100 g de sable de quartz pur et maintenir à la température ambiante à proximité de l'emplacement du four où les échantillons seront fondus.
- Préchauffer le FASS à 1500 ° C.
- Mesurer soigneusement 1,00 g du mélange de poudre non-radioactifs et placer la poudre dans un creuset en graphite de haute pureté.
- Placez soigneusement le creuset dans le FASS chauffée (en utilisant une longue paire de pince à creuset acier) et fondre le mélange pendant 30 min.
- Retirer l'échantillon (de nouveau en utilisant les pinces) et verser l'échantillon fondu dans le mortier rempli de sable.
- Laisser la perle de verre refroidir pendant 1-2 min avant de le manipuler.
- Polir le talon pour enlever le sable résiduel (si nécessaire).
- Production d'un échantillon radioactif
- Répétez les étapes 2.1.1 et 2.1.2 ci-dessus.
- Mesurer soigneusement 1,00 gramme du mélange de poudre radioactifs (y compris UNH) et placer le Powd er dans un creuset en graphite de haute pureté à l'aide d'une spatule et microbalance séparé pour éviter toute contamination croisée.
- Répétez les étapes 2.1.4 - 2.1.6 ci-dessus.
- Surveiller la zone autour du four (en utilisant un détecteur à main rayonnement et / ou analyses magnétiques) pour vérifier la contamination radioactive.
3. Activation de l'échantillon
Remarque: Les équations qui suivent ont été établies en supposant l'utilisation de qualité militaire (enrichi) en uranium métal. Les quantités de UNH ou oxyde d'uranium devront être mis à l'échelle en fonction de la fraction de la masse d'uranium élémentaire et le niveau de 235 U enrichissement.
- Activation d'un échantillon de fusion de verre avec de l'uranium Fue
- Calculer la fraction massique de l'uranium métal requise pour l'échantillon en utilisant l'équation ci-dessous 13 (où m U représente la fraction massique de l'uranium et Y représente le rendement de l'arme):
473 / 53473eq1.jpg "/> - Facultatif: Calculer la fraction massique de sabotage (par exemple, l'uranium naturel, le plomb, le tungstène) en utilisant l'équation ci-dessous: 13
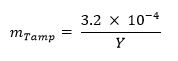
- Calculer le nombre de fissions cible dans l'échantillon en utilisant l'équation 13 ci-dessous dans laquelle M représente la masse de l'échantillon en grammes f et N représente le nombre de fissions produites dans l'échantillon pendant l'irradiation:
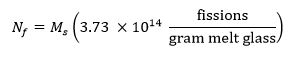
- Calculer le temps d'irradiation nécessaire en utilisant l'équation ci-dessous 13 235 m où représente la 235 U fraction de masse (niveau d'enrichissement) et t irr est le temps d'irradiation en quelques secondes:
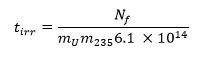
- Irradier l'échantillon pourT secondes irr à un flux de neutrons thermiques de 4,0 x 10 14 n / cm 2 / sec. Par exemple, une irradiation de 60 secondes dans pneumatique Tube 1 (PT-1) à HFIR (avec une thermique à résonance rapport de 35) produira environ 1,1 x 10 11 fissions dans un échantillon contenant 870 ug de UNH (l'équivalent de 410 pg de l'uranium naturel, ou 3,0 pg de 235 U). Ceci a été réalisé pour une 0,433 g de billes de verre conçu pour simuler un échantillon de verre à l'état fondu produit par une arme avec un rendement de 0,1 kilotonnes. Cet échantillon a été analysé en profondeur par Cook et al. 14
- Suivre les protocoles de sécurité relatives à la manipulation de la post-irradiation échantillon radioactif.
- Calculer la fraction massique de l'uranium métal requise pour l'échantillon en utilisant l'équation ci-dessous 13 (où m U représente la fraction massique de l'uranium et Y représente le rendement de l'arme):
- Activation d'un échantillon de fusion de verre avec du plutonium combustible (Facteurs de planification)
- Calculer la fraction de masse de plutonium métal nécessaire pour l'échantillon en utilisant l'équation ci-dessous 13 où M représen Puts de la fraction de masse de plutonium et Y représente le rendement de l'arme:
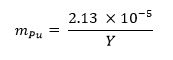
- Répétez les étapes 3.1.2 et 3.1.3 ci-dessus.
- Déterminer le temps d'irradiation nécessaire pour obtenir le nombre souhaité de fissions dans l'échantillon de verre à l'état fondu. Ce temps dépend de la composition et la qualité du plutonium ainsi que le spectre d'énergie des neutrons.
- Calculer la fraction de masse de plutonium métal nécessaire pour l'échantillon en utilisant l'équation ci-dessous 13 où M représen Puts de la fraction de masse de plutonium et Y représente le rendement de l'arme:
Remarque: Un grand soin doit être apporté au traitement du plutonium et des analyses supplémentaires seront nécessaires. Comme d'écrire ces lignes, seul l'uranium a été utilisé dans les échantillons de verre de fusion synthétiques produits à l'UT et irradiés à HFIR.
Résultats
Les échantillons non-radioactifs produits dans cette étude ont été comparés à trinitite et les figures 1-3 montrent que les propriétés physiques et la morphologie sont en effet similaires. La figure 1 fournit des photos qui révèlent les similitudes couleur et de texture qui sont observées au niveau macroscopique. La figure 2 montre microscope électronique à balayage (MEB) secondaires images Electron (SE) qui révèlent des caractéristiques...
Discussion
Remarque concernant les étapes 1.2.2 et 1.2.3: Le montant exact de UNH va varier en fonction du scénario simulé. Les formules de planification élaborés par Giminaro et al. Peuvent être utilisés pour choisir la masse appropriée de l'uranium pour un échantillon donné 13 tel que discuté dans la section «Activation de l'échantillon" de ce document. En outre, l'oxyde d'uranium (UO 2 ou U 3 O 8) peut être utilisé à la place de UNH, si di...
Déclarations de divulgation
This work was performed under grant number DE-NA0001983 from the Stewardship Science Academic Alliances (SSAA) Program of the National Nuclear Security Administration (NNSA).
Remerciements
Portions of this study have been previously published in the Journal of Radioanalytical and Nuclear Chemistry.3,13 A patent is pending for this method.
matériels
| Name | Company | Catalog Number | Comments |
| High Temperature Furnace (HTF) | Carbolite | HTF 18 | 1,800 °C HTF used to melt samples |
| High Temperature Drop Furnace | CM Inc. | 1706 BL | 1,700 °C Drop Furnace used to melt samples |
| Graphite Crucibles | SCP Science | 040-060-041 | 27 ml high purity graphite crucibles (10 pack) |
| Crucible Tongs | Grainger | 5ZPV0 | 26 in., stainless steele tongs for handling crucibles |
| Heat Resistent Gloves | Grainger | 8814-09 | Gloves used to protect hands from heat during sample intro/removal |
| Mortar & Pestle | Fisherbrand | S337631 | 300 ml, Ceramic mortar and pestle for powdering and mixing |
| Micro Balance | Grainger | 8NJG2 | 220 g Cap, high precision scale for measuring powder mass |
| Spatulas | Fisherbrand | 14374 | Metal spatulas for measure small quantities of powder |
| SiO2 | Sigma-Aldrich | 274739-5KG | Quartz Sand CAS Number: 14808-60-7 |
| Al2O3 | Sigma-Aldrich | 11028-1KG | Aluminum Oxide Powder CAS Number: 1344-28-1 |
| CaO | Sigma-Aldrich | 12047-2.5KG | Calcium Oxide Powder CAS Number: 1305-78-8 |
| FeO | Sigma-Aldrich | 400866-25G | Iron Oxide Powder CAS Number: 1345-25-1 |
| MgO | Sigma-Aldrich | 342793-250G | Magnesium Oxide Powder CAS Number: 1309-48-4 |
| Na2O | Sigma-Aldrich | 36712-25G | Sodium Oxide Powder CAS Number: 1313-59-3 |
| KOH | Sigma-Aldrich | 278904-250G | Potasium Hydroxide Pellets CAS Number: 12030-88-5 |
| MnO | Sigma-Aldrich | 377201-500G | Manganese Oxide Powder CAS Number: 1344-43-0 |
| TiO2 | Sigma-Aldrich | 791326-5G | Titanium Oxide Beads CAS Number: 12188-41-9 |
Références
- Carnesdale, A. . Nuclear Forensics: A Capability at Risk (Abbreviated Version). , (2010).
- Garrison, J. R., Hanson, D. E., Hall, H. L. Monte Carlo analysis of thermochromatography as a fast separation method for nuclear forensics. J Radioanal Nucl Chem. 291 (3), 885-894 (2011).
- Molgaard, J. J., et al. Development of synthetic nuclear melt glass for forensic analysis. J Radioanal Nucl Chem. 304 (3), 1293-1301 (2015).
- Fluegel, A. Modeling of Glass Liquidus Temperatures using Disconnected Peak Functions. , (2007).
- Oldham, C. J., Molgaard, J. J., Auxier, J. D., Hall, H. L. Comparison of Nuclear Debris Surrogates Using Powder X-Ray Diffraction. , (2014).
- Liezers, M., Fahey, A. J., Carman, A. J., Eiden, G. C. The formation of trinitite-like surrogate nuclear explosion debris ( SNED ) and extreme thermal fractionation of SRM-612 glass induced by high power CW CO 2 laser irradiation. J Radional Nucl Chem. 304 (2), 705-715 (2015).
- Harvey, S. D., et al. Porous chromatographic materials as substrates for preparing synthetic nuclear explosion debris particles. J Radioanal Nucl Chem. 298 (3), 1885-1898 (2013).
- Hanni, J. B., et al. Liquidus temperature measurements for modeling oxide glass systems relevant to nuclear waste vitrification. J Mater Res. 20 (12), 3346-3357 (2005).
- Weber, W. J., et al. Radiation Effects in Glasses Used for Immobilization of High-Level Waste and Plutonium Disposition. J Mater Res. 12 (8), 1946-1978 (1997).
- Eby, N., Hermes, R., Charnley, N., Smoliga, J. A. Trinitite-the atomic rock. Geol Today. 26 (5), 180-185 (2010).
- Bellucci, J. J., Simonetti, A. Nuclear forensics: searching for nuclear device debris in trinitite-hosted inclusions. J Radioanal Nucl Chem. 293 (1), 313-319 (2012).
- Ross, C. S. . Optical Properties of Glass from Alamogordo, New Mexico. , (1948).
- Giminaro, A. V., et al. Compositional planning for development of synthetic urban nuclear melt glass. J Radional Nucl Chem. , (2015).
- Cook, M. T., Auxier, J. D., Giminaro, A. V., Molgaard, J. J., Knowles, J. R., Hall, H. L. A comparison of gamma spectra from trinitite versus irradiated synthetic nuclear melt glass. J Radioanal Nucl Chem. , (2015).
- Fahey, J., Zeissler, C. J., Newbury, D. E., Davis, J., Lindstrom, R. M. Postdetonation nuclear debris for attribution. Proc Natl Acad Sci U S A. 107 (47), 20207-20212 (2010).
- Bellucci, J. J., Simonetti, A., Koeman, E. C., Wallace, C., Burns, P. C. A detailed geochemical investigation of post-nuclear detonation trinitite glass at high spatial resolution: Delineating anthropogenic vs. natural components. Chem Geol. 365, 69-86 (2014).
- Donohue, P. H., Simonetti, A., Koeman, E. C., Mana, S., Peter, C. Nuclear Forensic Applications Involving High Spatial Resolution Analysis of Trinitite Cross-Sections. J Radioanal Nucl Chem. , (2015).
- Eaton, G. F., Smith, D. K. Aged nuclear explosive melt glass: Radiography and scanning electron microscope analyses documenting radionuclide distribution and glass alteration. J Radioanal Nucl Chem. 248 (3), 543-547 (2001).
- Kersting, A. B., Smith, D. K. . Observations of Nuclear Explosive Melt Glass Textures and Surface Areas. , (2006).
- . . IAEA Safeguards Glossary. , (2001).
- Glasstone, S., Dolan, P. . Effects of Nuclear Weapons. , (1977).
- Carney, K. P., Finck, M. R., McGrath, C. A., Martin, L. R., Lewis, R. R. The development of radioactive glass surrogates for fallout debris. J Radioanal Nucl Chem. 299 (1), 363-372 (2013).
- Molgaard, J. J., Auxier, J. D., Hall, H. L. A Comparison of Activation Products in Different Types of Urban Nuclear Melt Glass. , (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon