È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione di sintetico Nucleare Melt Glass
In questo articolo
Riepilogo
A protocol for the production of synthetic nuclear melt glass, similar to trinitite, is presented.
Abstract
Realistic surrogate nuclear debris is needed within the nuclear forensics community to test and validate post-detonation analysis techniques. Here we outline a novel process for producing bulk surface debris using a high temperature furnace. The material developed in this study is physically and chemically similar to trinitite (the melt glass produced by the first nuclear test). This synthetic nuclear melt glass is assumed to be similar to the vitrified material produced near the epicenter (ground zero) of any surface nuclear detonation in a desert environment. The process outlined here can be applied to produce other types of nuclear melt glass including that likely to be formed in an urban environment. This can be accomplished by simply modifying the precursor matrix to which this production process is applied. The melt glass produced in this study has been analyzed and compared to trinitite, revealing a comparable crystalline morphology, physical structure, void fraction, and chemical composition.
Introduzione
Concerns over the potential malicious use of nuclear weapons by terrorists or rogue nations have highlighted the importance of nuclear forensics analysis for the purpose of attribution.1 Rapid post-detonation analysis techniques are desirable to shorten the attribution timeline as much as possible. The development and validation of such techniques requires realistic nuclear debris samples for testing. Nuclear testing no longer occurs in the United States and nuclear surface debris from the testing era is not readily available (with the exception of trinitite - the melt glass produced by the first nuclear test at the trinity site) and therefore realistic surrogate debris is needed.
The primary goal of the method described here is the production of realistic surrogate nuclear debris similar to trinitite. Synthetic nuclear melt glass samples which are readily available to the academic community can be used to test existing analysis techniques and to develop new methods such as thermo-chromatography for rapid post-detonation analysis.2 With this goal in mind the current study is focused on producing samples which mimic trinitite but do not contain any sensitive weapon design information. The fuel and tamper components within these samples are completely generic and the comparison to trinitite is based on chemistry, morphology, and physical characteristics. The similarities between trinitite and the synthetic nuclear melt glass produced in this study have been previously discussed.3
The purpose of this article is to outline the details of the production process used at the University of Tennessee (UT). This production process was developed with two key parameters in mind: 1) the composition of material incorporated into nuclear melt glass, and 2) the melting temperature of the material. Methods exist for estimating the melting temperature of glass forming networks4 and these techniques have been employed here, along with additional experimentation to determine the optimal processing temperature for the trinitite matrix.5
Alternative methods for surrogate debris production have been published recently. The use of high power lasers has the advantage of creating sufficiently high temperatures to cause elemental fractionation within the target matrix.6 Porous chromatographic substrates have been used to produce small particles similar to fallout particles using condensed phase methods7. The latter method is most useful for producing particulate debris (nuclear fallout) and has been demonstrated with natural metals. The advantages of the method presented here are 1) simplicity, 2) reproducibility, and 3) scalability (sample sizes can range from tiny beads to large chunks of melt glass). Also, this method is expandable both in terms of production output and variety of explosive scenarios covered, and it has already been demonstrated using radioactive materials. A sample has been successfully activated at the High Flux Isotope Reactor (HFIR) at Oak Ridge National Laboratory (ORNL). Natural uranium compounds were added to the matrix prior to melting and fission products were produced in situ by neutron irradiation.
Methods within the glass making industry and those employed for the purpose of radioactive waste immobilization8 have been consulted in the development of the method presented here. The unique effects of radiation in glasses are of inherent interest9 and will constitute an important area of study as this method is further developed.
The method described below is appropriate for any application where a bulk melt glass sample is desired. These samples most closely resemble the material found near the epicenter of a nuclear explosion. Samples of various sizes can be produced, however, methods employing plasma torches or lasers will be more useful for simulating fine particulate debris. Also, commercial HTFs do not reach temperatures high enough to cause elemental fractionation for a wide range of elements. This method should be employed when physical and morphological characteristics are of primary importance.
Protocollo
Attenzione: Il processo descritto qui include l'uso di materiale radioattivo (ad esempio, nitrato esaidrato Uranium) e diverse sostanze corrosive. Abbigliamento protettivo ed attrezzature devono essere utilizzati (tra cui un camice da laboratorio, guanti, occhiali di protezione, e una cappa) durante la preparazione del campione. Inoltre, le aree di laboratorio utilizzati per questo lavoro devono essere monitorati regolarmente per contaminazione radioattiva.
Nota:. I composti chimici necessari sono elencati nella tabella 1 Questa formulazione è stata sviluppata attraverso l'esame precedentemente riportato dati relativi alla composizione per Trinitite 10 Le frazioni di massa qui riportati sono stati determinati dai media delle frazioni di massa per diversi campioni Trinitite diversi 10 La massa "mancante".. (frazioni di non somma all'unità) esiste per consentire una maggiore flessibilità quando si aggiunge carburante, manomissione, e altri componenti. La nostra analisi indipendente diversi campioni Trinitite suggerisce che il quarzo è l'unica fase mineralesopravvivere in Trinitite. 5 Perciò, quarzo è l'unico minerale inclusa nel nostro Trinitite formulazione standard (STF). Sebbene i cereali reliquia di altri minerali sono stati segnalati in Trinitite, 11 questi tendono ad essere l'eccezione, non la regola. In generale, il quarzo è l'unico minerale trovato nel vetro fuso. 10,12 Inoltre, sabbia di quarzo è un componente comune di asfalto e calcestruzzo che sarà importante nella formazione del vetro fuso urbano nucleare.
-4| In media Trinitite dati | Standard Trinitite Formulazione (STF) | ||
| Composto | Frazione di massa | Composto | Frazione di massa |
| SiO 2 | 6.42x10 -1 | SiO 2 | 6.42x10 -1 |
| Al 2 O 3 | 1.43x10 -1 | Al 2 O 3 | 1.43x10 -1 |
| CaO | 9.64x10 -2 | CaO | 9.64x10 -2 |
| FeO | 1.97x10 -2 | 1.97x10 -2 | |
| MgO | 1.15x10 -2 | MgO | 1.15x10 -2 |
| Na 2 O | 1.25x10 -2 | Na 2 O | 1.25x10 -2 |
| K 2 O | 5.13x10 -2 | KOH | 6.12x10 -2 |
| MnO | 5.05x10 -4 | MnO | |
| TiO 2 | 4.27x10 -3 | TiO 2 | 4.27x10 -3 |
| Totale | 9.81x10 -1 | Totale | 9.91x10 -1 |
Tabella 1. Elenco dei composti chimici.
1. Preparazione del STF
Nota: Attrezzatura necessaria comprende una microbilancia, spatole metalliche, una ceramica mortaio e pestello, cappa, guanti in lattice, un camice da laboratorio e protezione per gli occhi.
- Miscelazione dei componenti non radioattivi
- Acquisire almeno 65 g di sabbia di quarzo (SiO 2), 15 g di Al 2 O 3 </ sub> polvere, 10 g di polvere CaO, 2 g di polvere FeO, 2 g di polvere di MgO, 2 g di Na 2 O in polvere, 7 g di pellet KOH, 1 g di polvere MnO e 1 g di TiO 2 polvere ( composti elencati nella Tabella 1).
- Utilizzare una microbilancia e spatolina di misurare con precisione le frazioni di massa di ciascun composto come elencato nella Tabella 1. Per ottenere i migliori risultati preparare 100 g della matrice precursore non radioattivo in una sola volta.
- Utilizzare un mortaio e pestello per polverizzare (a ~ 10-20 granuli di dimensioni micron) e miscelare accuratamente i composti, formando una miscela di polveri omogenea contenente 64,2 g di SiO 2, 14,2 g di Al 2 O 3, 9,64 g di CaO, 1,97 g di FeO, 1,15 g di MgO, 1,25 g di Na 2 O. 6.12 g di KOH, 0,0505 g di MnO, e 0,427 g di TiO 2.
- Agitare la miscela, utilizzando un mixer palla, poco prima del passaggio successivo è presa.
- Miscelazione di STF con uranio nitrato esaidrato (UNH)
- Acquire di almeno 1 g di UNH.
- All'interno di una cappa aspirante, polverizzare qualche cristallo UNH (utilizzando un mortaio e pestello) per formare una polvere fine di 1-2 micron granuli.
- Aggiungere 33.75 mg di UNH per grammo di matrice precursore non radioattivo (tale rapporto è appropriato per la simulazione di un arma semplice con una resa di 1 kiloton). 13
- Mescolare bene la miscela di polveri, tra cui l'UNH, utilizzando un mortaio e pestello. Completare mixaggio finale poco prima della fase di fusione.
2. La produzione di 1 grammo campione Melt Glass
Nota: Attrezzatura necessaria include un HTF valutato a più elevate, di elevata purezza crogioli in grafite, lunghi in acciaio inossidabile pinze crogiolo, guanti resistenti al calore e protezione per gli occhi 1.600 ° C o. Guanti resistenti al calore e protezione per gli occhi devono essere indossati quando si introducono o la rimozione dei campioni dal forno. Occhiali di sicurezza colorato (o occhiali da sole) sono utili in quanto riducono l'abbagliamento dal forno.
- Produzione di un campione non radioattivo
- Riempire un piatto di ceramica spessa (come un mortaio) con ~ 100 g di sabbia di quarzo puro e mantenere a RT vicino alla posizione del forno in cui verranno fusi i campioni.
- Preriscaldare il HTF a 1500 ° C.
- Misurare accuratamente 1,00 g della miscela di polveri non radioattivo e posizionare la polvere in un crogiolo di grafite di elevata purezza.
- Posizionare con cura il crogiolo nel HTF riscaldato (con un lungo paio di pinze in acciaio crogiolo) e sciogliere il composto per 30 minuti.
- Rimuovere il campione (di nuovo con le pinze) e versare il campione fuso nel mortaio riempito di sabbia.
- Lasciare che la biglia di vetro che raffreddare per 1-2 minuti prima dell'uso.
- Lucidare il tallone per rimuovere la sabbia residua (se necessario).
- Produzione di un campione radioattivo
- Ripetere i passaggi punti 2.1.1 e 2.1.2 di cui sopra.
- Misurare attentamente 1,00 grammo di miscela di polveri radioattive (comprese UNH) e posizionare il powd er in una elevata purezza crogiolo di grafite con una spatola e microbilancia separato per evitare la contaminazione incrociata.
- Ripetere i punti 2.1.4 - 2.1.6 sopra.
- Monitorare l'area intorno al forno (con un rilevatore portatile di radiazioni e / o saggi magnetiche) per verificare la presenza di contaminazione radioattiva.
Attivazione 3. Il campione
Nota: Le equazioni che seguono sono stati ottenuti ipotizzando l'uso di armi di grado (arricchito) uranio metallico. I quantitativi di UNH o ossido di uranio dovranno essere scalati secondo la frazione di massa di uranio elementare e il livello di 235 U arricchimento.
- L'attivazione di un campione Melt vetro con uranio Fue
- Calcolare la frazione di massa di uranio metallico richiesto per il campione utilizzando l'equazione sotto 13 (dove m U rappresenta la frazione di massa di uranio e Y rappresenta la resa arma):
473 / 53473eq1.jpg "/> - Opzionale: Calcolare la frazione di massa di manomissione (ad esempio, l'uranio naturale, piombo, tungsteno) utilizzando la seguente equazione: 13
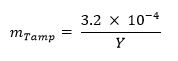
- Calcolare il numero di destinazione di fissioni nel campione mediante la seguente equazione 13 dove M s rappresenta la massa del campione in grammi e N f rappresenta il numero di fissioni prodotte nel campione durante l'irraggiamento:
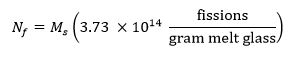
- Calcolare il tempo di irraggiamento richiesto utilizzando l'equazione che segue 13 dove m 235 rappresenta la frazione di massa 235 U (livello di arricchimento) e t irr è il tempo di irradiazione in secondi:
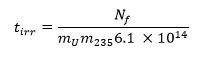
- Irradiare il campione perT secondi IRR un flusso di neutroni termici di 4,0 x 10 14 n / cm 2 / sec. Ad esempio, un irraggiamento 60 sec in pneumatico tubo 1 (PT-1) a HFIR (con una termica alla risonanza rapporto 35) produrrà circa 1,1 x 10 11 fissioni in un campione contenente 870 mg di UNH (equivalenti a 410 mg di uranio naturale, o 3.0 mg di 235 U). Questo è stato realizzato per una 0,433 g perle di vetro progettato per simulare un campione di vetro fuso prodotta da un'arma con una resa di 0,1 kiloton. Questo campione è stato analizzato a fondo da Cook et al. 14
- Seguire i protocolli di sicurezza applicabili per la gestione del campione radioattivo post-irradiazione.
- Calcolare la frazione di massa di uranio metallico richiesto per il campione utilizzando l'equazione sotto 13 (dove m U rappresenta la frazione di massa di uranio e Y rappresenta la resa arma):
- L'attivazione di un campione Melt vetro con plutonio carburante (Fattori di pianificazione)
- Calcolare la frazione di massa di plutonio metallo necessaria per il campione utilizzando l'equazione sotto 13 dove m rappre Puts la frazione di massa di plutonio e Y rappresenta la resa arma:
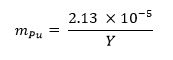
- Ripetere i punti 3.1.2 e 3.1.3 di cui sopra.
- Determinare il tempo di irradiazione necessaria per ottenere il numero desiderato di fissioni nel campione di vetro fuso. Questo tempo dipende dalla composizione e il grado del plutonio così come lo spettro di energia dei neutroni.
- Calcolare la frazione di massa di plutonio metallo necessaria per il campione utilizzando l'equazione sotto 13 dove m rappre Puts la frazione di massa di plutonio e Y rappresenta la resa arma:
Nota: Grande cura dovrebbe essere presa quando si tratta di plutonio e di ulteriori analisi sarà richiesto. Mentre scrivo, solo l'uranio è stato utilizzato nei campioni di vetro di fusione sintetici prodotti a UT e irradiate a HFIR.
Risultati
I campioni non radioattivi prodotti in questo studio sono stati confrontati Trinitite e figure 1-3 mostrano che le proprietà fisiche e la morfologia sono effettivamente simili. La Figura 1 fornisce le fotografie che rivelano le somiglianze di colore e struttura che si osservano a livello macroscopico. La figura 2 mostra microscopio elettronico a scansione (SEM) secondari Electron (SE) le immagini che rivelano caratteristiche simili a livello di micron....
Discussione
Nota relativa passi 1.2.2 e 1.2.3: L'importo esatto di UNH varia a seconda dello scenario in simulazione. Le formule di pianificazione sviluppati da Giminaro et al. Possono essere utilizzati per selezionare la massa appropriata di uranio per un dato campione 13 come discusso nella sezione "Attivazione Esempio" di questo documento. Inoltre, ossido di uranio (UO 2 o U 3 O 8) può essere usato al posto di UNH, se disponibile, e la frazione di massa di ...
Divulgazioni
This work was performed under grant number DE-NA0001983 from the Stewardship Science Academic Alliances (SSAA) Program of the National Nuclear Security Administration (NNSA).
Riconoscimenti
Portions of this study have been previously published in the Journal of Radioanalytical and Nuclear Chemistry.3,13 A patent is pending for this method.
Materiali
| Name | Company | Catalog Number | Comments |
| High Temperature Furnace (HTF) | Carbolite | HTF 18 | 1,800 °C HTF used to melt samples |
| High Temperature Drop Furnace | CM Inc. | 1706 BL | 1,700 °C Drop Furnace used to melt samples |
| Graphite Crucibles | SCP Science | 040-060-041 | 27 ml high purity graphite crucibles (10 pack) |
| Crucible Tongs | Grainger | 5ZPV0 | 26 in., stainless steele tongs for handling crucibles |
| Heat Resistent Gloves | Grainger | 8814-09 | Gloves used to protect hands from heat during sample intro/removal |
| Mortar & Pestle | Fisherbrand | S337631 | 300 ml, Ceramic mortar and pestle for powdering and mixing |
| Micro Balance | Grainger | 8NJG2 | 220 g Cap, high precision scale for measuring powder mass |
| Spatulas | Fisherbrand | 14374 | Metal spatulas for measure small quantities of powder |
| SiO2 | Sigma-Aldrich | 274739-5KG | Quartz Sand CAS Number: 14808-60-7 |
| Al2O3 | Sigma-Aldrich | 11028-1KG | Aluminum Oxide Powder CAS Number: 1344-28-1 |
| CaO | Sigma-Aldrich | 12047-2.5KG | Calcium Oxide Powder CAS Number: 1305-78-8 |
| FeO | Sigma-Aldrich | 400866-25G | Iron Oxide Powder CAS Number: 1345-25-1 |
| MgO | Sigma-Aldrich | 342793-250G | Magnesium Oxide Powder CAS Number: 1309-48-4 |
| Na2O | Sigma-Aldrich | 36712-25G | Sodium Oxide Powder CAS Number: 1313-59-3 |
| KOH | Sigma-Aldrich | 278904-250G | Potasium Hydroxide Pellets CAS Number: 12030-88-5 |
| MnO | Sigma-Aldrich | 377201-500G | Manganese Oxide Powder CAS Number: 1344-43-0 |
| TiO2 | Sigma-Aldrich | 791326-5G | Titanium Oxide Beads CAS Number: 12188-41-9 |
Riferimenti
- Carnesdale, A. . Nuclear Forensics: A Capability at Risk (Abbreviated Version). , (2010).
- Garrison, J. R., Hanson, D. E., Hall, H. L. Monte Carlo analysis of thermochromatography as a fast separation method for nuclear forensics. J Radioanal Nucl Chem. 291 (3), 885-894 (2011).
- Molgaard, J. J., et al. Development of synthetic nuclear melt glass for forensic analysis. J Radioanal Nucl Chem. 304 (3), 1293-1301 (2015).
- Fluegel, A. Modeling of Glass Liquidus Temperatures using Disconnected Peak Functions. , (2007).
- Oldham, C. J., Molgaard, J. J., Auxier, J. D., Hall, H. L. Comparison of Nuclear Debris Surrogates Using Powder X-Ray Diffraction. , (2014).
- Liezers, M., Fahey, A. J., Carman, A. J., Eiden, G. C. The formation of trinitite-like surrogate nuclear explosion debris ( SNED ) and extreme thermal fractionation of SRM-612 glass induced by high power CW CO 2 laser irradiation. J Radional Nucl Chem. 304 (2), 705-715 (2015).
- Harvey, S. D., et al. Porous chromatographic materials as substrates for preparing synthetic nuclear explosion debris particles. J Radioanal Nucl Chem. 298 (3), 1885-1898 (2013).
- Hanni, J. B., et al. Liquidus temperature measurements for modeling oxide glass systems relevant to nuclear waste vitrification. J Mater Res. 20 (12), 3346-3357 (2005).
- Weber, W. J., et al. Radiation Effects in Glasses Used for Immobilization of High-Level Waste and Plutonium Disposition. J Mater Res. 12 (8), 1946-1978 (1997).
- Eby, N., Hermes, R., Charnley, N., Smoliga, J. A. Trinitite-the atomic rock. Geol Today. 26 (5), 180-185 (2010).
- Bellucci, J. J., Simonetti, A. Nuclear forensics: searching for nuclear device debris in trinitite-hosted inclusions. J Radioanal Nucl Chem. 293 (1), 313-319 (2012).
- Ross, C. S. . Optical Properties of Glass from Alamogordo, New Mexico. , (1948).
- Giminaro, A. V., et al. Compositional planning for development of synthetic urban nuclear melt glass. J Radional Nucl Chem. , (2015).
- Cook, M. T., Auxier, J. D., Giminaro, A. V., Molgaard, J. J., Knowles, J. R., Hall, H. L. A comparison of gamma spectra from trinitite versus irradiated synthetic nuclear melt glass. J Radioanal Nucl Chem. , (2015).
- Fahey, J., Zeissler, C. J., Newbury, D. E., Davis, J., Lindstrom, R. M. Postdetonation nuclear debris for attribution. Proc Natl Acad Sci U S A. 107 (47), 20207-20212 (2010).
- Bellucci, J. J., Simonetti, A., Koeman, E. C., Wallace, C., Burns, P. C. A detailed geochemical investigation of post-nuclear detonation trinitite glass at high spatial resolution: Delineating anthropogenic vs. natural components. Chem Geol. 365, 69-86 (2014).
- Donohue, P. H., Simonetti, A., Koeman, E. C., Mana, S., Peter, C. Nuclear Forensic Applications Involving High Spatial Resolution Analysis of Trinitite Cross-Sections. J Radioanal Nucl Chem. , (2015).
- Eaton, G. F., Smith, D. K. Aged nuclear explosive melt glass: Radiography and scanning electron microscope analyses documenting radionuclide distribution and glass alteration. J Radioanal Nucl Chem. 248 (3), 543-547 (2001).
- Kersting, A. B., Smith, D. K. . Observations of Nuclear Explosive Melt Glass Textures and Surface Areas. , (2006).
- . . IAEA Safeguards Glossary. , (2001).
- Glasstone, S., Dolan, P. . Effects of Nuclear Weapons. , (1977).
- Carney, K. P., Finck, M. R., McGrath, C. A., Martin, L. R., Lewis, R. R. The development of radioactive glass surrogates for fallout debris. J Radioanal Nucl Chem. 299 (1), 363-372 (2013).
- Molgaard, J. J., Auxier, J. D., Hall, H. L. A Comparison of Activation Products in Different Types of Urban Nuclear Melt Glass. , (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon