Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Protocole de mesure des propriétés thermiques d'un synthétique Sable-eau-gaz-méthane Hydrate Sample surfondue
Dans cet article
Résumé
We present a protocol for measuring the thermal properties of synthetic hydrate-bearing sediment samples comprising sand, water, methane, and methane hydrate.
Résumé
Methane hydrates (MHs) are present in large amounts in the ocean floor and permafrost regions. Methane and hydrogen hydrates are being studied as future energy resources and energy storage media. To develop a method for gas production from natural MH-bearing sediments and hydrate-based technologies, it is imperative to understand the thermal properties of gas hydrates.
The thermal properties' measurements of samples comprising sand, water, methane, and MH are difficult because the melting heat of MH may affect the measurements. To solve this problem, we performed thermal properties' measurements at supercooled conditions during MH formation. The measurement protocol, calculation method of the saturation change, and tips for thermal constants' analysis of the sample using transient plane source techniques are described here.
The effect of the formation heat of MH on measurement is very small because the gas hydrate formation rate is very slow. This measurement method can be applied to the thermal properties of the gas hydrate-water-guest gas system, which contains hydrogen, CO2, and ozone hydrates, because the characteristic low formation rate of gas hydrate is not unique to MH. The key point of this method is the low rate of phase transition of the target material. Hence, this method may be applied to other materials having low phase-transition rates.
Introduction
Les hydrates de gaz sont des composés cristallins qui comprennent des structures en cage de molécules d'eau liées à l' hydrogène contenant des molécules hôtes dans la cage 1. De grandes quantités d'hydrates de méthane (MHS) dans les régions de plancher de l' océan et le pergélisol sont des ressources intéressantes énergétiques futurs , mais peuvent affecter les conditions climatiques mondiales 2.
En Mars 2013, la Japan Oil, Gas, and Metals National Corporation menées premier test de production offshore du monde pour extraire le gaz de sédiments naturels MH-portant dans l'est de Nankai Trough par la "méthode de dépressurisation" 3,4.
Les hydrates de gaz peuvent stocker des gaz tels que le méthane , 1, 5 un atome d' hydrogène, CO 2 de 1,6 et de l' ozone 7. Par conséquent, le méthane et d'hydrogène hydrates sont étudiés comme le stockage d'énergie potentielle et les médias de transport. Pour réduire les émissions de CO 2 dans l'atmosphère, CO 2 sequestration utilisant le CO 2 hydrates dans les sédiments océaniques profonds ont été étudiés 6. L'ozone est actuellement utilisé dans la purification de l'eau et de la stérilisation des aliments. Les études sur la technologie de conservation de l' ozone ont été menées parce qu'il est chimiquement instable 7. La concentration en ozone dans l' hydrate est beaucoup plus élevée que celle de l'eau ozonisée ou de la glace 7.
Pour développer la production de gaz à partir des sédiments MH-portant naturelles et des technologies à base d'hydrates, il est impératif de comprendre les propriétés thermiques des hydrates de gaz. Cependant, les données sur les propriétés thermiques et études de modèles de sédiments d'hydrate portant gaz sont rares 8.
La «méthode de dépressurisation» peut être utilisé pour dissocier MH dans l'espace poreux des sédiments en diminuant la pression de pore inférieure à la stabilité de l'hydrate. Dans ce procédé, les composants spatiaux interstitielles des sédiments changent de l'eau et de l'eau MH, MH, et le gaz. La mesure de Les propriétés thermiquesde cette dernière condition est difficile parce que la chaleur de fusion de MH peut affecter les mesures. Pour résoudre ce problème, Muraoka et al. Réalisée la mesure des propriétés thermiques dans des conditions surfusion pendant la formation MH 9.
Avec ce protocole vidéo, nous expliquons la méthode de mesure de surfusion synthétique échantillon de sable eau-gaz-MH.
La figure 1 illustre le dispositif expérimental permettant de mesurer les propriétés thermiques du méthane artificiel hydrates de sédiments. La configuration est la même que celle indiquée dans la référence 9. Le système comprend essentiellement un récipient à haute pression, de pression et de régulation de la température et des propriétés thermiques du système de mesure. Le récipient à haute pression est en acier inoxydable cylindrique avec un diamètre interne de 140 mm et une hauteur de 140 mm; son volume intérieur avec le volume mort est éliminé 2110 cm 3 et sa limite de pression est de 15 MPa. Le transie source plane nt (TPS) technique est utilisée pour mesurer les propriétés thermiques 10. Neuf sondes TPS avec des rayons individuels de 2.001 mm sont placés à l'intérieur du navire. La disposition des neuf sondes 9 est représenté sur la figure 2 en référence 9. Les sondes TPS sont connectées à l'analyseur des propriétés thermiques d'un câble et commutées manuellement pendant l'expérience. Les détails du capteur TPS, schéma de connexion et la configuration dans le récipient sont représentés sur les figures S1, 2 et 3 de l'information à l' appui en référence 9.
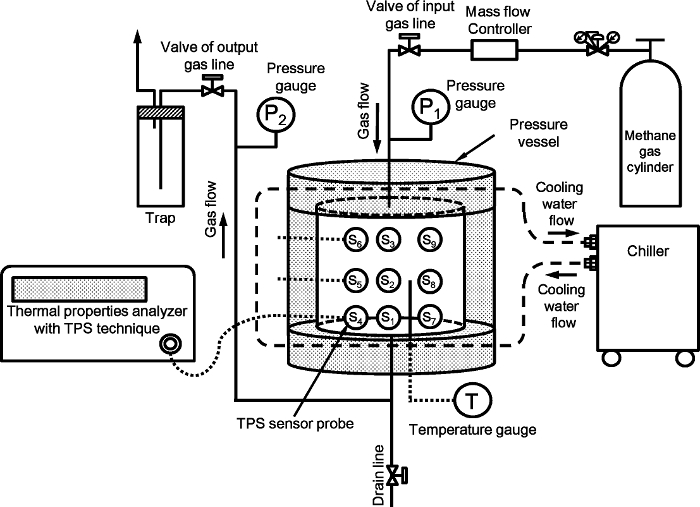
Figure 1:. Le dispositif expérimental pour mesurer les propriétés thermiques de l'artificiel sédiments hydrate de méthane porteur Le chiffre est modifié de la référence 9.3956fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
La méthode TPS a été utilisé pour mesurer les propriétés thermiques de chaque échantillon. Les principes de la méthode sont décrits dans la référence 10. Dans cette méthode, l'augmentation de la température en fonction du temps, AT ave, est
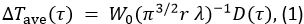
où
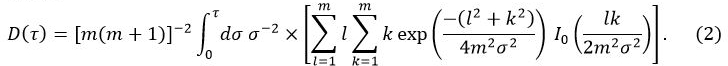
Dans l' équation 1, W 0 est la puissance de sortie du capteur, r est le rayon de la sonde de détection, λ est la conductivité thermique de l'échantillon, α est la diffusivité thermique, et t est le temps depuis le début de l'alimentation à la sonde de capteur. D (τ) est une fonction dépendant du temps sans dimension. τ est donnée par (aT / r) 1/2. Dans l' équation 2, m est le nombre d'anneaux concentriques de la sonde TPS et I 0 est une fonction de Bessel modifiée. La conductivité thermique, la diffusivité thermique et la chaleur spécifique de l'échantillon sont simultanément déterminées par une analyse d'inversion appliquée à l'augmentation de la température que l'énergie est fournie à la sonde de détection.
Protocole
Remarque: S'il vous plaît consulter toutes les fiches de données de sécurité des matériaux pertinents comme cette étude utilise haute pression inflammable gaz de méthane et un grand navire à haute pression. Portez un casque, des lunettes de sécurité, et des bottes de sécurité. Si le système de régulation de température cesse, la pression dans la cuve augmente avec MH dissociation. Pour éviter tout accident, l'utilisation d'un système de soupape de sécurité est fortement recommandée pour libérer automatiquement le gaz de méthane dans l'atmosphère. Le système de soupape de sécurité peut fonctionner sans alimentation électrique.
1. Préparation des échantillons de gaz de sable à l' eau-méthane 9
- Placer le récipient à haute pression sur la table vibrante.
- Verser 1,5 L d'eau pure dans une bouteille d'eau et 4000 g de sable de silice dans une bouteille de sable. Peser les masses de sable et de l'eau dans les bouteilles de sable et d'eau, respectivement.
- Versez 1 litre d'eau pure dans le récipient à haute pression avec un volume intérieur de 2110 cm 3 d'une bouteille d'eaujusqu'à ce que l'eau remplit la moitié de la cuve interne.
- Tourner sur la table vibrante pour faire vibrer l'ensemble du récipient. Réglez le taux de vibration et de l'alimentation à 50 Hz et 220 W, respectivement. Appliquer la vibration jusqu'à la fin de l'étape 1.5. Retirer l'air résiduel dans la conduite d'évacuation et un filtre métallique fritté, au fond du récipient en faisant vibrer la cuve.
- Verser 3,300 g de sable de silice d'une bouteille dans le récipient de sable à une vitesse constante d'environ 1 g s - 1 en utilisant un entonnoir tenu près de la surface de l' eau alors que l'ensemble du récipient est vibré pour assurer l' emballage uniforme.
- Arrêter la vibration lorsque l'eau atteint le bord du récipient.
- Placer un anneau comme un mur temporaire sur le bord du récipient pour empêcher l'eau de se répandre.
- Vibrer à nouveau le récipient à 50 Hz et 220 W.
- Lorsque le sable atteint le bord de la cuve (hauteur 140 mm), éteindre la vibration.
- Retirez le mur temporaire et de l'eau des pores en excès par eligne de fuite des e. Versez le dos excès d'eau des pores dans la bouteille d'eau.
- Emballez le sable en faisant vibrer le récipient une ou deux fois à 50 Hz et 300 W pendant 1 sec et ajouter plus de sable si nécessaire.
- Peser les masses de sable et de l'eau dans les bouteilles de sable et d'eau. Calculer les masses de sable et d'eau dans le récipient à partir des différences de masse dans les bouteilles de sable et d'eau. Dans cette expérience, les masses de sable et de l'eau dans la cuve étaient 3,385 g et 823,6 g, respectivement. La masse d'eau dans le récipient est notée en poids au total.
- Couvrir le récipient à haute pression avec un couvercle en acier inoxydable et serrer les boulons de paires diagonalement opposées dans l'ordre.
- Déplacer le récipient à haute pression de la table vibrante à la table destinée à l'expérience.
- Recouvrir la cuve haute pression avec l'isolant thermique pour contrôler la température.
- Connecter les gazoducs à haute pression et le refroidissement des conduites d'écoulement de l'eau dans la cuve à haute pression.
- Ouvrir les vannes des conduites d'entrée et du gaz de sortie. Ventiler 10 L de méthane à un débit de 800 ml min -1 jusqu'à aucun rejet d'eau en excès dans le piège sous pression atmosphérique. La décharge de sable est empêchée par un filtre métallique fritté fixée sur le fond du récipient. L'eau résiduelle reste sur la surface du sable, car le sable de silice hydrophile adsorbe les molécules d'eau.
- Peser la masse d'eau dans le piège, w piège, pour déterminer le volume de gaz dans la cuve. Déterminer la masse d'eau résiduelle, res w, dans le récipient en utilisant l'équation w res = w totale - w piège. Dans ce cas, res w et piège w était 360,6 g et 463,0 g, respectivement.
- Déterminer la porosité de l'échantillon en utilisant la formule Ѱ = 1 - V cellulaire sable / V, où le sable V est le volume de til sable déterminé par le rapport de la masse de sable à la densité du sable (c. -à ρ s = 2.630 kg m -3) et les cellules V est le volume interne du récipient. Ѱ la porosité de l'échantillon était de 0,39.
- Fermer la vanne de la conduite de gaz de sortie. Injecter du méthane pour augmenter la pression des pores de méthane dans le récipient à environ 12,1 MPa à la température ambiante (c. -à- 31,6 ° C).
- Fermer la vanne de la conduite de gaz d'entrée.
- Commencer à enregistrer la pression et la température dans le récipient au cours de l'expérience en utilisant l'enregistreur de données. L'intervalle d'échantillonnage de données est 5 s. Le temps expérimentale totale est d'environ 3000 min.
2. MH Synthèse et la mesure de l'échantillon surfondue 9 de Propriétés thermiques
- Mettre en marche le refroidisseur pour refroidir le récipient de la température ambiante à 2.0 ° C en faisant circuler le liquide de refroidissement. Laissez circuler le liquide de refroidissement du refroidisseur to le fond du récipient, à partir de là vers le couvercle de la cuve, et enfin vers le refroidisseur. Le taux de variation de la température dans la cuve était d' environ 0.001 ° C sec -1.
- Définissez les paramètres de mesure à l'aide du logiciel de l'analyseur TPS. Réglez le type de capteur à la conception # 7577. Régler la puissance de sortie W 0 à 30 mW et le temps de mesure de 5 secondes. Notez que les paramètres appropriés doivent être modifiés si le type de capteur ou conditions échantillons changent. Réglez les paramètres pour augmenter la température de 1 ° C à 1,5 ° C.
- Calculer le degré de surfusion, AT sup, avec l'équation suivante:
AT sup = T eq (P) - T. (3)
Teq (P) est la température d'équilibre de MH en fonction de la pression P. Teq (P) est calculée à l' aide du logiciel CSMGem 1.0, P et T sont la pression et la température dans le récipient de mesure à l'aide de jauges de pression et de température, respectivement. - Mesurer simultanément la conductivité thermique, diffusivité thermique, et la chaleur spécifique volumétrique en utilisant l'analyseur TPS après AT sup est supérieur à 2 ° C.
- Mettez la sonde TPS reliée aux propriétés analyseur thermique après chaque mesure. Mettez les câbles entre les sondes TPS et l'analyseur manuellement pendant l'expérience 9. Le schéma de raccordement est illustré à la figure S2 en référence 9. La séquence de commutation de chaque capteur est négative. 6 → 2 → 7 → 5 → 1 → 9 → 4 → 3 → 8 → 6 .... La séquence est basée sur la distance entre les capteurs, qui est fixé dans la mesure du possible d'éviter que la chaleur résiduelle d'affecter les mesures. Recueillir des données toutes les 3-5 min.
- Répéter les mesures jusqu'à ce que & #916; T sup atteint 2 ° C à nouveau. Dans cette expérience, Δ T sup augmente initialement avec le temps. Après sup AT atteint la valeur maximale, diminue progressivement sup AT à 0 ° C , car la pression diminue avec la formation de MH. Vérifiez si AT sup est supérieur à 2 ° C avant les mesures TPS utilisant l' équation 3.
- Assurez-vous que le profil de température est pas affectée par MH fusion. Si MH fond lors de la mesure, la température ne sera pas augmenter à cause de la fusion MH est une réaction endothermique. Vérifiez le profil de température pendant les mesures, et est discuté dans la section des résultats.
- Effectuer l'analyse des propriétés thermiques pour toutes les données de profil de température en utilisant la technique TPS.
3. Calcul de la Saturation Changement de l'échantillon 9,11
Remarque:Le degré de saturation pour MH, d' eau et de gaz dans l'échantillon en fonction du temps t est calculée en utilisant l'équation d'état du gaz. Les détails de calcul et les équations utilisées sont décrites précédemment 11.
- Calculer le V gaz de volume de gaz méthane, t au temps t
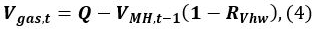
où Q est le volume initial de gaz dans la cuve, V MH, t - 1 est le volume de MH à l' instant t - 1 et R VHW est le rapport volumique de l' eau et MH.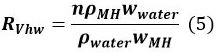
Dans l' équation 5, n est le nombre de MH d'hydratation (~ 6), et ρ ρ MH eau correspond à la densité de MH et de l' eau, respectivement, et w MH et de l' eau w représentent la masse moléculaire MH et de l' eau, respectively. - Calculer la quantité ΔM t (mole) de MH formé à partir de t - 1 à t
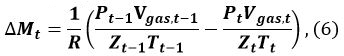
où R est la constante des gaz, P est la pression du gaz de méthane, et Zt (gaz T, T, P gaz, t) est le coefficient de méthane de compression à l' instant t. Nous 9 et Sakamoto et al. 11 avons utilisé l'équation Benedict-Webb-Rubin (BWR), tel que modifié par Lee et Kesler, pour calculer Z t 12, 13. Pour ce calcul, les formules (3-7.1) - (3-7.4) de l'équation BWR 13 et les constantes de Lee-Kesler sont utilisées dans les tableaux 3 - 7 de référence 13. - Calculer le changement de volume Δ V MH, t de MH de t - 1 à t
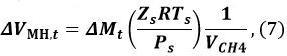
où P s est la pression de 101325 Pa de référence, T s est la température de référence de 273,15 K, Z s est le coefficient de compression au niveau de P s et de T (Z s ~ 1), et V CH4 est le rapport du volume de gaz méthane dans le unité de volume MH [Nm 3 m -3]. Utilisez une valeur V CH4 de 165,99 [Nm 3 m -3]. - Calculer le volume V MH, t de MH à l' instant t
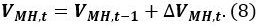
- Calculer le volume d'eau de l' eau de V, T dans le récipient sous pression à l' instant t
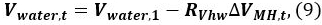
où l' eau de V 1 est le volume initial d'eau. - Répéter les calculs en utilisant les équations. 9.4 à l' instant t = 2, 3, ... afin de déterminer la variation de la saturation de l' eau, de méthane et 11 MH. La condition initiale est t = 1, c. -à- gaz V, 1 = Q. Le P et T à l' instant t sont prises à partir des journaux de données 9. Les résultats du calcul sont présentés dans la section suivante.
Résultats
La figure 2a représente le profil de température qui ne soit pas affectée par MH fusion. C AT est la variation de température due à la mesure des constantes thermiques. La figure 2b montre le profil de température qui est affectée par MH fusion. Le profil de la figure 2b ne peut être analysé par les équations 1 et 2 parce que ces équations sont dérivées en supposant que les conditions d'échantillonna...
Discussion
L'effet de la chaleur de formation de MH sur mesure a été estimé. La chaleur de formation de MH a été estimé à partir des produits de la vitesse de changement S h comme indiqué sur la figure 3b et l'enthalpie de formation H = 52,9 kJ mol -1 MH 14. Par conséquent, la variation de la température maximale était de 0,00081 ° C sec -1. Cela a été beaucoup plus faible que l'augmentation de température AT c
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Cette étude a été soutenue financièrement par le Consortium pour la recherche MH21 pour méthane Ressources Hydrater au Japon et le Programme national hydrate de méthane Exploitation par le Ministère de l'Economie, du Commerce et de l'Industrie. Les auteurs tiennent à remercier T. Maekawa et S. Goto pour leur aide avec les expériences.
chiffres Reproduit avec la permission de (Muraoka, M., Susuki, N., Yamaguchi, H., Tsuji, T., Yamamoto, Y., Energy Fuels, 29 (3), 2015, 1345-1351, 2015, DOI.: 10.1021 / ef502350n). Droit d'auteur (2015) American Chemical Society.
matériels
| Name | Company | Catalog Number | Comments |
| TPS thermal probe, Hot disk sensor | Hot Disk AB Co., Sweden | #7577 | Kapton sensor type, sensor radius 2.001 mm |
| Hot disk thermal properties analyzer | Hot Disk AB Co., Sweden | TPS 2500 | |
| Toyoura standard silica sand | Toyoura Keiseki Kogyo Co., Ltd., Japan | N/A | |
| Methane gas, 99.9999% | Tokyo Gas Chemicals Co., Ltd., Japan | N/A | Grade 6 N, Volume 47 L, Charging pressure 14.7 MPa |
| Water Purification System, Elix Advantage 3 | Merck Millipore., U.S. | N/A | 5 MΩ cm (at 25 °C) resistivity |
| Vibrating table, Vivratory packer | Sinfonia Technology Co. Ltd., Japan | VGP-60 | |
| Chiller, Thermostatic Bath Circulator | THOMAS KAGAKU Co., Ltd., Japan | TRL-40SP | |
| Coorant, Aurora brine | Tokyo Fine Chemical Co.,Ltd., Japan | N/A | ethylene glycol 71 wt% |
| Temparature gage | Nitto Kouatsu., Japan | N/A | Pt 100, sheath-type platinum resistance temperature detector |
| Pressure gage | Kyowa Electronic Instruments., Japan | PG-200 KU | |
| Data logger | KEYENCE., Japan | NR-500 | |
| Mass flow controller | OVAL Co., Japan | F-221S-A-11-11A | Maximum flow 2,000 N ml/M, maximum design pressure 19.6 MPa |
Références
- Sloan, E. D., Koh, C. A. . Clathrate Hydrates of Natural Gases, 3rd ed. , (2007).
- Hatzikiriakos, S. G., Englezos, P. The relationship between global warming and methane gas hydrates in the earth. Chem. Eng. Sci. 48 (23), 3963-3969 (1993).
- Yamamoto, K. Overview and introduction: pressure core-sampling and analyses in the 2012-2013 MH21 offshore test of gas production from methane hydrates in the eastern Nankai Trough. Mar. Petrol. Geol. 66 (Pt 2), 296 (2015).
- Fujii, T., et al. Geological setting and characterization of a methane hydrate reservoir distributed at the first offshore production test site on the Daini-Atsumi Knoll in the eastern Nankai Trough, Japan. Mar. Petrol. Geol. 66 (Pt 2), 310 (2015).
- Mao, W. L., et al. Hydrogen clusters in clathrate hydrate. Science. 297 (5590), 2247-2249 (2002).
- Lee, S., Liang, L., Riestenberg, D., West, O. R., Tsouris, C., Adams, E. CO2 hydrate composite for ocean carbon sequestration. Environ. Sci. Technol. 37 (16), 3701-3708 (2003).
- Muromachi, S., Ohmura, R., Takeya, S., Mori, H. Y. Clathrate Hydrates for Ozone Preservation. J. Phys. Chem. B. 114, 11430-11435 (2010).
- Waite, W. F., et al. Physical properties of hydrate-bearing sediments. Rev. Geophys. 47 (4), (2009).
- Muraoka, M., Susuki, N., Yamaguchi, H., Tsuji, T., Yamamoto, Y. Thermal properties of a supercooled synthetic sand-water-gas-methane hydrate sample. Energy Fuels. 29 (3), 1345-1351 (2015).
- Gustafsson, S. E. Transient plane source techniques for thermal conductivity and thermal diffusivity measurements of solid materials. Rev. Sci. Instrum. 62 (3), 797-804 (1991).
- Sakamoto, Y., Haneda, H., Kawamura, T., Aoki, K., Komai, T., Yamaguchi, T. Experimental Study on a New Enhanced Gas Recovery Method by Nitrogen Injection from a Methane Hydrate Reservoir. J. MMIJ. 123 (8), 386-393 (2007).
- Lee, B. I., Kesler, M. G. A generalized thermodynamic correlation based on three-parameter corresponding states. AIChE J. 21 (3), 510-527 (1975).
- Reid, R. C., Prausnitz, J. M., Poling, B. E. Chapter 3, Unit 3, 7. The properties of gases and liquids. , 47-49 (1987).
- Anderson, G. K. Enthalpy of dissociation and hydration number of methane hydrate from the Clapeyron equation. J. Chem. Thermodyn. 36 (12), 1119-1127 (2004).
- Waite, W. F., deMartin, B. J., Kirby, S. H., Pinkston, J., Ruppel, C. D. Thermal conductivity measurements in porous mixtures of methane hydrate and quartz sand. Geophys. Res. Lett. 29 (24), 82-1-82-4 (2002).
- Kumar, P., Turner, D., Sloan, E. D. Thermal diffusivity measurements of porous methane hydrate and hydrate-sediment mixtures. J. Geophys. Res. 109 (B1), (2004).
- Huang, D., Fan, S. Measuring and modeling thermal conductivity of gas hydrate-bearing sand. J. Geophys. Res. 110 (B1), (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon