Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Phosphore-31 Spectroscopie par résonance magnétique: un outil de mesure
Dans cet article
Résumé
This work demonstrates the feasibility of an in vivo phosphorus-31 magnetic resonance spectroscopy (31PMRS) technique to quantify mitochondrial oxidative phosphorylation (OXPHOS) capacity in human skeletal muscle.
Résumé
Skeletal muscle mitochondrial oxidative phosphorylation (OXPHOS) capacity, which is critically important in health and disease, can be measured in vivo and noninvasively in humans via phosphorus-31 magnetic resonance spectroscopy (31PMRS). However, the approach has not been widely adopted in translational and clinical research, with variations in methodology and limited guidance from the literature. Increased optimization, standardization, and dissemination of methods for in vivo 31PMRS would facilitate the development of targeted therapies to improve OXPHOS capacity and could ultimately favorably impact cardiovascular health. 31PMRS produces a noninvasive, in vivo measure of OXPHOS capacity in human skeletal muscle, as opposed to alternative measures obtained from explanted and potentially altered mitochondria via muscle biopsy. It relies upon only modest additional instrumentation beyond what is already in place on magnetic resonance scanners available for clinical and translational research at most institutions. In this work, we outline a method to measure in vivo skeletal muscle OXPHOS. The technique is demonstrated using a 1.5 Tesla whole-body MR scanner equipped with the suitable hardware and software for 31PMRS, and we explain a simple and robust protocol for in-magnet resistive exercise to rapidly fatigue the quadriceps muscle. Reproducibility and feasibility are demonstrated in volunteers as well as subjects over a wide range of functional capacities.
Introduction
Le but de ce travail est de décrire une méthode reproductible pour mesurer de manière non invasive in vivo muscle squelettique fonction mitochondriale chez les individus possédant un large éventail de capacités. déficience mitochondriale Aberrant est une caractéristique d'un large éventail de syndromes métaboliques et des maladies génétiques, des conditions communes telles que le vieillissement et le diabète de maladies rares telles que l'ataxie de Friedreich.
Syndrome métabolique et Dysfonctionnement mitochondrial
Le syndrome métabolique a été montré pour perturber la fonction mitochondriale, enfoncez squelettique OXPHOS musculaire, et conduire au stockage des lipides ectopique dans le muscle squelettique 1, 2. Organites Comme critiques de régulation métabolique et l' homéostasie énergétique, les mitochondries sont impliquées dans la physiopathologie de l' obésité 3, 4, 5 résistance à l'insuline , Diabète de type 2 (DT2) 6, 7, liée au diabète de micro 8, 9, 10, 11 et complications macrovasculaires 12, 13, et non alcoolisées maladie du foie gras (NAFLD) 14, 15, 16, entre autres .Insulin résistance se caractérise par des changements profonds dans le muscle squelettique activité mitochondriale, y compris une diminution mitochondrial acide tricarboxylique (TCA) taux de flux, le taux de synthèse d' ATP, et la citrate synthase et NADH: O 2 oxydoréductase 5. Une hypothèse est que ces modifications pourraient être dues à l'accumulation d'acides gras libres (AGL) métabolites dans le muscle, qui sont nettement augmenté au cours de l'obésité et d'autres l'obésité rmaladies exaltés 2, 17. L'exposition du muscle à FFAs élevées et intermédiaires de lipides peut diminuer l'expression des gènes dans la voie oxydative des lipides, ainsi que le cycle TCA et de la chaîne de transport d' électrons (CTE) 18. Cette réduction de la capacité de squelettique OXPHOS musculaire mitochondriale dans le cadre d'une surcharge lipidique est accompagnée d'une baisse du quantitatif (contenu et biogenèse des mitochondries) 19 et la fonction qualitative des mitochondries du muscle squelettique 20. Exposer le muscle squelettique et les myocytes à FFAs conduit à une résistance sévère à l'insuline et l'absorption accrue en acides gras libres dans le muscle est associée à une résistance à l'insuline chez les humains et les rongeurs 21. Les intermédiaires lipidiques céramide et diacylglycérol (DAG) se sont révélés inhiber directement la voie de signalisation de l'insuline en modifiant l'activité des kinases, telles que la protéine kinase C et protein kinase B 21. Par conséquent, les molécules lipidiques dérivés semblent jouer un rôle de premier plan dans le développement de la résistance à l'insuline des muscles squelettiques et DT2. Cependant, on ne sait pas si des changements dans la capacité des mitochondries sont une cause ou une conséquence de la résistance à l'insuline 22.
Ataxie et mitochondrial Dysfonction Friedrich
OXPHOS Diminué peuvent également résulter de défauts génétiques. Ataxie de Friedrich (FA), la forme la plus courante de l' ataxie héréditaire, est une maladie génétique causée par une mutation dans la frataxine (FXN) du gène, ce qui entraîne l' accumulation de fer intra-mitochondrial, production d'espèces réactives de l' oxygène, et des anomalies de la phosphorylation oxydative 23, 24, 25, 26. Cette découverte importante a conduit au développement de thérapies ciblées, which afin d'améliorer la fonction mitochondriale au niveau sub-cellulaire. En dépit de cette compréhension, il y a eu un développement limité de in vivo, des biomarqueurs reproductibles pour la recherche clinique FA. En fait, un obstacle majeur à l'évaluation efficace des thérapies ciblées en FA est l'incapacité de suivre l'évolution de la fonction mitochondriale. mesures fonctionnelles actuelles, par exemple, sont capables d'identifier une diminution du débit cardiaque; cependant, ils sont incapables de déterminer le niveau auquel se produit le dysfonctionnement (figure 1). Le développement d'un marqueur de la fonction mitochondriale fiable qui peut être utilisé pour identifier et évaluer la progression de la maladie dans l'ataxie de Friedrich est cruciale pour évaluer l'impact mécanique pertinente des thérapies ciblées.
OXPHOS avec facultés affaiblies et la dysfonction cardiaque
la fonction mitochondriale Aberrant, acquis ou génétique, pourrait contribuer au développement ou à la progression de cardidysfonction ac. Dans les conditions de surcharge de pression et de l'insuffisance cardiaque, l'énergie primaire commutateurs de préférence de substrat de la FFA au glucose. Ceci est associé à l' activité ETC diminué et la phosphorylation oxydative 27. La physiopathologie de la bioénergétique mitochondrial dans un dysfonctionnement cardiaque peut être différent en fonction de l'origine primaire du défaut mitochondrial. Le diabète et les résultats du syndrome métabolique dans des anomalies mitochondriales dans le myocarde, comme une déficience biogenèse et le métabolisme des acides gras, qui conduisent à une réduction de flexibilité du substrat, l' efficacité énergétique, et finalement, le dysfonctionnement diastolique 28, 29. Dans FA, d'autre part, il en résulte un déficit en frataxine dans l' accumulation de fer mitochondrial significative dans les cardiomyocytes 30, 31. L' accumulation de fer conduit à la production de radicaux libres par l' intermédiaire de la réaction de Fenton 32 </ Sup> et augmente les risques de dommages sans cardiomyocytes induite par les radicaux. L' accumulation de fer intramitochondriale est également associé à une sensibilité accrue au stress oxydatif et d' une capacité d'oxydation réduit 30, 31. L' accumulation de fer et la fonction mitochondriale aberrante ultérieure, en raison de la carence en frataxine, peuvent donc être responsables des energetics cardiaques avec facultés affaiblies et la cardiomyopathie observées dans FA 33, 34. Il est également intéressant de noter que la capacité oxydative réduite dans les mitochondries du muscle squelettique est parallèle à l'intolérance à l'exercice et réduit la capacité métabolique dans l' insuffisance cardiaque (HF) 35. Mesure de la capacité de squelette OXPHOS musculaire, tel que décrit ici, est facilement réalisable et robuste; couplée à l'importance de squelette OXPHOS musculaire dans HF, ces caractéristiques en font un biomarqueur attrayant aux études approfondies de heart 36 maladie.
OXPHOS avec facultés affaiblies et la dysfonction cardiaque d'accompagnement ne sont pas un aspect négligeable de maladies métaboliques et mitochondrial. Les sujets atteints de diabète et de maladies métaboliques sont à un risque plus élevé de développer une maladie cardiovasculaire et ont une surmortalité après un infarctus du myocarde (IM) 37, 38, 39, 40, 41; plus de la moitié des sujets FA ont une cardiomyopathie, et beaucoup meurent d'arythmie cardiaque ou d' insuffisance cardiaque 42. Par conséquent, la quantification de OXPHOS réduite ne pouvait pas permettre que pour la détection et le traitement de la dysfonction cardiaque précoce, mais elle pourrait aussi alléger un fardeau clinique majeur dans ces maladies.
Les thérapies ciblées pour accroître directement la capacité de OXPHOS est un domaine prometteur pour améliorer le traitement des sujets, whether la cause du dysfonctionnement métabolique est génétique ou acquise. Actuellement, le développement de nouveaux médicaments qui soulagent soit la fonction mitochondriale anormale 43 ou de corriger le défaut génétique primaire 44 peut améliorer la bioénergétique caractéristique dérangée de FA ciblée. Dans le cas d' un dysfonctionnement mitochondrial acquis, l' activité physique accrue peut améliorer la fonction mitochondriale 45, 46, 47.
31 Phosphore Spectroscopie par résonance magnétique comme un biomarqueur non invasif de la fonction mitochondriale
Quel que soit le traitement testé, un intégré dans l' évaluation in vivo de la bioénergétique du muscle squelettique est un outil essentiel pour évaluer l'impact des interventions ciblées, en particulier chez les sujets souffrant d' intolérance d'exercice sévère ou l'incapacité de se soumettre à metabo conventionnelletest lic. La spectroscopie par résonance magnétique accordé au phosphore (31 PMRS), un noyau endogène trouvé dans divers substrats à haute énergie dans les cellules dans tout le corps, a été utilisé pour quantifier la capacité oxydative mitochondriale en utilisant une variété d'approches, y compris dans les aimants protocoles exercice de récupération et protocoles de stimulation musculaire 48. Les protocoles d'exercice de recouvrement reposent sur une variété d'appareils, allant dans la complexité de ergomètres compatibles avec l'IRM qui régulent et mesurent la charge de travail à des configurations simples de sangles et les coussinets permettant de type rafale résistive et l'exercice quasi-statique. L' un des principaux objectifs de l' un de ces protocoles est de produire un déséquilibre énergétique pour lequel la demande de l' adénosine triphosphate (ATP) est d' abord rencontré par la dégradation enzymatique de la phosphocréatine (PCr) par la créatine kinase de réaction 49. Lors de la cessation de l'exercice, le taux de production d'ATP est dominé par pho oxydantesphorylation et représente le maximum de la capacité in vivo de la 50 mitochondrie. En outre, au cours OXPHOS récupération post-exercice peut être décrit par une réaction de vitesse de premier ordre 51. La récupération post-exercice de PCr peut donc être quantifiée par la mise en place d'une constante de temps exponentielle (τ PCr), avec des valeurs plus petites de τ PCr représentant plus grandes capacités de synthèse oxydative de l' ATP. Des efforts importants ont été faits pour valider 31 PMRS contre ex vivo et des mesures plus directes de OXPHOS et de démontrer l'applicabilité clinique potentielle de cette technique 52, 53, 54, 55.
Notamment, le protocole décrit dans ce travail peut être mis en œuvre sur les scanners cliniquement disponibles, et il a été largement validé en tant que biomarqueur non invasif ola fonction mitochondriale f 56. Cependant, un protocole d' exercice 31 PMRS optimisé pour l' application à des personnes avec différentes sévérités de déficience ou de la mobilité neuromusculaire n'a pas été bien établie 57. Un bien défini, le protocole d'exercice largement-applicable et 31 technique PMRS seraient particulièrement utiles dans l'évaluation des maladies présentant des anomalies fondamentales dans la fonction mitochondriale.
Plusieurs études antérieures ont exploré les applications des techniques non-invasives pour quantifier la fonction mitochondriale chez les sujets. Par exemple, ces techniques ont montré une déficience OXPHOS chez les sujets atteints de diabète de type 2 36. Lodi et al. d'abord testé la faisabilité de techniques PMRS chez les sujets atteints FA et a constaté que 1) le défaut génétique fondamentale FA altère squelettique OXPHOS musculaire et 2) le nombre de répétitions GAA triplet est inversement proportionnelle au muscle squelettique OXPHOS 33. Plus récemment, Nachbauer et al. PMRS utilisé comme critère d'évaluation secondaire dans un essai de médicament FA avec 7 sujets. PCr temps de récupération étaient significativement plus chez des sujets par rapport aux témoins, réaffirmant les travaux antérieurs de Lodi et indiquant que les effets de l' expression de la frataxine aberrante dans FA peut entraîner une baisse de la capacité mitochondriale qui est détectable en utilisant des techniques PMRS 58.
Des méthodes fiables pour définir de manière adéquate dans la fonction du muscle squelettique in vivo, de façon reproductible , réalisable rentable, et sont essentiels à l' amélioration des résultats soumis à une série de maladies qui affectent la fonction mitochondriale.
Ce travail décrit une procédure robuste pour obtenir in vivo la capacité oxydative maximale du muscle squelettique en utilisant 31 PMRS. Le protocole d'exercice en aimant est bien toléré par les personnes couvrant un large éventail de physique et functional capacités et offre une configuration simplifiée du sujet en utilisant un équipement peu coûteux et largement disponibles.
Protocole
Ce protocole est approuvé par et suit les lignes directrices de l'Institutional Review Board Ohio State University pour la recherche sur des sujets humains. Il est important que toutes les procédures impliquant l' équipement MR sont effectuées par du personnel formé de façon adéquate en respectant les normes les plus élevées de sécurité MR 59.
1. Matériels et Préparation
- Veiller à ce que tous les matériaux nécessaires sont disponibles avant l'expérience (Figure 2).
- Branchez la bobine 31 P dans le connecteur table bobine à la fin de la table d'examen le plus proche de l'alésage. Placer un grand coussin en mousse de triangle près de la tête de la table d'examen de MR, mais pas directement sur la bobine 31 P. Placez un oreiller de tête à l'autre extrémité de la table MR examen, la plus éloignée de l'alésage, pour le sujet confort.
2. Sous réserve de positionnement (Figure 3a)
- Instruire le sujet de mentir en décubitus, les piedsd'abord sur la table MR. Placer un coussin en mousse sous les genoux pour supporter la jambe dans une position partiellement fléchie.
- Placez le sujet proche du côté droit de la table (droit du sujet) afin de centrer plus près la cuisse gauche à l'isocentre de l'aimant que possible, assurant ainsi une homogénéité optimale de B0 dans le muscle de la cuisse en cours d'examen. Fournir le sujet avec des bouchons et / ou un casque oreille.
- Positionner la bobine RF 31 P sur les quadriceps gauche à environ mi - chemin entre la rotule et la tête fémorale, et le fixer à la jambe au moyen de sangles. Placez la bobine sur la partie latérale de la jambe, au-dessus du vaste externe.
- Fixer l'huile de bébé à la face interne de la cuisse avec les mêmes sangles utilisées pour fixer la bobine à la jambe. Ceci facilite la localisation de balayage.
- Lier les jambes du sujet avec une sangle placée au-dessous de la bobine et au-dessus du genou. Fixer les jambes du sujet à la table de M. avec stra supplémentairesps, une au-dessus du genou et une mi-chemin entre le genou et la cheville.
- Utilisez le guide de lumière laser pour délimiter le centre de la bobine et déplacer la table à l'isocentre de l'aimant en utilisant ce centrage point de repère.
Protocole 3. Exercice
- Expliquer au sujet que le protocole d'exercice se compose de trois phases: une phase de référence initiale; une phase d'exercice court, intense; et une phase de récupération.
- Instruire le sujet de rester immobile et se détendre leurs muscles des jambes pendant les base et de récupération des phases de l'acquisition de la spectroscopie afin de minimiser les artefacts de mouvement.
- Fournir un compte à rebours sur le sujet indiquant le début de l'exercice. À ce stade, ont fait l'objet initier genou extension / flexion avec autant de force et aussi rapidement que possible contre la résistance des sangles.
NOTE: Les muscles quadriceps sont utilisés pour déplacer la jambe gauche et vers le bas, avant d 'arrêter. - Terminate exercice après une baisse de 30%à la hauteur du pic de PCR.
- Observer la hauteur du pic PCr dans la fenêtre de la visionneuse d'acquisition, et voir également à la fin de la séquence d'exercice.
NOTE: Une ligne directrice générale est qu'une approximative baisse de 30% en PCr hauteur du pic correspond à un pic Pi qui est 50% de la hauteur du pic PCr. Si PCr l'épuisement ne se produit pas assez rapidement pour atteindre une baisse de 30% au cours de la phase d'exercice de l'examen, d'encourager le sujet à coup plus difficile ou plus rapide pendant l'exercice.
REMARQUE: La cessation de l'exercice est déterminée en contrôlant la hauteur du pic PCr et la durée de l'exercice. Il peut en résulter légèrement différentes durées d'exercice chez des patients différents et peut être pris en compte dans l'analyse.
- Observer la hauteur du pic PCr dans la fenêtre de la visionneuse d'acquisition, et voir également à la fin de la séquence d'exercice.
Protocole d'analyse 4.
- Acquérir un radiophare tri-plan pour vérifier le positionnement correct objet et identifier l'emplacement de la bobine 31 P.
NOTE: La séquence de radiophare commence automatiquement et centres au indicla position ATED en utilisant le guide de lumière laser (étape 2.9) - Acquérir une deuxième radiophare tri-plan.
- Ouvrez la vue de la tranche sur les premières images de radiophare tri-avion.
NOTE: Ce processus peut être différent pour les systèmes matériels et logiciels différents. - Center et pivoter l'orientation de tranche par un clic gauche et la tenue sur le groupe de tranches. Faites pivoter le groupe de tranches. Faire en sorte que l'orientation finale de tranches correspond à la position de l'huile pour bébé.
- Dans la fenêtre de routine de séquence, augmenter le nombre de tranches pour couvrir la totalité de la jambe dans le sens axial et sagittal (Figure 3b).
- Ouvrez la vue de la tranche sur les premières images de radiophare tri-avion.
- 31 P séquence de spectroscopie:
- Utilisez les paramètres suivants de la séquence d'impulsions acquièrent non localisées: TR: 1000 msec; TE: 0,34 msec; largeur spectrale: 2,000 Hz; angle de bascule: 90 degrés; points de données acquises: 1,024; 4 moyennes résultant en une résolution temporelle de spectre 1 toutes les 6 s.
- 31 P shim box placement:
- Utilisation d'une souris, faites glisser les secondes images triplan Localizer dans la fenêtre de visualisation en haut de l'écran. Faites glisser la séquence de spectroscopie dans la fenêtre de protocole et double-cliquez pour ouvrir.
- Utilisez la barre d'outils de mesure de visualiser le voxel de shim (sélectionnez le rectangle noir avec des lignes horizontales). Après avoir sélectionné cette option, observer une boîte verte sur les images de radiophare.
NOTE: Ceci est le voxel de shim. - Déplacer le voxel par un clic gauche et maintenir le voxel dans le centre. Modifier la taille et faire pivoter l'orientation du voxel par un clic gauche et maintenir le voxel au coin de la boîte. Placer la boîte de cale de manière à assurer l'homogénéité B0 champ directement au-dessous de la bobine et parallèle au plan du quadriceps.
REMARQUE: cela est approprié afin d'assurer un calage au sein de la zone sensible sous la bobine, ce qui est le volume de tissu directement en dessous du centre de la bobine. - Utilisez les images tri-plan localizer pour identifier le sensitivrégion e de la bobine et d'ajuster la zone de shim pour englober cette région dans le muscle quadriceps.
REMARQUE: La boîte de cale peut être plus grande que la couverture réelle de la bobine de surface afin d'assurer l' homogénéité B0 au sein de l'acquisition de données voxel (Figure 3c). - Acquisition d'essai 31 P:
- Ouvrez la fenêtre de visualisation d'acquisition et sélectionnez l'icône de la tête dans la barre d'outils d'acquisition. Cela permettra la visualisation de l'acquisition spectroscopique en temps réel.
- Après le placement de la 31P shim voxel, exécutez la séquence pour obtenir un spectre unique en cliquant sur le bouton "run" en haut de la fenêtre de protocole.
- Examiner la qualité de B0 shimming. Observer le spectre dans la fenêtre d'acquisition résultant. Observer un pic proéminent PCr centré à 0 ppm et pas de bruit significative (figure 4a, à gauche).
REMARQUE: Dépannage: Si le spectre apparaît bruyant, veiller à ce que la boîte de cale est placée à l'intérieur du muscle. Un djuste la taille et la position de la boîte de cale pour améliorer le rapport signal à bruit. Répétez l'acquisition de test selon les besoins. - Pour voir la hauteur du pic PCr, ouvrir le spectre dans l'outil de spectroscopie ( "Applications" → "Spectroscopie"). Ouvrez le dossier du patient (arborescence des dossiers de l'icône), sélectionnez le contrôle approprié, et double-cliquez pour charger le spectre.
- image T1 pré-exercice:
- Obtenir une image pondérée en T1 axiale seule tranche au centre d'une bobine.
- 31 P acquisition pré-exercice:
- Copiez la séquence de l'étape 4.4 (qui a produit la meilleure qualité spectrale) par un clic gauche et en faisant glisser la séquence dans la fenêtre de protocole. Utilisez cette séquence pour toutes les mesures ultérieures.
- Dans la fenêtre de routine de séquence, d'augmenter le nombre de mesures de 1 à 10. Sélectionnez terme pour acquérir 10 mesures alors que le sujet est au repos.
- 31 </ Sup> P acquisition d'exercice:
REMARQUE: Notez bien les heures de début et l'exercice final, car cela sera important pour l'analyse.- Rest: Appliquer les paramètres shim de l'analyse précédente et définir la séquence d'acquérir 20 mesures. Instruire le sujet pour commencer coups de pied après un compte à rebours. Instruire le sujet à rester au repos pendant 2 mesures.
- Exercice: Demander au sujet d'effectuer l'exercice d'extension du genou pendant environ 30 secondes (ou le temps nécessaire pour atteindre une diminution de 30% de l'amplitude de crête PCR). Après le sujet atteint l'épuisement PCr suffisante, demandez-leur de se reposer.
- 31 P post-exercice acquisitions:
- Acquérir une participation supplémentaire de 20 mesures au repos. Veiller à ce que les acquisitions post-exercice commencent immédiatement après la séquence d'exercice, sans pause ou calant (figure 4a, à droite).
NOTE: La subdivision de cette période de récupération en deux acquisitions distinctes permet l'analyse de l'i20 spectres dynamiques préside d'abord lors de l'acquisition de la seconde 20 spectres dynamiques, permettant à l'opérateur d'éviter l'acquisition de la période de récupération complète si l'exercice doit être répété.
- Acquérir une participation supplémentaire de 20 mesures au repos. Veiller à ce que les acquisitions post-exercice commencent immédiatement après la séquence d'exercice, sans pause ou calant (figure 4a, à droite).
- Assurer la qualité de l'exercice:
- Comparer les hauteurs des pics PCr au début et à la fin de l'exercice. séances d'exercices de haute qualité conduisent à une diminution de ~ 30% de la concentration PCr.
- Vérifier que la hauteur du pic de PCr est la même au début de repos et à la fin du recouvrement (typiquement <10% de différence est souhaitée). Cela garantit qu'il y avait une perte négligeable de champ homogénéité lors de l'acquisition.
NOTE: Si la ventilation PCr est insuffisante, ou s'il y a eu une perte de champ homogénéité, puis répétez la partie d'exercice / récupération de l'examen (en prenant soin d'éviter la fatigue), veiller à ce que la bobine et les sangles sont solidement fixés, et d'étendre la durée de l' exercice et / ou à encourager l' exercice plus vigoureux (figure 4b).
NE PASE: Une comparaison des images obtenues dans les étapes 6 et 11 permet à une étape de contrôle de qualité supplémentaire pour visualiser tout déplacement de la cuisse et de la bobine en raison de l'exercice, assurant ainsi que le mouvement minimal est survenu au cours du protocole, ce qui pourrait affecter de manière significative les données acquises .
- Après T1 imagerie post-exercice, répéter la pré-exercice axial imagerie T1 (étape 4.5) en utilisant les mêmes paramètres d'acquisition.
- En plus de l'épuisement suffisant de PCr, mesurer l'exercice fin pH à veiller à ce que l'exercice n'a pas induit une acidose du muscle.
- Effectuer en mesurant le déplacement chimique entre Pi et PCr (ôP i) et en utilisant l'équation 60 suivante:
pH = 6,77 + log [(ôP i -3.29) / (5,68-ôP i)]
NOTE: Le pH devrait rester supérieur à 6,8 61. Si la ventilation PCr est suffisante, mais le pH est trop faible, répéter le combat d'exercice pour une courteer durée et / ou avec une intensité réduite.
- La sauvegarde des données:
- Enregistrer tous les spectres acquis sous forme de fichiers DICOM et les exporter pour le traitement en utilisant JMRUI.
- Si vous utilisez un scanner, sélectionnez toutes les acquisitions de spectroscopie dans la fenêtre "Navigator".
- Sous la rubrique «Applications», sélectionnez «Outils de Dicom" → "Export MR Spectroscopy," et enregistrez les fichiers DICOM (* .dcm) à C: / Utilisateur / MedCom / temp / CDROFFLINE
(L'outil choisit automatiquement cet endroit). - Sous "Transfert", sélectionnez "Exporter vers Offline." Économisez jusqu'à l'emplacement souhaité.
5. Traitement et analyse des données 62
- Analyser les spectres MR avec librement disponibles logiciels JMRUI (version 5.2; http://www.jmrui.eu/).
- Apodiser et le déphasage des spectres pour assurer l' uniformité sur tous les points de temps acquis (figure 5). Le pic PCr sera centré unt 0 ppm dans les spectres.
- Utilisez l'algorithme de AMARES intégré pour quantifier l'amplitude du pic PCr dans chaque spectre acquis. L'amplitude du pic représente la concentration de PCr au sein de la zone sensible de la bobine de surface au niveau de ce point de temps particulier.
- Dans le logiciel de calcul, tracer les concentrations PCr en fonction du temps d'acquisition. Utilisation de l'outil intégré de la courbe d'ajustement logiciels de calcul, monter les PCr données de la période de récupération à l'équation suivante 52, 63:
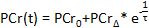
- Enregistrer les valeurs de la PCr de base (
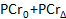 ), Le plus bas PCr (
), Le plus bas PCr (  ), Et le temps de récupération (
), Et le temps de récupération ( 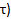 .
. - Veiller à ce que les conditions appropriées sont réunies au cours de l'exerSession cise en calculant l'épuisement PCr, la différence pour cent entre la valeur de référence PCR et la plus faible PCR. des séances d'exercice idéal se traduisent par une 20 - depletion de 50%.
REMARQUE: La qualité de l'ajustement de courbe peut être assurée en vérifiant que la valeur de R 2 est supérieur à 0,75. R 2 valeurs sont calculées automatiquement par le logiciel approprié.
Résultats
Étude de reproductibilité
Six volontaires (4 hommes et 2 femmes; âge moyen: 24,5 ± 6,2 ans) sans coeur autodéclaré, métaboliques, ou d'une maladie mitochondriale ont subi des séances de l'exercice et de l' imagerie 31 PMRS technique décrite sur 2 jours différents dans 1 semaine pour évaluer la technique reproductibilité (figure 6a). Les études effectuées su...
Discussion
Ce document décrit un protocole standard pour 31 PMRS examen qui donne la mesure de série et non invasive in vivo du muscle squelettique fonction mitochondriale. Le protocole tient un attrait considérable lorsque l'on considère l'ampleur des enquêtes ciblant la charge croissante du syndrome métabolique et de sa morbidité et la mortalité qui en résulte. Ce 31 protocole PMRS nécessite un minimum de temps de scanner et peut être incorporé dans les enquêtes métaboliques c...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported in part by a Davis Heart and Lung Research Institute Trifit Award, as well as by the Intramural Research Program of the NIH National Institute on Aging.
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 T MR Scanner | Siemens | manufacturer will not affect results | |
| 10 cm 31P transmit-receive coil, 1.5T compatible | PulseTeq | manufacturer will not affect results | |
| 3 fl oz Baby Oil | Johnson & Johnson | manufacturer will not affect results | |
| Foam triangle cushion (Knee) | Siemens | manufacturer will not affect results | |
| (3) plastic buckle resistive straps; table to table | Siemens | manufacturer will not affect results | |
| (1) plastic buckle resistive strap; self-connecting | Siemens |
Références
- Eckel, R. H., Alberti, K. G., Grundy, S. M., Zimmet, P. Z. The metabolic syndrome. Lancet. 375 (9710), 181-183 (2010).
- Shulman, G. I. Ectopic fat in insulin resistance, dyslipidemia, and cardiometabolic disease. N Engl J Med. 371 (12), 1131-1141 (2014).
- Holmstrom, M. H., Iglesias-Gutierrez, E., Zierath, J. R., Garcia-Roves, P. M. Tissue-specific control of mitochondrial respiration in obesity-related insulin resistance and diabetes. Am J Physiol Endocrinol Metab. 302 (6), 731-739 (2012).
- Jheng, H. F., et al. Mitochondrial fission contributes to mitochondrial dysfunction and insulin resistance in skeletal muscle. Mol Cell Biol. 32 (2), 309-319 (2012).
- Petersen, K. F., et al. Mitochondrial dysfunction in the elderly: possible role in insulin resistance. Science. 300 (5622), 1140-1142 (2003).
- Kelley, D. E., He, J., Menshikova, E. V., Ritov, V. B. Dysfunction of mitochondria in human skeletal muscle in type 2 diabetes. Diabetes. 51 (10), 2944-2950 (2002).
- Liu, R., et al. Impaired mitochondrial dynamics and bioenergetics in diabetic skeletal muscle. PLoS One. 9 (3), 92810 (2014).
- Ha, H., Hwang, I. A., Park, J. H., Lee, H. B. Role of reactive oxygen species in the pathogenesis of diabetic nephropathy. Diabetes Res Clin Pract. 82, 42-45 (2008).
- Akude, E., et al. Diminished superoxide generation is associated with respiratory chain dysfunction and changes in the mitochondrial proteome of sensory neurons from diabetic rats. Diabetes. 60 (1), 288-297 (2011).
- Fernyhough, P. Mitochondrial dysfunction in diabetic neuropathy: a series of unfortunate metabolic events. Curr Diab Rep. 15 (11), 89 (2015).
- Chen, M., Wang, W., Ma, J., Ye, P., Wang, K. High glucose induces mitochondrial dysfunction and apoptosis in human retinal pigment epithelium cells via promoting SOCS1 and Fas/FasL signaling. Cytokine. 78, 94-102 (2016).
- Blake, R., Trounce, I. A. Mitochondrial dysfunction and complications associated with diabetes. Biochim Biophys Acta. 1840 (4), 1404-1412 (2014).
- Rains, J. L., Jain, S. K. Oxidative stress, insulin signaling, and diabetes. Free Radic Biol Med. 50 (5), 567-575 (2011).
- Serviddio, G., et al. Mitochondrial involvement in non-alcoholic steatohepatitis. Mol Aspects Med. 29 (1-2), 22-35 (2008).
- Perez-Carreras, M., et al. Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis. Hepatology. 38 (4), 999-1007 (2003).
- Garcia-Ruiz, I., et al. Mitochondrial complex I subunits are decreased in murine nonalcoholic fatty liver disease: implication of peroxynitrite. J Proteome Res. 9 (5), 2450-2459 (2010).
- Patti, M. E., Corvera, S. The role of mitochondria in the pathogenesis of type 2 diabetes. Endocr Rev. 31 (3), 364-395 (2010).
- Muoio, D. M., Newgard, C. B. Obesity-related derangements in metabolic regulation. Annu Rev Biochem. 75, 367-401 (2006).
- Bonnard, C., et al. Mitochondrial dysfunction results from oxidative stress in the skeletal muscle of diet-induced insulin-resistant mice. J Clin Invest. 118 (2), 789-800 (2008).
- Jheng, H. F., Huang, S. H., Kuo, H. M., Hughes, M. W., Tsai, Y. S. Molecular insight and pharmacological approaches targeting mitochondrial dynamics in skeletal muscle during obesity. Ann N Y Acad Sci. 1350, 82-94 (2015).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends Endocrinol Metab. 23 (8), 391-398 (2012).
- Montgomery, M. K., Turner, N. Mitochondrial dysfunction and insulin resistance: an update. Endocr Connect. 4 (1), 1-15 (2015).
- Martelli, A., Puccio, H. Dysregulation of cellular iron metabolism in Friedreich ataxia: from primary iron-sulfur cluster deficit to mitochondrial iron accumulation. Front Pharmacol. 5, 130 (2014).
- Campuzano, V., et al. Frataxin is reduced in Friedreich ataxia patients and is associated with mitochondrial membranes. Hum Mol Genet. 6 (11), 1771-1780 (1997).
- Calabrese, V., et al. Oxidative stress, mitochondrial dysfunction and cellular stress response in Friedreich's ataxia. J Neurol Sci. 233 (1-2), 145-162 (2005).
- Ristow, M., et al. Frataxin activates mitochondrial energy conversion and oxidative phosphorylation. Proc Natl Acad Sci U S A. 97 (22), 12239-12243 (2000).
- Ardehali, H., et al. Targeting myocardial substrate metabolism in heart failure: potential for new therapies. Eur J Heart Fail. 14 (2), 120-129 (2012).
- Ren, J., Pulakat, L., Whaley-Connell, A., Sowers, J. R. Mitochondrial biogenesis in the metabolic syndrome and cardiovascular disease. J Mol Med (Berl). 88 (10), 993-1001 (2010).
- Marin-Garcia, J., Goldenthal, M. J. Understanding the impact of mitochondrial defects in cardiovascular disease: a review. J Card Fail. 8 (5), 347-361 (2002).
- Babcock, M., et al. Regulation of mitochondrial iron accumulation by Yfh1p, a putative homolog of frataxin. Science. 276 (5319), 1709-1712 (1997).
- Foury, F., Cazzalini, O. Deletion of the yeast homologue of the human gene associated with Friedreich's ataxia elicits iron accumulation in mitochondria. FEBS Lett. 411 (2-3), 373-377 (1997).
- Wardman, P., Candeias, L. P. Fenton chemistry: an introduction. Radiat Res. 145 (5), 523-531 (1996).
- Lodi, R., et al. Cardiac energetics are abnormal in Friedreich ataxia patients in the absence of cardiac dysfunction and hypertrophy: an in vivo 31P magnetic resonance spectroscopy study. Cardiovasc Res. 52 (1), 111-119 (2001).
- Raman, S. V., et al. Impaired myocardial perfusion reserve and fibrosis in Friedreich ataxia: a mitochondrial cardiomyopathy with metabolic syndrome. Eur Heart J. 32 (5), 561-567 (2011).
- Kitzman, D. W., et al. Skeletal muscle abnormalities and exercise intolerance in older patients with heart failure and preserved ejection fraction. Am J Physiol Heart Circ Physiol. 306 (9), 1364-1370 (2014).
- Scheuermann-Freestone, M., et al. Abnormal cardiac and skeletal muscle energy metabolism in patients with type 2 diabetes. Circulation. 107 (24), 3040-3046 (2003).
- Allcock, D. M., Sowers, J. R. Best strategies for hypertension management in type 2 diabetes and obesity. Curr Diab Rep. 10 (2), 139-144 (2010).
- Katzmarzyk, P. T., Church, T. S., Janssen, I., Ross, R., Blair, S. N. Metabolic syndrome, obesity, and mortality: impact of cardiorespiratory fitness. Diabetes Care. 28 (2), 391-397 (2005).
- Wang, J., et al. The metabolic syndrome predicts cardiovascular mortality: a 13-year follow-up study in elderly non-diabetic Finns. Eur Heart J. 28 (7), 857-864 (2007).
- Zambon, S., et al. Metabolic syndrome and all-cause and cardiovascular mortality in an Italian elderly population: the Progetto Veneto Anziani (Pro.V.A) Study. Diabetes Care. 32 (1), 153-159 (2009).
- Malik, S., et al. Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation. 110 (10), 1245-1250 (2004).
- Ropper, A. H., Samuels, M. A. . Adams and Victor's Principles of Neurology. 9 edn. , (2009).
- Abeti, R., et al. Targeting lipid peroxidation and mitochondrial imbalance in Friedreich's ataxia. Pharmacol Res. 99, 344-350 (2015).
- Li, Y., et al. Excision of Expanded GAA Repeats Alleviates the Molecular Phenotype of Friedreich's Ataxia. Mol Ther. 23 (6), 1055-1065 (2015).
- Toledo, F. G., Goodpaster, B. H. The role of weight loss and exercise in correcting skeletal muscle mitochondrial abnormalities in obesity, diabetes and aging. Mol Cell Endocrinol. 379 (1-2), 30-34 (2013).
- Oldridge, N. B., Guyatt, G. H., Fischer, M. E., Rimm, A. A. Cardiac rehabilitation after myocardial infarction. Combined experience of randomized clinical trials. JAMA. 260 (7), 945-950 (1988).
- O'Connor, G. T., et al. An overview of randomized trials of rehabilitation with exercise after myocardial infarction. Circulation. 80 (2), 234-244 (1989).
- Ryan, T. E., Brizendine, J. T., McCully, K. K. A comparison of exercise type and intensity on the noninvasive assessment of skeletal muscle mitochondrial function using near-infrared spectroscopy. J Appl Physiol (1985). 114 (2), 230-237 (2013).
- Wallimann, T. Bioenergetics. Dissecting the role of creatine kinase. Curr Biol. 4 (1), 42-46 (1994).
- Forbes, S. C., Paganini, A. T., Slade, J. M., Towse, T. F., Meyer, R. A. Phosphocreatine recovery kinetics following low- and high-intensity exercise in human triceps surae and rat posterior hindlimb muscles. Am J Physiol Regul Integr Comp Physiol. 296 (1), 161-170 (2009).
- Korzeniewski, B., Rossiter, H. B. Each-step activation of oxidative phosphorylation is necessary to explain muscle metabolic kinetic responses to exercise and recovery in humans. J Physiol. 593 (24), 5255-5268 (2015).
- Meyer, R. A. A linear model of muscle respiration explains monoexponential phosphocreatine changes. Am J Physiol. 254 (4), 548-553 (1988).
- McCully, K. K., Fielding, R. A., Evans, W. J., Leigh, J. S., Posner, J. D. Relationships between in vivo and in vitro measurements of metabolism in young and old human calf muscles. J Appl Physiol (1985). 75 (2), 813-819 (1993).
- Layec, G., Haseler, L. J., Richardson, R. S. Reduced muscle oxidative capacity is independent of O2 availability in elderly people. Age (Dordr). 35 (4), 1183-1192 (2013).
- Larson-Meyer, D. E., Newcomer, B. R., Hunter, G. R., Hetherington, H. P., Weinsier, R. L. 31P MRS measurement of mitochondrial function in skeletal muscle: reliability, force-level sensitivity and relation to whole body maximal oxygen uptake. NMR Biomed. 13 (1), 14-27 (2000).
- Kemp, G. J., Ahmad, R. E., Nicolay, K., Prompers, J. J. Quantification of skeletal muscle mitochondrial function by 31P magnetic resonance spectroscopy techniques: a quantitative review. Acta Physiol (Oxf). 213 (1), 107-144 (2015).
- Lynch, D. R., et al. Near infrared muscle spectroscopy in patients with Friedreich's ataxia. Muscle Nerve. 25 (5), 664-673 (2002).
- Nachbauer, W., et al. Bioenergetics of the calf muscle in Friedreich ataxia patients measured by 31P-MRS before and after treatment with recombinant human erythropoietin. PLoS One. 8 (7), 69229 (2013).
- Kanal, E., et al. ACR guidance document on MR safe practices: 2013. J Magn Reson Imaging. 37 (3), 501-530 (2013).
- Petroff, O. A., Ogino, T., Alger, J. R. High-resolution proton magnetic resonance spectroscopy of rabbit brain: regional metabolite levels and postmortem changes. J Neurochem. 51 (1), 163-171 (1988).
- Jubrias, S. A., Crowther, G. J., Shankland, E. G., Gronka, R. K., Conley, K. E. Acidosis inhibits oxidative phosphorylation in contracting human skeletal muscle in vivo. J Physiol. 553 (2), 589-599 (2003).
- Layec, G., et al. Reproducibility assessment of metabolic variables characterizing muscle energetics in vivo: A 31P-MRS study. Magn Reson Med. 62 (4), 840-854 (2009).
- Iotti, S., Lodi, R., Frassineti, C., Zaniol, P., Barbiroli, B. In vivo assessment of mitochondrial functionality in human gastrocnemius muscle by 31P MRS. The role of pH in the evaluation of phosphocreatine and inorganic phosphate recoveries from exercise. NMR Biomed. 6 (4), 248-253 (1993).
- Wren, T. A., Bluml, S., Tseng-Ong, L., Gilsanz, V. Three-point technique of fat quantification of muscle tissue as a marker of disease progression in Duchenne muscular dystrophy: preliminary study. AJR Am J Roentgenol. 190 (1), 8-12 (2008).
- Milani, R. V., Lavie, C. J., Mehra, M. R., Ventura, H. O. Understanding the basics of cardiopulmonary exercise testing. Mayo Clin Proc. 81 (12), 1603-1611 (2006).
- Wust, R. C., van der Laarse, W. J., Rossiter, H. B. On-off asymmetries in oxygen consumption kinetics of single Xenopus laevis skeletal muscle fibres suggest higher-order control. J Physiol. 591 (3), 731-744 (2013).
- Ryan, T. E., Brophy, P., Lin, C. T., Hickner, R. C., Neufer, P. D. Assessment of in vivo skeletal muscle mitochondrial respiratory capacity in humans by near-infrared spectroscopy: a comparison with in situ measurements. J Physiol. 592 (15), 3231-3241 (2014).
- Hamaoka, T., McCully, K. K., Niwayama, M., Chance, B. The use of muscle near-infrared spectroscopy in sport, health and medical sciences: recent developments. Philos Trans A Math Phys Eng Sci. 369, 4591-4604 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon