このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
リン-31磁気共鳴分光法:測定するためのツール
要約
This work demonstrates the feasibility of an in vivo phosphorus-31 magnetic resonance spectroscopy (31PMRS) technique to quantify mitochondrial oxidative phosphorylation (OXPHOS) capacity in human skeletal muscle.
要約
Skeletal muscle mitochondrial oxidative phosphorylation (OXPHOS) capacity, which is critically important in health and disease, can be measured in vivo and noninvasively in humans via phosphorus-31 magnetic resonance spectroscopy (31PMRS). However, the approach has not been widely adopted in translational and clinical research, with variations in methodology and limited guidance from the literature. Increased optimization, standardization, and dissemination of methods for in vivo 31PMRS would facilitate the development of targeted therapies to improve OXPHOS capacity and could ultimately favorably impact cardiovascular health. 31PMRS produces a noninvasive, in vivo measure of OXPHOS capacity in human skeletal muscle, as opposed to alternative measures obtained from explanted and potentially altered mitochondria via muscle biopsy. It relies upon only modest additional instrumentation beyond what is already in place on magnetic resonance scanners available for clinical and translational research at most institutions. In this work, we outline a method to measure in vivo skeletal muscle OXPHOS. The technique is demonstrated using a 1.5 Tesla whole-body MR scanner equipped with the suitable hardware and software for 31PMRS, and we explain a simple and robust protocol for in-magnet resistive exercise to rapidly fatigue the quadriceps muscle. Reproducibility and feasibility are demonstrated in volunteers as well as subjects over a wide range of functional capacities.
概要
この作業の目的は、非侵襲的な能力の広い範囲を有する個体においてin vivo骨格筋ミトコンドリア機能に測定するための再現性のある方法を概説することです。異常なミトコンドリアの機能障害は、そのようなフリードライヒ失調症などの稀な疾患への老化や糖尿病などの一般的な条件から、メタボリックシンドロームや遺伝性疾患の広い範囲の特徴です。
メタボリックシンドロームとミトコンドリア機能障害
メタボリック症候群は、ミトコンドリアの機能を破壊骨格筋OXPHOSを押し下げ、および骨格筋1、2における異所性脂質貯蔵をもたらすことが示されています。代謝およびエネルギー恒常性を調節する重要な細胞小器官として、ミトコンドリアは肥満3,4の病態生理に関与している、インスリン抵抗性5 、2型糖尿病(T2DM)6、7、糖尿病関連微小8、9、10、11および大血管合併症12,13、および非アルコール性脂肪肝疾患(NAFLD)14、15、16、とりわけO 2酸化還元酵素活性を5:抵抗.Insulinミトコンドリアのトリカルボン酸(TCA)流動速度、ATP合成速度、およびクエン酸シンターゼおよびNADHの減少を含む骨格筋ミトコンドリア活性における重大な変化によって特徴付けられます。 1つの仮説は、これらの変化が著しく、肥満および他の肥満rの間に増強された筋肉中の遊離脂肪酸(FFA)代謝産物の蓄積、に起因するかもしれないということです得意疾患2、17。高架のFFAおよび脂質中間体への筋の暴露は、脂質の酸化経路における遺伝子の発現だけでなく、TCAサイクルと電子輸送チェーン(ETC)18を減少させることができます。脂質の過負荷の設定におけるミトコンドリア骨格筋OXPHOS容量のこの減少は、定量的(ミトコンドリアの内容及び生物発生)の減少19と骨格筋ミトコンドリア20の定性的な機能を伴っています。 FFAに骨格筋や心筋細胞を公開する重度のインスリン抵抗性をもたらし、筋肉で増加したFFAの取り込みは、ヒトおよびげっ歯類21の両方におけるインスリン抵抗性と関連しています。脂質中間体セラミドおよびジアシルグリセロール(DAG)は、プロテインキナーゼCおよびPROTとして、直接のキナーゼの活性を変化させることにより、インスリンシグナル伝達経路を阻害することが示されていますEINキナーゼB 21。したがって、脂質由来分子は、骨格筋のインスリン抵抗性およびT2DMの発症において重要な役割を果たすように思われます。しかし、ミトコンドリアの容量の変化が原因またはインスリン抵抗22の結果であるかどうかは不明のままです。
フリードライヒ失調症およびミトコンドリア機能障害
減少OXPHOSはまた、遺伝的欠陥から生じ得ます。フリードリッヒ運動失調(FA)、遺伝性運動失調症の最も一般的な形態は、ミトコンドリア内鉄蓄積、活性酸素種の産生をもたらすフラタキシンにおける突然変異によって引き起こされる遺伝性疾患(FXN)遺伝子であり、酸化的リン酸化23の異常、 24、25、26。この重要な発見はwhic、標的治療の開発につながりましたHの目的は、サブ細胞レベルでのミトコンドリア機能を改善します。この理解にもかかわらず、in vivoでの限られた開発、FA臨床研究のための再現性のあるバイオマーカーがありました。実際には、FAにおける標的療法の効果的な評価に重要な障壁は、ミトコンドリア機能の変化を追跡することができないことです。現在の機能的手段は、例えば、心拍出量の減少を識別することができます。しかしながら、それらは、機能不全が起こるレベル( 図1)を決定することができません。識別し、フリードリッヒ運動失調における疾患の進行を評価するために使用され得るミトコンドリア機能の信頼できるマーカーの開発は、標的療法の関連する機械的影響を評価することが重要です。
減損OXPHOSと心機能不全
異常なミトコンドリア機能、のいずれかの取得または遺伝的には、カルディの発症または進行に寄与し得ます交流機能不全。圧負荷および心不全の条件下では、FFAの一次エネルギー基質優先スイッチがグルコースします。これは、減少したETC活性および酸化的リン酸化27に関連しています。心機能障害におけるミトコンドリアの生体エネルギーの病態生理は、ミトコンドリアの欠陥の主な起源に応じて異なる場合があります。糖尿病および還元基板の柔軟性、エネルギー効率、および最終的には、拡張機能障害28、29につながるような障害の生合成及び脂肪酸代謝のような心筋におけるミトコンドリア異常、代謝症候群をもたらします。心筋細胞30、31の大幅なミトコンドリアの鉄蓄積でFAで、一方、フラタキシン欠乏の結果。鉄蓄積は、<フェントン反応32を介してフリーラジカルの産生をもたらします/ SUP>とフリーラジカル誘発性心筋損傷の可能性が高くなります。ミトコンドリア内鉄蓄積はまた、酸化ストレスに対する感受性の増加および減少の酸化容量30、31に関連しています。フラタキシン欠乏に起因する鉄蓄積とそれに続く異常なミトコンドリア機能は、したがって、FA 33、34で観察された損なわれた心臓のエネルギー特性や心筋症を担当することがあります。骨格筋のミトコンドリア中の還元酸化能力は、運動不耐性に匹敵し、心不全(HF)35で代謝能を低下させたことに注目することも興味深いです。骨格筋OXPHOS容量の測定は、本明細書に詳述するように、容易に実現可能で堅牢です。 HFにおける骨格筋OXPHOSの重要性と相まって、これらの機能は、それ聞くの総合的な研究における魅力的なバイオマーカー作りますトン病36。
減損OXPHOS及び添付の心機能不全は、代謝およびミトコンドリア病の取るに足らない態様ではありません。糖尿病および代謝性疾患を有する対象は、心血管疾患を発症するリスクが高いと心筋梗塞(MI)37、38、39、40、41後の超過死亡率を持っています。 FAの半分以上の被験者は、心筋症、および心臓不整脈や心不全42の多くのダイを持っています。したがって、縮小OXPHOSの定量化は、心機能障害の早期発見と治療のための可能性だけでなく、これらの疾患における主要な臨床負担を軽減することができます。
直接OXPHOS容量を増加させる標的療法は、WHE、対象の治療を改善するための有望な領域でありますTHER代謝機能不全の原因は、遺伝的または後天性です。現在、異常なミトコンドリア機能43を軽減またはプライマリ遺伝的欠陥44を修正いずれかの新たな標的薬の開発は、FAの錯乱生体エネルギー特性を向上させることができます。取得されたミトコンドリア機能不全の場合には、増大した身体活動は、機能45、46、47、ミトコンドリアを向上させることができます。
ミトコンドリア機能の非侵襲的バイオマーカーとして31リン磁気共鳴分光法
かかわらず、試験された治療の、骨格筋の生体エネルギーのin vivo評価に統合され、特に重度の運動不耐性または従来のメタボを受けることができないの被験者に、対象となる介入の影響を評価するための重要なツールです。LICのテスト。体全体の細胞内リン(31 PMRS)に同調磁気共鳴分光法、さまざまな高エネルギー基質に見出される内因性の核は、で磁石の運動回復プロトコルを含む、様々なアプローチを用いて、ミトコンドリアの酸化的能力を定量化するために使用されてきたと筋肉刺激プロトコル48。運動回復プロトコルは規制し、バースト型抵抗と準静的な運動を可能にするストラップとパッドのシンプルな構成にワークロードを測定MRI対応エルゴメーターから複雑で測距装置の様々に依存しています。これらのプロトコルのいずれかの主要な目標の一つは、アデノシン三リン酸(ATP)の需要が最初にクレアチンキナーゼ反応49を介してホスホクレアチンの酵素的分解法(PCR)を介して満たされているエネルギーの不均衡を生成することです。運動の停止時に、ATP産生の速度は、酸化フォーによって支配されますsphorylationとは、ミトコンドリア50の生体内容量の最大値を表します。また、運動後の回復中OXPHOSは、一次速度反応51により説明することができます。 PCRを運動後の回復は、したがって、酸化ATP合成のためのより大きな能力を表すτPCRを小さい値を有する指数関数の時定数(τPCR)をフィッティングすることによって定量することができます。重要な努力が31 ex vivoでに対するPMRSとOXPHOSのより直接的な対策を検証し、この手法52、53、54、55の潜在的な臨床適用性を実証するために行われてきました。
注目すべきことに、この研究で説明されたプロトコルは、臨床的に利用可能なスキャナ上で実施することができ、広く非侵襲性バイオマーカーのOとして確認されていますFミトコンドリア機能56。しかし、神経筋障害や移動度の変化する重大度を持つ個人への適用のために最適化された運動31 PMRSプロトコルは、よく57を確立されていません。明確に定義され、広く-該当する運動プロトコルと31 PMRS技術は、ミトコンドリア機能の基本的な異常を伴う疾患の評価に特に有用であろう。
いくつかの先行研究では、被験者におけるミトコンドリア機能を定量化するために非侵襲的技術の応用を検討しています。例えば、これらの技術は、2型糖尿病の36の被験者における障害OXPHOSを示しています。ロディら。最初のFAを有する被験者にPMRS技術の実現可能性をテストし、1)FAにおける基本的な遺伝的欠陥は、骨格筋OXPHOSを損ない、2)GAAトリプレットの数が繰り返され、骨格筋Oに反比例することがわかりましたXPHOS 33。より最近では、Nachbauer ら。 7科目とFAの治験における二次アウトカム指標としてPMRSを使用していました。 PCr回復時間はロディの初期の作品を再確認し、FAでの異常なフラタキシン発現の効果がPMRS技術58を使用して検出可能であるミトコンドリア能力の低下をもたらすことができることを示す、対照と比較して、被験者において有意に長かったです。
信頼性の高い方法は十分に実現可能な、費用対効果、および再現可能な方法で生体内骨格筋の機能に定義するためには、ミトコンドリアの機能に影響を与える疾患の範囲の主題転帰を改善するために重要です。
この作品は31 PMRSを使用して、骨格筋の生体内最大酸化能力に取得するための堅牢な手順の概要を説明します。内磁石運動プロトコルはよく物理的および関数Aの広い範囲にわたる個人によって許容されますリットルの能力と安価で広く入手可能な装置を使用して簡略化された対象のセットアップを与えます。
プロトコル
このプロトコルは、によって承認され、人体実験のためのオハイオ州立大学施設内倫理委員会のガイドラインに準拠しています。 MR装置に関連するすべての手順は、MRの安全性59の最高水準に付着十分に訓練を受けた要員によって実行されることが非常に重要です。
1.材料と準備
- すべての必要な材料は、実験前( 図2)に利用可能であることを確認してください。
- ボアに最も近い試験テーブルの最後にでテーブルコイルコネクタに31 Pコイルを接続します。 MR試験のテーブルの先頭付近に大きな三角形のフォームクッションを置き、直接ではなく31 Pコイルに。対象の快適さのために、MR検査表、穴から最も遠いのもう一方の端にヘッド枕を置きます。
2.件名のポジショニング(図3a)
- 仰臥位、足を横にするために、被験者に指示MRテーブルの最初の。部分的に屈曲位で足をサポートするために、膝の下にフォームクッションを置きます。
- このように、検査中の大腿筋に最適なB0の均一性を確保し、可能な限りマグネットアイソセンタに同様に密接に左太ももをセンタリングするために、位置表の右側に近い対象(対象者の権利を)。耳栓および/またはヘッドフォンを対象に提供します。
- 膝蓋骨と大腿骨頭間の約中間点に左大腿四頭筋に31 PのRFコイルを置き、ストラップを使用して、脚に固定します。外側広筋の上に、脚部の横部分の上にコイルを配置します。
- 脚部にコイルを固定するために使用されるのと同じストラップで太ももの内側面にベビーオイルを固定します。これは、スキャン局在化を促進します。
- コイルの下に膝の上に配置されたストラップと一緒に被験者の足をバインドします。追加ストラとMRテーブルに対象者の足を確保psの、膝と膝と足首の間に1つの中間に上記1。
- コイルの中心を描くと、このセンタリングランドマークを使用して、磁石のアイソセンタにテーブルを移動するためにレーザー光ガイドを使用してください。
3.運動プロトコル
- 運動プロトコルは、3つのフェーズで構成され、対象に説明:初期、ベースライン相;短い、激しい運動段階;そして、回復期。
- まだ嘘とモーションアーチファクトを最小限にするために、分光取得のベースラインと回復の段階で自分の足の筋肉をリラックスする対象を指示します。
- 運動の開始を示す対象にカウントダウンを提供します。この時点で、対象は、ストラップの抵抗に抗して、可能な限り迅速にとして強制的に膝伸展/屈曲を開始しています。
注:大腿四頭筋が停止するように指示されるまで、上下左下肢を移動するために使用されています。 - 30%低下した後に運動を終了PCRピーク高さです。
- 取得ビューアウィンドウ内のPCRピーク高さを観察し、また運動シーケンスの完了時に、それを表示します。
注:一般的なガイドラインをPCRピークの高さの約30%の低下をPCRピークの高さの50%であるのPiピークに対応することです。 PCR枯渇は試験の運動相中に30%の低下を達成するのに十分迅速に発生していない場合は、硬いまたはより高速運動中にキックする対象を奨励します。
注:運動の停止をPCRピーク高さと運動の継続時間を監視することによって決定されます。これは、異なる患者における運動のわずかに異なる持続時間をもたらすことができると分析で説明することができます。
- 取得ビューアウィンドウ内のPCRピーク高さを観察し、また運動シーケンスの完了時に、それを表示します。
4.スキャンプロトコル
- 適切な対象の位置を確認し、31 Pコイルの位置を特定するために3平面ローカライザを取得します。
注:ローカライザーシーケンスが自動的に開始され、インド系で中心レーザー光ガイド(ステップ2.9)を使用してated位置 - 第3平面ローカライザーを取得します。
- 第3平面ローカライザ画像上のスライスビューを開きます。
注:このプロセスは、異なるソフトウェアおよびハードウェアシステムについて異なっていてもよいです。 - センターとは、左クリックし、スライスグループに保持することにより、スライスの向きを回転させます。スライスグループを回転させます。スライスの最終的な向きは、ベビーオイルの位置と一致することを確認します。
- シーケンスルーチンウィンドウで、軸方向及びサジタル画像( 図3b)で脚全体をカバーするためにスライス数を増やします。
- 第3平面ローカライザ画像上のスライスビューを開きます。
- 31 P分光シーケンス:
- 以下の非局在化しパルス取得シーケンスパラメータを使用してください:TR:1,000ミリ秒。 TE:0.34ミリ秒;スペクトル幅:2,000ヘルツ。フリップ角:90度。取得したデータポイント:1024; 1スペクトルごとに6秒の時間分解能が得られる4平均値。
- 31 Pシム洪明甫Xの配置:
- マウスを使用して、画面の上部に表示ウィンドウに二TRIPLANEのローカライザ画像をドラッグします。プロトコルウィンドウに分光シーケンスをドラッグし、ダブルクリックして開きます。
- (水平線と黒い四角形を選択)シムボクセルを可視化するために位置ツールバーを使用します。このオプションを選択した後、ローカライザ画像上の緑色のボックスを観察します。
注:これはシムボクセルです。 - 左クリックでボクセルを移動し、中央にボクセルを保持しています。サイズを変更し、左クリックし、ボックスのコーナーでボクセルを保持することによってボクセルの向きを回転させます。直接コイルの下のB0磁場の均一性を確保し、大腿四頭筋の平面に平行するようにシムボックスを配置します。
注:これは直接コイルの中心の下に組織の容積であるコイル、下に敏感な領域内の適切なシミングを確保することです。 - sensitivを識別するために3平面ローカライザ画像を使用しますEコイルの領域と大腿四頭筋の中に、この領域を包含するようにシムボックスを調整します。
注:シム・ボックスは、データ取得ボクセル( 図3c)内のB0の均一性を確保するために、表面コイルの真の適用範囲よりも大きくすることができます。 - 31 P・テスト・買収:
- 取得ビューアウィンドウを開き、取得ツールバーのヘッドアイコンを選択します。これは、リアルタイムで分光獲得の閲覧が可能になります。
- 31Pシムボクセルを配置した後、プロトコルウィンドウの上部にある「実行」ボタンをクリックすることで、単一のスペクトルを得るためにシーケンスを実行します。
- B0シミングの品質を調べます。取得窓が得られたスペクトルを観察します。 0 ppmの中心に顕著なのPCRピークと有意なノイズ( 図4a、左)を確認します。
注:トラブルシューティング:スペクトルは騒々しい表示された場合は、シムボックスは筋肉内に配置されていることを確認してください。広告ちょうどサイズ及びシムボックスの位置は、信号対雑音比を改善します。必要に応じてテスト買収を繰り返します。 - PCRピーク高さを確認するためには、分光ツール(「アプリケーション」→「分光法」)にスペクトルを開きます。患者のフォルダ(フォルダツリーのアイコン)を開き、適切なスキャンを選択して、スペクトルをロードするためにダブルクリックします。
- 運動前のT1の画像:
- コイルの中心にシングルスライス軸T1強調画像を得ます。
- 31 P運動前の取得:
- 左クリックとプロトコル・ウィンドウにシーケンスをドラッグして(最高のスペクトル品質を生産)ステップ4.4からの配列をコピーします。すべての後続の測定のために、このシーケンスを使用してください。
- 被写体が静止している一方でシーケンスルーチンウィンドウで、10の測定値を取得するために1〜10を選択し、実行からの測定値の数を増やします。
- 31 </ SUP> Pの運動取得:
注:これは、分析のために重要であるように、開始と終了の運動時間を慎重にメモしておいてください。- 残り:以前のスキャンからのシムの設定を適用し、20回の測定を取得する順序を設定します。カウントダウン後に蹴りを開始するために、対象を指示します。 2測定のために停止したままであるために、被験者に指示します。
- 運動:〜30秒(またはPCRピーク振幅の30%の低下を達成するのに必要な時間)が膝伸展運動を行うために被写体を確認して下さい。被験者は十分なのPCR枯渇を達成した後、休息してもらいます。
- 31 P、運動後の買収:
- 安静時に追加の20の測定値を取得します。運動後の買収は(右、 図4a)の一時停止またはシム調整せずに、運動シーケンスの直後に開始していることを確認してください。
注:二つの別々の買収にこの回復期間の細分化は、私の分析が可能運動は繰り返す必要がある場合、オペレータは、完全な回復期間の取得を回避することを可能にする第20のダイナミックスペクトルの取得時nitial 20ダイナミックスペクトル。
- 安静時に追加の20の測定値を取得します。運動後の買収は(右、 図4a)の一時停止またはシム調整せずに、運動シーケンスの直後に開始していることを確認してください。
- 運動の質の確保:
- 運動の開始時と終了時のPCRピーク高さの比較。高品質運動セッションは、PCR濃度の約30%の減少をもたらします。
- PCRピーク高さは残りの開始時および回復の終わりに同じであることを確認します(通常は、<10%の差が望まれています)。これは、取得時の磁場均一性の無視できる程度の損失があったことを保証します。
注:のPCr破壊が不十分である場合、または磁場均一性の損失があった場合には、(疲労を避けるように注意しながら)試験の行使/回復部分を繰り返し、コイルとストラップが確実に取り付けられていることを確認し、拡張運動および/または持続時間は、より激しい運動を奨励する( 図4b)。
NOTEは:ステップ6と11を許可追加の品質管理工程で得られた画像の比較は、このように、最小限の動きが顕著に取得したデータに影響を与える可能性があるプロトコル、中に発生したことを確実にすること、により行使に大腿部とコイルのいずれかの変位を可視化します。
- 運動後のT1イメージング後、同一の取得パラメータを用いて予備運動軸T1撮像(ステップ4.5)を繰り返します。
- PCRを十分枯渇に加えて、運動は筋肉のアシドーシスを誘導しなかったことを確実にするために、エンド運動のpHを測定します。
- PiとPCR(δPI)との間の化学シフトを測定し、次式60を使用してこれを実行します。
pH値= 6.77 +ログ[(δPI -3.29)/(5.68-δPI)]
注:pHが6.8 61より大きいままであるべきです。 PCR破壊が十分であるが、pHが低すぎると、略し運動試合を繰り返します持続時間および/または減少した強度でえー。
- データを保存します:
- DICOMファイルとして取得したすべてのスペクトルを保存し、JMRUIを使用して処理するためにそれらをエクスポートします。
- スキャナーを使用している場合は、「ナビゲータ」ウィンドウ内のすべての分光買収を選択します。
- 以下の下で「アプリケーション」、「ダイコムツール」→「エクスポートMRスペクトロスコピー」を選び、CにDICOM(* .dcm)ファイルを保存:/ユーザー/ MedCom /温度/ CDROFFLINE
(このツールは、自動的にこの場所を選択します)。 - 下に「転送」、「オフラインにエクスポート」を選択します。目的の場所に保存します。
5.データ処理と分析62
- 自由に利用できるJMRUIソフトウェア(; http://www.jmrui.eu/バージョン5.2)でMRスペクトルを分析します。
- アポダイズ位相はすべての取得時点( 図5)上の均一性を確保するためにスペクトルをシフトします。 PCRピークが中央に表示されますスペクトル中のT 0 ppmです。
- それぞれ得られたスペクトルでのPCRピークの振幅を定量化するために、組み込みのアマレスアルゴリズムを使用してください。ピーク振幅は、その特定の時点における表面コイルの感度領域内に、PCRの濃度を表します。
- 計算ソフトウェアでは、収集時間の関数としてのPCR濃度をプロットします。内蔵の計算ソフトウェアカーブフィットツールを使用して、以下の式52、63へのPCr回復期間のデータをフィット:
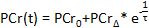
- (ベースラインのPCR値を記録
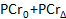 )、最も低いPCR(
)、最も低いPCR(  )、および回復時間(
)、および回復時間( 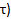 。
。 - 適切な条件がEXER中に満たされていることを確認PCR枯渇、ベースラインPCRおよび最低のPCr間のパーセント差を計算することによりciseセッション。 50%の枯渇 - 理想的な運動セッションが20になります。
注:カーブフィッティングの品質は、R 2値が0.75以上であることを検証することによって確保することができます。 R 2の値が自動的にフィッティングソフトウェアによって計算されます。
結果
再現性の研究
六人のボランティア(男性4人と女性2人、平均年齢:24.5±6.2歳)なし自己報告心臓、代謝、またはミトコンドリア病とは、技術を評価するために、1週間以内に2別の日に説明した31 PMRS運動とイメージング技術のセッションを受けました再現性( 図6a)。正常なボランティア?...
ディスカッション
本稿では、骨格筋ミトコンドリア機能のシリアルおよび非侵襲的in vivoでの測定を提供する31 PMRSの検査のための標準プロトコルを記述しています。メタボリックシンドロームとその結果の罹患率および死亡率の増加負担を標的捜査の幅を考慮した場合、プロトコルは、かなりの魅力を保持しています。この31 PMRSプロトコルは、スキャナ最小限の時間を必要とし、市販の...
開示事項
The authors have nothing to disclose.
謝辞
This work was supported in part by a Davis Heart and Lung Research Institute Trifit Award, as well as by the Intramural Research Program of the NIH National Institute on Aging.
資料
| Name | Company | Catalog Number | Comments |
| 1.5 T MR Scanner | Siemens | manufacturer will not affect results | |
| 10 cm 31P transmit-receive coil, 1.5T compatible | PulseTeq | manufacturer will not affect results | |
| 3 fl oz Baby Oil | Johnson & Johnson | manufacturer will not affect results | |
| Foam triangle cushion (Knee) | Siemens | manufacturer will not affect results | |
| (3) plastic buckle resistive straps; table to table | Siemens | manufacturer will not affect results | |
| (1) plastic buckle resistive strap; self-connecting | Siemens |
参考文献
- Eckel, R. H., Alberti, K. G., Grundy, S. M., Zimmet, P. Z. The metabolic syndrome. Lancet. 375 (9710), 181-183 (2010).
- Shulman, G. I. Ectopic fat in insulin resistance, dyslipidemia, and cardiometabolic disease. N Engl J Med. 371 (12), 1131-1141 (2014).
- Holmstrom, M. H., Iglesias-Gutierrez, E., Zierath, J. R., Garcia-Roves, P. M. Tissue-specific control of mitochondrial respiration in obesity-related insulin resistance and diabetes. Am J Physiol Endocrinol Metab. 302 (6), 731-739 (2012).
- Jheng, H. F., et al. Mitochondrial fission contributes to mitochondrial dysfunction and insulin resistance in skeletal muscle. Mol Cell Biol. 32 (2), 309-319 (2012).
- Petersen, K. F., et al. Mitochondrial dysfunction in the elderly: possible role in insulin resistance. Science. 300 (5622), 1140-1142 (2003).
- Kelley, D. E., He, J., Menshikova, E. V., Ritov, V. B. Dysfunction of mitochondria in human skeletal muscle in type 2 diabetes. Diabetes. 51 (10), 2944-2950 (2002).
- Liu, R., et al. Impaired mitochondrial dynamics and bioenergetics in diabetic skeletal muscle. PLoS One. 9 (3), 92810 (2014).
- Ha, H., Hwang, I. A., Park, J. H., Lee, H. B. Role of reactive oxygen species in the pathogenesis of diabetic nephropathy. Diabetes Res Clin Pract. 82, 42-45 (2008).
- Akude, E., et al. Diminished superoxide generation is associated with respiratory chain dysfunction and changes in the mitochondrial proteome of sensory neurons from diabetic rats. Diabetes. 60 (1), 288-297 (2011).
- Fernyhough, P. Mitochondrial dysfunction in diabetic neuropathy: a series of unfortunate metabolic events. Curr Diab Rep. 15 (11), 89 (2015).
- Chen, M., Wang, W., Ma, J., Ye, P., Wang, K. High glucose induces mitochondrial dysfunction and apoptosis in human retinal pigment epithelium cells via promoting SOCS1 and Fas/FasL signaling. Cytokine. 78, 94-102 (2016).
- Blake, R., Trounce, I. A. Mitochondrial dysfunction and complications associated with diabetes. Biochim Biophys Acta. 1840 (4), 1404-1412 (2014).
- Rains, J. L., Jain, S. K. Oxidative stress, insulin signaling, and diabetes. Free Radic Biol Med. 50 (5), 567-575 (2011).
- Serviddio, G., et al. Mitochondrial involvement in non-alcoholic steatohepatitis. Mol Aspects Med. 29 (1-2), 22-35 (2008).
- Perez-Carreras, M., et al. Defective hepatic mitochondrial respiratory chain in patients with nonalcoholic steatohepatitis. Hepatology. 38 (4), 999-1007 (2003).
- Garcia-Ruiz, I., et al. Mitochondrial complex I subunits are decreased in murine nonalcoholic fatty liver disease: implication of peroxynitrite. J Proteome Res. 9 (5), 2450-2459 (2010).
- Patti, M. E., Corvera, S. The role of mitochondria in the pathogenesis of type 2 diabetes. Endocr Rev. 31 (3), 364-395 (2010).
- Muoio, D. M., Newgard, C. B. Obesity-related derangements in metabolic regulation. Annu Rev Biochem. 75, 367-401 (2006).
- Bonnard, C., et al. Mitochondrial dysfunction results from oxidative stress in the skeletal muscle of diet-induced insulin-resistant mice. J Clin Invest. 118 (2), 789-800 (2008).
- Jheng, H. F., Huang, S. H., Kuo, H. M., Hughes, M. W., Tsai, Y. S. Molecular insight and pharmacological approaches targeting mitochondrial dynamics in skeletal muscle during obesity. Ann N Y Acad Sci. 1350, 82-94 (2015).
- Coen, P. M., Goodpaster, B. H. Role of intramyocelluar lipids in human health. Trends Endocrinol Metab. 23 (8), 391-398 (2012).
- Montgomery, M. K., Turner, N. Mitochondrial dysfunction and insulin resistance: an update. Endocr Connect. 4 (1), 1-15 (2015).
- Martelli, A., Puccio, H. Dysregulation of cellular iron metabolism in Friedreich ataxia: from primary iron-sulfur cluster deficit to mitochondrial iron accumulation. Front Pharmacol. 5, 130 (2014).
- Campuzano, V., et al. Frataxin is reduced in Friedreich ataxia patients and is associated with mitochondrial membranes. Hum Mol Genet. 6 (11), 1771-1780 (1997).
- Calabrese, V., et al. Oxidative stress, mitochondrial dysfunction and cellular stress response in Friedreich's ataxia. J Neurol Sci. 233 (1-2), 145-162 (2005).
- Ristow, M., et al. Frataxin activates mitochondrial energy conversion and oxidative phosphorylation. Proc Natl Acad Sci U S A. 97 (22), 12239-12243 (2000).
- Ardehali, H., et al. Targeting myocardial substrate metabolism in heart failure: potential for new therapies. Eur J Heart Fail. 14 (2), 120-129 (2012).
- Ren, J., Pulakat, L., Whaley-Connell, A., Sowers, J. R. Mitochondrial biogenesis in the metabolic syndrome and cardiovascular disease. J Mol Med (Berl). 88 (10), 993-1001 (2010).
- Marin-Garcia, J., Goldenthal, M. J. Understanding the impact of mitochondrial defects in cardiovascular disease: a review. J Card Fail. 8 (5), 347-361 (2002).
- Babcock, M., et al. Regulation of mitochondrial iron accumulation by Yfh1p, a putative homolog of frataxin. Science. 276 (5319), 1709-1712 (1997).
- Foury, F., Cazzalini, O. Deletion of the yeast homologue of the human gene associated with Friedreich's ataxia elicits iron accumulation in mitochondria. FEBS Lett. 411 (2-3), 373-377 (1997).
- Wardman, P., Candeias, L. P. Fenton chemistry: an introduction. Radiat Res. 145 (5), 523-531 (1996).
- Lodi, R., et al. Cardiac energetics are abnormal in Friedreich ataxia patients in the absence of cardiac dysfunction and hypertrophy: an in vivo 31P magnetic resonance spectroscopy study. Cardiovasc Res. 52 (1), 111-119 (2001).
- Raman, S. V., et al. Impaired myocardial perfusion reserve and fibrosis in Friedreich ataxia: a mitochondrial cardiomyopathy with metabolic syndrome. Eur Heart J. 32 (5), 561-567 (2011).
- Kitzman, D. W., et al. Skeletal muscle abnormalities and exercise intolerance in older patients with heart failure and preserved ejection fraction. Am J Physiol Heart Circ Physiol. 306 (9), 1364-1370 (2014).
- Scheuermann-Freestone, M., et al. Abnormal cardiac and skeletal muscle energy metabolism in patients with type 2 diabetes. Circulation. 107 (24), 3040-3046 (2003).
- Allcock, D. M., Sowers, J. R. Best strategies for hypertension management in type 2 diabetes and obesity. Curr Diab Rep. 10 (2), 139-144 (2010).
- Katzmarzyk, P. T., Church, T. S., Janssen, I., Ross, R., Blair, S. N. Metabolic syndrome, obesity, and mortality: impact of cardiorespiratory fitness. Diabetes Care. 28 (2), 391-397 (2005).
- Wang, J., et al. The metabolic syndrome predicts cardiovascular mortality: a 13-year follow-up study in elderly non-diabetic Finns. Eur Heart J. 28 (7), 857-864 (2007).
- Zambon, S., et al. Metabolic syndrome and all-cause and cardiovascular mortality in an Italian elderly population: the Progetto Veneto Anziani (Pro.V.A) Study. Diabetes Care. 32 (1), 153-159 (2009).
- Malik, S., et al. Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation. 110 (10), 1245-1250 (2004).
- Ropper, A. H., Samuels, M. A. . Adams and Victor's Principles of Neurology. 9 edn. , (2009).
- Abeti, R., et al. Targeting lipid peroxidation and mitochondrial imbalance in Friedreich's ataxia. Pharmacol Res. 99, 344-350 (2015).
- Li, Y., et al. Excision of Expanded GAA Repeats Alleviates the Molecular Phenotype of Friedreich's Ataxia. Mol Ther. 23 (6), 1055-1065 (2015).
- Toledo, F. G., Goodpaster, B. H. The role of weight loss and exercise in correcting skeletal muscle mitochondrial abnormalities in obesity, diabetes and aging. Mol Cell Endocrinol. 379 (1-2), 30-34 (2013).
- Oldridge, N. B., Guyatt, G. H., Fischer, M. E., Rimm, A. A. Cardiac rehabilitation after myocardial infarction. Combined experience of randomized clinical trials. JAMA. 260 (7), 945-950 (1988).
- O'Connor, G. T., et al. An overview of randomized trials of rehabilitation with exercise after myocardial infarction. Circulation. 80 (2), 234-244 (1989).
- Ryan, T. E., Brizendine, J. T., McCully, K. K. A comparison of exercise type and intensity on the noninvasive assessment of skeletal muscle mitochondrial function using near-infrared spectroscopy. J Appl Physiol (1985). 114 (2), 230-237 (2013).
- Wallimann, T. Bioenergetics. Dissecting the role of creatine kinase. Curr Biol. 4 (1), 42-46 (1994).
- Forbes, S. C., Paganini, A. T., Slade, J. M., Towse, T. F., Meyer, R. A. Phosphocreatine recovery kinetics following low- and high-intensity exercise in human triceps surae and rat posterior hindlimb muscles. Am J Physiol Regul Integr Comp Physiol. 296 (1), 161-170 (2009).
- Korzeniewski, B., Rossiter, H. B. Each-step activation of oxidative phosphorylation is necessary to explain muscle metabolic kinetic responses to exercise and recovery in humans. J Physiol. 593 (24), 5255-5268 (2015).
- Meyer, R. A. A linear model of muscle respiration explains monoexponential phosphocreatine changes. Am J Physiol. 254 (4), 548-553 (1988).
- McCully, K. K., Fielding, R. A., Evans, W. J., Leigh, J. S., Posner, J. D. Relationships between in vivo and in vitro measurements of metabolism in young and old human calf muscles. J Appl Physiol (1985). 75 (2), 813-819 (1993).
- Layec, G., Haseler, L. J., Richardson, R. S. Reduced muscle oxidative capacity is independent of O2 availability in elderly people. Age (Dordr). 35 (4), 1183-1192 (2013).
- Larson-Meyer, D. E., Newcomer, B. R., Hunter, G. R., Hetherington, H. P., Weinsier, R. L. 31P MRS measurement of mitochondrial function in skeletal muscle: reliability, force-level sensitivity and relation to whole body maximal oxygen uptake. NMR Biomed. 13 (1), 14-27 (2000).
- Kemp, G. J., Ahmad, R. E., Nicolay, K., Prompers, J. J. Quantification of skeletal muscle mitochondrial function by 31P magnetic resonance spectroscopy techniques: a quantitative review. Acta Physiol (Oxf). 213 (1), 107-144 (2015).
- Lynch, D. R., et al. Near infrared muscle spectroscopy in patients with Friedreich's ataxia. Muscle Nerve. 25 (5), 664-673 (2002).
- Nachbauer, W., et al. Bioenergetics of the calf muscle in Friedreich ataxia patients measured by 31P-MRS before and after treatment with recombinant human erythropoietin. PLoS One. 8 (7), 69229 (2013).
- Kanal, E., et al. ACR guidance document on MR safe practices: 2013. J Magn Reson Imaging. 37 (3), 501-530 (2013).
- Petroff, O. A., Ogino, T., Alger, J. R. High-resolution proton magnetic resonance spectroscopy of rabbit brain: regional metabolite levels and postmortem changes. J Neurochem. 51 (1), 163-171 (1988).
- Jubrias, S. A., Crowther, G. J., Shankland, E. G., Gronka, R. K., Conley, K. E. Acidosis inhibits oxidative phosphorylation in contracting human skeletal muscle in vivo. J Physiol. 553 (2), 589-599 (2003).
- Layec, G., et al. Reproducibility assessment of metabolic variables characterizing muscle energetics in vivo: A 31P-MRS study. Magn Reson Med. 62 (4), 840-854 (2009).
- Iotti, S., Lodi, R., Frassineti, C., Zaniol, P., Barbiroli, B. In vivo assessment of mitochondrial functionality in human gastrocnemius muscle by 31P MRS. The role of pH in the evaluation of phosphocreatine and inorganic phosphate recoveries from exercise. NMR Biomed. 6 (4), 248-253 (1993).
- Wren, T. A., Bluml, S., Tseng-Ong, L., Gilsanz, V. Three-point technique of fat quantification of muscle tissue as a marker of disease progression in Duchenne muscular dystrophy: preliminary study. AJR Am J Roentgenol. 190 (1), 8-12 (2008).
- Milani, R. V., Lavie, C. J., Mehra, M. R., Ventura, H. O. Understanding the basics of cardiopulmonary exercise testing. Mayo Clin Proc. 81 (12), 1603-1611 (2006).
- Wust, R. C., van der Laarse, W. J., Rossiter, H. B. On-off asymmetries in oxygen consumption kinetics of single Xenopus laevis skeletal muscle fibres suggest higher-order control. J Physiol. 591 (3), 731-744 (2013).
- Ryan, T. E., Brophy, P., Lin, C. T., Hickner, R. C., Neufer, P. D. Assessment of in vivo skeletal muscle mitochondrial respiratory capacity in humans by near-infrared spectroscopy: a comparison with in situ measurements. J Physiol. 592 (15), 3231-3241 (2014).
- Hamaoka, T., McCully, K. K., Niwayama, M., Chance, B. The use of muscle near-infrared spectroscopy in sport, health and medical sciences: recent developments. Philos Trans A Math Phys Eng Sci. 369, 4591-4604 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved